流式细胞术检测猪外周血T淋巴细胞亚群的方法与流程
本发明属于细胞检测技术领域,具体地说,涉及一种流式细胞术检测猪外周血t淋巴细胞亚群的方法。
背景技术:
流式细胞术(flowcytometry,fcm)是一种对单个细胞表面或细胞内化学成分进行荧光定量分析的新技术。其工作原理是对单个细胞或分子进行荧光标记后,进行多参数的定量分析。该技术作为一种快速细胞分析技术,广泛应用于免疫学、细胞生物学等基础医学研究领域。流式细胞术可以通过识别细胞表面特异的免疫荧光信号,来实现t淋巴细胞亚群的检测,有助于评价机体的细胞免疫功能。在兽医临床和科学研究中发现,样本前处理、检测时的参数调节、结果分析时的处理方式在一定程度上都会影响检测结果,造成检测值波动范围大、检测结果不稳定。目前,尚无使用流式细胞仪检测猪外周血t淋巴细胞亚群的可靠参考方法。
技术实现要素:
有鉴于此,本发明针对样本前处理、检测时电压和荧光补偿的调节、结果分析时的处理方式的不同造成检测结果波动大、不稳定的问题,提供了一种流式细胞术检测猪外周血t淋巴细胞亚群的方法,建立了一种稳定规范的猪外周血t淋巴细胞亚群的检测方法。
为了解决上述技术问题,本发明公开了一种流式细胞术检测猪外周血t淋巴细胞亚群的方法,包括以下步骤:
步骤1,取猪外周静脉血,制备抗凝血;
步骤2,吸取所述抗凝血于两支流式管中,一份抗凝血中加入抗猪cd3、cd4、cd8单克隆抗体,旋涡混匀,于4℃避光染色,用作检测管;另一份用做阴性设置管;
步骤3,用红细胞裂解液破裂红细胞;
步骤4,用pbs液洗涤并重悬细胞,使用流式细胞仪进行检测;
步骤5,分析检测结果,获得猪外周血t淋巴细胞亚群比例。
进一步地,制备抗凝血,具体为:于2ml规格的edta-na2抗凝管中加入2ml猪外周静脉血。
进一步地,吸取抗凝血的体积数为100ul。
进一步地,阴性设置管的处理方式有两种,一是用同型对照试剂染色;二是不染色。
进一步地,同型对照试剂的选择方法具体为:选择与抗体对应表面标志的一抗完全相同种属来源、相同亚型及荧光标记的抗体。例如,检测管使用的是小鼠抗猪的cd4fitc标记的抗体,说明书上显示其成份是mouseigg1,那么同型对照就是fitc标记的mouseigg1。熟悉各单抗阳性细胞的分群情况后,通常使用空白对照来设置阴性对照即可。
进一步地,染色的时间为30min。
进一步地,使用流式细胞仪进行检测,包括:在前向散射光/侧向散射光双参数图中调节电压和电流线性增益参数,使左下方的淋巴细胞与邻近右上的单核细胞群分开;选取淋巴细胞并设门;用阴性设置管设定阴性区,用检测管调节荧光补偿。
进一步地,调节电压和电流线性增益参数,具体为:调节侧向散射光通道的电压,将淋巴细胞群与周围细胞分开;调节前向散射光通道的电流增益,使细胞团与细胞碎片分开。
进一步地,设定阴性区具体为:取阴性设置管上流式细胞仪,设定散点图中十字门左下方的区域为阴性区,调节电压使阴性区内细胞百分比大于98%。
进一步地,分析检测结果,包括:圈取目标细胞并设门、分别在cd3/cd4、cd3/cd8、cd4/cd8象限图中准确界定双阴性区、单阴性区和双阳性区,读取cd3+、cd3+cd4+和cd3+cd8+t淋巴细胞百分比,从而获得猪外周血t淋巴细胞亚群比例。
进一步地,圈取目标细胞并设门要求圈取靠近fsc/ssc双参数图中左下角的细胞团。
与现有技术相比,本发明可以获得包括以下技术效果:
1)本发明成功建立了稳定规范的流式细胞术检测猪外周血t淋巴细胞亚群的方法,通过对样品前处理、检测和分析过程中的目标细胞选取、补偿调节及参数选择的问题进行改进,避免了试验过程中人为因素造成的误差,提高了结果判断的真实性和客观性。
2)本方法简单易行,可广泛应用于养猪生产实践中评价传染性疾病、代谢性疾病和中毒病时猪的细胞免疫功能状态,也能广泛应用于对家猪和野猪的科学研究中。
3)本申请先对全血用荧光单抗染色,再裂解红细胞,这是因为猪红细胞无核,通过裂解并洗除红细胞来可以获得较纯的白细胞。获得所需外周血白细胞,细胞碎片少。
4)本申请上机检测时,在fsc/ssc二维象限图中,淋巴细胞团位于左下角,通过参数调节,使淋巴细胞与右上角的单核细胞群分开,这样做能够使淋巴细胞群与其他细胞明显分开。
5)本申请上机和结果分析时,正视猪的cd8阳性细胞有强阳和弱阳两群。这样能够合理区分出cd3、cd4和cd8阳性细胞,合理分析各亚群t淋巴细胞的百分占比。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1为本发明实施例在fsc/ssc二维散点图中圈取猪外周血淋巴细胞示意图;
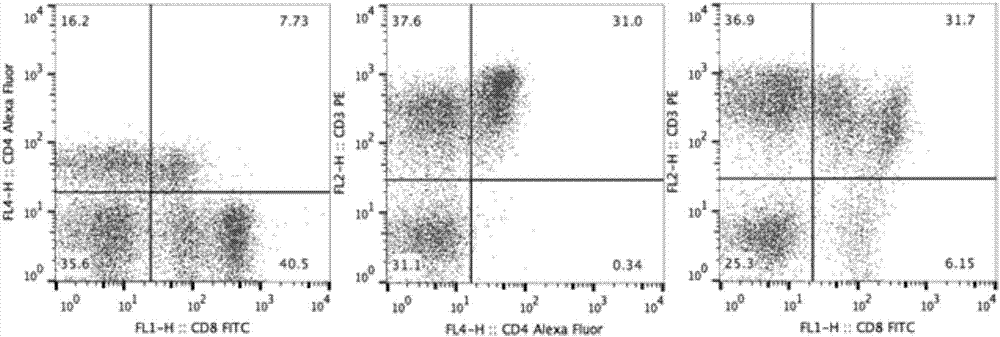
图2为利用本发明方法在流式细胞仪上得到的正常调节电压和补偿后的cd4/cd8、cd3/cd4、cd3/cd8双参数二维散点图。
图3为圈取单核细胞群时,得到的cd4/cd8、cd3/cd4、cd3/cd8双参数图;
图4为经染毒的猪外周血t淋巴细胞亚群结果分析图。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
本发明公开了一种流式细胞术检测猪外周血t淋巴细胞亚群的方法,具体包括以下步骤:
步骤1,取受试猪的外周静脉血2ml,制备抗凝血;
进一步地,所述制备抗凝血,具体为:于2ml规格的edta-na2抗凝管中入2ml猪外周静脉血,立即漩涡混匀。
步骤2,吸取100μl所述抗凝血于流式管中,分别加入抗猪cd3、cd4、cd8单克隆抗体,旋涡混匀,于4℃避光染色30min;
同时,吸取100μl所述单细胞悬液于另一流式管中,用作阴性设置管。
进一步地,阴性设置管的处理方式有两种,一是用同型对照试剂染色;二是不染色。
进一步地,同型对照试剂的选择方法具体为:选择与抗体对应表面标志的一抗完全相同种属来源、相同亚型及荧光标记的抗体。例如,检测管使用的是小鼠抗猪的cd4fitc标记的抗体,说明书上显示其成份是mouseigg1,那么同型对照就是fitc标记的mouseigg1。熟悉各单抗阳性细胞的分群情况后,通常使用空白对照来设置阴性对照即可。
步骤3,染色后,用红细胞裂解液破裂红细胞;
进一步地,所述步骤3中破裂红细胞,包括:制备1×浓度的红细胞裂解液;阴性设置管和检测管中均加入红细胞裂解液;红细胞被充分破裂的效果是液体变得清亮透明。
进一步地,1×红细胞裂解液的制备方法为:市售10×红细胞裂解液和双蒸水按1:9的比例混匀。
步骤4,用500μl预冷pbs液洗涤并重悬细胞,使用流式细胞仪进行检测;
进一步地,所述步骤4中使用facscalibur流式细胞仪进行检测,包括:在前向散射光/侧向散射光(fsc/ssc)双参数图中调节电压和电流线性增益(amp)参数,使细胞碎片、淋巴细胞、单核细胞和粒细胞彼此分开,如图1所示;选取淋巴细胞并设门;用未染色的细胞分别在cd3/cd4、cd3/cd8和cd4/cd8的双参数图中设定阴性区;用染色后的细胞调节电压和荧光补偿,完成数据获取。
本实施例中,在检测时,将细胞液置于上样口,以低速模式运行流式细胞仪。
其中,所述调节电压和电流线性增益(amp)参数,具体为:调节侧向散射光(ssc)通道的电压,沿ssc轴方向将左下方的淋巴细胞与邻近右上的单核细胞群分开;调节前向散射光(fsc)通道的amp参数,使淋巴细胞团与左侧火箭形的细胞碎片以及右侧的巨噬细胞团分开。根据猪外周血中有弱阳性和强阳性两群cd8+t淋巴细胞、有弱阳性cd4+cd8+t淋巴细胞群、有弱慢性和强阳性两群cd3+cd8+t淋巴细胞的特点,正确调节各通道的荧光补偿后得到的cd4/cd8、cd3/cd4和cd3/cd8的双参数图(如图2所示)。
其中,所述选取淋巴细胞具体为:设门圈取靠近fsc/ssc双参数图中左下角的细胞团。
其中,所述设定阴性区具体为:在cd3/cd4、cd3/cd8和cd4/cd8的双参数图中,调节十字门左下角的细胞,使其百分比大于98%。
在步骤4中,调节荧光补偿后,具体可达到的效果为:阳性和阴性、弱阳性和强阳性细胞团之间均有明显分界。
步骤5,分析检测结果,获得猪外周血t淋巴细胞亚群比例。
进一步地,所述步骤5中分析检测结果,包括:调出阴性区设置图,确定十字门的具体位置;调出用染色管收集的检测结果图,在fsc/ssc双参数图中圈取t淋巴细胞并设门;再分别在cd3/cd4、cd3/cd8、cd4/cd8象限图中准确界定双阴性区、单阳性区和双阳性区,分别读取cd3+、cd3+cd4+和cd3+cd8+t淋巴细胞百分比,从而获得猪胸腺t淋巴细胞亚群比例;计算cd3+cd4+和cd3+cd8+t淋巴细胞的比值。
具体的,应用cellquest或者flowjo软件在fsc/ssc双参数图中正确圈取t淋巴细胞并设门。分析时选取淋巴细胞的设门位置会导致结果差异极大,应圈取靠近ssc轴的细胞团并设门,如图1所示。得到的cd3+、cd3+cd4+和cd3+cd8+t淋巴细胞分布图如图2所示,cd3+t淋巴细胞百分比通常在60%以上。由图3所示圈取目标细胞时,cd3/cd4、cd3/cd8、cd4/cd8象限图中阴性区细胞占比高达95%左右,表明该团细胞非t淋巴细胞。因此,应按图1所示的方法,在fsc/ssc散点图中圈取靠近象限图左下方的细胞团。
其中,准确界定双阴性区、单阳性区和双阳性区,具体为:按照阴性区细胞数量大于98%的标准,用未染色细胞的cd3/cd4、cd3/cd8、cd4/cd8象限图确定十字门的位置,由此确定染色细胞在相应象限图中的十字门位置:十字门左下角显示阴性区细胞比例,左上角和右下角显示单阳性细胞比例,右上角显示双阳性细胞比例。
所述分别读取cd3+、cd3+cd4+和cd3+cd8+t淋巴细胞百分比,具体为:cd3+t淋巴细胞百分比的值为cd3/cd4象限图中左上角和右上角细胞百分比总和;cd3+cd4+和cd3+cd8+t淋巴细胞百分比的值分别为cd3/cd4和cd3/cd8象限图中右上角的细胞百分比。
在用流式细胞术检测猪外周血t淋巴细胞亚群时,其主要特点包括:一是需在染色后充分破裂红细胞;二是在fsc和ssc二维象限图中,淋巴细胞团位于左下角;三是猪的外周血中存在弱阳性和强阳性两团cd8+t细胞,需要根据这一特点来调节电压和荧光补偿。本发明通过在检测时,正确圈取淋巴细胞群,合理调节电压和amp参数,及合理调节荧光补偿,从而成功建立了一种稳定规范的猪外周血t淋巴细胞亚群的流式细胞仪检测方法。
实施例
检测滴鼻感染某呼吸道病毒对仔猪的新鲜外周血液中cd3/cd4/cd8的表达情况。
60日龄试验猪平均分为两组,对照组猪鼻腔喷雾生理盐水,攻毒组猪鼻腔喷雾病毒液。饲喂21天后,每组随机选取6只猪,颈静脉采血,制备抗凝血,用于检测猪的外周血t淋巴细胞亚群分布情况。
步骤1,取受试猪的外周静脉血2ml,于2ml规格的edta-na2抗凝管中,立即漩涡混匀,制备抗凝血;
步骤2,分别吸取100μl所述抗凝血于两支流式管中,一支管置4℃保存备用;另一支管中分别加入鼠抗猪cd3-sprd(sba,usa)、鼠抗猪cd4-fitc(sba,usa)、鼠抗猪cd8a-pe(sba,usa)单克隆抗体各1头份,旋涡混匀仪迅速混匀,于4℃静置避光染色30min;
步骤3,加入500μl1×浓度的红细胞裂解液,旋涡混匀后,于4℃冰箱中静置5min左右,充分破裂红细胞。
步骤4,用500μl预冷pbs液洗涤并重悬细胞,使用流式细胞仪(bdfacscalibur)进行检测:在前向散射光/侧向散射光(fsc/ssc)双参数图中调节电压和电流线性增益(amp)参数,使细胞碎片、淋巴细胞、单核细胞和粒细胞彼此分开;选取靠近ssc轴的细胞团并设门,如图1所示;用未染色细胞分别在cd3/cd4、cd3/cd8、cd4/cd8象限图中设定阴性区;用染色后的细胞调节荧光补偿,完成样品的数据获取。
步骤5,应用cellquest或flowjo7.6软件分析检测结果,在fsc/ssc双参数图中圈取t淋巴细胞并设门;再分别在cd3/cd4、cd3/cd8和cd4/cd8象限图中划十字门,十字门位置按阴性区细胞数量小于98%的标准设定,进而获得cd3+、cd3+cd4+、cd3+cd8+t淋巴细胞百分率值。
实验结果显示,染毒组猪外周血中cd3+和cd3+cd8+t淋巴细胞比例升高(图4)。结果表明,该病毒感染过程中,猪可能会以上调cd3+cd8+亚群t淋巴细胞比例的方式来调节机体的免疫功能。
通过以上内容可以看出,本发明通过充分裂解外周血液中的红细胞;在检测时正确圈取淋巴细胞群并合理调节电压及荧光补偿,从而成功建立了一种稳定规范的猪外周血t淋巴细胞亚群的流式细胞仪检测方法,避免了试验过程中人为因素造成的误差。应用流式细胞术更直观地展示猪外周血t淋巴细胞亚群的分群,为猪外周血t淋巴细胞亚群的研究提供了可靠的技术参考。
如在说明书及权利要求当中使用了某些词汇来指称特定成分或方法。本领域技术人员应可理解,不同地区可能会用不同名词来称呼同一个成分。本说明书及权利要求并不以名称的差异来作为区分成分的方式。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。说明书后续描述为实施本发明的较佳实施方式,然所述描述乃以说明本发明的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的商品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种商品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的商品或者系统中还存在另外的相同要素。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!