一种用于乙酰转移酶活性检测的电化学发光传感器的构建的制作方法
本发明属于电化学发光生物传感器领域,具体涉及一种用于乙酰转移酶活性检测的电化学发光传感器的构建。
背景技术:
组蛋白被修饰所引起的染色质结构的改变,在真核生物基因表达调控中发挥着重要作用。组蛋白修饰可包括甲基化、磷酸化、泛素化和乙酰化等。其中乙酰化为最主要的修饰方法,组蛋白乙酰转移酶(hat)则是调节组蛋白和转录因子乙酰化修饰水平的关键酶,它使得染色质结构松散、激活转录。hat催化的组蛋白乙酰化在生物化学以及药理学上有重要作用,因为其在表观遗传学基因调控上扮演重要角色,从而在控制细胞生命活动中hat的活性在临床上被作为多种疾病的诊断标准,例如急性白血病、癌症、肿瘤、代谢综合征、神经系统疾病等。因此对hat的活性检测在抗癌药物发现、基因转录的生化研究等临床诊断上有着重要意义。
对于hat活性检测的方法,早期的检测方法主要依赖于放射自显影和放射性同位素,这些方法深受放射性物质的危害。故而需要发展一些非放射性的检测手段,hat活性的检测主要依赖于抗体识别乙酰化位点、酶联免疫分析等,随着荧光的发展,荧光作为一个新颖的检测手段也应用于hat活性检测上,然而荧光剂自身的光漂白、高背景值以及被测物中的一些自荧光现象都影响着hat活性检测效率以及灵敏度,因此一种方法简便、无危害、高灵敏并且受限因素少的检测手段亟待被应用于hat活性检测上。
电化学发光(ecl)是化学发光与电化学相结合的产物,是指通过施加一定的电压进行电化学反应,在电极表面产生一些电生的物质,然后这些电生物质之间或电生物质与体系中某些组分之间通过电子传递形成激发态,由激发态返回到基态而产生的一种发光现象。ecl由于背景信号低,有效避免了荧光法的缺点已经被用于多种传感器的设计上,其中agncs的ecl应用还比较少,在hat活性检测上未出现相关报道。因此制备一种用于乙酰转移酶活性检测的电化学发光传感器为hat活性检测提供了一种理想的选择。迄今为止,尚没有发现此类传感器在hat活性应用上的专利与文章报道。
技术实现要素:
针对上述背景技术,为了克服现有技术中乙酰转移酶活性检测方法的不足,本发明的第一个目的是提供一种用于乙酰转移酶活性检测的电化学发光传感器,该电化学发光传感器是通过以下方法构建得到的:
首先,将金电极进行抛光、清洗及活化处理,通过金硫键(au-s)作用将捕获dna(简称cdna)组装于电极表面,并用巯基己醇(mch)封闭电极表面非特异性结合位点;随后通过静电作用吸附多肽链,并在组蛋白乙酰转移酶(hatp300)作用下对多肽链进行乙酰化处理,使之脱离金电极表面;其次金电极于含有两种发夹dna(hp1&hp2)的杂交链溶液中进行杂交链反应,以及银簇(agncs)的还原;即可组装好的电化学发光(ecl)生物传感器。
为了尽可能发展一种组蛋白乙酰转移酶(hatp300)的检测方法而提出的一种新型的方法简便、成本低,本发明的第二个目的是提供一种检测组蛋白乙酰转移酶活性的方法,该方法为非疾病诊断方法,包括以下步骤:
将上述电化学发光(ecl)生物传感器作工作电极,ag/agcl作参比电极,铂丝作对电极,组成三电极体系于过硫酸钾(k2s2o8)的pbs溶液中进行ecl测试;
将该电化学发光(ecl)生物传感器用不同浓度的蛋白乙酰转移酶处理后,利用三电极体系得到的ecl信号强度对蛋白乙酰转移酶浓度做线性回归方程,得工作曲线。
为了更加方便组蛋白乙酰转移酶(hatp300)活性的检测,本发明的第三个目的是提供一种检测组蛋白乙酰转移酶活性的试剂盒,该试剂盒包括:金电极;
金电极表面修饰体系:捕获dna、巯基己醇溶液;
目标物反应体系:肽链、组蛋白乙酰转移酶、乙酰辅酶a、目标物反应体系缓冲液;
杂交链反应体系:发夹hp1、发夹hp2、杂交链反应缓冲液;
银簇还原体系:硝酸银溶液、nabh4溶液;
ecl测试体系:过硫酸钾(k2s2o8)、pbs溶液。
与现有技术相比,本发明的有益效果是:
本发明相对于现有催化剂制备技术,具有以下优点和有益效果:
(1)本发明首次将agncs的电化学发光行为作为组蛋白乙酰转移酶活性检测的信号标志。与现有检测方法相比,本发明制备方法简便,易操控,反应条件温和。
(2)本发明使用杂交链反应(hcr)作为信号放大策略,与传统的一些信号放大方法相比,极大的增强了信号强度,使得目标物的检测灵敏度更高,检测限达到0.1nm,同时具备操作简便,检测快速等优点。
本发明对改进现有的组蛋白乙酰转移酶活性检测手段与方法存在的缺陷有显著效果。与现有技术相比,本发明制备方法简单、快捷、实用性强、成本低,制备出的传感器不仅易于重复测试,且对组蛋白乙酰转移酶的灵敏度有显著提高,这对电化学发光生物传感器在组蛋白乙酰转移酶活性上的应用和研究提供了很好的参考方向。
附图说明
图1为本发明的制备示意图。
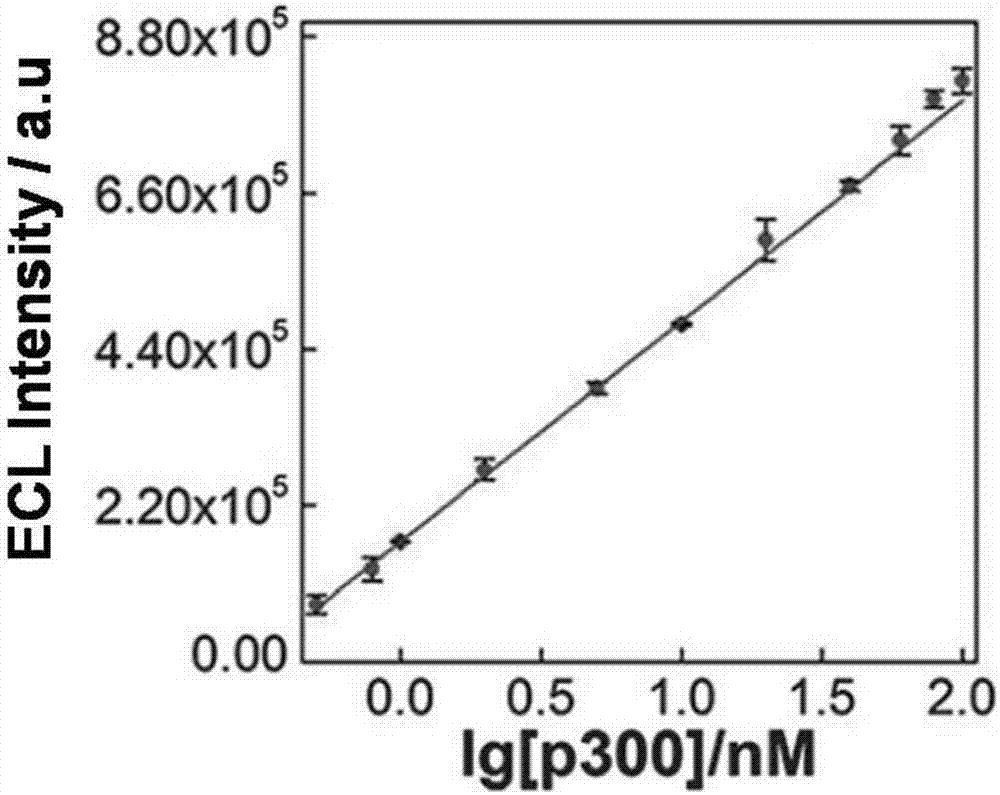
图2为本发明检测组蛋白乙酰转移酶活性的线性关系图。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作和/或它们的组合。
本发明的第一个方面,正如背景技术所介绍的,现有技术中乙酰转移酶活性检测方法存在一定的不足,为了解决如上的技术问题,提出一种用于乙酰转移酶活性检测的电化学发光传感器,基本构建方法如图1所示,该电化学发光传感器是通过以下方法构建得到的:
首先,将金电极进行抛光、清洗及活化处理,通过金硫键(au-s)作用将捕获dna(cdna)组装于电极表面,并用巯基己醇(mch)封闭电极表面非特异性结合位点;随后通过静电作用吸附多肽链,并在组蛋白乙酰转移酶(hatp300)作用下对多肽链进行乙酰化处理,使之脱离金电极表面;其次金电极于含有两种发夹dna(hp1&hp2)的杂交链溶液中进行杂交链反应,以及银簇(agncs)的还原;即可组装好的电化学发光(ecl)生物传感器。
为进一步提高检测的灵敏度,结合杂交链反应形成超级三明治结构的信号放大策略,使得agncs的ecl信号进一步增强,极大的提高了检测灵敏度、降低了检测限,检测限达到0.1nm。
具体的构建方法包括以下步骤:
(1)金电极表面预处理及活化:
金电极用铝粉抛光,用乙醇、水依次超声清洗后,于硫酸溶液中进行金电极表面的活化处理,水洗,吹干。
(2)金电极表面修饰:
将活化后的金电极浸入捕获dna(捕获dna采用cdna)溶液中,孵化,形成捕获dna修饰的金电极(cdna-au),洗净、吹干后将捕获dna修饰的金电极置于mch溶液中封闭电极表面的非特异性结合位点,得到mch-捕获dna-au电极。
(3)目标物反应
将洗净、吹干的封闭好的金电极于肽链溶液中,室温下放置;随后将金电极浸泡在含有hatp300和乙酰辅酶a(ac-coa)的缓冲液中,恒温反应。
此步骤发生乙酰化处理,就是hatp300将ac-coa上的乙酰基转移到肽链的特定赖氨酸残基上。
(4)杂交链反应(hcr)及银簇还原:
将金电极取出洗净、吹干,浸入含有两种发夹dna(hp1&hp2)的杂交缓冲液中,恒温进行杂交链反应;随后向杂交缓冲液中加入硝酸银溶液,暗中放置后,加入nabh4溶液,暗中进行反应还原形成银簇,即得到组装完全的ecl生物传感器。
以下内容是对上述步骤的具体阐述和进一步优选:
步骤(1)中,超声清洗时间为2.0~3.0min;硫酸溶液浓度为0.5~1.0m;吹干使用氮气。
步骤(2)中,所述捕获dna的浓度为1.0~10.0μm,孵化的温度范围为35.0~37.5℃,时间范围为1.0~3.0h,吹干使用氮气;所述mch溶液的浓度范围为1.0~2.0mm,封闭时间范围为0.5~1.5h。
步骤(3)中,室温下放置时间范围为20~50min;所用肽链浓度与捕获dna浓度比为1:1,使用的hatp300的浓度范围为0.1~1000.0nm,ac-coa的浓度范围为8.0~10.0μm;缓冲液为pbs溶液,ph=7.2~7.6;反应温度范围为30.0~37.0℃,反应时间范围为0.0~4.0h。
步骤(4)中,所述的hp1与hp2的浓度比为1:1;hp1&hp2与cdna的浓度比为1:1~3:1;缓冲液为pbs溶液,ph=7.2~7.6;反应的温度范围为35.0~37.5℃,时间范围为10.0~20.0h;所用agno3与hp1&hp2的摩尔比为6:1~15.5:1,放置时间范围为1.0~3.0h;所用的nabh4与agno3的摩尔比为1:1~2:1;还原反应时间范围为18.0~24.0h。
本发明中的捕获dna(全写是capturedna,简称cdna),用于捕获目标肽链,它的碱基设计与后续杂交链反应是密不可分的,其自身发生碱基配对的能力要远小于其与hp1杂交的能力,这样才能发生后续反应。在本发明的一个具体的技术方案中,所述cdna的序列为5’-ctaagtaactctgcactcttatatatcatagaattggtagat-(ch2)6-sh-3’,如seqidno:1所示。但并不仅仅限于此碱基序列,当cdna发生变化时,相应的后续的hp1和hp2都需要重新设计配对。
本发明中的肽链的氨基酸并没有特别的限定,只要是含有可以发生乙酰化反应的特定赖氨酸残基(k)即可,为了更加方便乙酰化的研究,本发明提供一条满足具备可以乙酰化的标准的肽链,其氨基酸序列为:rgkggkglgkggaka(即argglylysglyglylysglyleuglylysglyglyalalysala,如seqidno:2所示)。
本发明中的发夹dna(hp1&hp2)并没有特别的限定,hp1和hp2的设计原则是:利用cdna引发,只要能够发生hcr反应即可,即hp1和hp2交替杂交形成的很长的带缺口双链dna聚合物。具体是,hp1的设计标准是其3’端可以与修饰在电极上的cdna的5’端杂交,并预留出自身的5’端;hp2的设计标准是其3’末端含有12个c(胞嘧啶)序列不参与杂交,悬垂在杂交链外,用于吸附银离子,后续生成银簇,从12个c之后的序列部分进行与hp1预留的5’端杂交,并延伸出自身的5’端;进而再与hp1的3’端结合,以此依次循环。在本发明的一个具体的技术方案中,基于以如seqidno:1所示的cdna为引发链,hp1的序列是:5’-agagtgcagagttacttagaaacatctaagtaactctg-3’,如seqidno:3所示;hp2的序列是:5’-ctaagtaactctgtgaatacagagttacttagcccccccccccc-3’,如seqidno:4所示。当然,当引发链(cdna)改变时,hp1和hp2都需要重新设计配对。
本发明中所述电化学发光传感器在检测组蛋白乙酰转移酶活性的应用。
本发明的第二个方面,为了尽可能发展一种组蛋白乙酰转移酶(hatp300)的检测方法而提出的一种新型的方法简便、成本低,该方法包括:
将上述电化学发光(ecl)生物传感器作工作电极,ag/agcl作参比电极,铂丝作对电极,组成三电极体系于过硫酸钾(k2s2o8)的pbs溶液中进行ecl测试;
将该电化学发光(ecl)生物传感器用不同浓度的蛋白乙酰转移酶处理后,利用三电极体系得到的ecl信号强度对蛋白乙酰转移酶浓度做线性回归方程,得工作曲线,如图2所示。
其中,当制作组蛋白乙酰转移酶浓度工作曲线时,分别采用不同浓度的组蛋白乙酰转移酶(hatp300)对多肽链进行乙酰化处理,得到一系列的ecl信号强度,通过此ecl信号强度制作蛋白乙酰转移酶浓度线性回归方程。以此来推算本发明设计的传感器检测组蛋白乙酰转移酶(hatp300)活性的检测限范围。
当检测待测样品溶液中的组蛋白乙酰转移酶活性时,采用待测样品溶液对多肽链进行处理,得到ecl信号强度,即可检测出待测样品溶液中组蛋白乙酰转移酶的活性。
其中,所述待测样品可为复杂的细胞裂解液。
在本发明优选的技术方案中,ecl测试条件为:过硫酸钾(k2s2o8)的pbs溶液为含有5mmk2s2o8、100mmkcl的pbs溶液,测试的电压范围为-1.35~0.0v,扫速为100mv/s。
以上检测方法为非疾病诊断方法。在非疾病诊断上,通过检测组蛋白乙酰转移酶的活性,可以发现相关的抗癌药物,以及进行对相关抗癌药物的筛选研究。
本发明的第三个方面,为了更加方便组蛋白乙酰转移酶(hatp300)活性的检测,提供一种检测组蛋白乙酰转移酶活性的试剂盒,该试剂盒包括:金电极、捕获dna、巯基己醇、组蛋白乙酰转移酶、乙酰辅酶a、肽链、两种发夹dna(hp1&hp2)、硝酸银溶液、nabh4溶液、pbs溶液。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1
(1)金电极表面预处理及活化
将金电极用0.3μm的al2o3粉末在麂皮上进行打磨抛光处理,然后分别用乙醇、水超声清洗3min,用纯净氮气将电极表面吹干。
清洗吹干的金电极作工作电极,ag/agcl作参比电极,铂丝作对电极,于0.5mh2so4溶液中,-0.20~1.65v,100mv/s,扫描cv至稳定。
如此反复,直至金电极达到活化标准,将金电极用水洗净,氮气吹干。
(2)金电极表面修饰
将活化好的金电极浸入1μmcdna(5’-ctaagtaactctgcactcttatatatcatagaattggtagat-(ch2)6-sh-3’)的pbs溶液(50mm,ph7.4)中,35℃下孵化1h,形成cdna修饰的au电极(cdna-au)。
水洗净、氮气吹干后将cdna-au电极置于1mmmch溶液中60min,封闭电极表面的非特异性结合位点,得到mch-cdna-au电极。
(3)目标物反应及活性检测
将修饰好的金电极浸入含有1μm肽链的pbs溶液(50mm,ph7.4)中,室温下放置20min;随后将电极浸泡在含有100nmhatp300,10μmac-coa的pbs缓冲液(50mm,ph7.4)中,30℃下反应1h。
电极取出pbs(50mm,ph7.4)洗净、氮气吹干,浸入含有3μmhp1&hp2(hp1:5’-agagtgcagagttacttagaaacatctaagtaactctg-3’;hp2:5’-ctaagtaactctgtgaatacagagttacttagcccccccccccc-3’)的杂交缓冲液(pbs50mm,ph7.4)中,35℃,10h进行杂交链反应。随后往杂交缓冲液中加入18μmagno3溶液,4℃下暗中放置1h后,加入新鲜配制的18μmnabh4溶液,4℃下暗中反应18h用于还原形成银簇,即得到组装完全的ecl生物传感器。
将得到的传感器用pbs洗净,氮气吹干后,于含有5mmk2s2o8,100mmkcl的pbs溶液中,-1.35~0.0v,100mv/s,进行ecl测试。
实施例2
(1)金电极表面预处理及活化
将金电极用0.3μm的al2o3粉末在麂皮上进行打磨抛光处理,然后分别用乙醇、水超声清洗2min,用纯净氮气将电极表面吹干。
清洗吹干的金电极作工作电极,ag/agcl作参比电极,铂丝作对电极,于1.0mh2so4溶液中,-0.20~1.65v,100mv/s,扫描cv至稳定。
如此反复,直至金电极达到活化标准,将金电极用水洗净,氮气吹干。
(2)金电极表面修饰
将活化好的金电极浸入5μmcdna(5’-ctaagtaactctgcactcttatatatcatagaattggtagat-(ch2)6-sh-3’)的pbs溶液(50mm,ph7.4)中,37℃下孵化1h,形成cdna修饰的au电极(cdna-au)。
水洗净、氮气吹干后将cdna-au电极置于2mmmch溶液中30min,封闭电极表面的非特异性结合位点,得到mch-cdna-au电极。
(3)目标物反应及活性检测
将修饰好的金电极浸入含有5μm肽链的pbs溶液(50mm,ph7.4)中,室温下放置30min;随后将电极浸泡在含有500nmhatp300,8μmac-coa的pbs缓冲液(50mm,ph7.4)中,35℃下反应2h。
电极取出pbs(50mm,ph7.4)洗净、氮气吹干,浸入含有10μmhp1&hp2(hp1:5’-agagtgcagagttacttagaaacatctaagtaactctg-3’;hp2:5’-ctaagtaactctgtgaatacagagttacttagcccccccccccc-3’)的杂交缓冲液(pbs50mm,ph7.4)中,37℃,12h进行杂交链反应。随后往杂交缓冲液中加入100μmagno3溶液,4℃下暗中放置2h后,加入新鲜配制的100μmnabh4溶液,4℃下暗中反应20h用于还原形成银簇,即得到组装完全的ecl生物传感器。
将得到的传感器用pbs洗净,氮气吹干后,于含有5mmk2s2o8,100mmkcl的pbs溶液中,-1.35~0.0v,100mv/s,进行ecl测试。
实施例3
(1)金电极表面预处理及活化
将金电极用0.3μm的al2o3粉末在麂皮上进行打磨抛光处理,然后分别用乙醇、水超声清洗2min,用纯净氮气将电极表面吹干。
清洗吹干的金电极作工作电极,ag/agcl作参比电极,铂丝作对电极,于0.5mh2so4溶液中,-0.20~1.65v,100mv/s,扫描cv至稳定。
如此反复,直至金电极达到活化标准,将金电极用水洗净,氮气吹干。
(2)金电极表面修饰
将活化好的金电极浸入10μmcdna(5’-ctaagtaactctgcactcttatatatcatagaattggtagat-(ch2)6-sh-3’)的pbs溶液(50mm,ph7.4)中,36℃下孵化3h,形成cdna修饰的au电极(cdna-au)。
水洗净、氮气吹干后将cdna-au电极置于1mmmch溶液中45min,封闭电极表面的非特异性结合位点,得到mch-cdna-au电极。
(3)目标物反应及活性检测
将修饰好的金电极浸入含有10μm肽链的pbs溶液(50mm,ph7.4)中,室温下放置50min;随后将电极浸泡在含有100nmhatp300,10μmac-coa的pbs缓冲液(50mm,ph7.4)中,30℃下反应1h。
电极取出pbs(50mm,ph7.4)洗净、氮气吹干,浸入含有10μmhp1&hp2(hp1:5’-agagtgcagagttacttagaaacatctaagtaactctg-3’;hp2:5’-ctaagtaactctgtgaatacagagttacttagcccccccccccc-3’)的杂交缓冲液(pbs50mm,ph7.4)中,37.5℃,15h进行杂交链反应。随后往杂交缓冲液中加入155μmagno3溶液,4℃下暗中放置1h后,加入新鲜配制的155μmnabh4溶液,4℃下暗中反应24h用于还原形成银簇,即得到组装完全的ecl生物传感器。
将得到的传感器用pbs洗净,氮气吹干后,于含有5mmk2s2o8,100mmkcl的pbs溶液中,-1.35~0.0v,100mv/s,进行ecl测试。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>青岛大学
<120>一种用于乙酰转移酶活性检测的电化学发光传感器的构建
<130>2017
<160>4
<170>patentinversion3.5
<210>1
<211>42
<212>dna
<213>人工序列
<400>1
ctaagtaactctgcactcttatatatcatagaattggtagat42
<210>2
<211>15
<212>prt
<213>人工序列
<400>2
argglylysglyglylysglyleuglylysglyglyalalysala
151015
<210>3
<211>38
<212>dna
<213>人工序列
<400>3
agagtgcagagttacttagaaacatctaagtaactctg38
<210>4
<211>44
<212>dna
<213>人工序列
<400>4
ctaagtaactctgtgaatacagagttacttagcccccccccccc44
- 还没有人留言评论。精彩留言会获得点赞!