多重交联壳聚糖或其衍生物凝胶的体外梯度降解方法与流程
本发明涉及多重交联壳聚糖或其衍生物凝胶的体外梯度降解方法。该方法模拟体内酶环境或自由基环境,通过酶或自由基对多重交联壳聚糖或其衍生物凝胶进行定量降解,通过确定降解产物中还原糖的含量或降解产物中的氮含量的测定,确定凝胶的降解程度,从而获得多重交联壳聚糖或其衍生物凝胶的降解曲线,确定凝胶的降解周期。
背景技术:
壳聚糖(又称葡糖胺聚糖,英文名及简称:chitosan,cs)是甲壳素经过脱乙酰处理后得到的产物,所以又被称为:“脱乙酰甲壳素”。壳聚糖是由n-乙酰-d-氨基葡萄糖单体通过β-l,4-糖苷键连接起来的直链状高分子化合物,难溶于水,却易溶于酸。壳聚糖具有良好的生物相容性和生物可降解性,无毒,物理和化学性质相对稳定,粘合性好,成纤维及成膜性能优良,是一种可被生物体降解吸收的天然高分子材料。壳聚糖具有非常高的医用价值:壳聚糖可降低体内的胆固醇;还具有良好的抑菌效果,能够不利于细菌生长的环境;壳聚糖可以吸附和排泄体内重金属;还有能预防高血压,提高人体免疫力等功效。研究表明溶菌酶(一种人体体液中含量较高的抗菌物质,泪液中的含量最多,大约占人体泪液蛋白含量的40%),可以催化水解壳聚糖的β-1,4-氨基葡萄糖苷键成为氨基葡萄糖,因此壳聚糖在体内可被降解吸收。此外,体内的多种活性物质,如活性氧簇自由基以及甲壳素酶、葡萄糖酶、蛋白酶、脂酶、纤维素酶、半纤维素酶和果胶酶等30多种酶制剂也促进壳聚糖的降解代谢。酶对多糖的水解具有高度的选择性,而无其它副反应。因此,壳聚糖作为一种非常安全的天然高分子多糖,已经广泛的应用在生物医药,组织工程等领域。
作为可在生物医药及组织工程领域使用的材料,研究壳聚糖的降解过程十分必要。当前,针对壳聚糖的降解过程以及降解试剂已经有很多报道。目前已知的壳聚糖在体内可被溶菌酶(lysozyme)或自由基降解(邓倩莹等,化学世界,2005,6,338-340),溶菌酶可进攻壳聚糖中乙酰氨基葡萄糖,使1,4-糖苷键发生断裂而降解;自由基可直接促使糖苷键发生断裂而降解。交联壳聚糖虽然以壳聚糖作为主体,但针对交联壳聚糖的降解研究却鲜有报道。因此,寻找一种适合于交联壳聚糖的降解方法,确定交联壳聚糖的降解趋势也十分必要。
技术实现要素:
本发明的目的在于提供一种多重交联壳聚糖凝胶的体外梯度降解方法。该方法模拟体内酶环境或自由基环境,通过酶或自由基对多重交联壳聚糖凝胶进行定量降解,通过确定降解产物中还原糖的含量或降解产物中的氮含量的测定,确定壳聚糖凝胶的降解程度,从而获得多重交联壳聚糖凝胶的降解曲线,确定壳聚糖凝胶的降解周期。
本发明提供的多重交联壳聚糖凝胶的体外梯度降解方法为采用自由基对多重交联壳聚糖或其衍生物凝胶进行降解,并采用凯氏定氮仪对降解产物进行定量;或采用溶菌酶对多重交联壳聚糖或其衍生物凝胶进行降解,并采用gb/t5009.7-2016《食品安全国家标准食品中还原糖的测定》中第三法铁氰化钾还原糖测定法对降解产物进行定量。
本发明提供的多重交联壳聚糖凝胶的体外梯度降解方法包括的步骤:
1)配置浓度为0.001~0.1mol/l,优选0.01~0.05mol/l的抗坏血酸溶液,并用1~6mol/l盐酸调节ph至3~3.5;
2)取交联壳聚糖或其衍生物凝胶1~10ml(质量浓度范围为10~500mg/ml)置于10~50ml离心管,加入步骤1)中的抗坏血酸溶液1~10ml,并冷却至0~5℃,其中抗坏血酸的浓度为0.001~0.1mol/l,优选0.01~0.05mol/l;
2)保持0~5℃的环境,加入双氧水溶液1~10ml,其中双氧水浓度与加入体积必须与抗坏血酸的浓度与体积相等,双氧水的浓度为0.001~0.1mol/l,优选0.01~0.05mol/l;
3)将体系置于恒温水浴振荡器中,震荡温度设定37℃,每隔10~20min进行取样,每次取出降解液100~500μl,同时补充步骤1中抗坏血酸溶液100~500μl,总降解时间为120~1440min;
4)将取出后的降解液用浓度为1mol/l氢氧化钠中和至ph=7.0后,密封在截留分子量10~14kda的透析袋中,采用5ml纯水进行定量透析,透析时间为2~4h;
5)取透析液4.0ml,采用凯氏定氮仪检测透析液中的氮含量,凯氏定氮仪可选用包括但不限于上海沛欧skd-2000全自动凯氏定氮仪,检测过程可参照仪器购买时自带的凯氏定氮仪操作说明书中的要求,使用仪器的过程并不在本发明的保护范围之内,本发明将不对仪器的具体操作流程(包括参数)作详细说明;
6)凝胶的降解率将按照下面三个公式进行计算:
cn:采用凯氏定氮仪检测出的待检样品总氮含量(mg/g);
m:待检样品质量(g);
f:待检样品中水分含量(%);
v1:样品管消耗标准硫酸溶液体积(ml);
v0:空白管消耗标准硫酸溶液体积(ml);
c:标准硫酸溶液的浓度(mol/l);
c1:羧甲基壳聚糖含量(mg/g);
14:氮原子质量(da);
w:产品中羧甲基葡糖胺聚糖的降解率(%);
x为样品溶液的总体积与凯氏定氮仪所需测试液体积的比值。
本发明提供的多重交联壳聚糖凝胶的体外梯度降解方法包括以下的步骤:
1)取交联壳聚糖或其衍生物凝胶1~10ml(质量浓度范围为10~500mg/ml)置于10~50ml离心管,加入1~10ml浓度为0.01~0.05mol/l的磷酸盐缓冲液(ph7.0~7.4),加入400~2000u溶菌酶,并冷却至0~5℃;
2)将体系置于恒温水浴振荡器中,震荡温度设定37℃,每隔1~2h进行取样,每次取出降解液100~500μl,同时补充步骤1中磷酸盐缓冲液100~500μl,总降解时间为24~72h;
3)将取出后的降解液密封在截留分子量10~14kda的透析袋中,采用5ml纯水进行定量透析,透析时间为2~4h;
4)取透析液4.0ml,加入1ml浓度为12mol/l的盐酸溶液,于115~121℃条件下水解1~5h。水解液冷却至20~25℃后,采用gb/t5009.7-2016《食品安全国家标准食品中还原糖的测定》中第三法铁氰化钾还原糖测定法检测水解液中还原糖的含量,检测过程并不在本发明的保护范围之内,本发明将不对检测过程作详细说明;
5)凝胶的降解率将按照下面的公式进行计算:
m2=m1×m/m1(公式4)
w=m2/(c×m3/ρ)×100%(公式5)
m:聚壳聚糖或其衍生物单糖单元分子量(da);
m2:降解的凝胶质量(mg);
m1:按照铁氰化钾还原糖测定法检测出的还原糖(即氨基葡萄糖)质量(mg);
m1:氨基葡萄糖的分子量(da)。
w:凝胶的降解率(%)。
c:样品中羧甲基壳聚糖浓度(mg/ml);
m3:样品总质量(g);
ρ:样品的密度(g/ml)。
本发明中所选用的壳聚糖或其衍生物分子量范围为20kda至2000kda,优选分子量范围为100kda至800kda;脱乙酰度范围为60%至99%,优选80%至95%;本发明中所选用的水溶性壳聚糖衍生物主要为对壳聚糖进行侧基改性的衍生物,对壳聚糖主链六元糖环进行破坏改性的衍生物则不适用于本申请。壳聚糖的水溶性侧基改性包括:侧基羧基化改性,例如羧甲基壳聚糖等;侧基脂肪链改性,如羟丁基壳聚糖;侧基磺酸化改性,如磺酸化壳聚糖;以及保留伯氨基团或仲氨基团侧基季铵化改性。上述各种侧基改性壳聚糖的侧基取代度范围为0.5至2.0。
本发明中需要使用交联壳聚糖或交联壳聚糖衍生物凝胶,凝胶中所选用的交联剂包括但不限于多元环氧类化合物,多元醛基类化合物,水溶性多卤代烃,以及同时含有上述两种或多种官能团的化合物(例如,环氧氯丙烷等)。在上述交联剂中,多元环氧化合物包括二元、三元以及四元环氧化合物,其中,二元环氧化合物包括但不限于1,4-丁二醇二缩水甘油醚(bdde),1,2,3,4-二环氧丁烷以及1,2,7,8-二环氧辛烷(deo)等化合物;三元环氧化合物包括但不限于三甲基丙烷三缩水甘油醚等化合物;四元环氧类化合物包括但不限于季戊四醇四缩水甘油醚等化合物。多元醛基类化合物包括但不限于戊二醛、京尼平等。多元水溶性卤代烃包括但不限于1,4-二氯-2,3-丁二醇等。
本发明中提到的多重交联壳聚糖或其衍生物凝胶,可通过两种方式获得,其一为多次交联的壳聚糖或其衍生物凝胶,交联次数范围为2~5次,交联度(质量交联度,为加入交联剂质量与壳聚糖或其衍生物质量的比值)范围为1~20%(具体内容见本申请人同日申请的另一个发明专利:壳聚糖或其衍生物多重交联凝胶和制备方法);其二为多种不同交联度的壳聚糖或其衍生物凝胶经过均质混合后的产物,交联度范围为1~20%,可选用3~8种不同交联度的凝胶进行混合(具体内容见本申请人同日申请的另一个发明专利:仿生关节滑液及其制备方法)。
本发明提供了多重交联壳聚糖凝胶的体外梯度降解方法,模拟体内酶环境或自由基环境,通过酶或自由基对多重交联壳聚糖凝胶进行定量降解,通过确定降解产物中还原糖的含量或降解产物中的氮含量的测定,确定壳聚糖凝胶的降解程度,从而获得多重交联壳聚糖凝胶的降解曲线,精准确定壳聚糖凝胶的降解周期。
本发明提供的降解方法通过定量检测凝胶的降解产物以确定凝胶的降解过程,可以突出多重交联凝胶的梯度降解特点,操作简单且结果准确。凝胶的梯度降解,证明了凝胶在体内可以分阶段的起到凝胶的充填作用,凝胶进入体内前期,低交联度或表层的凝胶先被降解,凝胶的降解产物(氨基葡萄糖)可以起到刺激组织再生与修复的作用,随着时间延长,高交联度或内层的凝胶被缓慢降解,既可以长时间提供填充作用,也可以较长时间保证降解产物(氨基葡萄糖)的释放,长时间的刺激组织的再生与修复,直至修复完成。
附图说明
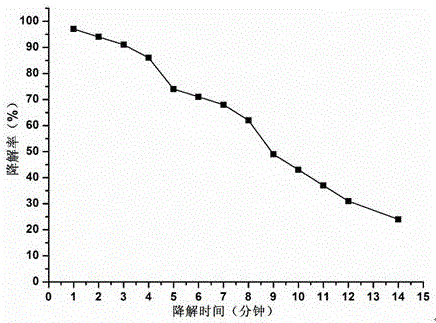
图1:交联壳聚糖凝胶的自由基降解曲线。
图2:交联壳聚糖凝胶的溶菌酶降解曲线。
图3:交联羧甲基壳聚糖凝胶的自由基降解曲线。
图4:交联羧甲基壳聚糖凝胶的溶菌酶降解曲线。
具体实施方式
以下通过实施例对本发明作进一步的详细说明,这并不限制本发明的保护范围。
实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件;所用的材料、试剂等,如无特殊说明,均可由商业途径获得。
需要特别说明的,本发明中所使用的多重交联壳聚糖或其衍生物凝胶均采用已知的方法制备得到,交联凝胶的制备工艺并不在本发明的保护范围之内。本发明中将不会对多重交联壳聚糖或其衍生物凝胶的制备过程做特别说明。
实施例中凯氏定氮仪的检测过程将参照仪器自带的凯氏定氮仪操作说明书中的要求,使用仪器的过程并不在本发明的保护范围之内。本发明将不对仪器的具体操作流程(包括参数)作详细说明。
实施例中铁氰化钾还原糖测定法的检测过程将参照gb/t5009.7-2016《食品安全国家标准食品中还原糖的测定》中第三法铁氰化钾还原糖测定法的具体操作流程,检测过程并不在本发明的保护范围之内,本发明将不对检测过程作详细说明。
实施例1:三重交联壳聚糖凝胶的自由基降解
配置浓度为0.01mol/l的抗坏血酸溶液,并用3mol/l盐酸调节至ph=3;取交联壳聚糖(脱乙酰度90%,分子量20kda,三次交联,质量浓度30mg/ml,交联度2%)凝胶2ml置于50ml离心管中,加入上述抗坏血酸溶液2ml,并冷却至0℃,其中抗坏血酸的浓度为0.01mol/l;保持0℃的环境,加入双氧水溶液2ml,双氧水的浓度为0.01mol/l;将体系置于恒温水浴振荡器中,震荡温度设定37℃,前100min每隔10min进行取样,此后每隔20min进行取样,每次取出降解液100μl,同时上述抗坏血酸溶液100μl,总降解时间为140min,总取样量12个;分别将取出后的降解液用浓度为1mol/l氢氧化钠中和至ph=7.0后,密封在截留分子量为14kda的透析袋中,采用5ml纯水进行定量透析,透析时间为2h;取透析液4.0ml,采用上海沛欧skd-2000全自动凯氏定氮仪检测透析液中的氮含量,并根据公式1至公式3换算为交联壳聚糖凝胶的降解率,结果见发明专利附图1。从附图中可以看到三次交联的壳聚糖凝胶呈现出三个梯度的降解趋势。
实施例2:三重交联壳聚糖凝胶的溶菌酶降解
取交联壳聚糖(脱乙酰度90%,分子量20kda,三次交联,质量浓度30mg/ml,交联度2%)凝胶2ml置于50ml离心管中,加入2ml浓度为0.01mol/l的磷酸盐缓冲液(ph7.2),加入800u溶菌酶,并冷却至0℃;将体系置于恒温水浴振荡器中,震荡温度设定37℃,前12h每隔1h进行取样,此后每隔2h进行取样,每次取出降解液100μl,同时补充上述磷酸盐缓冲溶液100μl,总降解时间为14h;将取出后的降解液密封在截留分子量为14kda的透析袋中,采用5ml纯水进行定量透析,透析时间为2h;取透析液4.0ml,采加入1ml浓度为12mol/l的盐酸溶液,于115℃条件下水解2h。水解液冷却至25℃后,采用gb/t5009.7-2016《食品安全国家标准食品中还原糖的测定》中第三法铁氰化钾还原糖测定法检测水解液中还原糖的含量,并根据公式(4)与公式(6)换算为交联壳聚糖凝胶的降解率,结果见发明专利附图2。从附图中可以看到三次交联的壳聚糖凝胶呈现出三个梯度的降解趋势。
实施例3:六重交联羧甲基壳聚糖凝胶的自由基降解
配置浓度为0.01mol/l的抗坏血酸溶液,并用3mol/l盐酸调节至ph=3;取交联羧甲基壳聚糖(脱乙酰度90%,分子量50kda,取代度1.2,质量浓度30mg/ml,等体积混合交联度为2%、4%、8%、12%、16%五种凝胶与非交联羧甲基壳聚糖)凝胶2ml置于50ml离心管中,加入上述抗坏血酸溶液2ml,并冷却至0℃,其中抗坏血酸的浓度为0.01mol/l;保持0℃的环境,加入双氧水溶液2ml,双氧水的浓度为0.01mol/l;将体系置于恒温水浴振荡器中,震荡温度设定37℃,前100min每隔10min进行取样,此后每隔20min进行取样,每次取出降解液100μl,同时上述抗坏血酸溶液100μl,总降解时间为250min;分别将取出后的降解液用浓度为1mol/l氢氧化钠中和至ph=7.0后,密封在截留分子量为14kda的透析袋中,采用5ml纯水进行定量透析,透析时间为2h;取透析液4.0ml,采用上海沛欧skd-2000全自动凯氏定氮仪检测透析液中的氮含量,并根据公式(1)至公式(3)换算为交联羧甲基壳聚糖凝胶的降解率,结果见图3。从附图中可以看到六重交联的壳聚糖凝胶呈现出六个梯度的降解趋势。
实施例4:六重交联羧甲基壳聚糖凝胶的溶菌酶降解
取交联羧甲基壳聚糖(脱乙酰度90%,分子量50kda,取代度1.2,质量浓度30mg/ml,等体积混合交联度为2%、4%、8%、12%、16%五种凝胶与非交联羧甲基壳聚糖)凝胶2ml置于50ml离心管中,加入2ml浓度为0.01mol/l的磷酸盐缓冲液(ph7.2),加入800u溶菌酶,并冷却至0℃;将体系置于恒温水浴振荡器中,震荡温度设定37℃,前12h每隔1h进行取样,此后每隔2h进行取样,每次取出降解液100μl,同时补充上述磷酸盐缓冲溶液100μl,总降解时间为25h;将取出后的降解液密封在截留分子量为14kda的透析袋中,采用5ml纯水进行定量透析,透析时间为2h;取透析液4.0ml,加入1ml浓度为12mol/l的盐酸溶液,于115℃条件下水解2h。水解液冷却至20℃后,采用gb/t5009.7-2016《食品安全国家标准食品中还原糖的测定》中第三法铁氰化钾还原糖测定法检测水解液中还原糖的含量,并根据公式(4)与公式(5)换算为交联羧甲基壳聚糖凝胶的降解率,结果见图4。从附图中可以看到六重交联羧甲基壳聚糖凝胶呈现出六个梯度的降解趋势。
- 还没有人留言评论。精彩留言会获得点赞!