用于进行过敏症和自身免疫性疾病的诊断测定的自动化免疫分析系统的制作方法
本申请是申请日为2014年3月17日的中国专利申请201480015969.4(pct/us2014/030373)的分案申请。
本教导涉及一种用于进行诊断测定的系统和方法,更具体地讲,涉及一种用于进行过敏症和自身免疫性疾病的诊断测定的自动化免疫分析系统和方法。
背景技术:
本部分的陈述只是提供关于本公开的背景信息并不应视作构成现有技术。
在自动化免疫化学分析期间,患者生物样品(例如,血清或血浆)中的分析物分子连接到顺磁性粒子。为了去除与可能同样存在于样品中的潜在化学来源相关的背景信号,通常在该工序中实施多个洗涤步骤。但是,这些洗涤步骤的结果是用于随后化学工艺的一部分初始粒子将会损失。
因此,需要一种允许量化在洗涤步骤后保留的粒子的方法以便标准化来自患者样品的发光信号。本申请意在改善并解决本领域的这些已知不足中的一些。
技术实现要素:
根据本申请的一个方面,提供一种用于进行自动化诊断测定的定量方法,该方法包括以下步骤:利用链霉亲和素包被的介质孵育捕获试剂以形成固相复合物;洗涤所述固相复合物以去除过量的捕获试剂;利用血清样品孵育所述固相复合物以形成免疫复合物;洗涤所述免疫复合物以去除任何未结合的样品;利用偶联物孵育所述免疫复合物以生成免疫-偶联复合物;洗涤所述免疫-偶联复合物以去除任何未结合的偶联物;引入能够产生可量化反应的底物;以及校准引入底物所产生的反应。
根据本申请的又另一个方面,提供一种用于将荧光标记结合到患者样品内的粒子的控制方法。根据本公开的此方面,该方法包括将发光标记结合到粒子,以及量化在一系列洗涤步骤后保留的粒子以标准化来自患者样品的发光信号。根据此说明性的方法,将发光标记与一些结合的分析物分子成比例地结合到粒子。
根据本公开的又另一个方面,提供一种被设计成在自动化平台上使用的用于评价血清样品中过敏原特异性免疫球蛋白e(ige)的定量方法。根据此方法,利用链霉亲和素包被的固相孵育生物素化捕获试剂以通过生物素-链霉亲和素的相互作用使捕获试剂连接到固相。然后,洗涤捕获试剂固相复合物以去除过量的生物素化捕获试剂。然后,利用捕获试剂固相复合物孵育血清样品以使血清中存在的过敏原特异性ige结合到所述的捕获试剂并生成免疫复合物。然后,洗涤免疫复合物以去除未结合的ige并随后利用标记的抗ige偶联物孵育以使偶联物结合到免疫复合物的过敏原特异性ige组分并生成免疫-偶联复合物。洗涤免疫-偶联复合物以去除未结合的标记的抗ige并随后引入能够产生可量化反应的底物。校准通过添加底物所产生的可量化反应并针对珠保持(beadretention)调节报道值。
根据文中某些方面,利用链霉亲和素包被的固相孵育生物素化捕获试剂的步骤来源于纯化过敏原、蛋白、酶或抗体的生物素化。
根据文中其它方面,利用链霉亲和素包被的固相孵育生物素化捕获试剂的步骤来源于由多种过敏原组成的过敏原提取物的生物素化。
根据文中又其它方面,利用链霉亲和素包被的固相孵育生物素化捕获试剂的步骤来源于用于体内人类诊断或治疗的过敏原提取物的生物素化。
根据本公开的特定说明性的方面,生物素化捕获试剂以包含纯化过敏原、蛋白、酶、抗体和过敏原提取物的不同来源的多种生物素化捕获试剂的掺混物存在。
根据本公开的又另一个特定说明性的方面,链霉亲和素包被的固相为一种通用的荧光标记的磁性微粒。
根据本公开的某些方面,一个或多个洗涤步骤包括通过磁性隔离在反应试杯的限定区域内的复合物来洗涤固相复合物。
根据本公开的又其它说明性的方面,利用血清样品孵育捕获试剂-固相复合物的步骤包括利用包含高浓度的人血清白蛋白(hsa)的反应稀释液孵育悬浮保持的捕获试剂-固相复合物。
根据本公开的又另一个说明性的方面,利用标记的抗ige偶联物孵育免疫复合物的步骤包括利用包含标示浓度的聚乙二醇的偶联物稀释液孵育悬浮保持的免疫复合物。根据本教导的特定方面,偶联物稀释液由100ng/ml抗ige-hrp,100μg/mlapo-hrp,50mm磷酸钠,ph6.7,150mmnacl,0.05%tween-20,1%bsa,4%(w/v)peg6,000,l%(v/v)proclin950,0.015%(v/v)消泡剂b组成。根据本教导的又另一个特定方面,偶联物稀释液由10ng/ml抗igg-hrp,10μg/mlapo-hrp,50mm磷酸钠,ph6.7,150mmnacl,0.05%tween-20,1%bsa,4%(w/v)peg6,000,l%(v/v)proclin950,0.015%(v/v)消泡剂b组成。
根据本公开的某些特定方面,与抗ige抗体偶联的辣根过氧化物酶(hrp)在洗涤免疫复合物以去除未结合ige时可用作间接标记,特别是因为ps-atto与hrp标记的偶联物的反应产生持久的高强度发光用于溶液测定中的最大检测灵敏度。
根据本公开的又其它特定方面,将底物加入免疫-偶联复合物中包括添加lumigenps-atto作为能够产生可量化反应的底物,可量化反应以通过hrp-ps-atto报告系统产生并通过光学盒中的照度计检测的化学发光信号存在。
根据本教导的某些方面,针对珠保持调节可量化反应的步骤包括以下步骤:将底物和免疫-偶联复合物转移到光学盒中,在其中量化荧光信号和化学发光信号;使用初始与最终荧光的比率以针对珠保持调节量化的化学发光信号;以及校准所调节的化学发光信号以计算报道值。为了将底物和免疫-偶联复合物转移到光学盒中,可使用具有抽吸样品的可重复使用的吸管端的自动化吸管臂。在光学盒内,测量荧光以确定珠保持,测量发光以检测由化学作用所产生的rlu信号。将测量值代入算法中以产生“经珠保持调节的rlu”,使其与校准曲线rlu比较,从而确定ige浓度。
根据本公开的又其它方面,荧光标记以alexafluor594生物胞素存在以及通用的磁性微粒以thermoscientificsa-speedbead或bangslabbiomagplus链霉亲和素存在。
本发明的另外其它目的和益处将从以下书面描述和附图中变得显而易见。
附图说明
通过参照本发明的实施方案的以下描述连同附图,本发明的上述方面和得到它们的方式将会更显而易见并且本发明自身将更好地理解,其中:
图1为根据本申请的进行自动化诊断测定的方法的示意图;以及
图2为根据本申请的教导的自动化免疫化学分析和试剂系统的顶视图。
在几个图中相应的参考符号表示相应的部件。虽然文中所述的示例以多种形式说明本发明的实施方案,但以下公开的实施方案并不旨在详尽或被视为将本发明范围限制为所公开的确切形式。
具体实施方式
以下所述的本申请的实施方案并不旨在详尽或将本申请限制为以下具体描述中所公开的确切形式。然而,选择并描述实施方案以使本领域的其他技术人员可认识并理解本申请的原理和实施。
除非另外定义,文中使用的所有技术和科学术语具有本申请所属领域的普通技术人员通常理解的相同意思。虽然与文中所述那些类似或等效的任意方法和材料可用于本申请的实施或测试中,但是现在要描述特定方法和材料。并且,文中所使用或想到的技术为本领域普通技术人员熟知的标准方法,并且材料、方法和实施例只是说明性的并无意限制。
在详细描述本公开的说明性的自动化免疫分析系统和方法前,在文中应理解并认识到,作为一种最小化来自过量或未结合材料的背景信号的方式,免疫测量通常需要在反应试杯中进行一次或多次相分离。为了利于分离或洗涤过程,可使用多种技术,包括但不限于,孔包被技术、珠包被技术或使用顺磁性粒子。利用将结合患者血样中所关注的分析物分子的捕获试剂包被这些分离介质中的每一种。根据本教导的某些方面,生物素化捕获试剂可以作为掺混物或混合物存在(即,来自类似种类但来自不同属种的捕获试剂)。本领域技术人员在文中应理解并认识到,可得到多种捕获试剂并可根据本教导使用,包括fda许可的可利用的那些,例如mixedvespidvenomprotein(混合的小黄蜂、大黄蜂和白脸大黄蜂)。在文中应理解,根据本教导使用的单独捕获试剂中的每一种的量和体积取决于它们的效力(即,它们产生可检测反应的能力)。
当将顺磁性粒子用作分离介质时,在洗涤过程期间将顺磁性粒子通过磁铁拉向试杯壁,然后抽吸所有液体。本领域技术人员在文中应理解并认识到,在常规洗涤过程期间,一些顺磁性粒子可连同液体一起被抽吸并因此对于进一步化学处理会损失。如果免疫测定步骤涉及多个洗涤步骤,则磁性粒子的损失会甚至更加明显。
本教导的一个目的是考虑在这些洗涤过程期间在免疫化学分析仪上发生的顺磁性粒子的损失。为此,根据本教导的某些方面,使患者血样中所关注的分析物结合捕获试剂,该捕获试剂已继而结合顺磁性粒子的表面。发光标记随后结合这些分析物分子。当将发光试剂或底物加入试杯中时,其与发光标记反应以产生可利用分析仪的光学检测器检测到的光。此外,如果顺磁性粒子连接荧光标记,则以荧光的方式读取试杯中的内容物将提供一种确定在洗涤步骤期间损失的粒子的分率的方法。
根据本公开的某些方面,自动化分析仪利用用于测定的常见顺磁性粒子,包括但不限于,磁珠或微粒。对于在分析仪上的每次测定,孵育捕获试剂并使其结合到反应试杯中的通用粒子以产生测定特异性、基于粒子的试剂,在文中有时被称为捕获-试剂固相复合物。根据本公开的某些方面,可用于进行诊断免疫测定的捕获试剂由生物素-pab或生物素-过敏原,10mm磷酸钠,ph7.4,0.9%nacl,0.05%tween-20,1%(w/v)人血清白蛋白,l%(v/v)proclin950,高达5%(v/v)甘油组成。根据本公开的又其它方面,可用于进行诊断免疫测定的另一种捕获试剂由生物素-ags,10mm磷酸钠,ph7.4,0.9%(w/v)nacl,0.05%tween-20,1%(w/v)牛血清白蛋白,l%(v/v)proclin950,1%蛋白酶抑制剂混合物,0.1mmdtt、25%(高达30%)(v/v)甘油组成。
在经历洗涤过程后,将患者样品,以及任选地稀释液(根据需要)加入试杯中的粒子中并孵育。此导致患者血样中特定分析物分子的捕获。根据本公开的一个特定说明性的方面,反应稀释液(样品稀释液)由10mm磷酸钠,ph7.4,500mmnacl,0.02%tween-20,1%(w/v)人血清白蛋白,1%(v/v)人igg,l%(v/v)proclin950,0.005%消泡剂-bv/v,2%(w/v)peg6,000组成。根据本公开的又另一个特定说明性的方面,反应稀释液(样品稀释液)由10mm磷酸钠,ph7.4;500mmnacl,0.02%tween-20,25%(w/v)人血清白蛋白,l%(v/v)proclin950组成。
根据这些说明性的实施方案,在文中应理解,高百分比的hsa(25%)部分地用于增加反应介质的粘度以在孵育步骤期间保持珠悬浮。此外,高hsa也在此孵育期间减小非特异性结合,并在患者样品稀释时改善相对光单位(rlu)线性。
然后进行另一次洗涤过程以去除任何过量或未结合样品,随后将发光标记和偶联物加入试杯中。当加入试杯中时,可预期到,在孵育期后,一部分偶联物将结合到顺磁性粒子上的捕获试剂/样品复合物。粒子随后进行另一次洗涤过程以去除任何未结合偶联物,然后将底物加入试杯中并短时间孵育以允许化学发光反应达到平衡。
达到平衡后,取得样品的发光和荧光读数。因为顺磁性粒子容置在分析仪的常见试剂瓶中并在吸入反应试杯中前保持均匀悬浮状态,所以将它们吸入试杯后的粒子的初始荧光测量值,当与每个测试的最终荧光测量值组合时,可用于确定在免疫测定法后保留在试杯中的初始粒子的分率。保留分率由下式给出:
f表示校正的荧光信号(即,通过光学检测器的计数效率校正的测量信号)。因为光学检测器具有一定的时间分辨率,所以当每单位时间检测的光子数增加,两个光子在时间分辨率内到达检测器的可能性也增加。因为这两个光子不能通过检测器分辨出,所以它们被计为单个光子。因此,光学检测器的检测效率随入射光子通量增加而减小。
因为与顺磁性粒子的容器壁相互作用并自此散射的极高通量的荧光激发光子,所以光学检测器会计数到一定量的光子,即使不存在荧光材料。此校对的背景信号由f背景表示。
使用荧光测量值来确定在免疫测定法中保留在反应试杯中的初始顺磁性粒子的百分比是有利的,因此该方法不限制系统吞吐量,尤其因为该方法不限制可实现的定时或平行处理。另一方面,大多数常规免疫测定分析仪依赖于顺磁性粒子和样品的再现性处理,这确实限制了可实现的定时或平行处理,因此,也限制系统吞吐量。虽然在这些常规免疫测定分析仪中检测不到处理效率随时间的变化,但是这些变化可利用荧光检测而检测到。本公开的教导允许使用平行处理(例如,多个洗涤臂),其洗涤效率因微小的机械对准或流体差异而变化。在免疫测定法的每个步骤后取得的荧光读数用于核实平行处理的等效功能。
现在将更详细地描述根据上述方法和技术的用于进行过敏症和自身免疫性疾病的诊断测定的自动化免疫分析设备和试剂系统。如该方法所述,在文中应理解并认识到,用于进行测定的所公开的设备可被配置成接收标准或通用的收集管以便可利用该系统进行多种不同试验。本领域技术人员在文中也应理解并认识到,存在用于分离抗原(包括过敏原和来自来源材料的自身免疫抗原)的多种已知方法。因为这些分离方法在本领域被广泛理解并接受,所以文中不详细讨论,尤其因为本领域的技术人员将认识到可将任何可接受的抗原分离法并入本发明系统中而不脱离其主旨或范围。在过敏原或自身免疫抗原被分离后,随后可使它们与生物素偶联以生成生物素化抗原或捕获试剂。生物素化抗原随后与链霉亲和素连接的固相载体或膜接触。根据本公开的某些方面,生物素化捕获试剂可来源于包括但不必限于以下的组分:纯化过敏原、蛋白、酶、抗体、dna、核提取物、细胞提取物和非蛋白抗原(例如,药物或与蛋白交联的材料)。
本领域技术人员在文中应理解和认识到,常用于诊断性过敏症免疫测定的标准生物素化方法和技术可根据本教导使用;但是反应的生物素/蛋白比可根据需要优化以确保用于化学作用的多种生物素化试剂的优化性能。根据本教导的某些方面,生物素试剂的特定尺寸的连接臂为nhs-peg12-生物素。并且,对于非蛋白抗原,可使材料与生物素化蛋白交联以包被到链霉亲和素珠固相上,但对于自身免疫抗原,例如dna,可将生物素化的双脱氧核苷酸并入dna中。
图1中显示了根据本公开的某些方面的自动化诊断测定法的示意性说明。根据此说明性的实施方案,所制造的具有链霉亲和素涂层的磁性珠或微粒与已知的生物素化过敏原或自身免疫抗原混合(孵育)(步骤10)。本领域技术人员在所文中应理解并认识到,链霉亲和素与生物素之间熟知的亲和结合有利于抗原包被到珠表面上并因此允许使用具有装载试剂制剂的通用珠。在文中也应理解并认识到,为根据本教导利用链霉亲和素包被的固相孵育生物素化捕获试剂所需的时间量和相关的实验室条件可根据进行的特定实验而变化,但是,根据本公开的某些方面,特别有效的孵育时间范围为约1分钟至约15分钟,更特别地约5分钟至约10分钟并在约2℃至约40℃,更特别地约36.8℃至约37.2℃的温度下。
如下表1中所示,根据本公开的这个方面,以下珠可用于文中所公开的磁性载体:
表1
虽然多种方法可用于将生物素化过敏原或自身免疫抗原与链霉亲和素包被的珠混合或孵育,但是根据某些特定实施方案,使产物在反应试杯中混合以使过敏原或抗原因为生物素/链霉亲和素相互作用而包被珠。根据一个说明性的实施方案,将10μl链霉亲和素(sa)包被的珠分配在反应试杯中,然后分配40μl生物素化过敏原或自身免疫抗原,在分配期间混合。使混合物孵育1-15分钟。然后通过将磁珠拉向反应试杯的一侧并固定它们同时利用缓冲液洗涤反应试杯可洗涤掉过量的生物素化过敏原或自身免疫抗原(步骤20)。根据一个说明性的实施方案,缓冲液可由10mm磷酸钠,ph7.4,0.9%(w/v)nacl,0.05%(v/v)tween-20,10mg/mlhsa和1%(v/v)proclin950组成。虽然本领域技术人员可采用本领域中已知的任何可轻易采用的固定技术以使磁珠保留在反应试杯一侧,但是根据某些特定的说明性的实施方案,使用外磁铁以固定磁珠同时进行洗涤步骤。
然后,将链霉亲和素包被的磁珠从磁场中释放出来并允许其在反应试杯内自由移动。然后,将生物样品(血清或血浆)加入反应试杯中,然后添加40μl反应缓冲液,从而重悬磁珠(步骤30)。除了生物样品,根据本公开的某些方面,在悬浮液中也可使用高浓度的人血清白蛋白(hsa)以促进大分子结合,并保持磁珠在溶液中。将人igg加入缓冲液中以保持反应线性。
如果样品含有对任何过敏原或抗原珠涂层具有反应性的任何抗体(例如,ige、igg),这些抗体在此样品孵育步骤期间将结合。样品孵育在37℃下保持40分钟。在患者样品中的任何抗体与珠结合后,则进行第二次洗涤步骤以去除任何未结合的患者样品(步骤40)。添加150μl洗涤缓冲浓缩液(50mm磷酸钠,ph7.4,4.5%(w/v)nacl,0.05%tween-20,0.05%(v/v)proclin950,0.02%(v/v)消泡剂-cv/v)以重悬珠并随后利用磁铁拉住珠子1.5分钟。去除溶液后,移开磁铁,添加200μl洗涤缓冲液以重悬该珠。然后,重复洗涤一次以上。
在进行第二次洗涤步骤后,使珠子重悬于在过敏症测定的情况中对人免疫球蛋白e(ige)具特异性或在自身免疫测定的情况中对人免疫球蛋白g、m或a(igg/m/a)具特异性的抗体中。根据本公开的某些方面,使抗体与酶(例如辣根过氧化物酶)偶联以结合被珠子捕获的任何特定的患者抗体(步骤50)。然后,再次洗涤珠子以去除任何过量的抗体(步骤60),添加高度灵敏的光形成试剂(例如,化学发光底物)以最大化检测灵敏度(步骤70)。根据本公开的教导,可用作化学发光底物的说明性的试剂包括但不限于,
一旦将高度灵敏的光形成试剂加入反应试杯中,就产生光(步骤80)。根据某些实施方案,可通过将吸管端中的溶液转移到阅读台上以读取发光信号和荧光信号二者,来测量所述光。但是,应理解,根据本公开发出的光可通过本领域可利用的任何适宜的已知检测方法检测,包括但不限于,照度计、x-射线胶片、高速照相胶片、ccd照相机、闪烁计数器、化学光量计或目测。本领域的技术人员应轻易地理解并认识到,每个检测平均值本身具有不同的光谱灵敏度;所选的检测装置可受多个因素支配,包括应用和用途、成本和便利性。并且,如文中所用,可根据本公开测量的可量化或可检测反应暗指阳性样品,其中过敏原特异性ige引起抗ige-hrp的结合,在添加底物时产生发光(即,rlu=相对光单位)。此外,在文中应理解到可量化或可检测反应也可应用于阴性样品所产生的可量化反应。
根据本教导的某些方面,使由任何过敏原特异性ige(slge)的阳性/阴性样品产生的rlu与整个ige(tige)校准曲线产生的rlu比较。通过利用生物素化的抗ige捕获试剂评价大量预先稀释的整个ige(tige)校准物(由who标准产生)来产生校准曲线。
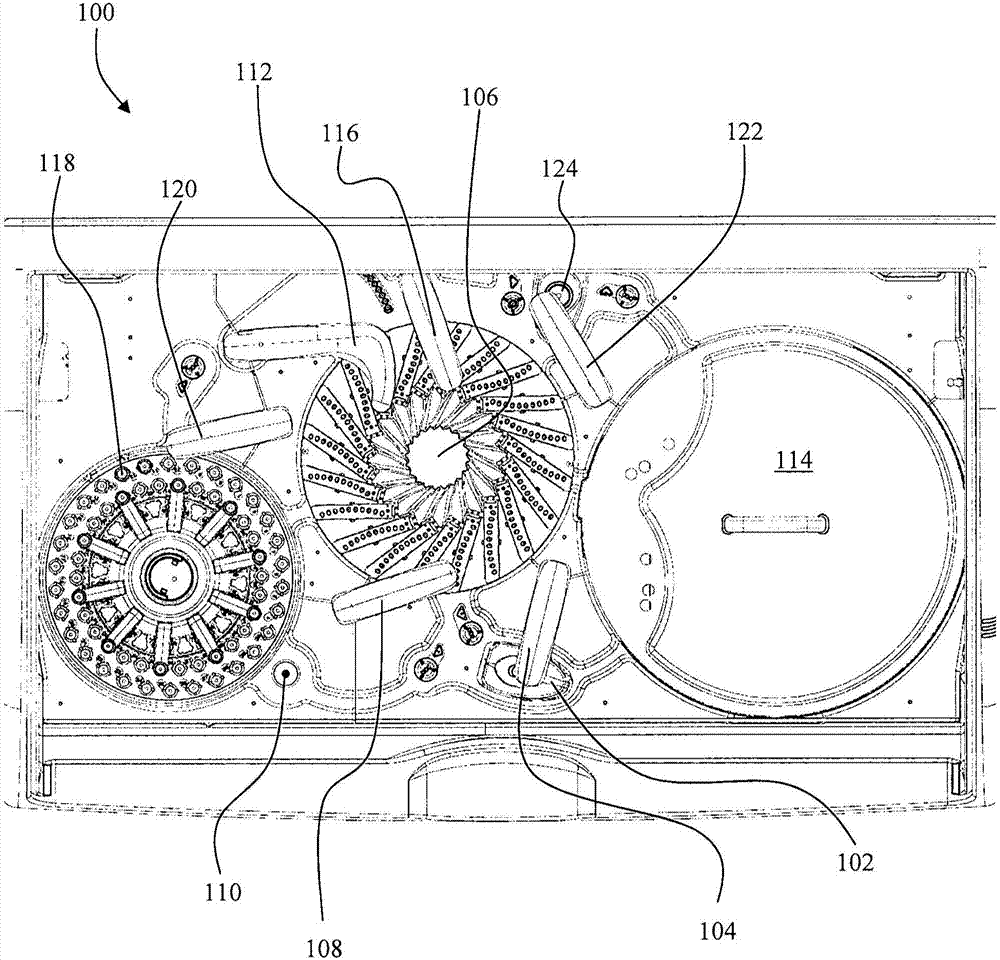
为了更好地理解本公开的机械方面,图2说明了自动化免疫化学分析仪和试剂系统100,其可根据本公开的教导用于量化和标准化分析物样品的发光信号。根据此说明性的方面,自动化免疫化学分析仪100开始于先将荧光标记的顺磁性粒子或荧光珠分配到位于反应旋转器106中的试杯中。根据文中的一个实施方案,一个示例性荧光珠包括荧光珠(sa-speedbead,atto590标记),1mg/ml。
先将荧光珠放于涡旋器102中并通过r1移液器104转移到反应旋转器106中。r1移液器104可抽吸所需量的荧光珠混合物并将所抽吸量转移到反应旋转器106中,在此处将其注入反应旋转器106的试杯中。在注入试杯后,光学移液器108可从反应旋转器106的试杯中抽吸试验样品并将试验样品转移到光学盒110中。一旦将样品置于光学盒110中时,可记录荧光和发光测量值。荧光和发光信号的初始记录可用作可对应于样品中荧光珠的初始浓度的荧光信号的基线测量。记录测量值后,多次冲洗移液器112可利用洗涤缓冲液冲洗试杯。
接着,可通过r1移液器104将荧光珠从涡旋器102转移到反应旋转器106中的试杯中。随后,r1移液器104可从试剂旋转器114中抽吸捕获试剂并将捕获试剂注入位于反应旋转器106中的试杯中。在孵育期后,单次冲洗移液器116可注入冲洗缓冲液以重悬荧光珠。然后在一段时间内通过磁铁可将大量悬浮的荧光珠集中(localize)在反应旋转器106中。在磁铁实质上已经将荧光珠集中在试杯中后,多次冲洗移液器112可抽吸并处理一部分冲洗缓冲液,在试杯中留下一部分荧光珠。多次冲洗移液器112可继续将洗涤缓冲液注入反应旋转器106的试杯中,重悬荧光珠。荧光珠可再次通过磁铁被集中在反应旋转器106中,然后多次冲洗移液器112从反应旋转器106的试杯中抽吸并丢弃未集中的一部分样品。
可将患者样品容置在样品管或样品旋转器118中。利用样品稀释液进一步对患者样品部分地稀释。此时,样品移液器120可抽吸一部分患者样品并将患者样品注入反应旋转器106的试杯中以重悬荧光珠。然后,可使反应旋转器106中含有患者样品的试杯在特定温度下孵育一段特定时间。孵育后,单次冲洗移液器116可注入冲洗缓冲液以重悬荧光珠。通过使荧光珠实质上在反应旋转器106中的磁铁附近的试杯中收集而利用反应旋转器106进行另一次集中过程。在荧光珠集中后,多次冲洗移液器112可抽吸并丢弃在集中过程期间未集中在反应旋转器106的试杯中的一部分流体。
然后对反应旋转器106的试杯中的样品进行几次冲洗循环。冲洗循环可包括利用多次冲洗移液器112以将洗涤缓冲液注入试杯中以重悬荧光珠。另一个集中步骤可允许利用磁铁将荧光珠收集在反应旋转器106中的试杯中。在允许荧光珠充分集中的一段时间后,多次冲洗移液器112可抽吸并无意地丢弃一部分样品,在反应旋转器106的试杯中留下一部分荧光珠。然后,可通过利用多次冲洗移液器112进行另一次冲洗循环以再次将洗涤缓冲液注入试杯中并允许荧光珠重悬。另一个荧光珠集中过程可在反应旋转器106中使用磁铁以从其余样品中集中荧光珠。最后,多次冲洗移液器112可抽吸通过集中过程未集中的一部分样品。
此时,r2移液器122可抽吸试剂旋转器114中试杯中所含的偶联物。然后,r2移液器122将先前抽吸的偶联物注入反应旋转器106的试杯中。在反应旋转器106中在控制时间和温度下孵育试杯后,单次冲洗移液器116可将冲洗缓冲液注入反应旋转器106的试杯中。可通过允许反应旋转器106中的磁铁实质地集中试杯中的荧光珠进行另一次荧光珠集中循环。多次冲洗移液器112可抽吸并丢弃试杯中的在集中循环期间没有被集中的一部分样品。
可对反应旋转器106的试杯中的样品另进行两次冲洗循环。多次冲洗移液器112可注入洗涤缓冲液以将荧光珠重悬在试杯中。另一个荧光珠集中循环可通过在足够长的时间内使反应旋转器106的试杯接近磁铁来集中荧光珠。在集中循环后,多次冲洗移液器112可抽吸并丢弃在集中循环期间未集中的一部分样品。然后,通过利用多次冲洗移液器112进行第二次洗涤循环以注入洗涤缓冲液,以重悬荧光珠。另一次集中循环可以利用反应旋转器106中的磁铁以集中试杯中的荧光珠。在集中过程后,多次冲洗移液器112可再次抽吸并丢弃在集中循环期间未集中的一部分样品。
此时,r2移液器122可从试剂旋转器114中抽吸一部分偶联物并将偶联物注入混合的底物容器124中,产生混合的底物样品。然后,r2移液器可从混合的底物容器124中抽吸混合的底物样品并将混合的底物样品注入反应旋转器106的试杯中,利用混合的底物样品重悬荧光珠。可随后利用光学移液器108抽吸反应旋转器106的试杯中的样品并放于光学盒110中。在光学盒观察荧光和发光后,丢弃样品并且多次冲洗移液器冲洗反应器旋转器106的试杯,准备用于下一次试验。
下面提供了一些非限制性实施方式来进一步说明本发明。
实施方式1:一种用于进行自动化诊断测定的定量方法,其包括:
利用生物素化捕获试剂孵育链霉亲和素包被的介质,以形成固相复合物,所述链霉亲和素包被的介质包含一种通用的荧光标记的磁性微粒,所述生物素化捕获试剂来源于自身免疫疾病所涉及的过敏原提取物、单过敏蛋白和人类蛋白中的至少一种;
洗涤所述固相复合物以去除过量的捕获试剂;
利用血清样品孵育所述固相复合物以形成免疫复合物;
洗涤所述免疫复合物以去除任何未结合的样品;
利用偶联物孵育所述免疫复合物以生成免疫-偶联复合物;
洗涤所述免疫-偶联复合物以去除任何未结合的偶联物;
引入能够产生可量化反应的底物;以及
校准引入底物所产生的所述反应。
实施方式2:根据实施方式1所述的方法,其中利用所述血清样品孵育所述固相复合物的步骤包括将血清样品中存在的过敏原特异性人免疫球蛋白e(ige)结合到所述生物素化捕获试剂。
实施方式3:根据实施方式1所述的方法,其中利用所述血清样品孵育所述固相复合物的步骤包括将血清样品中存在的自身免疫特异性人免疫球蛋白g(igg)、自身免疫特异性人免疫球蛋白m(igm)或自身免疫特异性人免疫球蛋白a(iga)结合到所述生物素化捕获试剂。
实施方式4:根据实施方式1所述的方法,其中所述生物素化捕获试剂来源于纯化过敏原、蛋白、酶或抗体的生物素化。
实施方式5:根据实施方式1所述的方法,其中所述生物素化捕获试剂由多种过敏原构成。
实施方式6:根据实施方式1所述的方法,其中所述生物素化捕获试剂以选自纯化过敏原、蛋白、酶、抗体和过敏原提取物的多种生物素化捕获试剂的掺混物存在。
实施方式7:根据实施方式1所述的方法,其中一个或多个洗涤步骤包括通过将进行洗涤的复合物磁性隔离在反应试杯的限定区域内而洗涤所述复合物。
实施方式8:根据实施方式1所述的方法,其中利用链霉亲和素包被的介质形成固相复合物的步骤包括利用包含高浓度的人血清白蛋白(hsa)的反应稀释液孵育悬浮保持的生物素化捕获试剂。
实施方式9:根据实施方式1所述的方法,其中利用偶联物孵育免疫复合物的步骤包括利用包含标示浓度的聚乙二醇的偶联物稀释液孵育悬浮保持的免疫复合物。
实施方式10:根据实施方式9所述的方法,进一步包括当洗涤所述免疫复合物以去除未结合样品时将辣根过氧化物酶(hrp)用作间接标记的步骤。
实施方式11:根据实施方式1所述的方法,进一步包括通过以下方式调节针对珠保持的可量化反应的步骤:
将所述底物和免疫-偶联复合物转移到光学盒中,其中量化荧光和化学发光信号;以及
采用初始与最终荧光的比率以调节量化的化学发光信号以计算报道值。
实施方式12:根据实施方式11所述的方法,其中将所述底物和免疫-偶联复合物转移到光学盒的步骤包括利用具有可再重复使用的吸管端的自动化吸管臂以抽吸样品。
实施方式13:根据实施方式11所述的方法,进一步包括:
测量所述光学盒内的荧光以确定珠保持;以及
测量所述光学盒内的发光以检测产生的相对光单位信号。
实施方式14:根据实施方式13所述的方法,进一步包括将荧光和发光测量值代入算法中以产生经珠保持调节的相对光单位信号。
实施方式15:根据实施方式14所述的方法,进一步包括将产生的经珠保持调节的相对光单位信号与校准曲线相对光单位信号进行比较。
在以下实施例中阐述本公开的过程、方法的优点和改进。这些实施例只是说明性的并无意限制或排除本公开的其它实施方案。
实施例1:抗人ige或过敏原提取物的生物素化:
将2μl在dmso中250mm的nhs-peg12-生物素(pierce)加入1ml亲和纯化的抗人ige(immunoreagents)5.0mg/ml的磷酸盐缓冲盐水(pbs)中。或者,将1.6ul在dmso中250mm的nhs-peg12-生物素(pierce)加入1ml过敏原提取物1.0mg/ml的磷酸盐缓冲盐水(pbs)中。
混合试剂溶液并放在冰上2小时。通过在2-8℃下4小时和一整夜,更换两次pbs的透析(抗体与缓冲液的体积比为1:100)将游离生物素试剂从生物素化抗体中分离出。
实施例2:荧光珠的制备:
将5μl在ddh2o中1mm的生物素-荧光(alexafluor594生物胞素,钠盐,lifetechnologies)加入45mlpbsthp缓冲液(10mm磷酸钠,ph7.4,0.9%(w/v)nacl,0.05%(v/v)tween-20,10mg/mlhsa,1%(v/v)proclin950)中。充分混合。
将5mlsa-speedbead(sera-magspeedbeads链霉亲和素包被的磁性粒子,thermo)10mg/ml加入生物素-荧光溶液中并充分混合。
实施例3:针对过敏原的特异性ige水平的测定
将10μl荧光珠(荧光标记的顺磁性微粒)以珠浓度1mg/ml分配在反应试杯中;将40μl生物素-过敏原(例如,蛋白、奶、花生等)或生物素-抗ige抗体分配并混合到荧光珠中,并在37℃下孵育1-10分钟。洗涤后,将过敏原或抗ige包被的珠子重悬在40μl反应缓冲液中。针对过敏原测定获自特应性和非特应性个体的血清样品。将10μl样品加入反应试杯中40μl悬浮的过敏原包被的珠子中。对于六点标准曲线,将10μl血清标准(根据whoige标准75/502校准的二级标准)各自加入反应试杯中的40μl抗ige包被的珠子中。虽然根据本教导可使用各种不同的标记的抗ige偶联物,但是根据某些教导,使用以下抗ige偶联物:对于过敏症测定,使用抗ige-hrp;对于自身免疫测定,使用抗iga-hrp、抗igg-hrp和抗igm-hrp;对于ecp,使用抗ecp-hrp;以及对于类胰蛋白酶,使用抗类胰蛋白酶-hrp。并且,如文中所用,每个偶联物具有用于化学作用的优化的hrp合并率。根据本教导的某些方面,用于所列举的偶联物的hrp合并率的范围在约1.2与约5.4之间。此外,本教导也希望并入其它类型的偶联物-报告系统包括但不限于:碱性磷酸酶偶联物和b-半乳糖偶联物。
混合溶液并在37℃下孵育40分钟。洗涤后,使珠子重悬于50μl抗人ige-hrp偶联物中,并在37℃下孵育30分钟。将50μlps-atto(lumigen)加入每个试杯中,珠子重悬。将珠悬浮液转移到吸管端并在光学盒中读取荧光和发光信号。利用四参数逻辑函数等式和从标准曲线内插的过敏原的特定ige水平来确定标准曲线。
可根据本教导使用的说明性试剂和组分表包括,但不必限于:珠子:荧光珠(sa-speedbead,atto590标记),1mg/ml;捕获试剂稀释液:ige:10mm磷酸钠,ph7.4,0.9%(w/v)nacl,0.05%tween-20,1%(w/v)人血清白蛋白、l%(v/v)proclin950、高达5%(v/v)甘油;ana:10mm磷酸钠,ph7.4,0.9%(w/v)nac1,0.05%tween-20,1%(w/v)牛血清白蛋白,1%蛋白酶抑制剂混合物,0.1mmdtt,l%(v/v)proclin950,25%(高达30%)(v/v)甘油;洗涤缓冲浓缩液(5x):50mm磷酸钠,ph7.4,4.5%(w/v)nacl,0.05%tween-20,0.05%(v/v)proclin950,0.02%(v/v)消泡剂-cv/v;试剂稀释液(反应稀释液和样品稀释液)ige--10mm磷酸钠,ph7.4,500mmnacl,0.02%tween-20,1%(w/v)人血清白蛋白,1%(v/v)人igg,l%(v/v)proclin950,0.005%消泡剂-bv/v,2%(w/v)peg6,000;ana-10mm磷酸钠,ph7.4,500mmnacl,0.02%tween-20,25%(w/v)人血清白蛋白,l%(v/v)proclin950;校准物和对照:校准物:稀释成样品稀释液的患者样品;对照:患者样品池;偶联物:偶联物稀释液:50mm磷酸钠,ph6.7,150mmnacl,0.05%tween-20,1%bsa,5%(w/v)peg6,000,l%(v/v)proclin950;ige:100ng/ml抗ige-hrp、100μg/mlapo-hrp(在稀释液中)、0.015%消泡剂-bv/v;以及底物:ps-attoa&b、0.01%消泡剂-bv/v。
虽然文中以上公开了并入本申请的原理的示例性实施方案,但本申请不限于所公开的实施方案。反而,本申请意在涵盖利用其普遍原理的本申请的任何变化、用途或修改。并且,本申请意在涵盖对本公开的这种偏离,只要其属于本申请所涉及领域中已知或惯用手段且落入随附权利要求的限制范围。
文中所用术语只是用于描述特定说明性的实施方案并无意限制。如文中所用,单数形式“一”、“一种”和“所述”可意在包括复数形式,除非上下文另外指出。术语“包括”、“包含”、“含有”和“具有”为包容性的并因此指出所述特征件、整数、步骤、操作、元素和/或组件的存在,但不排除一种或多种其它特征件、整数、步骤、操作、元素、组件和/或其组的存在或添加。文中所述的方法步骤、过程和操作不得视为必然要求按照所讨论或所说明的特定顺序实施,除非具体指明实施顺序。还应理解可使用额外或替代步骤。
- 还没有人留言评论。精彩留言会获得点赞!
- 胸腺素α-1用于制备预防及治疗自身免疫性疾病的药物的制作方法
- 用于治疗自身免疫性病症和炎性病症的作为s1p1 受体激动剂的经取代的三环酸衍生物的制作方法
- Il-23和il-17拮抗剂治疗自身免疫性眼部炎性疾病的用途的制作方法
- 用于治疗免疫炎性病症的方法和药剂的制作方法
- 可溶性cd164在炎性和/或自身免疫性疾病中的应用的制作方法
- 用于治疗癌症和免疫以及自身免疫性疾病的细胞凋亡诱导剂的制作方法
- 用于治疗过度增生性疾病、自身免疫性疾病和心脏病的包含3-奎宁环酮衍生物的水溶液的制作方法
- 一种预防或治疗自身免疫性糖尿病的化合物及其制备方法和用途的制作方法
- 从植物中药提取治疗老年性炎症和自身免疫性炎症的药品的制作方法
- 香草酸苷衍生物在治疗系统性自身免疫性疾病中的用途的制作方法
- 抗体制剂的制作方法
- 在治疗自身免疫性疾病和炎性疾病中作为s1p激动剂的取代的噁二唑衍生物的制作方法
- 用于治疗癌症以及免疫与自身免疫性疾病的细胞凋亡诱导剂的制作方法
- 治疗慢性淋巴性甲状腺炎的注射药物的制作方法
- 作为用于治疗癌症和免疫性和自身免疫性疾病的凋亡诱导剂的8-氨基甲酰基-2-(2
- 使用pde4抑制剂用于治疗和控制自身免疫性疾病和炎性疾病的方法和组合物的制作方法
- 胸腺素α-1用于制备预防及治疗自身免疫性疾病的药物的制作方法
- 用于治疗自身免疫性病症和炎性病症的作为s1p1 受体激动剂的经取代的三环酸衍生物的制作方法
- Il-23和il-17拮抗剂治疗自身免疫性眼部炎性疾病的用途的制作方法
- 用于治疗免疫炎性病症的方法和药剂的制作方法