白血病标志物联检抗体芯片及试剂盒的制作方法
本发明属于生物医学
技术领域:
,特别涉及一种同时定量检测白血病标志物的抗体芯片。
背景技术:
:白血病(leukemia),亦称作血癌,是一种造血系统的恶性肿瘤。病源是由于细胞内脱氧核糖核酸的变异形成的骨髓中造血组织的不正常工作。骨髓中的干细胞每天可以制造成千上万的红血球和白细胞。白血病病人过分生产不成熟的白细胞,妨害骨髓的其他工作,这使得骨髓生产其它血细胞的功能降低。白血病可以扩散到淋巴结、脾、肝、中枢神经系统和其它器官。白血病是一类造血干细胞恶性克隆性疾病,我国各地区白血病的发病率在各种肿瘤中占第六位。急性髓系白血病(acutemyeloidleukemia,aml)是最常见的成人急性白血病,具有高度的异质性。近年来细胞遗传学、分子生物学及治疗靶点识别技术的发展,推动了靶向治疗及分层治疗水平的进步,但现阶段尚缺乏一种可很好地将其中不同预后患者鉴别开的方法。并且许多预后良好的患者与临床治疗反应不相符,出现治疗效果差,难缓解,缓解后易复发等情况。提示目前的以细胞遗传学和分子生物学检测指标为主的aml诊断、预后分层体系存在较大的局限性。除已有的细胞遗传学、分子生物学检测指标及可能的检测误差等因素外,尚有许多更复杂的白血病预后因素尚未阐明。髓细胞白血病是恶性克隆增殖性疾病,其增殖机制尚未被阐明。由于细胞信号通路的调控是一个网状结构,由于细胞因子在体内彼此间形成网络并与各种免疫细胞相互作用,参与白血病发生发展,必须同时测定多种细胞因子含量变化才能全面、准确的反应白血病发生及进展的机理,而传统的elisa和流式细胞等技术只能针对某几个因子进行检测,无法整体、全面地了解白血病生物标志物的变化水平,深入了解白血病发病机理、以及对于白血病的准确诊断、病程监控和预后评估而言,都是十分困难的。因此,有必要针对上述问题,提供一种可用于全面了解白血病生物标志物变化水平的抗体芯片。技术实现要素:基于此,针对上述问题,本发明提供了一种可用于全面了解白血病生物标志物变化水平的抗体芯片。为实现上述目的,具体技术方案如下:一种白血病标志物联检抗体芯片,包括载体与固定在所述载体上的针对白血病标志物的特异性抗体,所述白血病标志物选自:ena-78、gcp-2、mdc、mif、mip-3a、mpif-1、mspa、opn、gdf-15、hb-egf、hgf、pdgf-aa、vegf-d、blc、g-csf、tnf-rⅰ、upar、tnfa、fasl、il-4、icam-1、il-5、kc、timp-1、tarc、il-2、il-7、m-csf、il-10、il-21、il-12p70、bdnf、pf-4、egf、tnf-rⅱ、light中的至少17个。在其中一些实施例中,所述白血病标志物至少包括:ena-78、gcp-2、mdc、mif、mip-3a、mpif-1、mspa、opn、gdf-15、hb-egf、hgf、pdgf-aa、vegf-d、blc、g-csf、tnf-rⅰ和upar。在其中一些实施例中,上述白血病标志物还包括:tnfa、fasl、il-4、icam-1、il-5、kc、timp-1、tarc、il-2、il-7、m-csf、il-10、il-21、il-12p70、bdnf、pf-4、egf、tnfrⅱ和light。在其中一些实施例中,上述固定有针对白血病标志物特异性抗体的载体包括为孔板、滤膜、玻片中的任意一种。本发明的目的还在于,提供一种白血病标志物联检抗体芯片试剂盒。为实现上述目的,具体技术方案如下:一种白血病标志物联检抗体芯片试剂盒,其特征在于,包括上述白血病标志物联检抗体芯片。在其中一些实施例中,上述试剂盒还包括针对白血病标志物的相应的检测抗体。在其中一些实施例中,上述白血病相应的检测抗体经过生物素、hrp或胶体金标记。在其中一些实施例中,上述试剂盒还包括白血病标志物的相应标准品。基于上述技术方案,本发明具有以下有益效果:本发明发明人通过大量创造性劳动,找到与白血病密切相关的36种蛋白,作为白血病生物标志物,可通过其表达量差异有效区分白血病患者与健康者,通过针对选自上述蛋白的特异性抗体制备抗体芯片,用于同时测定多个样品、多个白血病生物标志物的表达量,有助于从细胞因子信号网络的角度全面、深入地了解白血病发生及进展的机理,从而可更加准确且全面地反应白血病发生及病程,提高白血病的准确诊断、病程监控和预后评估水平。特别地,发明人找到与白血病的相关性更为显著的17个蛋白,可以很好地区分白血病患者和健康人,制备可以检测该17个蛋白的表达量的抗体芯片,17个蛋白与白血病相关性更为显著,得到的结果更可靠、更准确。本发明所述抗体芯片在对白血病生物标志物表达水平的检测中,具有高通量、标本用量少、能在普通实验室推广和规模化等优点,有利于获取对于治疗方法和预后有指导意义的生物标志物表达水平的信息,从而提升白血病的有效治疗率,改善病人的生活水平。附图说明图1为抗体芯片点阵排布方式示意图;图2为实施例5中的健康组与白血病组蛋白差异火山图;图3为实施例5中17个蛋白表达量主成分分析结果图;图4为实施例6中17个蛋白对应的roc曲线图;图5为实施例6验证白血病生物标志物的lda模型训练集的结果分析图;图6为实施例6验证白血病生物标志物的lda模型测试集的结果分析图;图7为实施例6验证白血病生物标志物的聚类热图。具体实施方式为了能够更清楚地理解本发明的技术内容,特举以下实施例详细说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的
技术领域:
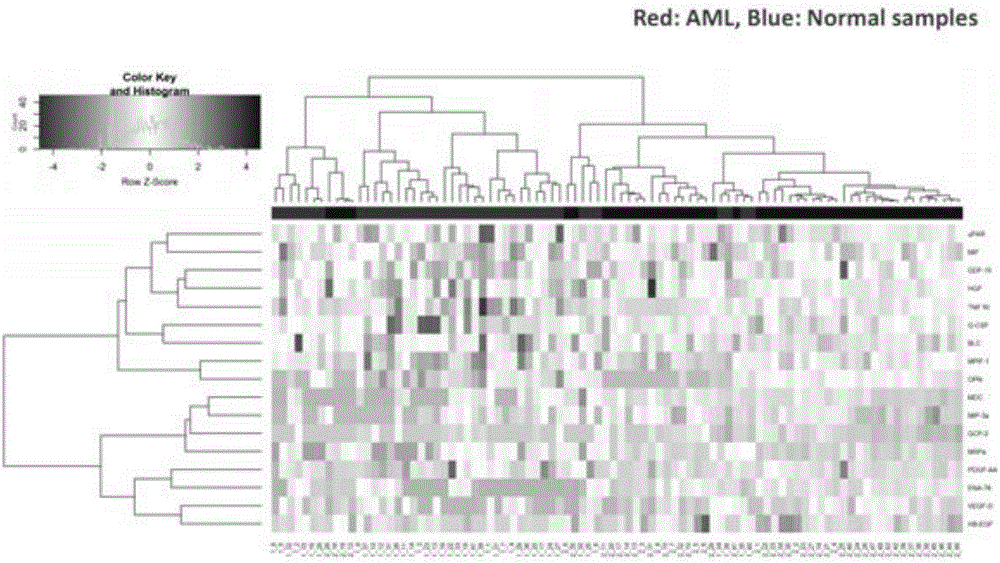
的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。实施例1白血病标志物联检抗体芯片试剂盒的制备1、白血病标志物及其特异性抗体:制备固定有针对重组人上皮粒细胞激活蛋白78(ena-78),中性粒细胞趋化蛋白-2(gcp-2、),巨噬细胞来源趋化因子(mdc),巨噬细胞迁移抑制因子(mif),巨噬细胞炎性蛋白-3a(mip-3a),髓祖细胞抑制因子-1(mpif-1),巨噬细胞刺激蛋白a(mspa),骨桥蛋白(opn),生长分化因子15(gdf-15),肝素结合性表皮生长因子(hb-egf),人类生长因子(hgf),重组人血小板衍生生长因子-aa(pdgf-aa),血管内皮生长因子d(vegf-d),b淋巴细胞趋化因子(blc),粒细胞集落刺激因子(g-csf),肿瘤坏死因子r1(tnf-rⅰ),尿激酶型纤溶酶原激活物受体(upar)的白血病标志物的特异性抗体的芯片,抗体的来源、浓度如表1所示。表1如上表所示,固定在载体玻片上的生物标志物特异性抗体的用途为,捕获生物样品中的生物标志物,因此称为“捕获抗体”。2、白血病标志物联检抗体芯片的制备与保存将上述生物标志物特异性抗体的tris缓冲液(含有0.01-10g/100ml牛白蛋白)用全自动点样仪点样于玻片上,以生物素标记的白蛋白作为阳性对照。在本实施例中芯片点阵采用的排布方式,每张玻片上有2-16个相同的芯片点阵,每个芯片点阵中,包括有上述每种抗体及阳性对照各4次重复,芯片点阵排布方式示意图如图1所示。事实上,在其他实施例中,阳性对照还可以采用生物素标记的igg;用于点样的芯片点阵还可以以其他方式的排布方式进行组合,并不局限于本实施例的形式。将点样好的玻片放于真空干燥后,于2℃到8℃保存备用。3、白血病标志物联检抗体芯片试剂盒的制备:本实施例中白血病标志物联检抗体芯片试剂盒包括:(1)上述制备得到的白血病标志物联检抗体芯片;(2)生物素标记的白血病标志物检测抗体混合物;(3)cy3标记的链霉素亲和素。其中,生物素标记的白血病标志物检测抗体混合物中包括来源、浓度如表2所示抗体:抗体名称批号厂家浓度ena-78抗体mab645rd2~500μg/mlgcp-2抗体af333rd2~500μg/mlmdc抗体mab336rd2~500μg/mlmif抗体mab289rd2~500μg/mlmip-3a抗体af360rd2~500μg/mlmpif-1抗体af371rd2~500μg/mlmspa抗体af691rd2~500μg/mlopn抗体af1433rd2~500μg/mlgdf-15抗体af957rd2~500μg/mlhb-egf抗体af8239rd2~500μg/mlhgf抗体af294nard2~500μg/mlpdgf-aa抗体mab1055rd2~500μg/mlvegf-d抗体mab286rd2~500μg/mlblc抗体mab801rd2~500μg/mlg-csf抗体mab214rrd2~500μg/mltnf-rⅰ抗体mab225rd2~500μg/mlupar抗体af534rd2~500μg/ml表2将上述各个生物素标记的白血病生物标志物的特异性抗体,按上表所示浓度,配制生物素标记的白血病生物标志物特异性抗体混合物溶液,于-20℃保存。4、白血病标志物联检抗体芯片试剂盒中的其他试剂:(1)白血病标志物标准品;(2)样品稀释液:用pbs溶液配制10%bsa溶液,将10%bsa溶液与casein以体积比1:1混匀,即得;(3)洗液ⅰ:取1l的20×洗涤液ⅱ与20mltween混匀。使用时,将20×洗涤液ⅰ倍比稀释得1×洗涤液ⅰ即可;(4)洗液ⅱ:20×洗涤液ⅱ,即20×tbs溶液:2mph=7.5的tris缓冲液800ml与5mnacl4800ml混匀后,纯化水加至8升。使用时,将20×洗涤液ⅱ倍比稀释得1×洗涤液ⅱ即可。其中,白血病标志物标准品,名称、来源如表3所示。表3将上述各个白血病生物标志物标准品,按上表所示浓度,配制白血病生物标志物标准品混合物溶液,冷冻干燥后,于-80℃保存。可以理解的,在其他实施例中,白血病标志物联检抗体芯片试剂盒可以不包括白血病标志物标准品混合物:若包括白血病标志物标准品混合物,可以定量检测生物样本中的白血病标志物;若不包括白血病标志物标准品混合物,该标准品可由其他途径获得,或本发明所述试剂盒仍可用于定性检测。同样地,样品稀释液、洗液ⅰ、洗液ⅱ可采用其它途径购买或制备得到,为本发明所述试剂盒中的非必要组成。在其他实施例中,试剂盒中的检测抗体可以选用不同标记的检测抗体,并采用相应地不同的检测方法,并不局限于本实施例所述方案。实施例2白血病标志物联检抗体芯片试剂盒本实施例所述白血病标志物联检抗体芯片试剂盒中的白血病标志物联检抗体芯片除实施例1所述抗体外,还固定有针对肿瘤坏死因子(tnfa),fas受体(fasl),白介素4(il-4),细胞间黏附分子1(icam-1),白介素5(il-5),生长调节致癌基因1(kc),基质金属蛋白酶抑制剂1(timp-1),人胸腺活化调节趋化因子(tarc),白介素2(il-2),白介素7(il-7),巨噬细胞集落刺激因子(m-csf),白介素10(il-10),白介素21(il-21),白介素12(il-12p70),脑源性神经营养因子(bdnf),血小板因子4(pf-4),表皮生长因子(egf),肿瘤坏死受体ii(tnf-rⅱ),肿瘤坏死因子超家族14(light)等白血病生物标志物的共36种特异性抗体;相应地,白血病标志物标准品混合物、检测抗体包括有共36种生物标志物对应的标准品、及36种生物标志物带标记的检测抗体。实施例4定量检测白血病标志物的实验1、玻片抗体芯片的完全干燥将实施例1所述的玻片抗体芯片从盒子中取出来,在室温平衡20-30min后,将包装袋打开,揭开密封条,然后将芯片放在真空干燥器或者室温干燥1-2小时。2、白血病标志物标准品混合物的梯度稀释:2.1、添加500μl的实施例1所述样品稀释液到白血病标志物标准混合物的小管中,重新溶解标准品。打开小管前,先快速的离心,轻轻的上下抽打溶解粉末,标记这个小管为std1。2.2、分别标记6个干净的离心管为std2、std3到std7,添加200μl的样品稀释液到每个小管中。2.3、抽取100μl的std1加入到std2中轻轻混合,然后从std2中抽取100μl加入到std3中,如此梯度稀释至std7。2.4、抽取100μl的样品稀释液到另一个新的离心管中,标记为cntrl,作为空白对照。注:因为每种肿瘤标志物的起始浓度是不同的,所以std1到std7的梯度稀释后,每个肿瘤标志物的系列浓度是不同的,本实施例中,梯度重组蛋白稀释液的浓度如表4所示。白血病标志物蛋白标准品经梯度稀释后,用于后续实验中作标准曲线。表43、芯片操作流程下述实验中,取静脉采血后自然析出的血清作为样品,使用前用样品用稀释液1:1稀释。其中,样品1为正常人血清样本,样品2为白血病人血清样本。3.1、每个孔中加100μl的样品稀释液,室温摇床上孵育30分钟,封闭定量抗体芯片。3.2、抽去每个孔中的缓冲液,添加100μl的经梯度稀释后的系列浓度的标准品溶液和样品1、样品2到孔中,在摇床上4℃过夜孵育。3.3、清洗抽去每个孔中的标准品或样品,1×洗液i清洗5次,每次5min室温摇床震荡,每孔150μl的1×洗液i,每次清洗要抽干净洗液,用去离子水稀释20×洗液i。抽去每个孔中的1×洗液i,加入1×洗液ii清洗2次,每次5min室温摇床震荡,每孔150μl的1×洗液ii,每次清洗要抽干净洗液,用去离子水稀释20×洗液ii。3.4检测抗体混合物的孵育离心检测抗体混合物小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。添加80μl的检测抗体到每个孔中,室温摇床上孵育2小时。3.5清洗抽去每个孔中的检测抗体,1×洗液i清洗5次,每次5min室温摇床震荡,每孔150μl的1×洗液i,每次清洗要抽干净洗液,然后加入1×洗液ii清洗2次,每次5min室温摇床震荡,每孔150μl的1×洗液ii,每次清洗要抽干净洗液。3.6cy3-链霉亲和素的孵育离心cy3-链霉亲和素小管,然后加入1.4ml的样品稀释液,混合均匀后再次快速离心。添加80μl的cy3-链霉亲和素到每个孔中,用铝箔纸包住玻片避光孵育,室温摇床上孵育1个小时。3.7清洗抽去每个孔中的cy3-链霉亲和素,1×洗液i清洗5次,每次5min室温摇床震荡,每孔150μl的1×洗液i,每次清洗要抽干净洗液。3.8荧光检测1)将玻片框架拆掉,小心不要用手接触到玻片印制抗体的一面。2)将玻片放置在玻片清洗管中,添加约30ml的1×洗液i,能整个覆盖住玻片,在室温摇床上震荡15min,弃去1×洗液i,添加约30ml的1×洗液ii,在室温摇床上震荡5min。3)去除玻片的残留洗液。将玻片放置在玻片清洗管/干燥管中,不盖盖子,在1000rpm离心3min。4)采用激光扫描仪例如axongenepix扫描信号,采用cy3或者绿色通道(激发频率=532nm)。3.9芯片的数据提取以及用分析软件来进行数据分析。1)用genepix软件来读取生物芯片的荧光值。芯片的微阵列参数用6(行)x8(列),点的直径用120μm。2)读数后选用的数值为除掉地方背景的中间值读数(f532median-localbackground)。4.测定结果结果如表5所示荧光值空白std7std6std5std4std3std2std1ena-78703100012431935606293453327428876gcp-2973104911921474176436561406629515mdc571942128925858756300375427378655mif15441667207428287112164104125891523mip-3a43079921899249247106968152363269252300383mpif-116921904221426535650181003097848526mspa95424954414146563673870375104580114936opn5981738405089341620454982106340173664gdf-1532619924259135863685385566221447276009hb-egf13432014355583201769542830108369103763hgf4061312257373362312861934148969215995pdgf-aa3733294658120314365574873710436781863vegf-d510275549051785533525100364135769144324blc522409411449304405639391818242683114130g-csf7841210211044857396163543549622695tnf-ri8951355157324377752233674154662040upar5277921263330584983537659191115885阳性对照136335136927134598135100128994136566133047136508表5由上表数据,对浓度及信号强度分别作对数转换后,分别绘制各蛋白的标准曲线,计算得线性回归方程如表7所示。另样品1、样品2中测定得到的信号强度,及根据回归方程计算得到的生物标志物含量(pg/ml),如表6所示。其中x表示log(浓度),y表示log(信号强度)。表6实施例5白血病生物标志物的验证1、健康人-病人差异生物标记物首先通过挑选健康人及医院的白血病人作为研究对象,通过个体指标(如年龄、性别等)和临床指标(如白血病进展情况,有并发症,有无其他肿瘤)的综合考察,选取健康组109例和白血病组106例,采集血清并使用可以检测与白血病相关的炎症因子,趋化因子,生长因子的蛋白芯片进行检测。2、数据处理和分析(1)采用蛋白芯片分析两组样本的160个蛋白质,得到的数据首先会通过内参来进行归一化处理,比较健康组与白血病组之间测得数据并计算p值,并用fdr错误控制法对p-value作多重假设检验校正,以fdr<0.05,差异倍数(foldchange)>2,认为该蛋白具有差异,标记为true,否则标记为false。并绘制蛋白差异火山图,如图2所示-1<x<1或y<1.3的区域中的蛋白没有差异,标记为false,其余蛋白具有差异,标记为true。本发明实施例3所述36个蛋白,均符合上述条件。因此,本发明所述的36个蛋白,作为白血病生物标志物,可较好区分健康人与白血病人。(2)使用本发明实施例3所述的抗体芯片,对上述健康组及白血病组样本针对上述36个蛋白表达量进行测定,并进行主成份分析,把17个指标转化为3个综合指标,取前2个指标作主成分分析图,横、纵坐标分别表示第一、第二主成分。结果如图3所示,说明本发明实施例1所述17个蛋白与白血病的相关性更为显著,可以很好的区分白血病组和健康组,可作为白血病诊断或预后鉴别的生物标志物。其中,上述步骤(1)中的蛋白芯片分别测得17个可作为生物标志物的蛋白在健康组(109个样本)和白血病组(106个样本)中表达量的平均值及标准差数据如表7所示,计算健康组17个蛋白表达量和白血病组17个蛋白表达量之间的p值,用fdr错误控制法对p-value作多重假设检验校正,得出fdr值。由表7的数据可知,fdr值均为0,因此这17个蛋白的表达量在健康者与白血病患者之间有显著差异,说明其可以很好地区分健康人与白血病患者。表7实施例6线性判别模型(lda)验证白血病生物标志物(1)实施例5中所述健康组109例和白血病组106例样本,分别绘制17个蛋白对应的受试者工作特征(receiveroperatingcharacteristic,roc)曲线,结果如图4所示。选取41例白血病组和49例健康组的数据作为训练集建立lda分类模型。所用软件为用源r语言软件,数据包为caret及mass。将训练集中的90个样本(41例白血病组和49例健康组)的17个蛋白浓度值输入软件,设定3-折交叉验证(3-foldcrossvalidation)并重复5遍,以网格搜索(gridsearch)自动选择最合适的模型参数。lda模型最终输出结果为每个样本均为概率值(范围0~1),通过约登指数(youdenindex)划定最佳的截断值(threshold)为0.75,即样本概率值>0.75的被判别为白血病患者,<0.75的为正常人。以临床诊断判别分类模型预测的真、假阳性及真、假阴性,该模型能很好地把健康人和白血病人区分开,训练集准确率达到0.9以上,模型敏感性和特异性分别为1.0、0.9512,分类效果很好。其结果如图5所示,其中图5a为训练lda模型根据敏感性与特异性绘制roc曲线,图5b为训练集lda模型分类结果的混淆矩阵。(2)另选取实施例1中其余68例白血病样本和57例健康样本的数据作为测试集,对上述lda分类模型进行测试,结果准确度为0.8,模型敏感性和特异性分别为0.95、0.76。其结果如图6所示,其中图6a为测试集根据敏感性与特异性绘制的roc曲线,图6b为测试集通过lda模型分类结果的混淆矩阵。(3)聚类热图结果也说明了这17个蛋白可以很好的把aml白血病患者和正常人区分开,如图7所示,而且这两群人的蛋白表达水平有明显差别:在aml白血病患者中表达水平较高的蛋白,在正常人中表达量比较低;反之,在aml病人中表达水平较低的蛋白,在正常人中表达量比较高。而且白血病患者和正常人分别被分到不同的两个层次(cluster)。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1