一种肠炎沙门氏菌检测方法、试纸条及应用与流程
本发明属生物检测领域,具体涉及一种肠炎沙门氏菌检测方法、试纸条及应用。
背景技术:
沙门氏菌是一类革兰氏阴性,大部分周生鞭毛,可以运动,无荚膜和芽孢,两端钝圆的短杆菌,最适生长温度为37℃,20℃以上可以正常繁殖。沙门氏菌感染是公共卫生学中具有重要意义的人畜共患病之一,夏秋季节的食物传播是主要感染途径,人体摄入之后一般在12-14h内出现腹泻、发热、头痛、腹痛、恶心及呕吐和畏寒等症状,还伴有乏力、肌肉酸痛等症状,严重的可以造成死亡。其中以鼠伤寒沙门氏菌、猪霍乱沙门氏菌和肠炎沙门氏菌最为常见。沙门氏菌是我国众多食品标准中的检测项目,且要求不得检出。快速、准确、灵敏、简便地检测出沙门氏菌,在医疗卫生、食品卫生、动物疫病监测等方面具有重要的意义。迄今为止,已经报道了检测沙门氏菌的几种可行方法,包括传统沙门氏菌检测方法,酶联免疫吸附测定,聚合酶链反应和电化学生物传感器。但是,这些方法不适合实时检测,因为它们需要依靠复杂而昂贵的仪器,复杂的样品预处理和操作,耗时费力。为了更早更灵敏地检测肠炎沙门氏菌,特别是对于定点护理应用,实现易于操作,快速,便携和低成本的方法仍然是巨大的技术挑战。
近年来,免疫层析试纸条,由于其制备和操作方便,成本低,一次性使用,检测时间短,结果直观可靠等优点,得到了广泛的关注,成为快速检测的成熟诊断工具。免疫层析试纸条是一类优异的生物传感器,在食源性致病菌检测领域得到广泛的应用。传统试纸条用胶体金作为探针,但是灵敏度低,这阻碍了其进一步的应用。为了满足需求,研究者从诸多方面致力于提高试纸条检测方法的灵敏度,例如通过使用不同的标签如荧光纳米微球,量子点,磁性微球,上转换纳米材料,石墨烯,复合材料等。虽然提高了灵敏度,但这些纳米材料的合成方法较复杂,合成条件较高。另外,在传统探针的构建过程中,会影响到抗体的活性,进而影响到免疫层析试纸条的广泛应用。因此,迫切需要不依赖于传统探针构建,稳定低成本的信号载体,以简化分析步骤,提高试纸条的实用性。
技术实现要素:
针对现有技术中的缺陷和不足,本发明提供了一种肠炎沙门氏菌检测方法、试纸条及应用,打破传统的沙门氏菌的夹心检测方法,只用一种抗体划在硝酸纤维素膜上直接进行检测,只需将细菌和表面正电的富氮碳纳米颗粒进行简单的孵育就可得到明亮的黑色条带,而不使用任何纳传统探针的构建。
为达到上述技术效果,本发明采取的技术方案为:
根据本发明的第一个目的,一种肠炎沙门氏菌的检测方法,包括将带正电的富氮碳纳米颗粒与待检测样品中的肠炎沙门氏菌进行孵育得到待检液,再通过肠炎沙门氏菌单克隆抗体捕获待检液中的与带正电的富氮碳纳米颗粒结合的肠炎沙门氏菌。
可选的,所述的带正电的富氮碳纳米颗粒采用氮化碳纳米颗粒在高温下碳化得到富氮碳纳米颗粒;再将得到的富氮碳纳米颗粒经过高温强酸刻蚀给富氮碳纳米颗粒表面带有正电荷即得。
可选的,高温下碳化的温度为700~900℃;高温强酸刻蚀的温度为90~120℃;所述的强酸选自浓盐酸、浓硝酸或浓硫酸。
可选的,(1)制备富氮碳纳米颗粒:包括将尿素在高温下煅烧得到氮化碳纳米颗粒,氮化碳纳米颗粒在高温下碳化得到富氮碳纳米颗粒;
(2)制备表面正电的富氮碳纳米颗粒溶液:包括将得到的富氮碳纳米颗粒经过高温强酸刻蚀给富氮碳纳米颗粒表面带有正电荷即得;
尿素的高温煅烧温度为500~600℃,高温下碳化的温度为700~900℃;高温强酸刻蚀的温度为90~120℃;所述的强酸选自浓盐酸、浓硝酸或浓硫酸。
可选的,所述的待检液中,带正电的富氮碳纳米颗粒的质量百分浓度为0.010%~0.060%,肠炎沙门氏菌单克隆抗体的用量为1~1.5mg/ml。
可选的,所述捕获的捕获时间为10~20分钟。
根据本发明的第二个目的,一种肠炎沙门氏菌的检测试纸条,该试纸条采用本发明所述的肠炎沙门氏菌的检测方法进行检测。
可选的,所述试纸条的检测线包被有肠炎沙门氏菌单克隆抗体,试纸条无质控线;
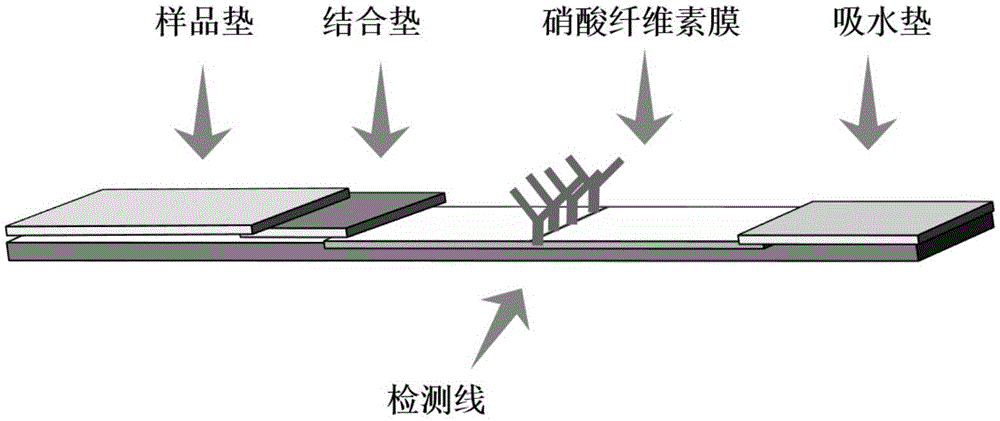
所述的试纸条包括衬板,衬板上贴有硝酸纤维素膜,硝酸纤维素膜的一端覆盖吸水垫,硝酸纤维素膜的另一端依次覆盖样品垫和结合垫,硝酸纤维素膜的非覆盖面上沿横向设置检测线;检测线包被有肠炎沙门氏菌单克隆抗体,结合垫及样品垫分别经封闭液封闭处理。
可选的,检测线包被有肠炎沙门氏菌单克隆抗体的制备方法包括:肠炎沙门氏菌单克隆抗体溶于包被液配制成1mg/ml的抗体包被溶液,将抗体包被溶液以1μl/cm的速度包被于距硝酸纤维素膜的检测线上;
所述的包被液为:0.02g叠氮化钠、0.8g氯化钠、0.29g十二水磷酸氢二钠、0.02g氯化钾和磷酸二氢钾0.02g加水定容至100ml即得。
本发明所述的肠炎沙门氏菌的检测方法或本发明所述的肠炎沙门氏菌的检测试纸条用于检测饮用水中肠炎沙门氏菌的应用。
由于采用上述技术方案,具有以下有益效果:
(1)免标记。只需将细菌和表面正电的富氮碳纳米颗粒进行简单的孵育就可得到明亮的黑色条带,免去了复杂的标记过程。
(2)打破传统的夹心检测方法。该发明只用一种抗体划在硝酸纤维素膜上直接进行检测,打破了传统同时采用两种抗体的夹心检测方法,大大节省了成本,解决了配对抗体的困难,更简单,方便,新颖。
(3)灵敏度高。本发明提供的试纸条对肠炎沙门氏菌的最低检测限为102cfu·ml-1,其值低于很多其他文献报道的。
(4)特异性高。该发明用细菌鞭毛蛋白免疫制备出的单克隆抗体,只能高度特异性识别肠炎沙门氏菌,对其他沙门类和非沙门类的细菌都无特异性。
(5)良好的实际应用。本发明可以检测饮用水中的肠炎沙门氏菌,且灵敏度与标准菌株浓度一样,可以达到102cfu·ml-1,具有很好的应用前景,可以作为通用检测方法检测所有的病原菌。
本制备方法与传统的方法相比,不需要任何复杂的材料标记抗体的探针;只用一种抗体,解决了两个配对抗体的困难;大大简化了制备过程,结构简单,无需在结合垫上提前加载探针,只有检测线,没有质控线。这种方法新颖,简单,快捷,成本低,制作周期短,整个过程在15分钟内完成,且能用于实际样品饮用水的检测,通过一种抗体及简单的孵育就可作为通用的检测病原菌的方法,适合现场检测。
附图说明
图1为本发明的快速检测肠炎沙门氏菌的免疫层析试纸条的试纸条组装示意图;
图2为本发明的快速检测肠炎沙门氏菌的免疫层析的原理流程图;
图3为实施例3的结果图;
图4为实施例4的结果图;
图5为实施例5的结果图;
图6为实施例6的结果图;
以下结合说明书附图和具体实施方式对本发明做具体说明。
具体实施方式
本发明的工作原理为:基于静电吸附原理,表面正电的富氮碳纳米颗粒富集在了沙门菌表面,将孵育后的菌悬液滴加到试纸条上,然后由于毛细管作用,孵育后的细菌沿着硝酸纤维素膜迁移,基于抗原抗体特异性结合原理,被t线的抗体捕获,使t线显示可见的强烈的黑色条带。通过该过程,肠炎沙门氏菌能够通过t线上的捕获抗体有效捕获,其打破了传统同时采用测试抗体和捕获抗体的夹心试纸条的形式,只使用一种抗体,大大降低了成本并实现高度灵敏的检测。此外,这种简便的传感器大大简化了免疫测定相关分析试剂的早期制备过程,如传统探针的制备过程。该设备具有很高的灵敏度和很强的特异性,结构简单,成本效益高,不需要设备,快速的分析时间和便携性,具有极大的应用潜力来满足poc诊断测定的要求。该方法已成功应用于饮用水中沙门氏菌的检测,验证了其实用性和适用性。因此只需一种抗体,该方法就可以作为通用检测平台去检测所有病原菌。
表面正电的富氮碳纳米颗粒可以是现有的方法制备,比如可以是直接购买富氮碳纳米颗粒,然后对颗粒进行带电荷处理;或者,为了采用廉价的原料,将尿素在空气中煅烧得到氮化碳纳米颗粒,将氮化碳纳米颗粒进一步高温煅烧得到富氮碳纳米颗粒。再将富氮碳纳米颗粒经过高温浓酸刻蚀得到表面正电的富氮碳纳米颗粒。
肠炎沙门氏菌单克隆抗体可以是现有的方法制备得到或者市场上能买到的单克隆抗体,最好是按照zhangdaohong等人在刊物《analyticalchimicaacta》第635卷第63-69页题目为“productionofultrasensitivegenericmonoclonalantibodiesagainstmajoraflatoxinsusingamodifiedtwo-stepscreeningprocedure”一文中记载的方法制备得到的:将肠炎沙门氏菌免疫小鼠以诱导抗沙门氏菌的抗血清产生,然后取小鼠的脾细胞与sp2/0骨髓瘤细胞进行半固体细胞融合,再通过间接elisa和夹心elisa筛选能够产生目的抗体的杂交瘤细胞,得到5株高灵敏度特异性的肠炎沙门氏菌单克隆抗体,且其中两株抗体能配对形成夹心。再将效价最好杂交瘤细胞注射入小鼠腹腔,大量产生抗体,采用辛酸硫酸铵法纯化抗体。
结合图2,基于静电吸附,表面正电的富氮碳纳米颗粒可以吸附在肠炎沙门氏菌的表面,然后由于毛细管作用,吸附纳米材料的细菌沿着硝酸纤维素膜迁移,基于抗原抗体特异性结合原理,被t线的抗体捕获,使t线显示可见的强烈的黑色条带。只需将细菌和纳米材料进行简单的孵育就可得到明亮的黑色条带,而不使用任何纳米材料标记抗体,免去了复杂的标记过程。
实施例1:肠炎沙门氏菌通用单克隆抗体的制备方法
肠炎沙门氏菌通用单克隆抗体的制备方法,包括以下步骤:
1)动物免疫
购买6周龄balb/c小鼠,用杨保伟实验室提供的本实验室保存的肠炎沙门氏菌,提取鞭毛蛋白进行免疫。第一次免疫用0.8mg/ml的肠炎沙门氏菌鞭毛蛋白与等量福氏完全佐剂混合乳化,小鼠腹腔注射乳化后的抗原。于4周后进行第二次免疫,采用0.8mg/ml的肠炎沙门氏菌鞭毛蛋白与等量福氏不完全佐剂混合乳化,小鼠腹腔注射乳化后的抗原。于4周后进行第三次免疫,免疫方式与第二次相同。再于三周后进行第四次免疫,免疫方式同样与第二次相同。4次免疫剂量相同,均为每鼠100μg肠炎沙门氏菌。这4次免疫后一周,尾静脉采血,分离血清,采用间接elisa法监测小鼠血清效价。选择效价相对较高的血清对应的小鼠再进行最后一次加强免疫,免疫剂量为之前的2倍,免疫方式为腹腔注射。
所述的0.8mg/ml的肠炎沙门氏菌鞭毛蛋白溶液为将提取的鞭毛蛋白0.8mg溶于0.01mol/l磷酸缓冲盐溶液,磷酸缓冲盐溶液为0.02g叠氮化钠、0.8g氯化钠、0.29g十二水磷酸氢二钠、0.02g氯化钾和磷酸二氢钾0.02g加水定容至100ml即得。
2)细胞融合
对经过加强免疫后的小鼠,于加强免疫3天后,采用50%聚乙二醇(分子量为1450)作融合剂,按常规方法进行细胞融合。具体方法:
(1)取1~2×107个sp2/0骨髓瘤细胞与免疫脾细胞混合,800rpm离心7min,洗细胞两次;
(2)于超净工作台内取出灭菌的吸水纸,将装有骨髓瘤细胞与免疫脾细胞混合细胞的50ml离心管上清倒尽后,倒扣在吸水纸上去除明显水滴;
(3)从co2培养箱中取出温育至37℃的50%peg,用1ml的吸管吸取0.8ml,手持装有混合细胞的50ml离心管,置于37℃水浴中,将peg缓缓加到混合细胞上,边加边轻轻搅拌,持续90s加完,静置1min,挪走水浴锅,取出温育至37℃的50mlrpmi-1640基础培养液,用吸管吸取10ml缓缓加到融合细胞上,边加边轻轻搅拌,使细胞团块分散,先加1ml,再加2ml,再加3ml,最后加完剩下的4ml,加完第一个10ml后,接着沿管壁加完剩下的40ml,加完后,拧紧盖,轻轻颠倒几次,使细胞混匀;
(4)800rpm离心7min,弃上清,用重悬有饲养细胞的20mlhat完全培养液将融合细胞重悬;
(5)将重悬起来的细胞加入到80ml已温育至37℃的半固体培养基中,轻轻摇晃使细胞混合均匀,之后用20ml注射器将悬有融合细胞的半固体培养基吸起,均匀分配到8~9个六孔细胞培养板中,1.5~2ml/孔,置37℃co2培养箱培养;
(6)融合后2~3周左右进行观察,可以看到半固体培养基上出现白色细胞集落,用无菌枪头逐个吸取单集落并转移至96孔培养板中,每孔一个克隆。用ht液体培养基继续培养。当克隆长满孔底1/2~2/3时,培养液变黄,即可进行杂交瘤细胞的筛选。
3)细胞株的筛选
先采用间接elisa法筛选出抗肠炎沙门氏菌的阳性孔;再采用夹心elisa法对筛选出的阳性孔进行配对检测,用肠炎沙门氏菌作为抗原,选择吸光值和灵敏度均较高的孔。获得能配对的单克隆细胞株。
4)单克隆抗体的纯化
在筛选到的细胞株中2b4细胞株产生的抗体对肠炎沙门氏菌具有最好的灵敏度,所以选择2b4细胞株注射预先用福氏不完全佐剂处理过的balb/c小鼠,收集该小鼠的腹水,采用辛酸-硫酸铵法纯化抗体,具体操作为:腹水用双层滤纸过滤,4℃,12000r/min离心15min,吸取上清。所得腹水上清与2倍体积的醋酸盐缓冲液混合,搅拌下缓慢加入正辛酸33μl/ml腹水,室温混合30min,4℃静置2h。4℃,12000r/min离心30min,弃沉淀。上清用0.22μm滤膜过滤后,加入1/10滤液体积的0.1mol/lph值7.4的磷酸盐缓冲液,用2mol/l氢氧化钠溶液调混合液ph值至7.4。上清4℃预冷,缓慢加入等体积的饱和硫酸铵溶液,4℃静置2h。4℃,12000r/min离心30min,弃上清。所得沉淀用1/10原腹水体积的0.02mol/l磷酸盐缓冲液重悬,装入透析袋,先用0.01mol/l磷酸盐缓冲液透析6-8h,再用纯水透析。透析完后取出液体4℃,12000r/min离心30min,弃沉淀。将充分透析好的蛋白溶液置-80℃冰箱冷冻,之后用冷冻干燥机冻干,收集冻干粉,即得纯化好的肠炎沙门氏菌单克隆抗体,将抗体置-20℃冰箱中备用。
所述的醋酸盐缓冲液为0.29g醋酸钠,0.141ml醋酸加水定容至100ml所得。
所述的0.01mol/l的磷酸盐缓冲液为0.8g氯化钠,0.29g十二水磷酸氢二钠,0.02g氯化钾,磷酸二氢钾0.02g加水定容至100ml所得。所述的用2mol/l氢氧化钠溶液为80g氢氧化钠加水定容至1000ml所得。
实施例2:表面正电的富氮碳纳米颗粒的制备方法
表面正电的富氮碳纳米颗粒的制备方法,包括以下步骤:
1)富氮碳纳米颗粒的制备
将尿素放入带盖的坩埚中,在空气中加热4小时至550℃并在该温度下再保持4小时。形成的黄色固体是氮化碳(g-c3n4),然后将其研磨成粉末以供进一步使用。通过将1,4-苯二甲酸和三乙酸二胺溶解在n,n-二甲基甲酰胺(dmf)中来制备均相前体溶液。然后在磁力搅拌下将氮化碳粉末加入到混匀的前体溶液中。除去溶剂后,将固体粉末转移到管式炉中,在氩气下慢速加热至800℃,并在该温度下保持1小时。所获得的黑色固体粉末是富氮碳纳米颗粒。
2)表面正电的富氮碳纳米颗粒的制备
将制备得到的富氮碳纳米颗粒进一步经过高温浓酸刻蚀处理得到表面正电的富氮碳纳米颗粒:将富氮碳纳米颗粒粉末放入100ml浓硝酸中并在125℃下回流24小时。在自然冷却至室温后,将回流的产物离心并用超纯水洗涤直至其ph达到7.0。将最终产物在35℃下真空干燥12小时,以获得表面正电的富氮碳纳米颗粒
下述实施例3-6使用的肠炎沙门氏菌通用单克隆抗体为实施例1制备得到的,使用的表面正电的富氮碳纳米颗粒为实施例2制备得到的。
实施例3:快速检测肠炎沙门氏菌的试纸条的各条件优化
1)硝酸纤维素膜的制备(结合图1和图2)
检测线的包被:将肠炎沙门氏菌单克隆抗体溶于包被液配制成1mg/ml的溶液;用划线方式将包被液以1μl/cm的速度横向包被于距硝酸纤维素膜上沿30mm的位置(即检测线上),然后于37℃条件下干燥30分钟。所述的包被液为:0.02g叠氮化钠,0.8g氯化钠,0.29g十二水磷酸氢二钠,0.02g氯化钾,磷酸二氢钾0.02g加水定容至100ml所得。
2)样品垫的制备:将玻璃纤维膜剪裁成长15mm宽3mm的规格,放入封闭液中浸湿,于37℃条件下干燥10-16小时,得样品垫,然后置干燥器中室温保存。所述的封闭液为2g牛血清白蛋白,0.02g叠氮化钠,0.8g氯化钠,0.29g十二水磷酸氢二钠,0.02g氯化钾,磷酸二氢钾0.02g加水定容至100ml所得。
3)结合垫的制备:将玻璃纤维膜剪裁成长8mm宽3mm的规格,放入封闭液中浸湿,取出,于37℃条件下干燥10-16小时,置干燥器中室温保存。
4)吸水垫的制备
将吸水纸剪裁成长18mm宽3mm的规格,即得吸水垫。
5)所述的微生物培养为:肠炎沙门氏菌活化后分别接种于lb培养基,静置37℃培养24小时;挑取单菌落接种于250mllb肉汤培养基中,150r/min摇床37℃培养24小时;将菌液以4000r/min离心15min,收集菌体;分别用ph7.4浓度为0.01mol/l的磷酸盐缓冲溶液洗涤菌体3次,以10ml0.01mol/l的磷酸盐缓冲溶液重悬;加0.5%福尔马林溶液,室温下放置24小时灭活;灭活结束后,分别用0.01mol/l的磷酸盐缓冲溶液洗涤3次后,用0.01mol/l的pbs调节成合适浓度,调整抗原浓度为108cfu·ml-1,于-20℃保存备用。
6)试纸条的组装:首先将硝酸纤维素膜贴附于衬板上,然后样品垫压结合垫1-3mm,结合垫压硝酸纤维素膜1-3mm,吸水垫压硝酸纤维素膜1-3mm依次贴附于衬板上,即得快速检测肠炎沙门氏菌的免疫层析试纸条。
7)纳米材料与细菌溶液孵育的时间的优化
孵育的时间也可能影响检测线上的信号强度。将表面正电的氮化碳纳米颗粒溶液和细菌混合物孵育不同时间,时间范围为0至25分钟。
8)表面正电的富氮碳纳米颗粒溶液浓度的优化
表面正电的富氮碳纳米颗粒的浓度对细菌的着色效果有显着影响。在固定细菌浓度107cfu·ml-1的下,研究了不同材料浓度分别为0.015%-0.055%。
9)菌悬液ph的优化
影响检测线强度的另一个重要参数是菌悬液ph。在固定细菌浓度107cfu·ml-1及材料浓度是0.035%下,研究了不同菌悬液ph分别为3-10。
结果:见图3a,随着培养时间的增加,t线上的颜色强度逐渐加深,直到达到5分钟,然后保持在几乎恒定的水平。因此,孵育时间的最佳时间为5分钟。
见图3b,随着表面正电的富氮碳纳米颗粒溶液浓度的增加,t线上的颜色强度逐渐加深,最大值达到0.035%。因此,最佳的表面正电的富氮碳纳米颗粒溶液浓度为0.035%。
见图3c,当细菌悬浮液的ph值为6.0时,t线的强度达到最大值。此外,高酸性或碱性环境会影响固定化蛋白质(检测抗体)的活性,因此ph6.0的弱酸性环境作为最佳条件
实施例4:快速检测肠炎沙门氏菌的试纸条的灵敏度测定
试纸条制备及细菌培养过程步骤与实施例2中的1)-6)相同。
7)检测过程:将表面正电的富氮碳纳米颗粒分散于水配成浓度为0.035%的溶液,再将菌液用0.01m磷酸盐缓冲液稀释成101-108cfu·ml-1的浓度,保证菌悬液ph6.0。各浓度分别取100μl溶液作为检测液,与100μl面正电的富氮碳纳米颗粒混合孵育5分钟,再逐滴加入试纸条的样品垫,同时取100μl0.01m磷酸盐缓冲液作为阴性对照液,操作与上述相同,逐滴加入另一试纸条的样品垫,15分钟后读取结果。
检测结果:(1)阳性:当检测试纸条的检测线显示出黑色线条时,判为阳性,表明待测样品中的肠炎沙门氏菌的浓度高于或等于102cfu·ml-1。(2)阴性:当检测试纸条的检测线不显示颜色时,判为阴性结果,表明待测样品中的肠炎沙门氏菌低于102cfu·ml-1。
见图4,随着肠炎沙门氏菌浓度的降低,试纸条t线的黑色条带越来越浅,肉眼可见的浓度为102cfu·ml-1,因此,本发明可以检测到肠炎沙门氏菌最低浓度为102cfu·ml-1。该方法能高灵敏度检测肠炎沙门氏菌,且可作为通用方法只需一种抗体就可检测,快速便捷。
实施例5:快速检测肠炎沙门氏菌的试纸条的特异性测定
试纸条制备及细菌培养过程步骤与实施例2中的1)-6)相同。
7)检测过程:将表面正电的富氮碳纳米颗粒分散于水配成浓度为0.035%的溶液,,分别将哈达尔沙门氏菌,伦敦沙门氏菌,鼠伤寒沙门氏菌,乙型沙门氏菌,大肠杆菌,金黄色葡萄球菌,李斯特菌,弯曲杆菌,阪崎肠杆菌,白色念珠菌的菌液用0.01m磷酸盐缓冲液稀释成108cfu·ml-1的浓度,肠炎沙门菌的菌液用0.01m盐酸盐缓冲液稀释成107cfu·ml-1的溶度,空白对照待测液用0.01m盐酸盐缓冲液。各浓度分别取100μl溶液作为检测液,与100μl表面正电的富氮碳纳米颗粒溶液混合孵育5分钟,再逐滴加入试纸条的样品垫,同时取100μl0.01m磷酸盐缓冲液作为阴性对照液,操作与上述相同,逐滴加入另一试纸条的样品垫,15分钟后读取结果。
检测结果:(1)阳性:当检测试纸条的检测线显示出黑色线条时,判为阳性。(2)阴性:当检测试纸条的检测线不显示颜色时,判为阴性结果。
见图5,数字1-11分别表示不同的菌种,依次为肠炎沙门氏菌,伦敦沙门氏菌,鼠伤寒沙门氏菌,乙型沙门氏菌,哈达尔沙门氏菌,金黄色葡萄球菌,大肠杆菌,李斯特菌,弯曲杆菌,白色念珠菌,阪崎肠杆菌;数字12表示空白对照。除了检测肠炎沙门氏菌的试纸条t线有肉眼可见的明亮的黑色外,检测其他细菌的试纸条t线都没有颜色,说明该发明能高度特异性识别肠炎沙门氏菌,有特别高的特异性。
实施例6:快速检测肠炎沙门氏菌的试纸条的应用
试纸条制备及细菌培养过程步骤与实施例2中的1)-6)相同。
7)检测过程:将表面正电的富氮碳纳米颗粒分散于水配成浓度为0.035%的溶液,将已知浓度的菌液加入到饮用水中形成101-107cfu·ml-1的浓度,各浓度分别取100μl溶液作为检测液,与100μl表面正电的富氮碳纳米颗粒溶液混合孵育5分钟,再逐滴加入试纸条的样品垫,同时取100μl饮用水作为阴性对照液,操作与上述相同,逐滴加入另一试纸条的样品垫,15分钟后读取结果。
检测结果:(1)阳性:当检测试纸条的检测线显示出黑色线条时,判为阳性,表明待测样品中的肠炎沙门氏菌的浓度高于或等于102cfu·ml-1。(2)阴性:当检测试纸条的检测线不显示颜色时,判为阴性结果,表明待测样品中的肠炎沙门氏菌低于102cfu·ml-1。
见图6,随着菌浓度降低,试纸条上黑色条带越来越浅,有眼可见的浓度可达到102cfu·ml-1,因此,本发明能检测饮用水中的肠炎沙门氏菌最低浓度到102cfu·ml-1,反映了其良好的实际应用价值。
- 还没有人留言评论。精彩留言会获得点赞!