一种检测饮用水中硝基呋喃类抗生素或喹诺酮类抗生素的方法与流程
本发明涉及检测饮用水中抗生素的方法。
背景技术:
镧系金属-有机骨架(ln-mofs)是由多齿键和稀土离子的无机节点通过配位键自组装而成的具有特征发光性能的晶体状有机/无机杂化材料。在ln-mofs中,通过调节配体向镧系离子的能量传递(天线效应),可以很容易地获得多发射特性,从而为ln-mofs的发光颜色和强度方面提供了一个敏感的平台。另一方面,配位环境的敏感性又导致了ln-mofs发光的不稳定性。利用其不稳定性,ln-mofs可作为温度、ph值、溶剂效应等环境因素的传感器,这种传感器已被广泛报道,并被用作灵敏温度计、ph指示器和溶剂探针。然而,对激发波长依赖性的不稳定性很少得到解决和利用。
多孔性是ln-mofs的一个决定性特征,有助于包封好的荧光团,特别是具有激发波长无关性能的荧光染料分子,从而通过离子交换过程和/或空间限制效应构建基态原子。通过将荧光染料引入多孔ln-mofs中,双均匀多发射染料@ln-mof复合材料,这不仅为设计与激发波长无关的发光材料提供了一条新的途径,而且为通过光子诱导的电子转移和荧光共振能量传递获得耐久而灵敏的传感器提供了机会。对多发射传感器各组成部分的不同分析物的扰动可能会改变元件的发光颜色和发射强度比,从而提供一个容易方便地区分序列组合中的组分的有效平台。通过同时考虑发光-变色和打开/关闭过程,可以很容易地实现多选择发光传感。但基于ln-mofs的不受激发波长的影响的多选择性材料或复合材料很少被报道,同时,对传感机制的系统分析对该类传感器的发展仍然是一个很大的挑战。
此外,抗生素是预防和治疗某些疾病的重要药物,特别是对水环境中细菌感染的抗药性。然而,由于抗生素的广泛应用,在粮食、动物体甚至饮用水中出现了更多的抗生素残留。长期摄入这些受污染的食物可能导致严重疾病,如免疫力下降、过敏反应,遗传性遗传缺陷和各种类型的癌症。目前,已经开发了各种昂贵和复杂的方法来测定抗生素,如色谱技术、光学传感器、电化学传感器和生物传感器。尽管这些技术在灵敏度和选择性方面有很大的优势,但这些技术必然需要专业仪器,前处理繁琐,操作成本高。因此,作为发光传感器,染料@ln-mof可以提供一种简便、灵敏度高的抗生素检测方法。另外,在现实世界里,抗生素的混合物经常存在。因此,水溶液中抗生素的多选择性发光传感具有重要的意义和挑战性。
技术实现要素:
本发明为了解决现有镧系金属-有机骨架存在对激发波长依赖性的不稳定,且现有测定抗生素的方法存在需要专业仪器,前处理繁琐,操作成本高的问题,提供了一种检测饮用水中硝基呋喃类抗生素或喹诺酮类抗生素的方法。
一种检测饮用水中硝基呋喃类抗生素或喹诺酮类抗生素的方法按照以下步骤进行:
一、制备tb-dcpcpt晶体:
①、将tb(no3)3·6h2o、3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑、n,n’-二甲基甲酰胺和h2o混合,得到混合物,将混合物置于高温反应釜中,在温度为150℃~200℃的条件下,密封24h~72h进行溶剂热反应,得到晶体样品;
所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑与tb(no3)3·6h2o的摩尔比为1:(0.5~2);所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑的摩尔与n,n’-二甲基甲酰胺的体积比为0.1mmol:(5~10)ml;所述的n,n’-二甲基甲酰胺与h2o的体积比为1:(0.1~2);
②、将晶体样品用n,n’-二甲基甲酰胺和乙醇分别洗涤3次~5次,得到tb-dcpcpt晶体;
二、制备rhb@tb-dcpcpt复合材料:
将tb-dcpcpt晶体浸渍于浓度为10-4mol/l~10-5mol/l的罗丹明b水溶液中,保持12h~48h,得到粉红晶体,将粉红晶体用去离子水冲洗,并在空气中干燥,得到rhb@tb-dcpcpt复合材料;
三、制备rhb@tb-dcpcpt分散液:
在搅拌条件下,将rhb@tb-dcpcpt复合材料分散于水中,得到rhb@tb-dcpcpt分散液;
所述的rhb@tb-dcpcpt分散液的浓度为0.1g/l~10g/l;
四、荧光检测:
将饮用水与rhb@tb-dcpcpt分散液混合,得到待检测饮用水,对待检测饮用水采用波长为300nm~390nm的紫外光照射,观察溶液颜色;
所述的饮用水与rhb@tb-dcpcpt分散液的体积比为1:(0.5~2);
所述的饮用水中含有硝基呋喃类抗生素或喹诺酮类抗生素;
当所述的饮用水中含有硝基呋喃类抗生素,且饮用水中硝基呋喃类抗生素的浓度高于0.502μmol/l时,溶液颜色由黄光发生荧光淬灭;
当所述的饮用水中含有喹诺酮类抗生素,且饮用水中喹诺酮类抗生素的浓度高于0.448μmol/l时,溶液颜色由黄色先变为白色,再变为蓝色。
本发明步骤一①中所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑,英文名称为3-(3,5-dicarboxylphenyl)-5-(4-carboxylphenyl)-1h-1,2,4-triazole,本发明中3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑简写为h3dcpcpt。
本发明步骤一②制备的tb-dcpcpt晶体的分子式为[(ch3)2nh2][tb3(dcpcpt)3(hcoo)]·dmf·15h2o,简写为tb-dcpcpt。
本发明的有益效果:
选择[(ch3)2nh2][tb3(dcpcpt)3(hcoo)]·dmf·15h2o(tb-dcpcpt)的阴离子骨架和罗丹明b阳离子染料(rhb)制备了rhb@tb-dcpcpt复合材料。该复合材料具有tb-dcpcpt和rhb的共同发光,在300nm~390nm的激发下产生持久的黄光发射。对14种抗生素进行了发光检测,无论是对硝基呋喃类抗生素的发光强度,还是对喹诺酮类抗生素的发光颜色,都显示出良好的鉴别能力。该传感行为具有良好的灵敏度、选择性和可回收性,其受到激发波长的影响很小。
通过离子交换将阳离子rhb固定在阴离子ln-mof通道中,成功地合成了一种与激发波长无关的黄色发光复合材料。该复合材料对硝基呋喃类抗生素(nzf和nft)具有较高的灵敏度和选择性检测能力。此外,对喹诺酮类抗生素(cpfx和nfx),rhb@tb-dcpcpt也显示出从黄色到白色到蓝色的明显的发光-颜色变化过程。激发波长对传感行为的影响很小。该复合材料检测限低(对nzf和nft的检测限分别为0.502μmol/l和0.448μmol/l,对cpfx和nfx的检测限分别为2.16μmol/l和0.63μmol/l),稳定性好,选择性好,可回收利用,是一种很有前途的呋喃类和喹诺酮类抗生素传感器,在水质监测方面具有潜在的实用价值。
附图说明
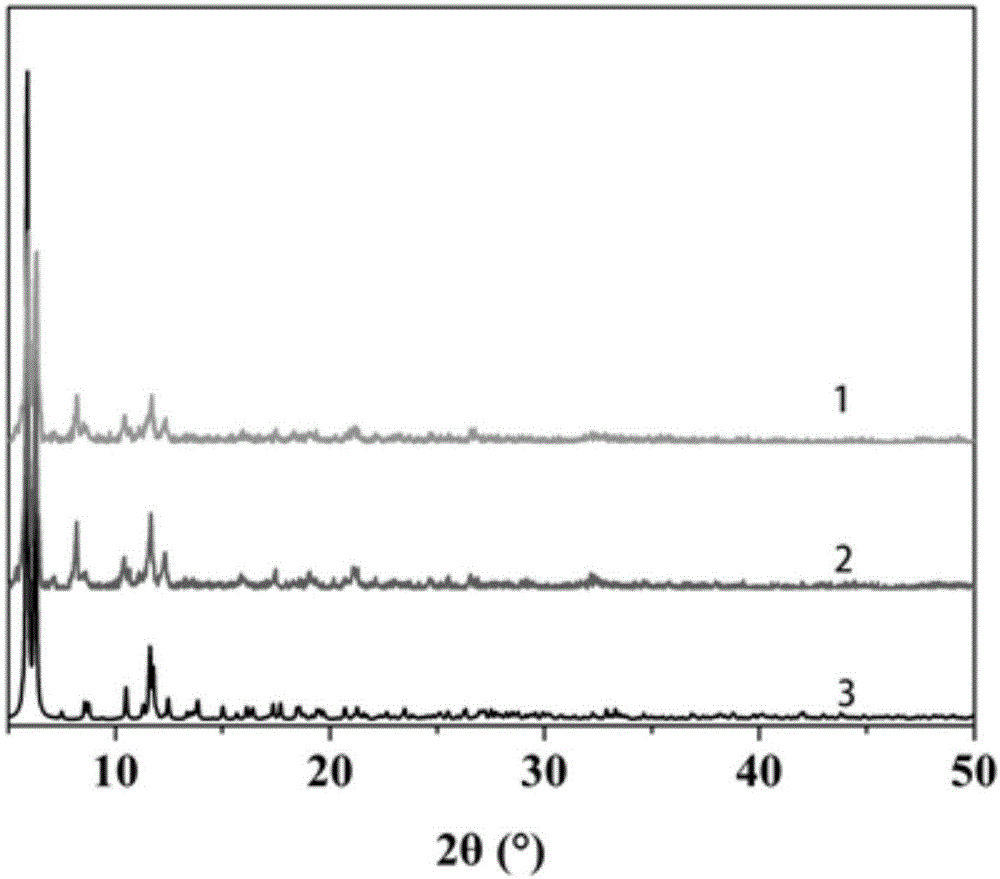
图1为x射线粉末衍射谱图,1为实施例一步骤二制备的rhb@tb-dcpcpt复合材料实测x射线粉末衍射曲线,2为实施例一步骤一制备的tb-dcpcpt晶体实测x射线粉末衍射曲线,3为tb-dcpcpt晶体拟合x射线粉末衍射曲线;
图2为氮气吸附脱附谱图,1为实施例一步骤一制备的tb-dcpcpt晶体,2为实施例一步骤二制备的rhb@tb-dcpcpt复合材料;
图3为紫外可见吸收谱图,1为实施例一步骤一制备的tb-dcpcpt晶体,2为罗丹明b,3为水溶液过滤后的rhb@tb-dcpcpt复合材料;
图4为实施例一步骤一制备的tb-dcpcpt晶体固态三维荧光谱图;
图5为实施例一步骤二制备的rhb@tb-dcpcpt复合材料固态三维荧光谱图;
图6为实施例一步骤二制备的rhb@tb-dcpcpt复合材料和水溶液过滤后的rhb@tb-dcpcpt复合材料实测x射线粉末衍射谱图,1为实施例一步骤二制备的rhb@tb-dcpcpt复合材料,2为水溶液过滤后的rhb@tb-dcpcpt复合材料;
图7为实施例一步骤三制备的rhb@tb-dcpcpt分散液不同激发波长下荧光谱图;
图8为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nzf的水溶液后的荧光谱图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nzf的水溶液;
图9为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nft的水溶液后的荧光谱图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nft的水溶液;
图10为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含cpfx的水溶液后的荧光谱图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含cpfx的水溶液;
图11为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nfx的水溶液后的荧光谱图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nfx的水溶液;
图12为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nzf的水溶液后的荧光谱图;
图13为不同浓度含nzf的水溶液在544nm处与相对荧光强度的关系对比图;
图14为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nft的水溶液后的荧光谱图;
图15为不同浓度含nft的水溶液在544nm处与相对荧光强度的关系对比图;
图16为实施例一步骤三制备的rhb@tb-dcpcpt分散液在其他抗生素存在下,加入不同浓度含nzf的水溶液后544nm处荧光峰强柱状图;
图17为实施例一步骤三制备的rhb@tb-dcpcpt分散液在其他抗生素存在下,加入不同浓度含nft的水溶液后544nm处荧光峰强柱状图;
图18为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nzf的水溶液循环性谱图,1为rhb@tb-dcpcpt分散液,2为rhb@tb-dcpcpt分散液加入含nzf的水溶液;
图19为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nft的水溶液循环性谱图,1为rhb@tb-dcpcpt分散液,2为rhb@tb-dcpcpt分散液加入含nft的水溶液;
图20为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含不同抗生素的水溶液过滤后的x射线粉末衍射图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nfx的水溶液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含cpfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nft的水溶液,4为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nzf的水溶液,5为实施例一步骤三制备的rhb@tb-dcpcpt分散液;
图21为实施例一步骤三制备的rhb@tb-dcpcpt分散液在acl存在下,加入含cpfx或nfx的水溶液后的荧光cie图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液与acl的混合物,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液在acl存在下,加入含cpfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液在acl存在下,加入含nft的水溶液;
图22为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx的水溶液后的荧光谱图;
图23为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx的水溶液后的的荧光cie图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为0mmol/l含cpfx的水溶液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为1mmol/l含cpfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为2mmol/l含cpfx的水溶液,4为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为3mmol/l含cpfx的水溶液,5为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为4mmol/l含cpfx的水溶液,6为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为5mmol/l含cpfx的水溶液,7为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为6mmol/l含cpfx的水溶液,8为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为7mmol/l含cpfx的水溶液,9为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为8mmol/l含cpfx的水溶液;
图24为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx或nfx的水溶液后的荧光颜色变化,a为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx的水溶液,b为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nfx的水溶液;
图25为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nfx的水溶液后的荧光谱图;
图26为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nfx的水溶液后的荧光cie图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为0mmol/l含nfx的水溶液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为1mmol/l含nfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为2mmol/l含nfx的水溶液,4为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为3mmol/l含nfx的水溶液,5为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为4mmol/l含nfx的水溶液,6为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为5mmol/l含nfx的水溶液,7为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为6mmol/l含nfx的水溶液,8为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为7mmol/l含nfx的水溶液,9为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为8mmol/l含nfx的水溶液;
图27为实施例一步骤三制备的rhb@tb-dcpcpt分散液的荧光分峰图;
图28为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含cpfx的水溶液后的荧光分峰;
图29为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nfx的水溶液后的荧光分峰;
图30为实施例一步骤一制备的tb-dcpcpt晶体、cpfx固体和nfx固体的荧光图,1为实施例一步骤一制备的tb-dcpcpt晶体,2为nfx固体,3为cpfx固体。
具体实施方式
本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。
具体实施方式一:本实施方式一种检测饮用水中硝基呋喃类抗生素或喹诺酮类抗生素的方法按照以下步骤进行:
一、制备tb-dcpcpt晶体:
①、将tb(no3)3·6h2o、3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑、n,n’-二甲基甲酰胺和h2o混合,得到混合物,将混合物置于高温反应釜中,在温度为150℃~200℃的条件下,密封24h~72h进行溶剂热反应,得到晶体样品;
所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑与tb(no3)3·6h2o的摩尔比为1:(0.5~2);所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑的摩尔与n,n’-二甲基甲酰胺的体积比为0.1mmol:(5~10)ml;所述的n,n’-二甲基甲酰胺与h2o的体积比为1:(0.1~2);
②、将晶体样品用n,n’-二甲基甲酰胺和乙醇分别洗涤3次~5次,得到tb-dcpcpt晶体;二、制备rhb@tb-dcpcpt复合材料:
将tb-dcpcpt晶体浸渍于浓度为10-4mol/l~10-5mol/l的罗丹明b水溶液中,保持12h~48h,得到粉红晶体,将粉红晶体用去离子水冲洗,并在空气中干燥,得到rhb@tb-dcpcpt复合材料;
三、制备rhb@tb-dcpcpt分散液:
在搅拌条件下,将rhb@tb-dcpcpt复合材料分散于水中,得到rhb@tb-dcpcpt分散液;
所述的rhb@tb-dcpcpt分散液的浓度为0.1g/l~10g/l;
四、荧光检测:
将饮用水与rhb@tb-dcpcpt分散液混合,得到待检测饮用水,对待检测饮用水采用波长为300nm~390nm的紫外光照射,观察溶液颜色;
所述的饮用水与rhb@tb-dcpcpt分散液的体积比为1:(0.5~2);
所述的饮用水中含有硝基呋喃类抗生素或喹诺酮类抗生素;
当所述的饮用水中含有硝基呋喃类抗生素,且饮用水中硝基呋喃类抗生素的浓度高于0.502μmol/l时,溶液颜色由黄光发生荧光淬灭;
当所述的饮用水中含有喹诺酮类抗生素,且饮用水中喹诺酮类抗生素的浓度高于0.448μmol/l时,溶液颜色由黄色先变为白色,再变为蓝色。
本具体实施方式中饮用水中硝基呋喃类抗生素与喹诺酮类抗生素不同时存在。
本具体实施方式的有益效果:
选择[(ch3)2nh2][tb3(dcpcpt)3(hcoo)]·dmf·15h2o(tb-dcpcpt)的阴离子骨架和罗丹明b阳离子染料(rhb)制备了rhb@tb-dcpcpt复合材料。该复合材料具有tb-dcpcpt和rhb的共同发光,在300nm~390nm的激发下产生持久的黄光发射。对14种抗生素进行了发光检测,无论是对硝基呋喃类抗生素的发光强度,还是对喹诺酮类抗生素的发光颜色,都显示出良好的鉴别能力。该传感行为具有良好的灵敏度、选择性和可回收性,其受到激发波长的影响很小。
通过离子交换将阳离子rhb固定在阴离子ln-mof通道中,成功地合成了一种与激发波长无关的黄色发光复合材料。该复合材料对硝基呋喃类抗生素(nzf和nft)具有较高的灵敏度和选择性检测能力。此外,对喹诺酮类抗生素(cpfx和nfx),rhb@tb-dcpcpt也显示出从黄色到白色到蓝色的明显的发光-颜色变化过程。激发波长对传感行为的影响很小。该复合材料检测限低(对nzf和nft的检测限分别为0.502μmol/l和0.448μmol/l,对cpfx和nfx的检测限分别为2.16μmol/l和0.63μmol/l),稳定性好,选择性好,可回收利用,是一种很有前途的呋喃类和喹诺酮类抗生素传感器,在水质监测方面具有潜在的实用价值。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一①中所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑与tb(no3)3·6h2o的摩尔比为1:(0.5~1)。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二之一不同的是:步骤一①中所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑的摩尔与n,n’-二甲基甲酰胺的体积比为0.1mmol:(8~10)ml。其它与具体实施方式一或二之一相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤一①中所述的n,n’-二甲基甲酰胺与h2o的体积比为1:(0.25~2)。其它与具体实施方式一至三之一相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤二中将tb-dcpcpt晶体浸渍于浓度为10-5mol/l的罗丹明b水溶液中,保持24h~48h,得到粉红晶体,将粉红晶体用去离子水冲洗,并在空气中干燥,得到rhb@tb-dcpcpt复合材料。其它与具体实施方式一至四之一相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤二中将tb-dcpcpt晶体浸渍于浓度为10-5mol/l的罗丹明b水溶液中,保持12h~24h,得到粉红晶体,将粉红晶体用去离子水冲洗,并在空气中干燥,得到rhb@tb-dcpcpt复合材料。其它与具体实施方式一至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤三中所述的rhb@tb-dcpcpt分散液的浓度为1g/l~10g/l。其它与具体实施方式一至六之一相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤三中所述的rhb@tb-dcpcpt分散液的浓度为0.1g/l~1g/l。其它与具体实施方式一至七之一相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:步骤四中所述的饮用水与rhb@tb-dcpcpt分散液的体积比为1:(1~2)。其它与具体实施方式一至八之一相同。
具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:步骤四中所述的饮用水与rhb@tb-dcpcpt分散液的体积比为1:(0.5~1)。其它与具体实施方式一至九之一相同。
采用下述实验验证本发明效果:
实施例一:
一、制备tb-dcpcpt晶体:
①、将0.1mmoltb(no3)3·6h2o、0.1mmol3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑、8mln,n’-二甲基甲酰胺和2mlh2o混合,得到混合物,将混合物置于高温反应釜中,在温度为160℃的条件下,密封72h进行溶剂热反应,得到晶体样品;
②、将晶体样品用n,n’-二甲基甲酰胺和乙醇分别洗涤3次,得到tb-dcpcpt晶体;
二、制备rhb@tb-dcpcpt复合材料:
将1.6mgtb-dcpcpt晶体浸渍于8ml浓度为10-5mol/l的罗丹明b水溶液中,保持24h,得到粉红晶体,将粉红晶体用去离子水冲洗,并在空气中干燥,得到rhb@tb-dcpcpt复合材料;
三、制备rhb@tb-dcpcpt分散液:
在搅拌条件下,将rhb@tb-dcpcpt复合材料分散于水中,得到rhb@tb-dcpcpt分散液;
所述的rhb@tb-dcpcpt分散液的浓度为1g/l;
四、荧光检测:
将饮用水与rhb@tb-dcpcpt分散液混合,得到待检测饮用水,对待检测饮用水采用波长为300nm~390nm的紫外光照射,观察溶液颜色;
所述的饮用水与rhb@tb-dcpcpt分散液的体积比为1:1;
所述的饮用水中含有硝基呋喃类抗生素或喹诺酮类抗生素;
当所述的饮用水中含有硝基呋喃类抗生素,且饮用水中硝基呋喃类抗生素的浓度高于0.502μmol/l时,溶液颜色由黄光发生荧光淬灭;
当所述的饮用水中含有喹诺酮类抗生素,且饮用水中喹诺酮类抗生素的浓度高于0.448μmol/l时,溶液颜色由黄色先变为白色,再变为蓝色。
本实施例材料和仪器:本实施例步骤一①中所述的3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑为济南恒化科技有限公司生产,产品编号为130811as,英文名称为3-(3,5-dicarboxylphenyl)-5-(4-carboxylphenyl)-1h-1,2,4-triazole,本实施例中3-(3,5-二羧基苯基)-5-(4-羧基苯基)-1-氢-1,2,4-三氮唑简写为h3dcpcpt。
tb2o3与硝酸反应制得tb(no3)3·6h2o。其他化学品是从商业公司购买的,未经净化而使用。所有抗生素的生产厂商为强健科技有限公司。
在perkin-elmerlambda35光谱仪上采集了紫外(uv)光谱。在perkin-elmer2400分析仪上对c、h、o和n进行了元素分析。用爱丁堡fls920荧光分光光度计测量光致发光(pl)光谱,校正后的光谱是通过仪器提供的校准曲线得到的。
本实施例步骤一中制备的tb-dcpcpt晶体产率:1.6mg(2.02wt%)。
理论计算碳(c)在化合物c57h67n11o36tb3中占有的质量比为34.94%;氢(h)在化合物c57h67n11o36tb3中占有的质量比为3.45%,氧(o)在化合物c57h67n11o36tb3中占有的质量比为29.40%,氮(n)在化合物c57h67n11o36tb3中占有的质量比为7.86%。
经由实际元素分析试验:碳(c)在tb-dcpcpt晶体占34.68%;氢(h)在tb-dcpcpt晶体占3.48%,氧(o)在tb-dcpcpt晶体占29.44%,氮(n)在tb-dcpcpt晶体占8.03%。
图1为x射线粉末衍射谱图,1为实施例一步骤二制备的rhb@tb-dcpcpt复合材料实测x射线粉末衍射曲线,2为实施例一步骤一制备的tb-dcpcpt晶体实测x射线粉末衍射曲线,3为tb-dcpcpt晶体拟合x射线粉末衍射曲线。本实施例根据先前的文献报道合成了tb-dcpcpt晶体,tb-dcpcpt晶体是由刚性配体h3dcpcpt和tb(no3)3·6h2o在溶剂热条件下生成的。所得的tb-dcpcpt晶体与先前报道的单晶结构的有一致的pxrd谱图,证实了tb-dcpcpt的成功合成(图1)。值得注意的是,tb-dcpcpt晶体不仅具有永久孔隙度(比表面积为801m2/g;一维沟道尺寸为
罗丹明b(rhb)是一种优秀的荧光载体,用于化学/生物传感。然而,聚合引发的猝灭限制了rhb的广泛应用。在本实施例中,一种封装策略是通过捕获和抑制rhb分子进入多孔骨架来实现的。通过将tb-dcpcpt晶体浸泡在rhb水溶液中,将染料引入tb-dcpcpt通道,得到rhb@tb-dcpcpt复合材料。封装后,日照下的晶体颜色由透明变为粉红色,紫外光下的发光颜色由绿色变为黄色。引入rhb前后的pxrd图谱显示了相同的框架结构(图1)。
图2为氮气吸附脱附谱图,1为实施例一步骤一制备的tb-dcpcpt晶体,2为实施例一步骤二制备的rhb@tb-dcpcpt复合材料;n2吸附等温线和紫外-可见吸收进一步验证了rhb的成功装载(图2和5)。
几个因素促使封装的实现:一方面,rhb的动力学尺寸
tb-dcpcpt晶体和rhb@tb-dcpcpt复合材料的光致发光:
研究了tb-dcpcpt晶体、rhb和rhb@tb-dcpcpt复合材料为固态时的发光光谱。图4为实施例一步骤一制备的tb-dcpcpt晶体固态三维荧光谱图;如图4所示,tb-dcpcpt晶体分别在489nm、544nm、581nm和619nm处显示了tb3+离子与5d4→7fj(j=6、5、4和3)跃迁对应的尖锐特征峰。
图5为实施例一步骤二制备的rhb@tb-dcpcpt复合材料固态三维荧光谱图;rhb可以代表明显的红光发射范围从600nm到670nm,因此rhb@tb-dcpcpt复合材料显示了tb3+和rhb的共发光(图5),489nm和544nm处的强发射属于骨架发射,635nm附近的另一个强发射属于rhb的发射。
由于所合成的rhb@tb-dcpcpt复合材料能在水溶液中检测抗生素,因此,对rhb@tb-dcpcpt复合材料在水介质中的稳定性和发光特性进行了检测。通过搅拌将rhb@tb-dcpcpt复合材料悬浮到水中,得到rhb@tb-dcpcpt分散液,然后再将rhb@tb-dcpcpt分散液中rhb@tb-dcpcpt复合材料过滤出来,得到水溶液过滤后的rhb@tb-dcpcpt复合材料;
在rhb@tb-dcpcpt复合材料中,荧光共振能量从骨架转移到rhb可能有助于骨架和染料的共同发光。图3为紫外可见吸收谱图,1为实施例一步骤一制备的tb-dcpcpt晶体,2为罗丹明b,3为水溶液过滤后的rhb@tb-dcpcpt复合材料。如图3中和图4所示,rhb的uv-vis吸收谱主要在544nm附近,与tb-dcpcpt的5d4→7f2跃迁带几乎完全重叠。包覆后,tb-dcpcpt在544nm处的发光强度明显降低,证实了有效荧光共振能量转移的存在。
图6为实施例一步骤二制备的rhb@tb-dcpcpt复合材料和水溶液过滤后的rhb@tb-dcpcpt复合材料实测x射线粉末衍射谱图,1为实施例一步骤二制备的rhb@tb-dcpcpt复合材料,2为水溶液过滤后的rhb@tb-dcpcpt复合材料;从悬浮液中过滤出的rhb@tb-dcpcpt的pxrd图谱几乎没有变化,说明框架在悬浮在水中后仍然是完整的(图6)。
通过紫外-可见光谱可以检测到少量的rhb,说明rhb位于骨架的通道中(图3)。
这些结果表明,该复合材料具有良好的稳定性,同时表明纳米孔道对rhb聚集和解离具有一定的限制作用,大大提高了复合材料的稳定性。实验结果也证实了rhb@tb-dcpcpt在水溶液化学/生物传感中的应用。
图7为实施例一步骤三制备的rhb@tb-dcpcpt分散液不同激发波长下荧光谱图;rhb@tb-dcpcpt复合材料发光颜色在整个激发波长300nm~390nm范围内保持稳定的黄光发射。这一贡献解决了镧系传感器在发光强度和颜色上与激发波长有关的不稳定性问题。尽管rhb@tb-dcpcpt复合材料在水溶液中具有持久的黄光发射(图7),但被包裹的rhb的发光从图5中的635nm变为图7中的590nm,这是由于染料分子的浓度效应引起的。重要的是,通过使用多孔网络去封装rhb染料,这些结果证实了rhb分子不存在聚集诱导猝灭现象。
硝基呋喃类抗生素的检测:
向实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入浓度为0.01mol/l的含抗生素的水溶液,并采用波长为320nm的紫外光照射,以研究rhb@tb-dcpcpt检测微量抗生素的能力,所述的含抗生素的水溶液与rhb@tb-dcpcpt分散液的体积比为1:1。所述的含抗生素的水溶液中抗生素为以下6类常用抗生素14种中的一种,如β-内酰胺类抗生素(青霉素pcl、阿莫西林acl、头孢克肟cfx、头孢拉定cfd),氨基糖苷类抗生素(庆大霉素gtm、卡那霉素knm)、大环内酯类抗生素(罗红霉素rox、阿奇霉素azm)、喹诺酮类抗生素(环丙沙星cpfx、诺氟沙星nfx)、硝基呋喃类抗生素(呋喃唑酮nzf、呋喃妥因nft)以及其他类抗生素(万古霉素vcc、林可霉素lcc)。
图8为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nzf的水溶液后的荧光谱图;1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nzf的水溶液;图9为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nft的水溶液后的荧光谱图;1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nft的水溶液;图10为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含cpfx的水溶液后的荧光谱图;1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含cpfx的水溶液;图11为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nfx的水溶液后的荧光谱图;1为实施例一步骤三制备的rhb@tb-dcpcpt分散液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含nfx的水溶液;根据图8~图11,rhb@tb-dcpcpt在添加硝基呋喃类抗生素(如nzf和nft)时会出现高发光猝灭。
图20为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含不同抗生素的水溶液过滤后的x射线粉末衍射图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nfx的水溶液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含cpfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nft的水溶液,4为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nzf的水溶液,5为实施例一步骤三制备的rhb@tb-dcpcpt分散液;经pxrd证实,在对nzf和nft的传感实验后,rhb@tb-dcpcpt的结构完好无损(图20)。
向实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含硝基呋喃类抗生素的水溶液,并采用波长为320nm的紫外光照射,以研究rhb@tb-dcpcpt检测硝基呋喃类抗生素的检测限,所述的含硝基呋喃类抗生素的水溶液与rhb@tb-dcpcpt分散液的体积比为1:1。用stern-volmer(sv)方程:i0/i=1+ksv×[c],其中ksv为猝灭常数(mol/l)-1,设含硝基呋喃类抗生素的水溶液中硝基呋喃类抗生素的浓度为[c],[c]的单位为mol/l,i0和i分别是在硝基呋喃类抗生素不存在和存在时的发光强度,所述的硝基呋喃类抗生素为呋喃唑酮nzf或呋喃妥因nft。
图12为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nzf的水溶液后的荧光谱图;对图12中不同曲线的荧光强度用stern-volmer(sv)方程进行计算并绘图,得到图13,图13为不同浓度含nzf的水溶液在544nm处与相对荧光强度的关系对比图,图14为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nft的水溶液后的荧光谱图,对图14中不同曲线的荧光强度用stern-volmer(sv)方程进行计算并绘图,得到图15,图15为不同浓度含nft的水溶液在544nm处与相对荧光强度的关系对比图;nzf和nft的sv曲线呈良好的线性关系,rhb@tb-dcppt对nzf和nft的ksv值分别为5.98×104(mol/l)-1和6.69×104(mol/l)-1(图13和图15)。根据空白溶液三次重复荧光测量的ksv值和标准差(σ=0.010),确定了rhb@tb-dcpcpt对nzf和nft的检测限(lod=3σ/ksv),计算值分别为0.502μmol/l(99.47ppb)和0.448μmol/l(106.7ppb)。本实施例的方法灵敏度远优于大部分已报道的nzf和nft荧光探针,符合美国环境保护局和世界卫生组织饮用水中抗生素的最高允许含量的标准。
对nzf和nft的优良敏感度表明,rhb@tb-dcpcpt对硝基呋喃类抗生素有很高的猝灭效率,但对其他种类的抗生素则不敏感。在此基础上,本实施例进一步检查了在其他抗生素存在下对硝基呋喃类抗生素的检测选择性。在对照实验中,将浓度为1mmol/l的含抗生素(pcl、acl、cfx、cfd、gtm、knm、rox、azm、cpfx、nfx、vcc或lcc)的水溶液加入到实施例一步骤三制备的rhb@tb-dcpcpt分散液中,然后加入不同浓度含nzf或nft的水溶液,并采用波长为320nm的紫外光照射,所述的含抗生素的水溶液与实施例一步骤三制备的rhb@tb-dcpcpt分散液的体积比为1:1,所述的不同浓度含nzf或nft的水溶液与实施例一步骤三制备的rhb@tb-dcpcpt分散液的体积比为1:1。
图16为实施例一步骤三制备的rhb@tb-dcpcpt分散液在其他抗生素存在下,加入不同浓度含nzf的水溶液后544nm处荧光峰强柱状图;图17为实施例一步骤三制备的rhb@tb-dcpcpt分散液在其他抗生素存在下,加入不同浓度含nft的水溶液后544nm处荧光峰强柱状图;在其他抗生素过量的情况下(图16和17),rhb@tb-dcpcpt的发光强度略有变化。将硝基呋喃类抗生素引入rhb@tb-dcpcpt和其他抗生素的混合物后,发光被明显地猝灭,说明rhb@tb-dcpcpt对硝基呋喃具有较高的猝灭选择性。
此外,按体积比为1:1向实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入浓度为1mmol/l的含nzf或nft的水溶液,并采用波长为320nm的紫外光照射,在使用后经过离心和用水几次洗涤,过滤重新得到rhb@tb-dcpcpt,然后重新将rhb@tb-dcpcpt分散到水中,得到浓度为1g/l的rhb@tb-dcpcpt分散液,并按体积比为1:1向浓度为1g/l的rhb@tb-dcpcpt分散液中重新加入浓度为1mmol/l的含nzf或nft的水溶液,采用波长为320nm的紫外光照射,以此循环,研究rhb@tb-dcpcpt检测硝基呋喃类抗生素的循环性。图18为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nzf的水溶液循环性谱图,1为rhb@tb-dcpcpt分散液,2为rhb@tb-dcpcpt分散液加入含nzf的水溶液;图19为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nft的水溶液循环性谱图,1为rhb@tb-dcpcpt分散液,2为rhb@tb-dcpcpt分散液加入含nft的水溶液;说明荧光检测对硝基呋喃类抗生素具有良好的可回收性,可以再生和大量的循环重复使用(图18和19)。
rhb@tb-dcpcpt对nzf和nft的作用机理:首先,经pxrd证实,在对nzf和nft的传感实验后,rhb@tb-dcpcpt的结构完好无损(图20)。其次,根据本领域人员公知常识,抗生素的紫外-可见光谱,nzf和nft在300nm~400nm处有较强的吸收,由于竞争光子吸收导致rhb@tb-dcpcpt的发光猝灭。第三,nzf和nft的最低未占据分子轨道(lumo)能量低于其它抗生素,说明光诱导的电子转移是在这些系统中观察到的发光猝灭的一种机制。结果表明,电子转移和竞争光子吸收的共存使得呋喃类化合物与其它已被证实的分析物质相比,表现出良好的发光猝灭效应。
喹诺酮类抗生素的检测:
向实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入浓度为0.01mol/l的含喹诺酮类抗生素的水溶液,并采用波长为320nm的紫外光照射,测试了发光变色过程,所述的含喹诺酮类抗生素的水溶液与实施例一步骤三制备的rhb@tb-dcpcpt分散液的体积比为1:1。
图27为实施例一步骤三制备的rhb@tb-dcpcpt分散液的荧光分峰图;图28为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含cpfx的水溶液后的荧光分峰;图29为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入含nfx的水溶液后的荧光分峰;随着cpfx和nfx的增加,配体中心发射产生深致变色位移。这表明从rhb@tb-dcpcpt到喹诺酮分子存在辐射俘获。因此,配体中心发射在发射光谱中起主导作用,使发光颜色发生由黄色到白色到蓝色的变化。
向实施例一步骤三制备的rhb@tb-dcpcpt分散液中加入含喹诺酮类抗生素的水溶液,并采用波长为320nm的紫外光照射,所述的含喹诺酮类抗生素的水溶液与rhb@tb-dcpcpt分散液的体积比为1:1。图22为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx的水溶液后的荧光谱图;图23为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx的水溶液后的的荧光cie图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为0mmol/l含cpfx的水溶液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为1mmol/l含cpfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为2mmol/l含cpfx的水溶液,4为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为3mmol/l含cpfx的水溶液,5为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为4mmol/l含cpfx的水溶液,6为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为5mmol/l含cpfx的水溶液,7为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为6mmol/l含cpfx的水溶液,8为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为7mmol/l含cpfx的水溶液,9为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为8mmol/l含cpfx的水溶液;图24为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx或nfx的水溶液后的荧光颜色变化,a为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含cpfx的水溶液,b为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nfx的水溶液;图25为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nfx的水溶液后的荧光谱图;图26为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入不同浓度含nfx的水溶液后的荧光cie图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为0mmol/l含nfx的水溶液,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为1mmol/l含nfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为2mmol/l含nfx的水溶液,4为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为3mmol/l含nfx的水溶液,5为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为4mmol/l含nfx的水溶液,6为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为5mmol/l含nfx的水溶液,7为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为6mmol/l含nfx的水溶液,8为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为7mmol/l含nfx的水溶液,9为实施例一步骤三制备的rhb@tb-dcpcpt分散液加入浓度为8mmol/l含nfx的水溶液;根据图22-图26,样品的发光颜色明显由黄色变为白色,然后变为蓝色。随着cpfx和nfx浓度的增加,tb3+和rhb组分的强度迅速下降,但nfx配体的组分仍保持不变,cpfx的配体组分甚至增加(图22和图25)。因此,随着cpfx和nfx的不断加入,蓝光发射逐渐占据主导地位,导致发光颜色从黄色到白色到蓝色。根据图24,当cpfx或nfx浓度为4mmol/l时样品的发光颜色变为白色,7mmol/l时变为蓝色,这是一个相对较低的视觉检测限制。在544nm处进行光强监测,对cpfx和nfx的检出限分别为2.16μmol/l(716ppb)和0.63μmol/l(201ppb)。结果表明,rhb@tb-dcpcpt具有双倍和低视觉检测限,检测范围广。
随后对喹诺酮类药物在其他抗生素存在下的检测选择性进行了研究。将浓度为1mmol/l的含抗生素(pcl、acl、cfx、cfd、gtm、knm、rox、azm、vcc或lcc)的水溶液加入到实施例一步骤三制备的rhb@tb-dcpcpt分散液中,然后加入浓度为0.01mol/l的含cpfx或nfx的水溶液,并采用波长为320nm的紫外光照射,所述的含抗生素的水溶液与实施例一步骤三制备的rhb@tb-dcpcpt分散液的体积比为1:1,所述的含cpfx或nfx的水溶液与实施例一步骤三制备的rhb@tb-dcpcpt分散液的体积比为1:1。图21为实施例一步骤三制备的rhb@tb-dcpcpt分散液在acl存在下,加入含cpfx或nfx的水溶液后的荧光cie图,1为实施例一步骤三制备的rhb@tb-dcpcpt分散液与acl的混合物,2为实施例一步骤三制备的rhb@tb-dcpcpt分散液在acl存在下,加入含cpfx的水溶液,3为实施例一步骤三制备的rhb@tb-dcpcpt分散液在acl存在下,加入含nft的水溶液;rhb@tb-dcpcpt复合材料在加入cpfx和nfx等喹诺酮类药物后,荧光颜色从黄色到蓝色的明显变化过程(图21)。在rhb@tb-dcpcpt与其他抗生素的混合物中引入喹诺酮类药物后,发光颜色明显变蓝,证明了rhb@tb-dcpcpt在发光颜色上对喹诺酮类化合物具有较高的选择性(图21)。
发光变色过程的机理:首先,对喹诺酮类抗生素检测前后rhb@tb-dcpcpt的pxrd图谱基本一致,表明荧光变色现象与结构变化无关(图20)。其次,对rhb@tb-dcpcpt进行了发光峰分析(图27~29)。随着cpfx和nfx的增加,配体中心发射产生深致变色位移。这表明从rhb@tb-dcpcpt到喹诺酮分子存在辐射俘获。因此,配体中心发射在发射光谱中起主导作用,使发光颜色发生由黄色到白色到蓝色的变化。第三,在320nm的激发下,喹诺酮类化合物在400nm~500nm处具有弱的发光,与h3dcpcpt的发光相似,这是使蓝光占主导地位的另一个原因(图30),图30为实施例一步骤一制备的tb-dcpcpt晶体、cpfx固体和nfx固体的荧光图,1为实施例一步骤一制备的tb-dcpcpt晶体,2为nfx固体,3为cpfx固体。因此,rhb@tb-dcpcpt向喹诺酮类化合物的发光变色过程是由于分析物的发光发射与能量传递干扰共存和配体向镧系离子能量转移的扰动所致。
- 还没有人留言评论。精彩留言会获得点赞!