与肝脏损伤、肝细胞凋亡相关特异蛋白分子标志物筛选方法与流程
本发明属于分子生物学研究领域,具体地说,涉及一种hcy(同型半胱氨酸)损伤肝脏后特异性诊断相关特异指标的筛选及应用。
背景技术:
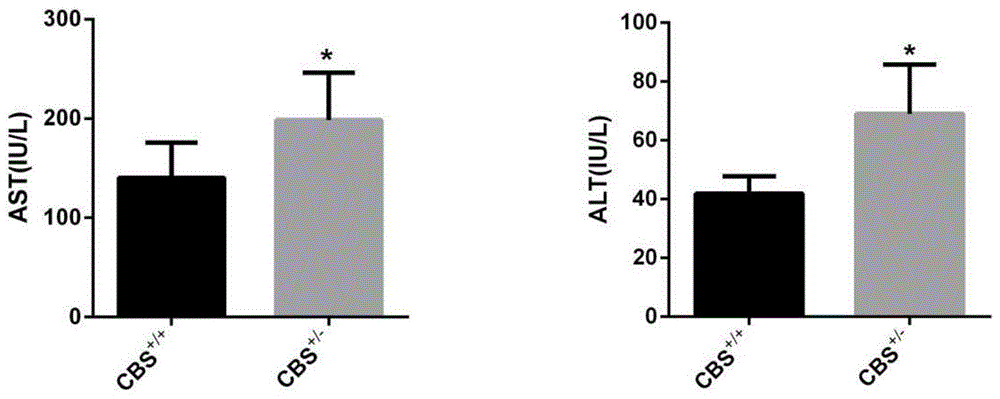
:同型半胱氨酸(homocysteine,hcy)是一种含硫氨基酸,为蛋氨酸和半胱氨酸(cysteine,cys)代谢的中间产物,近年来研究表明hhcy(高同型半胱氨酸血症)与心脑血管疾病、肝硬化、慢性肾病等疾病密切相关,因此针对hcy(同型半胱氨酸)致病环节进行多靶点干预研究成为热点。肝脏是腹腔内最大的实质性器官,担负人体的重要生理功能,肝细胞损伤是各型肝病共同的病理基础,肝损伤的结果可致肝细胞死亡,甚至肝衰竭的发生。在正常肝脏中,自发性细胞凋亡的发生率非常低,仅细胞凋亡不仅在肝细胞的生理性消亡中起关键作用,而且还与过多的急性和慢性肝病以及肝毒性有关。肝脏的稳态依赖于细胞生长和细胞死亡之间的关键性平衡,后者主要通过程序化的凋亡模式实现。然而,在几种急性和慢性肝病中,包括暴发性肝衰竭、酒精性肝炎、自身免疫性肝炎、急慢性病毒性肝炎、还有非酒精性的脂肪性肝炎、大量的胆汁淤积性肝病、还有肝脏发生纤维化和肝脏发生硬化结节,肝细胞凋亡活动强烈增加,hcy(同型半胱氨酸)诱导的肝细胞ers(内质网应激)与凋亡与细胞内hcy(同型半胱氨酸)异构体的形成有关以及n-同型半胱氨酸脱羟基导致广泛的细胞内蛋白应激造成的错误折叠有关。同型半胱氨酸在正常的机体代谢过程中,同型半胱氨酸硫代内酯的水平在0-24.8nmol/l(纳摩尔每升),而在患高同型半胱氨酸血症的人体内,血清hcy同型半胱氨酸硫代内酯的水平高于正常人的数倍。肝脏是同型半胱氨酸代谢的主要脏器,同型半胱氨酸水平的改变也可以引起肝脏疾病,目前认为同型半胱氨酸通过引起显著的氧化应激导致机体抗氧化能力失衡,进而影响还原型谷胱甘肽的合成与功能引起肝细胞凋亡对肝脏产生负面作用,肝脏作为同型半胱氨酸代谢重要的生物场所,同型半胱氨酸浓度的增高导致肝脏的代谢动能受损,继而造成肝脏的损伤,大量的临床研究表明,在低浓度同型半胱氨酸水平下,硫代内酯已经会造成n-同型半胱氨酸脱羟基化,肝脏作为机体的代谢功能最为旺盛的器官,同时也是机体的解毒器官,大量的蛋白n-同型半胱氨酸脱羟基化可发生在hhcy(高同型半胱氨酸血症)患者的肝细胞内,造成肝脏功能的受损。目前针对肝脏损伤的检测临床上较为单一,大多依赖生化指标的检测,但是生化指标的改变已经以为这肝脏的损伤,而且目前的肝脏功能诊断特异性并不是很强。因此早期对肝脏的损伤进行监控是迫在眉睫,因此对于早期发现肝脏损伤的靶标有利于临床上防治各种肝损伤,建立多元化的治疗体系。gankyrin(psmd10)(26s蛋白酶体非腺嘌呤核苷三磷酸酶)作为一种与凋亡调控密切相关的蛋白,它控制磷酸化的rb(成视网膜细胞瘤基因)和p53(人体抑癌基因)降解,此外,它还被证明可以调节nf-κb(核因子κb)和akt(蛋白激酶b),gankyrin是否可以做为特异性的检测指标在肝脏损伤过程中未见报道。技术实现要素:本发明的目的在于发现开发一种针对早期防治的肝脏损伤靶标,肝细胞凋亡异常的蛋白分子,该发明中组织标本来自于雄性cbs+/-(胱硫醚β-合酶基因)基因敲除小鼠,细胞是人源的肝细胞,一种与肝脏损伤的蛋白质指标,以及肝细胞凋亡相关的损伤标志物,包括:psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶),cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3),cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12),bax(凋亡相关蛋白),bcl2(凋亡相关蛋白)。本发明的具体技术方案为:一种与肝脏损伤,肝细胞凋亡异常的蛋白分子标志物筛选方法,具体步骤为:(1)构建cbs+/-(胱硫醚β-合酶基因)基因敲除小鼠hhcy(高同型半胱氨酸血症)模型。(2)全自动生化分析检测小鼠肝功能指标。(3)westernblot(蛋白质印迹实验)和qrt-pcr(实时荧光定量)分析cbs+/-(胱硫醚β-合酶基因)基因敲除小鼠血管组织中差异性表达的蛋白分子,并在细胞水平给予验证。(4)荧光共定位,qrt-pcr(实时荧光定量)和westernblot分别检测培养动物肝脏组织中kdelreceptor(赖-天冬-谷-亮氨酸受体)表达量和细胞中cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3),cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)含量及表达使用tunel(脱氧核糖核酸断裂的原位末端标记法)染色检测hhcy小鼠肝脏凋亡情况。(5)使用流式细胞术检测hcy干预肝细胞后肝细胞凋亡的改变。(6)干扰psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)后,使用流式细胞术检测肝细胞凋亡。(7)干扰psmd10后,使用westernblot检测肝细胞凋亡因子。(8)分析比较肝细胞表达异常的蛋白和凋亡相关基因cleavedcaspase3,cleavedcaspase12的表达改变与常规检测肝功能生化指标比较并进行评价。在cbs+/-(胱硫醚β-合酶基因)基因敲除小鼠中,与正常组相比,hhcy肝脏组织中psmd10表达明显降低,在体外hcy干预的肝细胞中得到了相同的趋势。cbs+/-基因敲除小鼠hhcy模型中肝脏组织中cleavedcaspase3和cleavedcaspase12表达显著增加,psmd10,cleavedcaspase3和cleavedcaspase12的联合应用的特异性和灵敏度均与肝损伤生化学检测诊断的结果一致。本发明所述肝脏损伤,肝细胞凋亡异常的蛋白分子在hhcy致肝损伤疾病早期诊断过程中得到广泛的应用。本发明与现有技术相比,有益效果如下:(1)本发明找出靶蛋白psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)作为建立肝细胞凋亡致肝损伤蛋白早期诊断的候选靶标。(2)本发明建立了由psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶),cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)组成的在hhcy(高同型半胱氨酸血症)诱导肝脏损伤,肝细胞凋亡检测中蛋白靶标的应用。(3)本发明由psmd10,cleavedcaspase3和cleavedcaspase12组成的hhcy诱导肝细胞凋亡造成肝脏损伤的蛋白靶标,敏感度和特异性与肝脏生化检测指标结果高度吻合。(4)本发明的方法取材来自cbs(胱硫醚β-合酶基因)基因敲除小鼠hhcy模型小鼠和人源的肝细胞,该方法简单可靠,容易推广。附图说明图1为:cbs(胱硫醚β-合酶基因)基因敲除小鼠对照组和实验组肝脏组织中靶标蛋白的检测对照结果示意图。图2为:cbs(胱硫醚-β-合成酶)小鼠血清中生化指标的检测示意图。图3为:cbs(胱硫醚-β-合成酶)免疫荧光检测小鼠肝脏组织中ers的检测,小鼠对照组和实验组psmd10mrna与蛋白表达及验证示意图。图4为:肝细胞中psmd10与psmd10mrna的蛋白表达验证示意图。图5为:psmd10sirna转染细胞后培养检测,cleavedcaspase3和cleavedcaspase12的表达及验证示意图。图6为:流式细胞术psmd10sirna转染细胞后培养检测肝细胞的凋亡状态示意图。如图1所示,使用全自动生化分析仪检测小鼠肝脏ast,alt(冬氨酸转移酶,丙氨酸转移酶)的表达,结果表明,cbs+/-(胱硫醚-β-合成酶基因敲除小鼠杂合子)小鼠的ast与alt(冬氨酸转移酶与丙氨酸转移酶)的表达显著cbs+/+(胱硫醚-β-合成酶基因敲除小鼠野生型)小鼠(*p<0.05)。如图2所示,kdel受体(赖-天冬-谷-亮氨酸受体)对er(内质网)应激十分敏感,作为ers(内质网应激)敏感的感受器,可以作为很好的反应ers(内质网应激)的改变,因此使用免疫荧光检测kdelreceptor(赖-天冬-谷-亮氨酸受体)的表达改变,结果表明,cbs+/-(胱硫醚-β-合成酶基因敲除小鼠杂合子)小鼠中kdelreceptor(赖-天冬-谷-亮氨酸受体)的表达显著增加(*p<0.05)。如图3所示,cbs(胱硫醚-β-合成酶)小鼠对照组和实验组psmd10mrna(26s蛋白酶体非腺嘌呤核苷三磷酸酶信使单链核糖核酸)与蛋白表达及验证使用westernblot(蛋白质印迹)和q-pcr(荧光定量聚合酶链式反应)检测小鼠肝脏组织中psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)的表达,结果表明,cbs+/-(胱硫醚-β-合成酶基因敲除小鼠杂合子)小鼠中psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)的表达显著增加(*p<0.05)。如图4所示,人源肝细胞中psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)的表达验证,hcy(同型半胱氨酸)刺激肝细胞后,提取两组细胞rna,做qrt-pcr,结果显示,hcy(同型半胱氨酸)作用肝细胞后,psmd10mrna(26s蛋白酶体非腺嘌呤核苷三磷酸酶信使单链核糖核酸)的表达明显增加,westernblot(蛋白质印迹)结果显示,hcy(同型半胱氨酸)作用肝细胞后,psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)蛋白表达明显增加。如图5所示,肝细胞分为hcy(同型半胱氨酸),hcy+ncsirna(同型半胱氨酸加小分子干扰片段正常对照),hcy+psmd10siran(同型半胱氨酸加26s蛋白酶体非腺嘌呤核苷三磷酸酶小分子干扰片段)组。分别检测cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)这两个凋亡因子表达改变,结果显示敲低psmd10(26s蛋白酶体非atp酶)后cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)的改变显著降低。如图6所示,肝细胞分为hcy(同型半胱氨酸),hcy+ncsirna(同型半胱氨酸加小分子干扰片段正常对照),hcy+psmd10siran(26s蛋白酶体非腺嘌呤核苷三磷酸酶小分子干扰片段)组,流式细胞术检测肝细胞凋亡的改变。结果显示敲低psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)后,hcy(同型半胱氨酸)引起肝细胞的凋亡显著下降。具体实施方式与肝脏损伤、肝细胞凋亡异常的蛋白分子标志物筛选方法,下面结合附图和具体实施方案对本发明的技术方案作进一步详细地说明。1材料1.1主要试剂美国赛默飞公司荧光定量试剂盒;贝博细胞凋亡检测试剂盒;丙酮;过氧化物酶封闭液;山羊血清;psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶),cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)抗体,荧光二抗;dapi(4',6-二脒基-2-苯基吲哚)染液,he(苏木精-伊红染色法)染色液。1.2主要仪器超净工作台、伯乐转膜仪,伯乐电转仪,核酸分析仪、凝胶成像系统、低温冰箱、迷你离心机、蔡司共聚焦荧光显微镜、高速低温离心机,冰冻切片机。2方法2.1实验对象的选择从美国杰克逊实验室购买体重25-28g(克)的6周龄雄性cbs+/-(胱硫醚β-合酶基因)小鼠,小鼠均分笼饲养在spf(无特定病原体级实验动物)环境中,使用高压灭菌垫料,饲养笼及饮水瓶每周消毒,室内温度为20~25℃,相对湿度为55%~65%,明暗交替各12h(小时),换气次数18次/小时,饲养房内定期紫外灯消毒并自由摄食和饮水,将小鼠随机分为两组:(1)对照组(cbs+/+-+hmd(胱硫醚β-合酶基因小鼠野生型高蛋氨酸饮食))采用喂养;(2)实验组(cbs+/-+hmd(胱硫醚β-合酶基因小鼠突变型杂合子高蛋氨酸饮食))采用2%蛋氨酸喂养。2.2免疫荧光检测kedl(赖-天冬-谷-亮氨酸受体)在斑块中的表达从-80℃冰箱取小鼠主动脉根部血管冰冻切片平衡至室温,4%冰丙酮固定冰冻切片30min(分钟),然后用预先准备好的pbs(磷酸缓冲盐溶液)洗涤3次,每次5分钟;接着用新鲜配制的pbs(磷酸缓冲盐溶液)浸洗波片3次,每次洗涤5分钟,然后用吸水纸将玻片上组织周围的pbs(磷酸缓冲盐溶液)吸干净,滴加内源性过氧化物酶作用10min(分钟),用新鲜配制的pbs(磷酸缓冲盐溶液)浸洗波片3次,每次洗涤5分钟;吸干净组织周围的pbs(磷酸缓冲盐溶液)后滴加正常的山羊血清封闭1小时;封闭结束后,用吸水纸将山羊血清封闭液吸干净(注意:不可使玻片干片),每张玻片滴加足够将血管组织覆盖的一抗,滴加抗体完成后,将玻片放入湿盒中,于4℃孵育过夜或者37℃温箱内孵育30min(分钟);回收一抗,用新鲜配制的pbs(磷酸缓冲盐溶液)浸洗3遍,并将荧光二抗滴加到载玻片上,在37℃湿盒孵育1-2h(小时)。用pbs(磷酸缓冲盐溶液)浸洗玻片3次,每次浸洗5min(分钟);(注意:从加入荧光二抗开始,后面所有操作步骤都必须在避光环境中进行)。将dapi(4',6-二脒基-2-苯基吲哚)染料溶液加到组织上,在黑暗环境中孵育3-5min(分钟),染色完成后,将玻片用pbs(磷酸缓冲盐溶液)浸洗3次,每次浸洗3分钟;用滤纸吸干爬片上的残留液体,接着用含抗荧光淬灭剂的封片液封片。最后在激光共聚焦显微镜下观察并收集细胞图像。2.3cbs(胱硫醚-β-合成酶)小鼠组织切片取小鼠肝脏,包埋固定后使用石蜡切片机切片。2.4psmd10sirna(26s蛋白酶体非atp酶小分子干扰片段)的转染正常传代培养的肝细胞至汇合度达到50%且生长状态良好时,将细胞转至10cm(厘米)培养皿中,按照lipofection2000transfectionreagent(脂质2000体转染)说明书,即取6只1.5ml(毫升)的离心管,第1只离心管只加入1.2ml(毫升)空白的1640培养基和48μl(微升)lipofection2000transfectionreagent(脂质2000体转染)混匀,第2只离心管加入含100μmol/l(微摩尔每升)hcy(同型半胱氨酸)的1640培养基,另外4只离心管中分别加入100μmol/lhcy(微摩尔每升的同型半胱氨酸)的1640培养基加psmd10sirna-nc(26s蛋白酶体非atp酶干扰小分子片段正常对照)+100μmol/lhcy(微摩尔每升的同型半胱氨酸)的1640培养基,psmd10sirna(26s蛋白酶体非atp酶小分子干扰片段)+100μmol/lhcy(微摩尔每升的同型半胱氨酸)的1640培养基,以及只加hcy(同型半胱氨酸)的对照,室温静置5min(分钟)后将第1管只含lipofection2000transfectionreagent(脂质2000体转染)的液体分别加入其他5只离心管中,每管加入200μl(微升)混匀,静置20min(分钟),将培养皿中的正常培养基去掉,使用不含血清的1640培养基洗两遍,每个皿加入1ml(毫升)含有lipofection2000transfection(脂质2000体转染)混合液。在37℃5%co2(二氧化碳)培养箱中培养6小时后,将转染培养基更换为含有10%胎牛血清的1640培养基,在37℃5%co2培养箱中培养48小时后收取细胞备用。2.5annexinv-fitc/pi(膜联蛋白-v-异硫氰酸荧光素/碘化丙啶)流式细胞术⑴从培养箱取出待检测的肝细胞,轻柔地将肝细胞的细胞培养液吸出,放入提前备好的蓝色15ml(毫升)无菌离心管内,备用;⑵贴壁的肝细胞用pbs(磷酸缓冲盐溶液)洗涤2次,巴氏吸管尽可能吸尽pbs(磷酸缓冲盐溶液),加入适量胰酶消化液(应不含edta(乙二胺四乙酸),edta(乙二胺四乙酸)影响annxinv(膜联蛋白-v-异硫氰酸荧光素)与ps(膜磷脂酰丝氨酸)的结合)消化细胞。(注意,避免胰酶的过度消化,以防引起假阳性);⑶加入消化液的细胞,再加入步骤⑴中收集的细胞培养液,一起转移至离心管内,1,000g(克)离心5min(分钟),弃上清,收集细胞,用pbs(磷酸缓冲盐溶液)重悬细胞并计数,浓度约1×106cell/ml(细胞/毫升).⑷将上述细胞收集后,1,000rpm/min(转/分钟)离心5min(分钟),弃上清,加入400μl×annexinv(膜联蛋白-v-异硫氰酸荧光素/碘化丙啶)结合液,轻轻重悬细胞;⑸5μlannexinv-fitc(膜联蛋白-v-异硫氰酸荧光素)染色加入的细胞悬液中,轻轻混匀;⑹避光4℃孵育15min(分钟);⑺加入10μlpi(10微升碘化丙啶)染色液,轻轻混匀;⑻避光4℃孵育5min(分钟);⑼随即进行激发波长为488nm(纳米)的流式细胞仪检测,annexinv-fitc(膜联蛋白-v-异硫氰酸荧光素)为绿色荧光信号,波长620nm(纳米)激发的pi(碘化丙啶)为红色荧光信号。2.6westernblot(蛋白质印迹)法(1)蛋白上样及电泳a.将配好的凝胶与电泳槽组装好放到电泳槽中,加入电泳液,向孔内按照顺序依次加入,5μl(微升)的蛋白marker(标签)和10μl(微升)的相应组别样品;b.电泳:以65v(伏)电压,使蛋白样品过浓缩凝胶和分离凝胶的临界点后,将电压升至180v(伏),marker(标签)电泳至玻璃板底部绿线时,立即终止电泳;(2)蛋白转至pvdf(聚偏氟乙烯)膜a.准备工作:选择适合分子大小的pvdf膜(聚偏氟乙烯)(0.22μm(微米)或者0.45μm(微米))、厚滤纸、无水乙醇、牛奶封闭液等;b.剪好合适大小面积的pvdf(聚偏氟乙烯)膜,无水乙醇激活2-3min(分钟),用电转液完全浸湿滤纸,c.将玻璃板轻轻撬开,按marker(标签)提示,切胶备用。从“+”开始,依次为厚滤纸一层→pvdf(聚偏氟乙烯)膜→样品胶→厚滤纸一层→海绵垫片(注意:各层中间不可有气泡),扣紧转膜夹板,放入加满电转液的电泳槽中,将槽放入4℃冰箱中,600ma(毫安)60min(分钟)转膜;(3)封闭:取出pvdf(聚偏氟乙烯)膜,置于5%脱脂奶粉封闭2h(小时)左右;(4)孵育一抗:pbst(吐温-20的磷酸盐缓冲液)洗膜10min(分钟)×3。用pbst(吐温-20的磷酸盐缓冲液)将一抗稀释至抗体说明书推荐的最佳浓度,一抗覆盖膜,4ºc水平摇床上过夜;(5)孵育二抗:回收一抗,pbst(吐温-20的磷酸盐缓冲液)洗膜10min×3,将未结合的一抗完全洗去。按抗体说明书,加入二抗(稀释比通常为1∶5000),室温孵育2h(小时);(6)曝光及凝胶图像分析:根据实验室条件,二抗也可回收。pbst(吐温-20的磷酸盐缓冲液)洗10min(分钟)×3。显影液按照a∶b=1∶1避光混合,将显影液均匀的滴洒在平整的,放置于显影板上的pvdf(聚偏氟乙烯)膜上,立即曝光;(7)在曝光完成后,通过凝胶图象处理系统分析条带的光密度值,以目的与相对应内参的比值,来反应蛋白的相对表达水平。3.统计学处理所有涉及到的数据均采用graphpadprism5.0(图片处理软件)进行统计学处理。数据以均数±标准差()表示。两样本均数间比较采用两样本独立t检验,多样本均数间比较采用one-wayanova(单因素方差分析)检验,组间的两两比较采用student-newman-keuls(纽曼-科伊尔斯检验)检验,以p<0.05为差异有显著性。影像学诊断as(动脉粥样硬化)的特异性、敏感性等指标进行评价。4.结果4.1cbs+/-(胱硫醚-β-合成酶基因敲除小鼠杂合子)小鼠中ast与alt(冬氨酸转移酶与丙氨酸转移酶)显著增加与cbs+/+(胱硫醚-β-合成酶基因敲除小鼠野生型)组相比。(见图1)4.2cbs+/-(胱硫醚-β-合成酶基因敲除小鼠杂合子)小鼠中kdelreceptor(赖-天冬-谷-亮氨酸受体)表达量显著高于cbs+/+(胱硫醚-β-合成酶基因敲除小鼠野生型)组的表达。(见图2)4.3cbs(胱硫醚-β-合成酶)小鼠对照组和实验组组候蛋白标志物表达及验证,通过westernblot(免疫印迹)和q-pcr(实时荧光聚合酶链式反应)分析发现psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)在cbs+/-+hmd(胱硫醚-β-合成酶基因敲除小鼠杂合子喂养高蛋氨酸饮食)组中高表达(**p<0.05)。(见图3)4.4人源肝细胞中psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)在hcy(同型半胱氨酸)刺激后,结果显示,hcy(同型半胱氨酸)作用肝细胞后,psmd10mrna(26s蛋白酶体非腺嘌呤核苷三磷酸酶信使单链核糖核酸)和蛋白表达明显增加,(*p<0.05)。(见图4)4.5psmd10sirna(26s蛋白酶体非腺嘌呤核苷三磷酸酶小分子干扰片段)转染细胞后检测肝细胞中凋亡相关蛋白的含量及表达改变结果显示psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)敲低后cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)的表达显著降低与hcy(同型半胱氨酸)组比。(见图5)4.6psmd10sirna(26s蛋白酶体非atp酶小分子干扰片段)转染细胞流式细胞术检测肝细胞肝细胞凋亡,psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)敲低后,肝细胞凋亡率显著降低。(图6)5.结论同型半胱氨酸作为肝脏损伤的重要危险因子,肝脏的稳态依赖于细胞生长和细胞死亡之间的关键性平衡,研究表明psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)在hhcy(高同型半胱氨酸血症)组中表达显著增加,凋亡等相关蛋白cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)的表达在hhcy(高同型半胱氨酸血症)中也显著增加,肝细胞在干扰了psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶)后凋亡等相关蛋白cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12),以及流式细胞术检测显示,hcy(同型半胱氨酸)引起的肝细胞凋亡显著降低,psmd10(26s蛋白酶体非腺嘌呤核苷三磷酸酶),cleavedcaspase3(含半胱氨酸的天冬氨酸蛋白水解酶3)和cleavedcaspase12(含半胱氨酸的天冬氨酸蛋白水解酶12)构成的hhcy(高同型半胱氨酸血症)诱导肝脏损伤的相关的特异性靶蛋白对肝损伤的的诊断特异性和灵敏性均较高,依靠肝脏组织中特异性的靶标蛋白评估和诊断hhcy(高同型半胱氨酸血症)诱导的肝损伤是可靠的。以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本
技术领域:
的技术人员在本发明披露的技术范围内,可显而易见地得到的技术方案的简单变化或等效替换均落入本发明的保护范围内。psmd10、gapdh((26s蛋白酶体非腺嘌呤核苷三磷酸酶),内参)引物序列geneprimersequence,5'to3'gapdhf:ggtgaaggtcggtgtgaacgr:ctcgctcctggaagatggtghumpsmd10f:gaactgaccaggacagcagaactgr:agcagaagccgcaatatgaagaggf:forwardandr:reverse(前向引物,后向引物)psmd10sirna(26s蛋白酶体非atp酶小分子干扰片段)序列基因名称sense(5'-3')antisense(5'-3')psmd10-homo-373gccgggaugagauuguaaattuuuacaaucucaucccggcttpsmd10基因序列(cds区(外显子区))atggaggggtgtgtgtctaacctaatggtctgcaacct61ggcctacagcgggaagctggaagagttgaaggagagtattctggccgataaatccctggc121tactagaactgaccaggacagcagaactgcattgcactgggcatgctcagctggacatac181agaaattgttgaatttttgttgcaacttggagtgccagtgaatgataaagacgatgcagg241ttggtctcctcttcatattgcggcttctgctggccgggatgagattgtaaaagcccttct301gggaaaaggtgctcaagtgaatgctgtcaatcaaaatggctgtactcccttacattatgc361agcttcgaaaaacaggcatgagatcgctgtcatgttactggaaggcggggctaatccaga421tgctaaggaccattatgaggctacagcaatgcaccgggcagcagccaagggtaacttgaa481gatgattcatatccttctgtactacaaagcatccacaaacatccaagacactgagggtaa541cactcctctacacttagcctgtgatgaggagagagtggaagaagcaaaactgctggtgtc601ccaaggagcaagtatttacattgagaataaagaagaaaagacacccctgcaagtggccaa661aggtggcctgggtttaatactcaagagaatggtggaaggttaa。序列表<110>宁夏医科大学总医院<120>与肝脏损伤、肝细胞凋亡相关特异蛋白分子标志物筛选方法<140>2019113543348<141>2019-12-25<160>2<170>siposequencelisting1.0<210>1<211>524<212>dna<213>psmd10-(非atp酶蛋白酶体26s亚基10)(human)<400>1aggagggggggcaaccaaggcgcaaccggccacagcgggaagcggaagaggaaggagaga60cggccgaaaacccggcacagaacgaccaggacagcagaacgcagcacgggcagccagcgg120acaacagaaaggaaggcaacggaggccaggaagaaaagacgagcaggggcccccaagcgg180ccgcggccgggagagagaaaagccccgggaaaagggccaaggaagcgcaacaaaaggcga240ccccacaagcagccgaaaaacaggcagagacgcgcagacggaaggcggggcaaccagagc300aaggaccaagaggcacagcaagcaccgggcagcagccaagggaacgaagagacaacccga360cacaaagcaccacaaacaccaagacacgagggaacaccccacacagccggagaggagaga420gggaagaagcaaaacgcgggcccaaggagcaagaacagagaaaaagaagaaaagacaccc480cgcaagggccaaaggggccgggaaaccaagagaaggggaaggaa524<210>2<211>49<212>dna<213>psmd10(human)<400>2gaactgaccaggacagcagaactgragcagaagccgcaatatgaagagg49当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1