一种镁铁氧/碳复合材料及其制备方法与流程
本申请涉及了一种可作为锂离子电池负极材料的碳复合材料的制备方法及其锂电性质检测,特别是一种碳复合镁铁氧材料的制备方法及其应用,其作为锂电负极材料表现出高倍率、循环稳定的特点。
背景技术:
目前金属氧化物作为锂离子负极材料是一个热门的研究课题(其理论比容量高达1000mAh/g,而传统石墨类负极材料,理论比容量仅为372mAh/g),但是其自身存在一定的缺陷从而限制其应用。
氧化物作为锂电负极材料,如单纯的氧化铁,在循环过程中,相当于是氧化铁与金属铁颗粒之间的充放电行为,即电池一次循环前后的物相发生变化,由此导致材料结构坍塌,循环性逐步变差。目前最有效的方法是在氧化物颗粒表层包覆一层导电碳,此碳层可阻止氧化物之间的聚集,也可作为氧化物的支撑体,保持其微观形貌不变;再次,碳包覆层具有极好的导电性,可以提高材料的高倍率充放电性能,这一改进途径得到研究人员的普遍认同。
人们认为包覆碳材料主要改变的是材料表面的结构特征,为使得材料的颗粒内部也得到相似的改进,研究人员发现利用两种甚至多种金属的协同作用,可以改良材料的活性和结构稳定性。此类多元氧化物在循环过程中,伴随锂离子的嵌入/脱出,生产相应的氧化物。如铜铁氧材料,初始材料为CuFe2O4纯相,电池首先放电,发生如下反应(1-2);首次充电,发生(3-4)反应,以上为第一个循环结束。电池继续循环,则只是(3-4)的反应,即后续反应为氧化物与其相应金属的相互转化。
CuFe2O4+nLi--ne-→LinCuFe2O4 (1)
LinCuFe2O4-(8-n)Li-+(8-n)e-→xCu0+(2-x)Fe0+FexCu1-x+4Li2O(0≤n.x≤1) (2)
目前,为得到多元氧化物以及碳复合/碳包覆结构,研究人员一般采取的实验方案如下:
A.固相合成法,如CuFe2O4,先通过球磨混合原材料,后需要通入惰性气体:如氮气。(参考文献:One-step solid state reaction to selectively fabricate cubic and tetragonal CuFe2O4anode material for high power lithium ion batteries)。
B.溶胶-凝胶法,先制备均一溶液,经处理形成凝胶后,在氮气中高温煅烧(Combustion synthesis of MgFe2O4graphene nanocomposite as a high-performance negative for lithium ion batteries)。
C.溶剂热法,镁盐和铁盐在EG中混合,额外加入少量添加剂,200度溶剂热反应。但报道的循环次数仅为70次(Hollow spheres of MgFe2O4as anode material for lithium-ion batteries)。
D.溶胶-凝胶法:硝酸铁和硝酸镁以及柠檬酸形成凝胶后,经过三步热处理才可得到产物(MgFe2O4nanoparticles as anode materials for lithium-ion batteries)。
E.共沉淀法,先制备二元前驱体,随后高温煅烧得到产品。包覆碳材料,需再将产物与传统固体碳源混合,高温碳化(Preparation of carbon-coated MgFe2O4with excellent cycling and rate performance)。
F.微波辅助法,使用氧化石墨烯为碳材料。氧化石墨烯价格昂贵,此方法反应复杂(MgFe2O4reduced graphene oxide composites as high-performance anode materials for sodium ion batteries;微波催化剂MgFe2O4-Fe2O3微波催化氧化降解结晶紫废水_高令飞)。
通过以上的实验流程可以看出,目前很多研究工作可以在一定程度是提高材料导电性、放电比容量等性能,但是多数实验过程较为复杂,有时需要通特殊气体,这些都会增加合成成本。与碳材料复合,甚至需要更多的步骤,这就导致材料合成路线较为复杂、产量低、成本高的局面。
技术实现要素:
为了克服现有技术中合成过程复杂,特别是碳复合过程,甚至需要使用惰性气体,产量低、成本高的问题,本发明提供一种镁铁氧/碳复合材料的制备方法,将铁源、镁粉、液体碳源混合,转移到密闭反应容器内,密封并置于坩埚炉中,在550-650℃下反应8-12h,从而得到复合产物。
与现有技术中利用两种金属的盐类相互混合,再进行处理的方式不同,本发明利用金属镁粉的还原性,Mg与液体碳源如乙醇在密闭条件下反应,Mg转化为碳酸镁或氧化镁,乙醇除释放出气体,本身部分转化为碳材料,而原材料中的硝酸铁(铁盐),分解为氧化铁。即镁粉、乙醇、铁盐同时反应,生产的氧化镁与氧化铁形成均一相镁铁氧,乙醇形成的碳层恰好包覆在颗粒表面。在此过程中,氧化镁与氧化铁的同步合成,在生成二元氧化物颗粒时,同步热解碳源(乙醇)得到碳包覆层,两种物质在化学反应的气氛下相互依附,碳包覆层与二元氧化物颗粒形成理想的核壳结构,一步构建碳复合材料。
反应的方程式为:
Mg+CH3CH2OH→2C+MgO+3H2↑
4Fe(NO3)3=2Fe2O3+l2NO2↑+3O2↑
MgO+Fe2O3=MgFe2O4
总反应为:
2Mg+2CH3CH2OH+4Fe(NO3)3→2MgFe2O4/C+2C+6H2↑+l2NO2↑+3O2↑
碳复合过程是碳复合材料合成中的很重要的过程。目前,多数报道的碳复合过程需要2步或多步来实现,如(上述参考文献中的E和F)。相较于我们的一步制备要复杂很多。目前诸多报道得到碳材料,都需要在特殊的惰性气氛下进行,此法耗能、耗气、产量低,且得到的碳材料导电性比密闭容器内得到的碳材料要低很多。
同时氧化物的结晶度越好,说明其微观晶体缺陷少,对电化学性能也有积极影响。在提高材料结晶度方面,有报道是:首先合成氧化物的前驱体或是结晶度较差的氧化物,在高温下将其退火,从而达到提高结晶度的目的,如(上述参考文献中的B和D)。而我们的工作是将原料置于反应容器内,一次性升温到固定温度,即可得到结晶度良好的氧化物颗粒。
本发明材料需要一步反应即可合成。常规碳复合过程,是将得到的氧化物颗粒与碳材料混合,这属于单纯混合,氧化物与碳材料之间只是表面接触。本发明的碳复合材料是从原材料角度混合,在一个密闭的反应容器内,分子间相互接触反应得到的产品。因此,氧化物颗粒与碳层的接触更均匀,通过透射电镜可以看到所有的镁铁氧颗粒的表层都均匀覆盖一层碳膜,且厚薄均匀。再次,一般低温(200度左右)得到的氧化物都需要高温(一般大于500度)退火过程,这一过程不仅除去氧化物内部的少量水分,还可以提高其结晶度。本发明中,控制反应温度从室温直接升高到600度,直接得到结晶度极好的氧化物颗粒。制备方法简单,只需要注意反应容器的密封性,不需任何特殊气氛的辅助,实验过程简便,可操作性强,仅一步即可得到产品。
优选的是:铁源选自硝酸铁、氯化铁等三价铁源的至少一种。
优选的是:液体碳源为无水乙醇、乙醚,丙酮,乙二醇等的至少一种。
优选的是:铁和镁的摩尔比为2-2.5∶1-1.5。
优选的是:液体碳源的体积与镁的摩尔数比例为0.1-0.5mol/L。
优选的是:铁源、镁粉、液体碳源混合条件为室温下超声混合30min。
优选的是:坩埚炉中的升温速率为6-8℃/min。
优选的是:复合产物经水和醇的混合溶液洗涤后,60-80℃下烘干4-10h。
本发明还提供采用上述方法制备的一种镁铁氧/碳复合材料,碳的存在形式包括碳包覆层和碳球,碳包覆层彼此连接呈现三维立体构型,均匀包覆在镁铁氧化物颗粒表面,使得氧化物颗粒不再长大,维持在颗粒尺寸很小的程度,呈圆形,相对较稳定。氧化物是很容易聚集长大的,特别是含铁的氧化物,由于具有磁性,产品会长到微米级,如果没有碳层的包覆,铁氧化物易聚集形成较大的八面体或无规则聚集体,本发明中,碳层的包覆,可以很快隔绝氧化物颗粒之间的聚集。
镁铁氧化物颗粒直径为30-80nm,碳球直径为微米级,碳包覆层厚度为7-9nm,碳包覆层和碳球的质量比为1∶8-10。
与现有技术不同的是,本发明的镁铁氧材料在循环过程中产生MgO和氧化铁,其中氧化镁主要作为氧化铁颗粒的支撑体,维持氧化铁的微观形貌,不参与充放电行为(氧化镁不作为锂电负极材料,因此不参与充放电)。由此,氧化镁的存在从复合材料的内部起到稳定结构的作用,使得产物的循环稳定性极高。
本发明中的碳材料为碳层和碳球,两者均起到稳定材料的作用,但是侧重点不同:
碳包覆层较薄,其在实验产品生成过程中,可以控制镁铁氧颗粒的大小。如果镁铁氧的颗粒较大,其在电池的充放电过程中,结构坍塌很严重,同时也不利于锂离子的输送。因此碳包覆层的作用很重要,纳米级的碳包覆层既可以限制镁铁氧颗粒大小,又能作为导电材料快速传输电子,提高材料的放电比容量和循环寿命。
碳球颗粒较大,可防止活性颗粒聚集,本身也可作为材料提供容量,并可作为活性颗粒的依附体,防止活性颗粒坍塌,起到稳定结构的作用。因此,碳球本身一方面提供放电容量,同时也起到延长材料循环寿命的作用。
碳包覆镁铁氧及碳球的存在使得该复合材料作为锂离子电池负极材料时,放电容量和循环寿命均有极大提升。
附图说明
图1是实施例1的EDX图
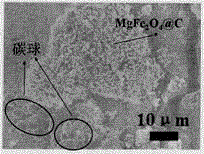
图2是实施例1的MgFe2O4@C产品扫描电镜图
图3是实施例1的碳包覆层扫描电镜图
图4是实施例1的MgFe2O4@C产品透射电镜图
图5是实施例1的碳包覆层透射电镜图
图6-7均为实施例1的是MgFe2O4@C产品的高分辨透射图
图8-9是实施例1和6的热重分析图(图8中乙醇为10ml,为实例1的热重;图9中乙醇为5ml,为实例6的热重)图10为实施例1-3的XRD衍射图
图11是实施例4-5的XRD衍射图
图12是实施例3和6的XRD衍射图
图13-16分别为实施例7-10的XRD衍射图
图17-18是实施例1的恒流充放电循环图(图17为电流倍率100mA/g的充放电比容量,图18为变化倍率,倍率依次为:0.1C-0.2C-0.5C-1C-1.5C-2C-2.5C-2C-1.5C-1C-0.5C-0.C(1C=1000mA/g))
图19-20是实施例1的恒流充放电循环图(图19为电流倍率1000mA/g的充放电比容量,图20为3000mA/g的充放电比容量;说明:传统石墨的理论容量:372mAh/g;镁铁氧化物的的理论容量:~1000mAh/g。)
具体实施方式
下面将结合附图对本发明中具体实施例作进一步详细说明。
Mg粉用量为0.02-0.056g,得到纯相产品,可恰好匹配:PCPDF标准卡片号:88-1936。
实施例1:称取一定量的2.0130g Fe(NO3)3·9H2O和金属镁粉0.0560g,倒入10ml无水乙醇。室温下超声30min,转移并密封到容积为20ml的高温反应釜内。将反应釜置于坩埚炉中,以6℃/min的升温速率升到600℃,保持10h,等反应釜自然冷却后,收集产品,并用去离子水和无水乙醇的混合溶液洗涤3次,在70℃的干燥箱内干燥6h,得到黑色粉末产品(MgFe2O4@C,XRD,图10)。
实施例2:称取一定量的2.0154g Fe(NO3)3·9H2O和金属镁粉0.0325g,倒入10ml无水乙醇。后续过程同实例1,得到纯相产品,XRD。
实施例3:称取一定量的2.0155g Fe(NO3)3·9H2O和金属镁粉0.0287g,倒入10ml无水乙醇。后续过程同实例1,得到纯相产品,XRD。
Mg粉用量大于0.056g,得到的产品中含有碳酸镁(MgCO3)杂质,对应碳酸镁标准卡片08-0479中的401晶面。
实施例4:称取一定量的2.0558g Fe(NO3)3·9H2O和金属镁粉0.1194g,倒入10ml无水乙醇。后续过程同实例1,得到含有碳酸镁杂质的产品,XRD证实,见图11。
实施例5:称取一定量的2.0023g Fe(NO3)3·9H2O和金属镁粉0.0726g,倒入10ml无水乙醇。后续过程同实例1,得到含有碳酸镁杂质的产品,XRD证实,见图11。
乙醇用量范围:5-10ml,对产品纯度,镁铁氧颗粒尺寸以及碳层厚度影响不大,对于产品中碳含量影响也较小(见图8-9,热重分析碳含量),与实例2相比。
实施例6:称取一定量的2.0141g Fe(NO3)3·9H2O和金属镁粉0.0338g,倒入5ml无水乙醇。后续过程同实例1,得到纯相产品,XRD见图12。
实施例7:铁源为FeCl3·6H2O(1.330g,4.92mmol),镁粉(0.0308g),乙醇6ml(乙醇用量影响不大,10ml的结果与6ml的基本一致)。后续过程同实例1,产品为纯相的镁铁氧。XRD见图13。
实施例8:铁源为硝酸铁(2.058g),镁粉(0.032g),乙醚5ml(10ml的结果与5ml的基本一致)。后续过程同实例1,产品中含有少量碳酸镁杂质,通过调节镁粉的用量去除。XRD见图14。
实施例9:铁源为硝酸铁(2.007g),镁粉(0.031g),丙酮5ml(10ml的结果与5ml的基本一致)。后续过程同实例1,产品为纯相的镁铁氧。XRD见图15。
实施例10:铁源为硝酸铁(2.038g),镁粉(0.032g),乙二醇5ml(10ml的结果与5ml的基本一致)。后续过程同实例1,产品为纯相的镁铁氧。XRD见图16。
本申请的复合材料结合了任一物相单独存在时的优势,且同时避免了各自物相的缺点。比如,碳材料作为锂电负极材料,具有极高的导电率和循环稳定的优势,但其放电比容量较低(其理论比容量有限,为372mAh/g);镁铁氧材料,具有较高的比容量(其理论比容量:~1000mAh/g),但循环性能较差。我们构建的复合材料经过测试发现,不仅具有较高的放电比容量,同时循环上千次后,容量保持率较高,是一类极具潜力的高倍率、长寿命的锂电负极替代材料。本申请使用的物料种类少,成本低廉且对环境友好;产品极易制备,可操作性强,易于大规模成产。
将产品与乙炔黑、PVDF粉末混合,制作成负极极片;在手套箱内组装扣式锂电电池。进行恒流充放电行为测试,如图17-20所示。
图17说明,材料在电流倍率为100mA/g时的充放电循环性能,容量有逐渐上升的趋势(循环60次后,放电比容量为941mAh/g,是理论比容量的94%)且上升平稳,说明材料结构逐渐稳定。
图18说明,材料的结构很稳定,即使经过大倍率放电(2.5C=2500mA/g)后,回到小倍率(0.1C)时,材料依然与初始的放电容量相近(920mAh/g),且库伦效率几乎为99.9%,说明其结构的稳定。
图19-20是电池更高电流倍率下的循环性能表现。图19为电流倍率1000mA/g的充放电比容量,图20为3000mA/g的充放电比容量。在2种较高电流倍率下,电池放电比容量平缓稳定,分别循环650次和1000次,容量稳定在665mAh/g和440mAh/g,其容量普遍高于目前的报道;且循环寿命也达上千次不衰减。
产品中镁、铁、氧、碳四种元素的存在,可由EDX图说明,如图1所示。
通过扫描电镜和透射电镜,分析复合材料表面结构和核壳结构:
图2可看到产品中有较大的碳球(黑色圆圈处),以及较小的碳包覆镁铁氧颗粒;图3为方便观察核壳结构,产品中的镁铁氧颗粒已经由盐酸洗掉。
如图2中,可看到产品中有较大的碳球(黑色圆圈处),碳球:5-7μm;以及较小的碳包覆镁铁氧颗粒。为方便观察核壳结构,我们用盐酸洗去产品中的镁铁氧颗粒,剩余碳包覆层和碳球,并经过超声,检测扫描。其中碳包覆层可由图3看到,有明显的空洞现象,空心处为原本的镁铁氧颗粒,这是因为碳复合氧化物经由酸浸泡后,镁铁氧与酸反应生产可以溶于水的镁离子和铁离子,只剩余碳材料沉淀下来,如碳层和碳球。
乙醇产生的碳材料有两种,一种是大的碳球,另一种就是碳层,这种碳层可以通过透射图片清晰的观察到。因为在密闭容器内,氧气有限,因此,乙醇没有全部分解为气体,而是部分发生碳化。同时,炉温上升很快,氧化物的产生与乙醇的分解和碳化几近是同步进行,由此镁铁氧颗粒恰好形成,而碳层也在覆盖镁铁氧表面的同时,抑制了镁铁氧颗粒的长大,控制在50nm左右。
碳材料有两种形貌:碳包覆层:7-9nm厚度,碳包覆镁铁氧颗粒平均尺寸为50nm(见透射图,图4-5,图4可以很清晰的看到均一的碳层;图5为方便观察,镁铁氧颗粒已经由盐酸洗掉,因此图片中碳层为空心结构)。图4为MgFe2O4@C产品,图5为碳包覆层,材料微观上呈现三维碳包覆结构,其中MgFe2O4颗粒均匀嵌入碳层的内部,彼此通过碳层连接(见图4)。图6-7均为MgFe2O4@C产品的高分辨透射图片,碳层厚度为7-9nm。
采用热重分析法测试碳含量,图8中乙醇为10mL,图9中乙醇为5mL,碳百分含量分别为56.94%和53.27%,说明实验中乙醇用量对于碳含量的影响不是很大。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种纳米银/氧化石墨烯复合材料分散液及其制备方法和应用与制造工艺
- 四氧化三钴/石墨烯复合材料(Co3O4/N‑RGO)的制备方法及应用与制造工艺
- 一种添加纳米氧铁体石墨烯复合材料的氯磺化聚乙烯防腐涂料的制造方法与工艺
- 磁性四氧化三铁/石墨烯复合材料的制备及其在制备磁性油漆中的应用的制造方法与工艺
- 一种利用掺氮氧化石墨烯/TiO2复合颗粒增强抗污染性的超滤膜的制备方法与制造工艺
- 一种制备聚合物/还原氧化石墨烯复合材料的方法与制造工艺
- 一种氧化石墨烯‑喹诺酮复合材料的制造方法与工艺
- 基于微波还原剥离氧化石墨烯或其复合物的高效催化宏量制备方法与制造工艺
- 一种聚丙烯接枝氧化石墨烯复合材料的制备方法
- 一种氧化石墨烯改性热塑性淀粉复合材料及其制备方法