锂二次电池的制作方法
本公开涉及锂二次电池。
背景技术:
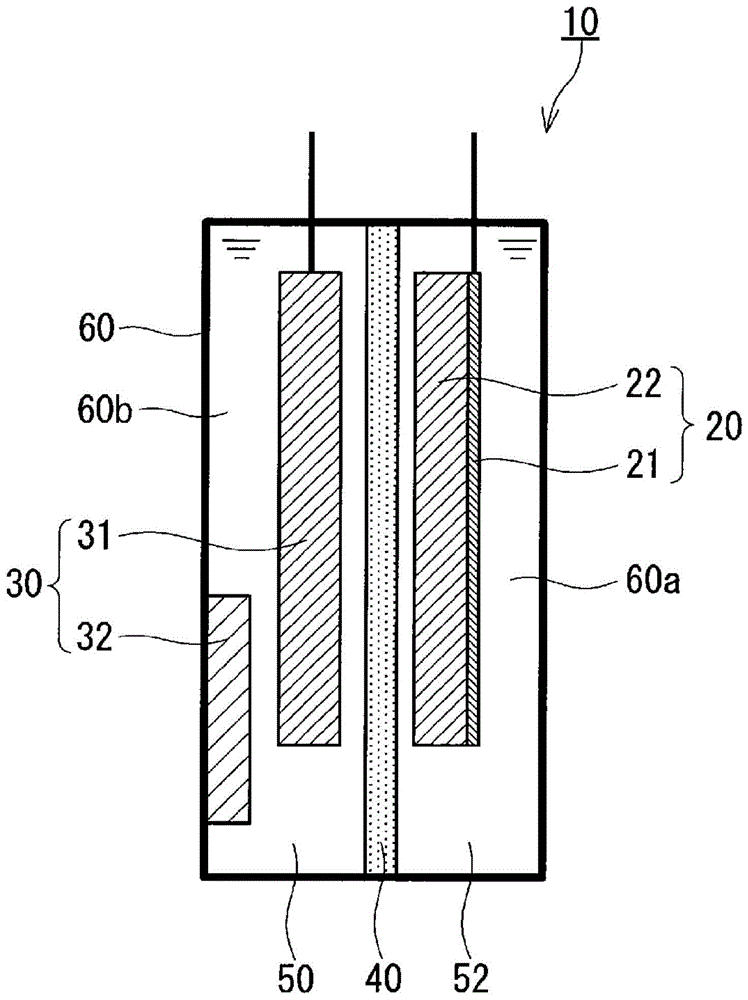
:锂二次电池的特性会根据活性物质的种类而变化。例如,如果使用锂金属作为负极活性物质,则能够得到高的能量密度的锂二次电池。但如果使用锂金属作为负极活性物质,在锂二次电池的充电时锂金属呈枝晶状析出,有时会引起内部短路。析出的锂金属以原子团的形态生成,因此非常活跃。析出的锂金属与电解液溶剂反应,一部分成为惰性的有机锂化合物,因此存在充放电效率降低之类的课题。为了抑制与溶剂的反应性,研究了各种溶剂种类,但没有发现值得注意的优秀的溶剂。另一方面,如果使用石墨作为负极活性物质,则能够在充电时防止锂金属呈枝晶状析出。锂离子插入石墨的层间的反应以及锂离子从石墨的层间脱离的反应是局部规整反应,可逆性优异。由于存在这样的优点,使用石墨作为负极活性物质的锂二次电池被实用化。但锂离子插入石墨层间的反应大大受到电解液溶剂的影响。锂二次电池,从电位窗的宽度(耐还原性、耐氧化性)、粘度、溶解有锂盐的情况下的离子导电性等出发,通常使用碳酸酯作为溶剂,但是,将碳酸亚丙酯、碳酸亚丁酯等的一个氢原子用烷基置换得到的环状碳酸酯会发生溶剂的分解,无法进行锂离子的插入。另一方面,没有发生置换的碳酸亚乙酯、或由卤素置换得到的氯代碳酸亚乙酯、氟代碳酸亚乙酯、链状碳酸酯能够进行锂离子的插入。在先技术文献专利文献1:日本特许第4898737号公报专利文献2:日本特许第3733065号公报技术实现要素:发明要解决的课题锂金属的理论容量密度为3884mah/g。与此相对,石墨的理论容量密度为372mah/g,是锂金属的理论容量密度的大约1/10。实际的锂二次电池中的石墨的容量密度也接近理论容量密度,难以进一步增加使用石墨作为负极活性物质的锂二次电池的容量。作为取代石墨的负极活性物质,与锂形成合金的材料备受关注。作为与锂形成合金的材料,已知铝、硅、锡等。这些材料的理论容量密度比石墨的理论容量密度大得多。但是,使用这些材料的锂二次电池存在充放电的可逆性低之类的课题。本公开提供一种使用这些与锂形成合金的材料且具有优异的可逆性的锂二次电池。用于解决课题的手段本公开提供一种锂二次电池,其具备正极、负极、隔膜和电解液,所述负极具有负极集电体和负极活性物质,所述隔膜配置于所述正极与所述负极之间,所述电解液与所述负极接触,所述正极具有正极集电体和配置在所述正极集电体上的正极活性物质层,所述负极包含在充电时与锂形成合金的材料,所述电解液包含锂离子及其抗衡阴离子,所述电解液含有选自菲、联苯、三亚苯、苊、苊烯、荧蒽和偶苯酰中的至少一者,所述电解液包含选自环状醚、甘醇二甲醚和环丁砜中的至少一者作为溶剂。发明的效果根据本公开,能够提供一种具有优异的可逆性的锂二次电池。附图说明图1是本公开的一实施方式涉及的锂二次电池的概略截面图。图2是本公开的实施例涉及的电位测定用电池单元的概略截面图。图3是表示电位测定用电池单元1~9中,三甘醇二甲醚的体积相对于电解液的溶剂的体积的比例与电位测定用电池单元的电位的值之间的关系的图表。图4a是表示电池10的充放电特性的图表。图4b是投入到电池10之前的铝的图像。图4c是投入到电池10之后的铝的图像。图5是表示电池18的充放电特性的图表。具体实施方式(成为本公开的基础的见解)如果使用铝、硅、锡等材料作为锂二次电池的负极活性物质,则这些材料在充电时电化学地与锂形成合金。本说明书中,也将与锂形成合金的这些材料称为“合金化材料(alloyingmaterial)”。使用合金化材料的负极,在吸藏锂时膨胀,在释放锂时收缩。如果反复膨胀和收缩,则合金化材料微粉化,从负极集电体剥离。即使合金化材料滞留在负极内,也无法达成合金化材料与负极集电体的电接触,难以进行充放电。也就是说,如果在充电时膨胀,则该时刻几乎全部活性物质的部位都会与集电体分离,几乎无法放电。该现象是使用合金化材料的锂二次电池的可逆性变差的主要原因。该现象与电解液溶剂完全无关,因此即使改变溶剂种类,也观察不到可逆性的提高。本发明人认真研究了用于克服由合金化材料的充放电机制导致的上述课题。其结果,完成了以下所示的本公开的锂二次电池。(本公开涉及的一个技术方案的概要)本公开的一个技术方案涉及的锂二次电池,具有以下结构。具备正极、负极、隔膜和电解液,所述负极具有负极集电体和负极活性物质,所述隔膜配置于所述正极与所述负极之间,所述电解液与所述正极和负极接触,所述正极具有正极集电体和配置在所述正极集电体上的正极活性物质层,所述负极包含在充电时与锂形成合金的材料,所述电解液包含锂离子及其抗衡阴离子,所述电解液含有选自菲、联苯、三亚苯、苊、苊烯、荧蒽和偶苯酰中的至少一者,所述电解液包含选自环状醚、甘醇二甲醚和环丁砜中的至少一者作为溶剂。根据以上的技术方案,即使负极活性物质微粉化,也能够经由选自菲、联苯、三亚苯、苊、苊烯、荧蒽和偶苯酰中的至少一者切实地进行锂二次电池的充放电。例如,能够提供一种使用高容量的合金化材料作为负极活性物质并且具有高的能量密度和优异的可逆性的锂二次电池。所述环状醚可以包含选自2-甲基四氢呋喃、四氢呋喃、1,3-二氧戊环和4-甲基-1,3-二氧戊环中的至少一者。由此,能够提供具有优异的可逆性的锂二次电池。所述甘醇二甲醚可以包含选自单甘醇二甲醚、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚和聚乙二醇二甲醚中的至少一者。由此,能够提供具有优异的可逆性的锂二次电池。所述环丁砜可以包含3-甲基环丁砜。由此,能够提供具有优异的可逆性的锂二次电池。所述负极活性物质可以包含al,可以在充电时生成lial合金,所述lial合金的组成可以是选自lial、li2al3和li4al5中的至少一者。所述负极活性物质可以包含zn,可以在充电时生成lizn合金,所述lizn合金的组成可以是选自li2zn3、lizn2、li2zn5、lizn4和lizn中的至少一者。所述负极活性物质可以包含si,可以在充电时生成lisi合金,所述lisi合金的组成可以是选自li22si5、li13si4、li7si3和li12si7中的至少一者。所述负极活性物质可以包含sn,可以在充电时生成lisn合金,所述lisn合金的组成可以是选自li22sn5、li7sn2、li13sn5、li7sn3、li5sn2、lisn和li2sn5中的至少一者。所述负极活性物质可以包含ge,可以在充电时生成lige合金,所述lige合金的组成可以是选自li5ge22和li3ge中的至少一者。所述负极活性物质可以包含cd,可以在充电时生成licd合金,所述licd合金的组成可以是选自licd3和li3cd中的至少一者。所述负极活性物质可以包含bi,可以在充电时生成libi合金,所述libi合金的组成可以是选自libi和li3bi中的至少一者。根据以上的技术方案,能够得到具有高的能量密度的锂二次电池。所述隔膜可以包含选自固体电解质、凝胶电解质、离子交换树脂膜、半透膜和多孔质摸中的至少一者。由此,能够充分地担保锂二次电池的安全性。所述负极活性物质可以以与所述负极集电体分离的方式配置。由此,能够提高设计负极集电体和负极活性物质的形状和尺寸等时的自由度。以下,参照附图对本公开的实施方式进行说明。本公开不限定于以下的实施方式。(实施方式)图1表示本公开的一个实施方式涉及的锂二次电池的截面。锂二次电池10具备正极20、负极30、隔膜40和第1电解液50。隔膜40配置于正极20与负极30之间。第1电解液50包含溶剂和负极介体,并与负极30接触。在第1电解液50的溶剂中溶解负极介体。负极30具有负极集电体31和负极活性物质32。负极30中的负极活性物质32的氧化还原反应经由负极介体进行。锂二次电池10,即使负极活性物质32微粉化也能够经由负极介体切实地进行充放电。例如,能够提供使用高容量的合金化材料作为负极活性物质32并且具有高的能量密度和优异的循环特性的锂二次电池10。通过使用平衡电位(vs.li/li+)较低的活性物质作为负极活性物质32,能够使用平衡电位(vs.li/li+)较低的物质作为负极介体。作为负极活性物质32的平衡电位较低的活性物质例如为铝。作为负极介体的平衡电位较低的物质例如为稠合芳香族化合物。由此,能够实现电位更低的锂二次电池10的负极30。因此,能够实现具有高的电池电压的锂二次电池10。锂与负极活性物质32的化合物可以是合金,也可以是c6li之类的石墨层间化合物。本实施方式的锂二次电池10,可以在第1电解液50中溶解锂。负极活性物质32可以是具有吸藏和释放锂的性质的物质。在锂二次电池10的充电时,负极介体在负极集电体31的表面上被还原。被还原了的负极介体被负极活性物质32氧化。负极活性物质32吸藏锂。在锂二次电池10的放电时,吸藏了锂的负极活性物质32将负极介体还原,并且释放锂。被还原了的负极介体在负极集电体31的表面上被氧化。负极活性物质32例如具有可逆地吸藏和释放锂和/或锂离子的性质。由此,负极活性物质32的材料设计更容易。并且,能够实现更高的容量。本实施方式的锂二次电池10的充电时,负极介体可以在负极集电体31的表面上被还原。本实施方式的锂二次电池10的放电时,负极介体可以在负极集电体31的表面上被氧化。本实施方式的锂二次电池10能够实现更高的能量密度和更高的容量。即、在充电时通过负极集电体31将负极介体还原,由此在放电时能够使被负极集电体31氧化的负极介体的量增加。另外,在放电时通过负极集电体31将负极介体氧化,由此在充电时能够使被负极集电体31还原的负极介体的量增加。从而,能够使充放电的容量增加。例如,如果第1电解液50与负极集电体31接触,则负极介体被负极集电体31氧化或还原。例如,如果第1电解液50与负极活性物质32接触,则通过负极活性物质32发生负极介体的还原反应或通过负极活性物质32发生负极介体的氧化反应。负极介体只要是通过与锂一起溶解于第1电解液50的溶剂中而将形成锂和负极活性物质32的化合物的上限电位以下的平衡电位赋予第1电解液50的化合物,就不特别限定。负极介体可以是稠合芳香族化合物。溶解有稠合芳香族化合物的第1电解液50,具有使锂的溶剂化电子释放,将锂作为阳离子溶解的性质。换言之,稠合芳香族化合物具有将在锂溶解于第1电解液50的溶剂中时释放的电子作为溶剂化电子接受并且将其溶解于第1电解液50的溶剂中的性质。本实施方式的锂二次电池10能够实现具有电位低的性质的负极介体。包含稠合芳香族化合物的溶液具有溶解锂的能力。包含稠合芳香族化合物的溶液例如可以是醚溶液。锂容易释放电子而成为阳离子。因此,向溶液中的稠合芳香族化合物传递电子,成为阳离子,溶解于该溶液中。此时,接受了电子的稠合芳香族化合物与电子溶剂化。通过与电子溶剂化,稠合芳香族化合物作为阴离子发挥作用。因此,包含稠合芳香族化合物的溶液本身具有离子导电性。在此,包含稠合芳香族化合物的溶液中,li阳离子与电子当量存在。因此,包含稠合芳香族化合物的溶液自身能够具有还原性强的性质、换言之为电位低的性质。例如,如果将对于锂在化学上惰性的电极浸渍于溶解有稠合芳香族化合物的第1电解液50的溶剂中并测定对于锂金属的电极的电位,则会观测到非常低的电位。观测到的电位取决于稠合芳香族化合物与电子的溶剂化的程度,即、取决于稠合芳香族化合物的种类。对锂二次电池10的构成进行详细说明。锂二次电池10具备容器60。容器60密闭。容器60由具有绝缘性和耐腐蚀性的材料制成。正极20、负极30、隔膜40和第1电解液50配置在容器60的内部。容器60的内部被隔膜40划分为两个区域60a和60b。在两个区域60a和60b中的一方的区域60a配置正极20,在另一方的区域60b配置负极30。正极20具有正极集电体21和正极活性物质层22。正极活性物质层22配置在正极集电体21上。正极集电体21与正极活性物质层22电接触。正极集电体21例如由不锈钢、铜、镍、碳等具有电子传导性的材料制成。对于正极集电体21的形状不特别限定,例如为板状。正极活性物质层22是包含正极活性物质的层。正极活性物质可以是具有可逆地吸藏和释放锂离子的特性的物质。作为正极活性物质,可举出过渡金属氧化物、氟化物、聚阴离子、氟化聚阴离子、过渡金属硫化物、具有橄榄石结构的氧化物等。作为过渡金属氧化物,可举出licoo2、linio2、li2mn2o4等。作为磷氧化物,可举出lifepo4、linipo4、licopo4等。正极活性物质层22可以包含多种正极活性物质。正极活性物质层22预先含有锂的情况下,负极活性物质32不需要含有锂。正极活性物质22不含有锂的情况下,负极活性物质32预先含有锂即可。正极活性物质层22可以根据需要包含导电剂、离子传导辅助剂、粘结剂等添加剂。正极20可以由锂金属构成。作为正极20使用锂金属的情况下,作为金属正极的溶解析出的控制变得容易,并且能够实现高容量。负极30具有负极集电体31和负极活性物质32。负极集电体31和负极活性物质32这两者浸渍于第1电解液50中。本实施方式中,负极活性物质32以与负极集电体31分离的方式配置。根据这样的构成,能够提高涉及负极集电体31和负极活性物质32的形状和尺寸等方面的自由度。在负极集电体31与负极活性物质32之间存在包含负极介体的第1电解液50。即、负极活性物质32不与负极集电体31直接接触,但负极活性物质32也可以与负极集电体31接触。负极集电体31具有作为负极介体的反应场所发挥作用的表面。作为负极集电体31可使用对于第1电解液50稳定的材料。另外,作为负极集电体31可使用对于作为电极反应的电化学反应稳定的材料。例如,作为负极集电体31可使用金属、碳等具有电子传导性的材料。作为金属可举出不锈钢、铁、铜、镍等。负极集电体31可以具有使其表面积增大的结构。作为使表面积增大的结构,可举出丝网、无纺布、表面粗糙化处理板、烧结多孔体等。负极集电体31具有这些结构的情况下,负极介体的氧化反应或还原反应容易进行。负极活性物质32例如包含在充电时与锂形成合金的材料。通过以下所示的合金化材料,能够得到具有高的能量密度的锂二次电池10。负极活性物质32可以包含al。该情况下,在锂二次电池10的充电时生成lial合金。lial合金的组成可以是选自lial、li2al3和li4al5中的至少一者。负极活性物质32可以包含zn。该情况下,在锂二次电池10的充电时生成lizn合金。lizn合金的组成可以是选自li2zn3、lizn2、li2zn5、lizn4和lizn中的至少一者。负极活性物质32可以包含si。该情况下,在锂二次电池10的充电时生成lisi合金。lisi合金的组成可以是选自li22si5、li13si4、li7si3和li12si7中的至少一者。负极活性物质32可以包含sn。该情况下,在锂二次电池10的充电时生成lisn合金。lisn合金的组成可以是选自li22sn5、li7sn2、li13sn5、li7sn3、li5sn2、lisn和li2sn5中的至少一者。负极活性物质32可以包含ge。该情况下,在锂二次电池10的充电时生成lige合金。lige合金的组成可以是选自li5ge22和li3ge中的至少一者。负极活性物质32可以包含cd。该情况下,在锂二次电池10的充电时生成licd合金。licd合金的组成可以是选自licd3和li3cd中的至少一者。负极活性物质32可以包含bi。该情况下,在锂二次电池10的充电时生成libi合金。libi合金的组成可以是选自libi和li3bi中的至少一者。负极活性物质32可以包含选自al、zn、si、sn、ge、cd和bi中的至少一者。负极活性物质32可以包含石墨等碳材料。对于负极活性物质32的形状没有特别限定。负极活性物质32可以是粉末状,也可以是颗粒状。负极活性物质32可以由粘合剂固定。作为粘合剂,可举出聚偏二氟乙烯、聚丙烯、聚乙烯、聚酰亚胺等树脂。负极活性物质32可以是不溶于第1电解液50的物质。当锂金属溶液中的溶剂化电子与正极接触时会发生短路,因此需要防止该短路。为此,需要具有不使溶剂化电子透过的功能的隔膜。但作为电荷载体的锂离子需要通过隔膜。隔膜40将正极20和负极30电隔离。隔膜40具有锂离子传导性。隔膜40可以由选自固体电解质、凝胶电解质、离子交换树脂膜、半透膜和多孔质膜中的至少一者构成。如果由这些材料制成隔膜40,能够充分确保锂二次电池10的安全性。作为固体电解质,可举出li2s-p2s5等硫化物固体电解质、li7la3zr2o12(llz)等氧化物固体电解质等。作为凝胶电解质,可举出包含pvdf等氟树脂的凝胶电解质。作为离子交换树脂膜,可举出阳离子交换膜、阴离子交换膜等。作为多孔质膜,可举出聚烯烃树脂制的多孔质膜、将玻璃纤维织入无纺布而得到的玻璃纸制成的多孔质膜等。本实施方式中,隔膜40具有禁止第1电解液50中所含的负极介体通过的性质。由此,能够经由负极介体防止在正极20与负极30之间进行电子的授受。第1电解液50包含溶剂和负极介体。第1电解液50将配置有负极30的区域60b充满。第1电解液50可以包含电解质盐。作为电解质盐,可举出lipf6、libf4、lisbf6、liasf6、liso3cf3、lin(so2cf3)2、lin(so2c2f5)2、lin(so2cf3)(so2c4f9)、lic(so2cf3)3、liclo4、双草酸硼酸锂等。本实施方式中,锂二次电池10还具备第2电解液52。第2电解液52包含溶剂和电解质盐。第2电解液52将配置有正极20的区域60a充满。正极20与第2电解液52接触。正极20a可以浸渍于第2电解液52中。对于第2电解液52的组成没有特别限定。不需要第2电解液52包含介体。除了不含介体以外,第2电解液52的组成可以与第1电解液50的组成相同。可以将能够作为第1电解液50的溶剂使用的材料用作第2电解液52的溶剂。可以将能够作为第1电解液50的电解质盐使用的材料用作第2电解液52的电解质盐。第2电解液52可以被具有锂离子传导性的固体电解质替换。作为具有锂离子传导性的固体电解质,可举出li2s-p2s5等硫化物固体电解质。在第2电解液52被固体电解质替换的情况下,可省略隔膜40。对第1电解液52的溶剂和负极介体进行详细说明。例如,负极活性物质32包含铝的情况下,在锂二次电池10的充电时,负极活性物质32中所含的铝与锂反应而还原为lial合金。因此,作为负极介体,如果使用显示形成lial合金的上限电位以下的电位的稠合芳香族化合物,则能够构成介体型的负极30。形成lial合金的上限电位例如为0.18vvs.li/li+。负极介体例如是通过与锂一起溶解于第1电解液50的溶剂中而将0.18vvs.li/li+以下的平衡电位赋予第1电解液50的化合物。例如,负极活性物质32包含锡的情况下,在锂二次电池10的充电时,负极活性物质32中所含的锡与锂反应而还原为lisn合金。因此,作为负极介体,如果使用显示形成lisn合金的上限电位以下的电位的稠合芳香族化合物,则能够构成介体型的负极30。形成lisn合金的上限电位例如为0.25vvs.li/li+。负极介体例如是通过与锂一起溶解于第1电解液50的溶剂中而将0.25vvs.li/li+以下的平衡电位赋予第1电解液50的化合物。例如,负极活性物质32包含石墨的情况下,在锂二次电池10的充电时,负极活性物质32中所含的石墨与锂反应而还原为c6li。因此,作为负极介体,如果使用显示形成c6li的上限电位以下的电位的稠合芳香族化合物,则能够构成介体型的负极30。形成c6li的上限电位例如为0.15vvs.li/li+。负极介体例如是通过与锂一起溶解于第1电解液50的溶剂中而将0.15vvs.li/li+以下的平衡电位赋予第1电解液50的化合物。与铝、锡和石墨相关的上述说明,也适用于zn、si、ge、cd、pb、bi和sb。可以根据lizn、lisi、lige、licd、lipb、libi和lisb分别形成的上限电位来适当选择负极介体。作为产生低电位的稠合芳香族化合物,可举出菲、联苯、邻三联苯、三亚苯、苊、苊烯、荧蒽、2,2’-联吡啶、反式二苯乙烯、2,4’-联吡啶、2,3’-联吡啶、顺式二苯乙烯、苯丙酮、苯丁酮、苯戊酮、乙二胺、偶苯酰和四苯基环戊二烯酮等。作为显示十分低的电位的稠合芳香族化合物,例如可举出菲、联苯、邻三联苯、三亚苯、苊、苊烯、荧蒽和偶苯酰。即、负极介体包含选自菲、联苯、邻三联苯、三亚苯、苊、苊烯、荧蒽和偶苯酰中的至少一种。第1电解液50中的负极介体的浓度可以为0.001mol/l以上且2mol/l以下。本实施方式的锂二次电池10中,第1电解液50可以包含选自环状醚、甘醇二甲醚和环丁砜中的至少一者。第1电解液50可以是醚溶液。作为醚,例如可举出环状醚和二醇醚。二醇醚可以是由组成式ch3(och2ch2)noch3表示的甘醇二甲醚。上述组成式中,n为1以上的整数。第1电解液50可以包含环状醚和甘醇二甲醚的混合物或环状醚作为溶剂。根据以上的技术构成,作为第1电解液50,能够实现包含负极介体的电解液。即、包含负极介体的溶液是不具有电子传导性的醚溶液,因此该醚溶液自身能够具有作为电解液的性质。作为环状醚,可举出四氢呋喃(thf)、2-甲基四氢呋喃(2methf)、1,3-二氧戊环(1,3do)和4-甲基-1,3-二氧戊环(4me1,3do)等。作为甘醇二甲醚,可举出单甘醇二甲醚(1,2-二甲氧基乙烷)、二甘醇二甲醚(二乙二醇二甲醚)、三甘醇二甲醚(三乙二醇二甲醚)、四甘醇二甲醚(四乙二醇二甲醚)、五甘醇二甲醚、聚乙二醇二甲醚等。甘醇二甲醚可以是四甘醇二甲醚和五甘醇二甲醚的混合物。作为环丁砜,可举出3-甲基环丁砜。在使稠合芳香族化合物的醚溶液中溶解有锂的情况下,醚溶液的电位根据溶剂的种类而稍有不同。环状醚的沸点低,因此容易挥发。所以可以将环状醚与沸点较高的甘醇二甲醚混合使用。在使用环状醚作为醚溶液的溶剂的情况下,如果使用thf或2methf作为环状醚,则存在醚溶液的电位进一步降低的倾向。在使用甘醇二甲醚作为醚溶液的溶剂的情况下,如果使用三甘醇二甲醚作为甘醇二甲醚,则醚溶液的电位最大程度降低。因此,作为醚溶液的溶剂,可以使用thf或2methf与三甘醇二甲醚的混合物。存在醚溶液的溶剂中的甘醇二甲醚的比率越高,醚溶液的电位越高的倾向。因此,第1电解液50的溶剂中环状醚的体积与甘醇二甲醚的体积的比率可以为10:0~7:3。充电时,通过在负极集电体31上溶剂化了的负极介体被还原,形成包含溶剂化电子和li阳离子的复合体。如果该复合体与负极活性物质32接触,则负极活性物质32接受li阳离子和溶剂化电子,形成锂与负极活性物质32的化合物。复合体释放出li阳离子和溶剂化电子后,溶剂化了的负极介体再次在负极集电体31上被还原。通过该循环,负极活性物质32被还原为锂与负极活性物质32的化合物,第1电解液50中的溶剂化了的负极介体被还原。由此,锂二次电池10的充电结束。放电时,首先,第1电解液50中的溶剂化了的负极介体的还原体在负极集电体31上,释放出溶剂化电子和li阳离子。电子通过外部回路向正极20移动。li阳离子通过隔膜40向正极20移动。随着放电的进行,释放出溶剂化电子和li阳离子的负极介体的浓度在第1电解液50中增加。由此,第1电解液50的电位上升。如果第1电解液50的电位超过锂与负极活性物质32的化合物的平衡电位,则从锂与负极活性物质32的化合物向负极介体供给li阳离子和溶剂化电子,再次形成包含li阳离子的复合体。通过包含li阳离子的复合体,锂二次电池10的放电持续。从锂与负极活性物质32的化合物释放出li阳离子和溶剂化电子,第1电解液50中的包含li阳离子的复合体释放出li阳离子和溶剂化电子时,锂二次电池10的放电结束。以往已知锂等的碱金属具有溶解于特定的溶剂或溶液中的性质。作为这样的溶剂,可举出氨、甲胺、乙胺等胺类。此外,苯乙酮、苯丁酮等芳香酮以及它们的溶液或某些芳香族的醚溶液,也具有锂金属溶解能力。这些液体中,锂金属将自身的2s轨道上的电子以与溶剂进行溶剂化的形式释放出来,成为锂离子而溶解。与溶剂进行了溶剂化的电子被称为溶剂化电子,像阴离子那样发挥作用。胺类、特别是氨这样的单独溶剂的情况下,仅形成其溶剂和溶剂化电子,但在芳香酮溶液或某些芳香族的醚溶液的情况下,成为形成溶液成分和溶剂化电子的复杂结构,锂金属溶解需要所有溶液成分。这些溶剂化电子存在于与锂离子非常近的位置,彼此相互作用。随着该相互作用越强,溶液电位降低,随着该相互作用越弱,溶液电位变高。相互作用的强度取决于溶液(溶剂)种类及其浓度,溶液(溶剂)种类占非常主导的位置。在芳香酮溶液的情况下,相互作用弱,在某些芳香族的醚溶液的情况下,相互作用非常强。另外,胺类为其中间程度的相互作用。其电位可以通过将上述溶液配置在由锂金属和不与锂反应的稳定过渡金属(cu、fe、ni等)构成的电极之间来进行测定。实际中,使用铜箔作为过渡金属,使用2甲基四氢呋喃作为醚,将使各种物质溶解于该醚中的电位测定结果示于表1。表1在具有锂金属溶解能力的芳香族的醚溶液中,芳香族化合物种类保持原样,在代替醚而使用碳酸亚乙烯酯、碳酸亚乙酯、碳酸亚丙酯、碳酸亚丁酯、氟代碳酸亚乙酯、碳酸二甲酯、碳酸甲乙酯、碳酸二乙酯等碳酸酯或γ-丁内酯等内酯的情况下,锂金属不溶解。因此,这种溶液不具有电位。同样地,芳香族化合物种类保持原样,在代替醚使用作为碳酸酯的碳酸甲乙酯的情况下,虽然观察到了锂金属溶解能力,但如表2所示,电位(vs.li/li+)高达1v以上。表2物质名称溶剂电位溶液浓度(m)4’-苯基苯乙酮(4-乙酰基联苯)碳酸甲乙酯20.14’-苯基丁酮(4-丁酰基联苯)碳酸甲乙酯1.70.14,4’-二叔丁基二苯甲酮碳酸甲乙酯1.40.12,4-二甲基二苯甲酮碳酸甲乙酯1.30.13,4-二甲基二苯甲酮碳酸甲乙酯1.40.14,4-二甲基二苯甲酮碳酸甲乙酯1.40.12-甲基二苯甲酮碳酸甲乙酯1.40.13-甲基二苯甲酮碳酸甲乙酯1.50.14-甲基二苯甲酮碳酸甲乙酯1.40.14-苯基二苯甲酮碳酸甲乙酯1.50.12-萘基苯基酮碳酸甲乙酯1.50.14,4’-二甲氧基苯偶酰(对茴香偶酰)碳酸甲乙酯20.14,4’-二甲基苯偶酰碳酸甲乙酯2.10.12,4’-二甲氧基二苯甲酮碳酸甲乙酯1.50.1如果锂金属溶液的电位低,特别是与负极活性物质的平衡电位相比非常低,则通过将负极活性物质于锂金属溶液中,能够使负极活性物质锂化,即进行充电。但由于负极活性物质的平衡电位会根据负极活性物质种类而有所不同,因此需要根据负极活性物质种类来选择适当的锂金属溶液的电位。也就是说,需要根据负极活性物质种类,选择芳香族的醚溶液的成分。将采用与表1的测定时相同的方法测定溶解有锂金属的各种芳香族化合物的2甲基四氢呋喃溶液的电位的结果示于表3。表3在这些溶液中如果进行电解还原则生成锂金属,与该生成同时溶解锂而生成锂金属溶液。然而,作为与锂合金化的金属有铋、锡、锗、铝、硅、锌、镉等,但在与锂合金化的情况下的平衡电位各不相同。表4中示出各自的平衡电位。表4物质名称平衡电位(vvsli/li+)铋1锡0.6锗0.5铝0.4硅0.3锌0.2镉0.1例如,使用锌、镉这样具有低电位的合金金属,需要具有小于0.1v的电位的锂金属溶液。作为这样的锂金属溶液,可举出菲、联苯、三亚苯、苊、苊烯、荧蒽的2甲基四氢呋喃溶液或联苯的二丁氧基乙烷溶液、联苯的三甘醇二甲醚溶液等。使用铝、硅需要具有小于0.1v的电位的锂金属溶液。作为锂金属溶液,除了上述溶液以外,可举出联苯的二甘醇二甲醚溶液、联苯的四甘醇二甲醚溶液。将与锂合金化的上述金属浸渍于锂金属溶液中的情况下,如果锂金属溶液的电位相对于与锂合金化的金属的平衡电位十分低,则进行锂的合金化反应,锂金属溶液中的锂被合金金属吸收。因此,与在通过电解还原而生成的锂金属溶液中存在与锂合金化的金属的情况同样地,进行锂的合金化反应,锂金属溶液中的锂被合金金属吸收。如果连续实施电解还原,则通过电解还原而电化学生成锂金属溶液的反应与锂金属溶液中的锂被合金金属化学吸收的反应达到平衡,以一定的锂金属溶液的电位进行反应。合金金属的锂化为化学性发生,因此合金金属与锂金属溶液接触(浸渍)即可,不需要像以往的锂合金负极活性物质那样进行电接触。如果合金金属吸收锂成为饱和的组成,则合金金属成为满充电状态。如果继续充电(电解还原),会吸收锂直到锂金属溶液的饱和浓度为止,但如果超过饱和浓度则会在电极上析出锂金属,因此作为电池在该时间点成为满充电。负极的充电容量为合金金属的充电容量与锂金属溶液的充电容量的合计,与以往单纯地将合金金属作为负极的电池相比,充电容量增加。但相对于锂金属溶液的充电容量,合金金属的充电容量压倒性地更大。锂金属溶液的电位是根据溶剂化电子的活性基于能斯特方程确定的。如果放电(电解氧化),则溶剂化电子的活性减少,因此电位向高方向移动。如果其电位超过锂合金的平衡电位,则通过锂合金将锂金属溶液化学性地还原,锂金属溶液的电位向低方向移动,锂合金被氧化。通过反复进行,从合金金属释放锂,合金金属被氧化。如果合金金属完全释放出锂,则合金金属成为完全放电状态。如果继续放电(电解氧化),则放电持续到锂金属溶液完全释放锂为止。负极的放电容量为合金金属的放电容量+锂金属溶液的放电容量的合计,与以往将合金金属作为负极的电池相比,放电容量增加。但相对于锂金属溶液的放电容量,合金金属的放电容量压倒性地更大。由以上说明可知,本公开的锂二次电池,通过存在锂金属溶液而进行合金金属的充放电。以往的锂合金负极活性物质,在充电时膨胀,在放电时收缩,因此在放电时会无法与电极(集电体)接触而不能进行放电,本公开的锂二次电池,即使不与电极(集电体)接触,合金金属也能够进行充放电。即、能够抑制合金负极的缺点即由基于充放电的体积的膨胀和收缩导致的集电性的降低。因此,本公开的锂二次电池,即使负极活性物质微粉化,也能够进行充放电,实现合金负极中无法充分得到的可逆性。<充放电过程的说明>以下,对本实施方式的锂二次电池10的充放电过程进行说明。具体而言,例示出下述技术构成即操作例,对充放电过程进行说明。即、本操作例中,负极集电体31由不锈钢制成。本操作例中,第1电解液50是溶解有负极介体的醚溶液。本操作例中,负极介体是1种稠合芳香族化合物(以下也记为md)。本操作例中,负极活性物质32是铝。本操作例中,正极20具备由不锈钢制成的正极集电体21、和包含磷酸铁锂(lifepo4)作为正极活性物质的正极活性物质层22。[充电过程的说明]首先,对充电反应进行说明。通过对正极集电体21与负极集电体31之间施加电压而进行充电。(正极侧的反应)通过电压的施加,在正极20发生正极活性物质的氧化反应。即、从正极活性物质释放出锂离子。由此,从正极20向锂二次电池10的外部释放电子。例如,本操作例中发生下述反应。lifepo4→fepo4+li++e-产生的锂离子(li+)的一部分通过隔膜40向第1电解液50移动。(负极侧的反应)通过电压的施加,从锂二次电池10的外部向负极集电体31供给电子。由此,在负极集电体31上发生负极介体的还原反应。例如,本操作例中发生下述反应。md+li++e-→md·li被还原了的负极介体被负极活性物质32氧化。即、负极活性物质32被负极介体还原。由此,负极活性物质32与锂反应而成为lial。例如,本操作例中发生下述反应。al+md·li→lial+md如上所述,负极介体以总反应来看没有发生变化。另一方面,位于与负极集电体31分开的场所的负极活性物质32成为充电状态。以上的充电反应可以进行到负极活性物质32成为充电状态或正极活性物质成为充电状态为止。[放电过程的说明]接着,对从满充电开始的放电反应进行说明。满充电时,负极活性物质32和正极活性物质成为充电状态。放电反应中,从正极集电体21与负极集电体31之间取出电力。(正极侧的反应)通过锂二次电池10的放电,从锂二次电池10的外部向正极20供给电子。由此,在正极20发生正极活性物质的还原反应。例如,本操作例中发生下述反应。fepo4+li++e-→lifepo4锂离子(li+)的一部分可以通过隔膜40从第1电解液50供给。(负极侧的反应)通过锂二次电池10的放电,在负极集电体31上发生负极介体的氧化反应。由此,从负极集电体31向锂二次电池10的外部释放出电子。例如,本操作例中发生下述反应。md·li→md+li++e-被氧化了的负极介体被负极活性物质32还原。即、负极活性物质32被负极介体氧化。由此,负极活性物质32释放出锂。例如,本操作例中发生下述反应。lial+md→al+md·li如上所述,负极介体以总反应来看没有发生变化。另一方面,在位于与负极集电体31分离的场所的负极活性物质32成为放电状态。以上的放电反应可以进行到负极活性物质32成为放电状态或正极活性物质成为放电状态为止。(实施例)基于实施例对本公开进行具体说明。但本公开并不限定于以下的实施例。(电位的测定1)将2×2cm的铜箔70用聚丙烯制微多孔性隔膜71包覆,再将其整体用大量的锂金属箔72包覆。接着,在铜箔70和锂金属箔72分别安装极耳75、76。然后,将其收纳于层压外装73中,注入以0.1mol/l溶解有联苯的醚溶液74后,将层压外装73的开口部热熔接而密封,制作了图2所示的电位测定用电池单元。醚溶液的溶剂中,作为环状醚包含2甲基四氢呋喃,另外,作为甘醇二甲醚包含三甘醇二甲醚。三甘醇二甲醚的体积相对于醚溶液的溶剂的体积的比例为0.2。换言之,2甲基四氢呋喃的体积与三甘醇二甲醚的体积的比率为8:2。醚溶液中,作为支持盐溶解有1mol/l的lipf6。通过以上制作了电位测定用电池单元1。将使用该电位测定用电池单元以锂金属基准测定出的电位(vvs.li/li+)示于图3。电位测定用电池单元刚制作后的电位的值约为0.24vvs.li/li+。制作电位测定用电池单元经过100小时后的电位的值约为0.15vvs.li/li+。接着,除了变更三甘醇二甲醚的体积相对于醚溶液的溶剂的体积的比例以外,采用与上述同样的方法制造了电位测定用电池单元2~9。电位测定用电池单元2~9中,三甘醇二甲醚的体积相对于醚溶液的溶剂的体积的比例分别为0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0。对这些电位测定用电池单元,测定了电位测定用电池单元刚制作后的电位和制作电位测定用电池单元经过100小时后的电位的值。将三甘醇二甲醚的体积相对于醚溶液的溶剂的体积的比例与电位测定用电池单元的电位的值之间的关系示于图3。图3中,虚线表示电位测定用电池单元刚制作后的电位的值。实线表示制作电位测定用电池单元经过100小时后的电位的值。然后,向电位测定用电池单元1~9各自的醚溶液中投入铝。在投入铝经过100小时后,观察铝的表面。其结果,投入到2甲基四氢呋喃的体积与三甘醇二甲醚的体积的比率为8:2的电位测定用电池单元1中的铝、以及投入到2甲基四氢呋喃的体积与三甘醇二甲醚的体积的比率为7:3的电位测定用电池单元2中的铝,观察到变化为粉末状的lial合金。投入到2甲基四氢呋喃的体积与三甘醇二甲醚的体积的比率为6:4的电位测定用电池单元3的铝,观察到仅表面粗糙,其一部分变化为lial合金。该铝维持了投入到醚溶液中时的形状。投入到2甲基四氢呋喃的体积与三甘醇二甲醚的体积的比率为5:5~0:10的电位测定用电池单元4~9的铝,没有观察到变化,没有形成lial合金。由以上结果可知,如果醚溶液的电位为0.18vvs.li/li+以下,则形成lial合金。这样的醚溶液能够作为锂二次电池的第1电解液的溶剂利用。(充放电特性的测定)为测定充放电特性,准备了电池10-1。电池10-1中,使用不锈钢箔作为工作极集电体(负极集电体)。作为隔膜使用了li7la3zr2o12(llz)。作为工作极侧电解液(负极电解液),使用了预先溶解有li的溶解有0.1mol/l的锂联苯和1mol/l的lipf6的醚溶液。醚溶液的溶剂包含2甲基四氢呋喃和三甘醇二甲醚。醚溶液的溶剂中,2甲基四氢呋喃的体积与三甘醇二甲醚的体积的比率为7:3。电池10-1中,使用金属li作为对电极(正极)。作为对电极侧电解液(正极电解液),使用了溶解有1mol/l的lipf6的三甘醇二甲醚溶液。使用该电池10-1实施充放电。另外,向该电池10-1的工作极侧电解液投入使电池10-1的容量增加0.8mah的量的铝,实施充放电。由此,测定电池10-1的充放电特性。图4a是表示电池10-1的充放电特性的图表。由图4a可知,通过铝的投入,电池10-1的容量增加了0.8mah。由此可知,通过将投入的铝利用于充放电,电池10-1的容量增加。图4b是投入到电池10-1之前的铝的图像。图4c是投入到电池10-1之后的铝的图像。由图4b和图4c可知,浸渍于工作极侧电解液中的铝变为黑色,确认形成了lial合金。对实施方式中记载的其它负极活性物质进行同样的测定,确认形成锂与负极活性物质的化合物(合金或c6li)。(电位的测定2)将2×2cm的铜箔70用聚丙烯制微多孔性隔膜71包覆,再将其整体用大量的锂金属箔72包覆。接着,在铜箔70和锂金属箔72分别安装极耳75、76。然后,将其安装于层压外装73。对其注入以0.00625mol/l溶解有联苯的三甘醇二甲醚溶液74后,将层压外装73热熔接而密封。三甘醇二甲醚溶液中,作为支持盐溶解有1mol/l的lipf6。通过以上制作了电位测定用电池单元11。将使用该电位测定用电池单元11以锂金属基准测定出的电位(vvs.li/li+)示于表2。电位测定用电池单元刚制作后的电位的值为2.016vvs.li/li+。制作电位测定用电池单元经过100小时后的电位的值为0.28vvs.li/li+。接着,除了改变三甘醇二甲醚溶液中的联苯的浓度以外,采用与上述同样的方法制作了电位测定用电池单元12~17。对这些电位测定用电池单元,测定了电位测定用电池单元刚制作后的电位的值、制作电位测定用电池单元经过20小时后的电位的值、以及制作电位测定用电池单元经过100小时后的电位的值。将测定结果示于表5。表5然后,然后,向电位测定用电池单元11~17各自的三甘醇二甲醚溶液中投入锡。在投入锡经过100小时后,观察锡的表面。其结果,在电位测定用电池单元13~17中,观察到锡变为lisn合金。由以上结果可知,如果三甘醇二甲醚溶液的电位为0.25vvs.li/li+以下,则形成lisn合金。这样的三甘醇二甲醚溶液可以作为锂二次电池的第1电解液的溶剂利用。(电位的测定3)将2×2cm的铜箔70用聚丙烯制微多孔性隔膜71包覆,再将其整体用大量的锂金属箔72包覆。接着,在铜箔70和锂金属箔72分别安装极耳75、76。然后,将其安装于层压外装73。对其注入以0.1mol/l溶解有联苯的醚溶液74后,将层压外装73热熔接而密封。醚溶液的溶剂,作为环状醚使用了2甲基四氢呋喃,作为支持盐溶解有1mol/l的lipf6。通过以上制作了电位测定用电池单元18。电位测定用电池单元18刚制作后的电位的值约为0.06vvs.li/li+。制作电位测定用电池单元18经过100小时后的电位的值约为0vvs.li/li+。(充放电特性的测定)为测定充放电特性,准备了电池10-2。电池10-2中,使用不锈钢箔作为工作极集电体(负极集电体)。作为隔膜使用了li7la3zr2o12(llz)。作为工作极侧电解液(负极电解液),使用了预先溶解有li的溶解有0.1mol/l的锂联苯和1mol/l的lipf6的醚溶液。醚溶液的溶剂包含2甲基四氢呋喃。电池10-2中,使用金属li作为对电极(正极)。作为对电极侧电解液(正极电解液),使用了溶解有1mol/l的lipf6的2甲基四氢呋喃溶液。使用该电池10-2实施充放电。另外,向该电池10-2的工作极侧电解液投入si,实施充放电。由此,测定电池10-2的充放电特性。图5是表示电池10-2的充放电特性的图表。由图5可知,通过硅的投入,电池10-2的容量增加了0.3mah。由此可知,通过将投入的硅利用于充放电,电池10-2的容量增加。<比较例1>进行了锂金属溶解于联苯-碳酸酯、γbl溶液的试验。调制以0.1mol/l溶解有联苯的各种碳酸酯溶液和以0.1mol/l溶解有联苯的γbl溶液,碳酸酯溶液具体而言为碳酸二甲酯溶液、碳酸二乙酯溶液、碳酸甲乙酯溶液、碳酸亚丙酯溶液、碳酸亚乙酯溶液。向这些溶液投入锂金属,观察溶液。如果锂金属溶解则产生溶剂化电子,与其相应地溶液颜色应该发生变化,但溶液保持无色透明状态没有发生变化,锂金属没有溶解。由于没能生成锂金属溶液,因此无法测定其电位。<比较例2>采用与实施例的充放电特性的测定相同的构成,代替溶解有0.1mol/l的锂联苯和1mol/l的lipf6的醚溶液,使用了溶解有0.1mol/l的锂联苯和1mol/l的lipf6的碳酸二甲酯溶液以及溶解有0.1mol/l的锂联苯和1mol/l的lipf6的γbl溶液实施了同样的试验。但是,充电时负极电位立即变为0v,没能完全充电。认为是由于这些溶液中没有溶解锂金属,因此没有电化学地生成锂金属溶液。<比较例3>将2×2cm的铜箔用聚丙烯制微多孔性隔膜包覆,再将其整体用大量的锂金属箔包覆。接着,将放置有铝箔的铜箔作为工作极,将这些电极组插入层压外装中,注入以0.1mol/l溶解有联苯的醚溶液后,将层压外装热熔接而密封。对该电池单元实施充电至电压为0、放电至电压为1v的试验。能够进行充电,但在放电时电压立即达到1v,无法完全放电。试验结束后,将电池拆开观察负极,铜箔上几乎没有残留铝,在隔膜侧附着有大量的似乎是锂铝合金的黑色粉末。当铝通过充电而成为锂铝合金时,体积膨胀约2倍。如果膨胀到这种程度,则无法与集电体接触,因此无法放电,如果像这样原样直接使用合金金属,则几乎观察不到可逆性。产业可利用性本公开的锂二次电池例如可很好地作为蓄电设备或蓄电系统使用。附图标记说明10锂二次电池20正极21正极集电体22正极活性物质层30负极31负极集电体32负极活性物质40隔膜50第1电解液52第2电解液60容器60a区域60b区域当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1