具有控制的钙离子水平的新型组合物和溶液以及用于再灌注的相关方法和用途与流程
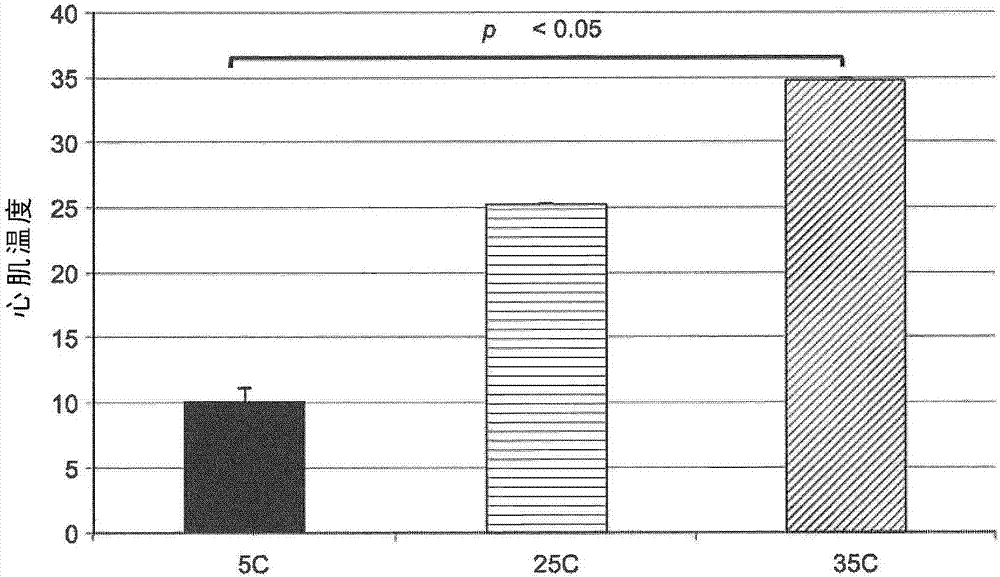
相关申请的引用本申请为于2015年4月10日提交的第pct/ca2015/050297号pct国际专利申请(其要求于2014年4月10日提交的第61/978,132号美国临时专利申请的权益和优先权)的部分继续申请,将其各自的全部内容援引加入本文。本申请要求于2014年10月24日提交的第62/068,524号美国临时专利申请的权益和优先权,将所述临时申请的全部内容援引加入本文。发明领域本发明涉及适合用于再灌注的新型组合物和溶液,并且还涉及获得的供体心脏在复苏和移植入受体个体前的获得后保存和保护。背景心力衰竭影响10%的北美洲人,并且是医院出院诊断中的主要内容。心力衰竭的诊断伴随着与主要癌症相当的生存前景。心力衰竭患者可用的康复选择有限,并且很少有策略真正使心脏康复。心脏移植仍是终末期心力衰竭患者的黄金标准治疗干预,加入移植候诊名单的个体数量每年持续增加。然而,此维持生命的干预的广泛应用受到供体可用性限制。国际心脏和肺移植注册协会(internationalsocietyofheartandlungtransplantationregistry)的数据显示,心脏移植的合适供体逐步下降(2007,overallheartandadulthearttransplantationstatistics)。在最近十年中,258名加拿大人在等待心脏移植时死亡(2000-2010;加拿大心脏与卒中基金会(heartandstrokefoundationofcanada))。类似地,在美国,仅在2010年就有304名患者在等待心脏移植时死亡(器官获取和移植网络(organprocurementandtransplantationnetwork),美国健康和人类服务部(u.s.dept.ofhealth&humanservice))。此现象主要是由于缺乏合适的器官供体,并且全球都面临该问题。对于从供体移出心脏和其成功植入受体,时间是关键。为了在从供体移出和移植之间的时期使供体心脏得到最优保存,一般应用以下常规原则:(i)使细胞肿胀和水肿减到最少,(ii)防止胞内酸中毒,(iii)防止由氧自由基导致的损伤,和(iv)提供用于在再灌注期间高能磷酸酯化合物(特别是腺苷三磷酸(atp))再生的底物。用于移植的供体心脏有两种主要来源。第一种为由于钝器头外伤或脑内出血而经历不可逆的脑功能损失的呼吸的患者。这样的患者被称作“脑干死亡”供体或脑死亡后的供体(“dbd”)。第二种为经历循环死亡的患者。这样的患者被称作“非心跳”供体、“心脏死亡”供体、心脏死亡后的供体或者循环死亡后的供体(dcd)。脑干死亡供体可在人工呼吸下维持延长的时间以提供遍及全身的血液动力学稳定性,直至器官重获的时间点。心脏灌注不受影响,且理论上维持器官功能。然而,脑干死亡本身可深刻影响心功能。对脑干死亡的体液反应特征在于循环儿茶酚胺明显升高。对此“儿茶酚胺风暴”的生理反应包括血管收缩、高血压和心动过速,这些都增加心肌氧需求。整个血管系统内增加的儿茶酚胺循环水平诱导血管收缩,进而影响心肌氧供给并可导致心内膜下缺血。这种心肌氧供给与需求之间的失衡是涉及脑干死亡后心功能受损的一个因素(halejcio-delophont等人,1998,increaseinmyocardialinterstitialadenosineandnetlactateproductioninbrain-deadpigs:aninvivomicrodialysisstudy.transplantation66(10):1278-1284;halejcio-delophont等人,1998,consequencesofbraindeathoncoronarybloodflowandmyocardialmetabolism.transplantproc.30(6):2840-2841)。在脑干死亡后发生的结构性心肌损伤特征在于肌细胞溶解、收缩带坏死、心内膜下出血、水肿和间质单核细胞浸润(baroldi等人,1997,typeandextentofmyocardialinjuryrelatedtobraindamageanditssignificanceinhearttransplantation:amorphometricstudy.j.heartlungtransplant16(10):994-1000)。尽管无直接心脏损害,脑干死亡的供体通常显示心功能降低,且目前的理解为仅40%的心脏可从该供体群体回收用于移植。已研发了许多灌注装置、系统和方法用于离体维持和移植获得的器官。大部分采用低温条件以减少器官代谢、降低器官能量需求、延迟高能磷酸酯储备耗尽、延迟乳酸蓄积以及延迟与氧合血供应破坏相关的形态和功能恶化。获得的器官一般在这些系统中用含抗氧化剂和丙酮酸(pyruvate)的溶液在低温下灌注,以维持其生理功能。本领域技术人员已认识到低温装置、系统和方法的缺点,并已研发了其它供选择的装置、系统和方法用于在约25℃-约35℃温度的范围下(可将其称作“常温”的温度,但是常温更通常意指正常的体温,即平均约37℃)保存和维持获得的器官。常温系统通常使用基于viaspantm配制物(也称为威斯康星大学溶液或uw液)的灌注液,所述配制物补充有下列中的一种或多种:作为蛋白质和胶体来源的血清白蛋白;用于增强活力和细胞功能的微量元素;用于支持氧化磷酸化的丙酮酸和腺苷;作为粘附因子的转铁蛋白;用于支持代谢的胰岛素和糖;用于清除毒性自由基和作为非渗透性来源的谷胱甘肽;作为非渗透性来源、清除剂以及细胞粘附和生长因子的增强剂的环糊精;用于支持微血管代谢的高mg2+浓度;用于生长因子增强和止血的粘多糖;以及内皮生长因子。例如,viaspan包含乳糖酸钾、kh2po4、mgso4、棉子糖、腺苷、谷胱甘肽、别嘌呤醇和羟乙基淀粉。已研发并使用其它常温灌注溶液(muhlbacher等人,1999,preservationsolutionsfortransplantation.transplantproc.31(5):2069-2070)。尽管获得的肾和肝可在常温系统中维持超过12小时,常温浴和通过灌注维持获得的心脏超过12小时导致心脏功能的衰退及不可逆衰弱。使用常温连续脉冲灌注系统以维持获得的心脏的另一缺点是从供体切离心脏,将其装入常温灌注系统且随后启动和稳定化灌注的过程所需的时间。在切离的供体心脏稳定后,确定其生理功能,若符合移植标准,则将该切离心脏尽快运送到移植设施。在脑干死亡供体的情况下,心脏在获取时一般是温热且跳动的。其随后被停止,冷却,放置在冰上直至移植。冷却获得的心脏使其代谢活性和相关要求降低约95%。然而,一些代谢活性持续,后果是心肌开始死亡,并且临床数据显示一旦冷却获得的心脏的时间延长超过4小时,移植后1年死亡的风险上升。例如,与接受冷却小于1小时的心脏的接受者相比,接受通过冷却保存6小时的心脏的接受者移植后1年的死亡风险超过两倍(taylor等人,2009,registryoftheinternationalsocietyforheartandlungtransplantation:twenty-sixthofficialadulthearttransplantreport-2009.jhlt28(10):1007-1022)。对于从无心跳供体获得用于移植的器官,已发展出明确的标准(kootstra等人,1995,categoriesofnon-heart-beatingdonors.transplantproc.27(5):2893-2894;bos,2005,ethicalandlegalissuesinnon-heart-beatingorgandonation.transplantation,2005.79(9):p.1143-1147)。无心跳供体的脑功能极小,但不符合脑干死亡的标准,因此这样的供体不能在法律上宣布为脑干死亡。当显然患者没有希望发生有意义恢复时,医生和家属必须一致同意撤去支持性措施。达到该护理点时,无心跳患者通常用机械通气以及静脉内肌肉收缩药或血管加压药支持。然而,仅单一系统器官衰竭(即神经系统衰竭)的那些患者可考虑用于器官捐赠。撤去生命维持最常见的是停止机械通气,然后是缺氧心搏停止,接着在允许器官获取前患者必须保持心搏停止5分钟。因此,无心跳供体的器官必需在心搏停止后暴露于可变时间段的热缺血,这可能导致不同程度的器官损伤。然而,只要热缺血持续时间不过度,许多类型的器官(如肾、肝和肺)可自无心跳供体获得,且能够在移植后恢复功能,其成功率接近来自脑干死亡供体的移植器官。尽管获得自脑死亡供体的心脏经历限于从器官获取到移植的时间的缺血期,而获得自心脏死亡后的供体的心脏经历更大的缺血损伤事件,包括血氧不足停搏事件(hypoxemicarrestevent),在器官获得可以开始前的强制性5分钟搁置期间发生的热缺血损伤,以及在心脏获得后的再灌注期间发生的进一步缺血损伤。由于器官获得开始前发生的缺血损伤,来自非心跳供体的心脏不用于移植。概述本公开包括新型溶液,其包含含有钙离子源的保存用混合物;以及用于维持所述溶液的ph的缓冲剂,其中所述溶液中钙离子(ca2+)的摩尔浓度为0.18-0.26mmol/l,并且所述ph低于7.4且高于6.6。所述钙离子(ca2+)的摩尔浓度可为0.22mmol/l。ph可为6.8-7.0,诸如6.9。所述保存用混合物可为含有腺苷、利多卡因和镁离子源的心脏停搏混合物。所述溶液可包含0.3-0.45mmol/l的腺苷,0.04-0.09mmol/l的利多卡因和11-15mmol/l的mg2+。所述溶液可包含钠离子源和钾离子源。所述溶液可包含约130mmol/l至约160mmol/l的na+和4mmol/l至7mmol/l的k+。所述溶液可包含氯化物、渗透缓冲剂和还原剂。所述溶液可包含70-140mmol/l或者70-180mmol/l的氯化物,8-12.5mmol/l的葡萄糖,7.5-12.5iu/l的胰岛素,100-140mmol/l的d-甘露醇,0.75-1.25mmol/l的丙酮酸和2.5-3.5mmol/l的还原型谷胱甘肽。所述溶液可包含0.3-0.45mmol/l的腺苷;0.04-0.09mmol/l的利多卡因;8-12.5mmol/l的葡萄糖;110-130mmol/l的nacl;4-7mmol/l的kcl;16-24mmol/l的nahco3;0.9-1.4mmol/l的nah2po4;0.18-0.26mmol/l的cacl2;11-15mmol/l的mgcl2;7.5-12.5iu/l的胰岛素;100-140mmol/l的d-甘露醇;0.75-1.25mmol/l的丙酮酸;和2.5-3.5mmol/l的还原型谷胱甘肽。所述溶液可包含0.4mmol/l的腺苷;0.05mmol/l的利多卡因;10mmol/l的葡萄糖;123.8mmol/l的nacl;5.9mmol/l的kcl;20mmol/l的nahco3;1.2mmol/l的nah2po4;0.22mmol/l的cacl2;13mmol/l的mgcl2;10iu/l的胰岛素;120mmol/l的d-甘露醇;1mmol/l的丙酮酸;和3mmol/l的还原型谷胱甘肽。还提供用于制备之前段落中描述的溶液的组合物。所述组合物可包含腺苷、利多卡因和钙源,其中腺苷:钙的摩尔比为0.3:0.26至0.45:0.18,并且利多卡因:钙的摩尔比为0.04:0.26至0.09:0.18。所述腺苷:钙的摩尔比可为0.4:0.22,并且利多卡因:钙的摩尔比可为0.05:0.22。所述组合物还可包含钠源、钾源和镁源,其中钙:钠的摩尔比为0.26:130至0.18:160,钙:钾的摩尔比为0.26:4至0.18:7,并且钙:镁的摩尔比为0.26:11至0.18:15。所述钙:钠的摩尔比可为0.22:147,所述钙:钾的摩尔比可为0.22:5.9,并且所述钙:镁的摩尔比可为0.22:13。所述组合物还可包含氯化物、葡萄糖、胰岛素、d-甘露醇、丙酮酸和还原型谷胱甘肽。如本文中所述溶液可用于再灌注供体心脏,并且本公开包括供体心脏再灌注的方法以及本文中所述溶液用于再灌注供体心脏的用途。可在将所述心脏从所述供体移出期间,将所述心脏用所述溶液再灌注。可将所述心脏在从所述供体移出后于再灌注装置中再灌注。可在将所述心脏从所述供体移出后,立即将所述心脏用所述溶液再灌注至少3分钟。所述供体可为循环死亡后的供体。所述再灌注可在高于约25℃且低于约37℃的温度下进行。所述再灌注可在再灌注期间于约35℃的温度下进行。在这样的方法或用途中,本公开所选择的实施方案涉及溶液,其用于浸渍和浸浴(bathing)获得的心脏,同时流过所述心脏及其脉管系统。本公开的一些实施方案涉及溶液用于离体维持获得的心脏以降低或改善获得后的缺血损伤的用途。本公开的一些实施方案涉及离体维持获得的心脏以将获得后缺血损伤的发生和程度最小化的方法。附图简要说明在附图中仅以示例的方式说明本发明的实施方案。图1为概括实施例1所用实验方案的流程示意图;图2为显示初始3分钟再灌注期后获得的猪心脏中所达到的心肌温度的图表;图3为显示再灌注温度对通过获得的猪心脏的冠状动脉血流量的影响(在初始3分钟再灌注期后测量)的图表;图4为显示再灌注温度对通过获得的猪心脏的血流的冠状血管阻力的影响(在初始3分钟再灌注期后测量)的图表;图5为显示再灌注温度对来自获得的猪心脏的冠状窦乳酸盐冲洗物的影响(在初始3分钟再灌注期后测量)的图表;图6为显示再灌注温度对灌注溶液中肌钙蛋白i(心肌损伤标志物)蓄积的影响(获得猪心脏后5小时测量)的图表;图7(a)是在5℃下再灌注的获得的猪心脏的截面的代表性显微照片,其显示肿胀的内皮细胞排列在毛细血管上,而图7(b)是在35℃下再灌注的获得的心脏的截面的代表性显微照片,其显示正常的内皮细胞排列在毛细血管上;图8是呈现在获得的猪心脏中对内皮细胞和肌细胞损伤的平均程度的图表,其如在电子显微术显微照片中所观察,并用评分系统评分,其作为再灌注温度的函数;图9为显示再灌注温度对获得的猪心脏的心脏指数的影响的图表,其在获得所述猪心脏后1小时(“t1”)、3小时(“t3”)和5小时(“t5”)时测量;图10为显示再灌注温度对获得的猪心脏的收缩功能的影响的图表,其在获得所述猪心脏后1小时(“t1”)、3小时(“t3”)和5小时(“t5”)时测量;图11为显示再灌注温度对获得的猪心脏的舒张功能的影响的图表,其在获得所述猪心脏后1小时(“t1”)、3小时(“t3”)和5小时(“t5”)时测量;图12为概括实施例2中所用心脏停搏溶液的温度和ca2+离子浓度的示意图表;图13为概括实施例2中所用实验方案的流程示意图;图14为显示再灌注液中ca2+离子浓度对获得的猪心脏的增重的影响(获得后1小时测量)的图表;图15为显示在获得的猪心脏中再灌注液中ca2+离子浓度对心输出量的影响(获得后1小时测量)的图表;图16为显示在获得的猪心脏中于心缩期期间ca2+离子浓度对左心室的收缩性的影响(获得后1小时测量)的图表;图17为显示在获得的猪心脏中于心舒期期间ca2+离子浓度对左心室的舒张的影响(获得后1小时测量)的图表;图18为概括实施例3中所用心脏停搏溶液的温度、ca2+离子浓度和ph值的示意图表;图19为概括实施例3所用实验方案的流程示意图;图20为显示心脏停搏再灌注溶液的ph对获得的猪心脏的增重的影响(获得后1小时测量)的图表;图21为显示在心脏停搏再灌注溶液的ph对获得的猪心脏的心输出量的影响(获得后1小时测量)的图表;图22为显示在获得的猪心脏中于心缩期期间心脏停搏再灌注溶液的ph对左心室的收缩性的影响(获得后1小时测量)的图表;图23为显示在获得的猪心脏中于心舒期期间心脏停搏再灌注溶液的ph对左心室的舒张的影响(获得后1小时测量)的图表;图24为概括实施例4中使用的心脏停搏再灌注溶液的温度、ca2+离子浓度和ph值以及再灌注次数的持续时间的示意图表;图25为概括实施例4第1部分所用实验方案的流程示意图;图26为显示初始再灌注持续时间对获得的心脏增重的影响的图表;图27为显示初始再灌注持续时间对获得的猪心脏的心肌功能的影响的图表,其在获得所述猪心脏后1小时(“t1”)、3小时(“t3”)和5小时(“t5”)时测量;图28为概括实施例4第2部分所用实验方案的流程示意图;图29为显示延长用含有降低浓度的麻醉剂的心脏停搏再灌注溶液的初始再灌注对获得的猪心脏增重的影响的图表;图30为显示延长用含有降低浓度的麻醉剂的心脏停搏再灌注溶液的初始再灌注对获得的猪心脏的心肌功能的影响的图表,其在获得后1小时(“t1”)、3小时(“t3”)和5小时(“t5”)时测量;以及图31为显示心脏停搏再灌注溶液中麻醉剂的浓度对获得的猪心脏的心肌功能的意向的图表,其在获得后1小时(“t1”)、3小时(“t3”)和5小时(“t5”)时测量。发明详述除非另有定义,否则本文中所用的全部技术和科学术语具有与本发明所属领域普通技术人员通常理解相同的含义。为了能够充分理解本文中所述发明,本文中提供以下术语和定义。词语“包含/包括(comprise)”或诸如“包含/包括(comprises)”或“包含/包括(comprising)”的变化应理解为指包括所示整数或整数组,但不排除任何其它整数或整数组。术语“约”或“大约”意指在给定值或范围的20%以内,优选10%以内,并且更优选5%以内。术语“后负荷”意指心室为了收缩而产生的平均张力。这也能视作心脏射血必须针对的“负荷”。因此,后负荷是主动脉大血管顺应性、波反射和小血管阻力(左心室后负荷)或类似肺动脉参数(右心室后负荷)的结果。术语“前负荷”意指单一心肌细胞在临收缩前的拉伸,并因而与肌节长度有关。由于肌节长度不能在完整心脏中测定,采用其它前负荷指标,如心室舒张期末容积或心室舒张期末压。例如,当静脉回流增加时,前负荷增加。术语“心肌细胞”意指心脏肌肉细胞。术语“每搏输出量”(sv)意指单次收缩中的右/左心室的射血量。其是舒张期末容积(edv)与收缩期末容积(esv)之间的差异。在数学上,sv=edv-esv。每搏输出量受前负荷、后负荷和收缩变力性(inotropy)(收缩性)变化的影响。在正常心脏中,后负荷对sv影响不强烈,而在衰竭心脏中,sv对后负荷变化高度敏感。术语“搏出功”(sw)指左或右心室将每搏输出量分别射入主动脉或肺动脉所作的功。由压力/容积环封闭的面积是心室搏出功的量度,其是每搏输出量和平均主或肺动脉压(后负荷)的产物,取决于所考虑的是左心室还是右心室。术语“射血分数”(ef)指每次收缩期间从心室射出的舒张期末容积的分数。在数学上,ef=sv/edv。健康心室通常射血分数大于0.55。低ef通常表明收缩功能障碍,且严重心力衰竭能导致ef小于0.2。ef也用作心脏收缩变力性(收缩性)的临床指标。收缩变力性增加导致ef上升,而收缩变力性减少会降低ef。术语“收缩期末压力容积关系”(espvr)描述左心室在任何给定左心室容积或者右心室在任何给定右心室容积,可能发展的最大压力。这意味着pv环无法跨越就任何给定收缩状态定义espvr的线。espvr斜率(ees)代表收缩期末弹性,其提供心肌收缩性指标。espvr对前负荷、后负荷和心率变化相对不敏感。这使其成为相对于其它血液动力学参数(如射血分数、心输出量和每搏输出量)改良收缩功能指标。随着收缩变力性(收缩性)增加,espvr变得更陡并左移。随着收缩变力性(收缩性)减小,espvr变得更平并右移。术语“前负荷补充搏功关系”(prsw)指心肌收缩性量度,且是sw与edv之间的线性关系。术语“压力-容积面积”(pva)指心室收缩产生的总机械能。这等于搏出功(sw)(由pv环涵盖)与弹性势能(pe)之和。在数学上,pva=pe+sw。术语“dp/dtmax”是左心室整体收缩性的量度。心缩期间的收缩力越大,左心室压力增加率越高。术语“dp/dtmin”是心舒期间左心室舒张的量度。如本文中所使用,术语“dcd”意指循环死亡后的供体,或者心脏死亡后的供体。如本文中所使用,术语“dbd”意指脑死亡后的供体。术语“langendorff灌注”指用营养丰富的氧合溶液经主动脉逆向灌注切离的心脏的方法。反向的压力引起主动脉瓣关闭,从而迫使所述溶液进入冠状血管,这向心脏组织提供血液。这为心肌转运营养物和氧气,允许其从动物中移出后继续跳动数小时。如本文中所使用,术语“工作心脏”指临床离体冠状动脉灌注通过整个切离的心脏,这是通过经左心房的心室填充和经主动脉的左心室射血进行的,其由心脏收缩功能和常规心律驱动。切离的心脏在langendorff制剂中由套管连接到灌注液储存器和循环泵。“工作心脏”模式中通过切离的心脏的灌注液流的方向与langendorff灌注期间灌注液流的方向相反。术语“缺血”意指抑制血流和氧气进入心脏时发生的病况。如本文中所使用,术语“再灌注”意指使溶液通过心脏以再建立氧供应,并向所述心脏提供保护性或保存性材料,诸如通过将所述溶液在灌注装置至泵送至心脏中,并任选地将所述心脏浸入所述溶液中。任选地,在再灌注期间,可将所述心脏浸入至富含氧的灌注溶液,其可与所述再灌注溶液相同,或者可为不同的溶液。如本文中所使用,术语“再灌注损伤”指在缺血阶段或缺氧后经灌注溶液向组织供氧时,获得的心脏中发生的组织损伤。缺血阶段期间剥夺心脏充足的氧和营养造成病况,其中循环恢复通过诱导氧化应激而不是恢复正常功能而导致炎症和氧化损伤。如本文中所使用,术语“心脏停搏”意指为了保存心肌健康的目的,心搏的策划且暂时的停止,或者停止或降低的心搏的维持,诸如通过阻滞或者停止心脏搏动,其包括通过显著降低氧和代谢底物的提供的时期。可以通过冷却或通过施用含一种或多种会导致心肌麻痹的化学品的溶液,或者通过二者同时地使跳动心脏停搏。在本公开的实施方案中,还可通过向心肌膜提供有限的氧和其它供给来实现心脏停搏,以保留其健康而不完全恢复心脏的心脏搏动。如本文中所使用,术语“心脏停搏溶液”意指包含在含有保存或保护心脏细胞功能的组分的混合物中的导致或维持心脏的无收缩(瘫痪)的化学组分的溶液。如本文中所使用,术语“稳态”指在获得的心脏的肌细胞内或之间维持相对稳定的代谢平衡。如本文中所使用,术语“正常血钾”指血液中具有或表征为正常浓度的钾离子。人血液中正常血清钾离子水平范围是3.5meq/l-5.0meq/l。如本文中所使用,术语“高血钾”指血液中具有或表征为比正常血钾浓度显著上升的钾离子浓度。高血钾浓度包括超过6.0meq/l的任何钾离子浓度。如本文中所使用,术语“低温”指小于约20℃的温度。从循环死亡(dcd)后的供体合乎伦理地获取可移植心脏必须发生的医学上和法律上规定的事件势必造成心搏骤停和一系列导致心肌损伤的缺血事件的发生。这些预定的事件不能够被修改。缺血伴随着进入和离开心肌细胞的离子交换模式显著变化,其作为主要为供氧缺失的结果。随着氧气可用性降低和停止,心肌细胞代谢从有氧变成无氧,直接后果是胞内ph水平迅速降低。低细胞内ph导致从肌细胞分泌入胞外空间的h+离子的量增加。同时由于因为降低的细胞内atp水平而显著降低的na+/ca2+离子交换,跨细胞膜的离子电位减小。最终结果是胞内ca2+水平超负荷增加。胞内ca2+增加的水平活化破坏细胞结构的ca2+依赖性蛋白酶,这导致细胞死亡。这类破坏的严重性随着缺血情况的持续时间而增加。可通过获得后尽快在血液或血液替代产品中再灌注获得的心脏来减少在获取供体心脏期间发生的缺血损伤,所述血液替代产品例如viaspan和(celsior是genzymecorp.,cambridge,massachusetts,u.s.a.的注册商标)。再灌注导致细胞外ph的快速升高,其导致h+离子向细胞外空间稳健的分泌。h+离子移动入细胞外空间驱动na+离子进入细胞。较高的细胞内na+离子浓度逆转跨心脏细胞膜的na+/ca2+离子交换,这导致“反向模式”分泌蓄积的胞内na+离子,这伴随有ca2+离子流入、atp合成恢复,和随后的ca2+离子再分泌。然而,尽管再灌注可在获得的心脏中重建有氧呼吸和代谢,再灌注通常导致对心脏肌细胞的进一步损伤(称作再灌注损伤)。例如,胞内ph水平的立即增加导致活性氧物质产生,其激活亚细胞信号,进而活化导致细胞凋亡和细胞因子释放的炎症级联反应。另外,活性氧物质直接破坏dna结构和蛋白质结构,从而导致细胞死亡。另一与常规的再灌注技术相关的问题是在这些技术中,在再灌注过程中非常难以调节ca2+离子的胞内水平,在此再灌注进一步增加心脏肌细胞的胞内ca2+离子超负荷。当心脏肌细胞在再灌注期间有胞内ca2+离子超负荷时,心脏收缩势必造成破坏型坏死,将其称为收缩带坏死,其为大规模肌原纤维收缩的结果。收缩带坏死被认为是最严重的再灌注损伤形式。因此,在获取后即刻和再灌注期间冷却供体心脏的基本原理是尽快降低心肌细胞内的代谢活性,以使再灌注期间活性氧物质的产生最少化,并使再灌注期间的后续胞内ca2+离子超负荷最少化。我们已发现对供体心脏的心肌损伤可通过着眼于维持获得和再灌注过程期间心脏内和周围钙离子稳态的策略来最小化。我们的策略包括两部分,其中第一部分是氧合心脏停搏组合物,其用作在获得的心脏的获取期间的再灌注溶液,并且其持续获得(期间将获得的心脏再灌注)后即刻的时间,优选持续至少3分钟。所述再灌注溶液导致在再灌注下供体心脏节律性跳动的立即停止。所述至少3分钟的再灌注时期(从获得心脏后即刻开始)被称作即刻-早(ie)期。我们策略的第二部分是在获取过程期间和获得后再灌注阶段期间避免冷却心脏,相反在获得期间、ie再灌注期间和获得的心脏后续离体维持期间维持常温条件。已认识到,在供体心脏细胞内钙超负荷被解决之前以及心脏内atp储存充足之前,防止肌细胞收缩是有益的。预计在一段时间的再灌注或灌注之后,随着氧气和能量底物被递送至心脏,心脏可以再次开始跳动。然而,如果在存在细胞内钙超负荷时心脏再次开始跳动,这会导致挛缩。因此,期望在重新开始肌细胞收缩或完全恢复心搏之前降低细胞内钙离子浓度以消除或防止细胞内钙超负荷,这能够减少再灌注损伤。我们的结果表明细胞内钙浓度及相应的再灌注损伤可通过控制(至少部分控制)再灌注液中的钙含量来降低。当选择用于在约25℃至约37℃的温度下,(例如用于移植的dcd心脏的)再灌注的心脏停搏组合物的组分及其浓度时,需要考虑很多因素。为降低或最小化在再灌注期间对这样的供体心脏的心肌损伤,可需要考虑到这些因素的平衡方法。例如,潜在并发症的来源是特定离子的细胞内浓度(特别是ca2+或h+离子的细胞内浓度,如果其没有被恰当地控制可导致心肌损伤)可能对这些离子以及其它离子的细胞外浓度敏感。例如,预计肌细胞中的细胞内ca2+浓度不仅被细胞外ca2+浓度影响,也由于质膜中特定的离子交换而被其它离子的细胞外浓度影响(如h+和na+)。因此,细胞内钙离子浓度可通过改变ca2+、na+和h+中一种或多种的细胞外浓度来调整。然而,除了优化细胞内ca2+之外,h+和na+的细胞外浓度的变化可导致能够影响心肌损伤其它方面的其它改变。另一个要考虑的因素是在再灌注液中提供足够的钙离子以避免称作“钙反常”的现象—其中低钙性心肌重新暴露在正常水平的ca2+下,细胞会变得ca2+超负荷,其可导致显著的细胞损伤或破坏。为获得最优结果,当选择组分及其各自的浓度时,应以平衡的方法考虑这些不同的影响。在一实施方案中,用作再灌注溶液的溶液可包含以下组分:-保存混合物,其可包含用于提供氧化磷酸化支持的腺苷,以及用于防止肌细胞在再灌注期间收缩的利多卡因。另外,还可包含相对高浓度的mg2+,因为高镁血症也被认为有助于防止在再灌注期间的肌细胞收缩。例如,所述混合物可包含0.3-0.45mmol/l的腺苷,0.04-0.09mmol/l的利多卡因以及11-15mmol/l的mg2+。-浓度为0.18mmol/l至0.26mmol/l的ca2+,以提供比正常心脏中细胞外钙离子生理浓度低的浓度。-na+,例如浓度为130mmol/l至160mmol/l,以提供适合的细胞外钠离子浓度。-正常血钾浓度(如4-7mmol/l)的k+。-浓度为例如70-180mmol/l的cl-。但是在一些实施方案中,cl-浓度可更高,如溶液中高达约180mmol/l,在一些实施方案中,具有较低的cl-浓度可能是有益的,例如70-140mmol/l或至多140mmol/l。-ph缓冲剂,其用于维持再灌注溶液在对于再灌注期望的操作温度下的ph为高于6.7且低于7.4。所述ph缓冲剂可由例如16-24mmol/l的hco31-和0.9-1.4mmol/l的h2po41-的组合来提供。-能量代谢底物,如8-12.5mmol/l的葡萄糖和0.75-1.25mmol/l的丙酮酸的组合。-用于获得合适的渗量的浓度的渗透剂,例如100-140mmol/l的d-甘露醇。-用于获得针对活性氧物质合适的保护程度和生理水平还原的浓度的抗氧化剂或还原剂,例如2.5-3.5mmol/l的还原型谷胱甘肽。-任选存在地一种或多种生长因子,例如7.5-12.5iu/l的胰岛素。在使用时,可将预先制备的心脏停搏组合物在使用前滴定到期望的ph,使得所述组合物在期望的再灌注温度下,在再灌注时具有期望的ph。用于在与所述心脏停搏组合物接触后造成供体心脏是节律性跳动立即停止的心脏停搏组合物可包含腺苷-利多卡因混合物,正常血钾浓度的钾离子,选择浓度以将获得的心脏的肌肉细胞中胞内ca2+离子水平维持于约10-4mmol/l的ca2+离子,和ph6.9。适合的腺苷-利多卡因混合物可包含300μmol/l、325μmol/l、350μmol/l、375μmol/l、400μmol/l、425μmol/l、450μmol/l的腺苷和40μmol/l、45μmol/l、50μmol/l、55μmol/l、60μmol/l、70μmol/l、80μmol/l、90μmol/l的利多卡因。所述心脏停搏组合物可另外包含8.0-12.5mmol/l的葡萄糖,120-140mmol/l的nacl,4.0-7.0mmol/l的kcl,12.0-16.0mmol/l的nahco3,0.9-1.4mmol/l的nah2po4,0.18-0.26mmol/l的cacl2,11.0-15.0mmol/l的mgcl2,7.5-12.5iu/l的胰岛素,100.0-140.0mmol/l的d-甘露醇,0.75-1.25mmol/l的丙酮酸以及2.5-3.5mmol/l的还原型谷胱甘肽。在具体的实施方案中,心脏停搏组合物可包含400μmol/l的腺苷;50μmol/l的利多卡因;10.0mmol/l的葡萄糖;123.8mmol/l的nacl;5.9mmol/l的kcl;20mmol/l的nahco3;1.2mmol/l的nah2po4;0.22mmol/l的cacl2;13.0mmol/l的mgcl2;10.0iu/l的胰岛素;120.0mmol/l的d-甘露醇;1.0mmol/l的丙酮酸;和3.0mmol/l的还原型谷胱甘肽。可通过在用于浸浴和再灌注获得的供体之前和期间,使o2气流经过心脏停搏组合物起泡,对所述心脏停搏组合物进行氧合。本公开的另一个所选择的实施方案涉及所选择的氧合的心脏停搏组合物用于在约35℃的温度下再灌注获得的心脏的用途。因此,将所选择的氧合的心脏停搏组合物温热到约35℃,然后在获取期间以及完成获取后的后续ie再灌注期间(持续至少3分钟)接触心脏。常温条件下于所选择的氧合的心脏停搏组合物中进行初始ie再灌注阶段后,可通过将获得的心脏装入合适装置来复苏以离体维持具有收缩功能的获得的心脏,这是通过将装置内提供的管道设施与心脏主动脉、肺动脉、肺静脉和腔静脉互联,并将切离的心脏在恒定流动的灌注液中浸浴来进行,所述灌注液包括氧合血和/或氧合血替代溶液。另外,恒定流动的灌注溶液流经心室,同时其维持于该装置内。这类装置一般由以下配制:(i)灌注液泵送系统,(ii)流量传感器,其用于监控灌注液流入或流出所装的心脏主动脉、肺动脉、肺静脉和腔静脉,(iii)ecg装置,其与切离的心脏可互连,(v)探针,将所装心脏与仪器互连以监控切离的心脏的生理功能,其使用负载无关指标和负载依赖性指标,以及任选存在的(vi)起搏器,其用于启动或维持心脏收缩功能。预期使用本文中公开的实例氧合的心脏停搏组合物再灌注从供体移出的心脏用于移植可为获得的心脏提供离体维持心脏所必需的离子补足物以继续产生atp并将过量钙泵出心肌细胞,同时使心脏保持麻痹状态,即非跳动停搏状态,从而最小化发生收缩带坏死的可能性。尽管不希望受任何特定理论约束,使用这样的心脏停搏组合物在约25℃至约35℃的温度下再灌注获得的心脏可能在植入受体对象后,促进钙离子稳态的快速恢复并促进获得的心脏更迅速复原及功能性操作。不希望受任何特定理论限制,还预期当从dcd供体移出的心脏在其从供体移出后立即用适合的具有控制的钙离子浓度和ph的心脏停搏溶液再灌注足够时间时,可以避免心脏中过度的再灌注损伤,例如由细胞内钙超负荷导致的那些,而在再灌注期间或之后未将dcd心脏冷却至低于约25℃,并且提供适于移植的心脏。在一实施方案中,这样的溶液可包含心脏停搏混合物。所述混合物包含钙离子源以及用于维持所述溶液的ph的缓冲剂。所述溶液中钙离子(ca2+)的摩尔浓度为0.18-0.26mmol/l,并且ph低于7.4且高于6.6。所述溶液中钙离子(ca2+)的摩尔浓度可为0.22mmol/l。ph可为6.8-7.0,诸如6.9。在具体的实施方案中,所述心脏停搏混合物可包含腺苷、利多卡因和镁离子源,诸如0.3-0.45mmol/l的腺苷、0.04-0.09mmol/l的利多卡因和11-15mmol/l的mg2+。所述溶液还可包含钠离子源和钾离子源,诸如约130mmol/l至约160mmol/l的na+和4-7mmol/l的k+。所述溶液还可包含氯化物、渗透缓冲剂和抗氧化剂或还原剂。例如,适合的渗透缓冲剂可包括d-甘露醇、乳糖酸盐、葡聚糖、白蛋白等。适合的抗氧化剂可包括还原型谷胱甘肽、白藜芦醇、爱帕琳肽(apelin)类似物等。所述溶液可包含例如70-140mmol/l的氯化物、100-140mmol/l的d-甘露醇和2.5-3.5mmol/l的还原型谷胱甘肽。所述溶液可包含用于能量代谢的底物,诸如葡萄糖、丙酮酸、游离脂肪酸(例如油酸盐或棕榈酸盐)、甘油三酯等中的一种或多种。例如,在一些实施方案中,所述溶液可包含8-12.5mmol/l的葡萄糖和0.75-1.25mmol/l的丙酮酸。所述溶液可包含一种或多种生长因子,诸如胰岛素、心脏营养素-1、红细胞生成素、血小板衍生生长因子(pdgf)、多种形式的成纤维细胞生长因子(fgf)等。例如,所述溶液可包含7.5-12.5iu/l的胰岛素。因此,根据本申请,所述溶液可包含0.3-0.45mmol/l的腺苷;0.04-0.09mmol/l的利多卡因;8-12.5mmol/l的葡萄糖;110-130mmol/l的nacl;4-7mmol/l的kcl;16-24mmol/l的nahco3;0.9-1.4mmol/l的nah2po4;0.18-0.26mmol/l的cacl2;11-15mmol/l的mgcl2;7.5-12.5iu/l的胰岛素;100-140mmol/l的d-甘露醇;0.75-1.25mmol/l的丙酮酸;和2.5-3.5mmol/l的还原型谷胱甘肽。更具体地,所述溶液可包含0.4mmol/l的腺苷;0.05mmol/l的利多卡因;10mmol/l的葡萄糖;123.8mmol/l的nacl;5.9mmol/l的kcl;20mmol/l的nahco3;1.2mmol/l的nah2po4;0.22mmol/l的cacl2;13mmol/l的mgcl2;10iu/l的胰岛素;120mmol/l的d-甘露醇;1mmol/l的丙酮酸;和3mmol/l的还原型谷胱甘肽。在不同实施方案中,用于再灌注离体心脏的溶液可包含心脏停搏混合物,其含有用于使心脏麻痹和防止再灌注期间肌细胞收缩的麻醉剂;以及用于保护或恢复心脏的心脏功能的药剂,所述药剂包含选择用于恢复或维持在约25℃至约35℃的温度下心脏中钙离子稳态的量的钙源、钠源和钾源。所述溶液的温度可为约25℃至约35℃,诸如约35℃。如本领域技术人员可理解,本文中公开的溶液可在使用前准备并储存,或者所述溶液可在即用前通过混合预包装组合物或材料来制备,或者通过向预制剂中加入诸如水或缓冲溶液的溶剂以形成期望的溶液。例如,用于制备再灌注溶液的组合物可包含腺苷、利多卡因和钙源的混合物。腺苷:钙的摩尔比可为0.3:0.26至0.45:0.18,诸如0.4:0.22,并且利多卡因:钙的摩尔比可为0.04:0.26至0.09:0.18,诸如0.05:0.22。所述组合物还可包含钠源、钾源和镁源。钙:钠的摩尔比可为0.26:130至0.18:160,诸如0.22:147。钙:钾的摩尔比可为0.26:4至0.18:7,诸如0.22:5.9。钙:镁的摩尔比可为0.26:11至0.18:15,诸如0.22:13。所述组合物还可包含氯化物,以及葡萄糖、胰岛素、d-甘露醇、丙酮酸和还原型谷胱甘肽中的一种或多种。可将所述组合物与适合的ph缓冲剂混合,以制备期望的再灌注溶液,诸如本文中所述选择的再灌注溶液。另外的实施方案涉及保存和制备用于移植的心脏的方法。例如,在用于再灌注用于移植的心脏的方法中,可将所述心脏用本文中公开的再灌注溶液于再灌注装置中再灌注。所述再灌注装置可与常规的再灌注装置类似,并且可类似地操作,除了将灌注溶液用本文中所述的再灌注溶液替换。例如,由questmedicalinc.,allen,tx,usa提供的quest2心肌保护系统可用作再灌注装置。还可将体积输注泵用于泵送所述再灌注溶液。输注器(诸如通常由创伤患者使用的)或者类似的输注器可用于再灌注。例如,在再灌注装置中可使用belmonttm快速输注器ri-2。可在将所述心脏从所述心脏的供体移出后,立即将所述心脏用所述再灌注溶液再灌注至少3分钟。所述供体可为dcd供体,并且在获取、再灌注、灌注、储存和移植操作的任意阶段时,可将dcd心脏维持在高于约25℃且低于约37℃的温度下,诸如约35℃。其它的实施方案涉及维持用于移植的心脏的方法。例如,可处理所述心脏以维持在约25℃至约37℃的温度下心脏中的钙离子稳态,诸如通过使用如本文中公开的适合的溶液或组合物。如现在可理解,本文中公开的溶液的实施方案可用于在心脏移出期间,或者在心脏从供体移出后即刻或者上述二者期间再灌注供体心脏。此外,所述溶液还可在可能适合的其它时候或者为了其它目的时用作灌注溶液。方便地,可将所述心脏从循环死亡(dcd)后的供体在约25-37℃的温度下移出。在不同的实施方案中,本文中的所述溶液还可用于再灌注其它类型的心脏,诸如从脑死亡(dbd)后的供体移出的心脏。在一些实施方案中,所述溶液还可在较低温度下使用。尽管在本文中参照再灌注或心脏停搏溶液或组合物,或者心脏停搏混合物描述了一些实施方案,可理解它们为保存组合物、溶液或混合物,其可保存或保护细胞功能,并因此保存和保护要移植的器官中细胞的健康。提供以下实施例以更充分描述本公开,并且呈现其用于非限制性、说明性的目的。实施例在这些实施例中所使用的样品心脏停搏溶液在室温下制备,并且它们标明的ph为在室温下测量。用于制备样品溶液的利多卡因和d-甘露醇溶液由市售来源获得。通过将组分成分加入至水中来制备所有样品溶液。将水如本领域技术人员已知那样二次去离子化并灭菌。将样品溶液在使用前氧合。实施例1:显然,用于最小化对供体心脏的获得后离体创伤和损伤的策略需要理解缺血期间和再灌注期间/之后在心脏中发生的离子变化。缺血期间,心脏代谢从有氧变成无氧,然后在心肌细胞内生成质子。过量质子通过肌细胞细胞壁流出,交换经na+/k+泵进入的(ingressing)na+离子。随着保留在肌细胞内的atp被耗竭,肌细胞变得无法经na+/k+泵将进入的na+离子泵出。因此,随着缺血过程持续,蓄积了:(i)肌细胞内的na+离子和(ii)肌细胞内外的na+离子和h+离子。在再灌注期间,洗去肌细胞外的h+离子,这导致出现跨肌细胞壁的巨大的na+/h+梯度,引起na+离子大量流入肌细胞。na+离子浓度增加使得na+/ca2+泵以反向模式运作,导致随着na+/ca2+泵尝试平衡肌细胞内外的na+离子水平,ca2+离子流入肌细胞。如果ca2+超负荷肌细胞能收缩,可能发生致命的过度挛缩(其也常称为“收缩带坏死”)。因而,复苏dcd心脏的主要目标是缓解肌细胞中的ca2+离子超负荷。因此,我们的目标是如下防止获得的dcd心脏收缩:用含麻醉剂的心脏停搏液再灌注,同时提供再生atp所需底物,使得再灌注的心脏能通过泵送na+离子和ca2+离子来恢复其稳态并由此最小化缺血性再灌注创伤和损伤。由于生成atp以提供跨na+/k+泵和na+/ca2+泵交换离子所需的能量,我们的想法是再灌注获得的供体心脏会有利于更迅速地恢复离子稳态和心功能恢复。因此,第一研究评价再灌注温度对获得的供体心脏的影响。将18头猪分成3组,随后遵循图1所示流程示意图根据标准方案和医学伦理学程序处死。将6头猪分入第一组(“冷却”组)。在各个心脏的获取完成后,立即将各个心脏装入quest2心肌保护系统(mps为questmedicalinc.,allen,tx,usa的注册商标),其用于准确控制再灌注压力和温度。将来自第一组猪的获得的心脏用样品氧合的心脏停搏组合物(参见表i)灌注3分钟,所述组合物在开始再灌注过程前被冷却至5℃。开始在室温下制备心脏停搏组合物,并在室温下测量组合物的ph。在3分钟初始再灌注期中连续监测主动脉灌注压力、冠状动脉流量和心肌温度,并由2设备记录。将血气样品在初始再灌注期的0、30、60、120和180秒时测量以收集数据,尤其涉及o2分压(pao2)、co2分压(paco2)、ph水平、电解质水平、乳酸盐水平等发生的变化。表i样品i-心脏停搏溶液(ph=7.35)组分mmol/liu/l腺苷0.4利多卡因0.5葡萄糖10nacl111.8kcl5.9nahco332nah2po41.2cacl20.22mgcl22.6d-甘露醇120丙酮酸1还原型谷胱甘肽3胰岛素10初始3分钟再灌注期结束后,从quest2设备中移出各心脏并转移到离体心脏灌注(evhp)设备,在该处将其用有不断流动供应的血-steen溶液混合物(hb45g/l;xvivoperfusioninc.,englewood,co,usa)进行灌注,其中其收缩功能恢复并维持langendorff模式,35℃常温下持续6小时。连续监测主动脉压和心率,并用软件(labchart是adinstrumentspty.ltd.(bellavista,nsw,australia)的注册商标)处理。在evhp设备中用血-steen溶液混合物灌注1小时、3小时和5小时后,将各心脏从langendorff模式转换到工作模式,这是通过使左心房压从0到8mmhg并以每分钟100次心跳次数(“bpm”)起搏心脏进行的。测量心输出量、冠状动脉血流量、主动脉根和冠状窦血气,并用压力-容积环导管评估心功能。这些测量完成后,各心脏立即返回langendorff模式。将5头猪分入第二组(“放凉”组),并以如上对第一组所描述进行处理,除了ie再灌注用如表i中所示的样品氧合的心脏停搏组合物(在开始再灌注过程前放凉至25℃)完成。将7头猪分入第三组(“正常温度”组),并以如上对第一组所描述进行处理,除了ie再灌注用如表i中所示的样品氧合的心脏停搏组合物(在开始再灌注过程前温热到35℃)完成。图2的数据显示在接受用冷却到5℃的样品氧合的心脏停搏组合物ie再灌注处理的心脏中所记录的心肌温度在3分钟ie再灌注期结束时下降到约10℃。在接受用放凉至25℃的样品氧合的心脏停搏组合物ie再灌注的心脏中所记录的心肌温度为约25℃,而在接受用选择的氧合的心脏停搏组合物再灌注的心脏中所记录的心肌温度为约35℃。图3显示相较于接受用样品氧合的心脏停搏组合物再灌注的心脏中的冠脉血流,用放凉至25℃的样品氧合的心脏停搏组合物再灌注的心脏中的冠脉血流速度减少约15%。然而,相较于接受样品氧合的心脏停搏组合物再灌注的心脏中的冠脉血流,用冷却至5℃的样品氧合的心脏停搏组合物再灌注的心脏中的冠脉血流速度降低近50%。图4显示相较于用氧合的心脏停搏组合物再灌注的心脏,用放凉的氧合的心脏停搏组合物再灌注的心脏中的冠状血管阻力下降约40%,而冷却的氧合的心脏停搏组合物引起冠状血管阻力下降超过50%。图5显示相较于接受常温ie再灌注处理的心脏中的冠状窦乳酸盐水平,接受冷却的ie再灌注处理的心脏中的冠状窦乳酸盐降低超过50%,接受放凉的ie再灌注处理的心脏中降低约25%。图6显示相对于接受常温ie再灌注处理的心脏中观察到的水平,肌钙蛋白i(心肌损伤标志物)水平随着ie再灌注温度降低而增加。图7(a)为显示接受冷却的ie再灌注处理3分钟的心脏毛细血管中的肿胀内皮细胞的电子显微照片,而图7(b)为显示接受常温ie再灌注处理3分钟的心脏毛细血管中的典型表现正常的内皮细胞的电子显微照片。图8为比较来自接受冷却的ie再灌注3分钟的心脏与来自接受常温ie再灌注3分钟的心脏的内皮细胞损伤和肌细胞损伤的评分的图表。图9为显示用放凉的氧合的心脏停搏组合物以及用冷却的氧合的心脏停搏组合物的ie再灌注对心脏指数的影响,以及用常温氧合的心脏停搏组合物进行ip灌注的影响的图表。图10为比较在用血-steen溶液混合物进行心脏复苏及灌注1小时(“t1”)、3小时(“t3”)和5小时(“t5”)后,初始ie再灌注温度对获得的心脏后续收缩功能的影响的图表。图11为比较在用血-steen溶液混合物进行心脏复苏及灌注1小时(“t1”)、3小时(“t3”)和5小时(“t5”)后,初始ie再灌注温度对获得的心脏后续舒张功能的影响的图表。该研究收集的数据证明初始再灌注条件(其持续仅3分钟)显著影响从猪dcd供体获得的心脏的获得后创伤的严重性以及功能恢复。实施例2:第二研究评估降低心脏停搏溶液中ca2+离子浓度的影响,以测定降低肌细胞外ca2+离子水平是否会使na+/ca2+泵的反向模式功能最小化,从而减少肌细胞内ca2+离子的蓄积。因此,该研究评价样品氧合的心脏停搏溶液中50μmol/l、220μmol/l、500μmol/l和1250μmol/l的ca2+离子的效果(图12)。这些样品溶液的组分如表ii中所示。所述样品溶液也在室温下制备,并且在室温下测量它们所标明的ph值,如同对于实施例i中的样品溶液所述,但是分别具有0.05、0.22、0.5或1.25mmol/l的不同的氯化钙浓度。该实施例中的所有再灌注在35℃下进行。表ii样品ii-心脏停搏溶液(ph=7.35)将24头猪分成4组,然后遵循图13所示流程示意图根据标准方案和医学伦理学程序处死。完成各心脏获取后,将各心脏立即装入quest2心肌保护系统。将来自第一组猪的获得的心脏用样品氧合的心脏停搏组合物(包含50μmol/lca2+离子)灌注(所述组合物温热至35℃,然后开始再灌注过程)3分钟。将来自第二组猪的获得的心脏用样品氧合的心脏停搏组合物(包含220μmol/lca2+离子)灌注(将所述组合物温热至35℃,然后开始再灌注过程)3分钟。将来自第三组猪的获得的心脏用样品氧合的心脏停搏组合物(包含500μmol/lca2+离子,将所述组合物温热至35℃,然后开始再灌注过程)灌注3分钟。将来自第四组猪的获得的心脏用样品氧合的心脏停搏组合物(包含1,250μmol/lca2+离子,将所述组合物温热至35℃,然后开始再灌注过程)灌注3分钟。在3分钟初始再灌注期间连续监测主动脉灌注压力、冠状动脉流量和心肌温度,并由2设备记录。血气样品在初始再灌注期的0、30、60、120和180秒时测量以收集数据,其与o2分压(pao2)、co2分压(paco2)、ph水平、电解质水平、乳酸盐水平等发生的变化有关。初始3分钟再灌注期完成后,从quest2设备中移出各心脏,并将其转移到离体心脏灌注(evhp)设备,在此将其用不断流动供应的血-steen溶液混合物(hb45g/l;xvivoperfusioninc.,englewood,co,usa)灌注,其中其收缩功能恢复并维持在35℃的常温下的langendorff模式持续1小时。连续监测主动脉压和心率,并使用软件处理。在evhp设备中用血-steen溶液混合物灌注1小时的时候,将各心脏从langendorff模式转换到工作模式,这是通过使左心房压从0到8mmhg并以100bpm起搏心脏进行的。测量心输出量、冠状动脉血流量、主动脉根和冠状窦血气,并用压力-容积环导管评估心功能。在这些测量完成后,将各心脏立即返回langendorff模式。图14显示用含220μmοl/lca2+离子的样品氧合的心脏停搏组合物在35℃初始再灌注的心脏比用含另3种ca2+离子浓度之一的氧合的心脏停搏组合物再灌注的心脏进展出显著更小的心肌水肿。图15显示随着氧合的心脏停搏组合物中的ca2+离子浓度从1,250μmοl/l降至220μmοl/l,再灌注心脏的心输出量(心脏重量的指标)改善。然而,用含50μmοl/lca2+离子的氧合的心脏停搏组合物再灌注的心脏心输出量非常弱。图16显示随着氧合的心脏停搏组合物中的ca2+离子浓度从1,250μmοl/l降至500μmοl/l再到220μmοl/l,再灌注心脏在心缩期间的左心室收缩性(如dp/dtmax所测)改善。然而,用含50μmοl/lca2+离子的氧合的心脏停搏组合物再灌注的心脏中左心室的收缩性非常弱。图17显示随着氧合的心脏停搏组合物中的ca2+离子浓度从1,250μmοl/l降至500μmοl/l再到220μmοl/l,再灌注心脏在心舒期的左心室舒张(如dp/dtmin所测)改善。然而,用含50μmοl/lca2+离子的氧合的心脏停搏组合物再灌注的心脏中左心室的舒张非常弱。该研究期间收集的数据证明低血钙氧合的心脏停搏组合物在35℃下显著改善心肌功能恢复。该研究中的最佳性能是采用220μmol/l的ca2+离子浓度。然而,似乎降低ca2+离子浓度太低(例如降低至50μmol/l)可能具有有害作用,其为之前被描述为“钙悖论”的现象。实施例3:下一研究评估酸化低血钙氧合的心脏停搏组合物是否有潜在的增量效益。因此,该研究评估将样品低血钙氧合的心脏停搏组合物的ph从7.9调节至7.4、至6.9和至6.4的影响。这些样品溶液iiia至iiid的组分分别如表iiia至iiid中所示。表iiia样品iiia-心脏停搏溶液(ph=7.9)组分mmol/liu/l腺苷0.4利多卡因0.5葡萄糖10nacl43.8kcl5.9nahco3100nah2po41.2cacl20.22mgcl22.6d-甘露醇120丙酮酸1还原型谷胱甘肽3胰岛素10表iiib样品iiib-心脏停搏溶液(ph=7.35)表iiic样品iiic-心脏停搏溶液(ph=6.9)组分mmol/liu/l腺苷0.4利多卡因0.5葡萄糖10nacl131.8kcl5.9nahco312nah2po41.2cacl20.22mgcl22.6d-甘露醇120丙酮酸1还原型谷胱甘肽3胰岛素10表iiid样品iiid-心脏停搏溶液(ph=6.4)所述样品心脏停搏溶液包含220μmol/l的ca2+离子,并且所有再灌注在35℃下进行(图18)。将24头猪分成4组,随后,遵循图19所示流程示意图根据标准方案和医学伦理学程序处死。完成各心脏获取后,将各心脏立即装入quest2心肌保护系统。获得自第一组猪的心脏用ph7.9的样品低血钙氧合的心脏停搏组合物灌注3分钟,将所述组合物在开始再灌注过程前温热至35℃。获得自第二组猪的心脏用调节至ph7.4的样品低血钙氧合的心脏停搏组合物灌注3分钟,将所述组合物在开始再灌注过程前温热至35℃。获得自第三组猪的心脏用调节至ph6.9的样品低血钙氧合的心脏停搏组合物灌注3分钟,将所述组合物在开始再灌注过程前温热至35℃。获得自第四组猪的心脏用调节至ph6.4的样品低血钙氧合的心脏停搏组合物灌注3分钟,将所述组合物在开始再灌注过程前温热至35℃。在3分钟初始再灌注期中连续监测主动脉灌注压力、冠状动脉流量和心肌温度,并由2设备记录。血气样品在初始再灌注期的0、30、60、120和180秒测量以收集数据,其与o2分压(pao2)、co2分压(paco2)、ph水平、电解质水平、乳酸盐水平等发生的变化有关。初始3分钟再灌注期结束后,从quest2设备中移出各心脏,并将其转移到离体心脏灌注(evhp)设备,在此将其用不断流动供应的血-steen溶液混合物(hb45g/l;xvivoperfusioninc.,englewood,co,usa)灌注,其中其收缩功能恢复并维持在35℃的常温下的langendorff模式持续1小时。连续监测主动脉压和心率,并用软件处理。在evhp设备中用血-steen溶液混合物灌注1小时后,将各心脏从langendorff模式转换到工作模式,这是通过使左心房压从0到8mmhg并以100bpm起搏心脏进行的。测量心输出量、冠状动脉血流量、主动脉根和冠状窦血气,并用压力-容积环导管评估心功能。这些测量完成后,将各心脏立即返回langendorff模式。图20显示用弱酸性(即ph6.4)的样品低血钙氧合的心脏停搏组合物在35℃初始再灌注的心脏比用更为碱性(即ph7.9、7.4、6.9)的低血钙氧合的心脏停搏组合物再灌注的那些表现出更多的心肌水肿。图21显示略微酸性的低血钙氧合的心脏停搏组合物(即ph6.9)和略微碱性的低血钙氧合的心脏停搏组合物(即ph7.4)中再灌注的心脏的心输出量(心脏重量的指标)显著优于调至ph7.9或6.4的低血钙氧合的心脏停搏组合物中再灌注的心脏的心输出量。图22显示略微酸性的低血钙氧合的心脏停搏组合物(即ph6.9)和略微碱性的低血钙氧合的心脏停搏组合物(即ph7.4)中再灌注的心脏在心缩期间的左心室收缩性(如dp/dtmax所测)显著优于调节至ph7.9或6.4的低血钙氧合的心脏停搏组合物中再灌注的心脏的左心室收缩性。图23显示略微酸性的低血钙氧合的心脏停搏组合物(即ph6.9)和略微碱性的低血钙氧合的心脏停搏组合物(即ph7.4)中再灌注的心脏在心舒期间的左心室舒张(如dp/dtmin所测)显著优于调节至ph7.9或6.4的低血钙氧合的心脏停搏组合物中再灌注心脏的左心室舒张。该研究期间收集的数据证明初始碱性的再灌注是有害的,且显著酸度(如6.4的ph)也有害。然而,看来适度酸性(如ph为6.6-6.9)是有益的。实施例4:第1部分:下一研究评估增加获得的供体再灌注持续时间是否有潜在的增量效益,所述再灌注采用弱酸性低血钙氧合的心脏停搏组合物。用于这些测试的样品溶液与上文所述样品溶液iiic相同。因此,该研究评估用样品弱酸性(ph6.9)低血钙(220μmοl/lca2+)氧合的心脏停搏液在35℃进行3分钟或9分钟再灌注的影响(图24)。用于该研究第1部分的心脏停搏溶液包含400μmοl/l腺苷和500μmοl/l利多卡因。将12头猪分成2组,然后遵循图25所示流程示意图根据标准方案和医学伦理学程序处死。完成各心脏获取后,将各心脏立即装入quest2心肌保护系统。来自第一组猪的获得的心脏用样品弱酸性低血钙氧合的心脏停搏组合物灌注3分钟,所述组合物温热至35℃,然后开始再灌注过程持续3分钟。来自第二组猪的获得的心脏用样品弱酸性低血钙氧合的心脏停搏组合物灌注9分钟,所述组合物温热至55℃,然后开始再灌注过程。在3分钟或9分钟初始再灌注期中连续监测主动脉灌注压力、冠状动脉流量和心肌温度,并由2设备记录。血气样品在初始再灌注期的0、30、60、120和180秒测量以收集数据,其与o2分压(pao2)、co2分压(paco2)、ph水平、电解质水平、乳酸盐水平等发生的变化有关。在初始3分钟再灌注期间或初始9分钟再灌注期间完成后,从quest2设备中移出各心脏,并将其转移到离体心脏灌注(evhp)设备,在此将其用不断流动供应的血-steen溶液混合物(hb45g/l;xvivoperfusioninc.,englewood,co,usa)灌注,其中其收缩功能恢复并维持在35℃的常温下的langendorff模式持续1小时、3小时和5小时。连续监测主动脉压和心率,并用软件处理。在evhp设备中用血-steen溶液混合物灌注1小时后,将各心脏从langendorff模式转换到工作模式,这是通过使左心房压从0到8mmhg并以100bpm起搏心脏进行的。测量心输出量、冠状动脉血流量、主动脉根和冠状窦血气,并用压力-容积环导管评估心功能。这些测量完成后,各心脏立即返回langendorff模式,持续另外2小时,之后重复测量(即从再灌注移出后3小时)。这些测量完成后,各心脏立即返回langendorff模式,再持续2小时,之后重复测量(即从再灌注移出后5小时)。图26显示用样品弱酸性低血钙氧合的心脏停搏组合物初始再灌注9分钟的心脏表现出的心肌水肿多于仅再灌注3分钟的那些。图27显示随着离体心脏灌注从1小时推进到3小时再到5小时,初始再灌注9分钟的心脏趋向功能恶化。这些数据表明高浓度(500μmol/l)的利多卡因可能是毒性的。第2部分:下一研究评估降低样品弱酸性低血钙氧合的心脏停搏组合物中利多卡因浓度的影响。因此,该研究评估用样品弱酸性(ph6.9)低血钙(220μmοl/lca2+)氧合的心脏停搏溶液(包含400μmol/l腺苷和50μmol/l利多卡因)在35℃进行3分钟或9分钟再灌注的影响(图28)。该样品溶液的组分如表iv中所示。表iv样品iv-心脏停搏溶液(ph=6.9)将12头猪分成2组,然后遵循图25所示流程示意图根据标准方案和医学伦理学程序处死。完成各心脏获取后,将各心脏立即装入quest2心肌保护系统。来自第一组猪的获得的心脏用样品弱酸性低血钙氧合的心脏停搏组合物灌注3分钟,所述组合物温热至35℃,然后开始再灌注过程持续3分钟。来自第二组猪的获得的心脏用样品弱酸性低血钙氧合的心脏停搏组合物灌注9分钟,所述组合物温热至55℃,然后开始再灌注过程。在3分钟或9分钟初始再灌注期中连续监测主动脉灌注压力、冠状动脉流量和心肌温度,并由2设备记录。血气样品在初始再灌注期的0、30、60、120和180秒测量以收集数据,其与o2分压(pao2)、co2分压(paco2)、ph水平、电解质水平、乳酸盐水平等发生的变化有关。在初始3分钟再灌注期间或初始9分钟再灌注期间完成后,从quest2设备中移出各心脏,并将其转移到离体心脏灌注(evhp)设备,在此将其用不断流动供应的血-steen溶液混合物(hb45g/l;xvivoperfusioninc.,englewood,co,usa)灌注,其中其收缩功能恢复并维持在35℃的常温下的langendorff模式持续1小时、3小时和5小时。连续监测主动脉压和心率,并用软件处理。在evhp设备中的血-steen溶液混合物灌注1小时的时候,各心脏从langendorff模式转换到工作模式,这是通过使左心房压从0到8mmhg并以100bpm起搏心脏进行的。测量心输出量、冠状动脉血流量、主动脉根和冠状窦血气,并用压力-容积环导管评估心功能。这些测量完成后,各心脏立即返回langendorff模式,持续另外2小时,之后重复测量(即从再灌注移出后3小时)。这些测量完成后,各心脏立即返回langendorff模式,持续另外2小时,之后重复测量(即从再灌注移出后5小时)。图29显示在含400μmοl/l腺苷和50μmοl/l利多卡因的样品弱酸性低血钙氧合的心脏停搏组合物中初始再灌注9分钟心脏中发生的心肌水肿相较于灌注3分钟心脏没有任何显著差异,。图30显示在含400μmοl/l腺苷和50μmοl/l利多卡因的样品弱酸性低血钙氧合的心脏停搏组合物中将初始再灌注期从3分钟延长到9分钟,对再灌注后灌注1小时、3小时和5小时的心脏功能恢复没有不良影响。图31组合来自第1部分(图27)与第2部分(图30)的心肌功能数据,其中显然用于初始离体获得后再灌注的心脏停搏组合物中的500μmοl/l的利多卡因浓度有使供体心脏产生衰弱的影响。该数据还表明延长初始再灌注期超过3分钟不利于在获得的供体心脏中恢复稳态和心功能。本文中所示数据表明,用于供体心脏的初始再灌注的心脏停搏溶液的可能有效组成如表iv中所示。会理解,本文中公开的任意值的范围意图具体包括所给定范围内的任意中间值或子范围,并且所有这样的中间值和子范围是独立的且具体公开的。还会理解词语“a”或“an”意指“一个或多个”或者“至少一个”,并且本文中的任意单数形式意图包括复数。会进一步理解,术语“包含/包括(comprise)”包括其任意变体意图为开放式的,并且意指“包括但不限于”,除非另外相反地具体说明。当项目列表在本文中于最后一个项目前用“或”给出时,所列项目中的任意一个或者任意两个或更多个所列项目的适合组合可被选择或使用。对上述实施方案的其它修改是可以的。因此,本发明由权利要求书限定,应给予与说明书整体一致的宽泛解释。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1