一种新型糖基化蛋白水解物运载的共轭亚油酸水包油乳液的制备方法与流程
本发明属于食品科学与工程技术领域,具体涉及一种糖基化蛋白水解物运载的共轭亚油酸水包油乳液的方法。
背景技术:
水包油(o/w)乳液是食品工业中最常见的乳液体系,然而在长时间的储存过程中容易造成油脂氧化、分层、絮凝等现象的发生,从而导致乳液的氧化稳定性和物理稳定性降低,在工业生产中,通常加入吐温(tween)、斯潘(span)、单甘脂等合成乳化剂,然而其即使具有很强的乳化效果,但是化学合成乳化剂对人体会存在潜在的危害,影响人的身体健康,从而在使用上受到了极大的限制,因此开发出绿色、安全、健康的天然乳化剂尤为重要。解决该问题的一个重要方法就是在水相中加入具有抗氧化性能力的天然乳化剂从而改善o/w乳液的稳定性。
共轭亚油酸(cla)是一种具有共轭双键体系的亚油酸,cla具有抗癌、预防心血管疾病、减脂、抗炎、抗糖尿病和抗粥样动脉硬化等潜在的生物活性,然而,cla在食品中很容易被氧化和不稳定,在加工和储存过程中会产生不良的、腐臭的气味和味道,因此cla常被加工为乳液抑制其油脂氧化。近年来,通常使用小分子表面活性剂、表面活性蛋白质或离子多糖作为外水相运载cla乳液,然而以上外水相的抗氧化性较低,难以使cla乳液长时间储存。
糖基化改性和水解改性是两种普遍存在的食品蛋白质改性方式。糖基化反应产物(mrps)在食品加工和储藏过程中较为常见,其具有较好的抗氧化性、乳化性、安全性,并且大量研究发现mrps作为乳化剂应用于o/w乳液中,能够保证乳液在长时间储存过程中不发生分层、絮凝等情况,并且提供了良好的氧化稳定性,从而减缓油脂的氧化;一些研究表明水解物具有作为乳化剂的潜在能力,并且水解物具有抗氧化性,能够抑制乳液的油脂氧化。近年来,糖基化和水解结合改性作为新型抗氧化剂和乳化剂应用于o/w乳液中得到国内外广泛的关注,然而将糖基化蛋白水解物作为外水相运载cla乳液,并探究cla乳液的氧化稳定性和物理稳定性未见报道。
技术实现要素:
本发明的目的在于解决糖基化蛋白水解物作为外水相运载cla乳液,能够提高乳液的氧化稳定性和物理稳定性的问题。利用糖基化结合蛋白酶水解技术,制备糖基化蛋白水解物,进而以糖基化蛋白水解物作为外水相运载cla水包油乳液,能够明显抑制cla中的油脂氧化,提供了一种提高乳液的物理稳定性和氧化稳定性的方法。
本发明的目的是通过以下技术方案实现的:
本发明的一种新型糖基化蛋白水解物运载的共轭亚油酸水包油乳液的制备方法,包含以下步骤:
(1)乳清分离蛋白糖基化产物溶液的制备:将乳清分离蛋白(wpi)溶于蒸馏水中配置成浓度为1%-5%(w/v)的溶液,向溶液中加入还原糖使其与wpi粉末之比为1∶1(w/w)制备为混合液,调节起始反应ph值为8,在反应温度为90℃的条件下,反应时间为4h,反应结束后迅速冷却,即制得乳清分离蛋白糖基化反应产物溶液;
(2)糖基化蛋白水解物溶液的制备:将乳清分离蛋白糖基化反应产物溶液(1)用1mol/l的naoh调节ph值为7.0,向其中添加as1.398中性蛋白酶(e/s=5%),放入45℃水浴锅中进行水解,并且水解过程中不断用1mol/l和6mol/l的naoh维持溶液的ph值为7.0,水解时间为30min-120min,水解完成时,将反应溶液置于80℃条件下灭酶10min,即制得糖基化蛋白水解物溶液;
(3)共轭亚油酸水包油乳液的制备:将共轭亚油酸(cla)和糖基化蛋白水解物溶液(2)以一定比例进行混合,将混合液用高速分散器乳化时间为4min,在分散速度为10000r/min的条件下,制备粗乳液,然后用超高压均质机将粗乳液进行均质,在60-100mpa条件下,循环4-6次形成cla水包油乳液,整个超高压均质过程在冰水浴条件下完成以减少cla的氧化。
在本发明中,优选的,所述步骤(1)中wpi溶液浓度为3%。
在本发明中,优选的,所述步骤(1)中还原糖为半乳糖。
在本发明中,优选的,所述步骤(2)中水解时间为120min。
在本发明中,优选的,所述步骤(3)中cla纯度为80%。
在本发明中,优选的,所述步骤(3)中超高压均质压力为80mpa,循环次数为6次。
在本发明中,优选的,所述步骤(3)中共轭亚油酸(cla)和糖基化蛋白水解物溶液(2)以1∶9(w/w)的比例混合。
本发明与现有技术不同之处在于本发明取得了如下技术效果:
(1)将糖基化蛋白水解120min比未水解的糖基化产物运载的cla乳液的暴露出更多的疏水基团,分子量降低,产生游离氨基,抗氧化性显著增强;
(2)将糖基化蛋白水解120min比未水解的糖基化产物运载的cla乳液在储存15天后的脂质过氧化值(pov)、硫代巴比妥酸反应性物质(tbars)、共轭二烯烃(cd)分别降低了42.28%、48.45%、19.92%;
(3)将糖基化蛋白水解120min比未水解的糖基化产物运载的cla乳液的平均粒径降低了59.68%,然而界面吸附量提高了16.51%,并且由乳析指数以及乳液微观结构的结果分析,糖基化蛋白水解120min运载的cla乳液的脂质颗粒最小、最均匀;
(4)将糖基化蛋白质水解物作为乳化剂,能够显著提高cla水包油乳液的氧化稳定性、物理稳定性及货架期,有效抑制cla遇光、热、氧气发生的油脂氧化,从而发挥cla的生物活性。
通过上述制备方法可以直接获得具有良好物理稳定性和氧化稳定性的cla水包油乳液,并为cla在食品中的应用提供了技术支持。
下面结合附图对本发明作进一步说明。
附图说明
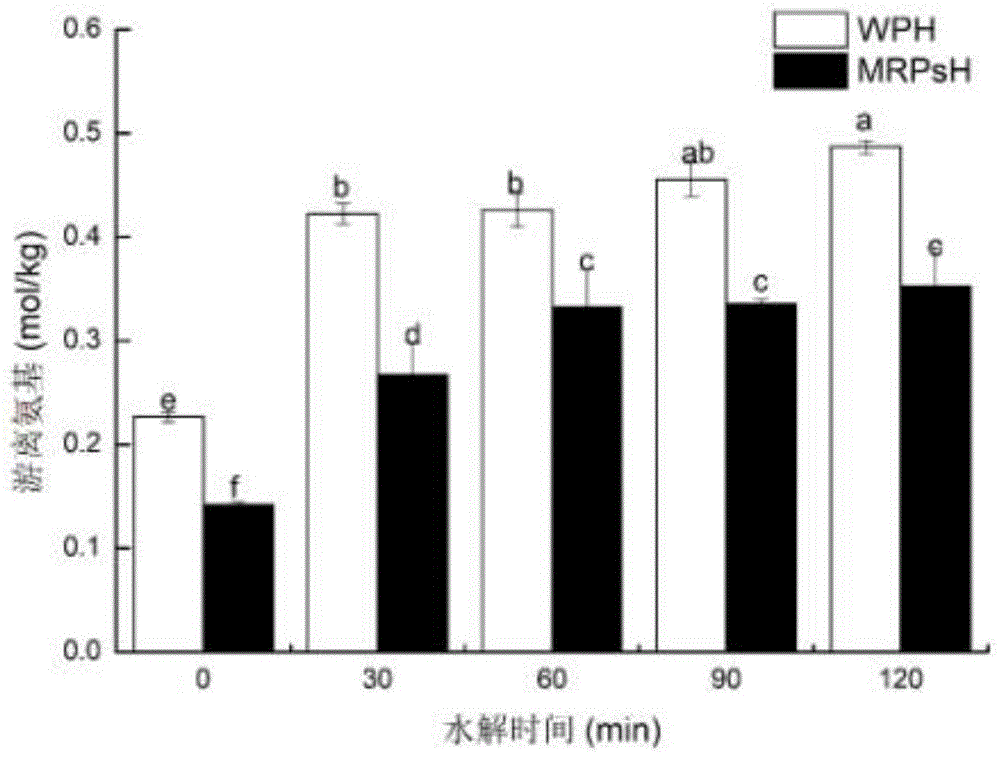
图1水解时间对糖基化蛋白水解游离氨基含量的影响
注:标注无相同字母者差异显著(p<0.05);
图2水解时间对糖基化蛋白水解分子量分布的影响
注:a为蛋白质水解物的凝胶过滤色谱图,b为糖基化蛋白水解物的凝胶过滤色谱图;
图3水解时间对糖基化蛋白水解dpph自由基清除能力的影响
注:标注无相同字母者差异显著(p<0.05);
图4水解时间对cla乳液的脂质过氧化值(pov)的影响
图5水解时间对cla乳液的硫代巴比妥酸反应性物质(tbars)的影响
图6水解时间对cla乳液的共轭二烯烃含量(cd)的影响
图7水解时间对cla乳液的平均粒径的影响
注:标注无相同字母者差异显著(p<0.05);
图8水解时间对cla乳液的乳析指数和分层情况的影响
图9水解时间对cla乳液的界面吸附量的影响
注:标注无相同字母者差异显著(p<0.05);
图10水解时间对采用共聚焦显微镜观察cla乳液的微观结构的影响
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1
一种新型糖基化蛋白水解物运载的共轭亚油酸水包油乳液的制备方法,包含以下步骤:
(1)乳清分离蛋白糖基化产物溶液的制备:将乳清分离蛋白(wpi)溶于蒸馏水中配置成浓度为3%(w/v)的溶液,向溶液中加入半乳糖使其与wpi粉末之比为1∶1(w/w)制备为混合液,调节起始反应ph值为8,在反应温度为90℃的条件下,反应时间为4h,反应结束后迅速冷却,即制得乳清分离蛋白糖基化反应产物溶液;
(2)糖基化蛋白水解物溶液的制备:将乳清分离蛋白糖基化反应产物溶液(1)用1mol/l的naoh调节ph值为7.0,向其中添加as1.398中性蛋白酶(e/s=5%),放入45℃水浴锅中进行水解,并且水解过程中不断用1mol/l和6mol/l的naoh维持溶液的ph值为7.0,水解时间为120min,水解完成时,将反应溶液置于80℃条件下灭酶10min,即制得糖基化蛋白水解物溶液;
(3)共轭亚油酸水包油乳液的制备:将共轭亚油酸(cla,纯度80%)和糖基化蛋白水解物溶液(2)以1∶9(w/w)的比例混合,将混合液用高速分散器乳化时间为4min,在分散速度为10000r/min的条件下,制备粗乳液,然后用超高压均质机将粗乳液进行均质,在80mpa条件下,循环6次形成cla水包油乳液,整个超高压均质过程在冰水浴条件下完成以减少cla的氧化。
实施例2
一种新型糖基化蛋白水解物运载的共轭亚油酸水包油乳液的制备方法,包含以下步骤:
(1)乳清分离蛋白糖基化产物溶液的制备:将乳清分离蛋白(wpi)溶于蒸馏水中配置成浓度为2%(w/v)的溶液,向溶液中加入半乳糖使其与wpi粉末之比为1∶1(w/w)制备为混合液,调节起始反应ph值为8,在反应温度为90℃的条件下,反应时间为4h,反应结束后迅速冷却,即制得乳清分离蛋白糖基化反应产物溶液;
(2)糖基化蛋白水解物溶液的制备:将乳清分离蛋白糖基化反应产物溶液(1)用1mol/l的naoh调节ph值为7.0,向其中添加as1.398中性蛋白酶(e/s=5%),放入45℃水浴锅中进行水解,并且水解过程中不断用1mol/l和6mol/l的naoh维持溶液的ph值为7.0,水解时间为90min,水解完成时,将反应溶液置于80℃条件下灭酶10min,即制得糖基化蛋白水解物溶液;
(3)共轭亚油酸水包油乳液的制备:将共轭亚油酸(cla,纯度80%)和糖基化蛋白水解物溶液(2)以1∶9(w/w)的比例混合,将混合液用高速分散器乳化时间为4min,在分散速度为10000r/min的条件下,制备粗乳液,然后用超高压均质机将粗乳液进行均质,在60mpa条件下,循环6次形成cla水包油乳液,整个超高压均质过程在冰水浴条件下完成以减少cla的氧化。
实施例3
一种新型糖基化蛋白水解物运载的共轭亚油酸水包油乳液的制备方法,包含以下步骤:
(1)乳清分离蛋白糖基化产物溶液的制备:将乳清分离蛋白(wpi)溶于蒸馏水中配置成浓度为1%(w/v)的溶液,向溶液中加入半乳糖使其与wpi粉末之比为1∶1(w/w)制备为混合液,调节起始反应ph值为8,在反应温度为90℃的条件下,反应时间为4h,反应结束后迅速冷却,即制得乳清分离蛋白糖基化反应产物溶液;
(2)糖基化蛋白水解物溶液的制备:将乳清分离蛋白糖基化反应产物溶液(1)用1mol/l的naoh调节ph值为7.0,向其中添加as1.398中性蛋白酶(e/s=5%),放入45℃水浴锅中进行水解,并且水解过程中不断用1mol/l和6mol/l的naoh维持溶液的ph值为7.0,水解时间为60min,水解完成时,将反应溶液置于80℃条件下灭酶10min,即制得糖基化蛋白水解物溶液;
(3)共轭亚油酸水包油乳液的制备:将共轭亚油酸(cla,纯度80%)和糖基化蛋白水解物溶液(2)以1∶9(w/w)的比例混合,将混合液用高速分散器乳化时间为4min,在分散速度为10000r/min的条件下,制备粗乳液,然后用超高压均质机将粗乳液进行均质,在100mpa条件下,循环6次形成cla水包油乳液,整个超高压均质过程在冰水浴条件下完成以减少cla的氧化。
实验例1:水解时间对糖基化蛋白水解物理化性质的影响
1、游离氨基含量的测定
采用opa法测定游离氨基,opa试剂是现用现制的,其制备方法如下:100mm四硼酸钠125ml,20%(wt/wt)sds12.5ml,0.2g的opa溶于5ml甲醇中,随后添加500μl的β-巯基乙醇。将所有样品用ph7.0的pbs稀释至2mg/ml,从中取100μl,向其中加入3ml的opa,立即避光反应5min,然后测定在340nm的吸光值。以l-亮氨酸为标准品,以其浓度为横坐标,吸光值为纵坐标,按上述方式测定,绘制标准曲线,其回归方程为y=1.667x+0.1397,r2=0.9991。将混合液的吸光值作为y值计算其游离氨基含量。以wpi的游离氨基含量为基准,计算其它样品的游离氨基的消耗量,计算公式为:
由图1试验结果可知,随着水解时间的延长,糖基化蛋白水解物(mrpsh)比蛋白水解物(wph)的游离氨基含量显著降低(p>0.05),水解120min时,wph的游离氨基含量为0.49mol/kg,mrpsh相比之下显著降低(p>0.05),为0.35mol/kg,说明水解消耗游离氨基,并且随着水解时间的增加,游离氨基不断增加,在水解120min时消耗量最多,这是因为糖基化反应产物经过进一步水解后,导致体系中部分氨基释放。
2、分子量分布的测定
将样品稀释至2.5mg/ml,每次上样15μl,并采用等度洗脱的方式,洗脱液是含有0.1%tfa的30%乙腈溶液,流速为0.5ml/min。检测波长为214nm。分别选择牛血清蛋白(66409da)、卵清蛋白(44300da)、胰蛋白酶抑制剂(20100da)、β-乳球蛋白(18400da)、α-乳白蛋白(14147da)、抑肽酶(6500da)、氧化型谷胱甘肽(612.63da)、还原型谷胱甘肽(307.32da),这8个分子量的标样,将其出峰的保留时间与分子量分布制成标准曲线,方程为logmw=-0.1148t+7.865,r2=0.9802其中mw表示分子量,t表示保留时间。
由图2试验结果可知,糖基化蛋白(mrps)图谱出现了两个独立峰,峰1面积大于峰2,表明wpi和半乳糖发生糖基化反应后,单体量减少而大分子聚集体增多,峰1约从23.05min开始出峰,时间早于牛血清白蛋白标准品(23.67min),因此其对应的分子量大于66409da,糖基化产物形成的过程中产生了少量小分子和中等分子量的组分,原因可能是wpi内存在一些小分子发生聚集,或者wpi内的小分子与少量半乳糖结合,或长时间的高温处理使半乳糖自身发生焦糖化。所有水解时间形成的mrpsh的图谱中均出现三个未完全分离的峰,经计算mrpsh经水解30min、60min、90min、120min对应的分子量范围分别为274.52da-88726.87da、239.80da-88706.26da、239.80da-88685.22da、238.63da-88685.22da,随着水解时间的不断增加,mrps水解物分子量分布范围逐渐减小,大分子聚合物逐渐降低,小分子肽类含量增加。
3、dpph自由基清除率的测定
将样品稀释至15mg/ml,将160μl稀释后的样品与640μl0.1mm的dpph溶液(dpph用95%乙醇溶解)混匀,室温下避光反应30min。以95%乙醇为参照液,在517nm测定吸光值。计算公式为:
a为混合dpph乙醇溶液的吸光度,ai为混合95%乙醇溶液的吸光度,aj为单独的dpph乙醇溶液的吸光度。
由图3试验结果可知,与对照组wpi与mrps相比,wph和mrpsh的dpph自由基清除能力显著增加(p<0.05),并且随着水解时间的增加而逐渐提高,然而较长的水解时间制备的mrpsh能够增加其表面疏水性。因此这些肽能够定位邻近的dpph自由基,因此水解后形成小肽能够很容易地提供氢或电子。糖基化产物的水解时间越长,糖基化蛋白水解物(mrpsh)的dpph自由基清除能力更强,这是因为其形成更多的疏水性氨基酸残基。
实验例2:cla水包油乳液产品分析:
1、脂质过氧化值(pov)的测定
吸取1ml乳液,加入5ml异丙醇和异辛烷(1∶2,v/v)的混合溶液,混合均匀后,在3000r/min的转速下离心2min。将500μl的上清液,向其中添加20μl的硫氰酸钾和20μl氯化亚铁溶液,然后将正丁醇和甲醇(1∶2,v/v)的溶液定容至5ml,混匀后在室温下避光静置20min,以甲醇和正丁醇(2∶1,v/v)的混合溶液作对照组,记测定510nm的吸光值。计算公式为:
pov为乳液的过氧化值(meq/kg),a为乳液的吸光度,k为fe3+标曲斜率,m为称取的乳液中油脂的含量(g),n为吸取上清液的体积分数。
由图4试验结果可知,在储存15天时,将wpi分别水解30min,60min,90min,120min的脂质过氧化值比未水解的wpi运载的乳液的pov分别降低了14.56%,18.56%,22.74%,30.04%。将mrps分别水解30min,60min,90min,120min,在储存15天时,其pov比未水解的mrps降低了7.35%,16.54%,31.03%,42.28%,表示mrpsh可以显著使乳液的过氧化值含量下降(p<0.05)。
2、硫代巴比妥酸反应性物质的测定(tbars)的测定
混合0.375g硫代巴比妥酸,15g三氯乙酸,12m的hcl1.76ml和82.9ml水而制备的。将0.3ml乳液,0.7ml蒸馏水以及2ml上述制备的tba混合均匀放在离心管中,并置于沸水里保持15min,结束后将离心管立刻放入冰水中冷却,然后3500×g离心15min。取离心后的上清液,将其在532nm测定吸光值。tbars的浓度是根据用1,1,3,3-四乙氧丙烷制备的标准曲线计算的。
由图5试验结果可知,在储藏15天时,将mrps进行水解30min,60min,90min,120min时,其抗氧化性比mrps下降了11.50%,16.87%,19.75%,48.45%,说明水解可以显著降低丙二醛的生成,进而提高乳液的氧化稳定性,因此能够抑制cla油脂氧化。在相同的水解时间下,mrpsh比wph运载的cla乳液的丙二醛含量显著降低(p<0.05),尤其地,在水解时间为120min时,mrpsh比wph运载的cla乳液的tbars值降低了56.07%,这是因为mrpsh比wph具有更强的抗氧化性,从而其作为乳化剂制备的cla乳液具有更好的氧化稳定性。
3、共轭二烯烃的测定(cd)的测定
将100μl乳液加入1.5ml异丙醇和异辛烷(1∶3,v/v)的混合溶液中,然后漩涡三次,每次10s。随后以548×g下离心5min,并吸取5μl上清液放入离心管中,用异辛烷将其稀释到5ml。测定其在234nm吸光值,计算公式为:
cd表示共轭二烯烃含量(μmol/l),a表示样品的吸光度,e表示油脂的摩尔消光系数(e=26000),b表示光程长度。
从图6试验结果可知,将mrps分别水解30min,60min,90min,120min时,在储存15天后,其cd值相比于未水解的mrps降低了7.25%,13.89%,22.61%,50.10%,将蛋白质水解后,其共轭二烯烃含量相比于wpi运载的乳液降低了3.98%,7.73%,13.78%,19.92%,从共轭二烯烃的降低量发现,mrpsh的共轭二烯烃降低量比wph的高,说明水解能够使乳液的氧化稳定性增强。这是因为与mrps运载的乳液相比,糖基化蛋白水解物(mrpsh)能够使蛋白质分子展开并释放氨基酸残基与氧化分子结合,并且水解能够使蛋白分子产生更多的强抗氧化活性产物作用在油-水界面上,从而起到抑制cla油脂氧化的作用。
4、粒径测定
采用粒度分布仪测定乳液的粒径。用ph值为7.0的pbs缓冲液将所有乳液样品稀释至1mg/ml,然后将稀释液放入试管中待测。所有稀释液均在25℃条件下测定,并平行测定三次。
从图7中试验结果可知,与对照组wpi和mrps运载的乳液相比,其水解物wph和mrpsh运载的乳液的平均粒径显著降低(p<0.05),并且wph和mrpsh运载的乳液的平均粒径随水解时间的增加而显著降低(p<0.05)。在全部水解时间中,相比于wph运载的乳液,mrpsh运载的乳液的平均粒径显著下降。
5、乳析指数和分层情况
新鲜乳液10ml,置于室温样品瓶中。ci是将乳液储藏0、3、6、9、12、15天后进行计算。同时取在室温下放置15天的乳液样品分析其分层情况。
ci的计算公式为:
式中,hc是某一储存时间后下清液的高度(cm),hs是乳液的总高度(cm)。
从图中8试验结果可知,水解后的蛋白质分子在储存9天内均未出现显著分层情况,在室温条件下,储藏9天后所有乳液均出现乳析情况,并且乳析指数接近于0,然而wph运载的乳液比mrpsh运载的乳液的乳析速度更快,并且在储存15天时,wph-30min,和wph-120min运载的乳液的乳析指数分别达到58.76%和42.31%,然而mrpsh-30min和mrpsh-120min运载的乳液的乳析指数分别为22.86%和8.47%,表示蛋白质的水解物运载的乳液可以显著使乳液的乳析指数下降。这可能一方面因为随着水解时间的延长,蛋白质分子分解为小分子,其运载的乳液液滴之间具有较强的空间排斥作用,另一方面mrpsh具有较高的疏水性,从而其更易吸附在油-水界面上,导致界面吸附量提高,乳析指数下降。
6、界面吸附量
取1ml乳液于离心管中,以15000r/min离心60min,用1ml的注射器小心地吸取下清液,并用0.22μm的过滤器进行过滤。以牛血清蛋白(bsa)为标曲,采用考马斯亮蓝法测定蛋白含量,计算公式为:
ap表示界面吸附量(mg/ml),c0表示蛋白分散液的初始浓度(mg/ml),cf表示下清液中的蛋白含量(mg/ml)。
从图9中试验结果可知,与未处理的wpi运载的乳液相比,水解后形成的wph运载的乳液的ap显著提高(p<0.05),而且mrpsh运载的乳液比对照组mrps运载的乳液的ap同样显著增加(p<0.05),说明水解能够显著提高乳液的ap,并且在水解时间依次为30min、60min、90min、120min时,mrpsh比wph运载的cla乳液的ap分别提高了13.33%、13.81%、15.96%、17.86%,说明mrpsh比wph运载的乳液能够显著提高乳液的界面吸附量,这是因为水解使大分子蛋白质分解为小分子物质,蛋白质分子展开,导致部分疏水基团暴露,同时具有表面活性的多肽也暴露出来,从而大部分具有表面活性的多肽会向非水相界面移动,因此能够吸附到油滴的表面,从而导致界面蛋白覆盖量显著提高。
7、采用共聚焦显微镜观察乳液的微观结构
使用激光用聚焦显微镜(clsm)研究乳液的微观结构。取0.05g尼罗蓝和0.005g尼罗红分别溶于5ml异丙醇中,配置成荧光染料(0.1%(w/v)尼罗蓝和0.01%(w/v)尼罗红),避光溶解30min后,通过0.45μm的滤膜。将乳液用水稀释5倍,并吸取1ml依次加入25μl尼罗蓝和20μl尼罗红,并避光染色30min。取5μl染色后的乳液进行制片。用硅油密封盖玻片边缘,将载玻片置于载物台上,在明场条件下选择合适的视野,将显微镜的功能键转换至荧光观察,随后采用40倍的物镜观察乳液的微观结构,并通过激发波长为488nm和633nm的ar/kr和he/ne双通道激光模式采集图像。
从图10中试验结果可知,所有乳液均通过neilred和neilblue染色,并且neilred发射红色荧光并用于标记油相,neilblue发射绿色荧光并用于标记蛋白,结果展示出油滴均被蛋白包埋,所有显微结构均呈现出水包油结构。水解物运载的乳液的油脂颗粒比未水解物运载的乳液的油脂颗粒显著下降(p<0.05),这是因为水解使大分子分解为小分子肽段,进而可以提高蛋白质的表面疏水性和分子柔韧性,这些性质都有利于吸附到油滴表面,从而有效的降低界面张力,形成粒径较小且更稳定乳液。
- 还没有人留言评论。精彩留言会获得点赞!