可植入装置的制作方法
本申请要求提交于2014年2月21日的澳大利亚临时专利申请第2014900570号的优先权,该临时专利申请的内容以引用方式并入本文中。
技术领域
本公开涉及在愈合过程中对骨(具体地讲断骨)提供强度或使其稳定的装置、系统和方法。其他设备和方法包括对骨递送试剂以促进骨生长或修复。
背景技术:
过去50年内,在骨固定法方面取得了许多进展。然而,对于通过微创技术降低发病率以及提高治疗有效性的需要持续存在。目前,可以用标准装置以微创方式(通常称为“封闭方法”,用于和“开放性”手术区分)将金属棒设置在多种骨折的髓管中。与骨板技术一样,可以将骨板设置在肌肉下方并通过经由皮肤穿过极小的切口插入螺钉来实现压缩和保持。然而,就儿童而言,这些装置需要改型,使得它们不会妨碍生长,另外,植入物通常需要进一步手术和全身麻醉以移除所述标准装置。因此,用于固定骨折的微创方法不需要进一步常规手术和全身麻醉以常规移除植入物将为有利的。
就成人而言,标准骨科实践不一定涉及移除植入物,但在某些骨折中,可能需要非侵入性治疗以获得最佳结果。
另外,在对骨骼递送活性骨试剂以实现骨愈合或脊柱融合时,现行的临床标准常引入包含试剂的基于胶原的支架。例子包括移植骨(胶原海绵上的rhBMP-2)和或(颗粒状胶原中的BMP-7)。在临床实践中这些产品目前都不能通过注射来非侵入性地递送。一个问题在于将有源元件保持在所述部位。因此,可非侵入性地利用的递送系统和约束系统保持了用于改进骨科护理的吸引性区域。
技术实现要素:
在第一方面,提供了一种髓内骨装置,该髓内骨装置从第一端部延伸至第二端部并且具有限定内腔的侧壁,所述侧壁包括位于或邻近第一端部的第一穿孔区和位于或邻近第二端部的第二穿孔区,所述第一穿孔区包括侧壁中的第一开口并且第二穿孔区包括侧壁中的第二开口,第一开口和第二开口与内腔流体连通,其中该装置还包括与第一开口中的至少一个相连的第一导流结构以及与第二开口中的至少一个相连的第二导流结构,并且其中第一导流结构导引流体流沿第一方向从内腔穿过第一开口并且第二导流结构导引流体流沿不同于第一方向的第二方向从内腔穿过第二开口。
在第二方面,提供了一种稳定或固定骨的方法,包括:
在骨中制备进入点;
将导丝插入骨的髓腔中;
对导丝上方的一定长度的髓腔钻孔;
在导丝上方推进装置,该装置从第一端部延伸至第二端部并且具有限定内腔的侧壁,所述侧壁包括邻近第一端部的第一穿孔区和邻近第二端部的第二穿孔区,第一穿孔区包括侧壁中的第一开口并且第二穿孔区包括侧壁中的第二开口,第一开口和第二开口与内腔流体连通,其中该装置还包括与一个或多个第一开口相连的第一导流结构以及与一个或多个第二开口相连的第二导流结构;
当装置被理想地定位在骨内时,取出导丝;
将流体引入装置的内腔中,使得第一导流结构导引流体流沿第一方向从内腔穿过第一开口并且第二导流结构导引流体流沿不同于第一方向的第二方向从内腔穿过第二开口。
在第三方面,提供了一种髓内骨系统,包括:
装置,该装置从第一端部延伸至第二端部并且包括限定内腔的侧壁,所述侧壁包括邻近所述第一端部的第一穿孔区和邻近第二端部的第二穿孔区,所述第一穿孔区包括侧壁中的第一开口并且第二穿孔区包括侧壁中的第二开口,第一开口和第二开口与内腔流体连通,其中该装置还包括与一个或多个第一开口相连的第一导流结构以及与一个或多个第二开口相连的第二导流结构,并且其中第一导流结构导引流体流沿第一方向从内腔穿过第一开口并且第二导流结构导引流体流沿不同于第一方向的第二方向从内腔穿过第二开口;
流体导引器构件,该流体导引器构件被基本定位在装置的内腔内,所述流体导引器构件包括具有入口以接纳流体的第一端部,具有至少一个出口的第二相对端部,以及使入口和出口流体连接的内部通道。
在第四方面,提供了一种稳定和/或固定骨的方法,包括:
在骨中制备进入点;
将导丝插入骨的髓腔中;
对导丝上方的一定长度的骨髓腔钻孔;
在导丝上方推进髓内骨系统,该髓内骨系统包括:
髓内装置,该髓内装置从第一端部延伸至第二端部并且具有限定内腔的侧壁,所述侧壁包括邻近第一端部的第一穿孔区和邻近第二端部的第二穿孔区,第一穿孔区包括侧壁中的第一开口并且第二穿孔区包括侧壁中的第二开口,第一开口和第二开口与内腔流体连通,其中该装置还包括与一个或多个第一开口相连的第一导流结构以及与一个或多个第二开口相连的第二导流结构;以及
流体导引器构件,该流体导引器构件被基本定位在髓内骨装置的内腔内,所述流体导引器构件包括具有入口以接纳流体的第一端部,具有至少一个出口的第二端部,以及使入口和出口流体连接的内部通道,并且其中流体导引器构件的出口定位在髓内骨装置的第二穿孔区内;
当髓内骨系统被理想地定位在骨内时,取出导丝;
将流体引入流体导引器构件的内部通道中,使得所述流体从流体导引器构件的出口流出并且被至少一个第二导流结构沿第二方向导引穿过至少一个第二开口;
取出流体导引器构件,直至出口定位在髓内骨装置的第一穿孔区内,使得流体从流体导引器构件的出口流出并且被至少一个第一导流结构沿第一方向导引穿过至少一个第一开口,该第一方向不同于第二方向。
在第五方面,提供了一种骨支架,该骨支架包括一系列限定孔的支柱,当部署在骨中时该支架可从压缩的未展开构型径向膨胀为膨胀构型,其中该支架从近端延伸至远端并且还包括密封构件,该密封构件基本上密封近端或远端中的至少一个,从而在所述展开构型时基本上防止引入支架中的任何物质渗漏。
在第六方面,提供了用于稳定受试者的骨的系统,所述系统包括将骨支架插入受试者的骨中并对支架施加物质,其中所述骨支架包括具有主壁的细长主体,该主壁包括限定主壁中的孔的一系列支柱,当部署在骨中时该支架可从压缩的未展开构型径向膨胀为膨胀构型,其中该细长主体从近端延伸至远端并且还在任一或两个端部包括密封构件,该密封构件基本上密封支架的至少一个端部,从而在支架处于所述展开构型时基本上防止物质从所述端部渗漏。
在第七方面,提供了一种骨科装置,该装置包括具有从开放近端延伸至闭合远端的细长主体的引入棒,该引入棒包括限定内腔以接纳物质的主壁,所述内腔从开放近端朝向远端延伸,主壁中还包括多个孔。
在第八方面,提供了一种骨科递送系统,该递送系统包括:
载体装置,其具有被构造用于定位在受试者体内的主体,其中当部署在受试者体内时主体可从压缩的未展开构型膨胀为膨胀构型;主体具有其中包括一个或多个孔的壁,并且其中主体限定内部储存器以接纳物质;
其中主体的孔具有诸如用于将物质保持在主体中一段时间的尺寸和/或构型。
在第九方面,提供了一种骨科递送系统,该递送系统包括:
载体装置,其具有被构造用于定位在受试者体内的主体,当部署在受试者体内时所述主体可从压缩的未展开构型膨胀为膨胀构型;主体具有其中包括一个或多个孔的壁并且限定内部储存器;
所述内部储存器中的高粘度液体载体材料(HVLCM),所述HVLCM具有预定的粘度;
其中主体被构造为使得孔的至少一部分的尺寸设定成和/或被构造为使得HVLCM在一段时间内基本上容纳于载体装置内。
在第十方面,提供了稳定受试者的骨的方法,包括:
对穿过骨的髓内通道钻孔;
将承载支架的引入器构件引入通道中,该支架包括细长主体,该细长主体具有限定贯穿其中的内腔的主壁,该主壁包括限定主壁中的孔的一系列支柱,该支架可从压缩构型径向膨胀为膨胀构型,其中细长主体从近端延伸至远端并且还包括密封构件,该密封构件基本上密封近端或远端中的至少一个,引入骨中的所述支架处于其压缩构型;
沿近侧方向移动引入器,从而使支架从引入器展开;
使得或允许支架在骨腔内从其压缩构型移动至其膨胀构型;
将稳定物质引入到支架的内腔中。
在第十一方面,提供了一种对受试者引入载体装置和载体物质的方法,包括:
加载具有载体装置的引入器,所述载体装置包括可从压缩构型膨胀为膨胀构型的主体,该主体包括主壁,该主壁具有限定于其中的一个或多个预定尺寸和/或构型的孔,并且主体限定内部储存器,其中所述载体装置以其压缩构型加载到引入器中;
将引入器经由皮肤推进到受试者体内所需部位;
取出引入器以部署载体装置并且使得或允许载体装置从其压缩构型移动至其膨胀构型;
移除引入器并将导管经由皮肤插入到所述部位,该导管具有内腔以将液体载体物质递送到载体装置;
相对于载体装置布置导管,使得导管内腔与载体装置的储存器流体连通;
将液体载体物质递送到储存器;
其中液体载体物质具有预定粘度并且载体装置的孔的尺寸设定成和/或被构造为使得液体载体物质在至少一段时间内基本上容纳于载体装置内。
本公开的示例性实施方案
髓内骨装置
第一和第二方面的公开内容涉及髓内骨装置,该髓内骨装置从第一端部延伸至第二端部并且具有限定内腔的侧壁。还公开了一种植入该装置的方法。在第三方面中还公开了一种包括髓内骨装置并且还包括引入器构件的系统,在第四方面中公开了一种引入该系统的方法。
髓内装置的侧壁包括邻近第一端部的第一穿孔区和邻近第二端部的第二穿孔区。
第一穿孔区包括侧壁中的一个或多个第一开口并且第二穿孔区包括侧壁中的一个或多个第二开口。第一开口和/或第二开口可与内腔流体连通。
该装置还包括与一个或多个第一开口相连的第一导流结构以及与一个或多个第二开口相连的第二导流结构。
第一导流结构导引流体流沿第一方向从内腔穿过第一开口并且第二导流结构导引流体流沿不同于第一方向的第二方向从内腔穿过第二开口。
髓内骨装置通常为基本管状并且沿着第一轴线延伸。第一穿孔区和第二穿孔区可以被中间区分离,所述中间区通常不具有侧壁中的开口。
第一开口中的至少一些、优选地全部可围绕侧壁以有序和/或随机方式间隔开。通常,第一开口相对于彼此偏移。在管状髓内骨装置的另一个实施方案中,第一开口中的至少一些围绕侧壁相对于彼此为线性和/或周向对齐。在一个实施方案中,第一开口中的至少一些被螺旋地布置在髓内骨装置的侧壁中。
第二开口中的至少一些、优选地全部可围绕侧壁以有序和/或随机方式间隔开。通常,第二开口相对于彼此偏移。在管状髓内骨装置的另一个实施方案中,第二开口中的至少一些围绕侧壁相对于彼此为线性和/或周向对齐。在一个实施方案中,第二开口中的至少一些被螺旋地布置在髓内骨装置的侧壁中。
第一穿孔区可占髓内骨装置的总长度的10%至50%之间。通常,第一穿孔区延伸髓内骨装置的总长度的20%和40%之间。在一个实施方案中,第一穿孔区占髓内骨装置的总长度的大约30%。第一穿孔区可以不延伸到远至第一端部,使得邻近第一端部的髓内骨装置的主要区域不具有开口。
第二穿孔区可占髓内骨装置的总长度的10%至50%之间。通常,第一穿孔区延伸髓内骨装置的总长度的20%和40%之间。在一个实施方案中,第二穿孔区髓内骨装置的总长度的大约30%。第二穿孔区可以不延伸到远至第二端部,使得第二端部和第二穿孔区之间的髓内骨装置的末端区不具有开口。
中间区可占髓内骨装置的总长度的10%至60%之间。通常,中间区延伸髓内骨装置的总长度的20%和40%之间。在一个实施方案中,中间区占髓内骨装置的总长度的大约30%。中间区通常跨越第一穿孔区和第二穿孔区之间的一定长度的髓内骨装置。
第一导流结构可以包括髓内骨装置的侧壁的接近相连的第一开口的部分。或者,第一导流结构可以包括连接至侧壁的部分的单独构件。
相似地,第二导流结构可以包括髓内骨装置的侧壁的接近相连的第二开口的部分。或者,第二导流结构可以包括连接至侧壁的部分的单独构件。
在一个实施方案中,邻近第一开口和/或第二开口的侧壁部分延伸到内腔中,以形成第一导流结构和/或第二导流结构。在一个实施方案中,这可以通过对侧壁中的翼片穿孔并将翼片推进到髓内装置的内腔中来实现。翼片可以形成或被进一步模制以形成第一导流结构和/或第二导流结构。
与第一开口相连的示例性第一流体导引构件可以向内并相对于髓内骨装置的侧壁成角度延伸。该角度可以是变化的并且第一流体导引构件相对于侧壁延伸的特定角度决定了流体离开相连的第一开口时的轨迹。
第一流体导引构件可以在内部延伸髓内骨装置的最大直径的10%和60%之间的距离。通常,第一流体导引构件延伸装置直径的20%和40%之间的距离。在一个实施方案中,第一流体导引构件延伸装置直径的约30%的距离。
第一流体导引构件的形状可为部分圆形。或者,导引构件可为椭圆形、正方形、矩形或如侧壁中的切口确定的任何其他形状。
第一流体导引构件通常从连接至侧壁的连接端部下垂。连接端部可以包括第一开口的上边缘,即,限定更靠近髓内骨装置的第一端部的开口的侧壁部分。在此实施方案中,第一流体导引构件朝向髓内骨装置的第二端部下垂。第一流体导引构件可以相对于侧壁以如上所述的角度并且朝向髓内骨装置的第二端部下垂,使得其在相连的第一开口上方间隔地向下延伸,从而限定从内腔到相连的第一开口的流动通道。
第一流体导引构件可沿着从连接端部至第二端部自由端的长度为基本平坦的。或者,第一流体导引构件具有宽度并且在其整个宽度上为基本弯曲的。另外,第一导引构件可沿着其长度为基本弯曲的。
第一流体导引构件的连接端部可以占限定相连的第一开口的髓内骨装置的侧壁的总周长的相对较小百分比,诸如介于总周长的5%至10%之间。或者,连接端部可以延伸限定相连的开口的侧壁的总周长的大约10%至20%、或20%至30%、40%至50%、50%至60%、或70%至80%之间。
多个第一流体导引构件可以被布置在装置的第一穿孔区内部。每个流体导引构件通常与第一开口相连。
第一流体导引构件可以共同限定第一穿孔区的内腔内的较窄通道。在一个实施方案中,多个第一流体导引构件的自由第二端部可以被成形为使得它们限定通道。
此实施方案可以在插入引入棒或其他装置以递送流体时为可用的。在此实施方案中,较窄通道相对居中,从而使髓内骨装置内的引入棒居中。具有居中的引入棒的优点在于,流体基本上从引入棒均匀分布至髓内骨装置然后至骨。
第一流体导引构件的形状和/或取向可相对于彼此基本相同,以提供贯穿其中的流体的均匀流型。或者,第一流体导引构件可以包括相对于彼此不同的形状和/或可以相对于侧壁以不同角度延伸。
与第二开口相连的示例性第二流体导引构件可以向内并相对于髓内骨装置的侧壁成角度延伸。该角度可以是变化的,并且与第一流体导引构件一样,第二流体导引构件相对于侧壁延伸的特定角度决定了流体离开相连的第二开口时的轨迹。
第二流体导引构件可以在内部延伸髓内骨装置的最大直径的10%和60%之间的距离。通常,第二流体导引构件延伸装置直径的20%和40%之间的距离。在一个实施方案中,第二流体导引构件延伸装置直径的约30%的距离。
第二流体导引构件的形状可为部分圆形。或者,导引构件可为椭圆形、正方形、矩形或如侧壁中的切口确定的任何其他形状。第二流体导引构件中的至少一些的形状可与第一流体导引构件中的至少一些相同。或者,第二流体导引构件的形状可相对于第一流体导引构件不同。
第二流体导引构件可以从连接至侧壁的连接端部延伸。连接端部可以包括第二开口的下边缘,即,限定更靠近髓内骨装置的第二端部的开口的侧壁部分。在此实施方案中,第二流体导引构件朝向髓内骨装置的第一端部延伸。第二流体导引构件可以相对于侧壁成一角度并且朝向髓内骨装置的第一端部延伸,使得其在相连的第二开口上方间隔地向上延伸,从而限定从内腔到相连的第二开口的流动通道。
第二流体导引构件可沿着从连接端部至第二端部自由端的长度为基本平坦的。或者,第二流体导引构件具有宽度并且在其整个宽度上为基本弯曲的。另外,第二导引构件可沿着其长度为基本弯曲的。
第二流体导引构件的连接端部可以占限定相连的第二开口的髓内骨装置的侧壁的总周长的相对较小百分比,诸如介于总周长的5%至10%之间。或者,连接端部可以延伸限定相连的开口的侧壁的总周长的大约10%至20%、或20%至30%、40%至50%、50%至60%、或70%至80%之间。
多个第二流体导引构件可以被布置在装置的第二穿孔区内部。每个流体导引构件通常与第二开口相连。
第二流体导引构件可以一起限定第二穿孔区的内腔内的较窄通道。在一个实施方案中,多个第二流体导引构件的自由第二端部可以被成形为使得它们限定通道。
当插入引入棒或其他装置以递送流体时,第二穿孔区中的较窄通道也可以是可用的,诸如用于使髓内骨装置的第二穿孔区内的引入棒居中。
第二流体导引构件的形状和/或取向可相对于彼此基本相同,以提供贯穿其中的流体的均匀流型。或者,第二流体导引构件可以包括相对于彼此不同的形状和/或可以相对于侧壁以不同角度延伸。
髓内骨装置的横截面可为基本上圆形。或者,其可为卵形、椭圆形、矩形、正方形或用于定位在受试者的骨中的任何其他合适的横截面。
通常,髓内骨装置为基本直的。在用于长骨的情况中尤其如此。然而,可以设想到,根据其中将植入该装置的骨,该装置还可以是另一种形状。例如,该装置的形状可为弯曲的,具有一个或多个括口端或者针对与骨的特定解剖结构相对应的任何特定形状而定制。在一个实施方案中,邻近第一端部的髓内骨装置的主要部分相对于髓内骨的其余部分成角度。此实施方案可用于股骨的转子进入。
在另一个实施方案中,该装置由基本上柔性的弹性材料制成,使得其可适形于其中部署了该装置的骨的形状。
通常,本公开的髓内骨装置由聚合物材料制成。可以通过诸如挤出、注塑和溶剂浇铸的常规方法制备聚合物髓内骨装置,以形成第一开口和第二开口所需的形状和构型以及尺寸。
髓内骨装置的聚合物可以包括诸如常规的生物相容性、可吸收或不可吸收的聚合物的材料。在一个优选的实施方案中,髓内骨装置由生物相容性可吸收的聚合物制成。
生物相容性、可吸收的聚合物的例子包括聚(-羟基酯),诸如聚(丙交酯)、聚(乙交酯),聚(己内酯),聚(对二氧杂环己酮),聚(三亚甲基碳酸酯),聚(氧杂酯),聚(氧杂酰胺),以及它们的共聚物和共混物。“聚(乙交酯)”应理解为包括聚(乙醇酸)。“聚(丙交酯)”应理解为包括L-丙交酯、D-丙交酯、内消旋丙交酯的聚合物、它们的共混物以及乳酸聚合物。
合适的可吸收的聚合物的其他例子包括酪氨酸衍生的聚氨基酸,诸如聚(DTH碳酸酯);聚(芳基化物)和聚(亚氨基-碳酸酯);含磷聚合物,诸如聚(磷酸酯)和聚(磷腈);聚(乙二醇)[PEG]基的嵌段共聚物PEG-PLA;PEG-聚(丙二醇);PEG-聚(对苯二甲酸丁二醇酯);聚(α-苹果酸);聚(酯酰胺);以及聚链烷酸酯,诸如聚(羟基丁酸酯)(HB)和聚(羟基戊酸酯)(HV)共聚物。聚(丙交酯)和聚(乙交酯)(PLGA)的共聚物也可以是理想的,其中在一个实施方案中,每种聚合物的比例可以改变以调节主体的强度和再吸收时间。此外,三甲基碳酸酯可与上述聚合物中的任何一种共混。例如,髓内骨装置可以包括至多30重量%的三甲基碳酸酯以及上述聚合物中的任何一种。
不可吸收的聚合物的例子包括聚烯烃、聚酰胺、聚酯、含氟聚合物和丙烯酸类树脂。
髓内骨装置可以包含聚合物材料的共混物或聚合物材料与增塑剂的共混物。聚合物材料还可与添加剂共混以用于骨传导和/或与试剂共混以改变髓内骨装置再吸收时的pH曲线。
在一个实施方案中,髓内骨装置还可以包含生物玻璃、羟基磷灰石、碳酸钙。可以将用于增大再吸收聚合物的pH的任何合适的生物相容材料加入髓内骨装置。
可以设想到,髓内骨装置可以另选地由金属或合金制成。金属或金属合金可为可吸收的。例子包括镁合金,诸如镁锌钙合金。
髓内骨装置的直径将通常取决于其中部署了装置的髓内骨腔的钻孔直径。
髓内骨装置还可以包括治疗剂、造影剂或两者。
可以通过在制造过程中涂布髓内骨装置或浸渍髓内骨装置的材料来将治疗剂掺入到装置中。
可以将造影剂浸渍到髓内骨装置的材料中,或者,可以将造影剂涂布到装置的外部上。
造影剂通常选自一种或多种生物相容性试剂。合适的试剂的例子包括氧化铋、硫酸钡和/或碘化合物。不透射线添加剂可以另选地包括金属粉末,诸如钽、钨或金,或具有金、铂、铱、钯、铑或它们的组合的金属合金。
本文所述的流体可为可吸收的或不可吸收的。在一个实施方案中,流体包含骨粘固剂。骨粘固剂可为可吸收的骨粘固剂。合适的可吸收的骨粘固剂的例子包括钙。一个例子包括磷酸钙。另外的例子包括磷酸二钙、磷酸三钙(和)、磷酸四钙羟基磷灰石或它们的两种或更多种的混合物。另外,骨粘固剂可以包括以下中的一种或多种:磷酸七钙、磷酸八钙、焦磷酸钙、氧基磷灰石、偏磷酸钙、碳酸磷灰石、碳酸盐磷灰石、无水磷酸一钙、无定形磷酸钙、缺钙羟基磷灰石、氟磷灰石;硅酸钙陶瓷,包括:原硅酸钙、硅灰石、硅酸二钙、透辉石,以及生物玻璃(任何组合物);或钙盐,诸如硫酸钙(α-半水硫酸钙、β-半水硫酸钙、脱水硫酸钙以及它们的混合物)、熟石膏;或它们的混合物。陶瓷中的钙含量的一部分可以被另一种二价阳离子(诸如镁或锶)取代。
在一个实施方案中,再吸收粘固剂的pH曲线具有为碱性的pH。例如,再吸收粘固剂可具有大于7.2的pH。
骨粘固剂可另选地为不可吸收的。不可吸收的骨粘固剂的例子包括甲基丙烯酸甲酯和丙烯酸甲酯或它们的混合物。
可以从可吸收的骨粘固剂装置的第一端部引入处于相对可流动状态的骨粘固剂,使得其通过内腔朝向髓内骨装置的第二端部迁移。
可以针对多种特性选择粘固剂,包括最佳的混合、递送和凝固时间。混合时间可在从30秒至2分钟并且优选地30秒至1分钟的范围内。递送时间,即粘固剂处于液体形式以供递送至所需部位的时间,可在2分钟至5分钟的范围内。优选地,递送时间为3至4分钟。其中粘固剂在主体内基本上硬化的凝固时间可为从2至20分钟。优选地,凝固时间可为4至10分钟。术语“硬化”应当理解为,粘固剂可以在主体中继续硬化除凝固时间之外的另一段时间。术语“硬化”用于描述除可流动形式的液体状态之外基本上硬化,使得粘固剂可在递送部位保持其形状。
在使用中,髓内骨装置可以稳定受试者的骨中的骨折。骨折的例子包括长骨的骨折,诸如股骨、胫骨、腓骨、肱骨、桡骨和尺骨的骨折;以及其他骨折,诸如手的掌骨和脚的跖骨、锁骨的骨折。可以设想到其他应用,诸如用于稳定转移性骨或其他具有病灶的骨。
提供可生物吸收的髓内骨装置以接纳可生物吸收的骨粘固剂的优点在于,不需要进行进一步手术以移除装置和粘固剂。这可具体用于稳定或矫正骨折,但在其他稳定应用中(诸如在转移性骨中),装置和粘固剂可留在骨中。
固定骨折的方法包括在骨中制备进入点,以及对所需长度的断骨的髓腔钻孔。可以插入导丝并减轻骨折。
在一个实施方案中,在插入之前,将引入棒插入髓内骨装置的第一端部中,并且穿过内腔并朝向髓内骨装置的第二端部。
引入棒通常包括位于一个端部的入口以接纳诸如骨粘固剂的流体以及邻近第二端部的至少一个出口。引入棒包括连接入口和至少一个出口的内部通道。在一个实施方案中,所述至少一个出口包括邻近引入棒的第二端部的引入棒的侧壁中的多个孔。在另一个实施方案中,所述至少一个出口包括引入棒的第二端部中的孔。另外,所述至少一个出口可以包括引入棒的端部中的孔以及邻近引入棒的所述第二端部的侧壁中的一个或多个孔。
可以将引入棒插入髓内骨装置中,直至至少一个出口定位在第二穿孔区中。
可以通过将在导丝上方插入髓内骨装置的第二端部和引入棒的第二端部并进入骨髓腔直至所述第二端部定位在骨折部位上方,来将髓内骨装置的组件和引入棒插入骨中。根据骨和进入点,髓内骨装置的第二端部可以定位在骨折部位的近侧或远侧。通常,定位应当使得髓内骨装置的第二穿孔区和第一穿孔区定位在骨折部位的任一侧上。
髓内骨装置的中间区可以定位在邻近骨折部位处。因为中间区不具有开口,当被注入髓内骨装置中时,基本上没有被注入的粘固剂进入骨折部位。
当装置相对于骨折部位适当地定位,可以移除导丝并将粘固剂源连接至位于髓内骨装置的内腔内原位的引入棒的入口。
通常,粘固剂源包括可连接至入口的粘固剂枪或类似装置。在此实施方案中,引入棒的入口可以包括密封构件以密封其中的粘固剂枪或类似装置的喷嘴。一个例子可以包括入口处的鲁尔锁。
在离开至少一个出口之前,粘固剂可以流经引入棒的内部通道。在离开至少一个出口之后,粘固剂进入髓内骨装置的内腔并且被第二导引构件导引穿过它们相连的第二开口。第二导引构件的取向使得骨粘固剂被朝向装置的第二端部导引,并且重要的是,被导引远离骨折部位。
在一个实施方案中,骨内针或类似装置可以通过髓内骨装置的内腔插入。针可以连接至负压源,以提供内腔中的抽吸压力。当相对于引入棒的第二端部进一步朝向髓内装置的第二端部插入时,这种抽吸压力帮助粘固剂从引入棒的出口流出并穿过髓内骨装置的第一开口和/或第二开口。
引入棒可以朝向髓内骨装置的第一端部逐渐收缩。
通常,引入棒由不透射线材料制成或包含不透射线材料,因此用户可观察到其定位。
一旦引入棒收缩到第一穿孔区,随着粘固剂离开引入棒的出口并进入髓内骨装置的内腔,第一导引构件可以导引粘固剂流穿过相连的第一开口,另外,由于第一流体导引构件的取向,粘固剂通常流经第一开口并远离骨折部位。
如上所述,髓内骨装置中的内部延伸的第一和第二流体导引构件的布置方式提供了相对居中的通道,其中引入棒可以穿过该通道。所得的装置/棒组件比单独的部件相对更硬,因此当髓内骨装置移动至髓腔中或在髓腔内进一步调节时,此实施方案保护髓内骨装置免受损坏或破损。
可以将引入棒完全从髓内骨装置移除并且固定骨折处直至粘固剂基本凝固。其中粘固剂在主体内基本硬化的凝固时间可以改变,但如上所述可为从2至20分钟。优选地,凝固时间可为4至10分钟。
髓内骨装置的第一和第二流体导引构件可以提供增大的表面积以供与骨粘固剂粘结,从而强化受试者的骨中的总体装置/粘固剂支架以稳定所述骨。
引入棒
本发明所公开的引入棒可为位于诸如上面针对髓内骨装置所述的骨内原位的强化粘固剂系统的一部分。或者,引入棒可用于将物质递送至本文所公开的支架。本文所述引入棒的一个或多个特征可以涉及任一应用。
细长棒可以包括限定从近端延伸至远端的内腔的管状结构。引入棒的横截面可为基本上圆形的。或者,引入棒可为卵形、椭圆形、矩形、正方形或用于定位在受试者的骨中的任何其他合适的横截面。
引入棒的主壁通常包括从内表面延伸至外壁的一系列孔,使得引入棒的物质可从内腔移动并穿过孔。
在将引入棒插入断骨的情况下,在一个实施方案中,主壁可以包括不具有任何孔的长度。可以设想到,当位于骨内的位置时,主壁的不具有孔的区域将定位在邻近骨折部位处。由于棒的该部分中没有孔,被引入物质将不会通过断骨渗漏并进入周围组织区域。
细长主体中的孔可以被布置为沿着细长主体的多种构型。例如,孔可以是随机分布的。更优选地,孔可以按一定次序或图案被构造在主壁中。在一个实施方案中,孔可以沿着细长主体的长度以螺旋图案分布。此实施方案可允许骨试剂的最佳分布。孔可具有均匀的尺寸。或者,一些孔可具有与其他孔不同的尺寸。孔的形状还可以是均匀的或可以改变。
引入棒可为可旋转移动的。在此实施方案中,细长主体的近端可以连接至电机,以驱动围绕引入棒的纵向轴线的旋转。在具有螺旋布置的孔的实施方案中,旋转引入棒可以形成喷向周围区域的物质的最佳“喷雾”。
引入棒还可以耦接到物质源。引入棒的内腔通常与物质源流体连通。在其中物质包含骨粘固剂的实施方案中,物质源可以是基本液体状态的合适的粘固剂源。装置还可以包括致动器构件,以导致粘固剂从粘固剂源流动并进入引入棒的内腔。电机还可以通过致动器构件致动,使得引入棒随着粘固剂的引入而旋转。此实施方案可以在粘固剂行进穿过孔并接合邻近孔的周围骨表面之前防止粘固剂在棒的内腔中过早凝固。
一旦粘固剂分布到棒内所需的区域并穿过孔以与周围的骨结合,并且一旦粘固剂基本上凝固,细长棒将通常被留在骨中。引入棒中的一个或两个和粘固剂是可吸收的。或者,引入棒中的一个或两个和粘固剂可为不可吸收的。
在一个实施方案中,引入棒为相对刚性的。然而,还可以设想到,引入棒可为适当柔性的,使得在展开构型时,引入棒基本上适形于表面或进入骨腔或其中部署了引入棒的其他身体部分。
引入棒可由金属、金属合金或聚合物材料制成。引入棒的直径和用于非聚合物和聚合物引入棒的壁的厚度将通常取决于其中部署了引入棒的骨的髓腔直径。
引入棒可由许多不同的生物相容性、可生物吸收的或不可吸收的聚合物制成。
不可吸收的聚合物的例子包括聚烯烃、聚酰胺、聚酯、含氟聚合物和丙烯酸类树脂。生物相容性、可吸收的聚合物的例子包括聚(-羟基酯),诸如聚(丙交酯)、聚(乙交酯),聚(己内酯),聚(对二氧杂环己酮),聚(三亚甲基碳酸酯),聚(氧杂酯),聚(氧杂酰胺),以及它们的共聚物和共混物。“聚(乙交酯)”应理解为包括聚(乙醇酸)。“聚(丙交酯)”应理解为包括L-丙交酯、D-丙交酯、内消旋丙交酯的聚合物、它们的共混物以及乳酸聚合物。
合适的可吸收的聚合物的其他例子包括酪氨酸衍生的聚氨基酸,诸如聚(DTH碳酸酯);聚(芳基化物)和聚(亚氨基-碳酸酯);含磷聚合物,诸如聚(磷酸酯)和聚(磷腈);聚(乙二醇)[PEG]基的嵌段共聚物PEG-PLA;PEG-聚(丙二醇);PEG-聚(对苯二甲酸丁二醇酯);聚(α-苹果酸);聚(酯酰胺);以及聚链烷酸酯,诸如聚(羟基丁酸酯)(HB)和聚(羟基戊酸酯)(HV)共聚物。
聚合物材料还可以包括聚合物材料的共混物或聚合物材料与增塑剂的共混物。
引入棒还可以包含治疗剂、造影剂或两者。可以通过在制造过程中涂布引入棒或浸渍引入棒的材料来将治疗剂掺入到引入棒中。
相似地,可以将造影剂浸渍到棒的材料中,或者可以将造影剂涂布到棒的外部上。造影剂可选自一种或多种生物相容性试剂。合适的试剂的例子包括氧化铋、硫酸钡和/或碘化合物。不透射线添加剂可以另选地包括金属粉末,诸如钽、钨或金,或具有金、铂、铱、钯、铑或它们的组合的金属合金。
引入到引入棒中的本公开的骨粘固剂可以包括可吸收的粘固剂或不可吸收的粘固剂。合适的可吸收的骨粘固剂的例子包括磷酸钙。另外的例子包括硫酸钙、磷酸二钙、磷酸三钙、磷酸四钙羟基磷灰石或它们的两种或更多种的混合物。
不可吸收的骨粘固剂的例子包括甲基丙烯酸甲酯和丙烯酸甲酯或它们的混合物。
使用如本文所公开的引入棒在具有较窄直径并且其中不可能引入可膨胀支架或其他装置的骨中可特别有用。
骨支架
骨支架可以包括限定从近端延伸至远端的内腔的管状结构。骨支架的横截面可为基本上圆形的。或者,骨支架可为卵形、椭圆形、矩形、正方形或用于定位在受试者的骨中的任何其他合适的横截面。
支架的细长主体可以包括基本管状构件,该管状构件在处于其压缩的未展开构型时具有基本上圆形的横截面。当展开并处于其膨胀构型时,细长主体可呈现与压缩形状不同的形状。
通常,在其展开构型时,细长主体为基本上直的,特别是用于长骨时。然而,可以设想到,支架细长主体还可为螺线型形状。或者,细长主体的形状可以是弯曲的。在一个实施方案中,可以设想到,邻近近端或远端中的一个或两个的区域限定了直径大于细长主体的其余部分的管状结构。在此实施方案中,细长主体可以在一个或两个端部基本上向外扩展。喇叭形装置在诸如锁骨的骨手术中可特别有用。然而,可以设想到最终展开构型的其他构型,诸如中间部分具有更宽直径并且朝向近端和远端逐渐变细的细长主体。细长主体可以针对与骨的特定解剖结构相对应的任何特定形状而定制。
膨胀形状可以是预定的并且支架被预制为当部署在骨中时呈现此类预定形状。由形状记忆材料制成的支架可适用于此类实施方案以及骨的形状已知的情况。通过将展开的支架定制为骨或骨腔的形状,实现了在骨内更好的拟合。
合适的形状记忆材料的例子包括若干金属合金。一个例子为铜-铝-镍合金。此外,诸如镍钛诺的镍-钛(NiTi)合金可用于形成支架。其他例子包括锌、铜、金和铁的合金。
通过细长主体的主壁中的支柱的布置方式或构型,还可以实现处于展开构型的支架的特定形状。同时,支架的支柱通常被布置用于限定一系列单元格,所述单元格对支架提供拉伸强度,同时还限定主壁中的孔。
在一个实施方案中,单元格包括菱形结构。在另一个实施方案中,单元格可以限定三角形、正方形或矩形结构。
在一个实施方案中,每个单元格可以包括多个支柱,包括两个、三个、四个、五个、六个、七个、八个支柱或更多。
支架的单元格的尺寸和/或构型可以全部相同或者尺寸和/或构型可以不同。例如,支架的所有单元格可具有相同数量的边/支柱。或者,支架的一部分单元格的边/支柱数量可相对于支架的其他单元格不同。
单元格的支柱可为相对直的。或者,支柱可为弯曲的或正弦曲线的。
通常,单元格围绕支架主壁成一系列地周向布置。有利地,一个周向布置系列中的至少一个单元格连接至另一个周向布置系列中的邻近单元格或与另一个周向布置系列中的邻近单元格成一体。至少一个单元格可与所述周向系列或邻近周向系列中的另一个单元格具有至少一个共边。
通常,完整长度的支架的包括多个周向布置的单元格系列。
为改变支架的特征,诸如强度和/或形状,可以诸如通过改变单元格的尺寸(即,由单元格的边形成的孔的尺寸)来改变单元格布置方式。例如,细长主体的长度的至少一部分可以包括一系列相对密集的单元格,它们限定相对较小的孔。细长主体的主壁的另外的部分可以包括更开放的单元格布置方式,其具有限定相对较大尺寸的孔的支柱。
在另一个实施方案中,支架细长主体可为适当柔性的,使得在展开构型中,其基本上适形于骨的表面或其中部署了支架细长主体的其他身体部分。
另外如本文所述,支架可由金属、金属合金或聚合物材料制成。聚合物支架可以通过诸如挤出、注塑和溶剂浇铸的常规方法制备,以形成单元格所需的形状和构型。金属或金属合金支架可由已被蚀刻或更优选地激光切割为所需的单元格构型的金属管(例如,镍钛诺或不锈钢)制成。
支架的直径和用于非聚合物和聚合物支架两者的壁的厚度可取决于支架所需的最终直径,继而取决于其中将部署支架的髓内骨腔的直径。
骨支架的聚合物可以包括聚合物材料,诸如常规的生物相容性、可生物吸收的或不可吸收的聚合物。可以根据多种因素选择用于制备骨支架的聚合物材料,诸如材料的吸收时间和物理特性以及骨支架的几何结构。
不可吸收的聚合物的例子包括聚烯烃、聚酰胺、聚酯、含氟聚合物和丙烯酸类树脂。
生物相容性、可吸收的聚合物的例子包括聚(-羟基酯),诸如聚(丙交酯)、聚(乙交酯),聚(己内酯),聚(对二氧杂环己酮),聚(三亚甲基碳酸酯),聚(氧杂酯),聚(氧杂酰胺),以及它们的共聚物和共混物。“聚(乙交酯)”应理解为包括聚(乙醇酸)。“聚(丙交酯)”应理解为包括L-丙交酯、D-丙交酯、内消旋丙交酯的聚合物、它们的共混物以及乳酸聚合物。
合适的可吸收的聚合物的其他例子包括酪氨酸衍生的聚氨基酸,诸如聚(DTH碳酸酯);聚(芳基化物)和聚(亚氨基-碳酸酯);含磷聚合物,诸如聚(磷酸酯)和聚(磷腈);聚(乙二醇)[PEG]基的嵌段共聚物PEG-PLA;PEG-聚(丙二醇);PEG-聚(对苯二甲酸丁二醇酯);聚(α-苹果酸);聚(酯酰胺);以及聚链烷酸酯,诸如聚(羟基丁酸酯)(HB)和聚(羟基戊酸酯)(HV)共聚物。聚(丙交酯)和聚(乙交酯)(PLGA)的共聚物也可以是理想的,其中在一个实施方案中,每种聚合物的比例可以改变以调节主体的强度和再吸收时间。
聚合物材料还可以包括聚合物材料的共混物、聚合物材料与增塑剂的共混物。
在非聚合物和聚合物实施方案中,支架细长主体还可以包含治疗剂、造影剂或两者。
可以通过在制造过程中涂布支架或浸渍支架的材料来将治疗剂掺入到支架中。
支架可以如上所述包含造影剂。与治疗剂一样,可以将造影剂浸渍到支架的材料中,或者,涂布到支架的外部上。
造影剂通常选自一种或多种生物相容性试剂。合适的试剂的例子包括氧化铋、硫酸钡和/或碘化合物。不透射线添加剂可以另选地包括金属粉末,诸如钽、钨或金,或具有金、铂、铱、钯、铑或它们的组合的金属合金。
骨支架可以包括不止一个细长主体。在一个实施方案中,第一细长主体包括内部支架并且至少部分地被形成外部支架的第二细长主体环绕。内部支架和外部支架可通过一个或多个径向连接器支柱连接至彼此。内部支架和外部支架之间的距离可根据径向支柱的长度而变化。
与单独的细长主体相反,或者细长主体的主壁可具有厚度,该主壁具有限定贯穿其中的内腔的内表面以及被构造为与密封构件和/或其中部署了支架的骨的表面接合的外表面。支架的内表面和外表面可通过主壁中径向延伸的支柱互连。
不管单个支架或两个或更多个支架是否径向连接,径向支柱都可被构造用于促进支架压缩为压缩构型以供递送到骨中,以及在部署到骨之后后续的径向膨胀。
支架的细长主体还可以通过一个或多个纵向延伸的强化构件纵向强化。
本公开的支架被构造用于接纳物质。与骨支架一起使用的物质的例子包括骨粘固剂。物质可为可吸收的或者不可吸收的。在一个实施方案中,物质包括可吸收的骨粘固剂。合适的可吸收的骨粘固剂的例子包括磷酸钙。另外的例子包括磷酸二钙、磷酸三钙、磷酸四钙羟基磷灰石或它们的两种或更多种的混合物。
不可吸收的骨粘固剂的例子包括甲基丙烯酸甲酯和丙烯酸甲酯或它们的混合物。
可以从细长主体的近端或在沿着细长主体的任何其他区域引入骨试剂。通常,当被引入支架时,骨试剂处于相对可流动状态,使得其基本上填充支架的内腔并且还通过主壁中的孔迁移。
在其中骨试剂为骨粘固剂的实施方案中,粘固剂和支架提供了强化结构,对其中部署了支架和粘固剂的骨,该强化结构通过支架的强化支柱提供拉伸强度并且通过粘固剂提供压缩强度。
针对多种特性选择粘固剂,包括最佳的混合、递送和凝固时间。混合时间可在从30秒至2分钟并且优选地30秒至1分钟的范围内。递送时间,即粘固剂处于液体形式以供递送至所需部位的时间,可在2分钟至5分钟的范围内。优选地,递送时间为3至4分钟。其中粘固剂在主体内基本上硬化的凝固时间可为从2至20分钟。优选地,凝固时间可为4至10分钟。术语“硬化”应当理解为,粘固剂可以在主体中继续硬化除凝固时间之外的另一段时间。术语“硬化”用于描述除可流动形式的液态之外基本上硬化,使得粘固剂可在递送部位保持其形状。
密封构件通常包括被构造用于围绕支架细长主体的至少一部分的护套。具体地讲,护套可以围绕支架的远端以及邻近远端的支架区域。这样,基本上防止被引入支架的试剂从远端渗漏。或者,护套围绕除远端之外的支架的较大部分。在一个实施方案中,护套围绕支架细长主体从附接到邻近近端的支架区域的开放第一端部延伸至围绕细长主体的远端的闭合第二端部。
护套基本上包含粘固剂并且防止渗漏到周围骨中。在其中支架用于跨接骨中的骨折的实施方案中,可以通过骨腔并且在整个骨折部位上引入支架。然后支架可以接纳骨粘固剂。护套基本上防止骨粘固剂渗漏出支架并穿过骨折部位。应当理解,根据骨折部位的位置,护套可以围绕支架的多个部分形成。例如,护套可以仅覆盖细长主体的长度的10%。或者,护套可以围绕细长主体的20%、30%、40%、50%、60%、70%、80%、90%或完整长度。
护套可由生物相容性可吸收的材料制成。或者,护套可为不可吸收的。护套可由与支架的材料相同或不同的材料制成。护套还可以包含治疗剂或造影剂。
护套可以在一个或多个附接点附接到支架主体。护套可以在制造过程中通过包括胶粘、缝合或模制的任意多种方法附接。将护套附接到支架优选地允许支架从其压缩构型膨胀为膨胀构型。这样,附接点可允许护套相对于支架细长主体随着后者径向膨胀时一定程度地移动。这可通过在护套上提供缝合线来实现,该缝合线环绕细长主体的支柱并且其中缝合线可至少部分地沿着支柱移动。递送系绕
本文所公开的递送系统的载体装置可以包括如本文所公开的骨支架或引入棒。
然而一般来讲,骨支架和引入棒被构造用于髓内部署,而可以将载体装置递送至外部骨部位或实际上递送至用于移植特定骨以及随后移动至骨部位的组织区域。载体装置优选地经由皮肤递送至所需部位。
本文所公开的递送系统可用于对受试者递送任意多种试剂。在一个优选的实施方案中,可以配置载体装置并且载体物质可以承载合适的试剂,诸如用于促进骨生长。在载体装置和载体物质由可吸收的材料制成的情况下,可以设想到,受刺激的骨生长可导致新生骨形成为载体装置的形状。因此,可以按任意多种形状提供载体装置,如通过其最终用途(包括所需的骨的尺寸和形状)决定的。
载体装置具有用于接纳和保持载体物质的储存器。所谓术语“储存器”意指,该储存器可以形成载体装置的内部的任何部分并且可以具有一个或多个开口。在其中载体装置为管状结构的实施方案中,储存器可以包括管的内腔。在此实施方案中,储存器基本上具有两个开放端部。在此类实施方案中,可以设想到,载体物质具有足够粘度,使得其不会通过端部开放的储存器迁移。在另一个实施方案中,管状结构的一个或两个端部可以是基本上闭合的。在后一个实施方案中,端部可以通过网状结构基本上闭合,该网状结构仍然允许载体物质中的试剂流出并通过血管和其他细胞渗透到储存器中。
载体物质通常为高粘度液体载体材料(HVLCM)。
在一个实施方案中,载体装置的尺寸或孔径以及HVLCM的粘度的组合导致HVLCM包含于载体装置储存器内,即,尽管HVLCM在一段时间内为液态,但它不会通过孔从载体装置渗漏。
所谓术语“时间段”,可以设想到,HVLCM可以基本上包含于载体装置中1周和1个月的时间。或者,然后通过递送有源构件,HVLCM可以基本上包含于载体装置中至多2个月、3个月、4个月、5个月、6个月、7个月等。
载体装置可以被具体地构造用于不仅通过制备载体装置的材料而且通过孔的布置方式和尺寸来提供HVLCM的最佳表面张力。
虽然孔尺寸对储存器中载体物质的保持有影响,但在其中载体装置和载体物质被构造用于促进骨生长的实施方案中,孔还必须具有足以允许血管和细胞渗透的尺寸。
主体可以包括如上相对于骨支架所述的支架状结构。除圆柱体结构之外,在该方面主体可以包括基本矩形或正方形,此类实施方案可用于椎间脊柱融合。在此实施方案中,支架可具有足够的刚度以抵抗两个相邻椎体的压缩。另外,主体可以是基本上平整的,以减小用于特别小的空间的装置的轮廓。主体可被定制成适形于任何所需的形状。
载体装置的形状将很可能取决于其用途。在一个实施方案中,使用载体装置促进受试者的骨生长。载体装置可以被定制成待修复的骨的形状。例如,如果受损或缺失的骨位于受试者的颌部中,则载体装置可以包括基本U形的主体。可以设想到,弯曲形状的主体可在颌部重建和其他颅面手术中具有有利条件,或者有益于骨的节段在体内生长,以用于转移到需要骨质增大的接受部位。
液体载体物质
载体物质可以包括聚合物型高粘度液体载体材料(HVLCM)。与本文所述的骨支架或递送系统一起使用的合适的HVLCM的一个例子包括乙酸异丁酸蔗糖酯(SAIB)。或者,HVLCM可以包括酯化多糖,其为包括酯化糖单体单元的均聚物或共聚物,其中糖单体单元为酯化酮糖或醛糖。
或者,糖单体单元可以选自:酯化2-脱氧核糖、酯化2-脱氧-D-核糖、酯化果糖、酯化半乳糖、酯化葡萄糖、酯化2-脱氧葡萄糖、酯化2-脱氧-D-葡萄糖、酯化阿拉伯糖、酯化来苏糖、酯化核糖、酯化木糖、酯化核酮糖、酯化木酮糖、酯化阿洛糖、酯化阿卓糖、酯化甘露糖、酯化古洛糖、酯化艾杜糖、酯化塔洛糖、酯化阿洛酮糖、酯化山梨糖、酯化塔格糖,或者可以使用它们的混合物。
在一个实施方案中,HVLCM为相转变的,其中它们在生理条件下(即体内)形成半固体沉淀。
HVLCM可为可生物降解的。另外,可以通过选择HVLCM中的糖单体、HVLCM上的酯基的类型和量以及HVLCM的分子量来控制试剂从HVLCM载体释放的速率。
在一个实施方案中,本发明所公开的HVLCM不会在环境或生理条件下结晶。
本发明所公开的HVLCM可以包括在37℃下粘度为至少5,000mPa.s(并且任选地在37℃下为至少10,000、15,000、20,000、25,000或甚至约50,000mPa.s)的酯化多糖。物质的粘度可以构成物质的特性,该特性部分决定其中承载的试剂流出到周围骨的速率。
为了施用本文所公开的HVLCM或允许HVLCM释放包含于其中的试剂,例如包封在其中的药物,可将HVLCM与溶剂混合以便降低粘度。
物质还可以包括药学上可接受的成分,包括但不限于:药学上可接受的载体、稀释剂、赋形剂、佐剂、填充剂、缓冲剂、防腐剂、抗氧化剂、润滑剂、稳定剂、溶解剂、表面活性剂(例如,润湿剂)、螯合剂、助剂、渗透促进剂或它们的混合物。
试剂
上述本发明所公开的方面和实施方案中的任何一种可以对受试者递送试剂。
试剂可以足以对宿主受试者递送实现预期效果所需的有效量的试剂的量存在。掺入到物质中的试剂(具体地讲生物活性剂)的量取决于所需的释放曲线、诸如生物效应的效应所需的试剂浓度以及试剂所需的释放时间。
试剂的浓度可取决于诸如以下的因素:试剂的吸收、失活和排泄率。临床医生可以调节剂量,以顾及诸如特定病症的严重程度的因素。
术语“试剂”是指待递送到受试者的任何物质并且包括生物活性剂。如本文所用,生物活性剂是指有机分子,包括药物、肽、蛋白质、碳水化合物(包括单糖、寡糖和多糖)、核蛋白、粘蛋白、脂蛋白、合成多肽或蛋白质、或连接到蛋白质的小分子、糖蛋白、类固醇、核酸(任何形式的DNA,包括CDNA或RNA或其片段)、核苷酸、核苷、寡核苷酸(包括反义寡核苷酸)、基因、脂质、激素、维生素(包括维生素c和维生素E;无机化合物,或它们的组合,该生物活性剂在体内施用至受试者(例如人类或动物)或施用至例如在局部递送生物活性剂的情况下的受试者时导致生物效应。
如本文所用,术语“药物”是指在体内或体外用作治疗、治愈或预防疾病或失调药剂的任何物质,并且包括但不限于免疫抑制剂、抗氧化剂、麻醉剂、化疗剂、类固醇(包括类维生素A)、激素、抗生素、抗病毒药、抗真菌剂、抗增殖剂、抗组胺药、抗凝血剂、抗光老化剂、促黑细胞素肽、非甾体和甾体抗炎剂化合物、抗精神病药和辐射吸收剂(包括紫外吸收剂)。
骨诱导剂
在一个实施方案中,本文所公开的组合物或载体包含为骨诱导剂的生物活性剂。骨诱导剂可以选自:成骨蛋白、或生长因子、或TGF-β超级族的成员、或它们的混合物。成骨蛋白可以包括骨形态发生蛋白(BMP),包括人骨形态发生蛋白(rhBMP)。BMP的例子包括但不限于:BMP-2、BMP-4、BMP-6、BMP-7(OP-1)和BMP-9、rhBMP-1、rhBMP-2、rhBMP-3、rhBMP-4、rhBMP-5、rhBMP-6、rhBMP-7、rhBMP-8a、rhBMP-8b、rfiBMP-9、rhBMP-10、rhBMP-15、头蛋白抗性BMP、或它们的组合。
骨诱导剂可以是批准用于人类的BMP,其为rhBMP-2或rhBMP-7。
骨诱导剂可以是以约0.1至约40mg、优选地约1至约12mg的量存在的rhBMP-2。例如,骨诱导剂为rhBMP-2并且以约0.1至约5mg/mL的剂量存在;或者以约1至约2mg/mL的剂量存在。
在一个实施方案中,骨诱导剂为rhBMP-7并且以约0.1至约40mg、优选地约1至约12mg的量存在。例如,骨诱导剂为rhBMP-7并且以约0.1至约5mg/mL的剂量存在;或者以约1至约2mg/mL的剂量存在。
在另一个实施方案中,骨诱导剂为生长因子。长因子的例子包括但不限于:血小板/血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)、肌生成抑制蛋白(GDF-8)、胰岛素样生长因子(IGF)、和/或TGF-β超家族的成员(诸如TGF-β1、TGF-β2、TGF-β3)、生长和分化因子(GDF)、成纤维细胞生长因子-1(FGF-1)、成纤维细胞生长因子-2(FGF-2)、其他成纤维细胞生长因子、生长/分化因子5(GDF-5)、肝细胞生长因子(HGF)、表皮生长因子(EGF)激活素、抑制素、卵泡抑素或这些通道的其他特定激活剂。在另一个实施方案中,生长因子的混合物可以衍生自人骨或其他组织,或衍生自人工培养细胞的产物。
抗再吸收剂
在一个实施方案中,试剂可以包括抗再吸收剂。优选地,抗再吸收剂与组合物中存在的骨引导剂具有协同作用。抗再吸收剂的例子包括但不限于:双膦酸盐,包括:唑来膦酸、帕米膦酸、伊班膦酸、羟乙磷酸、阿仑膦酸、利塞膦酸和tilurondic酸;IKK抑制剂;骨保护素(OPG);组织蛋白酶K的抑制剂、氯离子通道阻滞剂;抗RANKL、SOST和DKK1的抗体;以及质子泵抑制剂、或它们的混合物。
在一个优选的实施方案中,抗再吸收剂可以选自:唑来膦酸、OPG和IKK和组织蛋白酶K两者的抑制剂、抗RANKL Ab、抗SOST Ab和抗DKK1Ab。
在其中抗再吸收剂为唑来膦酸的实施方案中,其可以按约10至约1000μg、优选地约20至约500μg的量存在。就其他双膦酸盐而言,典型的量将依次为:对于帕米膦酸约1至约50mg,对于阿仑膦酸盐约100μg至约1mg,以及对于伊班膦酸盐约40μg至约1mg,以及对于利塞膦酸盐约50μg至约1mg。
骨引导剂
在一个实施方案中,试剂可以包括骨引导剂。骨引导剂可以包括陶瓷颗粒。陶瓷颗粒的例子包括但不限于:衍生自包括以下的磷酸钙的陶瓷颗粒:羟基磷灰石、磷酸三钙(和)、磷酸四钙、无水磷酸二钙、磷酸一钙一水合物、脱水磷酸二钙、磷酸七钙、磷酸八钙、焦磷酸钙、氧基磷灰石、偏磷酸钙、碳酸磷灰石、碳酸盐磷灰石、无水磷酸一钙、无定形磷酸钙、缺钙羟基磷灰石、氟磷灰石;硅酸钙陶瓷,包括:原硅酸钙、硅灰石、硅酸二钙、透辉石,以及生物玻璃(任何组合物);或钙盐,诸如硫酸钙(-半水硫酸钙、-半水硫酸钙、脱水硫酸钙以及它们的混合物)、熟石膏;或它们的混合物。陶瓷中的钙含量的一部分可以被另一种二价阳离子(诸如镁或锶)取代。
血管生成剂
在另一个实施方案中,试剂为血管生成剂。血管生成化合物的例子包括但不限于:VEGF、促血管生成素、促红细胞生成素(EPO)、烟酸、去铁胺(DFO)和2-脱氧核糖。
另外的生物活性剂
在一个实施方案中,本文所公开的组合物(优选的药学上可接受的组合物)包括生物活性剂,已知该生物活性剂与骨相连并且影响生长因子递送和表达到所包括或添加的细胞。例子包括但不限于:肝素和其他糖胺聚糖和它们的组分,以及特异性结合蛋白,诸如TGF-结合蛋白。
在另一个实施方案中,试剂可以包括细胞。细胞的例子包括但不限于:成骨细胞,诸如衍生自骨髓、动物脂肪或另一种组织的祖细胞、干细胞,和/或造骨细胞。细胞还可以衍生自患者的血液,即单核细胞或血小板中任一种。细胞可来自需要体内骨生长的受试者;或者细胞可来自细胞系或来自合适的供体。
在另一个实施方案中,试剂可以包括抗体,包括影响骨形成、再吸收或修复的中和抗体、抗体Fc或基于抗体的治疗剂。这些包括可促进骨形成和/或抑制再吸收的抗骨硬化蛋白和抗RANKL治疗。
在另一个实施方案中,试剂可以包括促进伤口愈合、有丝分裂发生或血管生成的生长因子。这些包括但不限于IGF(例如,IGF-1)、PDGF或血小板、APC(活化蛋白C)或相关因子。
在另一个实施方案中,试剂可以包括抗生素。例子包括但不限于阳离子类固醇抗生素、环状脂肽、甘氨环素、噁唑烷酮和非达霉素。其他抗菌剂包括ceragenin。
应用
本文所公开的髓内骨装置、支架或引入棒可用于多种应用,包括使断骨稳定。骨折包括长骨骨折,诸如股骨、胫骨、腓骨、肱骨、桡骨和尺骨的骨折;以及其他骨折,诸如手的掌骨和脚的跖骨、锁骨的骨折。
在一个实施方案中,本文所公开的载体装置和载体物质可用于骨修复和骨组织工程。例如,支架和HVLCM可用于:骨折愈合(具体地讲开放性骨折)、脊柱融合、骨缺损矫正、促进骨植入物(包括骨板、螺钉、骨框架和关节置换植入物)的骨整合、坏死骨(包括髋部的派尔特斯病(Perthes disease))的恢复和骨质疏松骨的恢复。这些可包括闭合性骨折、开放性骨折、小骨缺损、临界性骨缺损、应力性骨折、脊柱侧凸/脊柱融合、骨坏死(包括髋部骨坏死)。此外,还可以治疗骨软骨缺损和软骨缺损,包括关节损伤和关节置换。
在本发明的一个实施方案中,当用于脊柱融合时,可以经由皮肤并且在圆盘部位的前部递送载体装置和载体物质。在所述递送到所述部位之前可以部分或完全移除圆盘。或者,可以在椎骨的后部和/或后侧部隔室递送载体装置和载体物质。可以将载体装置和载体物质设置在肌层和椎骨的后部或后侧部元件之间。
附图说明
图1A为本公开的支架和护套的侧视图;
图1B为已填充粘固剂的支架和护套的侧视图;
图2A为本公开的支架的示意图;
图2B为填充有粘固剂的图2A的支架的示意图;
图3为植入受试者的锁骨中的图2A的支架的示意图;
图4A至4D示出了本公开的引入棒的实施方案的侧视图;
图5示出了附接了示例性引入棒的本公开的引入枪的侧视图;
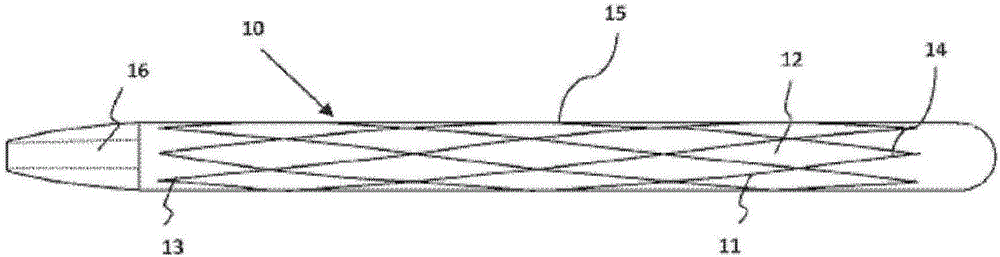
图6为本公开的髓内骨装置的侧视图;
图7为图6的髓内骨装置的部分的剖面图,包括引入棒的视图;
图8为图6的髓内骨装置的另外的部分的剖面图,包括引入棒的视图;
图9为本公开的髓内骨装置的第一穿孔区的剖面图;
图10为图9所示的标注B的区域的放大视图;
图11为图9所示的标注A的区域的放大视图;
图12A为通过髓腔插入本公开的髓内骨装置的股骨的图像;
图12B为图12A的股骨的射线图像;
图13A至13D为股骨以及横跨股骨的骨折插入髓内骨装置的过程的示意图;
图14A为实验1的断裂的锯骨的前视图和后视图的照片图像;
图14B示出了图14A的照片所示的锯骨的前视图和后视图的射线照片;并且
图15A至15C为提供实验2的结果的图表。
本公开的示例性实施方案的详述
在一个实施方案中,骨支架10由限定孔12的一系列支柱11构成。
当部署在骨中时,支架10可从压缩构型径向膨胀为膨胀构型。
支架10从近端13延伸至远端14。在图1A和1B所示的实施方案中,例如,支架10还包括围绕支架延伸并且覆盖远端14的护套15。近端13未被完全覆盖,这允许将物质递送到支架10。这在图1A和图1B中可见,其中护套15在邻近近端13的区域具有入口16。
在一个实施方案中,图2A所示的支架100在近端113和远端114两者均具有扩展区域117。
支架10、100为基本上直的,而部署在锁骨210中的弯曲支架200的例子示于图3中。
如图1B所示,支架10和护套15构造可填充有粘固剂20。通常通过护套15的入口16引入粘固剂20并引入到支架10的内部中。粘固剂20在被引入时处于可流动形式,从而通过孔12迁移以填充支架10和被护套15包含的支架10周围的空间。
图4A至4D示出了用于植入到受试者的骨中的引入棒30的另一个实施方案。引入棒30包括限定内腔(未示出)并且从近端31延伸至远端32的管状结构。引入棒30具有一系列孔33以允许被注入内腔中的流体离开棒30。
可以按多种不同的方式布置孔。例如,在图4A中,孔被沿着棒30的大部分长度螺旋地布置。在图4B中,提供了可供选择的实施方案,其中存在两个分开的孔组33a和33b以及不具有孔的棒10的部分34。在此实施方案中,可能有利的是将棒部署为使得部分34定位在骨折区域,以使得引入棒30中的任何流体不会在该部分通过断骨渗漏。部分34的长度可以根据骨的尺寸和骨折程度而变化。如图4C所示,部分34的长度小于图4B所示的装置的部分34。
在图4D中,仅邻近远端32的一定长度的棒30包括孔33。
引入棒可以包括入口37以接纳流体。在此实施方案中,入口包括用于附接到流体源的鲁尔锁系统的部分。
在图5中,示出了引入枪40,示出的引入枪耦接到棒30的近端31。示出的具体实施方案涉及图4C所示的引入棒30,但4A至4D的实施方案中的任何一种均可以附接到此类引入枪40。耦接示为鲁尔锁连接,其中枪40的鲁尔组件49与入口37连接,但适用于本发明目的任何形式的耦接均可。引入枪40包括柄部41和活塞机构42,活塞机构42连接至柄部41的致动器杠杆43。活塞机构42包括细长活塞44和端部活塞头45。引入枪还包括枪管46,其尺寸被设计为保持用于引入到引入棒30中的足够体积的流体。
当用户沿柄部41方向拉动致动器43时,活塞头被朝远侧朝向棒30驱动,从而迫使枪管46中的流体进入棒30的内腔。
在其中流体为骨粘固剂的实施方案中,棒30和致动器枪40之间的耦接可以包括电机(未示出),以使得在粘固剂被从枪管引入到棒30的内腔中时,棒30围绕纵向轴线旋转。
在本公开的另一个实施方案中,载体装置300可用于将载体物质递送至所需位置。在此实施方案中,该位置可以不在骨内,但可以是表面骨区域或身体的其他区域。载体装置可为任何合适的构型并且可包括例如图2B的支架310。载体300被构造用于接纳和保持具有预定粘度以允许其保持在支架310中预定时间段的载体物质311。
此实施方案的载体物质311可为高粘度液体载体材料(HVLCM)。
除HVLCM的粘度之外,支架310的孔312的尺寸和/或形状被设定成提供最佳的表面张力,从而将载体物质311保持在支架310内。
在用于促进骨生长或移植新骨的实施方案中,HVLCM将载有一种或多种试剂,所述试剂逐渐流出以增强骨生长。
髓内骨装置
在示例性实施方案中,本公开涉及髓内骨装置400,该髓内骨装置从第一端部401延伸至第二端部402并且具有限定内腔404的侧壁403。
髓内装置400的侧壁403包括邻近第一端部401的第一穿孔区405和邻近第二端部402的第二穿孔区406。
第一穿孔区405包括侧壁403中的多个第一开口407并且第二穿孔区406包括侧壁403中的多个第二开口408。第一开口407和第二开口408与内腔404流体连接。
髓内骨装置400还包括与第一开口407相连的第一导流结构420以及与第二开口408相连的第二导流结构440。
第一导流结构420导引流体流沿如箭头5a和5b所示的第一方向从内腔404穿过第一开口407,并且第二导流结构440导引流体流沿如箭头6a、6b和6c所示的不同于第一方向的第二方向从内腔404穿过第二开口408。
髓内骨装置400为管状并且沿着第一轴线7延伸。第一穿孔区405和第二穿孔区406被中间区409隔开。中间区409不具有侧壁403中的开口。
在图6所示的实施方案中,第一开口407和第二开口408沿着髓内骨装置400的一定长度的侧壁403螺旋地布置。
如图10和11所示的第一导流结构420,例如包括接近相连的第一开口407的髓内骨装置400的侧壁403的部分。
相似地,如图8所示的第二导流结构440包括接近相连的第二开口408的髓内骨装置400的侧壁403的部分。
第一导流结构420可以包括第一流体导引构件421。第一流体导引构件421向内并相对于侧壁403的内表面的附件成一角度延伸并进入内腔404。
在一个实施方案中,第一流体导引构件421从连接至侧壁的连接端部422下垂。在此实施方案中,连接端部422包括相连的第一开口407的上边缘423部分。
第一流体导引构件421从连接端部422朝向髓内骨装置400的第二端部402以及第二端部424延伸。
如例如图10所示,第一流体导引构件421在其整个宽度上并且沿着其从连接端部422至第二端部424的长度为基本上弯曲的。这提供了弯曲的流体接合表面425。弯曲的流体接合表面425提供了增大的表面积,用于与流体的后续结合。
多个第一流体导引构件421可以被布置在髓内骨装置400的第一穿孔区405内部,如例如图9所示。每个流体导引构件421与第一开口407相连。
如图7和9中被布置在内部的第一流体导引构件421共同限定第一穿孔区405的内腔404中的较窄通道430。在图7、8和9中较窄通道示为虚线431a和431b之间的通道。
髓内骨装置400可以接纳引入棒500。引入棒500可以被构造为连接至流体源并且其尺寸被设定成使得其可插入髓内骨装置400和位于第一端部401的内腔404中。当引入棒500朝向髓内装置400的第二端部402前进时,其受限于由多个第一流体导引构件421限定的较窄通道430。在例如图7和9所示的实施方案中,较窄通道430相对居中,从而使引入棒500在髓内骨装置400内居中。
如图所示的第一流体导引构件421的形状和/或取向相对于彼此基本上相同,以提供贯穿其中的流体的均匀流型。然而,应当注意的是,第一流体导引构件421可以包括相对于彼此不同的形状和/或可以相对于侧壁403以不同角度延伸。
在一个实施方案中,第二导流结构440包括第二流体导引构件441。第二流体导引构件441的形状通常与第一流体导引构件421相同。然而,如图8所示,第二流体导引构件441具有相对于图7中所示的第一流体导引构件420不同的取向。
在所示实施方案中,髓内骨装置400可插入断骨的髓腔中,以使骨在骨折愈合过程中稳定。为了进一步使骨稳定,本公开的流体为经由引入棒500引入的骨粘固剂。骨粘固剂以相对可流动状态引入,但其中粘固剂在递送后基本上硬化。
图12A和12B中示出了使股骨600的骨折稳定的髓内骨装置400。此实施方案的股骨600包括在部位601处故意断裂的锯骨,作为实验的一部分,以观察通过装置400的粘固剂流。
所示的髓内骨装置为可生物吸收的装置并且用于图12A和12B的粘固剂为可生物吸收的骨粘固剂。
如图12A和12B所示通过在股骨600的大转子602中钻取入口并通过髓腔插入导丝650来植入髓内骨装置400。该过程也在图13A至13D中示意性地示出。可以在导丝650上方插入钻孔装置(该步骤未示出)以钻取穿过髓腔的通道。然后在导丝上方插入髓内装置400并朝向股骨600的远端骺603推进。第二端部402定位在相对于骨折部位601的远侧,而第一端部401从大转子602的入口延伸。中间部分409横跨骨折部位601。
在一个实施方案中,在导丝上方插入髓内装置400之前,在第一端部将引入棒500插入内腔404并朝向髓内骨装置400的第二端部402推进。引入棒500从第一端部501延伸至第二端部502。通过引入棒500形成了从第一端部501至第二端部502的内腔503。第一端部501可连接至流体源,在图7所示的实施方案中,该流体源包括如箭头8所示的粘固剂源。
第二端部502包括出口504,如例如图8中所示。被引入第一端部501的粘固剂流经内腔503并最终经由出口504离开。
引入棒500通常被插入髓内骨装置400中,直至出口504定位在第二穿孔区406中。出口504可与最远的第二开口408(即最靠近装置400的第二端部402的第二开口)对齐。
一旦装置400和引入棒500被最佳定位,粘固剂源即耦接到引入棒500的第一端部501并且粘固剂被引入使得其朝向第二端部502流动。当粘固剂开始从出口504流出时,其被第二流体导引构件441引导朝向第二开口408。第二导引构件441的定位使得粘固剂在箭头6a、6b和6c的方向上流动。因此第二穿孔区中的流动方向朝向髓内装置400的第二端部402。在使用中,这一点是重要的,因为其导引粘固剂远离骨折部位,诸如图12B中的601。
从图12B的射线图像可见,粘固剂(示为比装置400和股骨600更加亮白)局限于第二穿孔区406周围。
引入棒500逐渐从髓内骨装置400的第二端部402朝向第一端部401收缩。图8示出了引入棒500,该引入棒正如箭头9所示朝向髓内骨装置400的第一端部401收缩。
髓内骨装置400的中间区409被定位成跨接图12B中的骨折部位601。中间区409中不含开口防止了粘固剂流到骨折部位601,相反粘固剂包含在内腔404内。
引入棒500进一步收缩,直至出口504定位在第一穿孔区405内。当粘固剂继续从出口504流出时,其被第一流体导引构件421沿箭头5a和5b所示的方向(即,朝向髓内骨装置400的第一端部401)引导。朝向装置400的第一端部401导引粘固剂促使粘固剂远离骨折部位。同样,如图12B中的X-射线可见,被引入第一穿孔区405中的粘固剂基本上局限于所述区域并且不会延伸到骨折部位601中。
然后可以将引入棒500完全从髓内骨装置400移除并且固定骨折处直至粘固剂基本凝固。
实验
实验1
用儿童胫骨锯骨(Pacific Research Laboratories,Inc.Washington USA)进行实验性实验台实验。使锯骨经受弯曲力并断裂。通过钻通邻近近侧区域的锯骨的区域来形成6.5mm髓管并且在干骺端的内侧面朝近侧形成2mm的入口。朝远侧形成骨中的通气孔。
插入金属支架并通过入口注入磷酸钙粘固剂,从而填充髓管。在10分钟固化时间后,观察到骨被充分固定。
在后前位和侧向获取射线照片并示于图14B中。这些清晰地显示了填充有磷酸钙粘固剂的髓管,其中观察到横跨骨折处并强化粘固剂的更加致密的金属支架环。还可观察到实验性孔和通气孔。
测试
在Instron 5944机械测试机(Instron;Melbourne,Australia)上,用1kN测力传感器,以60N为限值,以2mm/min的速率,进行四点非破坏性弯曲测试,并且在原位具有粘固剂填充的支架的断裂的经处理的锯骨的硬度为完整的(未断裂的)锯骨的硬度的85%。
实验2
该实验目的在于测试磷酸钙粘固剂相对于填充有粘固剂的聚合物装置的强度和硬度。
制备磷酸钙粘固剂(Hydroset,Stryker)的圆柱体并使其固化24小时。
测试3个组:
1.仅有Hydroset
2.被如本文所公开的聚己酸内酯(PCL)髓内骨装置环绕的Hydroset圆柱体
3.Hydroset连同聚酯(PE)网片外围强化
测试
在Instron 5944机械测试机(Instron;Melbourne,Australia)上,用1kN测力传感器,以2mm/min的速率进行四点弯曲破坏性测试。内跨度长度为10mm,外跨度长度为30mm。
在四点弯曲下失效的能量
第1组的易碎磷酸钙粘固剂相对而言极早失效,从而在失效前仅吸收少量弯曲能量。如图15A所示,第2组的PCL引入器中原位失效的能量增长为第1组的10倍,并且第3组网片和hydroset的组合提供了另外2.5倍的失效能量增长。
在四点弯曲下失效的最大负荷
如图15B所示,失效的最大负荷比第1组结果增加两倍以上并且对于第3组增加四倍。
在四点弯曲下的硬度
如图15C所示的硬度结果显示了第1组的磷酸钙粘固剂的易碎性质。虽然坚硬,但其失效能量非常低,从而使其易于破碎。
事后测试
第1组的磷酸钙表现为白垩样形式并且分离成片状。第2组和第3组的例子保持了它们的结构并且仍然能够承受负荷。
本领域的技术人员应当理解,在不脱离本公开的广泛的大体范围的情况下,可以对上文所述实施方案做出许多变型和/或修改。因此,本发明的实施方案在所有方面都将被视为示例性而非限制性的。
- 还没有人留言评论。精彩留言会获得点赞!