用于抗体和抗体负载树突状细胞介导治疗的方法和组合物与流程
本申请要求2014年1月22日提交的美国临时专利申请第61/930,386号和2014年10月21日提交的美国临时专利申请第62/066,574号的权益,所述申请各自通过引用全文并入本文。
政府权利
本发明在国立卫生研究院授予的合同CA141468项下的支持下获得。政府对本发明享有一定权利。
发明背景
虽然免疫系统有能力区分自体(self)与非自体(non-self)之间的细微差别,但是癌症仍然趋向于生长和扩散,通常导致其宿主死亡。对于肿瘤相关抗原(TAA)的适应性T细胞反应可以在这种环境下发生,导致在可变时间段内的肿瘤消退或者肿瘤生长中止。然而,大部分肿瘤最终藉助免疫编辑而发生免疫逃逸,肿瘤细胞通过选择不适当表达由效应T细胞识别的抗原的变异体而通过该过程逃脱免疫检测。
与自体肿瘤相反,源自遗传不同的个体或小鼠品系的同种异基因肿瘤在被转移到在免疫学完整的宿主时被可靠地排斥,就像是被移植的同种异体器官。值得注意的是,这甚至在肿瘤与宿主共有主要组织相容性复合体(MHC)抗原的相同等位基因时发生,所述抗原长期被认为是移植物排斥的主要决定因素。
在这些条件下,加工并提呈与MHC I或II类分子相关的多种次要组织相容性抗原,导致产生以抗原特异性方式攻击肿瘤的效应T细胞。这样的抗原通常由常见蛋白质的多态性序列构成,但也可以由基因缺失,肽的细胞内加工和其他细胞内机制的差异产生。据推测,由于由同种异基因肿瘤表达的独特蛋白质的数量和种类,这些肿瘤不能逃脱宿主T细胞反应。实际上,源自供体的T细胞对于次要组织相容性抗原的识别据信是同种异基因造血细胞移植物之所以可以治愈某些癌症的主要原因。
不管肿瘤类型或背景如何,抗原提呈细胞(APC)被认为负责加工TAA并将其提呈给T细胞。在APC之中,经典活化的树突状细胞(DC)和巨噬细胞可以引起T细胞介导的免疫应答,其介导肿瘤细胞毒性和肿瘤消退。用TAA体外加载和激活DC可以在晚期癌症患者中诱导临床上明显的抗肿瘤免疫应答。尽管如此,肿瘤相关DC通常未能在自体环境中诱导有效应答,并且甚至可以抑制抗肿瘤免疫。
考虑到使肿瘤能够逃脱免疫介导的破坏的广泛机制,APC藉以产生对抗同种异基因肿瘤的有效免疫应答的机制仍然未得到解释,虽然这些过程具有重要的临床意义。本领域需要用于诱导有效的抗肿瘤免疫应答的组合物和方法。确定负责在同种异基因环境中诱导有效的抗肿瘤免疫的机制使得能够发现和开发新颖且有效的自体肿瘤治疗方法。
出版物
Steinman等人,Nature.2007年9月27日;449(7161):419-26;Kurts等人,Nat Rev Immunol.2010年6月;10(6):403-14;Trombetta等人,Annu Rev Immunol.2005年;23:975-1028;Fong等人,J Immunol.2001年3月15日;166(6):4254-9;Hsu等人,Nat Med.1996年1月;2(1):52-8;Fong等人,Annu Rev Immunol.2000年;18:245-73;Gilboa等人,J Clin Invest.2007年5月;117(5):1195-203;Melief等人,Immunity.2008年9月19日;29(3):372-83;Palucka等人,Immunity.2013年7月25日;39(1):38-48;Tseng等人,Proc Natl Acad Sci U S A.2013年7月2日;110(27):11103-8;Schuurhuis等人,J Immunol.2006年4月15日;176(8):4573-80;美国专利申请第US20020155108号;和美国专利第8518405号。
技术实现要素:
提供了用于治疗患有癌症的个体的方法。所述方法的方面包括将下述施用于个体:(i)包含特异性结合个体的癌细胞抗原的同种IgG抗体的抗体组合物;和(ii)激活个体的树突状细胞的疗法。在一些情况下,抗体组合物包含具有多种结合特异性的多克隆同种IgG抗体。在一些情况下,多克隆同种IgG抗体可以是一组单克隆抗体(例如,具有确定的靶抗原特异性)。在一些情况下,多克隆同种IgG抗体可以来自于一个或多个个体的血清(例如,来自一个个体的血清、合并自两个或更多个个体的血清,等等)。在一些情况下,抗体组合物包含静脉内注射免疫球蛋白(IVIG)或者从IVIG纯化或富集的抗体。在一些情况下,激活个体的树突状细胞的疗法包括使个体暴露于局部辐照。在一些情况下,激活个体的树突状细胞的疗法包括将具有树突状细胞刺激剂的刺激组合物施用于个体。在一些情况下,树突状细胞刺激剂被缀合到同种IgG抗体。在一些情况下,刺激组合物包含CD40激动剂和促炎性细胞因子(例如,TNFα、IFNγ、等等)。在一些情况下,刺激组合物包含Toll样受体(TLR)激动剂。
提供了用于诱导个体中的免疫应答的方法。所述方法的方面包括:(a)将来自个体的树突状细胞(DC)(例如,来自个体的树突状细胞的群体)与靶抗原和具有特异性地结合靶抗原的同种IgG抗体的抗体组合物在对于由DC摄取靶抗原有效的剂量下体外接触对于由DC摄取靶抗原有效的一段时间,由此产生负载DC(loaded DC)(例如,负载DC的群体);和(b)将个体的T细胞(例如,个体的T细胞的群体)与负载DC接触,其中负载DC将抗原提呈给T细胞以产生接触的T细胞(contacted T cell),并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。在一些情况下,DC来自患有癌症的个体并且靶抗原与癌症相关。在一些情况下,DC与来自个体的癌细胞接触。在一些情况下,DC与来自个体的癌细胞的裂解物接触。在一些情况下,DC与来自个体的癌细胞的一种或多种(例如,两种或更多种)质膜蛋白接触。在一些情况下,DC与包含DC刺激剂的刺激组合物接触。在一些情况下,刺激组合物包含CD40激动剂和促炎性细胞因子。在一些情况下,刺激组合物包含TLR激动剂。在一些情况下,DC刺激剂被缀合到同种IgG抗体。在一些情况下,在接触DC之前,靶抗原(例如,靶细胞、癌细胞裂解物/提取物、具有两种或更多种质膜蛋白的组合物)与抗体组合物接触,产生免疫复合体。因此,在一些情况下,所述方法包括将DC与免疫复合体接触。在一些情况下,DC同时与靶抗原和抗体组合物接触。在一些情况下,体内进行接触T细胞的步骤并且所述方法包括将负载DC引入到个体中。在一些情况下,体外进行接触T细胞的步骤并且所述方法包括将接触的T细胞引入到个体中。
还提供了用于实施本公开的方法的组合物和试剂盒。在一些情况下,所述组合物包含:具有多种结合特异性的多克隆同种IgG抗体;和至少一种DC刺激剂。在一些情况下,所述组合物包含:具有多种结合特异性的多克隆同种IgG抗体;CD40激动剂;和促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)。在一些情况下,DC刺激剂被缀合到组合物的同种IgG抗体中的至少一种。在一些情况下,所述组合物包含静脉内注射免疫球蛋白(IVIG)或者从IVIG纯化或富集的抗体。在一些情况下,所述组合物包含IVIG或者从IVIG纯化或富集的抗体,其中组合物中存在的同种IgG抗体中的至少一种被缀合到DC刺激剂。在一些情况下,组合物中存在的同种IgG抗体中的至少一种被缀合到CD40激动剂,并且组合物中存在的同种IgG抗体中的至少一种被缀合到促炎性细胞因子。在一些情况下,组合物中存在的同种IgG抗体中的至少一种被缀合到CD40激动剂;组合物中存在的同种IgG抗体中的至少一种被缀合到促炎性细胞因子;或者组合物中存在的同种IgG抗体中的至少一种被缀合到CpG寡脱氧核苷酸(CpG ODN)。
在一些实施方式中,提供了用于减小肿瘤大小的包含同种IgG抗体和APC刺激组合物的组合物。
在一个方面,本发明提供了一种治疗患有癌症的个体的方法,所述方法包括:向个体施用:(i)包含结合个体的癌细胞抗原的同种IgG抗体的抗体组合物;和(ii)激活个体的APC的疗法,其中APC是树突状细胞、巨噬细胞或B细胞,由此治疗患有癌症的个体。
在一些实施方式中,同种IgG抗体结合个体中的癌细胞上的抗原以形成免疫复合体。在一些情况下,激活APC包括在个体中由APC摄取免疫复合体并且将癌细胞的多种抗原提呈给T细胞。在一些情况下,被提呈给T细胞的多种抗原中的至少一种与免疫复合体中的抗原不同。
在一些情况下,在个体中,所述方法减小癌细胞数量或者一个或多个肿瘤的大小。在一些情况下,癌症是实体肿瘤。在一些情况下,实体肿瘤直径小于1cm。在一些情况下,个体是人。
在一些情况下,同种IgG抗体结合以至少1000个拷贝存在于癌细胞的表面上的抗原。在一些情况下,同种IgG抗体以与非癌细胞上的抗原相比高至少100、1000、10000倍的亲和力(affinity)(低100、1000、10000倍的Kd)结合癌细胞上的抗原,其中与非癌细胞上的抗原相比,癌细胞上的抗原具有一种或多种多态性。在一些情况下,与同种IgG抗体结合非癌细胞相比,同种IgG抗体以更高的亲合力(avidity)结合癌细胞。
在一些情况下,激活树突状细胞的疗法包括包含树突状细胞刺激剂的树突状细胞刺激组合物。在一些情况下,树突状细胞刺激组合物包含选自以下的一种或多种树突状细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)检查点分子中和化合物;(v)吲哚胺2,3-二加氧酶(IDO)抑制剂;(vi)NFkB激活剂;(vii)打开钙通道的化合物;和(viii)T细胞相关共刺激分子。在一些情况下,树突状细胞刺激组合物包含CD40激动剂和促炎性细胞因子。在一些情况下,促炎性细胞因子是肿瘤坏死因子α(TNFα)和/或IFNγ。在一些情况下,树突状细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,激活B细胞的疗法包括含有B细胞刺激剂的B细胞刺激组合物。在一些情况下,B细胞刺激组合物包含选自以下的一种或多种B细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;和(vi)交联表面免疫球蛋白的试剂。在一些情况下,促炎性细胞因子是IL-1、IL-2、IL-3、IL-4、IL-6、IL-7、IL-9、IL-10、IL-12、IL-15、IL-18、IL-21、IFN-α、IFN-β、IFN-γ、G-CSF或GM-CSF。在一些情况下,TLR激动剂是CpG ODN、免疫刺激性DNA、免疫刺激性RNA、免疫刺激性寡核苷酸、咪喹莫特(Imiquimod)、瑞喹莫德(Resiquimod)、洛索立宾(Loxribine)、Flagellin、FSL-I或LPS。在一些情况下,抗原是自体抗原、同种抗原、肽抗原、核酸抗原、碳水化合物抗原或肿瘤相关抗原。在一些情况下,交联表面免疫球蛋白的试剂是抗Ig抗体、抗独特型抗体或抗同种型抗体。在一些情况下,B细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,激活巨噬细胞的疗法包括含有巨噬细胞刺激剂的巨噬细胞刺激组合物。在一些情况下,巨噬细胞刺激组合物包含选自以下的一种或多种巨噬细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;和(iii)糖皮质激素受体激动剂。在一些情况下,巨噬细胞激活性细胞因子是IL-1、IL-4、IL-6、IL-10、IL-13、TNF-α、TNF-β、G-CSF、GM-CSF或IFN-γ。在一些情况下,TLR激动剂是TLR4激动剂或TLR2激动剂。在一些情况下,TLR4激动剂或TLR2激动剂是脂多糖、胞壁酰二肽(muramyl dipeptide)、脂磷壁酸或细菌热休克蛋白。在一些情况下,巨噬细胞刺激剂被缀合到同种IgG抗体。在一些情况下,
在一些实施方式中,癌细胞抗原是在癌细胞中富集的抗原。在一些实施方式中,同种IgG抗体是单克隆抗体。在一些实施方式中,抗体组合物包含两种或更多种同种IgG抗体,其中两种或更多种同种IgG抗体中的至少两种特异性地结合不同抗原。在一些实施方式中,抗体组合物包含两种或更多种同种IgG抗体,其中两种或更多种同种IgG抗体中的至少两种特异性地结合相同抗原的不同表位。在一些情况下,两种或更多种同种IgG抗体中的至少两种是单克隆抗体。
在一些实施方式中,(a)所述抗体组合物和(b)激活个体的APC的所述疗法中的至少一个通过局部注射施用到(i)肿瘤中或肿瘤附近;和/或(ii)肿瘤切除部位中或肿瘤切除部位附近。在一些实施方式中,(a)抗体组合物和(b)激活个体的APC的疗法中的至少一个在脂质体、微粒或纳米颗粒中施用。
在一些实施方式中,APC是树突状细胞。在一些实施方式中,APC是巨噬细胞。在一些实施方式中,APC是B细胞。
在另一方面,本发明提供了一种治疗患有癌症的个体的方法,所述方法包括:向个体施用:(i)包含结合癌细胞上的多种抗原的多克隆同种IgG抗体的抗体组合物;和(ii)激活个体的抗原提呈细胞(APC)的疗法,其中APC是树突状细胞、巨噬细胞或B细胞。在一些实施方式中,多克隆同种IgG抗体来自于第二个体的血清。在一些实施方式中,多克隆同种IgG抗体合并自2个或更多个个体。
在一些实施方式中,同种IgG抗体中至少一种的靶抗原未被预先确定。在一些实施方式中,激活树突状细胞的疗法包括包含树突状细胞刺激剂的树突状细胞刺激组合物。
在一些情况下,树突状细胞刺激组合物包含选自以下的一种或多种树突状细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)检查点分子中和化合物;(v)吲哚胺2,3-二加氧酶(IDO)抑制剂;(vi)NFkB激活剂;(vii)打开钙通道的化合物;和(viii)T细胞相关共刺激分子。在一些情况下,树突状细胞刺激组合物包含CD40激动剂和促炎性细胞因子。在一些情况下,促炎性细胞因子是肿瘤坏死因子α(TNFα)和/或IFNγ。在一些情况下,树突状细胞刺激剂被缀合到同种IgG抗体中的至少一种。
在一些实施方式中,激活B细胞的疗法包括含有B细胞刺激剂的B细胞刺激组合物。在一些情况下,B细胞刺激组合物包含选自以下的一种或多种B细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;和(vi)交联表面免疫球蛋白的试剂。在一些情况下,促炎性细胞因子是IL-1、IL-2、IL-3、IL-4、IL-6、IL-7、IL-9、IL-10、IL-12、IL-15、IL-18、IL-21、IFN-α、IFN-β、IFN-γ、G-CSF或GM-CSF。在一些情况下,TLR激动剂是CpG ODN、免疫刺激性DNA、免疫刺激性RNA、免疫刺激性寡核苷酸、咪喹莫特、瑞喹莫德、洛索立宾、Flagellin、FSL-I或LPS。在一些情况下,抗原是自体抗原、同种抗原、肽抗原、核酸抗原、碳水化合物抗原或肿瘤相关抗原。在一些情况下,交联表面免疫球蛋白的试剂是抗Ig抗体、抗独特型抗体或抗同种型抗体。在一些情况下,B细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,激活巨噬细胞的疗法包括含有巨噬细胞刺激剂的巨噬细胞刺激组合物。在一些情况下,巨噬细胞刺激组合物包含选自以下的一种或多种巨噬细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;和(iii)糖皮质激素受体激动剂。在一些情况下,巨噬细胞激活性细胞因子是IL-1、IL-4、IL-6、IL-10、IL-13、TNF-α、TNF-β、G-CSF、GM-CSF或IFN-γ。在一些情况下,TLR激动剂是TLR4激动剂或TLR2激动剂。在一些情况下,TLR4激动剂或TLR2激动剂是脂多糖、胞壁酰二肽、脂磷壁酸或细菌热休克蛋白。在一些情况下,巨噬细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,(a)所述抗体组合物和(b)激活个体的APC的所述疗法中的至少一个通过局部注射施用到(i)肿瘤中或肿瘤附近和/或(ii)肿瘤切除部位中或肿瘤切除部位附近。在一些实施方式中,(a)所述抗体组合物和(b)激活个体的APC的所述疗法中的至少一个在脂质体、微粒或纳米颗粒中施用。
在一些实施方式中,多克隆同种IgG抗体是两种或更多种单克隆抗体。在一些情况下,两种或更多种单克隆抗体中的至少两种特异性地结合在癌细胞中富集的抗原。在一些情况下,两种或更多种单克隆抗体中的至少两种特异性地结合不同抗原。在一些情况下,两种或更多种单克隆抗体中的至少两种特异性地结合相同抗原上的两个不同表位。
在一些实施方式中,多克隆同种IgG抗体结合个体中癌细胞上的抗原以形成免疫复合体。在一些情况下,激活APC包括在个体中由APC摄取免疫复合体并且将癌细胞的多种抗原提呈给T细胞。在一些情况下,被提呈给T细胞的多种抗原中的至少一种与免疫复合体中抗原的任一种不同。
在一些实施方式中,在个体中,所述方法减少癌细胞数量或者减小肿瘤大小。在一些情况下,癌症是实体肿瘤。在一些情况下,实体肿瘤直径小于1cm。在一些情况下,个体是人。
在另一方面,本发明提供了一种诱导个体中的免疫应答的方法,所述方法包括:(a)将来自个体的抗原提呈细胞(APC)与下述体外接触:(i)癌细胞或其部分;和(ii)包含结合癌细胞上的抗原的同种IgG抗体的抗体组合物,其中癌细胞与结合癌细胞上的抗原的同种IgG抗体形成免疫复合体,和其中所述接触导致APC摄取免疫复合体,由此产生负载APC,其中APC是树突状细胞、巨噬细胞或B细胞;和(b)将个体的T细胞与负载APC接触,其中负载APC将癌细胞抗原提呈给T细胞以产生接触的T细胞,并且接触的T细胞产生对于被提呈的癌细胞抗原特异性的免疫应答。
在一些实施方式中,APC是选自骨髓来源DC、血液来源DC、脾DC和肿瘤相关DC(TADC)的树突状细胞。在一些实施方式中,所述方法还包括将所述APC与包含APC刺激剂的APC刺激组合物接触。在一些情况下,APC刺激组合物是包含树突状细胞刺激剂的树突状细胞刺激组合物。
在一些情况下,树突状细胞刺激组合物包含选自以下的一种或多种树突状细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)检查点分子中和化合物;(v)吲哚胺2,3-二加氧酶(IDO)抑制剂;(vi)NFkB激活剂;(vii)打开钙通道的化合物;和(viii)T细胞相关共刺激分子。在一些情况下,树突状细胞刺激组合物包含CD40激动剂和促炎性细胞因子。在一些情况下,促炎性细胞因子是肿瘤坏死因子α(TNFα)和/或IFNγ。在一些情况下,树突状细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,APC刺激组合物是包含B细胞刺激剂的B细胞刺激组合物。在一些情况下,B细胞刺激组合物包含选自以下的一种或多种B细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;和(vi)交联表面免疫球蛋白的试剂。在一些情况下,促炎性细胞因子是IL-1、IL-2、IL-3、IL-4、IL-6、IL-7、IL-9、IL-10、IL-12、IL-15、IL-18、IL-21、IFN-α、IFN-β、IFN-γ、G-CSF或GM-CSF。在一些情况下,TLR激动剂是CpG ODN、免疫刺激性DNA、免疫刺激性RNA、免疫刺激性寡核苷酸、咪喹莫特、瑞喹莫德、洛索立宾、Flagellin、FSL-I或LPS。在一些情况下,抗原是自体抗原、同种抗原、肽抗原、核酸抗原、碳水化合物抗原或肿瘤相关抗原。在一些情况下,交联表面免疫球蛋白的试剂是抗Ig抗体、抗独特型抗体或抗同种型抗体。在一些情况下,B细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,APC刺激组合物是包含巨噬细胞刺激剂的巨噬细胞刺激组合物。在一些情况下,巨噬细胞刺激组合物包含选自以下的一种或多种巨噬细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;和(iii)糖皮质激素受体激动剂。在一些情况下,巨噬细胞激活性细胞因子是IL-1、IL-4、IL-6、IL-10、IL-13、TNF-α、TNF-β、G-CSF、GM-CSF或IFN-γ。在一些情况下,TLR激动剂是TLR4激动剂或TLR2激动剂。在一些情况下,TLR4激动剂或TLR2激动剂是脂多糖、胞壁酰二肽、脂磷壁酸或细菌热休克蛋白。在一些情况下,巨噬细胞刺激剂被缀合到同种IgG抗体。
在一些实施方式中,癌细胞在接触APC之前与抗体组合物接触。在一些实施方式中,APC同时与癌细胞和抗体组合物接触。在一些实施方式中,体内进行接触T细胞的步骤并且所述方法包括将负载APC引入到个体中。在一些实施方式中,体外进行接触T细胞的步骤并且所述方法包括将接触的T细胞引入到个体中。在一些实施方式中,同种IgG抗体是单克隆抗体。在一些实施方式中,抗体组合物包含结合多种癌细胞抗原的多克隆同种IgG抗体。在一些情况下,多克隆同种IgG抗体是两种或更多种单克隆抗体。
在另一方面,本发明提供了一种用于加载(loading)APC的组合物,所述组合物包含:(i)包含结合癌细胞抗原的同种IgG抗体的抗体组合物;和(ii)APC刺激剂,其中APC刺激剂是树突状细胞刺激剂、巨噬细胞刺激剂或B细胞刺激剂。在一些实施方式中,同种IgG抗体是单克隆抗体。
在一些实施方式中,抗体组合物包含结合多种癌细胞抗原的多克隆同种IgG抗体。在一些情况下,多克隆同种IgG抗体包含两种或更多种单克隆抗体。在一些情况下,两种或更多种单克隆抗体中的至少两种特异性地结合在癌细胞中富集的抗原。在一些情况下,两种或更多种单克隆抗体中的至少两种特异性地结合不同抗原。在一些情况下,两种或更多种单克隆抗体中的至少两种特异性地结合相同抗原的不同表位。
在一些情况下,多克隆同种IgG抗体来自于个体的血清。在一些情况下,多克隆同种IgG抗体合并自2个或更多个个体。在一些情况下,所述组合物包含静脉内注射免疫球蛋白(IVIG)或者从IVIG纯化或富集的抗体。
在一些实施方式中,树突状细胞刺激剂选自:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)检查点分子中和化合物;(v)吲哚胺2,3-二加氧酶(IDO)抑制剂;(vi)NFkB激活剂;(vii)打开钙通道的化合物;和(viii)T细胞相关共刺激分子。
在一些实施方式中,B细胞刺激剂选自:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;和(vi)交联表面免疫球蛋白的试剂。
在一些实施方式中,巨噬细胞刺激剂选自:(i)Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;和(iii)糖皮质激素受体激动剂。
在一些实施方式中,抗体组合物的至少一种同种IgG抗体被缀合到APC刺激剂。在一些情况下,抗体组合物的至少一种同种IgG抗体被缀合到CD40激动剂,并且抗体组合物的至少一种同种IgG抗体被缀合到促炎性细胞因子。在一些情况下,促炎性细胞因子是TNFα和/或IFNγ。
在一些实施方式中,抗体组合物的至少一种同种IgG抗体被缀合到CD40激动剂;抗体组合物的至少一种同种IgG抗体被缀合到促炎性细胞因子;并且抗体组合物的至少一种同种IgG抗体被缀合到Toll样受体(TLR)激动剂。
在另一方面,本发明提供了用于前述方法中任一种的试剂盒。在另一方面,本发明提供了一种试剂盒,其包括:(i)包括包含结合癌细胞抗原的同种IgG抗体的抗体组合物的隔室;和(ii)包括至少一种APC刺激组合物的至少一个隔室,其中APC刺激组合物是树突状细胞刺激组合物、巨噬细胞刺激组合物或B细胞刺激组合物。
在一些实施方式中,APC刺激组合物包含选自以下的一种或多种树突状细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)检查点分子中和化合物;(v)吲哚胺2,3-二加氧酶(IDO)抑制剂;(vi)NFkB激活剂;(vii)打开钙通道的化合物;和(viii)T细胞相关共刺激分子。在一些情况下,CD40激动剂是CD40L并且促炎性细胞因子是TNFa和/或IFNg。在一些情况下,CD40激动剂和促炎性细胞因子在同一隔室中。在一些情况下,CD40激动剂和促炎性细胞因子在单独的隔室中。
在一些实施方式中,APC刺激组合物包含选自以下的一种或多种巨噬细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;和(iii)糖皮质激素受体激动剂。在一些实施方式中,APC刺激组合物包含选自以下的一种或多种B细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;和(vi)交联表面免疫球蛋白的试剂。
在另一方面,本发明提供了一种用于减小肿瘤大小或肿瘤中的细胞数量的方法,其包括:将肿瘤与下述接触:(i)包含特异性结合肿瘤细胞的抗原的同种IgG抗体的抗体组合物;和(ii)APC刺激组合物,其中APC是树突状细胞、巨噬细胞或B细胞,由此减小肿瘤的大小或肿瘤中的细胞数量。在一些实施方式中,接触肿瘤包括将抗体组合物和APC刺激组合物同时或顺序地直接注射到肿瘤部位中或者肿瘤部位附近。在一些实施方式中,APC是树突状细胞,并且APC刺激组合物包含树突状细胞刺激剂。在一些实施方式中,APC是巨噬细胞,并且APC刺激组合物包含巨噬细胞刺激剂。在一些实施方式中,APC是B细胞,并且APC刺激组合物包含B细胞刺激剂。
在一些情况下,APC刺激组合物包含选自以下的一种或多种树突状细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)检查点分子中和化合物;(v)吲哚胺2,3-二加氧酶(IDO)抑制剂;(vi)NFkB激活剂;(vii)打开钙通道的化合物;和(viii)T细胞相关共刺激分子。
在一些情况下,APC刺激组合物包含选自以下的一种或多种巨噬细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;和(iii)糖皮质激素受体激动剂。
在一些情况下,APC刺激组合物包含选自以下的一种或多种B细胞刺激剂:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;和(vi)交联表面免疫球蛋白的试剂。
附图说明
在结合随附附图阅读时,本发明根据以下详细描述得以最好地理解。所强调的是,根据惯例,附图的各种不同特征并非按比例绘制。反之,出于清楚的原因,各种不同特征的尺寸被任意地扩大或缩小。附图中包括以下图形。
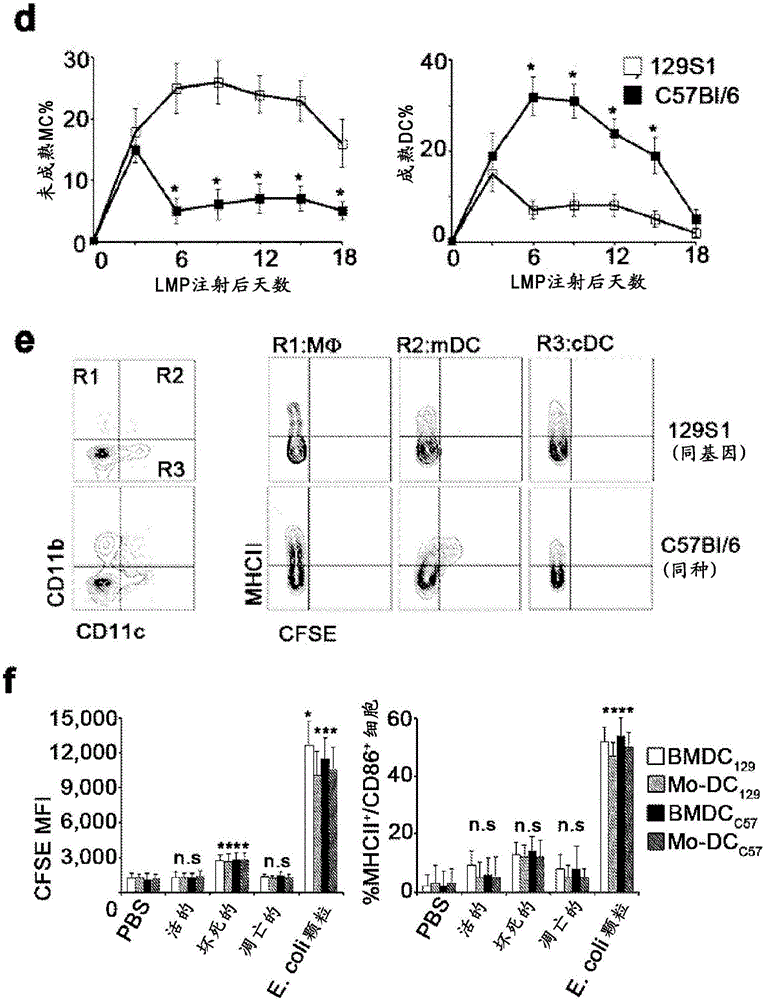
图1a-k.肿瘤结合抗体启动同种异基因肿瘤的排斥。a.实验设计:LMP细胞皮下(s.c.)注射到129S1同系和C57Bl/6同种异基因宿主中。B16F10细胞皮下注射到C57Bl/6同系和129S1同种异基因宿主中。b.LMP和B16肿瘤在C57Bl/6(■)、129S1(▲)、CD4+细胞耗竭同种异基因小鼠(◇)或CD8+细胞耗竭同种异基因小鼠(○)(n=16)中的生长。c.在129S1(□)和C57Bl/6小鼠(■)(n=8)中,CD45+细胞中LMP浸润CD4+和CD8+ T细胞的百分比。d.在129S1(□)和C57Bl/6小鼠(■)(n=8)中,LMP浸润未成熟髓系细胞(iMC)和成熟DC的百分比。e.3天前用CFSE标记LMP细胞接种的129S1或C57Bl/6小鼠(n=6)的引流淋巴结中的髓系细胞。f.用CFSE标记LMP细胞孵育过夜的同基因BMDC(□)和血液单核细胞(Mo)-DC以及同种异基因BMDC(■)和Mo-DC的肿瘤摄取、MHCII和CD86表达(n=10)。g.在肿瘤接种到129S1或C57Bl/6小鼠中之后48h,IgG和IgM体内结合CFSE标记LMP细胞(n=5)。h.和i.在CFSE标记LMP细胞接种到129S1和C57BI/6小鼠中之后24h,IgM(h)和IgG(i)的肿瘤切片染色(n=5)。j.在129S1(□)、C57Bl/6(■)和B细胞耗竭同种异基因宿主(◆)中的肿瘤生长(n=6)。k.左:原始的(naive)C57Bl/6(○)中或者在第-1天和第0天静脉内注射同基因IgG(■)、同基因IgM(▲)、同种IgG(□)或同种IgM(Δ)的小鼠中的B16肿瘤大小(n=6)。右:注射两次同种IgG(□)或同种IgM(Δ)的原始C57Bl/6(○)、或者注射同种IgG(■)或同种IgM(▲)的FcγR KO小鼠(C57BI/6背景)中的B16肿瘤大小(n=6)。星号(*)表示p<0.05,且双星号(**)表示p<0.01。
图2a-h.同种IgG-IC被BMDC摄取和提呈,并且在体内驱动保护性免疫。a.实验设计:肿瘤裂解物用同基因或同种IgG或IgM孵育并用同基因BMDC培养过夜。b.CD86和MHCII在用抗体及肿瘤裂解物(□)或完整肿瘤细胞(■)培养的DC上的表达(n=16)。c.在与LMP裂解物(□)或完整LMP细胞(■)Ig-IC培养过夜的BMDC的上清液中的IL-12和TNFα(n=16)。d.用从CFSE标记肿瘤裂解物(□)或CFSE标记完整细胞(■)形成的IC孵育过夜的BMDC(n=8)。e.与CFSE标记LMP细胞和同种抗体(x400)过夜培养的BMDC中的MHCII表达。f.与用从肿瘤裂解物(□)或完整细胞(■)形成的IC负载的DC培养的CD4+ T细胞的增殖(n=8)。g.实验设计:从小鼠移除肿瘤、用抗体涂布并且用同基因DC孵育24h。清洗DC并皮下注射到对应的肿瘤切除小鼠中。h.PBS(●)、用肿瘤裂解物负载的DC(○)、C57Bl/6 IgG-IC(▲)、C57Bl/6IgM-IC(Δ)、129S1 IgG-IC(■)或129S1 IgM-IC(□)对于肿瘤复发的作用(n=16)。
图3a-g.肿瘤相关树突状细胞(TADC)而非骨髓来源树突状细胞(BMDC)需要刺激来响应同种IgG-IC。a.肿瘤内注射PBS(○)、129S1 IgG(◇)或C57Bl/6 IgG(◆)后的肿瘤生长(n=12)。b.用PBS(各个情况下的左条)、肿瘤裂解物(各个情况下的中条)或同种IgG-IC(各个情况下的右条)孵育的DC上的CD86和MHCII表达(n=9)。c.单独培养的DC(各个情况下的左条)、用LMP裂解物培养的DC(各个情况下的中条)或用同种IgG-IC培养的DC(各个情况下的右条)的上清液中的TNFα和IL-12(n=12)。d.用DC(各个情况下的左条)、肿瘤裂解物负载的DC(各个情况下的中条)或同种IgG-IC负载的DC(各个情况下的右条)培养的CD4+ T细胞的增殖(n=12)。e.未治疗的小鼠(○)或者用同种IgG-IC激活BMDC(■)或TADC(▲)治疗的小鼠中被切除的LMP和B16肿瘤的复发(n=12)。f.未处理的DC(红色)或者用同种IgG-IC孵育的DC中的p-P38、pERK1/2和pJNK。曲线图显示了用LMP裂解物(各个情况下的左条)或同种IgG-IC(各个情况下的右条)孵育15min的DC中的p-pP38、pERK1/2和pJNK水平的反双曲正弦比率(n=8)。g.在与CFSE标记同种IgG-IC一起过夜培养之后,TADC的MHCII+和CD86+表达或CFSE水平(n=12)。PBS(各个情况下的左条);IgG129IC(各个情况下的右条)。
图4a-i.与CD40L和TNFα组合用同种抗体原位注射肿瘤诱导全身性的DC介导抗肿瘤免疫。a.未治疗的小鼠(○)或者用同种IgG(●)、TNFα+CD40L(□)、聚I:C(Δ)、同种IgG+TNFα+CD40L(■)或聚I:C+同种IgG(▲)注射的小鼠中的肿瘤生长(n=12)。b.在注射PBS(底部)、PE标记IgG(中部)或PE标记IgG与TNFα+CD40L(顶部)后2小时,来自B16携带小鼠的髓系细胞中PE的平均荧光水平。c.在治疗后5天,来自B16肿瘤的DC上的CD40和CD86表达(n=6)。d.用来自未治疗的B16肿瘤(○)或者用同种IgG(●)、TNFα+CD40L(□)、聚I:C(Δ)、TNFα+CD40L+同种IgG(■)或聚I:C+同种IgG(▲)注射的B16肿瘤的2x106个DC接种的小鼠中的B16生长(n=6)。e.未治疗的Tyr:CreER;BrafV600E/Ptenlox/lox小鼠(○)或者用同种IgG(□)、TNFα+CD40L(Δ)或TNFα+CD40L+同种IgG(■)治疗的Tyr:CreER;BrafV600E/Ptenlox/lox小鼠中的肿瘤数量。照片显示了在治疗当天和治疗后第24天的代表性小鼠(n=8)。f.未治疗的小鼠(○)或者用同种IgG(□)、TNFα+CD40L(Δ)或TNFα+CD40L+同种IgG(◆)治疗的小鼠中4T1原发肿瘤大小(n=7)。g.在第30天的可见肺转移瘤的平均计数。在第30天的肺转移瘤的照片和组织学(x10放大倍数,n=7)。h.用涂覆有自身IgG或同种IgG的CFSE染色自体肿瘤细胞过夜培养的来自肺癌患者的TADC上的抗原摄取和CD40/CD86共表达(n=2)。i.在自体BMDC用自身IgG或同种IgG涂覆的自体肿瘤细胞培养之后,来自间皮瘤(MSTO)患者的CD4+ T细胞的DC HLA-DR上调和增殖响应(n=2)。
图5a-f.a.在129S1(□)、C57Bl/6(■)或者用anti-asialo-GM1(Δ)或anti-NK1.1抗体(◇)预治疗的同种异基因宿主中的LMP(右)和B16(左)生长(n=5)。b.129S1(□)和C57Bl/6(■)LMP携带小鼠的淋巴器官中CD4+ T细胞(上图)和CD8+ T细胞(下图)的BrdU摄取。c.来自LMP携带小鼠(左图)和B16携带小鼠(右图)的Gr-1neg/CD11c+/MHCII+细胞的流式细胞术分析。直方图显示了在来自C57Bl/6(蓝色)和129S1小鼠(红色)的DC上共刺激分子的代表性表达水平。d.用LMP细胞孵育过夜的同基因BMDC(□)、同基因血液单核细胞(Mo)-DC、同种异基因BMDC(■)或Mo-DC的上清液中的IL12和TNFα。e.各种不同浓度的来自C57Bl/6的IgG(□)、来自C57Bl/6的IgM(Δ)、来自129S1的IgG(■)和来自129S1的IgM(▲)与LMP和B16细胞结合的流式细胞术分析。下图显示了在1μg的C57Bl/6(红色)或129S1(绿色)抗体与1x105个LMP(上)或B16(下)细胞孵育之后,IgG(左)或IgM(右)的MFI的代表性直方图。f.用同种IgG(■)、同种IgM(▲)、同基因IgG(□)或同基因IgM(Δ)注射的原始129S1小鼠中的LMP肿瘤大小(n=6)。星号(*)表示p<0.05,且双星号(**)表示p<0.01。
图6a-j.a.来自用IgG-IC过夜激活的C57Bl/6(□)和FcγR KO小鼠(■)的BMDC中的CD40和CD86表达(左)及IL-12分泌(右)的平均水平(n=5)。b.与来自负载有IgG-IC的C57Bl/6(□)和FcγRKO小鼠(■)的BMDC一起培养的CD4+ T细胞的增殖(n=4)。c.未治疗的小鼠(○)、用IgG-IC负载的WT BMDC治疗的小鼠(■)或用IgG-IC负载的FcγR KO BMDC治疗的小鼠(◇)中的肿瘤复发(n=4)。d.和e.在来自原始小鼠(●)或者来自用DC+IgGC57 IC(▲)、DC+IgMC57 IC(Δ)、DC+IgG129 IC(■)或DC+IgM129 IC(□)治疗的LMP(a)或B16(b)切除小鼠的5x106个脾CD4+ T细胞(左图)或CD8+ T细胞(右图)过继转移,并且随后用LMP(a)或B16(b)挑战之后的无肿瘤小鼠的百分比(n=6)。f.左:未治疗的小鼠(○)或者用负载有由同种IgG和细胞溶质肿瘤蛋白(◇)、核肿瘤蛋白(Δ)或膜肿瘤蛋白(■)形成的IC的DC治疗的小鼠中的肿瘤频率。右:未治疗的小鼠(○),用负载有由同种IgG和膜蛋白(□)、无O-和N-聚糖的膜蛋白(Δ)或热变性膜蛋白(◆)形成的IC的DC治疗的小鼠中的肿瘤频率。(n=5)。g.未治疗的C57Bl/6小鼠(○)或者用TNFα+CD40L(Δ)、TNFα+CD40L+同种IgG(■)或TNFα+CD40L和在IgG供体背景的正常细胞上(◆)或在肿瘤背景的正常细胞上(■)吸收的同种IgG注射的C57Bl/6小鼠中的B16肿瘤生长(n=6)。h.在未治疗的小鼠(○)、用来自常规饲养的C57Bl/6的负载有IgG-IC的2x106个DC(◇)或者用负载有来自无菌C57Bl/6小鼠的IgG-IC的2x106个DC(■)治疗的小鼠中切除之后的肿瘤复发率(n=4)。i.未治疗的小鼠(○)或者用负载有同种IgG涂覆的完整B16细胞的BMDC(□)或负载有交联同基因IgG的完整B16细胞的BMDC(▲)治疗的小鼠中的B16频率(n=4)。j.未治疗的小鼠(○)或者用负载同种IgG涂覆的完整B16细胞的BMDC(□)或负载针对MHC-I的单克隆IgG涂覆的完整B16的BMDC(▲)治疗的小鼠中的B16肿瘤频率。
图7a-d.a.来自BM和肿瘤的DC的分选和培养的图解。b.单独的培养基(空心条)、具有B16裂解物(灰色条)或者具有同种IgG-IC(实心条)的培养基中过夜培养的DC的上清液中IL-12(左图)和TNFα(右图)的平均水平。c.在有或没有刺激分子的情况下,在用PBS(各个情况下的左条)或CFSE标记同种IgG-IC(各个情况下的右条)激活过夜之后,肿瘤相关DC中的MHCII+/CD86+细胞的百分比(左图)或CFSE水平(右图)。d.与CFSE标记的固定B16细胞一起培养过夜的B16来源DC的流式细胞术分析和共焦图像。结果代表至少4次实验的平均值±SEM。星号(*)表示p<0.05,且双星号(**)表示p<0.01。
图8a-h.a.未治疗的C57BI/6小鼠(○)或者肿瘤内注射129S1同种IgG(◇)、LPS(□)、TNFα+CD28(Δ)、LPS+同种IgG(■)或TNFα+CD28+同种IgG(▲)的C57BI/6小鼠中的B16肿瘤大小。b.未治疗的C57BI/6小鼠(○)或者肿瘤内注射129S1同种IgG(●)、TNFα(□)、CD28(Δ)、CD40L的C57BI/6小鼠中的B16肿瘤大小。c.未治疗的C57BI/6小鼠(○)或者肿瘤内注射129S1同种IgG(●)、TNFα+CD40L(□)、TNFα+CD28(Δ)、129S1同种IgG+TNFα+CD40L(■)或TNFα+CD28+129S1 IgG(▲)的C57BI/6小鼠中的LL/2肿瘤大小。d.在肿瘤内注射PBS或5μg PE标记同种IgG后3小时,携带B16肿瘤的小鼠中IgG结合总髓系细胞的代表性流式细胞术分析(n=6)。e.在治疗后4天,携带B16肿瘤的小鼠的引流淋巴结中CD11c+细胞的总数(n=6)。f.用来自未治疗的B16肿瘤(○)或者用同种IgG(□)或同种IgG+TNFα+CD40L(◇)注射的B16肿瘤的2x106个B细胞、NK细胞、肥大细胞或巨噬细胞接种的小鼠中的B16生长(n=5)。g.在第30天的肺转移瘤的H&E切片(x10放大倍数,n=7)。h.在50ng/ml TNFα和1μg/mL CD40L的存在下与自体肿瘤细胞(绿色)一起孵育过夜的来自肺癌患者的TADC的宽场显微术,所述自体肿瘤细胞涂覆自身IgG或源自10个供体的池的同种IgG(1μg/2x105个细胞)。
图9a-b.a.CD115+单核细胞从小鼠外周血分离并与GM-SCF一起培养5-7天以获得DC。DC然后与B16肿瘤细胞一起培养,或者与预涂覆同种IgG的B16肿瘤细胞一起培养。在一些情况下,还存在10ng/mL TLR3激动剂(聚肌苷酸:聚胞苷酸(聚I:C))或20ng/mL TLR-9激动剂(CpG ODN)。所显示的是表达CD40和CD86二者的DC的平均百分比。b.CD14+人单核细胞从3个健康供体的外周血分离并与GM-SCF和IL-4一起培养5-7天以获得DC。DC然后与PANC-1肿瘤细胞一起培养,或者与预涂覆同种IgG的PANC-1肿瘤细胞一起培养。在一些情况下,还存在10ng/mL TLR3激动剂(聚肌苷酸:聚胞苷酸(聚I:C))或1.5μM钙通道打开剂(离子霉素)。所显示的是表达CD40和CD86二者的DC的平均百分比。
图10.与DC刺激结合的单克隆同种异基因抗MHC I抗体诱导了完全肿瘤消退。将4x106个CT26结肠癌细胞在右侧腹上皮下注射到Balb/c小鼠中。一旦肿瘤达到25mm2,它们不进行治疗(空心圆圈)、肿瘤内注射TNFa+aCD40激动剂+同种IgG(空心方块)或者肿瘤内注射TNFa+aCD40激动剂+aH-2Kd IgG(抗MHC I类抗体)(实心方块)。
图11a-c.治疗后肿瘤中的免疫细胞浸润。小鼠皮下注射2x105个B16黑色素瘤细胞,其被允许生长直到肿瘤达到25mm2。小鼠然后肿瘤内注射PBS(未治疗)、单独TNFa+aCD40、或者TNFa+aCD40+同种IgG(来自129S1小鼠)的组合、或者TNFa+aCD40+跨膜糖蛋白-NMB(TG-NMB,GPNMB)的抗体的组合。在一些情况下,缺乏功能性Fcg受体信号传导的小鼠被注射TNFa+aCD40+同种IgG。在6天后,切除肿瘤,并通过流式细胞术检测包括肿瘤细胞的整体细胞组成(n=8)。a.Y轴是总肿瘤细胞中的CD45细胞%。b.Y轴是CD45+细胞中的INFg+CD44+细胞%(对于CD8 T细胞和对于CD4 T细胞量化)。c.Y轴是表达gp100四聚体的CD8+细胞的%和表达Trp2四聚体的CD8+细胞的%。
图12.来自治疗的小鼠的T细胞的过继转移对于原始小鼠的肿瘤发生的影响。在用PBS(未治疗)、TNFa+aCD40、或者与同种异基因IgG(同种IgG)组合或与跨膜糖蛋白-NMB(TG-NMB;GPNMB)的抗体组合的TNFa+aCD40治疗后6天,从携带B16的小鼠纯化脾T细胞。5x106个CD4+细胞(上图)或CD8+细胞(下图)被静脉内注射到原始小鼠中,接着在1小时后皮下注射2.5x105个B16细胞。
图13.治疗后6天来自B16肿瘤的代表性FACS图。数字代表阳性细胞的%。
图14.治疗后6天来自B16肿瘤的代表性FACS图。
图15a-b.a.B16细胞固定和用不同的同种IgG子类孵育1小时以形成免疫复合体(IC)。IC被加入到来自野生型(WT)和FCγR敲除(KO)小鼠的BMDC培养物中,并且MHCII和CD86的DC表达进行检测。b.C57BI/6小鼠被皮下注射B16黑色素瘤肿瘤细胞。肿瘤在第16天被切除并用于与不同的同种IgG子类抗体形成同种IgG-IC。IC与同基因BMDC一起过夜培养,其然后被注射到肿瘤由其移除的对应小鼠中。
具体实施方式
I.介绍
本文描述的是用于癌症治疗的方法、组合物和试剂盒。所述方法、组合物和试剂盒中的一些是基于本发明人的发现:癌细胞桥连剂(bridging agent)和抗原提呈细胞(APC)刺激的组合在治疗癌症方面令人惊异地有效。在一些实施方式中,APC是树突状细胞。
癌细胞桥连剂是在癌细胞上的抗原和抗原提呈细胞上的一种或多种受体之间桥接的试剂。通常,桥连剂是抗体。在一些情况下,桥连剂是识别癌细胞表面上的一种或多种抗原的抗体。通常,抗体可以结合癌细胞或者与肿瘤团块结合并且被APC上的Fc受体识别。在一些实施方式中,抗体是同种异基因抗体(同种抗体(alloantibody))。在一个实施方式中,抗体是IgG抗体,例如,同种IgG抗体。
虽然APC通常在肿瘤环境下被抑制,但使用APC刺激剂可以克服肿瘤诱导的抑制。另外地,或者在替代方式中,APC刺激剂可以将APC激活到比将在其他情况下发生的更大的程度。激活的APC因此可以识别结合癌症抗原的桥连剂并且使癌细胞或其一部分内化(internalize)。APC然后可以从癌细胞产生众多抗原并提呈给CD4和CD8 T细胞,因此针对由癌细胞表达的众多抗原激活T细胞。针对多种肿瘤抗原(所述抗原不必在治疗前预先确定)的T细胞的这种令人惊讶的稳健激活极大降低了肿瘤可以逃脱免疫系统的识别或破坏的可能性。
抗肿瘤抗体可以促进肿瘤生长或进展或者诱导T细胞对肿瘤的耐受性。参见,例如,Cancer Cell 2005年v7 p411;Cancer Cell 2010年v17 p121;J Exp Med.2008年7月7日;205(7):1687-700);和其中引用的文献。静脉施用抗肿瘤IgG抗体通常不是有效的癌症疗法。参见,例如,Ann.NY Acad Sci 2007年v1110 p305-314。类似地,抗原提呈细胞的刺激已显示促进肿瘤生长或进展。参见,例如,Oncotarget.2014年12月15日;5(23):12027-42;Cancer Biol Ther.2014年1月;15(1):99-107。因此,由桥连剂(例如,抗体或同种抗体,如同种IgG)和APC刺激(例如,树突状细胞刺激)的组合诱导的稳健的抗肿瘤反应是令人惊讶的和预料不到的结果。而且,与其他成功的基于抗体的癌症疗法不同,这种作用并非主要来自,或者需要,抗体介导干预对癌细胞信号传导的干扰或抗体依赖性细胞毒性。
所述方法的方面包括向个体(例如,患有癌症的个体)施用:(i)具有特异性结合个体的癌细胞抗原的同种IgG抗体的抗体组合物;和(ii)激活个体的APC的疗法,其中APC是树突状细胞、巨噬细胞或B细胞。其他实施方式包括在(i)具有特异性结合个体的癌细胞抗原的同种IgG抗体的抗体组合物和(ii)激活个体的APC的疗法的存在下,将暴露于肿瘤抗原的APC群体施用于个体,其中APC是树突状细胞、巨噬细胞或B细胞。在一些情况下,抗体组合物包含具有多种结合特异性的多克隆同种IgG抗体。
在一些情况下,激活个体的APC(例如,树突状细胞(DC))的疗法包括将具有APC刺激剂(例如,DC刺激剂)的刺激组合物施用于个体。在一些情况下,APC刺激剂(例如,DC刺激剂)被缀合到同种IgG抗体。例如,APC刺激剂可以被缀合到同种抗体使得使得其可能是不稳定的。在一些情况下,在由APC内化后,缀合是不稳定的。例如,APC刺激剂可以被缀合到同种抗体,由APC内化并且APC刺激剂从抗体释放,由此刺激APC。在一些情况下,在可能在肿瘤细胞处或在肿瘤细胞附近遭遇的条件下,或者在结合APC的表面时,缀合是不稳定的。例如,刺激剂可以经由酯或肽键缀合,所述酯或肽键可以由一种或多种细胞表面蛋白酶或酯酶裂解。在一些情况下,单独或被缀合到同种抗体的刺激剂结合APC表面上的受体。在一些情况下,刺激组合物包含CD40配体(CD40L)和促炎性细胞因子。
提供了用于诱导个体中的免疫应答的方法。所述方法的方面包括:(a)将来自个体的APC(例如,DC)与靶抗原和具有特异性结合靶抗原的同种IgG抗体的抗体组合物在对APC(例如,DC)摄取靶抗原有效的剂量下体外接触对APC(例如,DC)摄取靶抗原有效的一段时间,由此产生负载APC(例如,负载DC);和(b)将个体的T细胞与负载APC(例如,负载DC)接触,其中负载APC(例如,负载DC)将抗原提呈给T细胞以产生接触的T细胞,并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。在一些情况下,APC(例如,DC)来自患有癌症的个体并且靶抗原与癌症相关。在一些情况下,APC(例如,DC)与来自个体的癌细胞接触。在一些情况下,APC(例如,DC)与来自个体的癌细胞的裂解物接触。在一些情况下,APC(例如,DC)与来自个体的癌细胞的两种或更多种质膜蛋白(其可以是裂解物的部分)接触。在一些情况下,APC(例如,DC)与包含APC刺激剂(例如,树突状细胞刺激组合物)的刺激组合物接触。在一些情况下,刺激组合物包含CD40L和促炎性细胞因子。在一些情况下,树突状细胞刺激剂被缀合到同种IgG抗体。在一些情况下,靶抗原在接触APC(例如,DC)之前与抗体组合物接触。在一些情况下,APC(例如,DC)同时与靶抗原和抗体组合物接触。在一些情况下,体内进行接触T细胞的步骤并且所述方法包括将负载APC(例如,负载DC)引入到个体中。在一些情况下,体外进行接触T细胞的步骤并且所述方法包括将接触的T细胞引入到个体中。
还提供了用于实施本公开的方法的组合物和试剂盒。在一些情况下,所述组合物包含:具有多种结合特异性的多克隆同种IgG抗体;和至少一种APC刺激剂(例如,树突状细胞刺激剂)。在一些情况下,所述组合物包含:具有多种结合特异性的多克隆同种IgG抗体;CD40L;和促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)。在一些情况下,APC刺激剂(例如,树突状细胞刺激剂)被缀合到组合物的同种IgG抗体中的至少一种。在一些情况下,所述组合物包含静脉内注射免疫球蛋白(IVIG)或者从IVIG纯化或富集的抗体。
在描述本方法和组合物之前,应理解本发明不限于所描述的特定方法或组合物,因为这样的方法和组合物当然可以变化。还应理解,本文所用的术语仅仅是为了描述特定实施方式的目的而非旨在作出限制,因为本发明的范围将仅由随附权利要求限定。
在提供了值的范围的情况下,应理解,除非上下文明确另行规定,否则该范围上下限之间到下限单位的十分之一的每个居中值也被具体公开。在规定范围中的任意规定值或居中值和在该规定范围中的其他任意规定值或居中值之间的每个较小范围都被涵盖在本发明内。这些较小范围的上下限可以被独立地包括在范围中或者排除出范围,并且在限度值任一被包括在较小范围内、没有限度值都包括在较小范围内或者限度值二者都被包括在较小范围内的情况下的每个范围也都被涵盖在本发明内,以规定范围中任何被具体排除的限度值为准。在规定范围包括限度值之一或二者的情况下,排除那些被包括的限度值之一或二者的范围也被包括在本发明中。
除非另行定义,否则本文使用的全部技术和科学术语都具有与本发明所属领域的技术人员通常理解的相同的含义。虽然与本文描述的那些相似或等同的任何方法和材料都可以在本发明的实施和测试中使用,但现在描述一些潜在的和优选的方法和材料。本文提到的全部出版物都通过引用并入本文以公开和描述与所引用的出版物相关的方法和/或材料。应理解,在存在矛盾的情况下,本公开优于所并入的出版物的任何公开。
如对阅读本公开的本领域技术人员明显的是,本文描述和说明的单独实施方式的每一个具有离散的组分和特征,其可以容易地与其他多个实施方式的任一个的特征分离或组合而不偏离本发明的范围或精神。任何记载的方法都可以以所记载的事件的顺序或者以逻辑上可能的其他任何顺序实施。
必须注意,除非上下文明确另行规定,否则如在本文中和随附权利要求中所使用的单数形式“一(a)”、“一个(an)”和“该(the)”包括复数的指示物。因此,例如,提及“一细胞(a cell)”包括多个这样的细胞,并且提及“该肽(the peptide)”包括提及一个或多个肽及其等价物,例如,本领域技术人员已知的多肽,诸如此类。
本文讨论的出版物仅仅为它们在本申请申请日之前的公开内容而提供。本文没有任何内容被解释为这样的出版物凭借在先发明而先于本发明。此外,所提供的出版日期可能与实际出版日期不同,其可能需要独立地确认。
II.定义
术语“特异性结合”、“特异性地结合”等是指相对于在溶液或反应混合物中的其他分子或部分非共价或共价地优先结合某一分子(例如,相对于其他可用多肽,抗体特异性结合特定多肽或表位)。例如,相对于其他可用抗原,特异性结合癌细胞抗原(靶抗原)的所述同种IgG抗体优先结合该特定抗原。然而,靶抗原不需要对于癌细胞是特异性的或甚至相对于其他细胞在癌细胞中富集(例如,靶抗原可以由其他细胞表达)。因此,在“特异性地结合癌细胞抗原的同种抗体”的短语中,术语“特异性地”是指抗体的特异性而非该特定细胞类型中抗原的独特性。在一些实施方式中,一个分子对其特异性结合的另一个分子的亲和力通过10-5M或更低(例如,10-6M或更低、10-7M或更低、10-8M或更低、10-9M或更低、10-10M或更低、10-11M或更低、10-12M或更低、10-13M或更低、10-14M或更低、10-15M或更低、或10-16M或更低)的KD(解离常数)表征。“亲和力”是指结合强度。例如,增加的结合亲和力可以通过较低的KD指示。在一些情况下,增加的结合亲和力与较低的KD相关。
本文所用术语“特异性结合成员”是指特异性结合对(即,两个分子,通常是两个不同的分子,其中分子之一(例如,第一特异性结合成员)通过非共价方式特异性地结合另一个分子(例如,第二特异性结合成员))的成员。
本文所用术语“特异性结合剂”是指任何特异性结合生物分子(例如,标志物,如核酸标志物分子、蛋白质标志物分子等等)的试剂。在一些情况下,使用标志物分子(例如,树突状细胞标志物分子)的“特异性结合剂”。特异性结合剂可以是任何类型的分子。在一些情况下,特异性结合剂是抗体或其片段。在一些情况下,特异性结合剂是核酸探针(例如,RNA探针;DNA探针;RNA/DNA探针;修饰的核酸探针,如锁核酸(LNA)探针、吗啉探针(morpholino probe)等;等等)。
本文所用“标志物分子”不必是确定性的(definitive)(即,标志物不必将细胞确定性地标记为特定类型)。例如,细胞的标志物分子的表达可以指示(即,暗示)细胞是特定细胞类型的。例如,如果3种细胞类型(A型、B型和C型)表达特定标志物分子(例如,特定mRNA、特定蛋白质等等),细胞表达这种标志物分子可能不是必然地本身用于确定性地判定该细胞是A型细胞。然而,这样的标志物的表达可以暗示该细胞是A型细胞。在一些情况下,这样的标志物的表达与其他证据组合可以确定性地表明该细胞是A型细胞。作为另一个说明性实例,如果已知特定细胞类型表达两种或更多种特定标志物分子(例如,mRNA、蛋白质,其组合等等),那么细胞表达两种或更多种特定标志物分子中的一种可以暗示,但非确定,该细胞是所述特定类型的。在这样的情况下,标志物仍被认为是标志物分子。
“抗体”是指包含特异性结合并识别抗原的来自免疫球蛋白基因或其片段的抗原结合区(包括互补决定区(CDR))的多肽。公认的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数的免疫球蛋白可变区基因。轻链归类为κ或λ。重链归类为γ、μ、α、δ或ε,其进而分别定义免疫球蛋白类别IgG、IgM、IgA、IgD和IgE。IgG抗体是由四个肽链组成的约150kDa的大分子。IgG抗体含有两个相同类别的约50kDa的γ重链和两个相同的约25kDa的轻链,因此具有四聚体四级结构。两个重链彼此连接并通过二硫键各自连接于轻链。所得四聚体具有两个相同的半等份,其共同形成Y状形状。叉状物的每个末端含有相同的抗原结合位点。在人中有四个IgG子类(IgG1、2、3和4),按照它们在血清中的丰度顺序命名(IgG1最丰富)。通常,抗体的抗原结合区在结合的特异性和亲和力方面最为关键。
示例性的免疫球蛋白(抗体)结构单元包含四聚体。每个四聚体由两个相同的多肽链对组成,每个对具有一个“轻”链(约25kD)和一个“重”链(约50-70kD)。每个链的N端限定了约100至110或更多个氨基酸的可变区,其主要负责抗原识别。术语可变轻链(VL)和可变重链(VH)分别是指这些轻链和重链。
抗体例如,作为完整免疫球蛋白或者作为通过各种肽酶消化产生的多种充分表征的片段而存在。因此,例如,胃蛋白酶在铰链区中二硫键的下方消化抗体以产生F(ab)’2(Fab二聚体),Fab自身是通过二硫键连接到VH-CH1的轻链。F(ab)’2可以在温和条件下被还原以破坏铰链区中的二硫键,由此将F(ab)’2二聚体转化成Fab’单体。Fab’单体基本上是具有铰链区的部分的Fab(参见,Fundamental Immunology,Paul编辑,第3版,1993)。虽然各种抗体片段按照完整抗体的消化定义,但本领域技术人员将认识到可以化学地或者通过使用重组DNA方法而从头合成这样的片段。因此,本文所用术语抗体同样包括通过修饰全抗体产生的抗体片段、或者使用重组DNA方法从头合成的抗体片段(例如,单链Fv)或者使用噬菌体展示文库鉴别的抗体片段(参见,例如,McCafferty等人,Nature 348:552-554(1990))。
术语“抗体”以最广泛的意义使用,并且具体覆盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们展示出期望的生物活性。本文所用的“抗体片段”及其所有语法变体定义为包含完整抗体的抗原结合部位或可变区的完整抗体的一部分,其中该部分不含完整抗体Fc区的的重链恒定域(即,CH2、CH3和CH5,取决于抗体同种型)。抗体片段的实例包括Fab、Fab'、Fab'-SH、F(ab')2和Fv片段;双抗体;作为具有由相连氨基酸残基的一个不间断序列组成的初级结构的多肽(本文称为“单链抗体片段”或“单链多肽”)的任何抗体片段,包括但不限于(1)单链Fv(scFv)分子;(2)仅含有一个轻链可变域的单链多肽,或含有轻链可变域的三个CDR但不含相关重链部分的其片段;(3)仅含有一个重链可变区的单链多肽,或含有重链可变区的三个CDR但不含相关轻链部分的其片段;(4)包含来自非人物种的单Ig域的纳米抗体或者其他特异性单域结合模块;和(5)从抗体片段形成的多特异性或多价结构。在包含一个或多个重链的抗体片段中,重链可以含有见于完整抗体的非Fc区中的任何恒定域序列(例如,IgG同种型中的CH1),和/或可以含有见于完整抗体中的任何铰链区序列,和/或可以含有融合于或位于铰链区序列或重链的恒定域序列的亮氨酸拉链序列。
本公开所用的术语“表位”是指抗体的互补位与其结合的抗原上的任何抗原决定簇。表位决定簇通常由分子的化学活性表面分组(grouping)如氨基酸或糖侧链组成,并且通常具有特定三维结构特性以及特定电荷特性。
术语“多肽”、“肽”和“蛋白质”在本文中可互换使用以指代氨基酸残基的聚合物。术语同样适用于其中一个或多个氨基酸残基是对应的天然存在氨基酸的人工化学模拟体的氨基酸聚合物,以及适用于天然存在氨基酸聚合物和非天然存在氨基酸聚合物。
本文所用术语“APC”或“抗原提呈细胞”是指在其细胞膜表面上表达主要组织相容性复合体II类(MHC II类)蛋白并且能够将与MHC II类的复合体中的抗原提呈给T细胞,由此针对被提呈的抗原激活T细胞的细胞。在一些实施方式中,APC是树突状细胞。在一些实施方式中,APC是巨噬细胞。在一些实施方式中,APC是B细胞。在一些实施方式中,APC是树突状细胞、巨噬细胞或B细胞。在一些实施方式中,APC是树突状细胞或巨噬细胞。在一些实施方式中,APC是树突状细胞或B细胞。在一些情况下,APC不是巨噬细胞。在一些情况下,APC不是B细胞。
细胞培养语境下的术语“传代”或“代”(即,分割或分开)是本领域已知的并且是指少量细胞转移到新容器中。如果细胞定期分开的话,细胞可以被培养,因为这避免了与高细胞密度相关的衰老。对于粘附细胞,作为传代方案的部分,细胞从生长表面脱离。脱离通常用酶胰蛋白酶和/或其他可商购试剂(例如,TrypLE、EDTA(乙二胺四乙酸)、用于从表面物理刮除细胞的淀帚(例如,橡胶淀帚)、等等)进行。少量的脱离细胞(例如,少至一个细胞)然后可以用于接种新细胞群体,例如,在用另外的培养基稀释后。因此,传代细胞群体是指解离细胞群体的细胞的至少一部分、稀释解离的细胞和涂板稀释的解离细胞(即,接种新细胞群体)。
术语“多种培养基”和“培养基”在本文中可交换使用。细胞培养基是在体外培养过程中浸浴细胞的液体混合物。
本文所用术语“群体”,例如,“细胞群体”或“细胞的群体”,是指与其他细胞和/或细胞分组分离(separate)(即,分隔(isolate))的两个或更多个细胞的分组(即,群体)。例如,6孔培养皿可以含有6个细胞群体,每个群体驻留在单个孔中。细胞群体的细胞可以但不必需是彼此的克隆衍生物。细胞群体可以源自一个个体细胞。例如,如果个体细胞各自置于6孔培养皿的单个孔中并且每个细胞分裂一次,那么培养皿将含有6个细胞群体。细胞群体可以是任何期望的大小并且含有大于一个细胞的任何数量的细胞。例如,细胞群体可以是2或更多、10或更多、100或更多、1,000或更多、5,000或更多、104或更多、105或更多、106或更多、107或更多、108或更多、109或更多、1010或更多、1011或更多、1012或更多、1013或更多、1014或更多、1015或更多、1016或更多、1017或更多、1018或更多、1019或更多或者1020或更多个细胞。
本文所用术语“多个(种)(plurality)”是指多于一个(种)。例如,多个(种)可以是2或更多、5或更多、10或更多、25或更多、50或更多、100或更多、500或更多、1,000或更多、2,000或更多、5,000或更多、104或更多、105或更多、106或更多、107或更多个(种)等等。例如,含有具有多种结合特异性的多克隆同种IgG抗体的抗体组合物是同种IgG抗体的组合物,其中抗体中的两种或更多种(例如,5或更多、10或更多、25或更多、50或更多、100或更多、500或更多、1,000或更多、2,000或更多、5,000或更多、104或更多、105或更多、106或更多、107或更多种)具有不同的结合特异性(例如,特异性结合相同抗原的不同表位、特异性结合不同抗原、等等)。
III.方法和组合物
本公开的方面包括用于诱导个体中的免疫应答的方法和组合物。因为这样的方法可以用于治疗个体,所以这样的方法也可以称为治疗个体的方法。
在一些实施方式中,治疗患有癌症的个体的方法包括向个体施用:(i)包含特异性结合个体的癌细胞抗原的同种IgG抗体的抗体组合物(如上文详细描述的);和(ii)激活个体的抗原提呈细胞(APC)(例如,树突状细胞(DC))的疗法。在这样的情况下,诱导个体的内源性APC(例如,树突状细胞)摄取靶抗原(例如,癌细胞、癌细胞碎片、分泌的癌细胞抗原等等)。
在一些实施方式中,治疗个体(例如,患有癌症的个体)的方法包括向个体施用:(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物;和(ii)激活个体的抗原提呈细胞(APC)(例如,树突状细胞(DC))的疗法。在一些实施方式中,治疗个体(例如,患有癌症的个体)的方法包括向个体施用:(i)包含特异性结合个体的癌细胞抗原的同种IgG抗体的抗体组合物;(ii)CD40配体(CD40L);和(iii)促炎性细胞因子。
在一些实施方式中,诱导个体中的免疫应答的方法包括:(a)将来自个体的APC(例如,DC)与(i)靶抗原和(ii)包含特异性结合靶抗原的同种IgG抗体的抗体组合物在对APC(例如,DC)摄取靶抗原有效的剂量下体外接触对APC(例如,DC)摄取靶抗原有效的一段时间,由此产生负载APC(例如,负载DC);和(b)将个体的T细胞与负载APC(例如,负载DC)接触,其中负载APC(例如,负载DC)将抗原提呈给T细胞以产生接触的T细胞,并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。在一些情况下,靶抗原(例如,靶细胞)在接触APC(例如,DC)之前与抗体组合物接触,从而产生免疫复合体。因此,在一些情况下,所述方法包括将APC(例如,DC)与免疫复合体接触。在一些情况下,接触个体的T细胞的步骤是在体内。在一些情况下,接触个体的T细胞的步骤是在体外。
在一些实施方式中,诱导个体中的免疫应答的方法包括:(a)将来自个体的APC(例如,DC)与(i)靶抗原和(ii)包含特异性结合靶抗原的同种IgG抗体的抗体组合物在对APC(例如,DC)摄取靶抗原有效的剂量下、在对APC(例如,DC)摄取靶抗原有效的条件下体外接触对APC(例如,DC)摄取靶抗原有效的一段时间,由此产生负载APC(例如,负载DC);和(b)将个体的T细胞与负载APC(例如,负载DC)接触,其中负载APC(例如,负载DC)将抗原提呈给T细胞以产生接触的T细胞,并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。在一些情况下,靶抗原(例如,靶细胞)在接触APC(例如,DC)之前与抗体组合物接触,从而产生免疫复合体。因此,在一些情况下,所述方法包括将APC(例如,DC)与免疫复合体接触。在一些情况下,接触个体的T细胞的步骤是在体内。在一些情况下,接触个体的T细胞的步骤是在体外。
本文所用术语“疗法(treatment)”、“治疗(treating)”、“处理(treat)”等一般是指获得期望的药理学和/或生理学效应。该效应就完全或部分防止疾病或其症状而言可以是预防性的,和/或就部分或完全稳定或治愈疾病和/或可归因于疾病的不良反应而言可以是治疗性的。术语“疗法”涵盖哺乳动物(特别是人)中的疾病的任何疗法,并且包括:(a)防止疾病和/或症状在受试者中出现,所述受试者可以易感疾病或症状但尚未诊断出具有此疾病或症状;(b)抑制疾病和/或症状,即阻抑疾病和/或相关症状的发生;或(c)减轻疾病和相关症状,即,导致疾病和/或症状消退。需要治疗的那些可以包括已经患病的那些(例如,患有癌症的那些,例如,具有肿瘤的那些)以及期望预防的那些(例如,具有增加的癌症易感性的那些;具有癌前肿瘤、病变的那些;怀疑具有癌症的那些;等等)。
术语“接受者”、“个体”、“受试者”、“宿主”和“患者”在本文中可互换使用并且是指任何期望诊断、处理或治疗的哺乳动物受试者,特别是人。“哺乳动物”出于治疗的目的是指任何归类为哺乳动物的动物,包括人,家畜和农畜,及动物园动物、体育动物或宠物动物,如狗、马、猫、奶牛、绵羊、山羊、猪、骆驼等。在一些实施方式中,哺乳动物是人。
治疗性疗法是其中受试者在施用前患病的治疗,而预防性疗法是其中受试者在施用前未患病的治疗。在一些实施方式中,受试者具有增加的变为患病的可能性,或着被怀疑具有增加的变为患病的可能性(例如,相对于标准,例如,相对于寻常个体,例如,受试者可以具有对癌症的遗传倾向性和/或表明增加的癌症风险的家族史),在此情况下,疗法可以是预防性疗法。在一些情况下,术语“预防接种”用于描述预防性疗法。例如,在其中被治疗的受试者未被诊断出具有癌症(例如,受试者具有增加的变为患病的可能性、被怀疑具有增加的变为患病的可能性)(例如,受试者可以具有对癌症的遗传倾向性和/或表明增加的癌症风险的家族史)的一些情况下,可以通过实施一种或多种所述方法而对受试者进行预防接种(治疗以使得该疗法是预防性治疗)(例如,施用(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物和(ii)激活个体的APC(例如,DC)的疗法(例如,将具有APC刺激剂(例如,树突状细胞刺激剂)的APC刺激组合物(例如,树突状细胞刺激组合物)施用于个体))。
APC刺激剂包括,但不限于,树突状细胞刺激剂、巨噬细胞刺激剂或B细胞刺激剂。在一些情况下,APC刺激剂是树突状细胞刺激剂。在一些情况下,APC刺激剂是巨噬细胞刺激剂。在一些情况下,APC刺激剂是B细胞刺激剂。在一些情况下,APC刺激剂不是巨噬细胞刺激剂。
在一些情况下,APC刺激组合物包含树突状细胞刺激剂和B细胞刺激剂。在一些情况下,APC刺激组合物包含树突状细胞刺激剂但不包含巨噬细胞刺激剂。在一些情况下,APC刺激组合物包含至少两种树突状细胞刺激剂。
树突状细胞刺激组合物可以包括,但不限于,含有以下的组合物:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂与促炎性细胞因子;(iii)检查点分子中和化合物;(iv)吲哚胺2,3-二加氧酶(IDO)抑制剂;(v)NFkB激活剂;(vi)打开钙通道的化合物;(vii)T细胞相关共刺激分子;或(viii)其组合。
B细胞刺激组合物可以包括,但不限于,含有以下的组合物:(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;或(vi)交联表面免疫球蛋白的试剂。在一些情况下,促炎性细胞因子是IL-1、IL-2、IL-3、IL-4、IL-6、IL-7、IL-9、IL-10、IL-12、IL-15、IL-18、IL-21、IFN-α、IFN-β、IFN-γ、G-CSF或GM-CSF。在一些情况下,TLR激动剂是CpG ODN、免疫刺激性DNA、免疫刺激性RNA、免疫刺激性寡核苷酸、咪喹莫特、瑞喹莫德、洛索立宾、Flagellin、FSL-I或LPS。在一些情况下,抗原是自体抗原、同种抗原、肽抗原、核酸抗原、碳水化合物抗原或肿瘤相关抗原。在一些情况下,交联表面免疫球蛋白的试剂是抗Ig抗体、抗独特型抗体或抗同种型抗体。
在被治疗的受试者未被诊断出患有癌症(例如,受试者具有增加的变为患病的可能性、被怀疑具有增加的变为患病的可能性)(例如,受试者可以具有对癌症的遗传倾向性和/或表明增加的癌症风险的家族史)的一些情况下,可以通过实施一种或多种所述方法而对受试者进行预防接种(进行治疗以使得该疗法是预防性治疗)(例如,施用(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物;和(ii)激活个体的APC(例如,DC)的疗法(例如,将具有APC刺激剂(例如,树突状细胞刺激剂)的APC刺激组合物(例如,树突状细胞刺激组合物)施用于个体,例如,包含(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂与促炎性细胞因子;(iii)检查点分子中和化合物;(iv)吲哚胺2,3-二加氧酶(IDO)抑制剂;(v)NFkB激活剂;(vi)打开钙通道的化合物;和(vii)T细胞相关共刺激分子;或(viii)其组合的树突状细胞刺激组合物))。
术语“共同施用”和“与……组合”包括在非特定时间限制内同时、并行或顺序施用两种或更多种治疗剂。在一个实施方式中,试剂同时存在于细胞或受试者身体中或者同时发挥它们的生物学作用或治疗作用。在一个实施方式中,治疗剂在同一组合物或单位剂型中。在其他实施方式中,治疗剂在单独组合物或单位剂型中。在某些实施方式中,第一试剂可以在施用第二治疗剂之前(例如,若干分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周前)、同时或之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周后)施用。
在一些实施方式中,待治疗的个体是患有癌症的个体。本文所用“癌症”包括任何形式的癌症(例如,白血病;急性髓性白血病(AML);急性成淋巴细胞性白血病(ALL);淋巴瘤;间皮瘤(MSTO);微小残留病;实体肿瘤癌症,例如,肺癌、前列腺癌、乳腺癌、膀胱癌、结肠癌、卵巢癌、胰腺癌、肾癌、成胶质细胞瘤、髓母细胞瘤、平滑肌肉瘤和头颈鳞状细胞癌、黑色素瘤;等等),包括原发瘤和转移瘤二者;等等。在一些情况下,个体已经在近期经历癌症治疗(例如,放疗、化疗、手术切除等等)并因此处于复发风险中。任何和全部癌症都是适合通过所述方法、组合物和试剂盒治疗的癌症。
术语“癌症”、“瘤”和“肿瘤”在本文中可互换使用以指代表现出自发的、未受调控的生长的细胞,使得它们表现出特征在于细胞增殖控制的明显丧失的异常生长表型。本申请中检测、分析和/或治的目标细胞包括癌症前期细胞(例如,良性细胞)、恶性细胞、转移前细胞、转移细胞和非转移细胞。已知几乎每种组织的癌症。短语“癌症负荷”是指受试者中的癌细胞或癌体积的量。减少癌症负荷相应地是指减小受试者中的癌细胞数量或癌体积。本文所用术语“癌细胞”是指作为癌细胞或者源自癌细胞(例如,癌细胞的克隆)的任何细胞。该术语还包括癌细胞的一部分,如癌细胞的亚细胞部分、细胞膜部分或细胞裂解物。本领域技术人员已知众多类型的癌症,包括实体肿瘤,如癌瘤、肉瘤、成胶质细胞瘤、黑色素瘤、淋巴瘤、骨髓瘤等等,以及循环癌,如白血病。
本文所用“癌症”包括任何形式的癌症,包括但不限于实体肿瘤癌(例如,肺癌、前列腺癌、乳腺癌、膀胱癌、结肠癌、卵巢癌、胰腺癌、肾癌、成胶质细胞瘤、髓母细胞瘤、平滑肌肉瘤、头颈鳞状细胞癌、黑色素瘤、神经内分泌瘤等等)和液体癌(例如,血液学癌症);癌瘤;软组织肿瘤;肉瘤;畸胎瘤;黑色素瘤;白血病;淋巴瘤;和脑癌,包括微小残留病,并且包括原发瘤和转移瘤二者。任何癌症是通过所述方法和组合物治疗的适合癌症。在一些情况下,癌细胞表达PD-L1。在一些情况下,癌细胞不表达PD-L1(例如,在这样的情况下,被治疗的个体的免疫系统细胞表达PD-L1)。
癌瘤是起源于上皮组织的恶性肿瘤。上皮细胞覆盖身体的外表面、内衬于内腔,和形成腺组织的内衬。癌瘤的实例包括,但不限于:腺癌(在腺(分泌)细胞中开始的癌症),例如,乳房、胰腺、肺、前列腺和结肠的癌症可以是腺癌;肾上腺皮质癌;肝细胞癌;肾细胞癌;卵巢癌;原位癌;导管癌;乳腺癌;基底细胞癌;鳞状细胞癌;移行细胞癌;结肠癌;鼻咽癌;多灶性囊性肾细胞癌;燕麦细胞癌;大细胞肺癌;小细胞肺癌;非小细胞肺癌;等等。癌瘤可见于前列腺、胰腺、结肠、脑(通常作为二次转移)、肺、乳腺、皮肤等。
软组织肿瘤是高度多样化的一组源自结缔组织的罕见肿瘤。软组织肿瘤的实例包括,但不限于:腺泡状软组织肉瘤;血管瘤样纤维性组织细胞瘤;软骨粘液样纤维瘤;骨骼软骨肉瘤;骨外粘液样软骨肉瘤;透明细胞肉瘤;促结缔组织增生性小圆细胞肿瘤;隆凸性皮肤纤维肉瘤;子宫内膜间质瘤;尤因肉瘤;纤维瘤病(纤维样的);纤维肉瘤,婴儿的;胃肠间质瘤;骨巨细胞瘤;腱鞘巨细胞瘤;炎性成肌纤维细胞瘤;子宫平滑肌瘤;平滑肌肉瘤;成脂细胞瘤;典型脂肪瘤;梭形细胞脂肪瘤或多形性脂肪瘤;非典型性脂肪瘤;软骨样脂肪瘤;高分化脂肪肉瘤;粘液样/圆形细胞脂肪肉瘤;多形性脂肪肉瘤;粘液样恶性纤维性组织细胞瘤;高级恶性纤维性组织细胞瘤;粘液纤维肉瘤;恶性外周神经鞘瘤;间皮瘤;成神经细胞瘤;骨软骨瘤;骨肉瘤;原始神经外胚层肿瘤;腺泡状横纹肌肉瘤;胚胎性横纹肌肉瘤;良性或恶性神经鞘瘤;滑膜肉瘤;埃文氏瘤(Evan's tumor);结节性筋膜炎;韧带样型纤维瘤病;孤立性纤维性肿瘤;隆凸性皮肤纤维肉瘤(DFSP);血管肉瘤;上皮样血管内皮瘤;腱鞘巨细胞瘤(TGCT);色素沉着绒毛结节性滑膜炎(PVNS);纤维性发育异常;粘液纤维肉瘤;纤维肉瘤;滑膜肉瘤;恶性外周神经鞘瘤;神经纤维瘤;和软组织的多形性腺瘤;和源自成纤维细胞、成肌纤维细胞、组织细胞、血管细胞/内皮细胞和神经鞘细胞的肿瘤形成。
肉瘤是在间叶细胞起源的细胞(例如,身体的骨或软组织中,包括软骨、脂肪、肌肉、血管、纤维组织或其他结缔组织或支持组织)中发生的罕见类型的癌症。肉瘤的不同类型是基于癌症在何处形成。例如,骨肉瘤在骨中形成,脂肪肉瘤在脂肪中形成,和横纹肌肉瘤在肌肉中形成。肉瘤的实例包括,但不限于:askin肿瘤;葡萄状肉瘤;软骨肉瘤;埃文氏肉瘤;恶性血管内皮瘤;恶性神经鞘瘤;骨肉瘤;和软组织肉瘤(例如,腺泡状软组织肉瘤;血管肉瘤;叶状囊肉瘤;隆凸性皮肤纤维肉瘤(DFSP);硬纤维瘤;促结缔组织增生性小圆细胞瘤;上皮样肉瘤;骨外软骨肉瘤;骨外骨肉瘤;纤维肉瘤;胃肠间质瘤(GIST);血管外皮细胞瘤;血管肉瘤(更常称为“血管肉瘤”);卡波西肉瘤;平滑肌肉瘤;脂肪肉瘤;淋巴管肉瘤;恶性外周神经鞘瘤(MPNST);神经纤维肉瘤;滑膜肉瘤;未分化多形性肉瘤等等)。
畸胎瘤是生殖细胞肿瘤的类型,其可含有几种不同类型的组织(例如,可包括源自任何和/或全部三个胚层(内胚层、中胚层和外胚层)的组织),包括例如,毛发、肌肉和骨。畸胎瘤最常在女性的卵巢、男性的睾丸和儿童的尾骨中发生。
黑色素瘤是在黑色素细胞(制造黑色素的细胞)中开始的癌症形式。它可以在痣(皮肤黑色素瘤)中开始,但也可以在其他色素沉着组织中开始,如在眼或在肠中。
白血病是在血液形成组织如骨髓中开始的癌症,并且导致大量异常血细胞产生并进入血流。例如,白血病可起源于通常在血流中成熟的骨髓来源细胞。白血病根据疾病发生和进展有多快(例如,急性相对于慢性)和受影响的白细胞类型(例如,髓性相对于淋巴细胞性)而命名。髓性白血病也称为髓细胞性白血病或髓母细胞性白血病。淋巴性白血病也称为成淋巴细胞性白血病或淋巴细胞性白血病。淋巴细胞性白血病细胞可在淋巴结中聚集,淋巴结可以变得肿胀。白血病的实例包括,但不限于:急性髓性白血病(AML)、急性成淋巴细胞性白血病(ALL)、慢性髓性白血病(CML)和慢性淋巴细胞性白血病(CLL)。
淋巴瘤是在免疫系统的细胞中开始的癌症。例如,淋巴瘤可起源于通常在淋巴系统中成熟的骨髓来源细胞。存在两种基本的淋巴瘤类别。一种是霍奇金淋巴瘤(HL),其以称为里-施细胞的细胞类型的存在为标志。目前存在6种公认类型的HL。霍奇金淋巴瘤的实例包括:结节硬化型经典霍奇金淋巴瘤(CHL)、混合细胞型CHL、淋巴细胞耗竭型CHL、富淋巴细胞型CHL和结节淋巴细胞支配型HL。
另一类别的淋巴瘤是非霍奇金淋巴瘤(NHL),其包括免疫系统细胞癌症的一个大的、多样化的组。非霍奇金淋巴瘤可以进一步划分成具有缓慢(缓慢生长)病程的癌症和具有侵袭性(快速生长)病程的癌症。目前存在61种公认类型的NHL。非霍奇金淋巴瘤的实例包括,但不限于:AIDS相关淋巴瘤、间变性大细胞淋巴瘤、血管免疫母细胞淋巴瘤、母细胞性NK细胞淋巴瘤、伯基特淋巴瘤、伯基特样淋巴瘤(小无裂细胞淋巴瘤)、慢性淋巴细胞性白血病/小淋巴细胞淋巴瘤、皮肤T细胞淋巴瘤、弥漫性大B细胞淋巴瘤、肠病型T细胞淋巴瘤、滤泡性淋巴瘤、肝脾γ-δT细胞淋巴瘤、T细胞白血病、成淋巴细胞淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、鼻T细胞淋巴瘤、儿科淋巴瘤、外周T细胞淋巴瘤、原发性中枢神经系统淋巴瘤、转化型淋巴瘤、治疗相关T细胞淋巴瘤和瓦尔登斯特伦巨球蛋白血症。
脑癌包括任何脑组织癌症。脑癌的实例包括,但不限于:胶质瘤(例如,成胶质细胞瘤、星形细胞瘤、少突神经胶质瘤、室管膜瘤等等)、脑膜瘤、垂体腺瘤、前庭神经鞘瘤、原始神经外胚层肿瘤(髓母细胞瘤)等等。
癌症的“病理”包括危害患者健康的所有现象。这包括,但不限于,异常或不可控的细胞生长、转移、干扰相邻细胞的正常功能性、释放异常水平的细胞因子或其他分泌产物、抑制或加剧炎症反应或免疫应答、瘤形成、恶变前、恶变、侵袭周围或远处组织或器官,如淋巴结,等等。
本文所用术语“癌症复发”和“肿瘤复发”及其语法变体是指在癌症诊断之后肿瘤细胞或癌细胞的进一步生长。特别地,复发可以在进一步的癌细胞生长在癌组织中发生时出现。“肿瘤扩散”类似地在肿瘤细胞散布到本地或远处组织和器官中时发生,因此肿瘤扩散涵盖肿瘤转移。“肿瘤侵袭”在肿瘤生长局部地扩散以通过压迫、破坏或阻止正常器官功能而危害所涉及组织的功能时发生。
本文所用术语“转移”是指在与初始癌症肿瘤的器官不直接关联的器官或身体部分中癌症肿瘤的生长。转移被理解为包括微转移,其是不可检测量的癌细胞在与初始癌症肿瘤的器官不直接关联的器官或身体部分中的存在。转移也可以被定义为多个过程步骤,如癌细胞从初始肿瘤位置脱离,和癌细胞迁移和/或侵入到身体的其他部分。
在一些实施方式中,诱导个体中的免疫应答的方法(在一些情况下称为治疗个体的方法)包括:(a)将来自个体的树突状细胞(DC)与靶抗原和抗体组合物体外接触,由此产生负载DC;和(b)将个体的T细胞与负载DC接触。负载DC将抗原提呈给T细胞以产生接触的T细胞,并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。
树突状细胞。树突状细胞(DC)是哺乳动物免疫系统的抗原提呈细胞的类型。本文所用术语“树突状细胞”是指在淋巴样或非淋巴样组织中发现的形态相似细胞类型的多样化群体中的任何成员。这些细胞的特征在于它们的独特形态和高水平的表面MHC II类表达(Steinman等人,Ann.Rev.Immunol.9:271(1991);其对这样的细胞的描述在此通过引用并入)。
树突状细胞存在于几乎全部组织中,如皮肤和鼻、肺、肝、胃和肠的内衬,以及存在于骨髓、血液、脾和淋巴结中。一旦被激活,DC迁移到淋巴结,它们在那里与T细胞和B细胞相互作用以启动和形成适应性免疫应答。在某些发育阶段,DC长出分枝的突起(树突),该细胞以此命名。树突状细胞的实例包括骨髓来源树突状细胞(BMDC)、浆细胞样树突状细胞、朗格汉斯细胞、交错突细胞、隐蔽细胞和真皮树突状细胞。在一些情况下,DC表达选自CD11(例如,CD11a和/或DC11c)、MHC II类(例如,在人的情况下,HLA-DR、HLA-DP和HLA-DQ)、CD40、CD80和CD86的至少一种标志物。在一些情况下,DC对于HLA-DR和CD83是阳性的,而对于CD14是阴性的。通常,DC可以基于任何或全部下述标志物而被识别(例如,DC的存在可以被验证):CD11c+;CD14-/低;CD80+;CD86++;MHC I类++、MHC II类+++;CD40++;CD83+/-;CCR7+/-。在一些情况下,CD是CD11b+/Gr1neg/CD11c+/MHCII+/CD64dull。在一些情况下,DC是CD11bneg/CD11chi/MHCII+。
在一些情况下,树突状细胞表达特异性Ig Fc受体。例如,树突状细胞可以表达Fc-γ受体,其识别IgG抗体或者含有IgG的Fc区的抗体。作为另一个实例,树突状细胞可以表达Fc-α受体,其识别IgA抗体或者含有IgA的Fc区的抗体。作为又一个实例,树突状细胞可以表达Fc-ε受体,其识别IgE抗体或者含有IgE的Fc区的抗体。在一些情况下,表达特定Fc受体的树突状细胞被获得并负载有适合的桥连分子(例如,由树突状细胞Fc受体识别的类别的同种Ig)。
在一些实施方式中,所述方法包括获得或分离DC(即,分离富集的DC群体)的步骤。用于分离、产生和培养DC的技术对本领域技术人员而言是已知的,并且任何便利的技术都可以使用。在一些情况下,DC对于被治疗的个体是自体性的(即,是从该个体分离的细胞或者是源自该个体的细胞的细胞)。
在一些情况下,CD34(+)祖细胞(例如,骨髓(BM)祖细胞)被用作产生DC的来源(例如,CD34+细胞可以使用例如,抗体结合的磁珠来富集),所述DC然后被称为骨髓(DM)来源的树突状细胞(BMDC)。例如,BMDC可以通过在细胞因子的存在下培养非粘附细胞(CD34+细胞)而产生,所述细胞因子起到白血细胞生长因子(例如,粒细胞-巨噬细胞-集落刺激因子(GM-CSF),例如,50ng/ml)和细胞因子(例如,白介素4(IL-4),例如,20ng/ml)的作用。在一些情况下,CD34+细胞在GM-CSF和/或IL-4的存在下培养4天至8天范围内的一段时间(例如,5天至17天、7天至16天、8天至13天、9天至12天、6天至15天、8天至15天、10天至15天、12天至15天、13天至15天、5天至14天、5天至12天、5天至10天、5天至9天、6天至8天、6天、7天、8天、9天、10天、12天或14天)。当CD34+细胞在GM-CSF和/或IL-4的存在下培养时,GM-CSF可以处于35ng/ml至65ng/ml范围内的浓度(35ng/ml至65ng/ml、40ng/ml至60ng/ml、45ng/ml至50ng/ml或50ng/ml)并且IL-4可以处于5ng/ml至35ng/ml范围内的浓度(10ng/ml至30ng/ml、15ng/ml至25ng/ml、17.5ng/ml至22.5ng/ml或20ng/ml)。作为说明性实例,骨可以用盐水溶液(例如,磷酸盐缓冲盐水(PBS))冲洗,并且单核细胞可以在Ficoll梯度上从骨髓分离。CD34+细胞然后可以被分离/富集(例如,使用抗体缀合磁珠),并且然后在GM-CSF和IL-4的存在下培养(如上所述)。在一些情况下(例如,在细胞是小鼠细胞时),DC可以通过在GM-CSF中培养细胞而衍生。在一些情况下(例如,在细胞是人细胞时),DC可以通过在GM-CSF和IL-4中培养细胞而衍生。
在一些情况下,单核细胞被用作用于产生DC(有时被称为血液来源DC、血液Mo-DC、单核细胞DC等等)的来源。例如,DC可以通过在GM-CSF(例如,处于如在上文中针对BMDC描述的范围内的浓度下)和/或IL-4(例如,处于如在上文中针对BMDC描述的范围内的浓度下)的存在下培养粘附细胞(单核细胞,例如,骨髓单核细胞、血液单核细胞等等)3天至9天范围内的一段时间(例如,4天至8天、5天至7天、3天至6天、4天至5天、6天至8天或7天)而产生。例如,在一些情况下,单核细胞从血液分离并且针对CD11b+细胞进行富集(例如,使用磁珠)。细胞可以针对“炎性单核细胞(FSClo/SSClo/Gr1hi/CD115hi)”和/或“巡逻单核细胞(FSClo/SSClo/Gr1neg/CD115hi)”进行分选。DC然后可以通过在GM-CSF的存在下培养单核细胞(例如,3天至6天范围内的一段时间(例如,4天至5天))而从各种类型的单核细胞产生。在一些情况下(例如,在细胞是小鼠细胞时),DC通过在GM-CSF中培养细胞而衍生。在一些情况下(例如,在细胞是人细胞时),DC通过在GM-CSF和IL-4中培养细胞而衍生。为从脾获得DC(脾DC),可以富集脾细胞的CD11c+细胞(例如,使用抗体偶联磁珠),并且可以使用流式细胞术(例如,FACS)分选/富集CD11chi/MHCIIhi细胞。
在一些情况下,DC是肿瘤相关DC(TADC)。TADC可以通过任何便利方法获得。例如,为从肿瘤获得DC(肿瘤相关DC,TADC),可以消化肿瘤(例如,使用胶原酶和核酸酶)和可以富集CD11c+细胞(例如,使用抗体缀合磁珠),并且可以使用流式细胞术(例如,FACS)分选/富集Gr1neg/CD11chi/MHCIIhi细胞。
可以使用各种因子,包括,但不限于TNFα(例如,50ng/ml)和DC40配体(例如,CD40L)(例如,500ng/ml)激活所分离和/或衍生的DC(例如,如上所述)(下文进一步详细描述)。
对于更多关于树突状细胞和分离、产生和/或培养DC的方法的信息,参见Vassalli,J Transplant.2013年;2013:761429:“Dendritic Cell-Based Approaches for Therapeutic Immune Regulation in Solid-Organ Transplantation”;Syme等人,Stem Cells.2005年;23(1):74-81:“Comparison of CD34 and monocyte-derived dendritic cells from mobilized peripheral blood from cancer patients”;Banchereau等人,Annu Rev Immunol.2000年;18:767-811:”Immunobiology of dendritic cells”;和美国专利申请号20130330822;20130273654;20130130380;20120251561;和20120244620;其均都在此通过引用将其全部内容并入。
在一些情况下(例如,在方法包括将抗体组合物施用于个体时),内源性DC(存在于个体中的DC)与所施用的抗体组合物在体内接触。因此,该方法可以被视为治疗患有癌症的个体的体内方法。例如,抗体组合物和/或树突状细胞刺激组合物可以被施用于(例如,注射到)个体(例如,注射到肿瘤中或肿瘤附近、注射到肿瘤切除部位中或肿瘤切除部位附近等等),并且内源性DC由此与抗体组合物和/或树突状细胞刺激组合物接触。负载DC然后可以体内接触内源性T细胞(下文提供了关于体内方法的另外详细内容;参见标题为“将T细胞与负载DC接触”的章节)。在一些情况下(例如,在DC是BMDC的情况下),不使用树突状细胞刺激组合物。
巨噬细胞。巨噬细胞是哺乳动物免疫系统的抗原提呈细胞的类型。本文所用术语“巨噬细胞”是指在淋巴样或非淋巴样组织中发现的形态相似细胞类型的多样化群体中的任何成员。这些细胞的特征在于它们的独特形态和高水平的表面MHC II类表达。巨噬细胞是单核细胞来源的吞噬细胞,其不是树突状细胞或通过局部增殖而源自组织巨噬细胞的细胞。在体内,这些细胞是组织特异性的,并且是指例如,肝中的库普弗细胞、肺中的肺泡巨噬细胞、脑中的小胶质细胞、骨中的破骨细胞等等。本领域技术人员知晓如何识别巨噬细胞、如何从人或动物的身体分离巨噬细胞,以及如何就巨噬细胞的子类和亚群表征巨噬细胞(Kruisbeek,2001;Davies和Gordon 2005a和b;Zhang等,2008;Mosser和Zhang,2008;Weischenfeldt和Porse,2008;Ray和Dittel,2010;Martinez等人,2008;Jenkins等人,2011)。
巨噬细胞可以通过不同机制激活成不同子类,包括,但不限于,M1、M2、M2a、M2b和M2c子类。术语M1被用于描述因损伤或细菌感染和IFN-y激活而产生的经典激活巨噬细胞,而M2是与M1不同地激活的众多形式巨噬细胞的通用术语。M2分类被进一步划分成亚群(Mantovani等人,2004)。最具有代表性的形式是M2a巨噬细胞,其通常在通过暴露于蠕虫(worm)诱导的Th2细胞因子IL-4和IL-13而产生的蠕虫(helminth)感染中出现。M2a巨噬细胞尤其被证明实质上参与保护宿主免于再感染(Anthony等人,2006)或者帮助伤口愈合和组织重塑(Gordon,2003)。另一亚群是M2b巨噬细胞,其产生高水平的IL-10和低水平的IL-12,但自身不是抗炎性的(Anderson和Mosser,2002;Edwards等人,2006)。M2b巨噬细胞是由结合于与TLR配体组合的Fc-γ受体的免疫复合体所引起。最后,M2c巨噬细胞代表由IL-10、TGF-β或糖皮质激素类引起的亚型(Martinez等人,2008)。
因此,“M2a巨噬细胞”是指已经暴露于Th2条件下的环境(例如,暴露于Th2细胞因子IL-4和IL-13)并且通过基因Ym1和/或基因CD206和/或基因RELM-α和/或基因精氨酸酶-1的更高表达而展现出特定表型的巨噬细胞。类似地,“M2b巨噬细胞”是指已经暴露于与TLR或TNF-α刺激组合的免疫复合体的环境的巨噬细胞。所述细胞特征在于基因SPHK-1和/或基因LIGHT和/或基因IL-10的更高表达。
在一些情况下,本申请涉及“源自患者身体”的巨噬细胞。这意味着表明巨噬细胞获自所述患者的身体,或者巨噬细胞前体细胞获自所述患者的身体并随后在体外分化成巨噬细胞,如Wahl等人,2006;Davis和Gordon,2005;Smythies等人,2006;Zhang等人,2008;Mosser和Zhang,2008所述。
B细胞。B细胞是哺乳动物免疫系统的抗原提呈细胞的类型。本文所用术语“B细胞”是指来自任何发育阶段(例如,B干细胞、B祖细胞、分化B细胞、浆细胞)和来自包括但不限于外周血,肿瘤处、肿瘤中或肿瘤附近的区域,淋巴结,骨髓,脐带血或脾细胞的任何来源的B细胞。
B细胞前体存在于骨髓中,未成熟B细胞在那里产生。B细胞发育经过多个阶段发生,每个阶段代表抗体基因座处基因组内容的变化。在基因组重链可变区中,有三个片段V、D和J,其在称为VDJ重排的过程中随机重组以在每个B细胞的免疫球蛋白中产生独特的可变区。除了只涉及两个片段V和J以外,轻链可变区也发生相似的重排。在完全重排之后,B细胞在骨髓中达到IgM+未成熟阶段。这些未成熟B细胞在它们的表面上呈现膜结合IgM(即BCR)并且迁移到脾,在那里它们被称为过渡性B细胞。这些细胞中的一些分化成成熟B淋巴细胞。在其表面上表达BCR的成熟B细胞在血液和淋巴系统中循环,起到免疫监视作用。它们不产生可溶性抗体,直到它们变得完全激活。每个B细胞都具有将结合一种特定抗原的独特受体蛋白。一旦B细胞遭遇其抗原并从辅助T细胞接收另外的信号,它可以进一步分化成表达和分泌可溶性抗体的浆B细胞或者记忆B细胞。
在本公开的上下文中,术语“B细胞”是指在其表面呈现完全重排的BCR(即成熟BCR)的任何B淋巴细胞。例如,本发明上下文中的B细胞可以是未成熟或成熟的B细胞。在一些情况下,B细胞是幼稚B细胞(B cell),即未暴露于由所述B细胞表面上的BCR特异性识别的抗原的B细胞。在一些实施方式中,B细胞是CD19+B细胞,即,在其表面上表达CD19。在一些情况下,本发明上下文中的B细胞是CD19+B细胞并且在其表面上表达完全重排的BCR。B细胞也可以是CD20+或CD21+B细胞。在一些情况下,CD20+或CD21+B细胞在其表面携带BCR。在一些实施方式中,B细胞是记忆B细胞,如IgG+记忆B细胞。
激活抗原提呈细胞(APC)(例如,树突状细胞(DC))的疗法。在一些实施方式中,所述方法包括将激活个体的APC(例如,DC)的疗法施用于个体。这样的步骤可以在体内或体外进行,并且可以在施用抗体组合物的步骤之前、之后或同时进行。激活APC(例如,DC)的任何便利疗法都可以进行。例如,在一些情况下,激活(刺激)APC(例如,DC)的疗法可以包括激活内源性APC(例如,DC)的任何形式的癌症疗法(例如,个体的局部辐射,例如,200-4000rad电离辐射;化疗;等等)。在一些情况下,激活APC的疗法不包括局部辐射。在一些情况下,激活APC(例如,DC)(例如,激活树突状细胞)的疗法包括将APC(例如,DC)(例如,内源性DC(即,体内DC,例如,体内TADC)、不是BMDC的DC、是BMDC的DC、TADC、巨噬细胞、B细胞等等)与APC刺激组合物(例如,树突状细胞刺激组合物)接触。在一些情况下,在体内激活APC(例如,DC)。在一些情况下,离体激活APC(例如,DC)(例如,DC(例如,TADC)可以从个体分离,并且TADC然后可以被激活,例如,与树突状细胞刺激组合物接触)。
树突状细胞刺激组合物。在一些情况下,激活树突状细胞的疗法(例如,激活树突状细胞)包括将DC(例如,内源性DC、不是BMDC的DC、是BMDC的DC、TADC等等)与树突状细胞刺激组合物接触。本文所用“树突状细胞刺激组合物”包含至少一种树突状细胞刺激剂。
树突状细胞刺激剂是激活DC,和/或刺激抗原摄取(例如,刺激肿瘤细胞的摄取,例如,吞噬作用),和/或刺激DC成熟,和/或刺激抗原提呈给T细胞的试剂。适合的树突状细胞刺激剂包括,但不限于:CD40激动剂、促炎性细胞因子、Toll样受体激动剂(例如,CpG ODN、聚肌苷酸:聚胞苷酸(“聚I:C”,TLR-3激动剂)等等)、吲哚胺2,3-二加氧酶(IDO)抑制剂、检查点分子中和化合物(例如,中和检查点分子的抗体,例如,抗CTLA-4抗体,例如,易普利姆玛)、NFkB激活剂(例如,佛波酯)、打开钙通道的化合物(例如,离子霉素)、T细胞相关共刺激分子(例如,CD27、CD28、4-BBL等等)及其任意组合。
例如,在一些情况下,所述树突状细胞刺激组合物包含CD40激动剂(例如,CD40L和/或激动性抗CD40抗体)和促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)。在一些情况下,所述树突状细胞刺激组合物包含CD40激动剂(例如,CD40L和/或激动性抗CD40抗体)、促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)和Toll样受体激动剂(例如,CpG ODN、聚肌苷酸:聚胞苷酸(“聚I:C”,TLR-3激动剂)等等)。在一些情况下,所述树突状细胞刺激组合物包含Toll样受体激动剂(例如,CpG ODN、聚肌苷酸:聚胞苷酸(“聚I:C”,TLR-3激动剂)等等)。在一些情况下,所述树突状细胞刺激组合物包含IDO抑制剂。在一些情况下,所述树突状细胞刺激组合物包含中和检查点分子的抗体(例如,抗CTLA-4抗体,例如,易普利姆玛)。在一些情况下,所述树突状细胞刺激组合物包含T细胞相关共刺激分子(例如,CD27、CD28、4-BBL等等)。在一些情况下,所述树突状细胞刺激组合物包含T细胞相关共刺激分子(例如,CD27、CD28、4-BBL等等)和促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)。在一些情况下,所述树突状细胞刺激组合物包含T细胞相关共刺激分子(例如,CD27、CD28、4-BBL等等)、促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)和Toll样受体激动剂(例如,CpG ODN、聚肌苷酸:聚胞苷酸(“聚I:C”,TLR-3激动剂)等等)。
B细胞刺激组合物。在一些情况下,激活B细胞的疗法(例如,激活B细胞)包括将B细胞与B细胞刺激组合物接触。本文所用“B细胞刺激组合物”包含至少一种B细胞刺激剂。
B细胞刺激剂是激活B细胞,和/或刺激抗原的摄取(例如,刺激肿瘤细胞的摄取,例如,吞噬作用),和/或刺激B细胞的成熟,和/或刺激抗原提呈给T细胞的试剂。适合的B细胞刺激剂包括,但不限于:Toll样受体(TLR)激动剂;(ii)CD40激动剂;(iii)CD40激动剂与促炎性细胞因子;(iv)结合B细胞受体的抗原;(v)抗独特型抗体;(vi)交联表面免疫球蛋白的试剂;及其任意组合。
巨噬细胞刺激组合物。在一些情况下,激活巨噬细胞的疗法(例如,激活巨噬细胞)包括将巨噬细胞与巨噬细胞刺激组合物接触。本文所用“巨噬细胞刺激组合物”包含至少一种巨噬细胞细胞刺激剂。
巨噬细胞刺激剂是激活巨噬细胞,和/或刺激抗原的摄取(例如,刺激肿瘤细胞的摄取,例如,吞噬作用),和/或刺激巨噬细胞的成熟,和/或刺激抗原提呈给T细胞的试剂。适合的巨噬细胞刺激剂包括,但不限于:Toll样受体(TLR)激动剂;(ii)巨噬细胞激活性细胞因子;(iii)糖皮质激素受体激动剂;及其任意组合。
任何便利的CD40激动剂都可以使用。适合的CD40激动剂的实例包括,但不限于:激动性抗CD40抗体、CD40配体(CD40L,也称为CD40LG)等等。任何便利的激动性抗CD40抗体都可以使用,并且激动性抗CD40抗体是本领域所已知的。任何便利的CD40L(或其功能片段)都可以使用。例如,人CD40L是具有以下蛋白质序列的多肽:
MIETYNQTSPRSAATGLPISMKIFMYLLTVFLITQMIGSALFAVYLHRRLDKIEDERNLHEDFVFMKTIQRCNTGERSLSLLNCEEIKSQFEGFVKDIMLNKEETKKENSFEMQKGDQNPQIAAHVISEASSKTTSVLQWAEKGYYTMSNNLVTLENGKQLTVKRQGLYYIYAQVTFCSNREASSQAPFIASLCLKSPGRFERILLRAANTHSSAKPCGQQSIHLGGVFELQPGASVFVNVTDPSQVSHGTGFTSFGLLKL(SEQ ID NO:1),其由具有以下cDNA序列的相应mRNA编码(下划线标记开放阅读框):
ACTTTGACAGTCTTCTCATGCTGCCTCTGCCACCTTCTCTGCCAGAAGATACCATTTCAACTTTAACACAGCATGATCGAAACATACAACCAAACTTCTCCCCGATCTGCGGCCACTGGACTGCCCATCAGCATGAAAATTTTTATGTATTTACTTACTGTTTTTCTTATCACCCAGATGATTGGGTCAGCACTTTTTGCTGTGTATCTTCATAGAAGGTTGGACAAGATAGAAGATGAAAGGAATCTTCATGAAGATTTTGTATTCATGAAAACGATACAGAGATGCAACACAGGAGAAAGATCCTTATCCTTACTGAACTGTGAGGAGATTAAAAGCCAGTTTGAAGGCTTTGTGAAGGATATAATGTTAAACAAAGAGGAGACGAAGAAAGAAAACAGCTTTGAAATGCAAAAAGGTGATCAGAATCCTCAAATTGCGGCACATGTCATAAGTGAGGCCAGCAGTAAAACAACATCTGTGTTACAGTGGGCTGAAAAAGGATACTACACCATGAGCAACAACTTGGTAACCCTGGAAAATGGGAAACAGCTGACCGTTAAAAGACAAGGACTCTATTATATCTATGCCCAAGTCACCTTCTGTTCCAATCGGGAAGCTTCGAGTCAAGCTCCATTTATAGCCAGCCTCTGCCTAAAGTCCCCCGGTAGATTCGAGAGAATCTTACTCAGAGCTGCAAATACCCACAGTTCCGCCAAACCTTGCGGGCAACAATCCATTCACTTGGGAGGAGTATTTGAATTGCAACCAGGTGCTTCGGTGTTTGTCAATGTGACTGATCCAAGCCAAGTGAGCCATGGCACTGGCTTCACGTCCTTTGGCTTACTCAAACTCTGAACAGTGTCACCTTGCAGGCTGTGGTGGAGCTGACGCTGGGAGTCTTCATAATACAGCACAGCGGTTAAGCCCACCCCCTGTTAACTGCCTATTTATAACCCTAGGATCCTCCTTATGGAGAACTATTTATTATACACTCCAAGGCATGTAGAACTGTAATAAGTGAATTACAGGTCACATGAAACCAAAACGGGCCCTGCTCCATAAGAGCTTATATATCTGAAGCAGCAACCCCACTGATGCAGACATCCAGAGAGTCCTATGAAAAGACAAGGCCATTATGCACAGGTTGAATTCTGAGTAAACAGCAGATAACTTGCCAAGTTCAGTTTTGTTTCTTTGCGTGCAGTGTCTTTCCATGGATAATGCATTTGATTTATCAGTGAAGATGCAGAAGGGAAATGGGGAGCCTCAGCTCACATTCAGTTATGGTTGACTCTGGGTTCCTATGGCCTTGTTGGAGGGGGCCAGGCTCTAGAACGTCTAACACAGTGGAGAACCGAAACCCCCCCCCCCCCCCCGCCACCCTCTCGGACAGTTATTCATTCTCTTTCAATCTCTCTCTCTCCATCTCTCTCTTTCAGTCTCTCTCTCTCAACCTCTTTCTTCCAATCTCTCTTTCTCAATCTCTCTGTTTCCCTTTGTCAGTCTCTTCCCTCCCCCAGTCTCTCTTCTCAATCCCCCTTTCTAACACACACACACACACACACACACACACACACACACACACACACACACACACAGAGTCAGGCCGTTGCTAGTCAGTTCTCTTCTTTCCACCCTGTCCCTATCTCTACCACTATAGATGAGGGTGAGGAGTAGGGAGTGCAGCCCTGAGCCTGCCCACTCCTCATTACGAAATGACTGTATTTAAAGGAAATCTATTGTATCTACCTGCAGTCTCCATTGTTTCCAGAGTGAACTTGTAATTATCTTGTTATTTATTTTTTGAATAATAAAGACCTCTTAACATTAA(SEQ ID NO:2)。
适合的CD40L也可以是CD40L的功能片段(即,CD40L不需要是全长多肽)。膜锚定CD40配体在CD4+ T淋巴细胞上表达。CD40的可溶形式是包含CD40L的整个TNF同源区的蛋白质,并且通过全长CD40L的细胞内蛋白水解加工而体内产生。例如,重组鼠CD40L可以是具有CD40L的受体结合TNF样结构域的含有149个氨基酸残基的可溶性16.4kDa蛋白质:
MQRGDEDPQIAAHVVSEANSNAASVLQWAKKGYYTMKSNLVMLENGKQLTVKREGLYYVYTQVTFCSNREPSSQRPFIVGLWLKPSSGSERILLKAANTHSSSQLCEQQSVHLGGVFELQAGASVFVNVTEASQVIHRVGFSSFGLLKL(SEQ ID NO:3)。作为另一个实例,重组人可溶性CD40配体(CD40L)可以是具有CD40L的受体结合TNF样结构域含有149个氨基酸残基的16.3kDa蛋白质:
MQKGDQNPQIAAHVISEASSKTTSVLQWAEKGYYTMSNNLVTLENGKQLTVKRQGLYYIYAQVTFCSNREASSQAPFIASLWLKSPGRFERILLRAANTHSSAKPCGQQSIHLGGVFELQPGASVFVNVTDPSQVSHGTGFTSFGLLKL(SEQ ID NO:4)。适合的CD40L(包括功能片段)也可以作为编码CD40L多肽(例如,全长、功能片段等等)的核酸(例如,DNA和/或mRNA)提供。
当使用CD40L时,它可以在任何便利的浓度下使用以实现APC(例如,DC)的负载。例如,在一些情况下,CD40L在350ng/ml至650ng/ml范围内的浓度下使用(例如,400ng/ml至600ng/ml、425ng/ml至575ng/ml、450ng/ml至550ng/ml、475ng/ml至525ng/ml或500ng/ml)。
对于更多关于CD40激动剂和CD40激动剂的非限制性实例的信息,参见:Khong等人,Int Rev Immunol.2012年8月;31(4):246-66;Khong等人,J Immunother.2013年9月;36(7):365-72;Rycyzyn等人,Hybridoma(Larchmt).2008年2月;27(1):25-30;Khalil等人,Update Cancer Ther.2007年6月1日;2(2):61-65;和美国专利申请20130024956、20120225014和20100098694;其均都在此通过引用将其全部内容并入。
任何便利的促炎性细胞因子或者促炎性细胞因子的诱导剂都可以使用。适合的促炎性细胞因子的实例包括,但不限于:肿瘤坏死因子(TNF,也称为肿瘤坏死因子α(TNFα));白介素(IL)1(IL-1)(例如,IL-1α、IL-1β);和IL-19。
例如,人肿瘤坏死因子(TNF,TNFα)是具有以下蛋白质序列的多肽:
MSTESMIRDVELAEEALPKKTGGPQGSRRCLFLSLFSFLIVAGATTLFCLLHFGVIGPQREEFPRDLSLISPLAQAVRSSSRTPSDKPVAHVVANPQAEGQLQWLNRRANALLANGVELRDNQLVVPSEGLYLIYSQVLFKGQGCPSTHVLLTHTISRIAVSYQTKVNLLSAIKSPCQRETPEGAEAKPWYEPIYLGGVFQLEKGDRLSAEINRPDYLDFAESGQVYFGIIAL(SEQ ID NO:5),其由具有以下cDNA序列的相应mRNA编码(下划线标记开放阅读框):
CAGACGCTCCCTCAGCAAGGACAGCAGAGGACCAGCTAAGAGGGAGAGAAGCAACTACAGACCCCCCCTGAAAACAACCCTCAGACGCCACATCCCCTGACAAGCTGCCAGGCAGGTTCTCTTCCTCTCACATACTGACCCACGGCTCCACCCTCTCTCCCCTGGAAAGGACACCATGAGCACTGAAAGCATGATCCGGGACGTGGAGCTGGCCGAGGAGGCGCTCCCCAAGAAGACAGGGGGGCCCCAGGGCTCCAGGCGGTGCTTGTTCCTCAGCCTCTTCTCCTTCCTGATCGTGGCAGGCGCCACCACGCTCTTCTGCCTGCTGCACTTTGGAGTGATCGGCCCCCAGAGGGAAGAGTTCCCCAGGGACCTCTCTCTAATCAGCCCTCTGGCCCAGGCAGTCAGATCATCTTCTCGAACCCCGAGTGACAAGCCTGTAGCCCATGTTGTAGCAAACCCTCAAGCTGAGGGGCAGCTCCAGTGGCTGAACCGCCGGGCCAATGCCCTCCTGGCCAATGGCGTGGAGCTGAGAGATAACCAGCTGGTGGTGCCATCAGAGGGCCTGTACCTCATCTACTCCCAGGTCCTCTTCAAGGGCCAAGGCTGCCCCTCCACCCATGTGCTCCTCACCCACACCATCAGCCGCATCGCCGTCTCCTACCAGACCAAGGTCAACCTCCTCTCTGCCATCAAGAGCCCCTGCCAGAGGGAGACCCCAGAGGGGGCTGAGGCCAAGCCCTGGTATGAGCCCATCTATCTGGGAGGGGTCTTCCAGCTGGAGAAGGGTGACCGACTCAGCGCTGAGATCAATCGGCCCGACTATCTCGACTTTGCCGAGTCTGGGCAGGTCTACTTTGGGATCATTGCCCTGTGAGGAGGACGAACATCCAACCTTCCCAAACGCCTCCCCTGCCCCAATCCCTTTATTACCCCCTCCTTCAGACACCCTCAACCTCTTCTGGCTCAAAAAGAGAATTGGGGGCTTAGGGTCGGAACCCAAGCTTAGAACTTTAAGCAACAAGACCACCACTTCGAAACCTGGGATTCAGGAATGTGTGGCCTGCACAGTGAAGTGCTGGCAACCACTAAGAATTCAAACTGGGGCCTCCAGAACTCACTGGGGCCTACAGCTTTGATCCCTGACATCTGGAATCTGGAGACCAGGGAGCCTTTGGTTCTGGCCAGAATGCTGCAGGACTTGAGAAGACCTCACCTAGAAATTGACACAAGTGGACCTTAGGCCTTCCTCTCTCCAGATGTTTCCAGACTTCCTTGAGACACGGAGCCCAGCCCTCCCCATGGAGCCAGCTCCCTCTATTTATGTTTGCACTTGTGATTATTTATTATTTATTTATTATTTATTTATTTACAGATGAATGTATTTATTTGGGAGACCGGGGTATCCTGGGGGACCCAATGTAGGAGCTGCCTTGGCTCAGACATGTTTTCCGTGAAAACGGAGCTGAACAATAGGCTGTTCCCATGTAGCCCCCTGGCCTCTGTGCCTTCTTTTGATTATGTTTTTTAAAATATTTATCTGATTAAGTTGTCTAAACAATGCTGATTTGGTGACCAACTGTCACTCATTGCTGAGCCTCTGCTCCCCAGGGGAGTTGTGTCTGTAATCGCCCTACTATTCAGTGGCGAGAAATAAAGTTTGCTTAGAAAAGAAAAAAAAAAAAA(SEQ ID NO:6)。
当使用TNFα时,它可以在任何便利的浓度下使用以实现APC(例如,DC)的负载。例如,在一些情况下,TNFα在20ng/ml至80ng/ml范围内的浓度下使用(例如,25ng/ml至75ng/ml、30ng/ml至70ng/ml、35ng/ml至65ng/ml、40ng/ml至60ng/ml、45ng/ml至55ng/ml、47.5ng/ml至52.5ng/ml或50ng/ml)。
作为另一个实例,人IL-1α是具有以下蛋白质序列的多肽:
MAKVPDMFEDLKNCYSENEEDSSSIDHLSLNQKSFYHVSYGPLHEGCMDQSVSLSISETSKTSKLTFKESMVVVATNGKVLKKRRLSLSQSITDDDLEAIANDSEEEIIKPRSAPFSFLSNVKYNFMRIIKYEFILNDALNQSIIRANDQYLTAAALHNLDEAVKFDMGAYKSSKDDAKITVILRISKTQLYVTAQDEDQPVLLKEMPEIPKTITGSETNLLFFWETHGTKNYFTSVAHPNLFIATKQDYWVCLAGGPPSITDFQILENQA(SEQ ID NO:7),其由具有以下cDNA序列的相应mRNA编码(下划线标记开放阅读框):
ACCAGGCAACACCATTGAAGGCTCATATGTAAAAATCCATGCCTTCCTTTCTCCCAATCTCCATTCCCAAACTTAGCCACTGGCTTCTGGCTGAGGCCTTACGCATACCTCCCGGGGCTTGCACACACCTTCTTCTACAGAAGACACACCTTGGGCATATCCTACAGAAGACCAGGCTTCTCTCTGGTCCTTGGTAGAGGGCTACTTTACTGTAACAGGGCCAGGGTGGAGAGTTCTCTCCTGAAGCTCCATCCCCTCTATAGGAAATGTGTTGACAATATTCAGAAGAGTAAGAGGATCAAGACTTCTTTGTGCTCAAATACCACTGTTCTCTTCTCTACCCTGCCCTAACCAGGAGCTTGTCACCCCAAACTCTGAGGTGATTTATGCCTTAATCAAGCAAACTTCCCTCTTCAGAAAAGATGGCTCATTTTCCCTCAAAAGTTGCCAGGAGCTGCCAAGTATTCTGCCAATTCACCCTGGAGCACAATCAACAAATTCAGCCAGAACACAACTACAGCTACTATTAGAACTATTATTATTAATAAATTCCTCTCCAAATCTAGCCCCTTGACTTCGGATTTCACGATTTCTCCCTTCCTCCTAGAAACTTGATAAGTTTCCCGCGCTTCCCTTTTTCTAAGACTACATGTTTGTCATCTTATAAAGCAAAGGGGTGAATAAATGAACCAAATCAATAACTTCTGGAATATCTGCAAACAACAATAATATCAGCTATGCCATCTTTCACTATTTTAGCCAGTATCGAGTTGAATGAACATAGAAAAATACAAAACTGAATTCTTCCCTGTAAATTCCCCGTTTTGACGACGCACTTGTAGCCACGTAGCCACGCCTACTTAAGACAATTACAAAAGGCGAAGAAGACTGACTCAGGCTTAAGCTGCCAGCCAGAGAGGGAGTCATTTCATTGGCGTTTGAGTCAGCAAAGAAGTCAAGATGGCCAAAGTTCCAGACATGTTTGAAGACCTGAAGAACTGTTACAGTGAAAATGAAGAAGACAGTTCCTCCATTGATCATCTGTCTCTGAATCAGAAATCCTTCTATCATGTAAGCTATGGCCCACTCCATGAAGGCTGCATGGATCAATCTGTGTCTCTGAGTATCTCTGAAACCTCTAAAACATCCAAGCTTACCTTCAAGGAGAGCATGGTGGTAGTAGCAACCAACGGGAAGGTTCTGAAGAAGAGACGGTTGAGTTTAAGCCAATCCATCACTGATGATGACCTGGAGGCCATCGCCAATGACTCAGAGGAAGAAATCATCAAGCCTAGGTCAGCACCTTTTAGCTTCCTGAGCAATGTGAAATACAACTTTATGAGGATCATCAAATACGAATTCATCCTGAATGACGCCCTCAATCAAAGTATAATTCGAGCCAATGATCAGTACCTCACGGCTGCTGCATTACATAATCTGGATGAAGCAGTGAAATTTGACATGGGTGCTTATAAGTCATCAAAGGATGATGCTAAAATTACCGTGATTCTAAGAATCTCAAAAACTCAATTGTATGTGACTGCCCAAGATGAAGACCAACCAGTGCTGCTGAAGGAGATGCCTGAGATACCCAAAACCATCACAGGTAGTGAGACCAACCTCCTCTTCTTCTGGGAAACTCACGGCACTAAGAACTATTTCACATCAGTTGCCCATCCAAACTTGTTTATTGCCACAAAGCAAGACTACTGGGTGTGCTTGGCAGGGGGGCCACCCTCTATCACTGACTTTCAGATACTGGAAAACCAGGCGTAGGTCTGGAGTCTCACTTGTCTCACTTGTGCAGTGTTGACAGTTCATATGTACCATGTACATGAAGAAGCTAAATCCTTTACTGTTAGTCATTTGCTGAGCATGTACTGAGCCTTGTAATTCTAAATGAATGTTTACACTCTTTGTAAGAGTGGAACCAACACTAACATATAATGTTGTTATTTAAAGAACACCCTATATTTTGCATAGTACCAATCATTTTAATTATTATTCTTCATAACAATTTTAGGAGGACCAGAGCTACTGACTATGGCTACCAAAAAGACTCTACCCATATTACAGATGGGCAAATTAAGGCATAAGAAAACTAAGAAATATGCACAATAGCAGTTGAAACAAGAAGCCACAGACCTAGGATTTCATGATTTCATTTCAACTGTTTGCCTTCTACTTTTAAGTTGCTGATGAACTCTTAATCAAATAGCATAAGTTTCTGGGACCTCAGTTTTATCATTTTCAAAATGGAGGGAATAATACCTAAGCCTTCCTGCCGCAACAGTTTTTTATGCTAATCAGGGAGGTCATTTTGGTAAAATACTTCTTGAAGCCGAGCCTCAAGATGAAGGCAAAGCACGAAATGTTATTTTTTAATTATTATTTATATATGTATTTATAAATATATTTAAGATAATTATAATATACTATATTTATGGGAACCCCTTCATCCTCTGAGTGTGACCAGGCATCCTCCACAATAGCAGACAGTGTTTTCTGGGATAAGTAAGTTTGATTTCATTAATACAGGGCATTTTGGTCCAAGTTGTGCTTATCCCATAGCCAGGAAACTCTGCATTCTAGTACTTGGGAGACCTGTAATCATATAATAAATGTACATTAATTACCTTGAGCCAGTAATTGGTCCGATCTTTGACTCTTTTGCCATTAAACTTACCTGGGCATTCTTGTTTCAATTCCACCTGCAATCAAGTCCTACAAGCTAAAATTAGATGAACTCAACTTTGACAACCATGAGACCACTGTTATCAAAACTTTCTTTTCTGGAATGTAATCAATGTTTCTTCTAGGTTCTAAAAATTGTGATCAGACCATAATGTTACATTATTATCAACAATAGTGATTGATAGAGTGTTATCAGTCATAACTAAATAAAGCTTGCAACAAAATTCTCTGACAAAAAAAAAAAAAAAA(SEQ ID NO:8)。
作为另一个实例,人IL-1β是具有以下蛋白质序列的多肽:
MAEVPELASEMMAYYSGNEDDLFFEADGPKQMKCSFQDLDLCPLDGGIQLRISDHHYSKGFRQAASVVVAMDKLRKMLVPCPQTFQENDLSTFFPFIFEEEPIFFDTWDNEAYVHDAPVRSLNCTLRDSQQKSLVMSGPYELKALHLQGQDMEQQVVFSMSFVQGEESNDKIPVALGLKEKNLYLSCVLKDDKPTLQLESVDPKNYPKKKMEKRFVFNKIEINNKLEFESAQFPNWYISTSQAENMPVFLGGTKGGQDITDFTMQFVSS(SEQ ID NO:9),其右具有以下cDNA序列的相应mRNA编码(下划线标记开放阅读框):
ACCAAACCTCTTCGAGGCACAAGGCACAACAGGCTGCTCTGGGATTCTCTTCAGCCAATCTTCATTGCTCAAGTGTCTGAAGCAGCCATGGCAGAAGTACCTGAGCTCGCCAGTGAAATGATGGCTTATTACAGTGGCAATGAGGATGACTTGTTCTTTGAAGCTGATGGCCCTAAACAGATGAAGTGCTCCTTCCAGGACCTGGACCTCTGCCCTCTGGATGGCGGCATCCAGCTACGAATCTCCGACCACCACTACAGCAAGGGCTTCAGGCAGGCCGCGTCAGTTGTTGTGGCCATGGACAAGCTGAGGAAGATGCTGGTTCCCTGCCCACAGACCTTCCAGGAGAATGACCTGAGCACCTTCTTTCCCTTCATCTTTGAAGAAGAACCTATCTTCTTCGACACATGGGATAACGAGGCTTATGTGCACGATGCACCTGTACGATCACTGAACTGCACGCTCCGGGACTCACAGCAAAAAAGCTTGGTGATGTCTGGTCCATATGAACTGAAAGCTCTCCACCTCCAGGGACAGGATATGGAGCAACAAGTGGTGTTCTCCATGTCCTTTGTACAAGGAGAAGAAAGTAATGACAAAATACCTGTGGCCTTGGGCCTCAAGGAAAAGAATCTGTACCTGTCCTGCGTGTTGAAAGATGATAAGCCCACTCTACAGCTGGAGAGTGTAGATCCCAAAAATTACCCAAAGAAGAAGATGGAAAAGCGATTTGTCTTCAACAAGATAGAAATCAATAACAAGCTGGAATTTGAGTCTGCCCAGTTCCCCAACTGGTACATCAGCACCTCTCAAGCAGAAAACATGCCCGTCTTCCTGGGAGGGACCAAAGGCGGCCAGGATATAACTGACTTCACCATGCAATTTGTGTCTTCCTAAAGAGAGCTGTACCCAGAGAGTCCTGTGCTGAATGTGGACTCAATCCCTAGGGCTGGCAGAAAGGGAACAGAAAGGTTTTTGAGTACGGCTATAGCCTGGACTTTCCTGTTGTCTACACCAATGCCCAACTGCCTGCCTTAGGGTAGTGCTAAGAGGATCTCCTGTCCATCAGCCAGGACAGTCAGCTCTCTCCTTTCAGGGCCAATCCCCAGCCCTTTTGTTGAGCCAGGCCTCTCTCACCTCTCCTACTCACTTAAAGCCCGCCTGACAGAAACCACGGCCACATTTGGTTCTAAGAAACCCTCTGTCATTCGCTCCCACATTCTGATGAGCAACCGCTTCCCTATTTATTTATTTATTTGTTTGTTTGTTTTATTCATTGGTCTAATTTATTCAAAGGGGGCAAGAAGTAGCAGTGTCTGTAAAAGAGCCTAGTTTTTAATAGCTATGGAATCAATTCAATTTGGACTGGTGTGCTCTCTTTAAATCAAGTCCTTTAATTAAGACTGAAAATATATAAGCTCAGATTATTTAAATGGGAATATTTATAAATGAGCAAATATCATACTGTTCAATGGTTCTGAAATAAACTTCACTGAAG(SEQ ID NO:10)。
作为另一个实例,人IL-19(异形体1)是具有以下蛋白质序列的多肽:
MCTEGAFPHRSACSLPLTHVHTHIHVCVPVLWGSVPRGMKLQCVSLWLLGTILILCSVDNHGLRRCLISTDMHHIEESFQEIKRAIQAKDTFPNVTILSTLETLQIIKPLDVCCVTKNLLAFYVDRVFKDHQEPNPKILRKISSIANSFLYMQKTLRQCQEQRQCHCRQEATNATRVIHDNYDQLEVHAAAIKSLGELDVFLAWINKNHEVMFSA(SEQ ID NO:11),其由具有以下cDNA序列的相应mRNA编码(下划线标记开放阅读框):
TGCACACACTGACAGGAGTCCAAGAATGTGCACTGAGGGAGCGTTTCCGCACAGATCTGCGTGTTCCTTACCACTCACACATGTGCACACACATATCCATGTGTGTGTGCCAGTGCTTTGGGGCTCTGTTCCACGGGGCATGAAGTTACAGTGTGTTTCCCTTTGGCTCCTGGGTACAATACTGATATTGTGCTCAGTAGACAACCACGGTCTCAGGAGATGTCTGATTTCCACAGACATGCACCATATAGAAGAGAGTTTCCAAGAAATCAAAAGAGCCATCCAAGCTAAGGACACCTTCCCAAATGTCACTATCCTGTCCACATTGGAGACTCTGCAGATCATTAAGCCCTTAGATGTGTGCTGCGTGACCAAGAACCTCCTGGCGTTCTACGTGGACAGGGTGTTCAAGGATCATCAGGAGCCAAACCCCAAAATCTTGAGAAAAATCAGCAGCATTGCCAACTCTTTCCTCTACATGCAGAAAACTCTGCGGCAATGTCAGGAACAGAGGCAGTGTCACTGCAGGCAGGAAGCCACCAATGCCACCAGAGTCATCCATGACAACTATGATCAGCTGGAGGTCCACGCTGCTGCCATTAAATCCCTGGGAGAGCTCGACGTCTTTCTAGCCTGGATTAATAAGAATCATGAAGTAATGTTCTCAGCTTGATGACAAGGAACCTGTATAGTGATCCAGGGATGAACACCCCCTGTGCGGTTTACTGTGGGAGACAGCCCACCTTGAAGGGGAAGGAGATGGGGAAGGCCCCTTGCAGCTGAAAGTCCCACTGGCTGGCCTCAGGCTGTCTTATTCCGCTTGAAAATAGCCAAAAAGTCTACTGTGGTATTTGTAATAAACTCTATCTGCTGAAAGGGCCTGCAGGCCATCCTGGGAGTAAAGGGCTGCCTTCCCATCTAATTTATTGTAAAGTCATATAGTCCATGTCTGTGATGTGAGCCAAGTGATATCCTGTAGTACACATTGTACTGAGTGGTTTTTCTGAATAAATTCCATATTTTACCTATGAAAAAAAAAAAAAAAAAA(SEQ ID NO:12)。
作为另一个实例,人IL-19(异形体2)是具有以下蛋白质序列的多肽:
MKLQCVSLWLLGTILILCSVDNHGLRRCLISTDMHHIEESFQEIKRAIQAKDTFPNVTILSTLETLQIIKPLDVCCVTKNLLAFYVDRVFKDHQEPNPKILRKISSIANSFLYMQKTLRQCQEQRQCHCRQEATNATRVIHDNYDQLEVHAAAIKSLGELDVFLAWINKNHEVMFSA(SEQ ID NO:13),其由具有以下cDNA序列的相应mRNA编码(下划线标记开放阅读框):
GCTGGAGTGCAATGGTGAAATTATAGCAGACTGCAGTCTTCAACTCCTGACCTCAAGCAATTGTCCTGCCTCCTCAACTTCCTGACTACAGGTGTGCATGAGGACTACAGGCAGGCATGTGCCAACACATGCAGCTTTTTTTTTTTTTTTTTTTCAGAGATGTGGTCTCGCTTTGTTGCCTACACTGGTCTCAAACTCTTGGCCTCAAGGGATCCTCCCACCTCGGCTTCCCAAAGTGCAGAGATTACAGTCTCATTTTCTCTCTCTCTGCATTAATCAAGAATGAGAGAACCCTCCAGGGGACAAGATGAAGGGGAAATAGATGATGTGCAAAGAAATCCTTGCTTTATGAGGGGAAAAAGTGTTCCTCATGAAGTTCAACAAAATGATGCAGGTAAAGCAGTTAGCTAGCACCTGGCACATGGCAGACACTCATAGCTGCCTAAGGCATTGGAGAACTGGATCGTGCTGCAGCCAGAGGCACCTGCAGAGCCTCATGGGCTGGCTGCTGCAGGGTGTGGCTGATTGAGAGTGCTTTTGTGAGTTGGCCTGCAGGGTACACTTGGTAACGTGCCACAGCTCTCAGGAAAGTGACCTAAGTTGGATTTTTCTGCATGGACATAGAATTGCAAAAAATTCTCATTTGCATGGAGATGGGGAGTTTATTTTTCCTAGAAGCTGCATGTCAAGACCCAGAAGAAAGAGGCATTTCATAATAATGATTAATCAGCTATATCTTAAAGAAGAAAGAAAACAATTAAGGAAATACAATACTAAGAAAACAAGGGGAAAAAACAATCTCCCCAAGGTGGATCCACCCAGCAAACCTTGACAGCATTTCCTCTTATCCACCTGAATAAAAATGACCAGCCCTTTCCAAATGGCAGAGAGCACTGAGAGGAGACACAAGGAGCAGCCCGCAAGCACCAAGTGAGAGGCATGAAGTTACAGTGTGTTTCCCTTTGGCTCCTGGGTACAATACTGATATTGTGCTCAGTAGACAACCACGGTCTCAGGAGATGTCTGATTTCCACAGACATGCACCATATAGAAGAGAGTTTCCAAGAAATCAAAAGAGCCATCCAAGCTAAGGACACCTTCCCAAATGTCACTATCCTGTCCACATTGGAGACTCTGCAGATCATTAAGCCCTTAGATGTGTGCTGCGTGACCAAGAACCTCCTGGCGTTCTACGTGGACAGGGTGTTCAAGGATCATCAGGAGCCAAACCCCAAAATCTTGAGAAAAATCAGCAGCATTGCCAACTCTTTCCTCTACATGCAGAAAACTCTGCGGCAATGTCAGGAACAGAGGCAGTGTCACTGCAGGCAGGAAGCCACCAATGCCACCAGAGTCATCCATGACAACTATGATCAGCTGGAGGTCCACGCTGCTGCCATTAAATCCCTGGGAGAGCTCGACGTCTTTCTAGCCTGGATTAATAAGAATCATGAAGTAATGTTCTCAGCTTGATGACAAGGAACCTGTATAGTGATCCAGGGATGAACACCCCCTGTGCGGTTTACTGTGGGAGACAGCCCACCTTGAAGGGGAAGGAGATGGGGAAGGCCCCTTGCAGCTGAAAGTCCCACTGGCTGGCCTCAGGCTGTCTTATTCCGCTTGAAAATAGCCAAAAAGTCTACTGTGGTATTTGTAATAAACTCTATCTGCTGAAAGGGCCTGCAGGCCATCCTGGGAGTAAAGGGCTGCCTTCCCATCTAATTTATTGTAAAGTCATATAGTCCATGTCTGTGATGTGAGCCAAGTGATATCCTGTAGTACACATTGTACTGAGTGGTTTTTCTGAATAAATTCCATATTTTACCTATGAAAAAAAAAAAAAAAAAA(SEQ ID NO:14)。
适合的CD40激动剂(例如,CD40L;激动性抗CD40抗体(例如,FGK4.5,BioXcell);等等)和/或促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)也可以是其功能片段(即,蛋白质不需要是全长多肽)。适合的CD40激动剂(例如,CD40L、激动性抗CD40抗体等等)(或其功能片段)和/或促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)(或其功能片段)也可以作为编码多肽(例如,全长、功能片段等等)的核酸(例如,DNA和/或mRNA)提供。
任何便利的Toll样受体激动剂都可以使用。适合的Toll样受体激动剂(TLR)的实例包括,但不限于:CpG寡脱氧核苷酸(CpG ODN)(TLR-9激动剂);天然Toll样受体配体;保守的微生物产物,包括(但不限于)细菌LPS及其衍生物、细菌细胞壁组分(例如,脂磷壁酸)、细菌鞭毛蛋白、微生物DNA、微生物单链RNA和病毒双链RNA;聚肌苷酸:聚胞苷酸(通常缩写成“聚I:C”)(TLR-3激动剂)、热休克蛋白(例如,HSP60、HSP70);尿酸;表面活性蛋白A;非组蛋白染色质结合蛋白高迁移率族蛋白1(HMGB1);Ca2+和Zn2+结合蛋白S100A9;细胞外基质的组分和分解产物;和线粒体DNA(mtDNA)。关于Toll样受体激动剂和各种Toll样受体激动剂的实例的更多信息可见于Vacchelli等人,Oncoimmunology.2013年8月1日;2(8):e25238.电子出版于2013年6月10日;和美国专利申请20130165455和20130084307;其均在此通过引用将其全部内容并入。CpG寡脱氧核苷酸(CpG ODN)是包含CpG基序(例如,其结合TLR-9)的核苷酸。任何便利的CpG ODN都可以使用。
任何便利的吲哚胺2,3-二加氧酶(IDO)抑制剂都可以使用。适合的IDO抑制剂的实例包括,但不限于1-甲基-DL-色氨酸(1MT);甲基-硫乙内酰脲-色氨酸(MTH-Trp);CAY10581((±)3,4-二氢-3-羟基-2,2-二甲基-4-[(苯基甲基)氨基]-2H-萘并[2,3-β]吡喃-5,10-二酮);annulin B;和抗IDO抗体;去甲哈尔满(9H-吡啶并[3,4-b]吲哚);等等。关于IDO抑制剂和IDO抑制剂的更多实例的信息可见于例如美国专利申请20130289083、20130123246和20120058079;其均都在此通过引用将其全部内容并入。
中和检查点分子(例如,CTLA-4)的任何便利化合物(例如,抗体)都可以使用(即,检查点分子中和化合物)。示例性抗体是抗CTLA-4抗体(例如,易普利姆玛)。检查点分子包括,但未必限于:CTLA-4(细胞毒性T淋巴细胞抗原-4)、PD-1(CD279、程序性死亡-1、PDCD1)、LAG-3(淋巴细胞激活基因-3)、PD-L1(CD274)、GITR(TNFRSF18、CD357)、OX40(CD134、TNFRSF4)和TIM-3(T细胞免疫球蛋白和粘蛋白-3)。因此,针对任一上述检查点分子的抗体都可以用作APC刺激剂(例如,树突状细胞刺激剂)。在一些情况下,APC刺激剂不是中和检查点分子的试剂(例如,抗体)。
将APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)体内接触可以包括将APC刺激组合物(例如,树突状细胞刺激组合物)引入到个体中(施用于个体,例如,全身或局部地)。将APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)接触也可以体外进行。
当APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)接触时,接触可以持续足以刺激APC(例如,DC)摄取抗原的一段时间(由此产生负载APC,例如,负载DC)。在一些情况下,当APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)接触时,接触可以持续足以刺激APC(例如,DC)在未来摄取抗原的一段时间(由此产生激活APC,例如,激活DC,或者预激活APC,例如,预激活DC)。在一些情况下,APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)接触2小时至48小时范围内的一段时间(例如,6小时至36小时、12小时至36小时、18小时至30小时、20小时至30小时、22小时至28小时、22小时至26小时、23小时至25小时或24小时)。
在一些情况下,APC(例如,DC)在与所述靶抗原(例如,在不存在所述靶抗原的情况下)和/或所述抗体组合物(例如,在不存在所述抗体组合物的情况下)接触之前与APC刺激组合物(例如,树突状细胞刺激组合物)接触。例如,在一些情况下,APC(例如,DC)在与所述靶抗原和/或所述抗体组合物接触之前与APC刺激组合物(例如,树突状细胞刺激组合物)接触2小时至48小时范围内的一段时间(例如,6小时至36小时、12小时至36小时、18小时至30小时、20小时至30小时、22小时至28小时、22小时至26小时、23小时至25小时或24小时)。换句话说,在一些情况下,APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)在不存在所述靶抗原和/或所述抗体组合物的情况下接触2小时至48小时范围内的一段时间(例如,6小时至36小时、12小时至36小时、18小时至30小时、20小时至30小时、22小时至28小时、22小时至26小时、23小时至25小时或24小时)。
作为一个说明性实例,在一些情况下,APC刺激组合物(例如,树突状细胞刺激组合物)在施用所述抗体组合物之前被引入到(即,施用于)个体中,且因此APC刺激组合物(例如,树突状细胞刺激组合物)在不存在所述抗体组合物的情况下被引入到个体中。在一些情况下,APC刺激组合物(例如,树突状细胞刺激组合物)在施用所述抗体组合物之后被引入到(即,施用于)个体中。在一些情况下,APC刺激组合物(例如,树突状细胞刺激组合物)与所述抗体组合物一起被引入到(即,施用于)个体(例如,与之同时施用、作为同一组合物的部分施用等等)。在一些情况下,APC(例如,DC)与APC刺激组合物(例如,树突状细胞刺激组合物)在靶抗原存在(例如,在也与之接触时)的情况下接触。在一些情况下(例如,当APC(例如,DC)是BMDC时),不使用APC刺激组合物(例如,树突状细胞刺激组合物)(对于体内或体外方法)。在一些情况下,引起内源性APC(例如,DC)从骨髓产生和/或释放的试剂(例如,Flt-3)在施用所述抗体组合物之前、与施用所述抗体组合物同时、或在施用所述抗体组合物之后施用于个体。
靶抗原。本文提供的是包括将APC(例如,DC)与靶抗原接触并随后由APC(例如,DC)摄取(例如,吞噬)抗原的方法。在一些情况下(例如,在抗体组合物被施用于个体的情况下),APC(例如,DC)与靶抗原在体内接触。例如,靶抗原(例如,癌细胞,肿瘤,癌细胞表达的蛋白质、碳水化合物或脂质,等等)存在于个体中,而APC(例如,DC)也存在于个体中,并且所述方法包括施用抗体组合物(如下文进一步详细描述的)以促进靶抗原的摄取。在一些这样的情况下,所述方法还包括将激活个体的APC(例如,DC)的疗法施用于个体(如上所述)。
在一些实施方式中,APC(例如,DC)与靶抗原在体外接触。在一些这样的情况下,APC(例如,DC)从个体分离,或者APC(例如,DC)从个体细胞衍生(例如,从个体的分离单核细胞衍生)。在任一情况下,APC(例如,DC)被认为对于个体是自体的。APC(例如,DC)与靶抗原和与所述抗体组合物体外接触。
靶抗原可以是由APC(例如,DC)摄取的任何抗原。如果抗原是蛋白质,那么APC(例如,DC)将对它进行加工并随后将某些肽组分提呈给T细胞。在一些情况下,靶抗原可以是多肽、蛋白质复合体、多肽混合物等等。在一些情况下,靶抗原是细胞(例如,来自个体的细胞)。例如,在一些情况下,接触APC(例如,DC)包括将自体APC(例如,DC)与细胞(例如,来自个体的癌细胞,例如,来自肿瘤的一个或多个细胞)接触。在一些情况下,靶抗原存在于复杂混合物中(例如,细胞裂解物、质膜蛋白质的集合等等)。因此,在一些实施方式中,靶抗原存在于细胞裂解物中。在一些这样的情况下,接触APC(例如,DC)可以包括将APC(例如,DC)与来自个体癌细胞的裂解物(即,癌细胞的细胞裂解物、质膜蛋白富集的裂解物、含有质膜蛋白的裂解物等等)接触。个体癌细胞(其可以是靶抗原的来源(例如,细胞裂解物的来源)或者可以是靶抗原)可以是个体的任何癌细胞(例如,来自原发肿瘤和/或转移肿瘤的细胞;来自血液的癌性细胞;淋巴结细胞;来自胸腔积液(例如,恶性胸腔积液)的细胞,例如,来自患有肺癌的患者;来自腹腔积液(例如,恶性腹腔积液)的细胞,例如,来自患有卵巢癌的患者;患有蕈样肉芽肿病的患者的相关皮肤;等等)。
靶抗原可以是肿瘤特异性抗原或肿瘤相关抗原(例如,全肿瘤或癌细胞、肿瘤细胞裂解物、肿瘤细胞膜制备物(例如,膜部分)、肿瘤细胞质膜制备物(例如,质膜部分)、来自肿瘤的分离或部分分离的抗原、融合蛋白、脂质体等等)、包含病毒抗原的病毒颗粒或其他制备物及其他任何抗原或抗原片段,例如,肽抗原或多肽抗原。抗原还可以是细菌细胞、细菌裂解物、来自细胞裂解物的膜部分或其他任何来源。抗原可以重组地表达或产生,或者甚至化学合成。重组抗原还可以在宿主细胞(例如,细菌、酵母、昆虫、脊椎动物或哺乳动物细胞)表面上表达(例如,在质膜上表达),可以存在于裂解物中,或者可以从裂解物纯化。或者,抗原可以由从肿瘤细胞纯化或扩增的核酸编码,所述核酸可以是核糖核酸(RNA)或脱氧核糖核酸(DNA)。
靶抗原可以存在于来自受试者的样品中。例如,来自受试者的过度增生或其他状况的组织样品可以用作抗原的来源。这样的样品可以例如通过活检或手术切除获得。这样的抗原可以用作裂解物或分离的制备物。或者,来自受试者(例如,癌症患者)的细胞的膜制备物或者确立的细胞系也可以用作抗原或者抗原或编码抗原的核酸的来源。
在一些实施方式中,所述抗体组合物的抗体所结合的靶抗原不是APC(例如,DC)随后提呈给T细胞的抗原。
抗体组合物。所述抗体组合物可以包含至少一种特异性结合靶抗原的同种IgG抗体。在一些情况下,靶抗原不是检查点分子。术语“同种异基因抗体”或“同种抗体”在本文中用于指不是来自讨论中的个体(例如,患有肿瘤并且寻求治疗的个体)的抗体,而是来自相同物种,或者来自不同物种但已经经过设计而减少、减轻或避免识别为外来抗体(例如,非自体)。例如,“同种抗体”可以是人源化抗体或超人源化抗体。
如果人类个体的癌细胞与并非由同一人产生的抗体(例如,抗体由第二人类个体产生,抗体由另一物种如小鼠产生,抗体是由另一物种产生的人源化抗体,等等)接触,那么该抗体被认为是同种异基因的(相对于第一个体)。同样,如果来自第一人类个体的APC(例如,DC)与抗原在存在同种抗体组合物(即,包含至少一种同种抗体的组合物)的情况下接触,那么同种抗体可以是人抗体(例如,人源化抗体、由人产生的抗体,等等),但是同种抗体和APC(例如,DC)可以来自不同个体(例如,同种抗体可以来自第二人类个体;同种抗体可以是来自另一物种的抗体,其中该抗体是人源化的;等等)。在一些实施方式中,APC(例如,DC)对于寻求或经历通过本文描述的一种或多种方法进行的癌症治疗的个体是内源性的。识别人抗原(例如,癌症特异性抗原,在癌细胞中和/或在癌细胞上富集的抗原,等等)的人源化小鼠单克隆抗体被认为是本文所用的“同种抗体”(同种异基因抗体)。例如,如果人源化单克隆抗体被施用于人个体或者与癌细胞接触,那么人源化单克隆抗体是同种抗体,因为它是人的(人源化的),但是人源化单克隆抗体并非来自其所施用的同一个体(人源化单克隆抗体并非来自癌细胞所来源的同一个体)。同样,由小鼠产生的全人抗体(例如,通过在负责产生抗体的小鼠中使基因座人源化的基因组工程)也会被认为是同种抗体。
在一些情况下,同种抗体并不明显结合非癌抗原(例如,同种抗体以比靶癌抗原低至少10、100、1000、10000、100000或1000000倍的亲和力(较高Kd)结合一种或多种非癌抗原)。在一些情况下,同种抗体所结合的靶癌抗原在癌细胞上富集。例如,靶癌抗原可以以比相应非癌细胞高至少2、5、10、100、1000、10000、100000或1000000倍的水平存在于癌细胞的表面上。在一些情况下,相应非癌细胞是相同组织或来源的细胞,所述组织或来源不是过度增生的或者其他癌性的。
在一些情况下,同种抗体结合在癌细胞表面上具有明显或可检测的存在的抗原。例如,同种抗体可以结合在癌细胞表面上以至少10、100、1000、10000、100000、1000000、2.5x106、5x106或1x107个或更多个拷贝的量存在的靶抗原。
在一些情况下,同种抗体以比非癌细胞上的相应抗原更高的亲和力结合癌细胞上的抗原。例如,与识别非癌细胞上的相应野生型抗原相比,同种抗体可以优先识别含有在癌细胞上发现的多态性的抗原。在一些情况下,同种抗体以比非癌细胞更大的亲合力结合癌细胞。例如,癌细胞可以表达更高密度的抗原,因此提供多价抗体与癌细胞的更高亲和力结合。
此外,本文所用术语“同种异基因抗体”或“同种抗体”是指IgG抗体,除非另有明确说明。因此,“同种异基因抗体”和“同种抗体”在本文中也称为“同种IgG抗体”、“同种-IgG-抗体”或“同种-IgG-Ab”。
在一些情况下,血清被用作同种IgG抗体的来源,在此情况下血清可以来自第二个体(被治疗的个体以外的个体)。因此,在一些情况下,多克隆IgG抗体来自血清(例如,来自第二个体的血清)。在一些情况下,含有具有多种结合特异性的多克隆同种IgG抗体的抗体组合物包含合并自2或更多个个体(3或更多个个体、4或更多个个体、5或更多个个体、6或更多个个体、7或更多个个体、8或更多个个体、9或更多个个体、10或更多个个体等等)的多克隆同种IgG抗体。在一些情况下,合并的血清被用作同种抗体的来源,在此情况下血清(例如,合并的血清)可以来自任何数量的个体,其均不是第一个体(例如,血清可以合并自2或更多个个体、3或更多个个体、4或更多个个体、5或更多个个体、6或更多个个体、7或更多个个体、8或更多个个体、9或更多个个体、10或更多个个体等等)。就这一点而言,为了从两个或更多个个体合并抗体,来自每个个体或者来个两个或更多个个体的子血清池的抗体可以在合并之前分离/纯化。另一方面,血清可以在抗体分离/纯化之前合并。在一些情况下,可以使用血清(例如,合并的血清)。在一些情况下,抗体在使用前从血清分离/纯化。在一些情况下,所述同种抗体组合物包含2或更多种(例如,3或更多种、4或更多种、5或更多种、6或更多种、7或更多种、8或更多种、9或更多种、10或更多种、15或更多种、20或更多种、30或更多种、40或更多种、50或更多种、100或更多种、200或更多种、500或更多种、1000或更多种等等)同种IgG抗体。在一些情况下,所述同种抗体组合物的同种IgG抗体中至少一种的靶抗原是未知的。
在一些情况下,同种抗体是规定子类(例如,IgG1、IgG2、IgG3或IgG4)的单克隆抗体。在一些情况下,同种抗体的混合物被用于本发明的方法、组合物或试剂盒中。在这样的情况下,同种抗体可以来自规定子类,或者可以是不同子类的混合物。例如,同种抗体可以是IgG2抗体。不同子类以不同相对比例的各种组合可以由本领域技术人员容易地获得。在一些情况下,特定子类或者不同子类的特定混合物可以在癌症治疗或者肿瘤大小减少方面特别有效。这样的子类可以通过分析各种不同子类及其混合物的癌症治疗效力而容易地鉴别,例如,如实施例4中所证明的。
在一些情况下,所述同种抗体组合物的同种IgG抗体中至少一种的靶抗原是已知的。例如,在一些情况下,一种或多种已知抗体被包含在所述抗体组合物中。例如,在一些情况下,所述同种抗体是靶向(特异性结合)于已知在特定细胞上/特定细胞中和/或在具有特定病症的患者中富集的靶标的抗体。例如,在一些情况下,个体患有癌症,并且已知所述癌症显示出升高水平的特定抗原(例如,肿瘤特异性抗原、癌症特异性抗原、肿瘤富集抗原、癌症富集抗原等等)。作为说明性实例,这样的适合抗体可以包括:同种抗gp75抗体、同种抗MHC I类抗体、同种抗CD20抗体、同种抗Her2抗体(例如,曲妥珠单抗,赫赛汀)等等。因此,在一些情况下,所述同种抗体可以是特异性结合特定抗原的抗体,所述抗原可以是由癌细胞表达的任何抗原(即,不必须是,但可以是癌细胞中相对于其他细胞富集的抗原,和对于癌细胞独特的抗原,等等)(例如,特异性结合个体癌细胞的抗原的同种IgG抗体;特异性结合癌细胞抗原的单克隆抗体,如人源化单克隆抗体;特异性结合肿瘤富集抗原、癌症富集抗原、肿瘤特异性抗原、癌症特异性抗原的单克隆抗体,如人源化单克隆抗体,等等)。在一些情况下,所述抗体组合物包含特异性结合癌细胞抗原的同种IgG抗体。在一些这样的情况下,同种IgG抗体是单克隆抗体(例如,人源化单克隆抗体)。在一些情况下,所述同种抗体组合物包含靶向(特异性结合)于表2中列出的蛋白质中的任一种或其直系同源物(例如,人直系同源物)的一种或多种抗体(参见下文实施例2)。例如,所述同种抗体组合物可以包含靶向(特异性结合)于下述蛋白质中的一种或多种(或其直系同源物,例如,人直系同源物)(括号中是登记标识符)的一种或多种抗体:ATP5I(Q06185)、OAT(P29758)、AIFM1(Q9Z0X1)、AOFA(Q64133)、MTDC(P18155)、CMC1(Q8BH59)、PREP(Q8K411)、YMEL1(O88967)、LPPRC(Q6PB66)、LONM(Q8CGK3)、ACON(Q99KI0)、ODO1(Q60597)、IDHP(P54071)、ALDH2(P47738)、ATPB(P56480)、AATM(P05202)、TMM93(Q9CQW0)、ERGI3(Q9CQE7)、RTN4(Q99P72)、CL041(Q8BQR4)、ERLN2(Q8BFZ9)、TERA(Q01853)、DAD1(P61804)、CALX(P35564)、CALU(O35887)、VAPA(Q9WV55)、MOGS(Q80UM7)、GANAB(Q8BHN3)、ERO1A(Q8R180)、UGGG1(Q6P5E4)、P4HA1(Q60715)、HYEP(Q9D379)、CALR(P14211)、AT2A2(O55143)、PDIA4(P08003)、PDIA1(P09103)、PDIA3(P27773)、PDIA6(Q922R8)、CLH(Q68FD5)、PPIB(P24369)、TCPG(P80318)、MOT4(P57787)、NICA(P57716)、BASI(P18572)、VAPA(Q9WV55)、ENV2(P11370)、VAT1(Q62465)、4F2(P10852)、ENOA(P17182)、ILK(O55222)、GPNMB(Q99P91)、ENV1(P10404)、ERO1A(Q8R180)、CLH(Q68FD5)、DSG1A(Q61495)、AT1A1(Q8VDN2)、HYOU1(Q9JKR6)、TRAP1(Q9CQN1)、GRP75(P38647)、ENPL(P08113)、CH60(P63038)和CH10(Q64433)。
为了清楚起见,如上文就术语“特异性结合”、“特异性地结合”等等的定义所述,特异性结合癌细胞抗原(靶抗原)的所述同种IgG抗体相对于其他可用抗原优先结合该特定抗原。然而,靶抗原不需要相对于其他细胞而对于癌细胞是特异性的或甚至在癌细胞中富集(例如,靶抗原可以由其他细胞表达)。因此,在“特异性地结合癌细胞抗原的同种抗体”的短语中,术语“特异性地”是指抗体的特异性而非在该特定细胞类型中抗原的独特性。为了避免混淆,在一些情况下,短语“结合癌细胞抗原的抗体”在本文中使用,其表示结合癌细胞抗原的抗体,但是该抗原不需要对于癌细胞是特异性的或甚至在癌细胞中相对于其他细胞富集。
在一些情况下,所述组合物包含2或更多种(例如,3或更多种、4或更多种、5或更多种、6或更多种、7或更多种、8或更多种、9或更多种、10或更多种、15或更多种、20或更多种、30或更多种、40或更多种、50或更多种、100或更多种、200或更多种、500或更多种、1000或更多种等等)同种IgG抗体,其中抗体中的至少两种特异性结合不同抗原,和/或其中抗体中的至少两种特异性结合相同抗原的不同表位。在一些这样的情况下,两种或更多种同种IgG抗体中的至少一种是单克隆抗体(例如,人源化单克隆抗体)。在一些这样的情况下,两种或更多种同种IgG抗体中的至少两种(3或更多种中的至少3种、4或更多种中的至少4种、5或更多种中的至少5种等等)是单克隆抗体(例如,人源化单克隆抗体)。
在一些情况下,所述抗体组合物含有具有未知结合特异性(即,未知靶抗原)的一种或多种抗体和具有已知结合特异性(即,已知靶抗原)的一种或多种抗体。例如,在一些情况下,所述抗体组合物可以“掺”有已知各自结合已知在一种或多种癌症中富集的抗原的一种或多种同种抗体(例如,2或更多种、3或更多种、4或更多种、5或更多种、6或更多种、10或更多种等等)。
在一些情况下,所述同种抗体组合物包含选自抗gp75抗体、抗MHC I类抗体、抗HLA抗体、抗CD20抗体和抗Her2抗体(例如,曲妥珠单抗,赫赛汀)的一种或多种抗体。在一些情况下,所述同种抗体组合物包含靶向(特异性结合)于表2中列出的蛋白质中的一种或多种或其直系同源物(例如,人直系同源物)的一种或多种抗体(参见下文实施例2)。例如,所述同种抗体组合物可以包含靶向(特异性结合)于下述蛋白质中的一种或多种(或其直系同源物,例如,人直系同源物)(括号中是登记标识符)的一种或多种抗体:ATP5I(Q06185)、OAT(P29758)、AIFM1(Q9Z0X1)、AOFA(Q64133)、MTDC(P18155)、CMC1(Q8BH59)、PREP(Q8K411)、YMEL1(O88967)、LPPRC(Q6PB66)、LONM(Q8CGK3)、ACON(Q99KI0)、ODO1(Q60597)、IDHP(P54071)、ALDH2(P47738)、ATPB(P56480)、AATM(P05202)、TMM93(Q9CQW0)、ERGI3(Q9CQE7)、RTN4(Q99P72)、CL041(Q8BQR4)、ERLN2(Q8BFZ9)、TERA(Q01853)、DAD1(P61804)、CALX(P35564)、CALU(O35887)、VAPA(Q9WV55)、MOGS(Q80UM7)、GANAB(Q8BHN3)、ERO1A(Q8R180)、UGGG1(Q6P5E4)、P4HA1(Q60715)、HYEP(Q9D379)、CALR(P14211)、AT2A2(O55143)、PDIA4(P08003)、PDIA1(P09103)、PDIA3(P27773)、PDIA6(Q922R8)、CLH(Q68FD5)、PPIB(P24369)、TCPG(P80318)、MOT4(P57787)、NICA(P57716)、BASI(P18572)、VAPA(Q9WV55)、ENV2(P11370)、VAT1(Q62465)、4F2(P10852)、ENOA(P17182)、ILK(O55222)、GPNMB(Q99P91)、ENV1(P10404)、ERO1A(Q8R180)、CLH(Q68FD5)、DSG1A(Q61495)、AT1A1(Q8VDN2)、HYOU1(Q9JKR6)、TRAP1(Q9CQN1)、GRP75(P38647)、ENPL(P08113)、CH60(P63038)和CH10(Q64433)。
在一些情况下,所述同种抗体组合物包含来自血清(例如,如上所述的来自一个个体的血清或合并的血清)的IgG。在一些情况下,所述同种抗体组合物包含从血清(例如,如上所述的来自一个个体的血清或合并的血清)富集的IgG。在一些这样的情况下,同种抗体(即,来自血清的IgG)中的一些(例如,大于0%但小于50%)、半数、大部份(大于50%但小于100%)或甚至全部的靶抗原是未知的。然而,组合物中的至少一种抗体识别方法的所述靶抗原的可能性是高的,因为这样的组合物含有对于种类繁多的靶抗原特异性的种类繁多的抗体。在一些这样的情况下,同种IgG抗体中至少一种的靶抗原是未知的。
当所述抗体组合物包含具有不同结合特异性(即,结合相同靶标的不同表位、结合不同靶抗原等等)的2或更多种抗体时,抗体组合物被认为具有“多克隆”抗体(例如,具有多种结合特异性的多克隆同种IgG抗体)。例如,具有两种或更多种单克隆抗体的组合物(例如,其中抗体中的至少两种结合共同靶标的不同表位和/或其中抗体中的至少两种结合不同靶抗原)被认为具有多克隆抗体(例如,具有多种结合特异性的多克隆同种IgG抗体)。就这一点而言,含有“具有多种结合特异性的多克隆同种IgG抗体”的组合物涵盖具有两种或更多种单克隆抗体的组合物。在一些情况下,包含具有多种结合特异性的多克隆同种IgG抗体的所述组合物包含2或更多种(例如,3或更多种、4或更多种、5或更多种、6或更多种、7或更多种、8或更多种、9或更多种、10或更多种、15或更多种、20或更多种、30或更多种、40或更多种、50或更多种、100或更多种、200或更多种、500或更多种、1000或更多种等等)单克隆抗体(例如,其中抗体中的至少两种特异性结合相同抗原的不同表位,和/或其中抗体中的至少两种特异性结合不同抗原)。
在一些情况下,所述抗体组合物包含缀合到APC刺激剂(例如,树突状细胞刺激剂(如上所述,例如,TLR激动剂,例如,CpG ODN;促炎性细胞因子;CD40激动剂;等等))的同种IgG抗体。在一些情况下,所述抗体组合物包含缀合到APC刺激剂(例如,树突状细胞刺激剂(如上所述,例如,TLR激动剂,例如,CpG ODN;促炎性细胞因子;CD40激动剂;等等))的两种或更多种抗体。当抗体被缀合到另一抗体时(例如,当所述同种IgG抗体被缀合到激动性抗CD40抗体时),缀合的分子可以是双特异性抗体的形式。在一些这样的情况下,两种或更多种抗体被缀合到相同APC刺激剂(例如,树突状细胞刺激剂)。在一些情况下,两种或更多种抗体被缀合到不同APC刺激剂(例如,树突状细胞刺激剂)。
所述同种抗体组合物可以包含血清或者可以包含从血清富集/纯化(例如,通过色谱法)的抗体。在一些情况下,所述抗体组合物包含基于其IgG子类(例如,IgG2)、肿瘤结合性质和/或APC激活(例如,DC激活)性质选择的IgG。
在一些情况下,同种抗体组合物包含静脉内注射免疫球蛋白(IVIG)或者来自(例如,富集自、纯化自,例如,亲和纯化)IVIG的抗体。IVIG是含有IgG(免疫球蛋白G)的血液制品,所述IgG合并自众多(例如,有时超过1000至60000)正常和健康血液供体的血浆(例如,在一些情况下,没有其他任何蛋白质)。IVIG可商购获得。IVIG含有高百分比的天然人单体IVIG并具有低IgA含量。当静脉内施用时,IVIG减轻多种疾病状况。因此,美国食品药品管理局(FDA)已经批准对大量疾病使用IVIG,包括(1)川崎病;(2)免疫介导血小板减少症;(3)原发性免疫缺陷;(4)造血干细胞移植(对于年龄大于20岁的那些);(5)慢性B细胞淋巴细胞性白血病;和(6)儿科HIV 1型感染。在2004年,FDA批准了用于肾移植受体的Cedars-Sinai IVIG方案,使得这样的受体可以从任何健康供体接受活体供肾,无论血型(ABO不相容)或组织是否匹配。
在其中同种抗体组合物包含IVIG或者包含来自IVIG的抗体的一些情况下,组合物中抗体的一种或多种被缀合到APC刺激剂(例如,树突状细胞刺激剂(如上所述,例如,TLR激动剂,例如,CpG ODN;促炎性细胞因子;CD40激动剂;等等))。在其中同种抗体组合物包含IVIG或者包含来自IVIG的抗体的一些情况下,组合物中抗体的一种或多种被缀合到CD40激动剂(例如,CD40L、激动性抗CD40抗体等等)。在其中同种抗体组合物包含IVIG或者包含来自IVIG的抗体的一些情况下,组合物中抗体的一种或多种被缀合到促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)(如下所述)。在其中同种抗体组合物包含IVIG或者包含来自IVIG的抗体的一些情况下,组合物中抗体的一种或多种被缀合到促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)(如下所述)并且组合物中的至少一种抗体被缀合到CD40激动剂(例如,CD40L、激动性抗CD40抗体等等)。在其中同种抗体组合物包含IVIG或者包含来自IVIG的抗体的一些情况下,组合物中的至少一种抗体被缀合到促炎性细胞因子(例如,TNFα、IL-1α、IL-1β、IL-19、干扰素γ(IFNγ)等等)(如下所述);组合物中的至少一种抗体被缀合到CD40激动剂(例如,CD40L、激动性抗CD40抗体等等);并且组合物中的至少一种抗体被缀合到CpG寡脱氧核苷酸(CpGODN)。当抗体被缀合到另一抗体时(例如,当所述同种IgG抗体被缀合到激动性抗CD40抗体时),缀合的分子可以是双特异性抗体形式。在其中同种抗体组合物包含IVIG或者包含来自IVIG的抗体的一些情况下,一种或多种缀合的抗体(与树突状细胞刺激剂缀合)被掺到(即,加入到)抗体组合物中,使得组合物包含IVIG的抗体和与APC刺激剂(例如,树突状细胞刺激剂)缀合的一种或多种抗体。
对于关于IVIG的更多信息,请参见美国专利申请20100150942、20040101909、20130177574、20130108619、20130011388;其均在此通过引用将其全部内容并入。
接触APC(例如,DC)以产生负载APC(例如,负载DC)。在一些实施方式中,APC(例如,DC)与靶抗原和所述抗体组合物在对APC(例如,DC)摄取靶抗原有效的剂量下接触对APC(例如,DC)摄取靶抗原有效的一段时间,由此产生负载APC(例如,负载DC)。在一些情况下,靶抗原在接触APC(例如,DC)之前(例如,在不存在APC(例如,DC)的情况下)与抗体组合物接触(因此产生免疫复合体)。在一些这样的情况下,靶抗原与抗体组合物接触5分钟至2小时范围内的一段时间(例如,5分钟至90分钟、5分钟至60分钟、10分钟至60分钟、10分钟至50分钟、10分钟至45分钟、15分钟至45分钟、20分钟至40分钟、20分钟至40分钟、25分钟至35分钟或30分钟)。
所述抗体(或所述抗体组合物)所特异性结合的抗原的身份不一定是所述方法的关键因素(例如,参见下文工作实施例)。在一些情况下,反而重要的是癌细胞(例如,肿瘤、肿瘤细胞等等)与足够的抗体接触使得APC(例如,DC)摄取靶抗原(例如,肿瘤细胞、癌细胞等等)。因此,在一些情况下,APC(例如,DC)与抗体组合物(例如,有效量的抗体组合物)接触,其中抗体(或多种抗体)处于足够高的浓度(即,有效浓度)下以刺激由APC(例如,DC)摄取靶抗原。
在一些情况下,靶抗原与抗体组合物接触,其中同种IgG抗体处于100ng/ml至100μg/ml范围内的抗体浓度下(例如,250ng/ml至75μg/ml、250ng/ml至50μg/ml、250ng/ml至25μg/ml、500ng/ml至25μg/ml、500ng/ml至15μg/ml、500ng/ml至10μg/ml、500ng/ml至5μg/ml、750ng/ml至3μg/ml、750ng/ml至2μg/ml或1μg/ml)。在一些情况下(例如,在靶抗原是细胞的情况下),靶抗原与抗体组合物接触,其中同种IgG抗体处于100ng/ml至100μg/ml(例如,250ng/ml至75μg/ml、250ng/ml至50μg/ml、250ng/ml至25μg/ml、500ng/ml至25μg/ml、500ng/ml至15μg/ml、500ng/ml至10μg/ml、500ng/ml至5μg/ml、750ng/ml至3μg/ml、750ng/ml至2μg/ml、或1μg/ml)/1x105个靶细胞(例如,来自个体的癌细胞)范围内的抗体浓度下。
在一些情况下,抗体组合物与1x102或更多个靶细胞(例如,来自个体的癌细胞)(例如,1x103或更多个细胞、1x104或更多个细胞、1x105或更多个细胞或1x106或更多个细胞)接触。在一些情况下,抗体组合物与1x102至1x1010个细胞(1x102至1x108个细胞、1x103至1x107个细胞、1x104至1x106个细胞、5x104至5x105个细胞或1x105个细胞)范围内的靶细胞(例如,来自个体的癌细胞)接触。
在一些情况下,当抗体组合物与靶抗原(例如,来自个体的细胞)在接触APC(例如,DC)之前接触而因此产生免疫复合体时,免疫复合体可以与APC(例如,DC)接触。在一些这样的情况下,免疫复合体可以与APC(例如,DC)接触,其中免疫复合体的细胞(已经与抗体组合物接触的来自个体的细胞)是完整的;而在其他情况下,免疫复合体可以与APC(例如,DC)接触,其中免疫复合体的细胞(已经与抗体组合物接触的来自个体的细胞)已经被裂解,从而形成裂解物(即,免疫复合体裂解物)。
在其中靶抗原是细胞并且所述抗体组合物在接触APC(例如,DC)之前与靶抗原细胞接触(因此形成免疫复合体)和其中细胞保持完整的一些情况下,APC(例如,DC)可以与1x102或更多个免疫复合体细胞(例如,已经与所述抗体组合物接触的来自个体的癌细胞)(例如,1x103或更多个细胞、1x104或更多个细胞、1x105或更多个细胞或者1x106或更多个细胞)接触。在其中靶抗原是细胞并且所述抗体组合物在接触APC(例如,DC)之前与靶抗原细胞接触(因此形成免疫复合体)并且其中细胞保持完整的一些情况下,APC(例如,DC)可以与1x102至1x1010个细胞(1x102至1x108个细胞、1x103至1x107个细胞、1x104至1x106个细胞、5x104至5x105个细胞或1x105个细胞)范围内的大量免疫复合体细胞(例如,已经与所述抗体组合物接触的来自个体的癌细胞)接触。
在其中靶抗原是细胞并且所述抗体组合物在接触APC(例如,DC)之前与靶抗原细胞接触(因此形成免疫复合体)和其中细胞被裂解以产生裂解物免疫复合体的一些情况下,APC(例如,DC)可以与来自1x102或更多个免疫复合体细胞(例如,已经与所述抗体组合物接触的来自个体的癌细胞)(例如,1x103或更多个细胞、1x104或更多个细胞、1x105或更多个细胞或者1x106或更多个细胞)的裂解物(例如具有表面表达抗原的裂解物;未分级(unfractionated)裂解物;表面表达抗原(即质膜表达抗原)富集的裂解物;裂解物的膜富集部分;等等)接触。在其中靶抗原是细胞并且所述抗体组合物在接触APC(例如,DC)之前与靶抗原细胞接触(因此形成免疫复合体)和其中细胞被裂解以产生裂解物免疫复合体的一些情况下,APC(例如,DC)可以与1x102至1x1010个细胞(1x102至1x108个细胞、1x103至1x107个细胞、1x104至1x106个细胞、5x104至5x105个细胞或1x105个细胞)范围内的大量免疫复合体细胞(例如,已经与所述抗体组合物接触的来自个体的癌细胞)的裂解物接触。
在一些实施方式中,APC(例如,DC)同时与靶抗原和所述抗体组合物接触。在这样的情况下,如在上文中就其中靶抗原与抗体组合物在接触APC(例如,DC)之前接触的情况下所论述的相同浓度和细胞数量是适用的。
在一些实施方式中,同基因IgG(分离自靶抗原从其分离/获得的同一体的IgG抗体)可以用于负载APC(例如,DC)。通常,这不会发挥作用,因为该个体被认为不具有结合靶抗原的循环抗体。然而,如果来自个体的抗体可以“被迫”去结合靶抗原,那么产物(在本文中仍称为免疫复合体)可以用于负载APC(例如,DC)。例如,在一些情况下,同基因IgG抗体(例如,具有多克隆同基因IgG抗体的组合物)可以交联于靶抗原(在上文中描述)以产生免疫复合体。所产生的免疫复合体然后可以接触APC(例如,DC)(例如,同基因APC(例如,同基因DC),即来自提供该靶抗原和抗体的同一个体的APC(例如,DC))以负载APC(例如,DC)。
在一些情况下,方法包括验证已经被负载的APC(例如,DC)(即,验证负载APC(例如,负载DC)的存在)。测定APC(例如,DC)是否是负载APC(例如,负载DC)的任何便利方法都可以使用。例如,在一些情况下,APC(例如,DC)的形态单独指示APC(例如,DC)被负载。在一些情况下,MHCII(例如,HLA-DR)、CD40和/或CD86的上调指示APC(例如,DC)被负载。例如,在一些情况下,MHCII(例如,HLA-DR)和/或CD86的上调指示DC被负载。在一些情况下,CD40和/或CD86的上调指示DC被负载。例如,在接触DC(例如,与肿瘤抗原、抗体、包含多克隆抗体的组合物、树突状细胞刺激组合物或其任意组合)之后,共表达CD40和CD86的DC的分数(%)(有时称为“%CD40/CD86”)相对于接触前的分数或者相对于对照DC(例如,未以相同方式接触和/或具有相同组成的DC)中的分数的增大可以被认为指示DC被负载。(参见下文实施例部分)。
将T细胞与负载APC(例如,负载DC)接触。在一些实施方式中,T细胞与负载APC(例如,负载DC)接触。在接触过程中,负载APC(例如,负载DC)将抗原提呈给T细胞以产生接触的T细胞,并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。T细胞可以是CD4+ T细胞、CD8+ T细胞或者CD4+与CD8+ T细胞的组合。
T细胞与负载APC(例如,负载DC)接触可以是在体外或体内。因此,短语“接触T细胞”涵盖体外与体内接触二者。如果接触是在体内,负载APC(例如,负载DC)可以被施用于个体,然后APC(例如,DC)接触个体的内源性T细胞以诱导免疫应答。因此,“将个体的T细胞与负载APC接触”的步骤,例如“将个体的T细胞与负载DC接触”的步骤,当在体内进行时,可以在一些情况下写做“将负载DC引入到个体中”。例如,在一些情况下,所述方法包括:(a)将来自个体的APC(例如,DC)与(i)靶抗原和(ii)包含特异性结合靶抗原的同种IgG抗体的抗体组合物在对APC(例如,DC)摄取靶抗原有效的剂量下体外接触对APC(例如,DC)摄取靶抗原有效的一段时间,由此产生负载APC(例如,负载DC);和(b)将负载APC(例如,负载DC)引入到个体中。APC(例如,DC)可以如下文对于“施用细胞”所述被施用于个体。
在一些情况下,可以体内进行所述方法。在一些这样的情况下,接触是在体内,内源性APC(例如,内源性DC)在体内负载,并且负载APC(例如,负载DC)然后体内接触T细胞。因此,方法可以通过体内施用实施(例如,施用抗体组合物、与激活个体的APC(例如,DC)的疗法组合施用抗体组合物,例如,与包含APC刺激剂(例如,树突状细胞刺激剂)的APC刺激组合物(例如,树突状细胞刺激组合物)组合施用抗体组合物)。例如,内源性APC(例如,内源性DC(例如,TADC))可以通过将抗体组合物(如上所述)(例如,包含具有多种结合特异性的多克隆同种IgG抗体的组合物)施用于个体并且提供激活个体的APC(例如,DC(例如,TADC))的疗法(如下文所定义的)而体内负载。例如,激活个体的树突状细胞的疗法可以包括将包含树突状细胞刺激剂(例如,(i)Toll样受体(TLR)激动剂;(ii)CD40激动剂与促炎性细胞因子;(iii)检查点分子中和化合物;(iv)吲哚胺2,3-二加氧酶(IDO)抑制剂;(v)NFkB激活剂;(vi)打开钙通道的化合物;(vii)T细胞相关共刺激分子;或(viii)其组合)的树突状细胞刺激组合物施用于个体。负载后,负载的DC体内接触内源性T细胞。
在其中体内进行所述方法的一些实施方式中,内源性APC(例如,内源性DC(例如,TADC))可以通过与包含APC刺激剂(例如,树突状细胞刺激剂)的APC刺激组合物(例如,树突状细胞刺激组合物)组合将抗体组合物(如上所述)(例如,包含具有多种结合特异性的多克隆同种IgG抗体的组合物)施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与CD40激动剂(例如,CD40L)组合将抗体组合物(如上所述)(例如,包含具有多种结合特异性的多克隆同种IgG抗体的组合物)施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与CD40激动剂(例如,CD40L)和促炎性细胞因子(例如,TNFα和/或IFNγ)组合将抗体组合物(如上所述)(例如,包含具有多种结合特异性的多克隆同种IgG抗体的组合物)施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与(ii)CD40激动剂(例如,CD40L)和TNFα组合将(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与(ii)CD40激动剂(例如,CD40L)和IFNγ组合将(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与Toll样受体激动剂(例如,CpG ODN、聚肌苷酸:聚胞苷酸(“聚I:C”,TLR-3激动剂)等等)组合将抗体组合物(如上所述)(例如,包含具有多种结合特异性的多克隆同种IgG抗体的组合物)施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与(ii)Toll样受体激动剂组合将(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物施用于个体而体内负载。在一些情况下,内源性APC(例如,内源性DC(例如,TADC))可以通过与(ii)聚肌苷酸:聚胞苷酸组合将(i)包含具有多种结合特异性的多克隆同种IgG抗体的抗体组合物施用于个体而体内负载。负载后,负载APC(例如,负载DC(例如,TADC))然后可以体内接触内源性T细胞。
如果接触是在体外,那么来自个体的自体T细胞(例如,自体T细胞的群体)可以与负载APC(例如,负载DC)接触以产生接触的T细胞(例如,接触的T细胞的群体)。T细胞可以与负载APC(例如,负载DC)接触足以激活T细胞的一段时间使得T细胞在被施用于个体时诱导免疫应答。T细胞(在与负载APC(例如,负载DC)接触之前或之后)可以在被施用于个体之前体外扩增和/或修饰(例如,遗传修饰)。
在一些情况下,T细胞与负载APC(例如,负载DC)体外接触5分钟至24小时(例如,5分钟至18小时、5分钟至12小时、5分钟至8小时、5分钟至6小时、5分钟至4小时、5分钟至2小时、5分钟至60分钟、5分钟至45分钟、5分钟至30分钟、15分钟至18小时、15分钟至12小时、15分钟至8小时、15分钟至6小时、15分钟至4小时、15分钟至2小时、15分钟至60分钟、15分钟至45分钟、15分钟至30分钟、20分钟至18小时、20分钟至12小时、20分钟至8小时、20分钟至6小时、20分钟至4小时、20分钟至2小时、20分钟至60分钟、20分钟至45分钟、30分钟至18小时、30分钟至12小时、30分钟至8小时、30分钟至6小时、30分钟至4小时、30分钟至2小时、30分钟至60分钟、30分钟至45分钟、45分钟至18小时、45分钟至12小时、45分钟至8小时、45分钟至6小时、45分钟至4小时、45分钟至2小时、45分钟至60分钟、1小时至18小时、1小时至12小时、1小时至8小时、1小时至6小时、1小时至4小时、1小时至2小时或1小时至90分钟)范围内的一段时间。
在一些情况下,T细胞的群体(例如,1x102或更多个细胞(例如,1x103或更多个细胞、1x104或更多个细胞、1x105或更多个细胞、或者1x106或更多个细胞))与负载APC(例如,负载DC)(例如,负载APC(例如,负载DC)的群体;具有负载APC(例如,负载DC)的群体;等等)体外接触。在一些情况下,T细胞的群体(例如,在1x102至1x1010个细胞(1x102至1x108个细胞、1x103至1x107个细胞、1x104至1x106个细胞、5x104至5x105个细胞或1x105个细胞)范围内)与负载APC(例如,负载DC)(例如,负载APC(例如,负载DC)的群体;具有负载APC(例如,负载DC)的群体;等等)体外接触。在一些情况下,T细胞(例如,T细胞的群体)与具有负载APC(例如,负载DC)的细胞群体(例如,1x102或更多个细胞(例如,1x103或更多个细胞、1x104或更多个细胞、1x105或更多个细胞、或者1x106或更多个细胞))(例如,负载APC(例如,负载DC)的细胞群体)接触。在一些情况下,T细胞(例如,T细胞的群体)与具有负载APC(例如,负载DC)的细胞群体(例如,在1x102至1x1010个细胞(1x102至1x108个细胞、1x103至1x107个细胞、1x104至1x106个细胞、5x104至5x105个细胞或1x105个细胞)范围内)(例如,负载APC(例如,负载DC)的细胞群体)接触。
接触的T细胞(例如,接触的T细胞群体的细胞)可以如以下对于“施用细胞”所述被施用于个体。
在一些实施方式中,来自个体的自体APC(例如,自体DC)与所述APC刺激剂(例如,树突状细胞刺激剂)接触以产生刺激的APC(例如,刺激的DC);自体靶抗原(例如,来自个体的癌细胞)与所述抗体组合物接触以产生免疫复合体;并且刺激的APC(例如,刺激的DC)与免疫复合体在有效诱导刺激的APC(例如,刺激的DC)摄取靶抗原(例如,免疫复合体)的浓度下接触有效诱导刺激的APC(例如,刺激的DC)摄取靶抗原(例如,免疫复合体)的一段时间;由此产生负载APC(例如,负载DC);并且负载APC(例如,负载DC)与T细胞接触(如上文更详细描述的)以产生接触的T细胞;并且接触的T细胞产生对于被提呈的抗原特异性的免疫应答。
施用细胞和/或组合物。在一些情况下,细胞(例如,负载APC(例如,负载DC、负载巨噬细胞、负载B细胞)、APC(例如,DC、巨噬细胞、B细胞)和/或接触的T细胞)在移植(即,施用于个体)之前培养一段时间。细胞(例如,负载APC,如负载DC、负载巨噬细胞、负载B细胞;APC,如DC、巨噬细胞、B细胞;和/或接触的T细胞)可以单独或者与适合的基底或基质(例如,以支撑他们在被移植到的组织(例如,靶器官、肿瘤组织、血流等等)中生长和/或组织化(organization))一起提供给个体(即,施用到个体中)。在一些实施方式中,基质是支架(例如,器官支架)。在一些实施方式中,将施用1x103或更多个细胞,例如,5x103或更多个细胞、1x104或更多个细胞、5x104或更多个细胞、1x105或更多个细胞、5x105或更多个细胞、1x106或更多个细胞、5x106或更多个细胞、1x107或更多个细胞、5x107或更多个细胞、1x108或更多个细胞、5x108或更多个细胞、1x109或更多个细胞、5x109或更多个细胞、或者1x1010或更多个细胞。在一些实施方式中,所述细胞在微载体上被施用到个体中(例如,在可生物降解的微载体上生长的细胞)。
所述细胞(例如,负载APC(例如,负载DC、负载巨噬细胞、负载B细胞);APC(例如,DC、巨噬细胞、B细胞);和/或接触的T细胞)和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物);其组合)可以在任何生理学可接受赋形剂(例如,William's E培养基)中施用,在其中细胞可以找到存活和起作用(例如,器官重建)的适合位点。细胞和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物);其组合)可以通过任何便利方法(例如,注射、插导等等)引入。细胞和/或组合物可以被包封到脂质体或其他可生物降解构建体中。在一些情况下,(a)所述抗体组合物(例如,包含同种IgG抗体、抗体组合物的抗体等等)和(b)激活个体的APC(例如,DC)的疗法(例如,APC刺激剂(例如,DC刺激剂))中的一种或多种在脂质体、微粒或纳米颗粒中施用。
细胞和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物))可以经由下述途径中的任一种引入到受试者中(即,施用于个体):胃肠外、皮下(s.c.)、静脉内(i.v.)、颅内(i.c.)、脊柱内、眼内、皮内(i.d.)、肌内(i.m.)、淋巴管内(i.l.)或者施用到脊髓液中。细胞和/或组合物(例如,所述抗体组合物、所述树突状细胞刺激组合物)可以通过注射(例如,全身注射、直接局部注射、局部注射到肿瘤中或肿瘤附近和/或肿瘤切除位置中或肿瘤切除位置附近,等等)、插管等等引入。局部递送方法(例如,递送到肿瘤和/或癌症位置)的实例包括,例如通过推注注射(例如通过注射器)到例如关节、肿瘤或器官中或者关节、肿瘤或器官附近;例如通过连续输注(例如通过套管插入术),例如利用传递(参见,例如,美国申请号20070254842,在此通过引用并入);或者通过植入其上可逆地附着细胞的器械(参见,例如,美国申请号20080081064和20090196903,在此通过引用并入)。
在一些情况下,(a)所述抗体组合物(例如,包含同种IgG抗体、抗体组合物的抗体等等);和(b)激活个体的APC(例如,DC)的疗法(例如,APC刺激剂(例如,DC刺激剂))中的一种或多种通过局部注射到肿瘤中或肿瘤附近和/或肿瘤切除位置中或肿瘤切除位置附近而被施用。在一些情况下,(a)所述抗体组合物(例如,包含同种IgG抗体、抗体组合物的抗体等等);和(b)激活个体的APC(例如,DC)的疗法(例如,APC刺激剂(例如,DC刺激剂))中的一种或多种通过在脂质体、微粒或纳米颗粒中局部注射到肿瘤中或肿瘤附近和/或肿瘤切除位置中或肿瘤切除位置附近而被施用。
对受试者施用治疗的次数可以变化。将细胞和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物))引入到个体中可以是一次性事件;但在某些情况下,这样的治疗可以引起有限的一段时间的改善而需要持续的一系列重复疗法。在其他情况下,在观察到效果之前可能需要多次施用细胞和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物))。如本领域技术人员将容易理解的,准确的方案取决于被治疗个体的疾病或病情、疾病阶段和参数。
“治疗有效剂量”或“治疗剂量”是足以实现期望临床结果(即,实现治疗效力)的量。治疗有效剂量可以在一次或多次施用中施用。出于本公开的目的,细胞(例如,负载APC(例如,负载DC);接触的T细胞;等等)和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物))的治疗有效剂量是在施用于个体(即,移植到个体中)时足以通过例如诱导对抗抗原性细胞(例如,癌细胞)的免疫应答而减轻、改善、稳定、逆转、预防、减缓或延迟疾病状态进展(例如,肿瘤大小、肿瘤生长、肿瘤存在、癌症存在等等)的量。
在一些实施方式中,细胞(例如,负载APC(例如,负载DC);接触的T细胞;等等)的治疗有效剂量是1x103或更多个细胞(例如,5x103或更多、1x104个细胞、5x104或更多、1x105或更多、5x105或更多、1x106或更多、2x106或更多、5x106或更多、1x107个细胞、5x107或更多、1x108或更多、5x108或更多、1x109或更多、5x109或更多、或者1x1010或更多)。
在一些实施方式中,细胞的治疗有效剂量在1x103个细胞至1x1010个细胞(例如,5x103个细胞至1x1010个细胞、1x104个细胞至1x1010个细胞、5x104个细胞至1x1010个细胞、1x105个细胞至1x1010个细胞、5x105个细胞至1x1010个细胞、1x106个细胞至1x1010个细胞、5x106个细胞至1x1010个细胞、1x107个细胞至1x1010个细胞、5x107个细胞至1x1010个细胞、1x108个细胞至1x1010个细胞、5x108个细胞至1x1010、5x103个细胞至5x109个细胞、1x104个细胞至5x109个细胞、5x104个细胞至5x109个细胞、1x105个细胞至5x109个细胞、5x105个细胞至5x109个细胞、1x106个细胞至5x109个细胞、5x106个细胞至5x109个细胞、1x107个细胞至5x109个细胞、5x107个细胞至5x109个细胞、1x108个细胞至5x109个细胞、5x108个细胞至5x109、5x103个细胞至1x109个细胞、1x104个细胞至1x109个细胞、5x104个细胞至1x109个细胞、1x105个细胞至1x109个细胞、5x105个细胞至1x109个细胞、1x106个细胞至1x109个细胞、5x106个细胞至1x109个细胞、1x107个细胞至1x109个细胞、5x107个细胞至1x109个细胞、1x108个细胞至1x109个细胞、5x108个细胞至1x109、5x103个细胞至5x108个细胞、1x104个细胞至5x108个细胞、5x104个细胞至5x108个细胞、1x105个细胞至5x108个细胞、5x105个细胞至5x108个细胞、1x106个细胞至5x108个细胞、5x106个细胞至5x108个细胞、1x107个细胞至5x108个细胞、5x107个细胞至5x108个细胞、或1x108个细胞至5x108个细胞)范围内。
在一些实施方式中,所施用的细胞(例如,负载APC(例如,负载DC);接触的T细胞;等等)的浓度在1x105个细胞/ml至1x109个细胞/ml(例如,1x105个细胞/ml至1x108个细胞/ml、5x105个细胞/ml至1x108个细胞/ml、5x105个细胞/ml至5x107个细胞/ml、1x106个细胞/ml至1x108个细胞/ml、1x106个细胞/ml至5x107个细胞/ml、1x106个细胞/ml至1x107个细胞/ml、1x106个细胞/ml至6x106个细胞/ml、或2x106个细胞/ml至8x106个细胞/ml)范围内。
在一些实施方式中,所施用的细胞(例如,负载APC(例如,负载DC);接触的T细胞;等等)的浓度是1x105个细胞/ml或更多(例如,1x105个细胞/ml或更多、2x105个细胞/ml或更多、3x105个细胞/ml或更多、4x105个细胞/ml或更多、5x105个细胞/ml或更多、6x105个细胞/ml或更多、7x105个细胞/ml或更多、8x105个细胞/ml或更多、9x105个细胞/ml或更多、1x106个细胞/ml或更多、2x106个细胞/ml或更多、3x106个细胞/ml或更多、4x106个细胞/ml或更多、5x106个细胞/ml或更多、6x106个细胞/ml或更多、7x106个细胞/ml或更多、或8x106个细胞/ml或更多)。
本公开的细胞和/或组合物(例如,所述抗体组合物;所述APC刺激组合物(例如,树突状细胞刺激组合物))可以以在足够无菌的条件下制备的包含等渗赋形剂的药学组合物的形式供应用于人施用。对于药物配制的一般原则,读者参考Cell Therapy:Stem Cell Transplantation,Gene Therapy,and Cellular Immunotherapy,by G.Morstyn&W.Sheridan eds,Cambridge University Press,1996;和Hematopoietic Stem Cell Therapy,E.D.Ball,J.Lister&P.Law,Churchill Livingstone,2000。组合物的细胞赋形剂和任何相伴成分的选择将根据用于施用的途径和装置而适应。组合物还可以包含或者伴随着促进细胞移植或功能性移动的一种或多种其他成分。适合的成分包括支持或促进细胞粘附的基质蛋白或者互补性细胞类型。
所述方法的细胞(例如,APC(例如,DC);负载APC(例如,负载DC);T细胞;接触的T细胞;等等)可以被遗传修饰以增强存活、控制增殖等等。细胞可以通过用适合载体转染或转导、同源重组或者其他适合技术进行遗传改造,使得它们表达感兴趣的基因。在一些实施方式中,引入选择标记以提供更高纯度的期望细胞。
对于可用于实施本公开的一般技术的进一步阐述,实施者可以参考细胞生物学、组织培养和胚胎学方面的标准课本和综述。关于组织培养和干细胞,读者不妨参考Teratocarcinomas and embryonic stem cells:A practical approach(E.J.Robertson,ed.,IRL Press Ltd.1987);Guide to Techniques in Mouse Development(P.M.Wasserman et al.eds.,Academic Press 1993);Embryonic Stem Cell Differentiation in Vitro (M.V.Wiles,Meth.Enzymol.225:900,1993);Properties and uses of Embryonic Stem Cells:Prospects for Application to Human Biology and Gene Therapy(P.D.Rathjen et al.,Reprod.Fertil.Dev.10:31,1998)。
试剂盒
还提供的是用于所述方法的试剂盒。所述试剂盒包括用于实施所述方法的组分和组合物的任意组合。在一些实施方式中,试剂盒可以包括下述:所述抗体组合物(如上文详细描述的,例如,同种IgG抗体、2种或更多种同种IgG抗体的组合物等等);APC刺激组合物(例如,树突状细胞刺激组合物)(如上文详细描述的,包含,例如,APC刺激剂(如,树突状细胞刺激剂、巨噬细胞刺激剂、B细胞刺激剂);缀合到IgG抗体的APC刺激剂(如,缀合到IgG抗体的树突状细胞刺激剂、缀合到IgG抗体的巨噬细胞刺激剂、缀合到IgG抗体的B细胞刺激剂);等等);用于APC(例如,DC)和/或T细胞的分离、培养、存活或施用的组分;用于接触APC(例如,DC)的试剂(例如,缓冲剂);用于接触T细胞的试剂(例如,缓冲剂);用于将靶抗原与所述抗体组合物接触以产生免疫复合体的试剂(例如,缓冲剂);及其任意组合。
在一些实施方式中,所述试剂盒包括在验证步骤(例如,验证APC(例如,DC)是负载APC(例如,负载DC))中使用的分析试剂(例如,用于检测HLA-DR的抗体、用于检测CD84的抗体等等)。
在一些实施方式中,试剂盒包括(i)包括包含结合癌细胞抗原的同种IgG抗体的抗体组合物的隔室;和(ii)包括至少一种APC刺激组合物的至少一个隔室,其中APC刺激组合物是树突状细胞刺激组合物、巨噬细胞刺激组合物或B细胞刺激组合物。
除上述组分外,所述试剂盒还可以包括(在某些实施方式中)用于实施所述方法的说明书。这些说明书可以以多种形式存在于所述试剂盒中,其中的一种或多种可以存在于试剂盒中。这些说明书可以呈现的一种形式是作为试剂盒包装、包装插入物等等中的适合介质或基底(例如,其上印有信息的一张或多张纸)上的打印信息。这些说明书的又一种形式是其上已经记录信息的计算机可读介质,例如,磁盘、光盘(CD)、闪存等等。这些说明书可以呈现的又一种形式是可以经由因特网使用以在移动位置获取信息的网站地址。
实施例
提出以下实施例以便给本领域技术人员提供如何完成和使用本发明的完整公开和描述,而非旨在限制本发明人视为其发明的范围,他们也不旨在表示下文实验是全部的或仅有的所进行的实验。已经做出了努力以确保所用数字(例如,量、温度等等)的准确性,但是一些实验误差和偏差应被考虑到。除非另行说明,否则份数是重量份、分子量是重均分子量、温度是摄氏度和压力是大气压或接近大气压。可以使用标准缩写,例如,室温(RT);碱基对(bp);千碱基(kb);皮升(pl);秒(s或sec);分钟(m或min);小时(h或hr);天(d);周(wk或wks);纳升(nl);微升(ul);毫升(ml);升(L);纳克(ng);微克(ug);毫克(mg);克((g),在质量语境中);千克(kg);重力的等同物((g),在离心语境中);纳摩尔(nM);微摩尔(uM);毫摩尔(mM);摩尔(M);氨基酸(aa);千碱基(kb);碱基对(bp);核苷酸(nt);肌肉内(i.m.);腹膜内(i.p.);皮下(s.c.);等等。
实施例1
材料和方法
小鼠
129S1/SvlmJ小鼠、C57Bl/6WT小鼠、CD-1远系繁殖小鼠、Balb/c、GFP转基因小鼠[C57BL/6-Tg(UBC-GFP)30Scha/J]和发生可诱导黑色素瘤的小鼠(B6.Cg-Braftm1Mmcm/Ptentm1HwuTg(Tyr-cre/ERT2)13Bos/BosJ)购自Jackson Laboratory(Bar Harbor,Maine)并就地繁殖。FcγR-/-(B6.129P2-Fcer1gtm1Rav)小鼠购自Taconic(Germantown,NY)。小鼠随机分组,之后分配治疗条件。所有小鼠都在American Association for the Accreditation of Laboratory Animal Care认证的动物设施中饲养。所有方案都根据协议APLAC-17466由Stanford University Institutional Animal Care and Use Committee批准。
细胞系
抗CD4(GK1.5)和抗CD8(2.43)杂交瘤、人细胞系MCF7和PANC-1以及小鼠系B16F10(黑色素瘤)、4T-1、LL/2(Lewis肺癌)和RMA(淋巴瘤)均购自ATCC。LMP胰腺肿瘤细胞分离自KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre小鼠,如所描述的13。细胞在标准条件下在补充有10%热灭活FCS、2mM L-谷氨酰胺、100U/mL青霉素和100μg/mL链霉素(Gibco)的DMEM(Gibco,Carlsbad,CA)中培养。
小鼠DC亚组的制备和体外研究
BM单核细胞使用鼠单核细胞富集试剂盒(Stem Cell Technologies,Vancouver Canada)负向选择,并且用FACS Aria II(BD Biosciences)分选FSClo/SSClo/Gr1hi/CD115hi/MHCIIneg细胞。单核细胞在50ng/ml GM-CSF(PeproTech)的存在下培养4-5天以产生DC。对于TADC,肿瘤在含有5mg/mL胶原酶IV和0.01mg/mL DNase I(Sigma)的Hank平衡盐溶液(HBSS,Gibco)中消化。将细胞施加到Ficoll梯度上并用CD11b+选择试剂盒(StemCells)磁富集,且通过FACS分选Gr1neg/CD11c+/MHCII+细胞。在一些实验中,用50ng/mLTNFα(PeproTech)和500ng/mL CD40L(PeproTech)重组小鼠蛋白激活TADC。
人DC的制备和体外研究
来自匹配的健康供体的新鲜BM抽吸物和外周血的单核细胞购自AllCells(Alameda,CA)。10cm长的肋骨和6mL血液获得自经历恶性胸膜间皮瘤切除的2位患者。研究方案由Stanford’s Institutional Review Board批准,并从所有受试者获得知情同意书。为了产生BMDC,然后用PBS冲洗骨,并且在Ficoll梯度上分离单核细胞。对于健康和肿瘤患者二者,用磁珠(Miltenyi)富集CD34+细胞并且在补充有50ng/mL GM-CSF和20ng/mL IL-4(PeproTech)的IMDM(Gibco)中培养9-12天。对于血液来源的DC,用磁珠(Miltenyi)从血液单核细胞富集CD14+细胞并且在补充有50ng/mL GM-CSF和20ng/mL IL-4(PeproTech)的IMDM(Gibco)中培养7天。在其他研究中,用50ng/mL人TNFα(PeproTech)和1μg/mL CD40L(PeproTech)过夜处理从I期肺癌患者获得的血液来源的DC。
流式细胞术
对于细胞表面染色,使用缀合到FITC、PE、PE-Cy7、PE-Cy5.5、APC-Cy7、eFluor650或PacificBlue并且对于以下抗原特异性的单克隆抗体:来自BioLegend(SanDiego,CA)的CD11b(M1/70)、Gr-1(RB6-8C5)、F4/80(BM8)、B220(RA3-6B2),和来自eBioscience(SanDiego,CA)的CD115(AFS98)、CD80(16-10A1)、I-Ab(AF6-120.1)、CD40(1C10)、CD86(GL1)和CD40L(MR1)。对于蛋白质磷酸化特异性的流式细胞术,细胞在具有或不具有IC的情况下激活5、15或30min并用1.8%低聚甲醛固定15min。用含有2%FCS的PBS洗涤2次细胞并在4℃下用95%甲醇孵育20min。对抗磷酸-p38MAPK(Thr180/Tyr182)、磷酸-Akt(Thr308)和磷酸-c-Jun(Ser63)的缀合抗体购自Cell Signaling,且对抗磷酸-ERK1/2(p44)(pT202/pY204)的缀合抗体购自BD Biosciences(San Jose,CA)。对于肿瘤结合IgM和IgG,PE缀合抗小鼠IgM(RMM-1)、抗小鼠IgG(Poli4052)和抗人IgG(HP6017)购自BioLegend。在LSRII(BD Biosciences)上进行流式细胞术,并用FlowJo软件(Tree Star,Inc.)分析数据集。
细胞因子测量
细胞以1x106细胞/mL接种,并且在具有或不具有肿瘤免疫复合体或者LPS(Sigma)的情况下培养12h。按照生产商说明书(R&D Systems,Minneapolis,MN),通过ELISA测量上清液中的TNFα、IFNγ和IL-12(p40/p70)。
IgG和IgM纯化和测量
通过在AKTA Explorer/100Air(GE Healthcare)上的液相色谱从合并的5mL 20-24周龄小鼠血清获得小鼠抗体。分别用蛋白-G和2-巯基吡啶柱(GE Healthcare)纯化总小鼠IgG和IgM。按照生产商说明书,用特异性ELISA试剂盒(Bethyl,Montgomery,TX)测量纯化IgG和IgM的水平。
制备抗体-肿瘤裂解物免疫复合体(Ig-IC)和抗体结合的肿瘤细胞
肿瘤细胞固定在2%低聚甲醛中,用CFSE染色并大量冲洗。对于手术切除,肿瘤最初在酶消化后分离并分选为FSChi/CD45neg细胞,之后固定并染色。为了获得Ig-IC,肿瘤细胞在冰上用1μg同基因或同种IgG或IgM/1x105肿瘤细胞孵育30min。细胞然后洗掉过量抗体并且原样使用,或者进一步用非变性裂解缓冲剂破坏以获得Ig-IC。
膜蛋白提取
对于天然膜蛋白提取,肿瘤悬浮在SEAT缓冲液(pH 7.4,250mM蔗糖,10mM三乙醇胺,1mM EDTA,10mM乙酸,蛋白酶抑制剂混合物I-Sigma)中,并在杜恩斯匀浆器中匀浆。裂解物在4℃下以900g旋转5min两次,并且上清液转移到新鲜管中并在4℃下以100,000xg旋转1h。膜球粒重悬到H2O中,并且在一些实验中,在使用前变性或去糖基化。对于变性膜蛋白提取,膜球粒重悬到500μl辐射-免疫-沉淀试验缓冲液(RIPA,Sigma)中并用25G针头注射器裂解。裂解物在4℃下孵育1h,并在4℃下以100,000xg旋转30min。收集含有洗涤剂增溶膜蛋白的上清液并在95℃下煮沸5min。按照生产商说明书,使用商业试剂盒(New England Biolabs,Ipswich,MA)进行膜蛋白的去糖基化。
体内肿瘤模型
对于肿瘤转移研究,在右侧腹上皮下(s.c.)注射1x105个LMP或B16肿瘤细胞,并用卡尺每周两次测量肿瘤发展。在一些实验中,按照生产商说明书(Invitrogen),用25μM CFSE标记肿瘤细胞。对于预防性免疫,小鼠相隔7天皮下注射2x106个负载肿瘤裂解物或IC的DC或单核细胞两次。对于肿瘤复发研究,在右侧腹上皮下注射2x105个肿瘤细胞,并使用卡尺测量生长肿瘤的大小。当肿瘤对于LMP达到45-55mm2而对于B16达到12-16mm2时,麻醉小鼠并手术移除肉眼可见的肿瘤。切除的肿瘤在PBS中用0.1mg/mL DNase I(Sigma)和5mg/mL胶原酶IV(Sigma)酶促消化。细胞然后在2%低聚甲醛中固定20min,在PBS中充分冲洗,并且与或不与纯化小鼠抗体一起添加到DC亚组。在过夜孵育后,洗涤细胞,并将2x106个皮下注射到肿瘤切除小鼠。在一些实验中,与200μg小鼠IgG组合的200ng TNFα(Peprotech)和1μg CD40L、CD28、OX-40(R&D)、2μg LPS或200μg聚I:C(Invivogen)在2个周期中被直接注射到肿瘤中,每周期连续2天,间隔1周。对于转移实验,将1x105个4T-1细胞注射到同基因Balb/c小鼠的乳腺脂肪垫中。在16天后,一旦肿瘤转移到引流淋巴结中,原发肿瘤结节用源自CD-1小鼠的IgG与TNFα和CD40L一起注射3次(间隔2天)。
体内细胞耗竭
通过在肿瘤接种前3天以及此后每3天,分别腹膜内(i.p.)注射500μg/小鼠GK1.5(抗CD4)和2.43(抗CD8)单克隆抗体实现CD4+和CD8+ T细胞的耗竭。对于B细胞耗竭,在肿瘤接种前5天和2天以及此后每3天,腹膜内注射300μg/小鼠抗CD19和300μg/小鼠抗B220(BioXcell,West Lebanon,NH)。对于NK细胞耗竭,在相对于肿瘤挑战的第-2、0、4和8天对小鼠腹膜内注射50μl抗去唾液酸GM1多克隆抗体(Wako Chemicals Richmond,VA)或者200μg抗NK1.1PK136(BioXCell)。个体小鼠在第0、7、14和21天取血,并通过流式细胞术测定NK1.1+/CD3εneg细胞的水平以确认耗竭。
过继转移
在肿瘤挑战前一天并且伴随肿瘤注射再一次,小鼠静脉内注射1mg/小鼠的同基因或同种IgG或IgM。对于T细胞转移,使用鼠富集试剂盒(Stem Cell Technologies)负向地选择CD4+和CD8+ T细胞,并且在肿瘤挑战前一天将5x106个细胞静脉内注射到受体小鼠。在转移之前,如下富集肿瘤相关细胞亚组:通过在磁珠(Miltenyi)上富集MHCII+细胞而分离TADC,随后通过FACS分选Gr1neg/CD11c+/CD64dull。用CD11b+磁珠(Miltenyi)富集肿瘤巨噬细胞(TAM),接着分选Gr1neg/CD64hi细胞。用CD19+磁珠(Miltenyi)富集B细胞。用NK1.1+磁珠(Miltenyi)富集NK细胞,并用c-kit+磁珠(Miltenyi)富集肥大细胞。对于每个细胞亚组,在用4x104个B16肿瘤细胞挑战前3天,将2x106个细胞皮下注射到原始小鼠中。
T细胞增殖
3x104个DC与来自LMP-或B16-免疫小鼠的脾的3x105个MACS富集CD4+ T细胞(Miltenyi,Germany)共培养。6天后,细胞用3H-胸苷(1μCi/孔)脉冲并再培养18h,之后在收获器400(Tomtec)中收获。通过1450MicroBeta计数器(LKB Wallac)测量放射性。
免疫荧光
DC或单核细胞在玻璃底培养板(In Vitro Scientific)上与CFSE标记肿瘤细胞并且在具有或不具有抗体的情况下过夜孵育。细胞用PBS(Gibco)轻轻洗涤,用2%低聚甲醛固定20min并用0.5%皂苷(Sigma)透化。样品用10%非免疫性山羊血清封闭,并用Alexa-缀合抗体IgG和IgM(Invitrogen 1:100)以及抗小鼠I-Ab(Biosciences,1:100)染色。
免疫组织化学
样品在4%低聚甲醛中固定,在20%蔗糖溶液中平衡并且包埋在冷冻组织基质(Tissue-Tek OCT,Torrance,CA)中。片切割成5μm,用10%非免疫性山羊血清封闭,并用Alexa-缀合兔抗CD4(RM4-5,eBioscience,1:100)、抗CD8β(YTS156.7.7BioLegend,1:100)、山羊抗小鼠IgG(Invitrogen 1:100)和抗小鼠IgM(II/41eBioscience,1:100)染色。在蔡司激光扫描共焦显微镜下检查切片。使用蔡司700共焦激光扫描显微镜收集图像,并使用ZEN软件(Carl Zeiss Microscopy)分析。
统计
选择样本大小使得可以使用适当的统计检验(例如,ANOVA)与从此前报告的研究近似的误差获得统计显著性。在Prism(GraphPad Software,Inc.)中进行无参数曼-惠特尼U检验以分析实验数据,除非另有说明。通过取反双曲线正弦(arcsinh)对磷酸化特异性流式细胞分析数据进行转换,并且比率相对于如此前描述(Irish等人,PNAS,2010)的相应基线(未刺激的)值获取。未进行盲法实验。未从分析中排除样本。P值表示实验值与对照(CT)值之间的差异的显著性。*p<0.05;**p<0.01。误差条代表+/-SEM。
结果
为了研究同种异基因肿瘤排斥的细胞学基础,比较了MHC匹配但在其他方面遗传学不同的C57Bl和129S1小鼠中对肿瘤的免疫应答(在图1a中说明)。B16黑色素瘤细胞在同基因C57Bl/6宿主中连续扩增,但在同种异基因129S1宿主中自发消退(图1b)。相反地,从KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre小鼠13分离的LMP胰腺肿瘤细胞在129S1小鼠中稳定生长,但在C57Bl/6动物中自发消退(图1b)。在两种模型中,NK细胞的耗竭不阻止肿瘤排斥(图5a)。相反,宿主T细胞在同种异基因肿瘤排斥中起到必不可少的作用,因为同种异基因肿瘤接种之前的CD4+或CD8+ T细胞的耗竭阻止了肿瘤消退(图1b)。T细胞增殖和同种异基因肿瘤的浸润在约1周时开始并且在10-12天时达到顶峰(图1c和图5b)。此外,同种异基因肿瘤比同基因肿瘤含有更多的成熟髓性DC(mDC;Gr1neg/CD11b+/CD11c+/MHCII+/CD64dim)和更少的未成熟髓性细胞(iMC;Gr1hi/CD11bhi/MHCIIneg/lo)(图1d)。而且,同种异基因肿瘤中的DC比同基因肿瘤中的DC表达更高水平的MHCII、CD86和CD40,反映出更高活化的表型(图5c)。在用CFSE标记的同种LMP细胞接种动物后,mDC还内化肿瘤细胞来源的分子,表明它们可能在这些条件下加工和提呈肿瘤相关抗原(图1e)。然而,与同种异基因肿瘤细胞共培养相对于同基因DC诱导了很少或者没有DC激活和肿瘤抗原摄取,且没有差别反应(图1f、图5d),证明体内存在的另外因素是促进有效的肿瘤抗原内化和DC激活所需要的。
由于抗体可以促进DC通过Fc受体介导的免疫复合体(IC)胞吞而摄取抗原,测试了肿瘤结核抗体的存在。在T细胞出现前(图1c),IgM和IgG抗体在接种肿瘤后24小时内结合同种异基因肿瘤细胞但不结合同基因肿瘤细胞(图1g-i)。而且,在培养物中,同种抗体结合的肿瘤细胞在培养中明显比同基因抗体更有效(图5e)。为了评估抗体在肿瘤排斥中的潜在作用,耗竭同种异基因宿主的B细胞。一旦循环IgG和IgG水平分别降低到180和10μg/mL以下,用同种异基因肿瘤挑战小鼠。B细胞耗竭相对于未处理宿主加快了肿瘤发展并且延迟或阻止了肿瘤排斥(图1j)。而且,同种IgG但非同种IgM的过继转移使得能够排斥同基因肿瘤(图1k和图5f)。这种作用在Fcγ受体(FcγR)缺陷小鼠中几乎被完全取消(图1k)。这些结果表明了同种抗体依赖性信号传导在诱导肿瘤根除性免疫应答方面的关键作用。
为了研究这些抗体对于DC的肿瘤摄取的作用,完整肿瘤细胞或肿瘤裂解物与同基因或同种抗体一起孵育以形成免疫复合体(IC),并将它们加入到骨髓来源(BM)DC(图2a)。只有与同种IgG抗体(同种IgG-IC)或同种IgM抗体(同种IgM-IC)形成的IC诱导了BMDC激活和肿瘤来源蛋白质的摄取(图2b-d)。共焦成像揭示了非常接近于MHCII分子的肿瘤蛋白(图2e),并且与同种IgG-IC一起孵育的BMDC诱导了明显的T细胞增殖(图2f),证明肿瘤抗原被加工和提呈。
为了确定这些免疫激活的机械原则是否可以引起对同基因肿瘤(源自相同小鼠品系)的抗肿瘤免疫应答,同基因宿主用B16或LMP细胞皮下接种,并且在肿瘤达到45-55mm2时移除肿瘤,留下约2mm的肉眼可见无肿瘤边缘。从切除的肿瘤制备IgG-IC或IgM-IC并与同基因BMDC一起过夜孵育,其随后皮下注射到相应肿瘤切除小鼠中(图2g)。几乎所有用负载同种IgG-IC的同基因DC治疗的小鼠都维持无肿瘤至少12个月(当实验终止时)(图2h)。仅负载同种IgG-IC的BMDC足以完全阻止肿瘤再生长,因为其他动物在30天内经历肿瘤复发(图2h)。负载同种IgG-IC的DC激活T细胞并保护小鼠免于肿瘤复发的能力在缺乏FcγR的DC中被完全取消(图6a-2c)。而且,脾CD4+或CD8+ T细胞从同种IgG-IC治疗的动物过继转移到原始小鼠中阻止了皮下肿瘤的生长(图6d-2e),证明已经引发了有效的肿瘤特异性T细胞应答。
被同种IgG识别的B16抗原的性质接下来通过在IC形成和BMDC接种之前修饰B16细胞或者吸收同种IgG的部分而进行研究。虽然除去聚糖残基几乎没有作用,但是使肿瘤蛋白变性消除了治疗益处(图6f)。而且,从膜结合B16蛋白形成的IC阻止了肿瘤复发,而从其他亚细胞蛋白部分形成的IC不能阻止肿瘤复发(图6f)。预先吸收抗与肿瘤同基因的正常皮肤、胰和脾细胞的同种IgG消除了它们的治疗益处,而吸收抗与抗体同基因的相似细胞的同种IgG则否(图6g)。此外,来自无菌小鼠的同种IgG诱导肿瘤免疫(图6h),表明响应于微生物而产生的IgG不是所需要的。这些数据表明同种IgG的保护效应依赖于抗体对可能在正常细胞上表达的B16膜蛋白的结合。
抗体的结合,而非所结合的抗原的身份,可能对于诱导肿瘤根除性免疫应答是必不可少的。与这种观点一致,通过同基因IgG共价交联到B16膜蛋白上形成的IC在与BMDC一起孵育后仍然赋予治疗益处(图6i)。而且,使用抗MHC-1(同种IgG-IC供体与C57Bl/6宿主共有的抗原)的单克隆抗体形成的IC足以在与BMDC一起孵育之后保护动物(图6j)。总的来看,这些数据证明了这种治疗策略的关键要素是IgG结合到肿瘤细胞表面而非所结合的抗原的特定身份或者IgG的来源。
用同种IgG-IC激活的BMDC的效力表明同种IgG直接注射到同基因肿瘤中也可能诱导肿瘤消退。然而,当同种IgG被注射到在自体宿主中生长的B16或LMP肿瘤中时,只观察到较小的效果(图3a)。为了解析这种明显的差异,获得了肿瘤相关DC(TADC)(图7a),并将这些细胞与肿瘤裂解物或同种IgG-IC一起培养。与BMDC相反,TADC不显示激活(图3b-d和图7b)并且对肿瘤复发无作用(图3e)。为了理解为什么TADC未能响应同种IgG-IC,研究了已知在FcγR刺激时被激活的细胞信号传导途径。用同种IgG-IC激活时,在BMDC中观察到强p38、ERK1/2和JNK磷酸化。相反,TADC未能展示出这些MAP激酶的磷酸化(图3f)。由于Fcγ受体在TADC上的表达模式与BMDC的相似,并且已知多种免疫刺激诱导DC中的MAPK激活,测试了这样的刺激对于TADC对同种IgG-IC的反应的作用。加入聚I:C、TNFα+CD40L或IFNγ+CD40L使得能够激活TADC以及摄取同种IgG-IC(图3g和图7c-3d)。
随后测试了与这些刺激之一组合的同种IgG是否可以原位诱导对同基因肿瘤的免疫应答。用B16细胞接种原始C57Bl/6小鼠,并允许肿瘤生长直到它们达到18-25mm2。与TNFα+CD40L或聚I:C组合的同种IgG肿瘤内注射诱导了完全的肿瘤消除(图4a和图8a-b)。类似的结果也在用Lewis肺癌(LL/2)挑战的小鼠中获得(图8c)。
为了评估哪些细胞类型在这些条件下响应IgG,用藻红蛋白共价标记同种IgG并肿瘤内注射。可能的是介导同种IgG的治疗效果的细胞在富有成效的抗肿瘤免疫应答的存在下(同种IgG+TNFα+CD40L)比不存在这样的应答的情况(单独的同种IgG)表现出更大的对同种IgG的结合。虽然未成熟髓性细胞(SSClo/Gr1hi/CD11bhi)和巨噬细胞(CD11b+/Gr1neg/F480+/MHCII+/CD64hi)在这两种情形中程度相似地结合IgG,但只有mDC(CD11b+/Gr1neg/CD11c+/MHCII+/CD64dull)和cDC(CD11bneg/CD11chi/MHCII+)在有效的抗肿瘤免疫应答期间明显增加它们的IgG结合(图4b和图8d)。而且,来自经治疗B16肿瘤的浸润免疫细胞的分析显示了肿瘤位置处DC的明显激活(图4c)和DC迁移到引流淋巴结中(图8e)。此外,TADC过继转移到原始小鼠中赋予了针对后续的B16挑战的完全保护(图4d),证明这些DC足以介导有效的抗肿瘤免疫。相反,来自同样的经治疗小鼠的巨噬细胞的过继转移只有轻微的保护效果,而B细胞、NK细胞和肥大细胞没有效果(图8f)。总的来说,这些结果指出了DC在介导同种IgG抗体的治疗作用方面的关键且充分的作用。
这种治疗策略接下来在通过突变的Braf(V600E)和Pten18的缺失驱动的侵袭性遗传工程化小鼠黑色素瘤模型中测试。在肿瘤诱导28天后,小鼠肿瘤内注射同种IgG+TNFα+CD40L。在未治疗小鼠在3周内发展出80-155个肿瘤的同时,经治疗小鼠不仅在被注射的肿瘤中而且还在远端的位置经历了持续超过8周的完全响应(图4e)。为了评估这些全身性响应是否可扩展到转移瘤,携带原位4T1乳腺肿瘤的动物在第16天通过注射其原发肿瘤进行治疗,并且在第30天测试对于肺转移瘤的作用。在治疗时,当肿瘤扩散到引流淋巴结中并且容易地观察到肺微转移时,所有小鼠都具有指示肿瘤扩散的可触知的肿瘤-引流淋巴结。只有使用同种IgG+TNFα+CD40L的治疗导致了几乎可见的转移瘤以及原发肿瘤的完全解决(图4f-g)。肺的组织学分析指示40%的小鼠中肿瘤完全消退,并且少数剩余的微转移被白细胞严重浸润(图4g和图8g)。总的来说,这些结果证明通过肿瘤结合抗体激活DC启动了有效且全身性的抗肿瘤免疫应答。
为了评估这些发现的临床相关性,测试了同种IgG、TNFα和CD40L是否可以诱导人TADC的肿瘤摄取和成熟。来自两位人类I期肺癌患者的肿瘤的CD11c+/MHCII+细胞与用涂覆自身IgG或者来自10位健康供体的合并同种IgG的自体肿瘤细胞一起孵育。加入TNFα+CD40L使得这些DC能够内化同种IgG-IC并且同时诱导CD40和CD86的明显上调,指示激活(图4h和图8h)。这些数据表明肿瘤-同种IgG IC激活DC的机制在物种之间是保守的。然后测试了负载同种IgG-IC的DC是否能够激活患者自身的CD4+ T细胞。来自具有恶性胸膜间皮瘤的2位人类患者的BMDC与单独的自体肿瘤裂解物一起孵育、与自体IgG组合孵育或者与来自健康供体的合并同种IgG组合孵育。在两位患者中,只有与合并的同种IgG-IC而非与自体IgG-IC一起孵育的BMDC表现出明显的激活,从而上调HLA-DR表达和驱动从相应患者收集的CD4+ T细胞的增殖(图4i)。
在过去二十年中,抗体在肿瘤进展过程中的作用已经成为了争论的源头。本文呈现的数据证明,虽然TADC并非天然响应于IgG-IC,但是加入特定刺激使得它们能够驱动肿瘤根除性免疫。本文呈现的数据证明,提呈肿瘤抗原,接着是抗体介导的DC摄取,足以启动有效的、全身性的抗肿瘤的T细胞介导免疫应答。而且,这项工作表明免疫识别和靶向的这种基本机制(其甚至在MHC匹配个体之间阻止肿瘤传播)可以作为强有力的癌症治疗策略而进行开发。
参考文件
1.Coussens,L.M.,Zitvogel,L.&Palucka,A.K.Neutralizing tumor-promoting chronic inflammation:a magic bullet?Science 339,286-291,doi:10.1126/science.1232227.339/6117/286[pii](2013).
2.Gabrilovich,D.I.,Ostrand-Rosenberg,S.&Bronte,V.Coordinated regulation of myeloid cells by tumours.Nat Rev Immunol 12,253-268,doi:10.1038/nri3175(2012).
3.Grivennikov,S.I.,Greten,F.R.&Karin,M.Immunity,inflammation,and cancer.Cell 140,883-899,doi:10.1016/j.cell.2010.01.025(2010).
4.Hanahan,D.&Coussens,L.M.Accessories to the crime:functions of cells recruited to the tumor microenvironment.Cancer cell 21,309-322,doi:10.1016/j.ccr.2012.02.022.S1535-6108(12)00082-7[pii](2012).
5.Mantovani,A.&Sica,A.Macrophages,innate immunity and cancer:balance,tolerance,and diversity.Current opinion in immunology 22,231-237,doi:10.1016/j.coi.2010.01.009(2010).
6.Schreiber,R.D.,Old,L.J.&Smyth,M.J.Cancer immunoediting:integrating immunity's roles in cancer suppression and promotion.Science 331,1565-1570,doi:10.1126/science.1203486(2011).
7.Vesely,M.D.,Kershaw,M.H.,Schreiber,R.D.&Smyth,M.J.Natural innate and adaptive immunity to cancer.Annual review of immunology 29,235-271,doi:10.1146/annurev-immunol-031210-101324(2011).
8.Manning,T.C.等人,Antigen recognition and allogeneic tumor rejection in CD8+ TCR transgenic/RAG(-/-)mice.Journal of immunology 159,4665-4675(1997).
9.Ferrara,J.,Guillen,F.J.,Sleckman,B.,Burakoff,S.J.&Murphy,G.F.Cutaneous acute graft-versus-host disease to minor histocompatibility antigens in a murine model:histologic analysis and correlation to clinical disease.J Invest Dermatol 86,371-375(1986).
10.Appelbaum,F.R.Haematopoietic cell transplantation as immunotherapy.Nature 411,385-389,doi:10.1038/35077251(2001).
11.Bishop,M.R.等人,Allogeneic lymphocytes induce tumor regression of advanced metastatic breast cancer.J Clin Oncol 22,3886-3892,doi:10.1200/JCO.2004.01.127(2004).
12.Goulmy,E.Minor histocompatibility antigens:allo target molecules for tumor-specific immunotherapy.Cancer J 10,1-7(2004).
13.Tseng,W.W.等人,Development of an orthotopic model of invasive pancreatic cancer in an immunocompetent murine host.Clinical cancer research:an official journal of the American Association for Cancer Research 16,3684-3695,doi:10.1158/1078-0432.CCR-09-2384(2010).
14.Baker,K.等人,Neonatal Fc receptor expression in dendritic cells mediates protective immunity against colorectal cancer.Immunity 39,1095-1107,doi:10.1016/j.immuni.2013.11.003(2013).
15.Dhodapkar,K.M.,Krasovsky,J.,Williamson,B.&Dhodapkar,M.V.Antitumor monoclonal antibodies enhance cross-presentation ofcCellular antigens and the generation of myeloma-specific killer T cells by dendritic cells.The Journal of experimental medicine 195,125-133(2002).
16.Rafiq,K.,Bergtold,A.&Clynes,R.Immune complex-mediated antigen presentation induces tumor immunity.The Journal of clinical investigation 110,71-79,doi:10.1172/JCI15640(2002).
17.Regnault,A.等人,Fcgamma receptor-mediated induction of dendritic cell maturation and major histocompatibility complex class I-restricted antigen presentation after immune complex internalization.The Journal of experimental medicine 189,371-380(1999).
18.Dankort,D.等人,Braf(V600E)cooperates with Pten loss to induce metastatic melanoma.Nat Genet 41,544-552,doi:10.1038/ng.356(2009).
19.Pulaski,B.A.&Ostrand-Rosenberg,S.Reduction of established spontaneous mammary carcinoma metastases following immunotherapy with major histocompatibility complex class II and B7.1cell-based tumor vaccines.Cancer research 58,1486-1493(1998).
20.Qin,Z.等人,B cells inhibit induction of T cell-dependent tumor immunity.Nature medicine 4,627-630(1998).
21.de Visser,K.E.,Korets,L.V.&Coussens,L.M.De novo carcinogenesis promoted by chronic inflammation is B lymphocyte dependent.Cancer cell 7,411-423,doi:10.1016/j.ccr.2005.04.014(2005).
22.Andreu,P.等人,FcRgamma activation regulates inflammation-associated squamous carcinogenesis.Cancer cell 17,121-134,doi:10.1016/j.ccr.2009.12.019.S1535-6108(09)00431-0[pii](2010).
23.Gerber,J.S.&Mosser,D.M.Reversing lipopolysaccharide toxicity by ligating the macrophage Fc gamma receptors.Journal of immunology 166,6861-6868(2001).
24.Soussi,T.p53Antibodies in the sera of patients with various types of cancer:a review.Cancer research 60,1777-1788(2000).
25.Gumus,E.等人,Association of positive serum anti-p53 antibodies with poor prognosis in bladder cancer patients.International journal of urology:official journal of the Japanese Urological Association 11,1070-1077,doi:10.1111/j.1442-2042.2004.00948.x(2004).
26.Li,Q.等人,Adoptive transfer of tumor reactive B cells confers host T-cell immunity and tumor regression.Clinical cancer research:an official journal of the American Association for Cancer Research 17,4987-4995,doi:10.1158/1078-0432.CCR-11-0207(2011).
27.DiLillo,D.J.,Yanaba,K.&Tedder,T.F.B cells are required for optimal CD4+ and CD8+ T cell tumor immunity:therapeutic B cell depletion enhances B16melanoma growth in mice.Journal of immunology 184,4006-4016,doi:10.4049/jimmunol.0903009(2010).
28.Clynes,R.,Takechi,Y.,Moroi,Y.,Houghton,A.&Ravetch,J.V.Fc receptors are required in passive and active immunity to melanoma.Proceedings of the National Academy of Sciences of the United States of America 95,652-656(1998).
29.Nimmerjahn,F.&Ravetch,J.V.Divergent immunoglobulin g subclass activity through selective Fc receptor binding.Science 310,1510-1512,doi:10.1126/science.1118948(2005).
30.Hamanaka,Y.等人,Circulating anti-MUC1 IgG antibodies as a favorable prognostic factor for pancreatic cancer.International journal of cancer.Journal international du cancer 103,97-100,doi:10.1002/ijc.10801(2003).
31.Kurtenkov,O.等人,Humoral immune response to MUC1and to the Thomsen-Friedenreich(TF)glycotope in patients with gastric cancer:relation to survival.Acta Oncol 46,316-323,doi:10.1080/02841860601055441(2007).
实施例2:同种IgG抗体可以识别通常不被同基因IgG识别的抗原
免疫沉淀法和质谱法被用来识别由同种异基因IgG(“同种IgG”)(来自129小鼠血清)相对于同基因IgG(“同基因IgG”)(来自C57Bl/6小鼠血清)识别的B16黑色素瘤(小鼠肿瘤)中的抗原。同基因IgG沉淀11种蛋白质,所述蛋白质没有同时被同种IgG拉下(表1)。相反,同种IgG沉淀许多不被同基因IgG识别的蛋白质(表2)。由同基因IgG和同种IgG二者沉淀的蛋白质显示在表3中。因此,靶向于表2中任一种蛋白质(例如,或者它们的直系同源物,如,它们的人直系同源物)的抗体可以在所述方法、组合物和试剂盒中用作适合的同种IgG抗体(例如,以在与DC刺激组合使用时诱导抗肿瘤作用)。
表1.由同基因IgG富集的蛋白质(由同基因IgG但不由同种IgG沉淀的蛋白质)
表2.通过同种IgG富集的蛋白质(通过同种IgG而非同基因IgG沉淀的蛋白质)
表3.未富集蛋白质(被同种IgG和同基因IgG同等沉淀的蛋白质)
实施例3
以下实验方法和结果提供了支持T细胞识别抗原(由负载APC提呈给它们)的见解的证据,所述抗原不同于用于负载APC的同种抗体识别的抗原。结果(图11-14)显示治疗诱导了CD45+细胞(即,单核白细胞)的大规模肿瘤浸润,所述CD45+细胞的大部分是激活的CD4和CD8 T细胞。它们还显示在远离肿瘤的位置处(例如,脾)看到了明显的免疫应答,如由来自脾的CD4或CD8 T细胞保护原始小鼠免受肿瘤挑战的能力所指出的。结果还显示同种IgG+DC刺激带来的响应大于对单一肿瘤相关抗原(跨膜糖蛋白-MMB)的多克隆抗体或者单独DC刺激带来的响应。
图10说明与DC刺激组合用单克隆小鼠抗小鼠MHC I类抗体治疗已经被注射和皮下生长的结肠直肠癌(CT26)导致了完全肿瘤消退。由于MHC I在CT26肿瘤细胞上高度表达,这个结果与结合肿瘤细胞的抗体总量是抗肿瘤反应的效力的决定因素的假设相一致。不存在系统毒性,虽然在若干天内完全痊愈的肿瘤的附近有明显炎症反应。MHC I类在许多肿瘤上下调,使得它们抗CD8 T细胞介导细胞毒性。很可能,DC刺激通过激活T细胞以及也许其他浸润肿瘤的细胞而上调肿瘤上的MHC I(和/或II)表达,其然后分泌IFNg。在一些情况下,IFNg自身可以用作APC(例如,DC)刺激剂。在一些情况下,抗MHC-I抗体(例如,与一种或多种APC刺激(例如,一种或多种DC刺激)组合)可以对缺乏MHC-I的高水平表达的肿瘤具有强有力的治疗作用。
图10.与DC刺激组合的单克隆同种抗MHC I抗体诱导了完全肿瘤消退。将4x106个CT26结肠癌细胞在右侧腹上皮下注射到Balb/c小鼠中。一旦肿瘤达到25mm2,它们保持不治疗(空心圈)、肿瘤内注射TNFa+aCD40激动剂+同种IgG(空心方块)或者肿瘤内注射TNFa+aCD40激动剂+aH-2Kd IgG(抗MHC I类抗体)(实心方块)。
图11a-c.治疗后肿瘤中的免疫细胞浸润。小鼠被皮下注射2x105个B16黑色素瘤细胞,其被允许生长直到肿瘤达到25mm2。小鼠然后被肿瘤内注射PBS(未治疗)、肿瘤内注射单独TNFa+aCD40、或者肿瘤内注射TNFa+aCD40+同种IgG(来自129S1小鼠)或者TNFa+aCD40+对跨膜糖蛋白-NMB的抗体(TG-NMB,GPNMB)的组合。在一些情况下,缺乏功能性Fcg受体信号传导的小鼠被注射TNFa+aCD40+同种IgG。在6天后,切除肿瘤,并通过流式细胞术检测包括肿瘤细胞的整个细胞组成(n=8)。a.Y轴是总肿瘤细胞中的CD45细胞%。b.Y轴是CD45+细胞中的INFg+CD44+细胞%(对于CD8 T细胞和对于CD4 T细胞量化)。c.Y轴是表达gp100四聚体的CD8+细胞的%和表达Trp2四聚体的CD8+细胞的%。
图12.来自经治疗小鼠的T细胞的过继转移对于原始小鼠的肿瘤发展的影响。在用PBS(未治疗)、用TNFa+aCD40、或者用与同种IgG组合(同种IgG)或与对跨膜糖蛋白-NMB的抗体组合(TG-NMB;GPNMB)的TNFa+aCD40治疗B16携带小鼠6天后,从B16携带小鼠纯化脾T细胞。5x106个CD4+细胞(上图)或CD8+细胞(下图)被静脉注射到原始小鼠中,接着在1小时后皮下注射2.5x105个B16细胞。
图13.来自治疗后第6天的B16肿瘤的代表性FACS图。数字代表阳性细胞的%。
图14.来自治疗后第6天的B16肿瘤的代表性FACS图。
实施例4:针对不同类别和亚类的人同种抗体的肿瘤结合性能和诱导DC预激(priming)和T细胞激活的能力,对于不同类别和亚类的人同种抗体的分析
本文提供的数据表明根除同种异基因肿瘤的抗肿瘤T细胞应答通过经由天然存在的同种抗体激活APC(例如,DC)而介导,并且其效果取决于抗体同种型(图2G)和IgG亚类(图15)。体外人类数据显示同种IgG Abs结合新鲜分离的人肿瘤细胞,同种IgG-肿瘤免疫复合体(IC)促进DC成熟、促进DC摄取肿瘤相关抗原(TAA),并且有助于通过DC激活自体T细胞(图4)。由不同Ig类别和亚类组成的同种Ig-IC制备物之间的差异在它们对人APC(例如,人DC)的激活方面作出比较。为了帮助设计临床级别的多克隆同种抗体制备物,具有最高效的肿瘤结合和DC激活性能的同种型(IgG、IgM、IgA、IgE)和亚类(IgG1、2、3或4)。例如,从经历根治性切除的NSCLC I和II期患者新获得人mo-DC、TADC和肿瘤细胞。研究了两种最常见的NSCLC组织学:腺癌和鳞状细胞癌。从10位女性和10位男性健康供体(20-40岁,抗HLA Abs阴性)的血清获得同种抗体。可以容易地获得新鲜的人NSCLC组织和健康的供体血液。
对固定的冷冻人NSCLC肿瘤切片进行免疫荧光显微分析并对FACS纯化的人NSCLC肿瘤细胞进行流式细胞术以确定四种不同亚类的人IgG之间是否存在肿瘤结合程度的差异。从20位健康供体的合并血清分离总人IgG、IgG亚类(IgG1、IgG2、IgG3、IgG4)、IgM、IgA和IgE。来自经历NSCLC切除的8位患者的肿瘤准备进行免疫荧光显微术和流式细胞术二者。在远离肿瘤的位置处从肺叶切除样品获得匹配的“非肿瘤”肺并用作对照。对于免疫荧光显微术实验,固定的冷冻人NSCLC切片与纯化的供体Ab部分一起孵育,然后用抗人总IgG、IgG1、IgG2、IgG3、IgG4、IgM、IgA或IgE的荧光物缀合抗体(在DAPI之外)染色,并用Zen软件(Zeiss,Dublin,CA)定量同种抗体染色的程度。这包括阳性染色的肿瘤面积百分比,以及染色强度。结果用流式细胞术确认。新鲜获得的人NSCLC样品在含有DNAse I和胶原酶的HBSS中消化30min以产生单一细胞悬浮液,其与纯化的供体Ab部分一起孵育,洗涤,然后用抗人总IgG、IgG1、IgG2、IgG3、IgG4、IgM、IgA或IgE的荧光团缀合Abs染色。不同亚类各自的中值荧光指数(MFI)在肿瘤细胞(CD45negSSChigh)上测定。自体Abs(来自经历手术的患者的血清)可以用作对照。至少两种来源的可商购静脉内注射免疫球蛋白(IVIG)在这些结合试验中另行测试。
由于Ab结合肿瘤细胞和APC(例如,DC)激活可以是两个独立的过程,因此可以识别具有激活人APC(例如,人DC)的能力的人同种IgG的亚类。总IgG、单个IgG亚类或IgM与新鲜分离的NSCLC人肿瘤细胞一起孵育30min以形成同种IgG-IC。这些抗体-肿瘤细胞免疫复合体与来自经历NSCLC切除的8位患者的自体血液mo-DC在助剂TNFα+CD40L的存在下一起过夜培养。获得了以下数据:1)DC成熟的量或程度,2)DC的TAA摄取的量或程度,和3)DC的T细胞刺激能力(如图4所示)。还检查了同种IgG-IC激活人TADC的能力,并且在从5位患者的肿瘤样品分离的FACS纯化TADC(HLA-DR+CD3-CD19-CD56-CD14-)中进行了相同实验。可以用1cm3肿瘤样品(其产生约1-5x105个TADC)获得足够的TADC收率,并且可以从大部分切片样品获得这种大小的肿瘤样品。DC成熟通过HAL-DR(MHC-II)和共刺激分子CD40、CD80和CD86的表达评估。DC摄取TAA通过与CFSE标记肿瘤细胞一起培养DC并使用流式细胞术检测DC中CFSE标记肿瘤蛋白的摄取来评估。DC的T细胞激活通过与自体患者血液CD4 T细胞一起培养同种IgG-IC负载的DC并通过3H-胸苷掺入测量T细胞增殖来分析。对照可以包括自体患者Abs,并且测试同种IgA和IgE以确定它们是否发现结合肿瘤。此外,通过测试由使用10X浓度的源自患者的IgG产生的IgG-IC来调查肿瘤结合Abs在自体血清中存在(以较低效价)的可能性。
前文仅仅说明了本发明的原理。将认识到,本领域技术人员能够设想各种各样的布置,其虽然未在本文中明确描述或显示,但体现了本发明的原理并且包括在其精神和范围内。而且,本文记载的所有实例和条件性语言都主要旨在帮助读者理解本发明的原理和本发明人所贡献出的推动本领域的理念,并且被解释为不限于这样的具体记载的实例和条件。而且,在本文中阐述本发明的原理、方面和实施方式的所有陈述及其具体实例都旨在涵盖其结果和功能等价物。另外,旨在这样的等价物包括目前已知的等价物和未来开发的等价物,即,无论结构如何,实施相同功能的开发出的任何元件。本发明的范围因此不旨在被限制于本文显示和描述的示例性实施方式。相反,本发明的范围和精神由随附权利要求体现。
- 还没有人留言评论。精彩留言会获得点赞!