羟基酪醇在制备防治阿尔茨海默病的药物中的应用的制作方法
本发明生物医药技术领域,涉及羟基酪醇在制备防治阿尔茨海默病的药物中的应用。
背景技术:
阿尔茨海默病作为老年痴呆症的主要类型,是老年人口中发病率最高的神经退行性疾病。其发病过程缓慢,随着时间不断恶化成持续性神经功能障碍,引起诸多并发症,确诊后平均生命时间为三到九年,患者逐渐丧失身体机能,最终导致死亡。
目前,阿尔茨海默病的具体发病机制尚不明确,因此,新的治疗阿尔茨海默病的方法是目前研究者努力研究的方向。脑内线粒体氧化应激出现在在阿尔茨海默病早期,并贯穿整个阿尔茨海默病病理过程。阿尔茨海默病病理进程产生淀粉样蛋白Aβ入侵线粒体,促使线粒体产生超氧自由基,进而将其转化为过氧化氢,导致氧化应激产生,激活JNK/MAPK信号通路,进一步引起NFkB释放炎症相关的白介素和细胞因子。
不健康的饮食结构和营养搭配影响阿尔茨海默病发病进程,因此,从营养干预角度出发减轻阿尔茨海默病并发症并减缓阿尔茨海默病发病进程急需重视。以橄榄为食材制造食品是地中海饮食的标志,有助于降低认知损伤及阿尔茨海默病。前期研究发现具有抗氧化功能的多酚类化合物羟基酪醇作为橄榄类制品的重要生物活性成分,在多种疾病模型例如肥胖、糖尿病、肌肉萎缩、产前应激中显著调控氧化应激、线粒体功能障碍、及神经毒性损伤。
技术实现要素:
本发明解决的问题在于提供一种羟基酪醇在制备防治阿尔茨海默病的药物中的应用,穿越血脑屏障的羟基酪醇分子靶向脑内线粒体,修复线粒体功能,以JNK/MAPK为靶点改善神经炎症,从而达到改善阿尔茨海默病的目的。
本发明是通过以下技术方案来实现:
羟基酪醇在制备防治阿尔茨海默病的药物中的应用。
所述的药物是口服药物,该药物能够穿越血脑屏障,提高脑组织中羟基酪醇含量。
所述的药物是改善神经功能、改善学习认知能力的药物。
所述的药物是改善神经细胞线粒体功能的药物。
所述的药物是不影响Aβ的积累加工,逆转脑组织的线粒体功能障碍、恢复线粒体蛋白羰基化异常的药物。
所述的药物是提高抗氧化损伤能力,提高SOD-2蛋白表达的药物。
所述的药物是改善脑内炎性损伤的药物。
所述的药物是通过调控线粒体功能,靶向JNK/MAPK信号通路改善神经炎症信号,修复神经功能损伤的药物。
羟基酪醇在制备防治阿尔茨海默病的保健品、功能性食品或饮料中的应用。
羟基酪醇在制备靶向JNK/MAPK信号通路以改善脑内炎性损伤的药物、保健品、功能性食品或饮料中的应用。
与现有技术相比,本发明具有以下有益的技术效果:
羟基酪醇源于天然营养素,安全性高,对人体无毒副作用。地中海饮食相同日摄取剂量的羟基酪醇可穿越血脑屏障改善阿尔茨海默病小鼠神经功能;羟基酪醇显著改善由Aβ所引起的线粒体氧化应激,修复阿尔茨海默病小鼠脑内线粒体功能;通过调控线粒体功能,靶向JNK/MAPK信号通路改善神经炎症信号,从而达到修复阿尔茨海默病的神经功能损伤的作用,达到改善阿尔茨海默病的目的,在防治阿尔茨海默病相关的保健食品及药物的应用中具有良好的前景。
附图说明
图1A~图1D表示羟基酪醇穿越血脑屏障改善阿尔兹海病小鼠神经功能。
图2A~图2D表示羟基酪醇不影响Aβ加工。
图2E是Aβ降解酶IDE的mRNA表达检测结果。
图3A~图3G表示羟基酪醇显著改善线粒体功能障碍。
图4A~图4E表示羟基酪醇作用JNK/MAPK信号通路显著修复阿尔茨海默小鼠脑内炎性损伤。
具体实施方式
下面结合具体的实施例对本发明做进一步的详细说明,所述是对本发明的解释而不是限定。
本发明发现在给予羟基酪醇之后,羟基酪醇可穿越血脑屏障提高脑组织的羟基酪醇含量,显著改善阿尔茨海默病小鼠脑神经功能及学习记忆能力。而且,羟基酪醇还可以逆转阿尔茨海默小鼠脑内的线粒体功能障碍及线粒体蛋白羰基化异常,提高SOD-2蛋白表达,进而改善二项酶系统稳态。更为重要的是,由于阿尔茨海默病脑内存在长期炎症损伤,在羟基酪醇的干预下,以JNK/MAPK为靶点,阿尔茨海默病小鼠脑内炎性损伤显著得到改善,达到预防和治疗阿尔茨海默病发生与发展的作用。下面基于动物实验模型来对本发明进行详细的说明。
1、动物饲养及药物处理
实验组APP/PS1转基因雌性小鼠、对照野生型C57雌性小鼠购自国家遗传工程小鼠资源库。小鼠饲养在可控温度(23度到25度)和湿度(60%)的房间内,房间的灯光维持在12小时白天、12小时黑夜的循环中,在实验进行中小鼠能够自由进食和进水。
APP/PS1是家族性阿尔茨海默病转基因小鼠模型,通过在C57BL/6J小鼠中同时表达人早老素PS1基因和嵌合淀粉样前提蛋白APPswe基因繁殖筛选而成。从3月龄(Aβ沉积起始月龄)起至9月龄结束(小鼠出现显著阿尔 茨海默病症状),对APP/PS1转基因阿尔茨海默病模型小鼠进行6个月的羟基酪醇灌胃处理,羟基酪醇剂量为5mg/kg小鼠/天,该剂量根据地中海饮食中每天羟基酪醇的摄取量换算而来。
实验小鼠分为三组:1.野生型C57BL/6J小鼠;2.AD模型APP/PS1小鼠,灌胃等体积生理盐水;3.APP/PS1小鼠,灌胃等体积羟基酪醇5mg/kg小鼠/天。饲喂结束后,通过脑电学检测方法检测小鼠神经功能,Morris水迷宫检测小鼠学习记忆能力,免疫荧光染色、蛋白印记、RT-PCR、及ELISA等生物化学及分子生物学方法检测Aβ前体蛋白加工过程、线粒体功能、炎症信号。
2、脑内羟基酪醇浓度检测
小鼠脑内羟基酪醇浓度采用液相色谱-质谱/质谱联用方法(AgilentTechnologies,Waldbronn,Germany),检测方式为多重反应监测方法,用于定量分析的离子反应为:m/z 153.1→m/z 123.1。
图1A为脑组织中羟基酪醇含量的检测结果,横坐标为各处理组:AD表示阿尔茨海默病小鼠、HT表示羟基酪醇,纵坐标为羟基酪醇的含量;结果显示阿尔茨海默病小鼠灌胃羟基酪醇后,每克脑组织中羟基酪醇含量可达8.19±3.77ng/mL,而未饲喂羟基酪醇的阿尔茨海默病小鼠每克脑组织中羟基酪醇含量仅为2.14±0.34ng/mL(羟基酪醇为脑内多巴胺代谢物之一,因此未经饲喂的小鼠脑内仍可检测出少量羟基酪醇)。
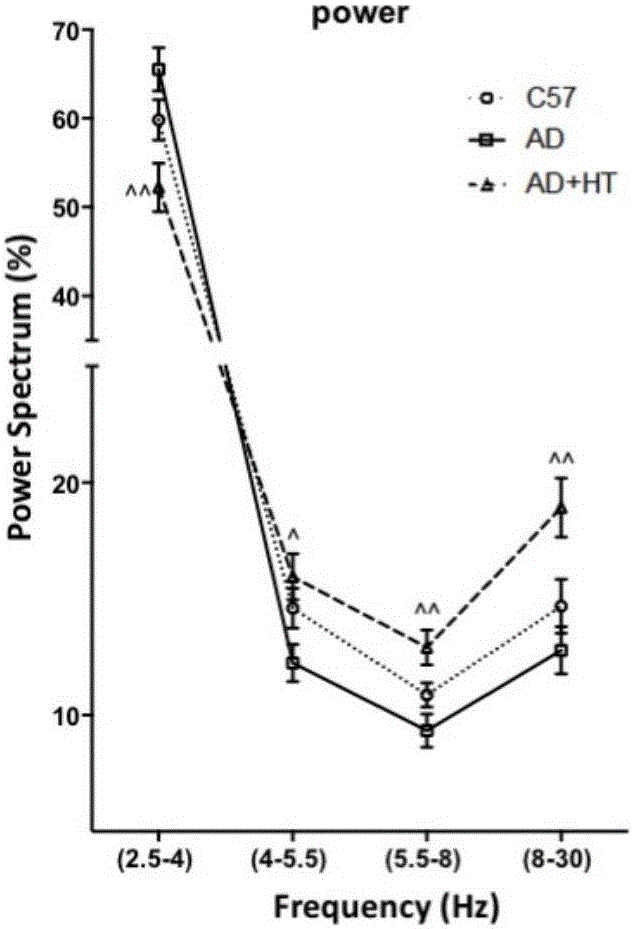
图1B为模型小鼠的频率检测结果,横坐标为频率,纵坐标为不同频率下的功率谱;结果显示阿尔茨海默病小鼠Delta波段功率谱较高,Theta,Alpha,Beta波段功率谱降低,与阿尔茨海默病患者脑内结果一致,羟基酪醇改善不同波段功率谱。
3、神经功能及学习记忆能力测试
学习记忆能力的下降是AD病人的临床特征,为了检测HT是否具有减 缓AD神经损伤的作用,以进行了神经功能及学习记忆能力测试。
神经功能通过脑电描记法进行检测,记录特定频率范围为2.8-4Hz(Delta),4-5.5Hz(Theta 1),5.5-8Hz(Theta 2),8-30Hz(Alpha and Beta)的功率谱。学习记忆能力通过Morris水迷宫方法进行检测,连续6天记录小鼠从不同象限放入迷宫后游向固定象限水下平台的时间和路程,后对其进行统计学分析。
图1C为水迷宫实验中,小鼠在训练的六天内游向平台的路程的检测结果,其中横坐标为训练天数,纵坐标为游泳距离。图1D为图1C的统计图,经过图1C计算曲线下面积所得。其中,横坐标为各处理组,纵坐标为曲线下面积。结果显示,在给予羟基酪醇灌胃处理之后模型小鼠的在水迷宫实验中的路程显著增强,其学习能力得到了提高。
结果显示,APP/PS1是小鼠模型较好的模拟了阿尔茨海默病,而在饲喂羟基酪醇之后,羟基酪醇能够穿越血脑屏障从而增加脑组织中羟基酪醇含量,而训练结果表明羟基酪醇的增加能够改善小鼠模型的学习能力,能够改善阿尔茨海默病小鼠的神经功能。
4、Aβ检测
研究发现,Aβ斑块是AD的经典病理特征,为了检测HT是否影响A否积累加工,下面进行Aβ检测。
免疫荧光染色石蜡固定的脑组织切片,激光共聚焦显微镜分析皮层及海马部位Aβ形态学沉积。Aβ沉积数量通过ELISA试剂盒(Invitrogen,Camarillo,CA,USA)进行检测量化。Aβ前体蛋白AβPP及加工产物BACE通过免疫印迹检测并量化,Aβ降解酶NEP和IDE分别通过免疫印迹和实时定量PCR检测并量化。
图2A为免疫荧光染色石蜡固定的脑组织切片,结果显示在正常C57小鼠脑海马和皮层部位均无Aβ斑块,阿尔茨海默病小鼠和灌胃羟基酪醇的阿 尔茨海默病小鼠脑海马和皮层部位有Aβ斑块,但无组间差异。
图2B为ELISA检测Aβ斑块数量的结果图,其中,横坐标为各处理组,纵坐标Aβ40、Aβ42分别为Aβ的两种亚型;结果显示经ELISA检测Aβ斑块数量在灌胃羟基酪醇和生理盐水两组对比中无显著差异。
图2C为蛋白免疫印迹法检测的AβPP、BACE、NEP的蛋白表达结构,其中,横坐标为各处理组,纵坐标为蛋白名称,AβPP是Aβ前体蛋白,BACE是AβPP加工成Aβ的中间产物;NEP是Aβ降解酶。图2D是图2C的统计学结果。
图2E是Aβ降解酶IDE的mRNA表达检测结果。其中,横坐标为各处理组,纵坐标为IDE的mRNA水平。结果显示IDE的mRNA表达并没有显著的变化,
结果表明,APP/PS1小鼠模型在饲喂羟基酪醇之后,羟基酪醇不影响Aβ积累加工,包括其前体、降解酶都没有特别的差异。
5、线粒体功能检测
研究发现Aβ能够引起氧化压力,因此,下面检测了蛋白、脂质氧化水平,以进一步检测AβPP引起的氧化压力是否涉及到线粒体功能的损伤,我们进行了线粒体复合物表达和活性的检测。
线粒体氧化损伤通过蛋白羰基化试剂盒记性检测(Cell Biolabs,SanDiego,CA,USA);图3A中横坐标为各处理组,纵坐标为线粒体蛋白羰基化水平。结果显示线粒体蛋白羰基化水平在阿尔茨海默病小鼠中较高,给予羟基酪醇处理后可将羰基化蛋白水平恢复至与正常小鼠相当。图3B是图3A的统计图。
抗氧化活力通过ELISA检测4-羟基壬稀酸(4-HNE,RD systems,Minneapolis,MN,USA)、谷胱甘肽(GSH,Beyotime,Jiangsu,China)、氧化型谷胱甘肽(GSSG,Beyotime,Jiangsu,China)。
图3C显示4-HNE水平在阿尔茨海默病小鼠脑组织中较高,羟基酪醇处理可将4-HNE水平恢复至与正常小鼠相当。其中,横坐标为各处理组,纵坐标为4-HNE的量。
图3D显示羟基酪醇处理显著提高GSH水平,降低氧化型GSSG,同时GSH和GSSG的比值也显著升高。其中,横坐标为各处理组,纵坐标分别为GSH、GSSG含量及二者的比值。
图3E显示免疫印迹法检测的线粒体相关蛋白表达,阿尔茨海默病小鼠脑内SOD-2表达水平较低,HO-1表达水平较高,羟基酪醇处理后将蛋白表达量恢复至正常小鼠脑内水平。图3F是图3E的统计图,其中,横坐标为各处理组,纵坐标为蛋白名称。
线粒体复合物活性通过分光光度法检测。
图3G显示线粒体复合物I,II,III,IV活力变化,阿尔茨海默病小鼠复合物I活力较高,复合物II,III,IV活力较低,羟基酪醇处理后,复合物I,II,III,IV活力都得到显著恢复。其中,横坐标分别表示复合物I,II,III,IV,纵坐标表示复合物活力值相对于正常组的活力变化。
6、神经炎症分子检测
NFκB是AD炎症激活的关键分子,JNK/MAPK是NFκB的上游信号分子,为了检测HT是否能够减缓AD炎症信号,下面进行NFκB,JNK/MAPK信号分子的检测。采用蛋白免疫印迹法检测JNK/MAPK信号通路分子p-JNK、p-ERK、p-p38、NFkB,以及炎性小体Caspase 1、Cleaved caspase 1,IL-18,以管家基因Actin作为参照;实时定量PCR检测白介素和细胞因子:IL-6、COXII。
图4A显示免疫印迹法检测的JNK/MAPK信号通路标志蛋白表达水平,JNK,ERK,p38,NFkB磷酸化水平在阿尔茨海默病小鼠中显著升高,而羟基酪醇处理降低以上蛋白的磷酸化水平。图4B是图4A的统计图。其中,横 坐标是各处理组,纵坐标是蛋白名称。
图4C显示炎性小体蛋白免疫印迹表达,阿尔茨海默病小鼠中Caspase-1和IL-18表达水平显著升高,羟基酪醇饲喂后,Caspase-1,Cleaved caspase-1,IL-18表达水平显著降低。图4D是图4C的统计图。其中,横坐标是各处理组,纵坐标是蛋白表达含量相对于正常组的百分比。
图4E显示炎性相关白介素和细胞因子IL-6,COXII的mRNA水平,阿尔茨海默病小鼠炎性反应明显,有较高的IL-6和COXII水平,羟基酪醇灌胃后IL-6和COXII水平恢复至正常小鼠水平。其中,横坐标为各处理组,纵坐标为白介素和细胞因子名称。
结果表明羟基酪醇作用JNK/MAPK信号通路显著修复阿尔茨海默小鼠脑内炎性损伤。
7、统计学分析
以上所有统计学结果采用均值±平均数标准误差,组间差异分析方法采用单因素方差分析或双因素方差分析,统计学分析显著性标准定为p<0.05。
通过以上试验结果证明羟基酪醇能有效穿越血脑屏障,在不影响Aβ加工的条件下,通过调控线粒体功能,靶向JNK/MAPK信号通路改善神经炎症信号,从而达到修复阿尔茨海默病的神经功能损伤的作用。为制备阿尔茨海默病相关保健食品及药物提供科学依据。羟基酪醇作为食物中的功能分子,其有效作用浓度低,长期服用无毒副作用,应用前景广阔。
以上给出的实施例是实现本发明较优的例子,本发明不限于上述实施例。本领域的技术人员根据本发明技术方案的技术特征所做出的任何非本质的添加、替换,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!