知母皂苷AⅢ纳米脂质体及其制备方法和应用与流程
本发明涉及医药和中药学的制剂领域,尤其是涉及中药有效成分知母皂苷AⅢ的纳米脂质体及其制备方法和在制备抗肿瘤药物方面的应用。
背景技术:
癌症(Cancer),亦称恶性肿瘤(Malignant neoplasm),为由控制细胞生长增殖机制失常而引起的疾病。肿瘤作为一类严重威胁人类生命的重大疾病,由于其治愈率低,复发率高,已成为人类疾病死亡的主要因素。据报道,在2012年全球范围内,共造成820万人死亡,其中以肺癌、肝癌、胃癌、结肠直肠癌为主。目前癌症的主要治疗方法有外科手术、放射治疗和化疗等,以治疗疾病或延长生命并改善患者生活质量。然而这些方法常常给患者带来巨大的痛苦,且治疗过程中产生较大的耐药性和较高的复发率。中药和天然药物对治疗癌症具有一定的疗效,已逐渐被国内外医学界广泛接受。那么,能否利用现代中药研究技术,发现一种对肿瘤细胞杀伤力强,毒副作用小的药物和治疗方法,对肿瘤的临床治疗具有深远意义。
知母为百合科植物知母(Anemarrhena asphodeloides Bunge)的干燥根茎,味苦,性寒,归肺、胃、肾经。具有清热泻火、滋阴润燥、止渴除烦等功效。知母的化学成分主要有甾体皂苷、双苯吡酮类、黄酮类、木脂素类、多糖类、有机酸类及微量元素等,其中皂苷类是其主要的成分之一,约占知母根茎的6%。知母皂苷为知母的主要药理活性成分,知母皂苷AⅢ在知母药材中含量很低,而知母中含量较高的知母皂苷BII可通过酶解转化为知母皂苷AⅢ。现代药理学研究表明知母皂苷AⅢ对肺癌、肝癌、肠癌、结肠癌、胰腺癌的肿瘤细胞的增殖具有一定的抑制作用。
虽然根据体外细胞试验的结果,知母皂苷AⅢ能够抑制肿瘤细胞增殖;然而,在实际应用中,因知母皂苷AⅢ的水溶性较差,体内生物利用度较低,严重影响知母皂苷AⅢ的药效发挥。本发明通过知母皂苷AⅢ纳米脂质体的制备,不仅改善了知母皂苷AⅢ的水溶性,而且提高了其对肿瘤细胞增殖的抑制作用。知母皂苷AⅢ脂质体包封率较高,稳定性较好,整体动物实验也表明知母皂苷AⅢ脂质体对肿瘤生长具有较好的抑制作用,优于知母皂苷AⅢ,可用于恶性肿瘤的预防与治疗。
技术实现要素:
本发明旨在提供一种知母皂苷AⅢ纳米脂质体。
本发明另一个目的是提供这种知母皂苷AⅢ纳米脂质体的制备方法。
本发明还提供了这种知母皂苷AⅢ纳米脂质体在制备抗肿瘤药物方面的应用。
本发明所采用的知母皂苷AⅢ,来源于传统中药知母中主要皂苷知母皂苷BII的酶解产物,其分子式为C39H64O13,分子量740.917660,结构式如式I所示。
本发明的技术方案为,一种知母皂苷AⅢ纳米脂质体,由知母皂苷AⅢ和磷脂等组成,其制备处方中,知母皂苷AⅢ、磷脂和二硬脂酰基磷脂酰乙醇胺-聚乙二醇(或二硬脂酰磷脂酰乙酰胺-甲氧基聚乙二醇)的摩尔比为1:8~10:0~2。用该方法所制备的知母皂苷AⅢ脂质体的载药量高于5%,包封率高于75%。该处方下知母皂苷AIII纳米脂质体的稳定性高,不易泄露。
制备知母皂苷AⅢ纳米脂质体的方法,包括以下步骤:
将知母皂苷、磷脂等膜材溶于有机溶剂中,除去所述的有机溶剂形成脂膜,再加入缓冲液进行水合,得到知母皂苷AⅢ脂质体的粗悬液,将所得到的粗悬液进行超声或经高压均质仪处理后,得到所述知母皂苷AⅢ脂质体。
具体的,制备方法步骤为:
(1)将知母皂苷AⅢ溶液与膜材溶液混合,去除有机溶剂得到脂质薄膜;膜材包括(A)磷脂,(B)二硬脂酰基磷脂酰乙醇胺-聚乙二醇或二硬脂酰磷脂酰乙酰胺-甲氧基聚乙二醇;
知母皂苷AⅢ、磷脂和二硬脂酰基磷脂酰乙醇胺-聚乙二醇或二硬脂酰磷脂酰乙酰胺-甲氧基聚乙二醇的摩尔比为1:8~10:0~2。
磷脂选自蛋黄卵磷脂(EPC)、氢化大豆卵磷脂(HSPC)、二硬脂酰磷脂酰胆碱(DSPC)、二肉豆蔻酰磷脂酰胆碱(DMPC)、二棕榈酰磷脂酰胆碱(DPPC)中的至少一种。
所述的二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)的分子量为2000~5000;二硬脂酰磷脂酰乙酰胺-甲氧基聚乙二醇分子量为1000~5000。所述膜材溶液的浓度为20~150mg/mL。
优选的,知母皂苷AⅢ溶液浓度为0.5~4mg/mL;知母皂苷AⅢ溶液用甲醇、乙醇或氯仿配制,更优选为甲醇或乙醇。
膜材溶液用甲醇、乙醇或氯仿配制;其浓度为15~50mg/mL。
除去有机溶剂形成脂膜的方法为吹干法和减压旋转蒸发法中的一种。采用吹干法时,使用氮气或惰性气体,在15~40℃(室温或磷脂的相变温度)下吹干;采用减压旋转蒸发法时,温度为40~60℃,真空度为-0.09~-0.1MPa。
(2)加入磷酸盐缓冲液,40~60℃下水化30~120分钟,得到知母皂苷AⅢ脂质体粗悬液;所述的磷酸盐缓冲溶液浓度为0.05~0.1mol/L,pH值为7.2~7.6;优选的,水化温度为45~50℃。
优选的,膜材与磷酸缓冲液的用量比为10~70mg:1mL。
(3)所述的知母皂苷AⅢ脂质体粗悬液在40~60℃下超声处理,或者高压均质处理,获得知母皂苷AⅢ的纳米脂质体;
优选的,超声频率为40~100Hz,功率200~300W;优选的,超声处理条件为45~50℃下超声2~5次,每次3~5分钟。高压均质条件为:10000~30000PSI条件下循环2~6次;优选为,在10000~20000PSI条件下循环2~4次。
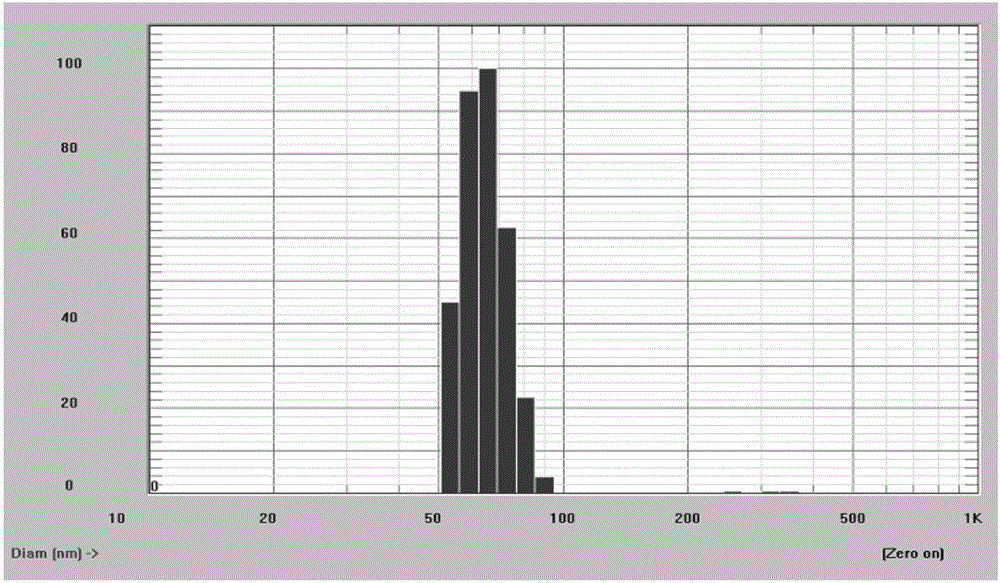
通过上述方法制备的知母皂苷AⅢ纳米脂质体外观呈均匀乳白色悬浮液,其平均粒径(D90)为25~80nm,Zeta电位范围-23~-35mV;包封率为75%~95%;pH值为7.3~7.4,载药率为5wt%~10wt%。
用上述方法所制备知母皂苷AⅢ脂质体在生理盐水中溶解度得到较好的改善,溶解度最高可达4mg/ml,相对于知母皂苷AⅢ在水中的溶解度提高了230倍左右;而且所得到的知母皂苷AⅢ脂质体稳定性高,不易泄露。
相对于知母皂苷AⅢ单体而言,本发明所制备知母皂苷AⅢ脂质体针对不同肿瘤细胞的增殖的抑制作用大大增强,其IC50降低约一倍左右。
本发明所制备的知母皂苷AⅢ纳米脂质体可应用于制备抑制肿瘤细胞增殖的药物;肿瘤细胞包括人黑色素瘤A375、66C14、B16-F10细胞、乳腺癌BT474细胞、人非小细胞肺癌细胞A549、肝癌HepG2、肠癌HCT-15、胃癌HGC-27,乳腺癌MCF-7、胰腺癌Panc-1或脑胶质瘤U87;尤其是可用于制备抑制人黑色素瘤A375、66c14、B16-F10细胞以及乳腺癌BT474细胞增殖的药物。在脑胶质瘤U87荷瘤裸鼠上的抑瘤效果高达54.1%,知母皂苷AIII脂质体抑瘤作用远强于知母皂苷AIII。
本发明所制备的知母皂苷AⅢ纳米脂质体大鼠体内药物动力学研究显示,经尾静脉给药后,知母皂苷AⅢ的AUC(0-∞)相对原型药物提高2.13倍,体内滞留时间增加了3.7倍,说明知母皂苷AⅢ脂质体的制备可以提高药物体内的吸收度,同时能延长药物作用时间。
本发明通过简单的方法制备知母皂苷AⅢ纳米脂质体,原料易得,包封率高;所得到的知母皂苷AⅢ纳米脂质体稳定性好,水溶性明显改善,可显著提高知母皂苷AⅢ的体内吸收度,延长药物作用时间,而且提高了对肿瘤细胞增殖的抑制作用;尤其是解决了知母皂苷AⅢ在生物体内不能产生抑瘤效果的问题。知母皂苷AⅢ在脂质体内稳定性高,不易泄露。因此,这种知母皂苷AⅢ纳米脂质体可用于制备抑制肿瘤细胞增殖的药物,具有良好的应用前景。
附图说明
图1为实施例1知母皂苷AⅢ纳米脂质体的透射电镜图。
图2~9为实施例1~8所制备的知母皂苷AⅢ纳米脂质体的粒径分布图。
图10~17为实施例1~8所制备的知母皂苷AⅢ纳米脂质体的Zeta电位图。
图18为知母皂苷AⅢ样品色谱图。
图19为实施例1所制备的知母皂苷AⅢ脂质体样品色谱图。
具体实施方案
下面结合具体实施例对本发明作进一步阐述,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径而得。
实施例1、知母皂苷AⅢ纳米脂质体制备(处方1)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中;称取8.35mg蛋黄卵磷脂(EPC)溶于200μL氯仿溶液中,超声溶解。合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。EPC与知母皂苷AⅢ摩尔比为10:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45~50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液在超声频率为40-100Hz、功率200-300W的条件下超声3次,每次超声时间为3-5min,即得到知母皂苷AⅢ纳米脂质体。
实施例2、知母皂苷AⅢ纳米脂质体制备(处方2)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中,称取8.53mg二硬脂酰磷脂酰胆碱(DSPC)溶于200μL氯仿溶液中,超声溶解。合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。DSPC与知母皂苷AⅢ摩尔比为10:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液于超声频率为40-100Hz,功率200-300W,超声3次,每次超声时间为3-5min,即得到知母皂苷AⅢ纳米脂质体。
实施例3、知母皂苷AⅢ纳米脂质体制备(处方3)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中,称取7.51mg蛋黄卵磷脂(EPC)、3.02mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)溶于500μL氯仿溶液中,超声溶解,合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。EPC、DSPE-PEG2000和知母皂苷AⅢ的摩尔比为9:1:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液于超声频率为40-100Hz,功率200-300W,超声3次,每次超声时间为3-5min,即得到知母皂苷AⅢ纳米脂质体。
实施例4、知母皂苷AⅢ纳米脂质体制备(处方4)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中,称取7.68mg二硬脂酰磷脂酰胆碱(DSPC)、3.02mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)溶于200μL氯仿溶液中,超声溶解,合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。DSPC、DSPE-PEG2000和知母皂苷AⅢ的摩尔比为9:1:1。-0.09MPa、45~50℃下减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液于超声频率为40-100Hz,功率200-300W,超声3次,每次超声时间为3-5min,即得到知母皂苷AⅢ纳米脂质体。
实施例5、知母皂苷AⅢ纳米脂质体制备(处方5)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中,称取7.51mg蛋黄卵磷脂(EPC)、5.40mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇5000(DSPE-PEG5000)溶于500μL氯仿溶液中,超声溶解,合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。EPC、DSPE-PEG5000和知母皂苷AⅢ的摩尔比为9:1:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液于超声频率为40-100Hz,功率200-300W,超声3次,每次超声时间为3-5min,即得到知母皂苷AⅢ纳米脂质体。
实施例6、知母皂苷AⅢ纳米脂质体制备(处方6)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中,称取7.67mg二硬脂酰磷脂酰胆碱(DSPC)、5.40mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇5000(DSPE-PEG5000)溶于200μL氯仿溶液中,超声溶解,合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。DSPC、DSPE-PEG5000和知母皂苷AⅢ的摩尔比为9:1:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液于超声频率为40-100Hz,功率200-300W,超声3次,每次超声时间为3-5min,即得到知母皂苷AⅢ纳米脂质体。
实施例7、知母皂苷AⅢ纳米脂质体制备(处方7)
称取400mg知母皂苷AⅢ溶于200ml甲醇中,称取3755mg蛋黄卵磷脂(EPC)、1510mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)溶于250ml氯仿溶液中,超声溶解,合并上述溶液于圆底烧瓶中,氮气吹干除去甲醇和氯仿,直至圆底烧瓶壁上形成一层均匀的脂质薄膜。EPC、DSPE-PEG2000和知母皂苷AⅢ的摩尔比为9:1:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入100ml 0.01mol/L磷酸盐缓冲液(pH=7.4),45~50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ粗悬液于高压均质仪中分散,20000PSI条件下循环3次,即得到知母皂苷AⅢ纳米脂质体。
实施例8、知母皂苷AⅢ纳米脂质体制备(处方8)
称取400mg知母皂苷AⅢ溶于200ml甲醇中,称取3835mg二硬脂酰磷脂酰胆碱(DSPC)、1510mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)溶于100ml氯仿溶液中,超声溶解,合并上述溶液于圆底烧瓶中,氮气吹干除去甲醇和氯仿,直至圆底烧瓶壁上形成一层均匀的脂质薄膜。DSPC、DSPE-PEG2000和知母皂苷AⅢ的摩尔比为9:1:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入100ml 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ粗悬液于高压均质仪中分散,20000PSI条件下循环3次,即得到知母皂苷AⅢ纳米脂质体。
对照例1、知母皂苷AⅢ纳米脂质体制备(处方9)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中;称取2.51mg蛋黄卵磷脂(EPC)溶于60μL氯仿溶液中,超声溶解。合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。EPC与知母皂苷AⅢ摩尔比为3:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45~50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液在超声频率为40-100Hz、功率200-300W的条件下超声3次,每次超声时间为3-5min,所得到的混合液容易形成沉淀,不能形成均匀的脂质体悬浮液。
对照例2、知母皂苷AⅢ纳米脂质体制备(处方10)
称取0.8mg知母皂苷AⅢ溶于400μL甲醇中,称取2.56mg二硬脂酰磷脂酰胆碱(DSPC)溶于60μL氯仿溶液中,超声溶解。合并上述溶液于圆底具塞试管中,氮气吹干除去甲醇和氯仿,直至圆底试管壁上形成一层均匀的脂质薄膜。DSPC与知母皂苷AⅢ摩尔比为3:1。-0.09MPa、45~50℃减压干燥除去残留溶剂和水分,加入200μL 0.01mol/L磷酸盐缓冲液(pH=7.4),45-50℃水浴条件下水化1小时,得到知母皂苷AⅢ脂质体粗悬液。将知母皂苷AⅢ脂质体粗悬液于超声频率为40-100Hz,功率200-300W,超声3次,每次超声时间为3-5min,所得到的混合液容易形成沉淀,不能形成均匀的脂质体悬浮液。
实施例9、知母皂苷AⅢ纳米脂质体的质量评价
9.1形态观察
取实施例1~8所制备的知母皂苷AⅢ纳米脂质体,以0.01mol/L磷酸盐缓冲液(pH=7.4)稀释至较低浓度,滴于铜网上,用滤纸吸干多余的液体,醋酸铀染色3min,染色三次后于透射电镜下观察产物的形态。实施例1~8所制备的知母皂苷AⅢ纳米脂质体呈圆形或椭圆形微球体,颗粒间分散、独立,且粒径<100nm。实施例1的知母皂苷AⅢ纳米脂质体如透射电镜图图1所示。对照例1、2所制备的知母皂苷AⅢ纳米脂质体发生沉淀,未形成均匀的脂质体悬浮液,其粒径大于1000nm。
9.2溶解度测定
采用HPLC测定知母皂苷AⅢ在不同饱和溶液中的溶解度及脂质体(处方1)中溶解度,由表1可见,知母皂苷AⅢ在水中的溶解度为0.017mg/ml,在脂质体中溶解度为4.00mg/ml,溶解度提高了230倍。
表1知母皂苷AⅢ脂质体的质量评价结果
9.3粒径与Zeta电位测定
取适量知母皂苷AⅢ纳米脂质体,以0.01mol/L磷酸盐缓冲液(pH=7.4)稀释至脂质体脂浓度为1mmol/L,采用Malvern Zeta电位仪测定其粒径与Zeta电位。采用上述方法分别测定实施例1-8所制备的脂质体的粒径和电位。测得粒径范围为:45.1-69.5nm(D90),Zeta电位范围为:-24.8--31.8mV,其粒径分布图如图2~9所示,Zeta电位图如图10~17所示。实验结果见表2。
9.4pH值:取实施例1~8所制备的知母皂苷AⅢ纳米脂质体检测pH值,测定结果为7.35±0.04。
9.5包封率与载药率的测定:采用HPLC-ELSD测定脂质体中知母皂苷AⅢ的含量。
9.5.1色谱条件
Agilent 1100型高效液相色谱仪(配Alltech3300蒸发光散射检测器;色谱柱为AlltimaTM C18色谱柱(4.6mm×250mm,5μm);流动相:甲醇-水(85:15);流速:1mL/min;进样量20μL;光散射检测器温度为60℃,雾化气体流速为1.5L/min。知母皂苷AⅢ及脂质体样品色谱图见图18、19。
9.5.2标准曲线的绘制
精密称取22.6mg知母皂苷AⅢ标准品,用甲醇溶解并定容至10mL,得到2.26mg/ml,分别稀释至浓度为56.5、113、226、452、904、1130μg/mL的对照品溶液,分别注入液相色谱仪,进样量为20μL,以知母皂苷AⅢ峰面积平均值的常用对数为纵坐标,对照品浓度的常用对数为横坐标绘制标准曲线,计算回归方程得:y=1.3764x-1.6816,r=0.9995。表明知母皂苷AⅢ在56.5~1130μg/mL范围内其浓度的常用对数与峰面积的常用对数呈良好的线性关系。
9.5.3知母皂苷AⅢ纳米脂质体中知母皂苷AⅢ的含量测定
准确移取知母皂苷AⅢ纳米脂质体20μL,加入180μL甲醇,涡旋混匀5mins,14000rpm/min离心5mins,取上清液进样测定。
9.5.4包封率与载药率的测定
取20μL知母皂苷AⅢ纳米脂质体,采用HPLC测定其质量浓度C1。另取50μL纳米脂质体于分子截留量为8000-14000D的透析袋中,置于1000mL 0.01mol/L磷酸盐缓冲液(pH=7.4)中透析24h。取出透析后的纳米脂质体,测定体积V2,并精密移取20μL透析后的知母皂苷AⅢ纳米脂质体,采用HPLC测定袋内脂质体内知母皂苷AⅢ的浓度C2。计算其包封率EE(%)=C2*V2/C1*50×100%。
载药率的测定:取200μL纳米脂质体,冻干后称定其质量为W1,并按上述方法测定其中知母皂苷AⅢ的重量W2,其载药率DL(%)=W2/W1×100%。分别计算实施例1-8所制备的脂质体的包封率和载药率,结果见表2。
表2知母皂苷AⅢ纳米脂质体的质量评价结果
结论:实例1-8制备的知母皂苷AⅢ脂质体包封率范围为:78.3%~93.1%。优选处方制备的知母皂苷AⅢ纳米脂质体包封率均在75%以上,均高于对照例1和2所制备的知母皂苷AⅢ纳米脂质体。制备的纳米脂质体载药率均高于5%。
9.6知母皂苷AIII纳米脂质体初步稳定性实验
将制备的知母皂苷AⅢ纳米脂质体(处方1)于4℃冷藏条件下放置3个月,以脂质体的外观形态、粒径及包封率变化为指标考察其稳定性。
表3知母皂苷AⅢ纳米脂质体初步稳定考察
结果表明,在4℃冷藏条件下放置3个月后,知母皂苷AⅢ脂质体外观形态、粒径及包封率变化均不明显,表明知母皂苷AⅢ脂质体稳定性良好。
处方2-8的知母皂苷AⅢ纳米脂质体在4℃冷藏条件下放置3个月后,外观形态、粒径及包封率同样无明显变化。
9.7体外抗肿瘤活性测定:
分别采用人黑色素瘤A375、66c14、B16-F10细胞,乳腺癌BT474细胞,人非小细胞肺癌细胞A549、肝癌HepG2、肠癌HCT-15、胃癌HGC-27,乳腺癌MCF-7、胰腺癌Panc-1,购自于中国科学院上海生命科学研究院细胞资源中心,脑胶质瘤U87,购自于上海奥陆生物科技有限公司。该细胞株培养体系为DMEM培养液(GIBCO)90%,优质胎牛血清10%。5%二氧化碳,温度37℃。0.25%胰蛋白酶、0.02%EDTA消化液传代。
9.7.1接种
分别取处于指数生长期的肿瘤细胞,用含有10%胎牛血清的DMEM培养液稀释成1×106、4×105、1×105、1×105细胞/ml。96孔板每孔中加入50μL细胞悬液,置于37℃、5%CO2培养箱中培养24h。
9.7.2培养
96孔板置于37℃、5%CO2培养箱中继续培养24h。
9.7.3加药
知母皂苷AⅢ:将知母皂苷AⅢ用DMSO配制成储备液,用DMEM培养液(含10%FBS)配制各浓度工作液(3.8、7.7、15.4、20.5、30.754、41.0、54.7、109.4、164.0、218.7μM),每孔中加入50μL以上各液体,设3个复孔。各组终浓度分别为1.9、3.8、7.7、10.3、15.4、20.5、27.3、54.7、82、109.4μM。同时设置空白组和对照组,其中空白组是以等体积的培养液代替细胞溶液,对照组是以等体积的PBS缓冲溶液代替知母皂苷AⅢ溶液加入其中。
知母皂苷AⅢ脂质体:将知母皂苷AⅢ脂质体用DMEM培养液(含10%FBS)配制各浓度工作液(5.9、11.9、23.7、31.6、47.4、63.3、84.3、168.7、253.0、337.4μM),每孔中加入50μL以上各液体,设3个复孔。各组终浓度分别为3.0、5.9、11.9、15.8、23.7、31.6、42.2、84.3、126.5、168.7μM。同时设置空白组和对照组,其中空白组是以等体积的培养液代替细胞溶液,对照组是以等体积的PBS缓冲溶液代替知母皂苷AⅢ溶液加入其中。
9.7.4孵育
置于37℃、5%CO2培养箱中继续培养24h。
9.7.5加MTT
MTT用磷酸缓冲液配成5mg/ml溶液,在培养结束前5h,每孔中加入20μL,置于37℃、5%C02孵箱中继续孵育。
9.7.6测定
培养结束后弃去细胞上清液,每孔加入100μL DMSO溶解结晶产物。用酶标仪读取490nm波长OD值。记录知母皂苷AⅢ对各种细胞增殖的抑制率。
抑制率(%)=(A490,Control-A490,样品)/(A490,Control-A490,Blank)×100%抑制率(%)=(A490,对照-A490,样品)/(A490,对照-A490,空白)×100%
根据不同浓度的知母皂苷AⅢ及知母皂苷AⅢ脂质体(实施例1~4的方法制备,用知母皂苷TAⅢ纳米脂质体1~4表示)对各种肿瘤细胞增殖的抑制率,采用SPSS 18.0计算IC50,见表4、5。
表4知母皂苷AⅢ脂质体的质量评价结果
T检验:*与知母皂苷AⅢ组比较,P<0.05;**与知母皂苷AⅢ组比较,P<0.01。
表5知母皂苷AⅢ脂质体的质量评价结果
结果表明:知母皂苷TAIII脂质体能够提高药物对肿瘤细胞增殖的抑制作用。
9.7知母皂苷AⅢ及其脂质体对脑胶质瘤U87皮下荷瘤裸鼠抑瘤作用
18只裸鼠,体重18-20g左右,饲养于SPF环境中,裸鼠食料、饮用水、垫料均定期经高压灭菌消毒,鼠笼、垫料一周更换一次。裸鼠造模后随机分为4组:生理盐水组,知母皂苷AⅢ腹腔注射治疗组(60mg/Kg),知母皂苷AⅢ脂质体腹腔注射治疗组(以知母皂苷AⅢ计为60mg/Kg),正常对照组,每组5只。
显微镜下观察脑胶质瘤U87细胞处于对数生长期时,状态好,无污染,胰酶消化,制备成细胞悬液(浓度2×107个/ml)。正常对照组不做种瘤操作。其他三组向每只裸鼠右侧前腋下接种0.1ml的U87细胞悬液,细胞接种量均为2×106个/ml。肿瘤接种当天记为第0天。一周后可以触及肿瘤小块,分为三组:生理盐水组,知母皂苷AⅢ腹腔注射治疗组(60mg/Kg),知母皂苷AⅢ脂质体腹腔注射治疗组(60mg/Kg),以实例8制备的脂质体进行实验。生理盐水组为每次腹腔注射0.1ml的9%生理盐水;知母皂苷AⅢ腹腔注射治疗组(60mg/Kg):取知母皂苷AⅢ混悬液,腹腔注射,给药剂量60mg/Kg,隔天给药1次;知母皂苷AⅢ脂质体腹腔注射治疗组(60mg/Kg):取知母皂苷AⅢ脂质体溶液,腹腔注射,给药剂量60mg/Kg,隔天给药1次;观察18天,观察给药期间和给药结束后连续记录裸鼠存活情况、体重变化、肿瘤大小、精神状态等指标。18天后,处死所有裸鼠,取瘤称重,计算瘤重指数,抑瘤率。瘤重指数=肿瘤重量/裸鼠重量×l00%,抑瘤率=l-实验各组平均瘤重指数/生理盐水组平均瘤重指数×l00%,各组实验结果以mean士SD表示,统计比较采用t检验,P值小于0.05为具有显著统计学差异。实验结果如表6。
表6知母皂苷AⅢ体内抗肿瘤活性实验结果
结果表明,知母皂苷AⅢ虽然细胞实验抑制肿瘤细胞增殖作用很强,但是整体动物实验结果表明,知母皂苷AⅢ药物对脑胶质瘤皮下荷瘤裸鼠的抑瘤效果并不明显,而知母皂苷AⅢ脂质体抑瘤效果高达54.1%,表明知母皂苷AⅢ脂质体可以增强药物本身知母皂苷AⅢ的药效作用。
实施例10、知母皂苷AⅢ纳米脂质体与知母皂苷AⅢ大鼠体内药物动力学差异研究
SD大鼠10只,180-200g,随即分为2组,分知母皂苷AⅢ与其纳米脂质体给药组,大鼠一次性尾静脉注射知母皂苷AⅢ或其脂质体(处方4)10mg/kg(以知母皂苷AⅢ实际含量计算),按1mL/l00g尾静脉注射。给药前眼眶取血作为空白样品,给药后于预先设定时间(2、5、10、30min、1、2、4、6、8、12、24、48、72h)眼眶采血,每次取血0.2mL左右至肝素化样品管中,离心(5000r/min)5min制备血浆,按血浆样品预处理方法处理样品,采用HPLC-MS/MS测定血浆中知母皂苷AⅢ的浓度,DAS程序进行知母皂苷AⅢ的动力学分析,并求算药代动力学参数,比较知母皂苷AⅢ及其脂质体在大鼠体内药代动力学差异,结果见表7。
表7知母皂苷AⅢ纳米脂质体与知母皂苷AⅢ大鼠体内药物动力学参数结果
结果表明,知母皂苷AⅢ脂质体大鼠尾静脉给药,体内药物AUC(0-∞)是知母皂苷AⅢ的2.13倍,体内滞留时间增加了3.7倍,说明知母皂苷AⅢ脂质体的制备可以提高药物体内的吸收度,同时能延长药物作用时间,也进一步佐证了知母皂苷AⅢ脂质体抗肿瘤药效强于知母皂苷AⅢ原型药物。
- 还没有人留言评论。精彩留言会获得点赞!