一种具有光热效应的纳米药物载体及其制备方法及应用与流程
本发明涉及一种具有光热效应的纳米药物载体、该纳米药物载体的制备方法及该纳米药物载体的应用,属于医药技术领域。
背景技术:
癌症治疗一直是临床难题,已成为除心脑血管疾病以外的引起人类死亡的首要疾病。据世界卫生组织(World Health Organization,WHO)报道,全球癌症发病率和死亡率都呈急剧上升趋势,每年都有上千万人因为癌症死亡,而且全世界约60%的癌症新增病例发生在发展中国家。目前癌症的治疗手段有:外科手术治疗、放射治疗、化学药物治疗和生物治疗等。其中,药物化疗是癌症治疗中的常用手段,但是化疗药物毒性大,全身给药往往出现药物利用率低、造成严重的毒副作用以及多药耐药性。因此,设计多功能的药物载体,在控制药物释放以提高药物利用率和降低毒副作用的同时,利用热疗、基因治疗等其他癌症治疗手段以获得与药物化疗的协同作用,可大大提高癌症治疗效果。
热疗作为一种有效的癌症治疗方法已经被广泛接受。热疗就是使患者的肿瘤部位温度升至43℃~48℃,在此温度环境下,怕"热"的癌细胞就会被高热直接杀伤凋亡,而对正常组织没有伤害。正常组织所能承受的温度高于癌细胞受能承受的温度,因此可以通过局部高温来选择性地杀死癌细胞。另外,研究也表明,热疗还能激活处于麻痹状态的免疫系统,产生抗肿瘤免疫,从而抑制和杀灭转移灶或亚临床病灶。除此之外,热疗可提高部分化疗药物的活性以增强化疗药物的疗效。因此,药物化疗和热疗联合使用可获得癌症治疗的协同效应,提高治疗效果。
金属有机框架材料(Metal-Organic Frameworks,MOFs)是由有机配体和金属离子或团簇通过配位键自组装形成的具有分子内孔隙的有机-无机杂化材料,具有高表面积和孔容、结构可调、易于化学修饰。研究表明,Zn、Fe、Zr等离子为金属离子的MOF材料具有生物相容性、可高量储藏药物并获得可控的药物释放行为,以及在特定环境中的可降解性能。另外,近年来的金属有机框架材料制备工艺可实现金属有机框架纳米颗粒的可控制备,这有利于作为载体用于药物输送应用。因此,金属有机框架材料在生物医学领域展现出巨大潜力。
氧化石墨烯(graphene oxide,GO)是石墨粉末经化学氧化及剥离后的产物,GO是单一的原子层,经过氧化处理后,GO仍保持石墨的层状结构,但在每一层的氧化石墨烯单片上引入了许多氧基功能团,如-OH,-COOH,-O-等,这些基团可以与很多材料相互作用,形成复合材料。另一方面,氧化石墨烯有着极宽的从紫外至近红外(UV-NIR)的光吸收,在NIR区的强列光吸收使得氧化石墨烯具有高的光热转换效率。已有研究也表明,氧化石墨烯在癌症的光热治疗方面具有潜在应用。
因此,如何设计制备氧化石墨烯与金属有机框架复合纳米颗粒成为获得抗癌药物输送并协同光热治疗的关键。
技术实现要素:
本发明的目的是提供一种具有光热效应的纳米药物载体、制备方法及应用,以同时满足药物化疗和光热治疗功能。
为了实现上述目的,本发明所采用的技术方案是:
一种具有光热效应的纳米药物载体,其特征在于,包括:金属有机框架,该金属有机框架是由有机配体和金属离子或金属团簇通过配位键自组装形成;以及,氧化石墨烯,嵌入在金属有机框架内部。
本发明所涉及的具有光热效应的纳米药物载体还可以具有这样的特征:纳米药物载体的颗粒粒径为30~500纳米。
本发明所涉及的具有光热效应的纳米药物载体还可以具有这样的特征:金属离子或金属团簇的金属为Zn、Fe、Cu、Co、Ni、Cr、Zr、Sr中的任意一种。
本发明所涉及的具有光热效应的纳米药物载体还可以具有这样的特征:有机配体为2-甲基咪唑、苯三甲酸、对苯二甲酸、硝基对苯二甲酸、氨基对苯二甲酸、己二烯二酸和反丁烯二酸中的任意一种。
并且,本发明还提供了一种制备具有光热效应的金属有机框架/氧化石墨烯纳米药物载体的方法,包括以下步骤:
步骤一,将2-甲基咪唑与预定溶剂以0.2g~2g:25ml的比例进行混合,并进行10~40分钟的磁力搅拌得到2-甲基咪唑溶液,然后将六水硝酸锌(Zn(NO3)2.6H2O)与预定溶剂以0.2g~2g:51ml的比例进行混合得到六水硝酸锌溶液,然后逐滴加入到2-甲基咪唑溶液中,反应20~40分钟,得到反应溶液,其中,加入的2-甲基咪唑溶液与六水硝酸锌溶液的混合体积比为1~10:1;
步骤二,将氧化石墨烯与预定溶剂以0.2mg~2mg:1ml的比例进行混合得到氧化石墨烯溶液,然后加入反应溶液继续搅拌1~4小时,得到生成物溶液,其中,加入的氧化石墨烯溶液与反应溶液的混合体积比为1~10:100;
步骤三,对生成物溶液体进行离心分离,并用水对其洗涤至少一次,对其进行真空干燥,得到所述纳米药物载体。
本发明提供的制备具有光热效应的纳米药物载体的方法,还可以具有这样的特征:甲基咪唑溶液、六水硝酸锌(Zn(NO3)2.6H2O)溶液和氧化石墨烯溶液中的溶剂均为预定溶剂,预定溶剂为水、乙醇、甲醇和乙醇甲醇混合液中的任意一种。
并且,本发明还提供了上述具有光热效应的纳米药物载体作为抗癌药物的载体的应用。
本发明提供的上述应用,还可以具有这样的特征:抗癌药物为阿霉素。
发明作用与效果
根据本发明提供的具有光热效应的纳米药物载体及其制备方法,制备出的纳米药物载体由于具有金属有机框架,可以作为药物载体,又由于该纳米药物载体具有嵌入在所述金属有机框架内部的氧化石墨烯,使得该纳米药物载体可以对光热进行高效转换,适宜癌症的热疗,而热疗又能提高部分化疗药物的活性以增强化疗药物的疗效,所以该纳米药物载体作为抗癌药物的载体,能够将对癌症的热疗和药物化疗结合起来,提高对癌症的治疗效果。
附图说明
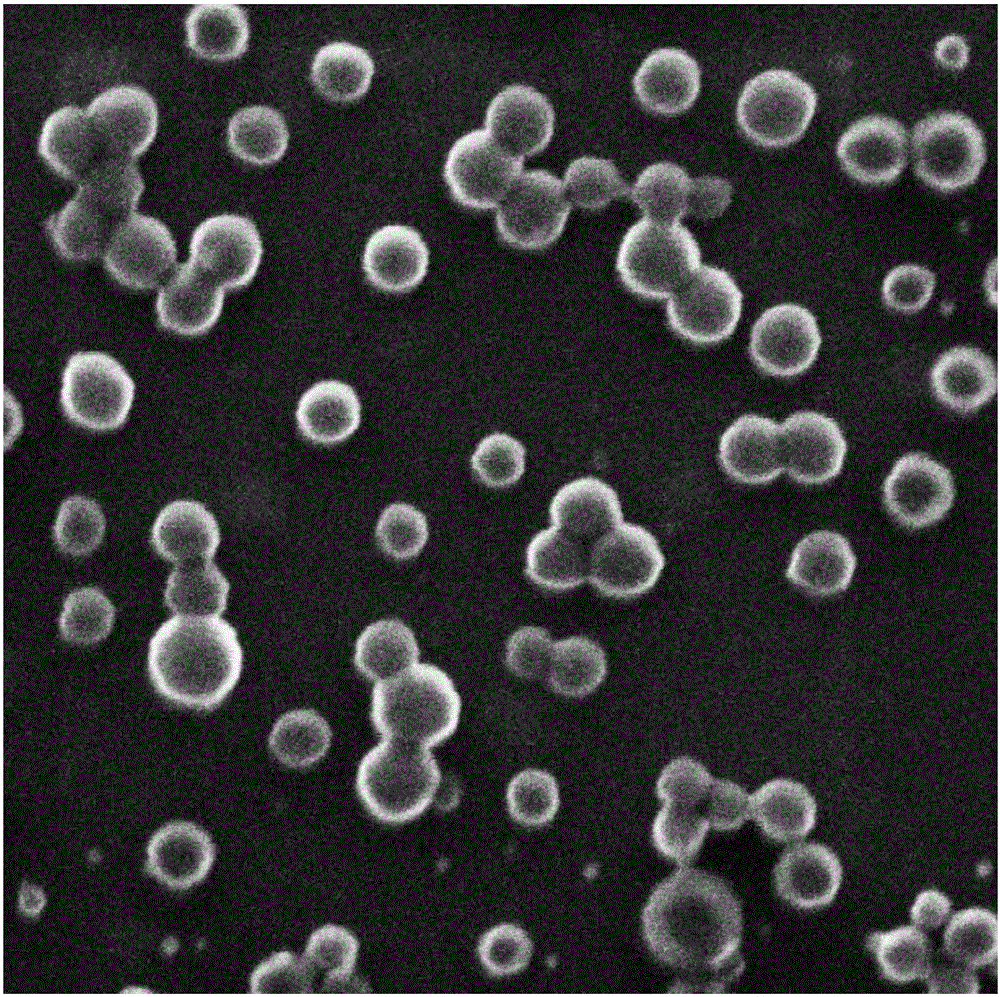
图1为实施例一制备的具有光热效应的纳米药物载体的扫射电镜(SEM)图;
图2为实施例二制备的具有光热效应的纳米药物载体的扫射电镜(SEM)图;
图3为实施例三制备的具有光热效应的纳米药物载体的扫射电镜(SEM)图;
图4为实施例一制备的具有光热效应的纳米药物载体的光热升温曲线;
图5为实施例一制备的具有光热效应的纳米药物载体的细胞毒性结果对比的柱状图;
图6为负载了阿霉素的具有光热效应的纳米药物载体的阿霉素药物释放浓度曲线图;
图7为负载了阿霉素的具有光热效应的纳米药物载体颗粒的细胞吞噬图;
图8为4T1细胞、阿霉素药物、实施例一制备得到的具有光热效应的纳米药物载体和负载了阿霉素的具有光热效应的纳米药物载体分别在红外光照射下抑制癌细胞的效果对比的柱状图。
具体实施方式
以下结合附图,对本发明所涉及的一种具有光热效应的纳米药物载体、制备方法及应用做进一步说明。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;所使用的原料、容器、设备等,如无特殊说明,均可从商业途径得到。
<实施例一>
本实施例为制备具有光热效应的纳米药物载体的方法,包括以下步骤:
步骤一:将2克2-甲基咪唑溶于50ml去离子水中磁力搅拌15分钟后形成澄清溶液;然后将0.95克六水硝酸锌水溶液50毫升逐滴加入上述反应液中,继续反应30分钟;
步骤二:向步骤一的反应体系中加入1毫升的0.5毫克/毫升的氧化氧化石墨烯水溶液,继续搅拌反应1小时,得到反应产物;
步骤三:对反应产物离心分离,并用水清洗三次,于37℃下真空干燥,得到金属有机框架/氧化石墨烯纳米药物载体。
纳米药物载体颗粒外形分析:
图1为实施例一制备的具有光热效应的纳米药物载体的扫射电镜(SEM)图。
如图1所示,采用扫射电镜对本实施例得到的具有光热效应的纳米药物载体进行扫射,得到的扫射电镜(SEM)图显示该纳米药物载体呈球形颗粒,粒径大约60纳米左右,分散性好。
<实施例二>
本实施例为制备具有光热效应的纳米药物载体的方法,包括以下步骤:
步骤一:将2克2-甲基咪唑溶于50ml去离子水中磁力搅拌15分钟后形成澄清溶液;然后将0.95克六水硝酸锌水溶液50毫升逐滴加入上述反应液中,继续反应30分钟;
步骤二:向步骤一的反应体系中加入2毫升的1毫克/毫升的氧化氧化石墨烯水溶液,继续搅拌反应1小时,得到反应产物;
步骤三:对反应产物离心分离,并用水清洗三次,于37℃下真空干燥,得到金属有机框架/氧化石墨烯纳米药物载体。
纳米药物载体颗粒外形分析:
图2为实施例二制备的具有光热效应的纳米药物载体的扫射电镜(SEM)图。
如图2所示,采用扫射电镜对本实施例得到的具有光热效应的纳米药物载体进行扫射,得到的扫射电镜(SEM)图显示该纳米药物载体呈球形颗粒,粒径大约210纳米左右,分散性好。
<实施例三>
本实施例为制备具有光热效应的纳米药物载体的方法,包括以下步骤:
步骤一:将2克2-甲基咪唑溶于50ml去离子水中磁力搅拌15分钟后形成澄清溶液;然后将0.95克六水硝酸锌水溶液50毫升逐滴加入上述反应液中,继续反应30分钟;
步骤二:向步骤一的反应体系中加入3毫升的1.5毫克/毫升的氧化氧化石墨烯水溶液,继续搅拌反应1小时,得到反应产物;
步骤三:对反应产物离心分离,并用水清洗三次,于37℃下真空干燥,得到金属有机框架/氧化石墨烯纳米药物载体。
纳米药物载体颗粒外形分析:
图3为实施例三制备的具有光热效应的纳米药物载体的扫射电镜(SEM)图。
如图3所示,采用扫射电镜对本实施例得到的具有光热效应的纳米药物载体进行扫射,得到的扫射电镜(SEM)图显示该纳米药物载体呈球形颗粒,粒径大约450纳米左右,分散性好。
产品分析
光热效应测试和细胞毒性测试:
对本实施例制备得到的具有光热效应的纳米药物载体进行热效应测试和细胞毒性测试。
采用如下的光热效应测试方法分析本实施例的具有光热效应的纳米药物载体的光热效应:
取5份上述纳米药物载体,每份5毫克,分别放入96孔板中,使用808nm的红外光在不同功率下对放了纳米药物载体的孔板以及不放纳米药物载体的孔板进行照射,观察该纳米药物载体表面的温度变化情况,并将其绘制成曲线来观察纳米药物载体的光热升温效果。
图4为实施例一制备的具有光热效应的纳米药物载体的光热升温曲线图。
从图4中可以看出不加该纳米药物载体的对照组在红外光功率为1.5w/cm2的光照下的温度几乎没有变化,而加了纳米药物载体的孔板在红外光的照射下,升温效果明显,并且升温速率随着功率的增加而加快。当红外光功率为2.5w/cm2时,经5分钟照射可使颗粒的温度从30℃升高至53℃,满足了热疗对温度的要求。
采用如下的细胞毒性测试方法分析本实施例的具有光热效应的纳米药物载体的细胞毒性:
体外细胞毒性测定采用标准的Cell Counting Kit-8方法。细胞采用的是小鼠的乳腺癌细胞(4T1细胞),具体实验过程如下:
将4T1细胞播种在96孔板中(细胞密度5000个/孔)后,将实施例一制备的纳米药物载体分散于DMEM培养液并配制成浓度为25、50、100和200微克/毫升的纳米药物载体悬浮液,然后将其加到96孔板,每种浓度的悬浮液各加12个孔,每个孔中各加入100微升。培养24小时后,向每个孔中加入10微升的CCK-8溶液,细胞继续培养2小时后用酶标仪测定450纳米波长处的吸光度。
纳米药物载体悬浮液处理过的4T1细胞的活细胞与没有纳米药物载体悬浮液处理的4T1细胞的活细胞相比的百分数表示为细胞毒性。
图5为实施例一制备的具有光热效应的纳米药物载体的细胞毒性测试结果对比的柱状图。
图5显示纳米药物载体颗粒的毒性较小,在200微克/毫升时的细胞存活率都已达到90%以上,表明纳米药物载体具有良好的生物相容性,可以作为载体用于药物输送。
产品应用分析:
本实施例制备的具有光热效应的纳米药物载体作为抗癌药物的载体应用时,可以通过如下的步骤将抗癌药物储藏到该载体中:
步骤一:将2克2-甲基咪唑溶于50ml去离子水中磁力搅拌15分钟后形成澄清溶液,接着加入20毫升的2毫克/毫升的阿霉素水溶液,并在黑暗条件下继续搅拌15分钟;
步骤二:将0.95克六水硝酸锌水溶液50毫升逐滴加入步骤一的反应液中,继续反应30分钟,得到反应产物;
步骤三:向步骤二的反应产物中加入1毫升的1.5毫克/毫升的氧化氧化石墨烯水溶液,继续反应1小时,得到生成物;
步骤四:对生成物进行离心分离,并用水对其清洗三次,于37℃下对其真空干燥,得到负载了阿霉素的具有光热效应的纳米药物载体。
对上述负载了抗癌药物阿霉素的具有光热效应的纳米药物载体进行了药物释放测试和细胞吞噬测试:
采用如下的药物释放测试方法分析本实施例的负载了阿霉素的具有光热效应的纳米药物载体的光热效应:
分别取2毫升(PH值为4.5、6.0和7.4)PBS溶液加入到3根离心管中,将4毫克上述负载了阿霉素的具有光热效应的纳米药物载体均分放入上述三根离心管中,在37℃下避光对其分别进行DOX释放实验;以选定的时间间隔对释放体系分别进行离心分离,并分别提取3微升上清液用于紫外-可见光分析,检测缓冲液中所含有的DOX的吸光度,每次试验重复三次,取三次的平均值作为最终的吸光度值。
根据事前绘制完成的DOX浓度与吸光度关系的标准曲线来计算DOX的浓度。
最后计算不同PH值下的DOX药物释放浓度与释放时间的关系,绘制成药物释放性能曲线图。
图6为负载了阿霉素的具有光热效应的纳米药物载体的阿霉素药物释放浓度曲线图。
本测试采用PBS缓冲溶液作为模拟体液来检测负载了阿霉素的纳米药物载体在不同PH值下的药物释放行为。
从图6中可以看出该纳米药物载体的阿霉素药物释放浓度随着PH值的降低而升高,其中,在PH值为7.4时释放浓度仅为10%左右,而当PH值为6.0时的释放浓度已达到70%,在PH值为4.5时的释放浓度已达到80%,表明该纳米药物载体具有PH控制释放功能,可实现纳米药物载体在进入细胞前较少释放抗癌药物,而进入细胞后可以获得抗癌药物的较快释放。
采用如下的细胞吞噬测试方法分析本实施例的负载了抗癌药物阿霉素的具有光热效应的纳米药物载体的细胞吞噬情况:
将1.5×105个4T1细胞播种于一个35mm的玻璃底培养皿,培养24小时;将上述纳米药物载体加到DMEM细胞培养液中,最终浓度为100 微克/毫升,随后将该含有纳米药物载体的细胞培养液加入到上述玻璃底培养皿中分别培养1小时、2小时和4小时,用PBS分别洗涤2次后,加入DAPI甲醇溶液染色15分钟后加入甲醇固定细胞;最后,用共聚焦荧光显微镜观察细胞各自吞噬该纳米药物载体的情况。
图7为负载了阿霉素的具有光热效应的纳米药物载体颗粒的细胞吞噬图。其中,
图7-A-1~图7-A-3为培养1小时后的该纳米药物载体的细胞吞噬图;
图7-B-1~图7-B-3为培养2小时后的该纳米药物载体的细胞吞噬图;
图7-C-1~图7-C-3为培养4小时后的该纳米药物载体的细胞吞噬图。
从图7各图中可以看出该纳米药物载体分布在细胞内,表明细胞能够吞噬负载了阿霉素的具有光热效应的纳米药物载体。
4T1细胞、阿霉素药物、实施例一制备得到的具有光热效应的纳米药物载体和负载了阿霉素的具有光热效应的纳米药物载体分别进行了光热效应测试,具体实验流程如下:
将4T1细胞播种在96孔板中(细胞密度5000个/孔)后,培养24小时;将阿霉素药物、实施例一制备得到的具有光热效应的纳米药物载体和负载了阿霉素的具有光热效应的纳米药物载体分别加到DMEM细胞培养液中,形成浓度均为100微克/毫升的悬浮液,将该三种悬浮液分别加入到上述播种细胞的96孔板中继续培养8小时;然后对每个孔进行红外光照射3分钟,再培养4小时;向每个孔中加入10微升的CCK-8溶液,细胞继续培养2小时;最后用酶标仪测定它们的450纳米波长处的吸光度,以其测定各自的细胞存活率。
图8为4T1细胞、阿霉素药物、实施例一制备得到的具有光热效应的纳米药物载体和负载了阿霉素的具有光热效应的纳米药物载体分别在红外光照射下抑制癌细胞的效果对比的柱状图。
从图8中可以看出,4T1细胞和阿霉素药物的加光和不加光的两组对照组中的细胞存活率相差不大;对加了实施例一制备得到的具有光热效应的纳米药物载体和负载了阿霉素药物的具有光热效应的纳米药物载体的两组细胞中进行808nm的红外光照射3分钟后,细胞大部分死亡,而且负载了阿霉素药物的具有光热效应的纳米药物载体在照射后,细胞存活率最低,仅为18%,表明药物化疗和热疗联合使用可获得癌症治疗的协同效应。
实施例的有益作用与效果
根据本实施例提供的具有光热效应的纳米药物载体及其制备方法,制备出的纳米药物载体由于具有金属有机框架,可以作为药物载体,又由于该纳米药物载体具有嵌入在所述金属有机框架内部的氧化石墨烯,使得该纳米药物载体可以对光热进行高效转换,适宜癌症的热疗,而热疗又能提高部分化疗药物的活性以增强化疗药物的疗效,所以该纳米药物载体作为抗癌药物的载体,能够将对癌症的热疗和药物疗结合起来,提高对癌症的治疗效果;
又由于本实施例的纳米药物载体随着红外光的照射强度的改变,其温度可以显著改变,所以可以通过控制近红外光强度来调控纳米药物载体的光热效应;
又由于本实施例的纳米药物载体具有PH控制药物释放浓度的功能,可实现纳米药物载体在进入细胞前较少释放抗癌药物,而进入细胞后可以获得抗癌药物的较快释放,从而提高了杀死癌细胞的效能。
当然,本发明所涉及的一种具有光热效应的金属有机框架/氧化石墨烯纳米药物载体、制备方法及应用并不仅仅限定于上述实施例一和实施例二中的内容。以上内容仅为本发明构思下的基本说明,而依据本发明的技术方案所作的任何等效变换,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!