用于治疗真菌病的药物组合物的制作方法
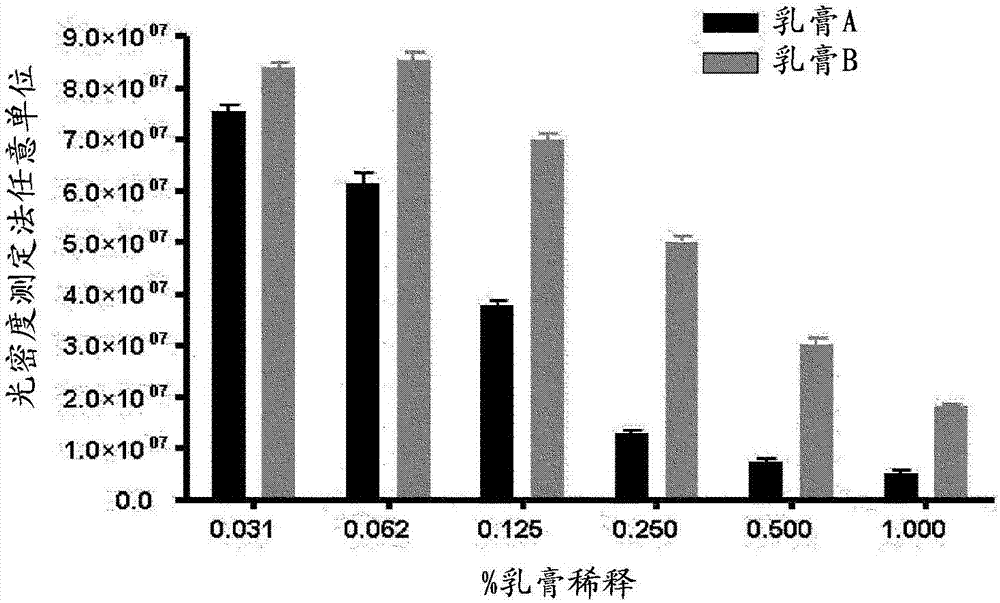
发明领域本发明涉及包含苄达明和抗真菌活性成分的组合的药物组合物,所述的组合在治疗真菌病中具有协同作用。发明背景属于假丝酵母属(candida)的真菌是全世界真菌感染的最常见原因之一。假丝酵母属的许多种是它们的宿主,例如人类的无害共生体或内共生体。属于白假丝酵母(candidaalbicans)种和热带假丝酵母(candidatropicalis)种的真菌通常存在于口腔、胃肠道和阴道的粘膜上。然而,当例如由于用抗生素长期治疗或激素变化,粘膜的菌群被改变时,真菌可以异常繁殖并引起表浅感染,例如在口腔或阴道中,该感染称为念珠菌病。在免疫抑制的人中,真菌甚至可能引起严重的全身感染,称为念珠菌血症,它们有时是致命的。目前由真菌引起的外阴阴道炎占阴道感染的约30-35%,且主要是由白假丝酵母真菌引起。外阴阴道炎伴随阴道ph的变化,且主要症状是阴道和/或外阴剧烈瘙痒、渗出、炎症和疼痛。典型地,治疗是通过以乳膏剂、阴道栓剂和外用溶液的形式施用局部抗真菌药。在严重和/或复发感染的情况下,口服抗真菌药。pevaryltm是用于治疗外阴阴道真菌病的市售乳膏剂,包含1%w/w的硝酸益康唑。益康唑是一种咪唑衍生物,具有广谱抗真菌活性并且通常用于治疗白假丝酵母真菌病。几篇专利申请公开了可用于治疗口腔和外阴阴道真菌病的活性成分的组合。wo96/26724公开了包含抗炎量的苄达明或其盐、抗微生物有效量的抗微生物剂和药学上可接受的载体或赋形剂的药物组合物。us2009/0208558涉及抗真菌剂和上皮细胞或内皮细胞粘附抑制剂在生产用于局部治疗假丝酵母真菌病的组合药物中的用途。大多数药物组合显示加和作用。然而,在一些情况下,组合显示比加和作用更弱的作用或比加和作用更强的作用。这些组合分别称为拮抗组合或协同组合。拮抗或协同作用是不可预期的并且是预料不到的实验发现。然而,发现非常有效的活性剂组合(即,协同性混合物)存在挑战。偶然性不是有效的路线,因为潜在药剂组合的数量是惊人地巨大的。从机制的知识推导潜在组合的另一个正常发现策略的潜能也是有限的,因为活生物体的许多生物学终点受到多种途径影响。这些途径通常是未知的,且即使已知这些途径,这些途径相互作用产生生物学终效应的方式通常是未知的。发明概述申请人面临提供用于治疗真菌病、与本领域已知的组合物相比具有改善的活性的药物组合物的问题。申请人已发现,苄达明可以与衍生自咪唑的抗真菌活性成分联合使用。特别地,申请人现在令人惊奇地发现,苄达明与衍生自咪唑的抗真菌活性成分的组合在抑制属于假丝酵母属的真菌的生长中具有协同作用。因此,在第一个方面,本发明涉及包含苄达明和咪唑类抗真菌药或其盐的组合,以及至少一种药学上可接受的赋形剂的药物组合物,该药物组合物用于治疗假丝酵母真菌病。有利地,根据本发明的组合物中的苄达明缓解外阴阴道瘙痒和疼痛。优选地,所述的咪唑类抗真菌药选自联苯苄唑、布康唑、氯米达唑、克霉唑、氯康唑、益康唑、芬替康唑、酮康唑、异康唑、咪康唑、奈康唑、奥莫康唑、奥昔康唑、舍他康唑、硫康唑、噻康唑或它们的盐。更优选地,所述的咪唑类抗真菌药选自联苯苄唑、布康唑、克霉唑、益康唑、芬替康唑、酮康唑、异康唑、咪康唑、奥莫康唑、舍他康唑、硫康唑、噻康唑或它们的盐。甚至更优选地,所述的咪唑类抗真菌药选自布康唑、益康唑、芬替康唑、异康唑、咪康唑、硫康唑或其盐。有利地,所述的咪唑类抗真菌药是益康唑、咪康唑或它们的盐。优选地,所述的假丝酵母真菌病由白假丝酵母(candidaalbicans)、葡萄牙假丝酵母(candidalusitaniae)、热带假丝酵母(candidatropicalis)、光滑假丝酵母(candidaglabrata)、皱落假丝酵母(candida.rugosa)、近平滑假丝酵母(candidaparapsilosis)、热带假丝酵母或杜氏假丝酵母(candidadubliniensis)引起。更优选地,所述的假丝酵母真菌病由白假丝酵母、葡萄牙假丝酵母或热带假丝酵母引起。更优选地,所述的假丝酵母真菌病是粘膜念珠菌病、皮肤念珠菌病、甲癣、系统性念珠菌病、医源性念珠菌病、尿布念珠菌病、肠念珠菌病或念珠菌龟头炎。甚至更优选地,所述粘膜念珠菌病是口腔或外阴阴道粘膜念珠菌病。附图简述图1形象地显示使用1%至0.03%重量/体积的乳膏剂,用琼脂稀释法在包含白假丝酵母菌株atcc10231的板上测试的实施例7的乳膏剂a至c的活性结果。图2图示在图1的板上进行的光密度测定法分析的结果。发明详述在本说明书中,表述“协同作用”意指苄达明和咪唑类抗真菌药的组合以低于苄达明和所述抗真菌咪唑类单独用于相同菌株以获得相同抑制作用的浓度总和的浓度抑制属于假丝酵母属的真菌菌株的生长。换句话说,协同作用意指苄达明和咪唑类抗真菌药的组合有效产生超过在相同菌株中每种成分的加和作用的作用。在本申请中按照相对抑制浓度(fic)指数定义协同,该指数是每种组合中使用的个体药物的fic的总和,如meletiadisj.等人在antimicrobialagentsandchemotherapy,2010年2月,第602-609页中所述。在严格的科学和优选的定义下,协同被定义为fic指数小于0.5,即,当每种药物如果单独使用产生相同效果所需浓度(即,每种药物的最小抑制浓度(mic))的四分之一或更低的组合产生50%抑制作用时。在该严格的定义下,0.5的fic指数定义了加和响应。在用于本申请目的的更广泛的定义下,协同有效的量被定义为fic指数小于1.0,即,当每种药物的mic的一半或更低的组合产生50%抑制作用时。在这种更广泛的定义下,1.0的fic指数定义了加和响应。在这种测试下,可以从苄达明和抗真菌咪唑类的各种组合在每种菌株中的剂量响应曲线制备等效线图,线下方的点表示协同,该线将苄达明为1的fic指数与抗真菌咪唑类为1的fic指数关联起来。该标准允许确定所测试的组合的mic,以便提供得到协同混合物所需的每种成分的mic。确切的量将取决于例如特定的菌株。在本说明书和所附权利要求书中,表述“咪唑类抗真菌药”表示在它们的化学结构中包含咪唑环的抗真菌活性成分。优选地,根据本发明的药物组合物包含含量0.001重量%重量至1重量%重量,更优选0.05重量%至0.5重量%,甚至更优选0.08重量%至0.2重量%的苄达明。优选地,根据本发明的药物组合物包含含量为0.01重量%至4重量%,更优选0.1重量%至2重量%,甚至更优选0.5重量%至1.5重量%的咪唑类抗真菌药或其盐。优选地,根据本发明的药物组合物用于局部应用。优选地,将根据本发明的药物组合物制备成适合的剂型,例如乳膏剂、软膏剂、洗剂、凝胶剂、泡沫剂、阴道栓剂、延长释放阴道栓剂、阴道灌洗剂或外用溶液。更优选地,所述的剂型是乳膏剂、软膏剂、洗剂、阴道灌洗剂或外用溶液。甚至更优选地,所述的剂型是乳膏剂或阴道灌洗剂。药学上可接受的赋形剂可以选自软化剂、增稠剂、防腐剂、稳定剂、表面活性剂、缓冲剂、用于调节渗透压的盐、乳化剂等。优选地,根据本发明的药物组合物包含一种或多种具有6至9的hlb的乳化剂和一种或多种具有大于9至12的hlb的乳化剂。本发明中可用的具有6至9的hlb的乳化剂是,例如,鲸蜡硬脂醇、鲸蜡硬脂醇聚醚-20、聚甘油-3-二异硬脂酸酯、山梨坦硬脂酸酯和蔗糖椰油酸酯的混合物、peg-4二月桂酸酯、甲基葡萄糖倍半硬脂酸酯、月桂醇聚醚-2、月桂醇聚醚-3、peg-8二油酸酯、聚甘油-5-二油酸、硬脂酰乳酸钠、山梨坦月桂酸酯、月桂酰聚乙二醇-6甘油酯、peg-40山梨坦过油酸酯、聚甘油-3硬脂酸酯、聚甘油-2月桂酸酯。本发明中可用的具有从高于9至12的hlb的乳化剂是,例如,月桂醇聚醚-4、peg-7甘油椰油酸酯、peg-20杏仁甘油酯、聚甘油-3棕榈酸酯、peg-25氢化蓖麻油、硬脂酰胺、甘油硬脂酸酯peg-100硬脂酸酯的混合物、聚山梨酯85、peg-7橄榄酸酯(olivate)、鲸蜡硬脂葡萄糖苷、鲸蜡硬脂橄榄酸酯、甘油单硬脂酸酯、聚甘油-10二异硬脂酸酯、聚山梨酯85、聚甘油-5油酸酯、peg-8油酸酯、甘油硬脂酸柠檬酸酯、peg-7甘油椰油酸酯、聚甘油-3甲基葡萄糖二硬脂酸酯。具有高于9至12的hlb的特别优选的乳化剂是tefose63,即peg-6和peg-32棕榈酸硬脂酸酯和二醇硬脂酸酯的混合物,以及gelot64,即甘油单硬脂酸酯和peg-75硬脂酸酯的混合物,它们均由法国gattefossésas制造。具有6至9的hlb的特别优选的乳化剂是labrafilm2130cs,即月桂酰聚氧乙烯-6甘油酯类的混合物,以及labrafilm1944cs,即油酰基聚氧乙烯-6甘油酯类的混合物,它们两者都是由法国gattefossésas制造。下面的实施例旨在进一步举例说明本发明,但不限制本发明。实施例实施例1-5中公开的测试的目的在于评估苄达明和咪唑-抗真菌药的组合对属于假丝酵母属真菌菌株的体外杀真菌活性。实施例11.1真菌菌株的制备将储存在-80℃的假丝酵母属菌株融化并且在sda平板上划线,然后进行第二次传代培养。然后,如下制备假丝酵母属菌株悬浮液。将10ml盐水放入具有5g玻璃珠的50mlfalcon试管中。将第二次传代培养物的菌环量的菌落细胞转移到盐水中,并通过将接种环对试管的湿壁摩擦以逐出细胞而使其悬浮。然后使用机械摇动器振摇管3分钟。根据0.5号mcfarland标准,使用盐水将悬浮液中的细胞数从1.5x106调节至5.0x106个菌落形成单位(cfu)/ml,并在550nm处读出光密度。为了进行计数,使用盐水制备连续1:10稀释液,以获得悬浮液的10-4和10-5的稀释液。将100μl的每种稀释液样品铺板,并在37℃下培养48h。通过视觉检查计数菌落数,并且发现细胞密度在期望的范围内。1.2琼脂稀释法该方法与r.moody等人,“invitroactivitiesofmiconazole,miconazolenitrateandketoconazolealoneandcombinedwithrifampinagainstcandidaspp.andtorulopsisglabratarecoveredfromcancerpatients.”,antimicrobialagentsandchemotherapy:1980,17,871-875所公开的方法类似。1.2.1活性成分溶液的制备使用标准培养皿(92mm直径×16mm高)。倾倒琼脂后,让板冷却,然后立即使用。(a)如下文所述制备用于计算活性成分的mic的溶液。将硝酸益康唑和硝酸咪康唑各自溶于100%二甲基亚砜(dmso)至浓度为每毫升5.0mg的活性药物。然后,在dmso中制备连续1:2稀释液,至浓度为5.0mg/ml-0.078mg/ml。将0.250ml的硝酸益康唑溶液或硝酸咪康唑溶液各自加到24.75ml(按1:100稀释)融化的沙氏葡萄糖培养基琼脂(difcolaboratoires,detroit,mich)中,混合,并且倾入标准培养皿中,至最终浓度为50μg/ml-0.78μg/ml。将苄达明溶于水至12.5mg/ml的浓度。然后,在水中制备连续1:2稀释液,至浓度为12.5mg/ml-1.56mg/ml。将1ml苄达明的各溶液加到24ml(按1:25稀释)融化的沙氏葡萄糖培养基琼脂中,混合,倾入标准培养皿中,至最终浓度为0.5mg/ml-0.0625mg/ml。作为阳性对照,来自1600μg/ml储备溶液的两性霉素b在dmso中被稀释至具有50μg/ml-6.25μg/ml的浓度的溶液。将这些溶液在沙氏葡萄糖培养基琼脂中以1:100稀释,混合并倾入标准培养皿中,至最终浓度为0.5μg/ml-0.0625μg/ml。在本实验中包括水、dmso和水+dmso的阴性对照。(b)为了进行协同研究,在dmso中制备具有2.5mg/ml-0.098mg/ml浓度的益康唑和咪康唑硝酸盐的另外的溶液,如第1.2.1(a)段中所公开的制备连续1:2稀释液。此外,在水中制备具有6.25mg/ml-1.56mg/ml的浓度的苄达明的另外的溶液,如第1.2.1(a)段中所公开的制备连续1:2稀释液。此外,将浓度为6.25mg/ml的苄达明溶液用水按1:1.43稀释,得到具有4.37mg/ml的浓度的苄达明溶液。然后将0.250ml的益康唑或咪康唑硝酸盐的各溶液和1ml的苄达明的各溶液加到23.750ml融化的沙氏葡萄糖培养基琼脂(difcolaboratoires,detroit,mich)中,混合,倾入标准培养皿中,由此得到25μg/ml-0.098μg/ml益康唑或咪康唑的终浓度和0.25mg/ml-0.0625mg/ml和0.175mg/ml的苄达明的终浓度。1.2.2易感性测试(a)为了计算mic,给按照第1.2.1(a)段中所述制备的每个标准培养皿的表面接种如第1.1段中所述制备的假丝酵母属菌株悬浮液的4个斑点(20μl接种体积)。将接种到含有两性霉素b的标准培养皿上的测试悬液用作阳性对照。将接种到不含药物但含有水、dmso和水+dmso的标准培养皿上的测试悬浮液用作阴性对照。将所有培养皿在35℃下培养48h。(b)为了进行协同研究,给如第1.2.1(b)段中所述制备的每个培养皿的表面接种如第1.1段中所述制备的假丝酵母属菌株悬浮液的四个斑点(20μl接种体积),并在35℃下培养48小时。1.3肉汤稀释法用于肉汤稀释法的方法与“eucastdefinitivedocumentedef7.1:methodforthedeterminationofbrothdilutionmicsofantifungalagentsforfermentativeyeasts”(clinmicrobiolinfect2008;14:398-408)中所公开的方法类似。1.3.1活性成分溶液的制备(a)如下文所述制备用于计算活性成分的mic的溶液。将硝酸益康唑和硝酸咪康唑各自溶于100%二甲基亚砜(dmso)至浓度为每毫升10.0mg活性药物。然后,在dmso中制备连续1:2稀释液,至浓度为10.0mg/ml-0.078mg/ml。将这些溶液在不含nahco3的包含2%葡萄糖、3-(n-吗啉代)丙磺酸(mops,来自sigma)的rpmi-1640(来自lifetechnologies)中进一步按照1:100稀释至终浓度为100μg/ml-0.78μg/ml。将硝酸克霉唑溶于100%二甲基亚砜(dmso)至浓度为每毫升1.250mg活性药物。然后,在dmso中制备连续1:2稀释液至浓度为1.250mg/ml-0.0196mg/ml。将这些溶液在不含nahco3的包含2%葡萄糖、3-(n-吗啉代)丙磺酸(mops,来自sigma)的rpmi-1640(来自lifetechnologies)中进一步按1:100稀释至终浓度为12.50μg/ml-0.196μg/ml。将硝酸氟康唑溶于100%二甲基亚砜(dmso)至浓度为每毫升5.0mg活性药物。然后,在dmso中制备连续1:2稀释液至浓度为5.0mg/ml-0.3125mg/ml。将这些溶液在不含nahco3的包含2%葡萄糖、3-(n-吗啉代)丙磺酸(mops,来自sigma)的rpmi-1640(来自lifetechnologies)中进一步按1:100稀释至终浓度为50μg/ml-3.125μg/ml。将苄达明溶于水中至25mg/ml的浓度。然后,在水中制备连续1:2的稀释液至浓度为25mg/ml-3.125mg/ml。将1ml的各溶液加到24ml(1:25稀释)的不含nahco3的包含2%葡萄糖、3-(n-吗啉代)丙磺酸(mops,来自sigma)的rpmi-1640(来自lifetechnologies)中至终浓度为1mg/ml-0.125mg/ml。作为阳性对照,来自1600μg/ml储备溶液的两性霉素b在dmso中被稀释至具有200μg/ml-50μg/ml的浓度的溶液。将这些溶液在不含nahco3的包含2%葡萄糖、3-(n-吗啉代)丙磺酸(mops,来自sigma)的rpmi-1640(来自lifetechnologies)中进一步按1:100稀释至终浓度为2μg/ml-0.5μg/ml。在本实验中包括水、dmso和水+dmso的阴性对照。(b)为了进行协同研究,如第1.3.1(a)段中所述,在rpmi-1640中国制备了具有浓度为100μg/ml-0.049μg/ml的硝酸益康唑、硝酸咪康唑、硝酸克霉唑和硝酸氟康唑的其它溶液。此外,如第1.3.1(a)段中所公开的,在rpmi-1640中制备了具有浓度为1mg/ml-0.25mg/ml的苄达明的其它溶液。此外,用rpmi-1640将浓度为1mg/ml的苄达明溶液进一步按1:1.43稀释至浓度为0.7mg/ml。1.3.2易感性测试使用包含具有标称容量约为300μl/孔的孔的微量稀释板。使如第1.1段中所述制备的假丝酵母属菌株悬浮液在沙氏葡萄糖培养基琼脂培养基sda(oxoid)上生长。将菌落在磷酸盐缓冲盐水(pbs)中稀释,并使用mcfarland0.5标准将悬浮液调节至约1-5x105cfu/ml,并在550nm处读取光密度。通过将来自假丝酵母属菌株的第二次传代培养的单一菌落悬浮以获得类似于0.5mcfarland标准的光密度(约1-5x105cfu/ml)来制备标准接种物。(a)为了计算mic,制备微量稀释板,其在每个孔中包含100μl如第1.3.1(a)段中所述得到的活性成分的每种溶液。然后给所述孔接种100μl如上文所公开获得的包含1-5x105cfu/ml的假丝酵母属菌株悬浮液。在每个孔中,最终的接种密度和活性成分的最终浓度是所用的一半(即最终接种密度为0.5-2.5x105cfu/ml,益康唑和咪康唑的浓度为50μg/ml-0.39μg/ml,克霉唑的浓度为6.25μg/ml-0.098μg/ml,氟康唑的浓度为50μg/ml-3.125μg/ml,且苄达明的浓度为0.5mg/ml-0.0625mg/ml)。将包含100μl两性霉素b的接种了100μl相同的假丝酵母属悬浮液的孔用作阳性对照。将包含100μl水、dmso和水+dmso和接种了100μl相同的假丝酵母属悬浮液的无菌不含药物的培养基的孔用作阴性对照。将微量稀释板在35℃下培养48小时。(b)为进行协同研究,制备在每个孔中包含50μl的益康唑和咪康唑的每种溶液以及50μl如第1.3.1(b)段中所公开得到的苄达明的每种溶液的微量稀释板。然后,用100μl的1-5x105cfu/ml假丝酵母属悬浮液接种所述孔。在每个孔中,最终的接种密度是所用的一半(即0.5-2.5x105cfu/ml),且活性成分的终浓度是所用的四分之一(即,益康唑和咪康唑的浓度为25μg/ml-0.098μg/ml,克霉唑的浓度为0.78μg/ml-0.049μg/ml,氟康唑浓度为25μg/ml-3.125μg/ml,且苄达明的浓度为0.25mg/ml-0.0625mg/ml和0.175mg/ml)。将微量稀释板在35℃下培养48小时。1.4mic的计算产生对某种假丝酵母属菌株的生长完全抑制的最低药物浓度被认为是对该菌株的最小抑制浓度(mic)。使用第1.2段中所公开的琼脂稀释法得到对葡萄牙假丝酵母34449的mic值。使用第1.3段中所公开的肉汤稀释法得到了对白假丝酵母mya-427、热带假丝酵母750、白假丝酵母10231和白假丝酵母mya-574氟康唑抗性的mic值。硝酸益康唑、硝酸咪康唑、硝酸克霉唑、硝酸氟康唑和苄达明对所测试的假丝酵母属菌株的mic值公开在下表1中。表1用作阴性对照的水、dmso和水+dmso显示没有抑制作用(n/a)。1.5协同作用用在第1.2段中公开的琼脂稀释法,评估了苄达明和硝酸益康唑在沙氏葡萄糖培养基琼脂中对葡萄牙假丝酵母34449的杀真菌活性。根据meletiadisj.等人在antimicrobialagentsandchemotherapy,2010年2月,第602-609页中所述,通过计算相对抑制浓度(fic)评估了包含苄达明和硝酸益康唑的组合的协同作用。fic值比较了包含苄达明和硝酸益康唑的组合的抗真菌活性与单独测试的活性成分各自的抗真菌活性。使用下列等式计算了包含苄达明和硝酸益康唑的组合对每种假丝酵母属菌株的fic值(fic[组合b+e]):fic[组合b+e]=fic[b]+fic[e]其中:fic[b]是苄达明对特定假丝酵母属菌株的相对抑制浓度,其被计算为在亚-mic量的益康唑的存在下苄达明的mic(mic(b+e))与单独的苄达明的mic(mic(b))之间的比值,如下:fic[e]是益康唑对特定假丝酵母菌株的相对抑制浓度,其被计算为在亚-mic量的苄达明的存在下益康唑的mic(mic(e+b))与单独的益康唑的mic(mic(e))之间的比值,如下:根据meletiadisj.等人,antimicrobialagentsandchemotherapy,2010年2月,第602-609页所述,将协同定义为低于0.5的fic。表2在上表中,字母“g”表示观察到了葡萄牙假丝酵母34449的生长。使用上文公开的等式计算了苄达明和硝酸益康唑的组合的fic(fic[组合b+e]):fic[b]=0.125/0.5=0.25fic[e]=0.098/1.56=0.0628fic[组合b+e]=0.0628+0.25=0.3128上述结果证实,当活性成分苄达明和硝酸益康唑在亚-mic浓度下联用时,观察到了对葡萄牙假丝酵母34449的协同杀真菌活性。下列实施例2-5概括了对于其它假丝酵母属菌株得到的结果。实施例2用第1.3段中公开的肉汤稀释方法,评估了苄达明和硝酸益康唑或硝酸咪康唑在rpmi-1640中对白假丝酵母mya-427的杀真菌活性。将结果概括在表3中。表3g=观察到了生长上述数据清楚地表明,与苄达明的组合使得硝酸益康唑的mic从表1中所示的25μg/ml降低至1.56μg/ml,并且硝酸咪康唑的mic从表1中所示的25μg/ml降低至0.78μg/ml。实施例3用第1.3段中公开的肉汤稀释方法,评估了苄达明和硝酸益康唑或硝酸咪康唑在rpmi-1640中对热带假丝酵母750的杀真菌活性。将结果概括在表4中。表4g=观察到了生长上述数据清楚地表明,与苄达明的组合使得硝酸益康唑的mic从表1中所示的12.5μg/ml降低至1.56μg/ml,并且硝酸咪康唑的mic从表1中所示的6.25μg/ml降低至0.78μg/ml。实施例3a用第1.3段中公开的肉汤稀释方法,评估了苄达明和硝酸克霉唑或硝酸氟康唑在rpmi-1640中对热带假丝酵母750的杀真菌活性。将结果概括在表4a中。表4ag=观察到了生长上述数据清楚地表明,与苄达明的组合使得硝酸克霉唑的mic从表1中所示的6.25μg/ml降至0.098μg/ml,并且硝酸氟康唑的mic从表1中所示的50μg/ml降低至6.25μg/ml。使用上文公开的等式计算的苄达明和硝酸克霉唑的组合的fic(fic[组合b+c])结果为0.37。使用上文公开的等式计算的苄达明和硝酸氟康唑的组合的fic(fic[组合b+f])结果为0.48。实施例4用第1.3段中公开的肉汤稀释方法,评估了苄达明和硝酸益康唑或硝酸咪康唑在rpmi-1640中对白假丝酵母10231的杀真菌活性。将结果概括在表5中。表5g=观察到了生长上述数据清楚地表明,与苄达明的组合使得硝酸益康唑的mic从表1中所示的25μg/ml降低至3.125μg/ml,并且硝酸咪康唑的mic从表1中所示的6.25μg/ml降至1.56μg/ml。实施例5用第1.3段中公开的肉汤稀释方法,评估了苄达明和硝酸益康唑或硝酸咪康唑在rpmi-1640中对耐氟康唑的白假丝酵母mya-574的杀真菌活性。将结果概括在表6中。表6g=观察到了生长上述数据清楚地表明,与苄达明的组合使得硝酸益康唑的mic从表1中所示的25μg/ml降低至12.5μg/ml,并且咪康唑硝酸盐的mic从表1中所示的50μg/ml的降低至12.5μg/ml。此外,当与益康唑组合时,苄达明的mic从表1中所示的0.5mg/ml降低至0.125mg/ml,并且当与咪康唑组合时,降低至0.0625mg/ml。实施例6下表7显示了三个根据本发明的药物组合物的制剂,其呈用于局部应用的乳膏剂形式。所有值都以相对于制剂总含量的重量百分比表示。表7miglyol812:辛酸/癸酸三甘油酯(sasololefin&surfactantsgmbh,德国compritol888ato:山萮酸甘油酯(gattefossésas,法国)gelot64:单硬脂酸甘油酯和peg-75硬脂酸酯的混合物-hlb10(gattefossésas,法国)tefose63:peg-6和peg-32棕榈硬脂酸酯/硬脂酸乙二醇酯-hlb10(gattefossésas,法国)labrafilm1944cs:油酰基聚氧乙烯-6甘油酯-hlb9(gattefossésas,法国)labrafilm2130cs:月桂酰基聚乙二醇-6甘油酯-hlb9(gattefossésas,法国)测试了乳膏制剂f1用于评估施用8小时后活性成分的释放。franz扩散池实验用于分析盐酸苄达明通过基底膜的体外透皮通量率。franz扩散池是用于测量透皮通量率的常见和众所周知的方法。一般性franz池方法描述在franz,t.j.,percutaneousabsorption:ontherelevanceofinvitrodata.jinvestderm,64:190-195(1975)中。以下是本实施例中使用的方法。使用具有0.45μm的孔隙的再生纤维素膜。在使用前用nacl0.9%重量/体积溶液调节该膜,目的在于从孔中除去空气。膜与产品的接触面积为0.6cm2。使接收室在37℃下恒温。将1克乳膏制剂1施用于供体室中的膜上。在8小时期间每小时取出0.3mlnacl0.9%重量/体积接收溶液,并用新鲜溶液替换。使用hplc方法分析收集的样品。将结果报告为相对于时间每单位面积释放的活性成分的累积量。将测试结果概括在下表8中。表8进度(h)活性成分的释放(μg/cm2)0015.4028.00310.13412.04513.41614.90716.50817.40实施例7与乳膏剂(仅包含1%硝酸益康唑的市售乳膏剂)(乳膏剂b)和安慰剂(乳膏剂c)的活性相比,测试了包含表7的乳膏剂f1的相同成分的本发明的乳膏制剂(乳膏剂a)的抗假丝酵母活性。白假丝酵母菌株atcc10231用于研究乳膏剂a-c的抗真菌特性,特别进一步证实苄达明的存在对益康唑的杀真菌活性具有影响。为此目的,根据asterholm等人(actadermvenereol2010;90:239–245)建立了琼脂稀释测定法,从而可以测试所述乳膏剂。由于技术需要,所述乳膏剂必须在琼脂中稀释,使得最终乳膏剂浓度在0.03%-1%(w/v)的范围内。如附图1和附图2中所报道的,所述板的目视检查和光密度测定分析确认,苄达明的存在增加了益康唑的杀真菌活性。实际上,光密度测定分析的数据表明,四分之一浓度的乳膏剂a足以获得类似于使用乳膏剂b观察到的生长减少。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1