益母草碱的新用途的制作方法
本发明属于中药制剂领域,涉及益母草碱的药用新用途,具体涉及益母草碱在制备治疗或预防抑郁症药物中的应用。
背景技术:
抑郁症是一种复杂的、持久的情感障碍类疾病,又称之抑郁障碍,其主要临床表现以显著而持久的心境低落、兴趣缺失、情绪的消沉、甚至悲观厌世,企图自杀等行为。据统计,自2004年起抑郁症已经成为人类第三大顽症,预计至2030年抑郁症可能成为影响人类生活的第一大疾病。
大量研究显示,抑郁症除社会环境诸多因素外,尚存在单胺类神经递质缺乏,丘脑-垂体-肾上腺皮质(HPA)轴亢进,脑内神经营养因子缺乏,神经炎症等病理假说。临床应用的抗抑郁药主要针对单胺类神经递质缺乏这一病理机制,包括单胺氧化酶抑制剂,选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂、选择性去甲肾上腺素(Norepinephrine,NE)再摄取抑制剂和三环类抗抑郁药等,上述药物虽然具有较好的治疗作用,已在临床上得到广泛的应用,但大多存在药效弱、起效慢、不良反应大、作用时间短等缺陷,如目前临床常用的是三环类抗抑郁药丙米嗪、选择性5-HT再摄取抑制剂氟西汀(Fluoxetine,FLX)。迄今,大约三分之一的抑郁症患者对传统的抗抑郁治疗无效。阐明抗抑郁作用新机制、寻找抗抑郁治疗新靶点、研发新的有效的治疗药物依然是神经科学研究的难点与重任。近年来,从中药/天然药物中开发抗抑郁制剂有望成为突破方向之一。
益母草属中药唇形科益母草(Leonurus japonicas houtts)属植物,始载于《神农本草经》,中医药文献中记载其功能主治为活血、调经、祛瘀、消水,素有“血脉圣药”、“经产良方”之称。自1990年以来,益母草已被列入中华人民共和国药典,超过300种含有益母草的处方被用于治疗各种疾病,其药理作用主要是对妇产科和心血管方面的保护。有研究报道指出益母草对孕期妇女的焦虑具有保护作用;益母草混合提取物对缺血性中风模型大鼠具有保护作用(中国专利申请号:20101087017.4)。益母草碱(Leonurine)作为益母草中主要的有效生物碱,现代药理研究界已证明益母草碱具有兴奋子宫、溶栓、抗凝、降血黏度、降脂、降低红细胞聚集、抑制血小板聚集、改善微循环、抗氧自由基、抗炎、减少细胞内钙超载等诸多药理作用,为其临床应用提供了可靠的理论基础。近年来研究报道指出益母草碱有许多非同于传统适应症的药物作用如抗糖尿病,心血管保护,脑卒中治疗,以及在肾脏损伤中发挥着重要作用。
然而,至今益母草碱对抑郁症的效应尚未见报道,本发明通过相关实验研究,从多方面确证益母草碱作为防治抑郁症药物应用的可能。
技术实现要素:
发明目的:为了解决上述技术问题,本发明的目的在于提供了益母草碱在制药中的新用途,具体涉及益母草碱在制备预防或治疗抑郁症药物中的应用。
本发明的益母草碱是基于中草药益母草的活性单体益母草碱的结构经化学合成得到,其分子式为C14H21N3O5,分子量为311.33,熔点为238℃,具体结构式如下:
本发明应用慢性温和性应激(Chronic mild stress,CMS)模型诱导小鼠抑郁样行为,观察益母草碱对CMS小鼠抑郁样行为影响,实验结果显示,益母草碱显著改善CMS小鼠的抑郁样行为,表现为糖水偏爱率(SPT)显著升高,强迫游泳(FST)和悬尾实验(TST)小鼠的不动时间显著缩短。
本发明应用高效液相色谱技术观察益母草碱对CMS小鼠脑内单胺类神经递质的影响。实验结果显示,益母草碱显著增加CMS小鼠脑内单胺类神经递质5-HT、NE、多巴胺(Dopamine,DA)的含量。
本发明应用尼氏染色、透射电镜技术观察益母草碱对CMS小鼠海马神经元的影响。尼氏染色结果显示,益母草碱显著改善CMS抑郁小鼠海马区神经元形态和结构;透射电镜结果显示,益母草碱显著改善CMS小鼠海马神经元损伤及神经元髓鞘结构异常。
本发明应用免疫荧光法观察益母草碱对CMS小鼠海马星形胶质细胞的影响,实验结果显示,益母草碱显著增加CMS小鼠海马星形胶质细胞的数量,具有改善脑内微环境的可能。
本发明应用Western Blot方法检测益母草碱对CMS小鼠海马炎症相关因子IL-1β、IL-6、TNF-а、NF-ΚB信号通路及神经营养因子BDNF、GDNF的影响。实验结果显示,益母草碱显著抑制CMS小鼠脑内神经炎症因子IL-1β、IL-6、TNF-а的蛋白表达及NF-ΚB信号通路的激活,升高神经营养因子BDNF、GDNF的水平。
本发明中所述的益母草碱,包含但不仅限于益母草碱及其盐,包含且不仅限于在单组分及复方制剂中的应用。本发明所述的预防或治疗抑郁症药物的剂型包含且不仅限于片剂、胶囊、缓释片、控释片、口服液、糖浆、滴丸、注射液剂型、冻干粉针剂型等。
已知抑郁症发病机制复杂,可能涉及多系统、多环节功能失调或障碍。本发明运用多系统、多角度的研究,综合阐明益母草碱对抑郁症的预防与治疗作用及其机制。由本发明所述可知,益母草碱改善CMS小鼠抑郁样行为的作用,与其增加脑内单胺类神经递质,抑制神经炎症,增加神经营养因子,调节星形胶质细胞改善脑内微环境等有关。
本发明内容还包括益母草碱在构建CMS动物模型中的应用。
本发明内容还包括益母草碱在构建CMS小鼠模型中的应用。
作为优选,本发明中每kg的CMS小鼠每天益母草碱的剂量为30mg~60mg。
由本发明中所述益母草碱防治CMS小鼠抑郁有效剂量推算至临床成人每日用量范围约为50~300mg。
有益效果:本发明中所述益母草碱通过调整抑郁症多个病理环节从而发挥抗抑郁作用,且安全性高(口服最大耐受剂量>5g/kg),有望超越目前作用于单一靶点的治疗药物。
附图说明
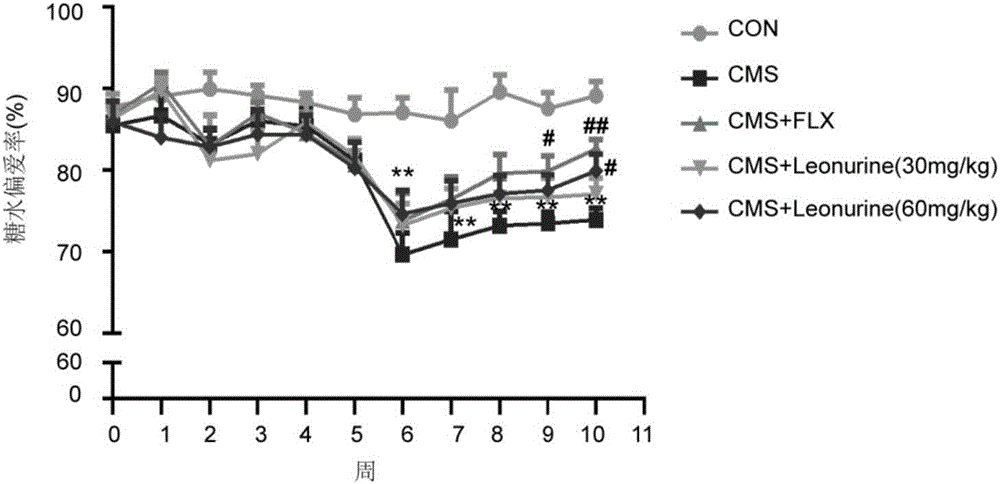
图1:益母草碱对CMS小鼠糖水偏爱率的影响。实验期间每周的糖水偏爱率以均数±标准误表示,n=11~13,*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较。CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀;
图2:益母草碱对CMS小鼠强迫游泳实验的影响。数值以均数±标准误表示,n=8~12,*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀;
图3:益母草碱对CMS小鼠悬尾实验的影响。数值以均数±标准误表示,n=8~12,*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀;
图4:益母草碱对CMS小鼠脑内单胺类神经递质5-HT、NE、DA的影响(A-F);数值以均数±标准误表示,n=7~9;其中图4A-4C是海马脑区5-HT、NE、DA的实验结果;图4E-4F是前额叶皮层5-HT、NE、DA的实验结果;*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀;
图5:益母草碱对CMS小鼠海马神经元形态的影响(A-B)(×100);其中图5A是海马DG区尼氏染色实验结果;图5B是海马CA3区尼氏染色实验结果;n=7~9,CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;
图6:益母草碱对CMS小鼠海马神经元损伤的影响;其中是图6(A-C)是神经元透射电镜实验结果(×1900);图6(D-F)分别是图(A-C)放大的透射电镜实验结果(×11000);n=3,线粒体(arrows),CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;
图7:益母草碱对CMS小鼠海马神经元髓鞘的影响;其中是图7A是透射电镜实验结果(×1900);图7B是各组的G-比率即髓鞘的内径/外径(n>100);CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;
图8:益母草碱对CMS抑郁模型小鼠海马星形胶质细胞的影响(×100);其中图8A是星形胶质细胞特异性marker GFAP的免疫荧光的实验结果;图8B是星形胶质细胞GFAP阳性细胞计数的实验结果;*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;n=5,CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;
图9:益母草碱对CMS小鼠海马炎症相关因子IL-1β、IL-6、TNF的影响;其中,数据用目的蛋白和内参β-actin相比;*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;n=3,CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀;
图10:益母草碱对CMS小鼠海马NF-ΚB信号通路的影响;数据用目的蛋白和内参β-actin相比;*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;n=3,CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀;
图11:益母草碱对CMS小鼠海马神经营养因子BDNF、GDNF的影响;数据用目的蛋白和内参β-actin相比;*P<0.05,**P<0.01,与同时期对照组比较;#P<0.05,##P<0.01,与同时期模型组比较;n=3,CON,正常小鼠;CMS,CMS小鼠;Leonurine,益母草碱;FLX,氟西汀。
具体实施方式:
实验材料和仪器:
实验材料:益母草碱,白色粉末,纯度>99.0%,复旦大学药学院提供。氟西汀(fluoxetine)购于sigma公司。标准品使用情况如下:去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)、购自美国sigma公司。抗体使用情况如下:兔抗Bax、兔抗Bcl-2,兔抗Phospho-IKKα/β(Ser176/180)(16A6),兔抗IKKβ(D30C6),兔抗Phospho-NF-κB p65(Ser536)(93H1),兔抗NF-κB p65(D14E12)购自美国Cell Signaling Technology公司;山羊抗IL-1β,小鼠抗β-actin购自美国Sigma公司,兔抗TNF-a,兔抗IL-6购自abcam公司,兔抗BDNF(N-20),兔抗GDNF购自Santa Cruz Biotechnology公司。
实验仪器:Forced Swim ScanTM(Clever Sys Inc.,VA,USA);Tail Susp ScanTM(Clever Sys Inc.,VA,USA),Thermo ultimate 3000高效液相色谱仪(Thermo,USA),Image Quant LAS 4000化学发光成像分析仪(GE,USA),透射电镜(JEM-1010,Tokyo,Japan),体视学系统(MBF,USA)。
小鼠来源:雄性C57BL/6J小鼠,体重18~22g,2~3月龄,购自扬州大学比较医学中心(动物生成许可证号为SCXR(苏)20120004)。
本发明中所有实施例中的30mg/kg/day或60mg/kg/day指的是每kg小鼠每天剂量为30mg或60mg。
实施例1:益母草碱对CMS小鼠抑郁样行为的改善作用
本发明采用国际学术界公认的制备啮齿类动物抑郁症的CMS抑郁模型。雄性C57BL/6J小鼠,体重18~22g,2~3月龄,购自扬州大学比较医学中心(动物生成许可证号为SCXR(苏)20120004)。适应性饲养1周后,正常对照组小鼠正常摄食饮水,不给予任何刺激,应激小鼠每天进行两种或三种随机、温和不可预测的刺激,直至抑郁样症状的出现。CMS方法包含一系列不可预知的慢性温和应激包括:夹尾、昼夜颠倒、45°斜笼(6h)、束缚(12h)、湿笼(12h)、空笼(10-14h)、食水剥夺(15h)、配对(2h)、更换垫料、频闪照明12h等,同种刺激不能连续给予。每只小鼠每周测量一次糖水偏爱率。小鼠进行慢性温和刺激至第6周,灌胃给予益母草碱(30mg/kg/day或60mg/kg/day)持续4周。于末次给药结束后1h,进行糖水偏好、强迫游泳和悬尾实验评价益母草碱对CMS小鼠行为学的影响。实验结果进行单因素方差分析。
糖水偏爱实验结果(表1,附图1)显示,CMS刺激小鼠进行至第6周糖水偏爱率降低20.14%±1.08%,与正常对照组比较具有显著差异(P<0.001),给予益母草碱各组小鼠糖水偏爱率逐周增加,至第4周时,60mg/kg/day益母草碱组小鼠糖水偏爱率增加较CMS组增加了8.12%±0.87%,具有显著性差异(P<0.05)。小鼠强迫游泳试验结果(表2,附图2)显示:给予CMS刺激,小鼠强迫游泳的不动时间增加174.55%±4.53%,具有显著差异(P<0.001),益母草碱缩短CMS小鼠不动时间,其中60mg/kg/day益母草碱小鼠的不动时间缩短31.85%±2.13%,具有显著性差异(P<0.05);小鼠悬尾试验结果(表2,附图3)显示:给予CMS刺激,小鼠悬尾不动时间增加83.11%±3.77%,具有显著差异(P<0.01),益母草碱缩短CMS小鼠悬尾不动时间,其中60mg/kg/day益母草碱小鼠的不动时间缩短28.93%±0.31%,具有显著性差异(P<0.05)。提示,益母草碱具有改善CMS小鼠抑郁样行为的作用。
表1小鼠糖水偏爱率(%)
注:*p<0.05,**p<0.01,***p<0.001vs正常对照组,#p<0.05,##p<0.01vs CMS模型组Mean±S.E.M.
表2小鼠强迫游泳与悬尾实验的不动时间
注:***p<0.001vs正常对照组,#p<0.05,##p<0.01vs CMS模型组Mean±S.E.M.
实施例2:益母草碱对CMS小鼠脑内单胺类神经递质的影响
本部分采用实施例1所述CMS抑郁模型,至第6周,灌胃给予益母草碱(30mg/kg/day或60mg/kg/day),持续4周。末次给药后1h深麻醉小鼠,迅速剥离脑组织,分离海马和前额叶皮层,加入匀浆液(0.1M HClO4,0.1mM EDTA)匀浆,离心(20,000rpm,30min),取上清,Thermo ultimate 3000高效液相色谱系统(HPLC)检测各样本中单胺类神经递质5-羟色胺(5-HT)、去甲肾上腺素(NE)和多巴胺(DA)含量。
海马区单胺递质测定结果(表3、附图4A-4C)所示,与正常对照组比较,CMS应激小鼠5-HT、NE、DA的含量分别降低35.73%、27.91%、37.38%,具有显著性差异(P<0.001,P<0.01,P<0.05);连续给予4周60mg/kg益母草碱组小鼠海马5-HT、NE、DA的含量较CMS组分别升高40.99%、35.50%、52.42%,具有显著性差异(P<0.05)。前额叶皮层单胺递质测定结果(表4、附图4D-4F)所示,CMS应激小鼠5-HT、NE、DA的含量分别降低42.55%、37.68%、57.31%,具有显著性差异(P<0.001,P<0.001,P<0.01),给药组5-HT、NE、DA的含量较CMS组分别升高21.37%、28.65%、68.30%,具有显著性差异(P<0.05,P<0.01,P<0.05)。提示,益母草碱增加CMS小鼠脑内5-HT、NE、DA等单胺类神经递质含量,改善单胺类神经递质的异常。表3小鼠海马区单胺类神经递质含量(ng/g湿组织)
注:*p<0.05,**p<0.01,***p<0.001vs正常对照组,#p<0.05,##p<0.01vs CMS模型组Mean±S.E.M.
表4小鼠前额叶皮层单胺类神经递质含量(ng/g湿组织)
注:**p<0.01,***p<0.001vs正常对照组,#p<0.05,##p<0.01vs CMS模型组Mean±S.E.M.
实施例3:益母草碱对CMS小鼠脑内神经元、胶质细胞的影响
本部分采用实施例1所述CMS抑郁模型,至第六周,灌胃给予益母草碱(30mg/kg/day或60mg/kg/day),持续4周。末次给药后1h深麻醉小鼠,4%多聚甲醛灌注,梯度蔗糖脱水,脑组织进行冰冻切片,根据脑图谱挑选海马脑片进行尼氏染色观察海马神经元形态、结构;此外,于4%(质量百分比)多聚甲醛灌注后,分离海马于2.5%(质量百分比)戊二醛中后固定,电镜标本制样,透射电镜下观察海马区神经元的超微结构;应用免疫荧光法检测海马区星形胶质细胞,结合MBF体视学系统计数GFAP阳性细胞数。
尼氏染色结果(图5)显示,正常对照组,小鼠海马齿状回(DG)和CA3区神经元排列紧密,神经元胞体较大,细胞核大而圆,尼氏体丰富;CMS模型组小鼠海马DG和CA3区神经元锥体细胞层变薄,细胞间隙大,排列疏松,细胞体积变小,尼氏体减少;益母草碱(60mg/kg/day)组小鼠海马DG和CA3区神经元的排列、胞体大小、胞核形态及尼氏体数目均接近正常(附图6C)。提示,益母草碱能够改善CMS小鼠脑内神经元形态。
透射电镜观察(图6)结果所示,正常对照组神经元胞体大小正常,表面光滑,细胞核呈卵圆形,两层膜结构清晰,核染色质分布均匀,胞浆内细胞器丰富,结构完整,线粒体呈圆形或椭圆形,内嵴清晰可见(6A,6D);CMS模型组神经元胞体变小,核异染色质增多,呈块状并向边缘聚集;核周间隙增宽;胞质内线粒体肿胀,少量呈空泡样;部分线粒体内嵴模糊(6B,6E)。益母草碱(60mg/kg/day)组神经元胞体基本正常,核内异染色质轻度增加,核周间隙基本正常,核缘光滑;线粒体结构基本完整,少见线粒体肿胀(图6C,图6F)。提示,益母草碱改善CMS小鼠海马区神经元结构,减轻神经元损伤。
神经髓鞘是神经元之间相互作用的关键调解物,髓鞘结构异常间接地导致神经元损失或死亡,影响大脑突触结构和空间记忆,是海马功能的结构基础。本发明采用透射电镜技术检测海马髓鞘结构,结果如图7A所示,正常对照组海马区神经元髓鞘形状和结构正常,具有密集的质膜环;模型组出现髓鞘结构异常表现为髓鞘松散排列、髓鞘变薄等组织损伤的迹象,益母草碱(60mg/kg/day)组髓鞘结构则趋于正常。应用髓鞘内直径与总外径的比值(G比率)作统计学分析,结果显示(表5,图7B)CMS模型组较正常对照组增加25.37%,具有显著差异(P<0.001);益母草碱(60mg/kg/day)组与正常对照组相近,较CMS组G比率降低15.48%,具有显著差异(P<0.01)。提示,益母草碱能够改善CMS小鼠脑内神经元结构。
表5各组小鼠髓鞘g-比率(髓鞘的内径/外径)
注:***p<0.001vs正常对照组,##p<0.01vs CMS模型组Mean±S.E.M.
星形胶质细胞是构成脑实质的重要组成部分,不仅为神经元提供多种营养支持物质,在突触重塑,神经细胞再生,调节神经细胞外离子、神经递质及代谢物等方面也起着重要作用,抑郁症患者海马区星形胶质细胞显著减少。本实施例应用免疫荧光化检测益母草碱对CMS小鼠星形胶质细胞的影响,结果(表6,图8)显示:与正常对照组比较,CMS模型组小鼠海马DG区星形胶质细胞表达减少(8A),胶质纤维酸性蛋白(GFAP)(星形胶质细胞特异性的标志物)阳性细胞数量减少36.09%(8B),具有显著差异(P<0.01);益母草碱(60mg/kg/day)组小鼠星形胶质细胞数量较模型组增加31.20%,具有显著差异(P<0.05)。提示,益母草碱具有增加脑内星形胶质细胞,显著改善神经元生存微环境的作用。
表6各组小鼠海马DG区星形胶质细胞数量
注:**p<0.01vs正常对照组,#p<0.05vs CMS模型组Mean±S.E.M.
实施例4:益母草碱对CMS小鼠脑内神经炎症的影响
本部分采用实施例1所述CMS抑郁模型,至第6周,灌胃给予益母草碱(30mg/kg/day或60mg/kg/day),持续4周。末次给药后1h深麻醉小鼠,迅速分离海马组织,加入蛋白裂解液,组织蛋白提取,应用Western blot方法检测小鼠海马神经炎症相关因子IL-1β、IL-6、TNF的蛋白表达及NF-ΚB信号通路的变化。将海马组织称重后,按1:10(w/v)加入RIPA裂解液,进行组织匀浆,冰上裂解30min,16000rpm×4℃×15min,吸取上清。取1μL进行BCA蛋白定量(碧云天,上海),余下上清蛋白按照体积比加入5X上样缓冲液95℃下变性5min,分装后-20℃保存。根据BCA定量结果,取40μg样品/泳道上样,根据蛋白的分子量选择浓度制备SDS-PAGE胶进行恒压(80-120V)凝胶电泳分离,300mA恒流下电转70-120min至PVDF膜(Millipore,USA)。5%(质量百分比脱脂奶粉的TBST(pH7.4,10mM Tris-HCl,150mM NaCl,0.1%Tween-20)室温下震荡封闭1h,加入5%(质量百分比)BSA-TBST配制的一抗:兔抗Phospho-IKKα/β(Ser176/180)(16A6)(1:1000,CST,2697),兔抗IKKβ(D30C6)(1:1000,CST,8943),兔抗Phospho-NF-κB p65(Ser536)(93H1)(1:1000,CST,3033),兔抗NF-κB p65(D14E12)(1:1000,CST,8242S),兔抗Bcl-2(1:1000,CST,2876),兔抗Bax(1:1000,CST,2772),山羊抗IL-1β(1:1000,sigma,13767,),兔抗TNF-a(1:1000,Abcam,ab9739),兔抗IL-6(1:1000,Abcam,ab83339),兔抗BDNF(N-20)(1:1000,Santa Cruz,sc-546),兔抗GDNF(1:1000,Santa Cruz,sc-328),小鼠抗β-actin(1:1000,Sigma,A5441)。4℃孵育过夜。TBST漂洗10min 3遍,加入辣根过氧化物酶标记的二抗:山羊抗兔-HRP(1:800,KPL),山羊抗小鼠-HRP(1:800,KPL),兔抗山羊-HRP(1:800,KPL),室温孵育60min,加入ECL(Pierce)化学发光底物显色。用Image Quant LAS 4000化学发光成像分析仪显影分析;将磷酸化蛋白激酶灰度值与各自总蛋白激酶灰度值进行比较判断磷酸化程度,用目的蛋白灰度值与各自内参β-actin灰度值之比进行半定量分析(Image J.)。以上的1:1000均指的是稀释1000倍。
结果显示(附图9、图10)。与正常小鼠组比较,CMS小鼠海马炎症因子IL-1β、IL-6、TNF-а的蛋白表达(附图9)及IKKβ和P65的磷酸化水平(附图10)显著升高。益母草碱组较CMS组海马炎症因子IL-1β、IL-6、TNF-а的蛋白水平及IKKβ和P65的磷酸化水平降低,其中60mg/kg/day益母草碱具有显著性差异(P<0.01)。提示,益母草碱抑制CMS小鼠脑内NF-ΚB信号通路的激活,从而抑制炎症反应。
实施例5:益母草碱对CMS小鼠脑内神经营养因子的影响
本部分采用实施例1所述CMS抑郁模型,至第六周,灌胃给予益母草碱(30mg/kg/day或60mg/kg/day),持续4周。末次给药后1h深麻醉小鼠,迅速分离海马组织,加入蛋白裂解液,组织蛋白提取,应用Western blot方法(同实施例4)检测小鼠海马区神经营养因子BDNF、GDNF的蛋白水平。
结果如图11所示,CMS小鼠海马神经营养因子BDNF、GDNF蛋白水平显著降低,益母草碱(60mg/kg/day)组BDNF、GDNF蛋白水平较CMS组升高具有显著性差异(P<0.05)。提示,益母草碱能够显著恢复CMS小鼠脑内神经营养因子水平。
- 还没有人留言评论。精彩留言会获得点赞!