可生物降解的多聚HPMA‑Gd磁共振成像探针及其制备方法与流程
本发明属于医学成像技术领域,涉及一种高分子磁共振成像探针,具体涉及一种可生物降解的多聚HPMA-Gd磁共振成像探针。
背景技术:
由于核磁共振成像(MRI)具有高空间分辨率、3D图像信息及无放射性等优势,已成为目前有效的肿瘤非侵入性诊断方法。据不完全统计,临床上50%以上MRI肿瘤诊断需使用MRI磁共振成像探针。临床常用的MRI磁共振成像探针包括钆喷酸葡胺(Magnevist)和钆特酸葡胺(Dotarem)。然而,它们都属于小分子磁共振成像探针,存在敏感性低、非特异性、很快从体内清除等缺点;并且主要是通过被动扩散至肿瘤间质或组织间质中,导致很难达到满意的成像效果。因此,更优异的、能克服以上缺点的MRI磁共振成像探针具有很高的研究价值,而基于Gd(III)的纳米复合物在新型磁共振成像探针的研究中展示了巨大的潜力。
技术实现要素:
基于上述技术问题,本发明构建了可生物降解的多聚HPMA-Gd磁共振成像探针,是一种高效率的具生物相容性的高分子MRI磁共振成像探针,可用于临床肿瘤诊断以及辅助治疗。
本发明的技术方案如下:
一种可生物降解的多聚HPMA-Gd磁共振成像探针,链结构如下:
其中:m:n:o=35~45:410~450:65~70;
本发明设计并表征了具有较高分子量、可生物降解的多聚HPMA聚合物-Gd(III)偶合物的纳米体系,体系中C、B和A基团的排列顺序不定,R基团可连接C、B和A中的任意一个。多聚HPMA(N-(2-羟丙基)甲基丙烯酰胺)能够结合多个小分子量Gd(III)共轭物(DOTA)从而大大提高弛豫效能,且具有无免疫性、无毒性、水溶性及良好的生物兼容性;同时,大分子量的纳米材料可以延长在血液中的循环时间,增加EPR(渗透滞留效应)被动靶向的能力,提高磁共振成像探针在肿瘤部位的聚集度,从而增加肿瘤部位的成像效果及治疗效果。
精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp RGD)的环肽cRGDyK是一种特异性肿瘤靶向短肽,本发明通过引入带cRGDyK的R1基团对材料进行表面修饰,使其具有主动靶向功能。cRGDyK可以被αvβ3整合素特异性的识别和结合,而αvβ3在多种肿瘤细胞及肿瘤新生血管内皮细胞内的表达量明显升高,但在正常组织细胞中表达较低甚至不表达。
尽管高分子量的HPMA共聚物可以提高磁共振成像探针在肿瘤部位的聚集,但是肾脏排泄阈值又要求其必须小于50kDa,否则将引起Gd中毒。由于HPMA主链不具有生物降解性,因此须在主链中引入可生物降解的基团。本发明设计构建了插入组织蛋白酶B底物GFLG多肽的HPMA聚合物,使其可以在溶酶体组织蛋白酶B存在的情况下被降解成小于50kDa的小片段。而溶酶体组织蛋白酶B作为一种溶酶体半胱氨酸蛋白酶在多种肿瘤及肿瘤血管内皮细胞具有高表达。相对于传统HPMA聚合物,本发明可降解的HPMA纳米药物递送系统表现出了更高的抗肿瘤效率及生物安全性。
该磁共振成像探针的平均分子量为85-94KDa。该分子量在肿瘤微环境下,降解为分子量低于50kDa的片段,能兼顾抗肿瘤效果及生物安全性,保证降解后能够被清除出体内。
优选地,其中,m:n:o=40:443:66。为了保证水溶性的高分子具有一定的钆离子的含量(质量百分含量一般为3-10%),可保证有效的磁共振成像。同时,调节o值,保证cRGDyK的含量(质量百分含量大于10%),以便提高其肿瘤靶向性。
本发明首先通过可逆加成-断裂链转移(RAFT)聚合,将酶敏感的多肽甘氨酸-苯丙氨酸-亮氨酸-甘氨酸(GFLG)插入多聚HPMA主链结构中;并通过与Gd(III)偶联,合成线性化的HPMA-DOTA-Gd。在此基础之上,引入多肽cRGDyK使其成为具有潜在主动肿瘤靶向性的MRI磁共振成像探针HPMA-DOTA-Gd-cRGD。
本发明多聚HPMA-Gd磁共振成像探针的制备方法,当R1=SH时,包括以下步骤:
多聚HPMA-Gd偶联物(pHPMA-DOTA-Gd)的合成:
1)将HPMA、MA-DOTA、pTEMA和CTA-GFLGK-CTA溶于含有VA044的去离子水/甲醇混合溶液,置于氩气中充溢40-60分钟,然后搅拌反应;溶液用液氮淬灭后经丙酮沉淀,析出吡啶二硫改性产物pHPMA-DOTA。
优选地,去离子水与甲醇以4:1的体积比混合得到步骤1)中的混合溶液。
进一步优选地,所述混合溶液中含引发剂VA044,VA044的浓度是链转移剂CTA-GFLGK-CTA的1/3-1/5当量。为1/3当量时,聚合反应可快速完成,且分子量和PDI可获得有效控制。通过RAFT聚合(RAFTpolymerization;可逆加成-断裂链转移聚合)制备的聚合物分子量基本可控,分子量多分散系数(PDI)低。
2)在氮气保护条件下,将吡啶二硫改性产物pHPMA-DOTA溶于去离子水中,加入DTT搅拌反应,获得中间产物;将中间产物与GdCl3·6H2O溶于蒸馏水中,搅拌反应后,调节pH值,再室温搅拌反应后,获得pHPMA-DOTA-Gd产物。
通过快速蛋白色谱柱提出,洗脱剂为水与甲醇以7:3的混合液,通过去离子水透析和冷冻干燥获得中间产物;
优选地,所述步骤2)调节pH值至5.2-5.4,保证钆离子的配位,同时保证短肽的稳定性。
本发明还提供了多聚HPMA-Gd磁共振成像探针的另一种制备方法,当R1不为SH时,pHPMA-DOTA-Gd-cRGD的合成包括以下步骤:
取pHPMA-DOTA-Gd溶于去离子水中,同时加入吡啶二硫改性修饰的cRGD,反应后通过快速蛋白柱分离和透析提纯,获得pHPMA-DOTA-Gd-cRGD。
本发明的优势在于:
1、本发明设计并表征了具有较高分子量、可生物降解的多聚HPMA聚合物-Gd(III)偶合物的纳米体系,聚合物主链由亲水和疏水嵌段构成,并在主链中心引入酶敏感短肽GFLGK。Gd(III)通过可降解两亲性嵌段HPMA聚合物-Gd(III)偶联物的方式自组装形成纳米粒子来进行递送。多聚HPMA能够结合多个小分子量Gd(III)共轭物(DOTA)从而大大提高弛豫效能,且具有无免疫性、无毒性、水溶性及良好的生物兼容性;同时,大分子量的纳米材料可以延长在血液中的循环时间,增加EPR被动靶向的能力,提高磁共振成像探针在肿瘤部位的聚集度,从而增加肿瘤部位的成像效果及治疗效果。
2、本发明通过引入带cRGDyK的R1基团对材料进行表面修饰,使其具有主动靶向功能;在主链中引入可生物降解的GFLGK多肽基团,使其可以在溶酶体组织蛋白酶B存在的情况下被降解成小于50kDa的小片段,兼具高效率的肿瘤靶向性及生物相容性的纳米级MRI磁共振成像探针,适用于临床肿瘤诊断以及辅助治疗等。
3、本发明的制备方法设计并通过RAFT和“点击”化学构建了功能化的pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD共轭物。首先通过可逆加成-断裂链转移(RAFT)聚合,将酶敏感的多肽甘氨酸-苯丙氨酸-亮氨酸-甘氨酸(GFLG)插入多聚HPMA主链结构中;制备的聚合物分子量基本可控,分子量多分散系数(PDI)低;并通过与Gd(III)偶联,合成线性化的HPMA-DOTA-Gd。在此基础之上,引入多肽cRGDyK使其成为具有潜在主动肿瘤靶向性的MRI磁共振成像探针HPMA-DOTA-Gd-cRGD。本发明的HPMA-Gd(III)共轭物(>90kDa)可以降解为低于肾脏阈值的低分子量产物(<44kDa)。与临床上在用的二乙基三胺五乙酸-Gd(DTPA-Gd)磁共振成像探针相比,纵向弛豫效能(T1)是前者的三倍多(15.16mM-1·s-1/Gd)。
4、多聚HPMA-Gd磁共振成像探针的提高弛豫效能,显著高于临床试剂DTPA-Gd的3倍以上,在肿瘤部位的磁共振信号强度显著高于临床试剂;同时,其在肿瘤微环境下可降解为低分子量的产物,便于其快速排出体外,降低毒副作用。
附图说明
图1为本发明多聚HPMA-Gd(III)共轭物的合成路线图。
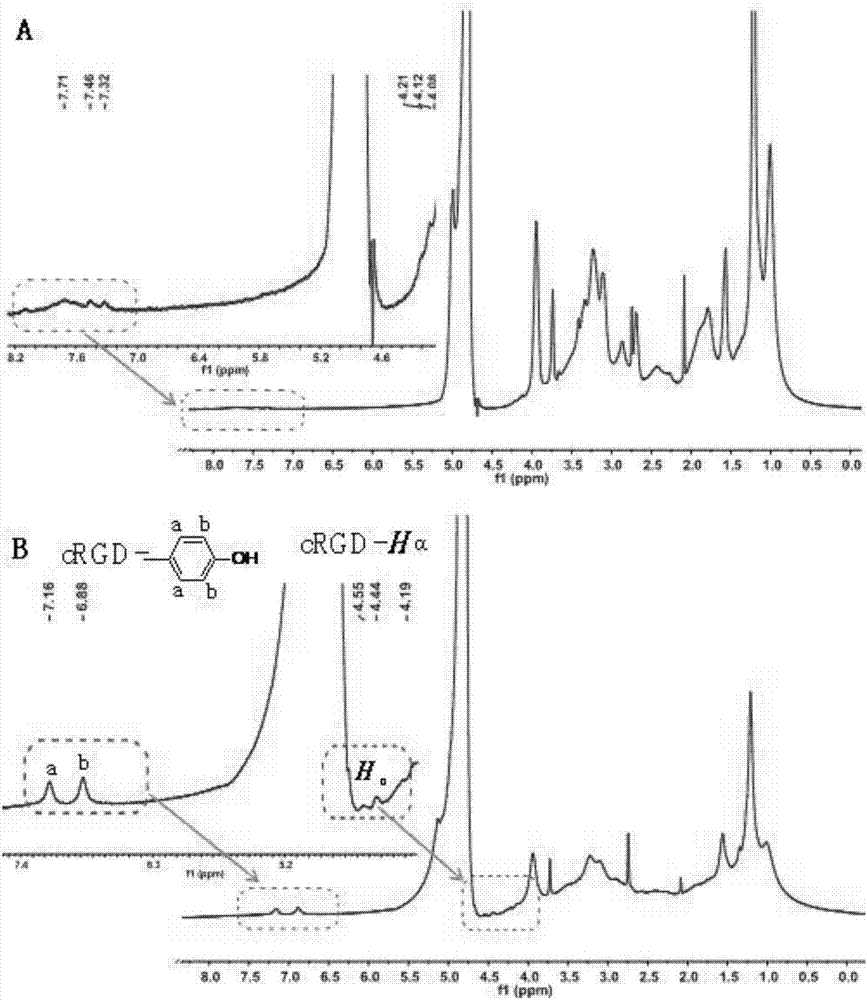
图2为pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD的1HNMR谱图。
图3为A.T1加权MRI成像结果;B.不同浓度的纵向弛豫率(1/T1)(溶剂:PBS,1.5T)。
图4为A.DTPA-Gd、pHPMA-DOTA-Gd或pHPMA-DOTA-Gd-cRGD(0.08mmolGd(III)/kg小鼠体重)给药后不同时间点肿瘤及膀胱轴MR成像的典型代表。B.小鼠肿瘤组织相对水模的信号增强比率(*P﹤0.05,**P﹤0.01)。C.小鼠膀胱相对水模的信号增强比率(**P﹤0.001)(n=5)。
图5为U87移植瘤模型BALB/c裸鼠不同组织中Gd(III)含量的定量分析结果(n=5)。
图6为L02细胞(A)和U87细胞(B)的细胞毒性分析。
图7为不同材料处理后红细胞裂解情况:A.pHPMA-DOTA-Gd;B.pHPMA-DOTA-Gd-cRGD;C.不同浓度处理后红细胞的相对溶血率(mean±SD)。
图8为通过SEM检测不同材料处理对红细胞聚集和形态的影响:A.PBS对照;B.pHPMA-DOTA-Gd;C.pHPMA-DOTA-Gd-cRGD。
图9为不同材料处理对APTT和PT的影响:A.pHPMA-DOTA-Gd;B.pHPMA-DOTA-Gd-cRGD。
图10为分别给予PBS(A)、pHPMA-DOTA-Gd(B)和pHPMA-DOTA-Gd-cRGD(C)后,不同小鼠器官组织学分析结果(100×)。
具体实施方式
下面结合具体实施方式对本发明的实质性内容作进一步详细的描述。
实施例1
一种可生物降解的多聚HPMA-Gd磁共振成像探针,链结构如下:
其中:m:n:o=35~45:410~450:65~70;
体系中C、B和A基团的排列顺序不定,R基团可连接C、B和A中的任意一个。
实施例2
在实施例1的基础上:
其中,R1为SH,m:n:o=35:410:65。
该磁共振成像探针的平均分子量为85KDa。
实施例3
在实施例1的基础上:
其中,R1不为SH,m:n:o=45:450:70。
该磁共振成像探针的平均分子量为94KDa。
实施例4
在实施例1的基础上:
其中,R1不为SH,m:n:o=40:443:66。
该磁共振成像探针的平均分子量为90KDa。
实施例5
实施例2的磁共振成像探针的制备方法,包括以下步骤:
1)将HPMA、MA-DOTA、pTEMA和CTA-GFLGK-CTA溶于含有VA044的去离子水/甲醇混合溶液,置于氩气中充溢40-60分钟,然后搅拌反应;溶液用液氮淬灭后经丙酮沉淀,析出吡啶二硫改性产物pHPMA-DOTA;
2)在氮气保护条件下,将吡啶二硫改性产物pHPMA-DOTA溶于去离子水中,加入DTT搅拌反应,获得中间产物;将中间产物与GdCl3·6H2O溶于蒸馏水中,搅拌反应后,调节pH值,再室温搅拌反应后,获得pHPMA-DOTA-Gd产物。
实施例6
实施例2的磁共振成像探针的制备方法,包括以下步骤:
1)将HPMA、MA-DOTA、pTEMA和CTA-GFLGK-CTA溶于含有VA044的去离子水/甲醇混合溶液,置于氩气中充溢40-60分钟,然后搅拌反应;溶液用液氮淬灭后经丙酮沉淀,析出吡啶二硫改性产物pHPMA-DOTA。
去离子水与甲醇以4:1的体积比混合得到步骤1)中的混合溶液;所有聚合反应、分离提纯用到的溶剂均为三类溶剂。
所述混合溶液中含引发剂VA044,VA044的浓度是链转移剂CTA-GFLGK-CTA的1/3-1/5当量。为1/3当量时,聚合反应可快速完成,且分子量和PDI可获得有效控制。
2)在氮气保护条件下,将吡啶二硫改性产物pHPMA-DOTA溶于去离子水中,加入DTT搅拌反应,获得中间产物;通过快速蛋白色谱柱提出,洗脱剂为水与甲醇以7:3的混合液,通过去离子水透析和冷冻干燥获得中间产物;该中间产物与GdCl3·6H2O溶于蒸馏水中,搅拌反应后,调节pH值至5.2-5.4,室温搅拌反应后,获得pHPMA-DOTA-Gd产物。
实施例7
实施例3和4的磁共振成像探针的制备方法,合成路线见图1,在实施例5制备方法的基础上:
3)取pHPMA-DOTA-Gd溶于去离子水中,同时加入吡啶二硫改性修饰的cRGD,反应后通过快速蛋白柱分离和透析提纯,获得pHPMA-DOTA-Gd-cRGD。
实施例8
实施例3和4的磁共振成像探针的制备方法,在实施例6制备方法的基础上:
3)在氮气保护条件下,将吡啶二硫改性产物pHPMA-DOTA-Gd溶于去离子水中,加入吡啶二硫改性cRGD搅拌反应;通过快速蛋白色谱柱提出,洗脱剂为水与甲醇以7:3的混合液,通过去离子水透析和冷冻干燥产物pHPMA-DOTA-Gd-cRGD。
实验方法
材料和方法
偶氮二异丁咪唑啉盐酸盐(VA044)购买自sigma-Adrich。单体HPMA(Eur.Polym.J.,1973,9,7-14)、MA-DOTA(ACS Appl.Mater.Interfaces,2016,8,10499-10512)、PTEMA(Bioconjug.Chem.,1998,9,749-757)、CTA-GFLGK-CTA(Biomaterials 2013,34(33),8430–8443)均按已有文献制备。吡啶二硫改性cRGD的合成方法见文献(ACSAppl.Mater.Interfaces,2016,8,10499-10512)。合成材料的数均分子量(Mn)、重均分子量(Mw)以及多分散性均采用体积排阻色谱法(SEC)进行检测(GE公司,系统),使用含30%甲醇的乙酸钠溶液作为流动相。Zeta电位通过纳米粒度及电位分析仪检测(Malvern仪器,乌斯特郡,英国),并采用DTS软件进行数据处理,结果以频率曲线图显示。
二嵌段式主链可降解的HPMA共聚物-Gd共轭物而作为MRI磁共振成像探针,其可以通过EPR效应增加在肿瘤部位的聚集从而提高肿瘤MR成像效果。此外,弛豫效能同样取决于磁共振成像探针的结构和分子量(MW),但HPMA共聚物的主链不能被降解,易造成Gd累积毒性。为了提高生物安全性,本发明通过HPMA单体、MA-DOTA及PTEMA的RAFT聚合化将一种酶促降解的寡肽(GFLGK)引入线性主链中(如图1)。
pHPMA-DOTA-Gd的合成
将HPMA(1.16g,8.13mmol)、MA-DOTA(1.61g,3.13mmol)、PTEMA(635mg,2.5mmol)和CTA-GFLGK-CTA(23.7mg,22.7μmol)溶于含有VA044(5.0mg,15.4μmol)的去离子水/甲醇(4:1,10mL)溶液,置于0℃氩气中充溢50分钟,然后转至44℃搅拌12小时。溶液用液氮淬灭后经丙酮沉淀,获得带有一些粉红色的固体。用水透析24小时后冷冻干燥,获得了带有轻微粉红色的吡啶二硫改性产物pHPMA-DOTA(60%纯度,2.06g)。
在氮气保护条件下,将粉红色固体(2.0g)溶于20mL去离子水中,加入DTT(200mg,1.3mmol)搅拌8小时。粗产物经过排阻色谱纯化(系统,Superose 6HR10/30;流动相为缓冲液/甲醇=7:3,pH 6.5;流速:2.5mL/分钟)。然后,水透析24小时并冷冻干燥,获得白色产物(1.69g),硫醇基含量通过已有文献报道的方法进行检测(ACS Appl.Mater.Interfaces,2016,8,10499-10512)。
在RAFT聚合中,本发明使用了酶响应多肽GFLGK功能化的链转移剂(CTA-GFLGK-CTA),共聚物的MW和PDI均得到很好的控制。将吡啶二硫改性产物pHPMA-DOTA与DTT反应,使其带有硫醇基团,每种产物的硫醇基含量为0.66mmol/g(表2)。产物颜色为粉红色。在1H核磁共振波谱的峰值7.31-7.71ppm。
将1.5g白色产物与GdCl3·6H2O(1.48g,4.0mmol)溶于30mL蒸馏水中,搅拌15小时并使用0.1MNaOH调节pH值直至5.2-5.4范围内。室温搅拌15小时。然后,水透析20小时并冷冻干燥,获得白色pHPMA-DOTA-Gd产物(1.46g)。通过前述氨基酸分析方法检测GFLGK多肽的含量(ACS Appl.Mater.Interfaces,2016,8,10499-10512),并通过电感耦合等离子体质谱分析(ICP-MS)得出产物中Gd(III)的含量为6.5%,pHPMA-DOTA-Gd的1H NMR波谱图见图2A。
pHPMA-DOTA-Gd-cRGD的合成:
取800mgpHPMA-DOTA-Gd溶于乙酸钠溶液(pH 6.5,8mL),同时加入400mg吡啶二硫改性修饰的cRGD,室温搅拌20小时。粗产物经过SEC法纯化(系统,GE医疗):Superose 6HR10/30预装柱装载含30%甲醇(pH6.5)的乙酸钠溶液作为流动相(流动率:2.5mL/min)。然后,经过24小时的水透析及冷冻干燥,获得785mg白色产物。通过氨基酸分析方法检测GFLGK和cRGDyK多肽的含量,硫醇基含量为0.10mmol/g,经ICP-MS检测,其中Gd(III)含量为4.0%(表2),pHPMA-DOTA-Gd-cRGD的1H NMR谱图见图2B。表1.pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD共轭物的氨基酸组成,相对氨基酸含量按所占样品质量的百分比表示。
表2.pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD的组成分析。
表明芳香环质子的存在(图2A),也预示着GFLG多肽的两个硫代苯甲酸酯基团及苯丙氨酸残渣中含有芳基。与GdCl3·6H2O反应后,获得白色产物pHPMA-DOTA-Gd。钆共轭物通过ICP-MS进行鉴定,其中钆含量为总质量的6.5%。甘氨酸、苯丙氨酸、亮氨酸和赖氨酸的含量分别为总质量的0.17%、0.18%、0.14%和0.17%(表1),而摩尔比十分接近于2:1:1:1,表明GFLGK成功引入到主链当中,并且在二嵌段可生物降解HPMA-Gd共轭物的整个制备过程中稳定存在。
为了增强聚合物MRI磁共振成像探针在肿瘤部位的聚集,本发明通过硫醇基与硫醇-二硫化物的交换反应,将吡啶二硫改性的环肽cRGDyK与pHPMA-DOTA共聚物进行偶联。而cRGDyK可以特异性识别肿瘤血管中活化内皮细胞过表达的αvβ3整合素。因此,cRGDyK修饰的共轭物pHPMA-DOTA-Gd-cRGD将作为一种主动靶向的MRI磁共振成像探针。共轭物通过FPLC系统进行纯化和透析,有效去除小分子化合物及副产物。功能化的共轭物通过硫醇基、氨基酸分析及1H核磁共振波谱进行鉴定。相较于pHPMA-DOTA,pHPMA-DOTA-Gd-cRGD 1H核磁共振波谱含有更多位于4.44、4.55、6.88、7.16及7.04 ppm的峰(图2B)。4.44和4.55 ppm峰表明cRGDyK氨基酸中手性氢原子(α-H)的存在,7.16和7.04 ppm所代表的的芳环质子可归于cRGDyK中酪氨酸所含的芳环质子。共轭物中硫醇基的含量为0.10 mmol/g,明显低于pHPMA-DOTA-Gd(0.66 mmol/g)。此外,根据氨基酸的含量(表1),精氨酸、天冬氨酸及色氨酸的摩尔比接近1:1:1,共轭物中氨基酸占总质量的百分比为22.74%。然而,pHPMA-DOTA-Gd的总氨基酸含量仅为0.66%。pHPMA-DOTA-Gd-cRGD硫醇基含量减少、1HNMR波谱出现更多的峰(4.44、4.55、6.88、7.16及7.04ppm)以及氨基酸含量的升高表明,通过硫醇-二硫化物交换,本发明成功将cRGDyK多肽偶联到pHPMA-DOTA-Gd共聚物之中。cRGDyK含量占总质量的22%,钆含量占总质量的4%。
本发明对多聚HPMA-Gd磁共振成像探针进行实验检测:
一、生物降解性研究
本发明采用溶酶体组织蛋白酶B和具有相似活性的木瓜蛋白酶来研究材料的生物降解性,不含酶的PBS作为阴性对照。将pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD溶于含有4mM木瓜蛋白酶或2.4mM组织蛋白酶B的McIlvaine's缓冲液(3mg/mL,50mM柠檬酸盐/0.1M磷酸盐,2mM EDTA,2mM谷胱甘肽,pH=5.4),37℃孵育24小时,然后通过SEC(系统,GE医疗)对样本的降解性进行检测,Superose 6HR10/30预装柱装载含30%甲醇(pH6.5)的乙酸钠溶液作为流动相(流动率:0.4mL/min)。
为了提高弛豫效能及肿瘤部位的聚集,需要提高钆共轭物的分子量。pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD的分子量分别为85kDa和94kDa。此外,为了满足肾脏排泄的需要,肾阈值又要求分子量更低。因此,可生物降解的多肽被引入到两种共轭物的主链结构中。在组织蛋白酶B存在的情况下,两种共轭物能够降解成低分子量的片段。与组织蛋白酶B共孵育8小时后,线性化的共聚物主链已完全降解为低分子量产物(小于43kDa)(表3),而这一大小低于肾阈值(50kDa)。这一降解性归因于组织蛋白酶B可以切开GFLGK多肽。然而,两种共轭物在PBS中可以稳定存在(pH 7.4,37℃),没有发现明显的降解性。无酶条件下不可降解而在肿瘤微环境中快速的生物降解揭示HPMA共轭物可以在血液循环中稳定存在,而一旦到达肿瘤部位完成作为MRI对比剂的任务就会发生降解,从而保证他们的有效清除和生物相容性。
表3.pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD的分子量和PDI,以及其降解随时间变化的分析。
二、体外驰豫效能研究
将DTPA-Gd、pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD分别溶解于0.1M PBS中,制备成不同Gd(III)浓度的溶液(0.1、0.15、0.2、0.25、0.3、0.4、0.5、0.6and 0.7mM)。随后,使用1.5T临床磁共振扫描仪(西门子)对样本进行自旋-点阵驰豫时间(T1)加权MRI检测。参数设置:TE=8.7ms;TR=25、30、50、70、90、110、150、170、190、210、250、300、400、600、700及800ms;视野(FOV)=200mm;层面厚度=2.0mm;矩阵尺寸=256×256。用不同浓度梯度样本的纵向弛豫率[1/T1(s-1)]与Gd(III)浓度作图,其斜率代表r1值。
图3A显示的是获得的不同浓度Gd(III)共轭物在1.5T MR扫描仪上T1加权MR成像结果。与临床上使用的DTPA-Gd相比,本发明制备的共轭物在相同Gd(III)浓度下具有更高的均匀增强信号。图3B是根据1/T1(s-1)与Gd(III)浓度制作的曲线。pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD共轭物的r1值分别是13.91mM-1·s-1/Gd(III)和15.16mM-1·s-1/Gd(III),均高于DTPA-Gd(3.98mM-1·s-1/Gd(III))3倍以上。根据Solomon-Bloembergen-Morgan理论可以很好的解释这一结果:由于旋转相关时间τR直接与大小相关,通过将低分子量的顺磁性Gd(III)共轭物与共聚物结合可以获得更高的弛豫率。两个材料1/T1(s-1)值均成线性说明本发明的材料在水溶液中具有较高的溶解性和稳定性。此外,cRGD修饰后的共轭物与pHPMA-DOTA-Gd相比表现出更高的r1值,这可能是因为pHPMA-DOTA-Gd-cRGD的分子量更高。以上特性及较高的弛豫率预示着本发明制备的材料在体内可成为有效的MRI磁共振成像探针。
三、细胞培养及实验动物
U87细胞(人恶性胶质瘤细胞)和L02细胞(人正常肝细胞)购买自中国科学院细胞库(上海)。两种细胞均使用含10%胎牛血清(Hyclone)及1%青霉素/链霉素(Hyclone)的RPMI1640培养基,放置于37℃、含5%CO2的饱和湿度孵育箱培养。雌性BALB/c裸鼠购买自成都达硕生物科技有限公司,6-8周龄,体重约20g。所有动物实验均按照四川大学动物管理委员会的要求执行。
1、体内MRI成像研究
本发明使用一台3.0T成像系统(西门子Sonata医疗系统)进行小鼠体内对比增强MRI研究。简言之,将U87细胞(1×107个细胞溶于200μL PBS)接种于BALB/c裸鼠的背部右下侧皮下。待移植的U87人恶性脑胶质瘤直径达到3-5mm,将小鼠随机分为三组,每组5只,分别注射DTPA-Gd、pHPMA-DOTA-Gd及pHPMA-DOTA-Gd-cRGD(0.08mmol Gd(III)/kg小鼠体重)。戊巴比妥钠麻醉小鼠,将其置于MRI扫描仪定制的小鼠线圈中进行信号传递及检测。T1加权成像变量设置如下:TR/TE=450/11ms,层面=11,立体尺寸=0.2×0.2×1.5mm3,FOV=51mm。分别采集了不同时间点(注射前,注射后10分钟、30分钟、1小时、3小时、19小时及24小时)的目的区域信号相关增强变化。结果使用信噪比表示(△SNR):△SNRT=SI(肿瘤)/SI(水模),△SNRB=SI(膀胱)/SI(水模);其中,SI(肿瘤)、SI(膀胱)及SI(水模)分别代表肿瘤、膀胱及水模的信号强度。
取不同时间点(注射前到注射后24小时)用3.0T MR扫描仪进行检测(图4A)。注射后10分钟时,使用DTPA-Gd造影的肿瘤组织与正常组织及水模相比仅有轻微的信号改变,并且信号增强不到30分钟就会衰退。相反,使用本发明制备的HPMA-Gd共轭物进行造影的小鼠肿瘤组织具有更高的信号增强,从注射后10分钟开始一直可以持续到24小时。此外,共轭物造影可以更好地界定正常组织与疾病组织间的边界,这一点对于肿瘤诊断和治疗至关重要。
随后使用相对增强的MR成像信号强度(SI),即环绕肿瘤部位与放置于旁边的水模的信号差值,进一步定量分析了肿瘤组织的对比增强。用MRI SI相对增强的平均值与时间作图(图4B)。DTPA-Gd组的最高值(183%)出现在处理后的10分钟,之后逐渐下降,直至处理后3小时恢复成与注射前相当(149%)。SI的迅速下降可能与其较短的体内循环时间以及被快速清除有关。相反,使用pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD进行造影的肿瘤组织在注射后10分钟时具有更高的SI值,并且SI值仍会继续升高,分别达到200%和240%。pHPMA-DOTA-Gd组的高SI值可以从注射后10分钟一直持续到注射后19小时,pHPMA-DOTA-Gd-cRGD组的维持时间更长至注射后24小时。
对于多聚共轭物的信号增强可以达到24小时的原因,可能是由于循环时间的延长和较高的肿瘤聚集两方面原因。对于小鼠膀胱SI信号增强的研究结果是这一结论的有力证据。DTPA-Gd组膀胱SI增强的最高点出现在注射后10分钟,然后在10到30分钟迅速下降(图4C)。因此,可以判定DTPA-Gd的肾排泄在注射后几分钟之内就开始了,这就解释了为什么肿瘤成像的造影效果很差。相反,共轭物组的膀胱SI信号增强可以从注射后30分钟维持到3小时,暗示着较慢的肾脏排泄以及较长的循环时间,究其原因是高的分子量介导的EPR效应使共轭物聚集在肿瘤部位。有趣的是,pHPMA-DOTA-Gd-cRGD相对于pHPMA-DOTA-Gd和DTPA-Gd具有更高及更长时间的SI增强,这一现象可能是由于cRGD多肽与αvβ3整合素的特异性结合引起的,并且这种结合更加稳定,进一步促进了共轭物在肿瘤组织的聚集从而延长了循环时间。
2、共轭物纳米系统的组织分布
U87荷瘤小鼠随机分成3组(每组7只),分别注射DTPA-Gd、pHPMA-DOTA-Gd及pHPMA-DOTA-Gd-cRGD(0.08mmolGd(III)/kg小鼠体重)进行MRI对比增强成像研究,注射后24小时处死小鼠。取心脏、肝脏、脾脏、肺、肾脏及肿瘤组织进行称重,并用1mL H2O2和3mL HNO3消化,样本在120℃处理48小时。样本的Gd(III)含量通过ICP-MS进行测量,数据采用所占每克小鼠的注射剂量的百分比表示。
图5显示,本发明制备的纳米系统相较于DTPA-Gd在肿瘤组织具有更高的Gd(III)滞留量(p<0.01)。这一结果与体内MR成像结果相一致。
pHPMA-DOTA-GdP和HPMA-DOTA-Gd-cRGD的肿瘤组织积累分别比DTPA-Gd组高出13倍和44倍。不难看出,cRGD多肽介导的配体特异性结合在共轭物的肿瘤组织聚集及残留中起了重要作用。此外,肝脏及脾脏中存在较高浓度的钆也确证了共聚物在体内具有更长的循环时间。这也提示磁共振成像探针的排泄路径及可能引起毒性的靶器官。
3、细胞毒性分析
采用CCK-8(同仁化学,日本)试剂盒进行三种材料的体外细胞毒性分析。将U87和L02细胞分别接种96孔板(5×103个/孔),培养24小时后,换成分别含有不同浓度DTPA-Gd、pHPMA-DOTA-Gd或pHPMA-DOTA-Gd-cRGD的培养基(Gd(III)浓度:50、100、250及500nmol/mL),继续培养48小时。PBS洗3次,每孔加入100μL CCK-8试剂(10μL原液:90μL RPMI1640培养基)。孵育2小时后,通过VarioscanFlash酶标仪(Thermo Fisher科技,美国)检测450nm的吸光度。未经药物处理的细胞作为100%活性细胞对照。
图6A显示,经过不同浓度DTPA-Gd、pHPMA-DOTA-Gd或pHPMA-DOTA-Gd-cRGD处理48小时后的L02细胞活性没有明显改变(Gd(III)含量:50-500nmol/mL)。然而,pHPMA-DOTA-Gd和pHPMA-DOTA-Gd-cRGD两者均表现出对U87细胞活性的剂量依赖性抑制作用(图6B)。这可能与HPMA共聚物与U87细胞间的相互作用有关。U87细胞高表达αvβ3和αvβ5整合素,而cRGD靶向αvβ3和αvβ5整合素,提高了细胞对磁共振成像探针的吞噬量,由于钆离子的毒性等引发了癌细胞的凋亡。值得注意的是,较低浓度的共轭物(Gd(III)﹤50nmol/mL)处理U87细胞没有表现出细胞毒性。
pHPMA-Gd共轭物体外生物相容性评估:
1、溶血分析
将健康人体新鲜血液使用PBS稀释后(16%v/v,300μL),分别与1mg/mL、3mg/mL或5mg/mL的不同材料共同在37℃孵育12小时,然后1000g离心10min,取200μL上层液至96孔板,通过VarioscanFlash酶标仪测量540nm的吸光度。血液样品溶于蒸馏水及PBS分别作为100%溶血及阴性对照。
红细胞溶血根据美国材料试验协会(ASTM)标准,本发明制备的磁共振成像探针均具有较高的血液相容性(红细胞溶血﹤5%)(图7),较高浓度下(5mg/mL)材料组与PBS对照组相比溶血率依然没有明显差异。这其中共轭物所具有的合适分子量、亲水性质及表面负电荷等卓越特性保护了红细胞胞膜免受磁共振成像探针的破坏,使之具有血液相容性。
红细胞聚集和形态 本发明通过SEM方法进一步评估了高浓度实验磁共振成像探针(5mg/mL)处理后红细胞有无聚集和形态改变。图8显示,与PBS对照组类似,共轭物处理后红细胞依然保持着单分散的正常双凹形态及光滑的表面。根据已有文献,材料处理后红细胞的溶血、聚集及形态改变通常与静电相互作用、亲水及疏水基团的分布和高分子量聚合物的聚集性等有关。幸运的是,经过精心设计,本发明制备的磁共振成像探针兼具表面负电荷、亲水基团以及合适的分子量,从而对红细胞具有很好的生物相容性。
2、凝血分析
采集健康人体新鲜血液,离心收集乏血小板血浆。取360μL血浆分别与三种不同材料(40μL)混合。活化部分凝血活酶时间(APTT)和凝血酶原时间(PT)通过全自动凝血分析仪检测。每个浓度做3个平行组。等体积的PBS作为对照。
如图9所示,本发明制备的磁共振成像探针即使在较高的浓度下(5mg/mL)依然具有与PBS对照组相似的APTT和PT。这表明本发明的材料对血液凝集因子没有明显的影响,归因于HPMA共聚物主链的亲水性。
3、血栓弹力图(TEG)
抽取健康人体新鲜血液与不同材料混合(血液:材料=9:1,1mL)使纳米材料的最终浓度为0.1mg/mL和1mg/mL。将混合物加入到含有高岭土的特制管中。取340μL上清液与20μL的CaCl2(0.2M)加入到测样杯中,通过血栓弹力图仪(Haemoscope公司)进行测试。等体积PBS作为对照。
不同实验材料处理的全血均与对照组相类似。不同组间R、K值、α角和MA均无明显差异。所有这些均证明本发明的磁共振成像探针(5mg/mL)不影响血液凝集过程,这都归因于精心设计的共轭物具有的合适分子量、亲水性以及表面负电荷。综上所述,可以确定制备的HPMA-Gd(III)共轭物是安全且血液相容的。
四、体内毒性研究
体外毒性研究仅仅是体内研究的前提,只有经过体内安全性验证后,磁共振成像探针才可以应用于临床。本发明采用健康的BALB/c小鼠进行研究,具体操作详见方法部分。本发明通过对动物的行为、体重、血液学及组织学分析对磁共振成像探针的体内毒性进行了全面评估。经过为期19天的研究,本发明没有发现任何脱水、运动障碍、肌肉萎缩、厌食或者其他与动物毒性相关的现象。同时,共轭物纳米系统给药后的小鼠具有与GTPA-Gd组相似的体重变化。没有发现其他异常现象。
为了进一步研究其他潜在毒性或明显的副作用,本发明对实验动物的红细胞、血红蛋白、血细胞比容、血小板、血小板平均体积及白细胞等进行了检测。与对照组相比,没有发现明显的差异。这一结果表明,共轭物纳米系统在血液中与体外研究一致,同样具有生物相容性。为了研究组织或器官毒性,本发明对主要器官和组织进行了组织学分析。图10显示了心脏、肝脏、脾脏、肺和肾脏五大主要器官均是正常的,不存在组织病理学上认为的异常、退化或损伤。因此,本发明认为制备的共轭物具有很好的生物相容性和安全性,这其中pHPMA-Gd(III)共轭物精心设计的结构和可生物降解的特性必然起到了重要的作用。
统计分析
所有数据均使用mean±SD表示。各组数据间的差异显著性采用ANOVA及Student's双侧t-检验进行统计分析,P﹤0.05为有统计学意义。
- 还没有人留言评论。精彩留言会获得点赞!