一种抗肿瘤纳米纤维药膜的制备方法与流程
本发明属于生物医用材料领域,具体涉及一种抗肿瘤纳米纤维药膜的制备方法。
背景技术:
肿瘤是目前世界上发病率和死亡率最高的疾病,据我国普查资料显示,每年因肿瘤死亡的患者高达160万例,累计病例640万例,我国每年新发肿瘤病例350万例,这意味着平均每分钟就有6人被诊断为肿瘤。发病率最高为胃癌,依次为肺癌、肠癌、乳癌和肝癌。因此,我国每年都在加大力度研发抗癌药物,其中5-氟尿嘧啶(5-fluorouracil)是经典的肿瘤化疗药物,其作用机理为:5-氟尿嘧啶在肿瘤细胞内转化为5-氟尿嘧啶脱氧核苷酸(5f-dump),可与还原型四氢叶酸及胸腺嘧啶核苷酸合成酶(ts)以共价结合形成三元复合物,使ts酸失活,进而抑制dna的合成,从而达到抑制肿瘤细胞增殖的效果。该药主要为s期特异性药物,但其在体内转化为5-氟尿嘧啶核苷(5-fur)后,也能掺入rna中干扰蛋白合成,故对其他各期细胞也有作用。同时,5-氟尿嘧啶作为临床上常用的代谢类抗癌药物,其血浆半衰期仅为10~20min,治疗剂量和中毒剂量接近,为达到治疗效果,大剂量持续给药将增加其毒副作用,而且用药期间,血药浓度迅速递减,难以维持在理想的治疗水平。
基于此,如何提高5-氟尿嘧啶的有效利用率,增强其对肿瘤的化疗效果,同时降低其毒副作用,减少对正常细胞的损伤,延长药物在体内的代谢周期,成为科研人员急需攻克的难题。
姜黄素(curcumin)是从姜科、天南星科中的一些植物的根茎中提取的一种化学成分,其中,姜黄约含3%~6%,是植物界很稀少的具有二酮的色素,为二酮类化合物。近年的研究不仅证明了姜黄的传统作用,而且揭示出了一些新的药理作用,如抗炎、抗氧化、保护心肌、抑制血管重构及抗动脉粥样硬化、抗人类免疫缺陷病毒、保护肝脏和肾脏、抗纤维化以及防癌抗癌等作用,可能与其抑制核因子κ-b和激活蛋白-1等转录因子的激活及表达有关,而且无明显的毒副作用。姜黄素的分子结构中的酚醛基侧链和中央的亚甲基碳基团都可以脱掉一个氢原子,形成稳定的无毒害的自由基,它能选择性地诱导癌细胞凋亡而对正常细胞作用很小。且研究报道姜黄素能抑制结直肠肿瘤细胞的增殖和转移,并且存在多种可能与5-氟尿嘧啶发挥协调抗肿瘤的作用。
丝素蛋白是一种天然高分子纤维蛋白质,具有独特的氨基酸组成,含有18种氨基酸,其中的11种为人体必需氨基酸,而且甘氨酸、丙氨酸、丝氨酸、酪氨酸四种主要氨基酸含量之和占其氨基酸总量的85%左右。丝素蛋白具备良好的生物相容性、生物可降解性及优良的机械性能,同时,丝素蛋白具有无规卷曲、silki、silkii、silkiii4种高级结构,通过调节丝素蛋白结构可以相互转化,得到不同性能的丝素材料。因此,丝素蛋白是作为药物缓释载体的理想材料。
目前,肿瘤的治疗手段包括手术、放化疗及生物治疗等。其中,化疗作为肿瘤手术前后的有效疗法,主要利用口服、静脉或皮下注射等方式给药,抗肿瘤药物经血液循环分布全身,在体内达到一定的血药浓度后产生治疗作用。通常,小分子抗肿瘤药物的体内半衰期短、给药量大、选择性差,对正常细胞产生很大的毒副作用。大多数抗肿瘤药物在长期使用过程中,会促使细胞产生耐药能力,降低药物的治疗效果。另外,小分子抗肿瘤药物多为疏水性,例如紫杉醇类抗癌药物的水中溶解度为1-5ug/ml。给药过程中,为了促进小分子抗肿瘤药物的溶解,往往添加表面活性剂或助溶剂,其中助溶剂(二甲基亚砜)容易引起神经毒性,危害患者的身体健康。因此,选择合适的载体材料,构建药物输送系统,实现药物的靶向输送,降低其对正常组织的毒副作用,提高药物的生物利用率,是十分必要的。
技术实现要素:
本发明目的是提供一种抗肿瘤纳米纤维药膜的制备方法,采用丝素蛋白搭载5-氟尿嘧啶和姜黄素两种抗肿瘤药物,一方面,根据化学预防的联合治疗原理,姜黄素协助提高5-氟尿嘧啶的抗肿瘤效果,同时降低后者的毒副作用,发挥共同抑制肿瘤细胞的作用;另一方面,利用缓释材料(丝素蛋白)本身控制释放抗肿瘤药物的效果,解决化疗药物利用口服、静脉注射等情况下产生的瞬时高剂量浓度、药物本身的半衰期短,远端达不到治疗的效果等的问题。
本发明的技术方案是:
一种抗肿瘤纳米纤维药膜的制备方法,该方法包括如下步骤:
(1)制备质量分数为23~30%的丝素蛋白溶液;
(2)制取姜黄素、5-氟尿嘧啶及聚乙二醇(peg)混合溶液;
(3)将步骤(1)、(2)分别制得的溶液按照质量比为1~3:50的比例进行混合,制得静电纺丝溶液,所述静电纺丝溶液在室温下静置24h脱泡后倒入塑料注射针管,并安装在高速滚筒静电纺丝机中制得静电喷射纺丝膜,即为抗肿瘤纳米纤维药膜。
进一步的,步骤(1)中所述制备质量分数为23~30%的丝素蛋白溶液包括如下步骤:
a)脱胶:将纯水置于脱胶锅中加热,待所述纯水即将沸腾时加入无水na2co3,使其充分溶解,待所述纯水沸腾后加入蚕丝,每隔10~20min搅拌一次,煮30~50min,取出后用纯水反复搓洗,置于通风厨中过夜干燥,制得脱胶蚕丝;
b)溶解:称取70~90g溴化锂并溶解,冷却后定容至100~120ml,制得溴化锂溶液,称取多份所述脱胶蚕丝,分装于多个烧杯中,每个烧杯中加入所述溴化锂溶液,使所述脱胶蚕丝充分浸入,用锡箔纸封口,置于60~80℃烘箱中,每隔1小时摇晃一次,4~5小时后取出混合溶液;
c)透析:剪取多段透析袋,浸泡在纯水中5~10min,将取出的多份所述混合溶液分别装入到多个透析袋中,每个透析袋均放入含有4~5l纯水的烧杯中透析,透析过程中每隔6h换水,36小时后制得丝素蛋白溶液;
d)浓缩:称取peg溶解在去离子水中,制得浓度为15~20%的peg浓缩液,将所述丝素蛋白溶液倒入透析袋内,封口,放在所述peg浓缩液中浓缩36h,最后制得质量分数为23~30%的丝素蛋白溶液。
进一步的,步骤a)中所述搓洗次数至少为3次。
进一步的,步骤b)中所述脱胶蚕丝的份数至少为5份。
进一步的,步骤d)中所述聚乙二醇替换为氯仿、无水乙醇或甲醇中的任意一种。
进一步的,步骤(2)中所述制取姜黄素、5-氟尿嘧啶及peg混合溶液包括:设定姜黄素、5-氟尿嘧啶的质量相对于质量分数为23~30%的丝素蛋白溶液分别为0.3~0.4%、0.4~0.8%,将所述姜黄素、5-氟尿嘧啶溶解在peg溶液中,然后在室温条件下在磁力搅拌器中密闭搅拌6h,制得姜黄素、5-氟尿嘧啶及peg混合溶液。
进一步的,步骤(3)中所述静电喷射纺丝膜制成后,还需将所述静电喷射纺丝膜在温度为60~80℃、压力为10mpa的条件下进行真空干燥抽滤时间24h,去除残留有机溶剂,制得抗肿瘤纳米纤维药膜。
进一步的,将所述抗肿瘤纳米纤维药膜置于玻璃干燥器内,同时向所述玻璃干燥器内加入100ml的乙醇溶液,使用循环水式真空泵进行抽真空,维持真空度在0.01mpa以下,进行乙醇蒸汽处理。
本发明所述抗肿瘤纳米纤维药膜的具体优点如下:
(1)通过静电纺丝技术实现抗肿瘤药物与释放载体的有效结合,形成药物控制释放体系,实现药物的控制释放,延长药物在体内的半衰期;
(2)以丝素蛋白溶液为主要组份材料,因此制得的静电喷射薄膜可以在体内自行降解,且降解产物为二氧化碳和水,经人体代谢可以排出体外;
(3)实现了药物的靶向输送,将药物输送至肿瘤部位,达到靶向治疗的效果,降低其对正常组织的毒副作用;
(4)通过化学键结合,提高了低水溶性抗肿瘤药物的溶解性,同时采用化学联合治疗,提高了给药效率;
(5)有效地实现了纺织技术与生物医药的创新结合,为推广和提升生物医用纺织的发展,提供了新思路。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中,
图1为本发明中所述的一种抗肿瘤纳米纤维药膜的制备方法所制备的不同配方的抗肿瘤纳米纤维药膜的电镜图;
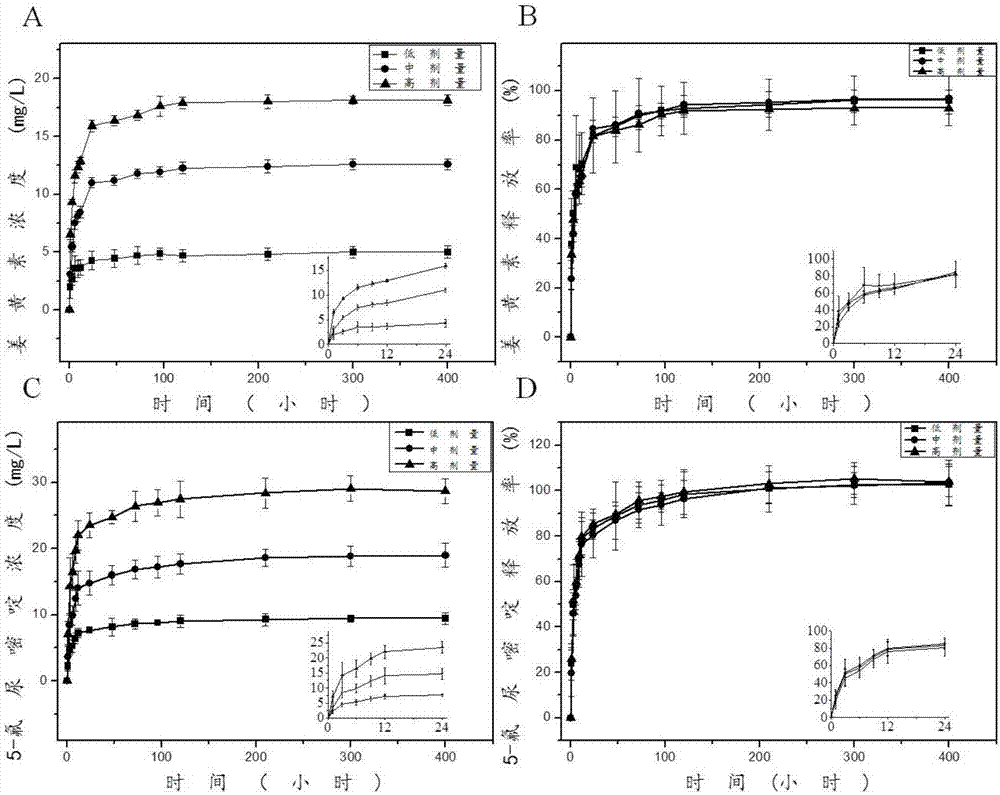
图2为本发明中所述的一种抗肿瘤纳米纤维药膜的制备方法所制备的不同配方的抗肿瘤纳米纤维药膜的缓释曲线图。
具体实施方式
本发明提供一种抗肿瘤纳米纤维药膜的制备方法,包括以下步骤:
(1)制备质量分数为23~30%的丝素蛋白溶液;
(2)制取姜黄素、5-氟尿嘧啶及peg混合溶液;
(3)将步骤(1)、(2)分别制得的溶液按照质量比为1~3:50的比例进行混合,制得静电纺丝溶液,所述静电纺丝溶液在室温下静置24h脱泡后倒入塑料注射针管,并安装在高速滚筒静电纺丝机中制得静电喷射纺丝膜,即为抗肿瘤纳米纤维药膜。
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施方式对本发明作进一步详细的说明。
一种抗肿瘤纳米纤维药膜的制备方法,包括:
步骤一:制备质量分数为23%的丝素蛋白溶液;
在一个实施例中,该步骤可以具体如下执行:制备质量分数为23~30%(丝素蛋白/混合溶液,w/w)的丝素蛋白溶液:
首先,脱胶:量取12l纯水于脱胶锅中加热,称取20~30g无水na2co3,待水即将沸腾时加入所述无水na2co3,使其充分溶解,称取25~35g蚕丝,待水沸腾后加入所述蚕丝,每隔10min搅拌一次,煮30~40min,取出后用纯水反复搓洗3次,置于通风橱中过夜干燥,制得脱胶蚕丝;
然后,溶解:称取70~90g溴化锂(99.9%)溶解,冷却后定容至100~120ml(9.3m),制得溴化锂溶液,称取5份所述脱胶蚕丝,每份5g分装于50ml烧杯中,每个烧杯中加入20ml所述溴化锂溶液,使所述脱胶蚕丝充分浸入,用锡箔纸封口,置于60~80℃烘箱中,每隔1小时摇晃一次,4小时后取出混合溶液;
接着,透析:剪取5段透析袋,浸泡在纯水中约5-10min,将取出的5份所述混合溶液分别装入到5个透析袋中,每个透析袋均放入含有4~5l纯水的烧杯中透析,36~40小时,透析过程中换水6次,制得丝素蛋白溶液;
最后,浓缩:称取300~400g聚乙二醇(polyethyleneglycol,peg)(20000),溶解在去离子水中,制得质量分数为15~20%的聚乙二醇浓缩液,将所述丝素蛋白溶液倒入透析袋内,封口,放在所述聚乙二醇浓缩液中浓缩36h,最后制得质量分数为23~30%的丝素蛋白溶液。
步骤二:制取姜黄素、5-氟尿嘧啶及peg混合溶液;
在一个实施例中,该步骤可以具体如下执行:在支架植入治疗过程中,为了使药膜中药物的释放浓度达到有效浓度以上,所以设定姜黄素、5-氟尿嘧啶的质量相对于丝素蛋白溶液(质量分数15~25%)分别为0.3~0.5%、0.4~0.8%,将所需的姜黄素、5-氟尿嘧啶溶解在聚乙二醇(400)溶液中,室温下,将溶液在磁力搅拌器上密闭搅拌6h,超声(功率120~150w)30~40min,加速双药在peg溶液中的溶解,形成均匀稳定的姜黄素、5-氟尿嘧啶及peg混合溶液。
步骤三:将步骤(1)、(2)分别制得的溶液按照质量比为1~3:50的比例进行混合,制得静电纺丝溶液,所述静电纺丝溶液在室温下静置24h脱泡后倒入塑料注射针管,并安装在高速滚筒静电纺丝机中制得静电喷射纺丝膜,即为抗肿瘤纳米纤维药膜。
在一个实施例中,该步骤可以具体如下执行:将步骤(1)、(2)分别制得的溶液)按照固定比例(w/w=1~3:50)进行混合,制得静电纺丝溶液,在室温下静置24h脱泡后用于后续纺丝,将配制好的静电纺丝溶液倒入10~60ml塑料注射针管,针头直径为0.1~0.5mm,安装在高速滚筒静电纺丝机中。纺丝过程中工作参数设定为:纺丝电压15~25kv,极距150~250mm,注速0.1~0.5ml/h,纺丝结束后得到静电喷射纺丝膜,放置于通风橱12h,即得抗肿瘤纳米纤维药膜。
上述步骤所得的抗肿瘤纳米纤维药膜,其性能请参阅图1、图2和表1,请参阅图1,图1为本发明中所述的一种抗肿瘤纳米纤维药膜的制备方法所制备的不同配方的抗肿瘤纳米纤维药膜的电镜图。如图1所示,图1中(a),(b),(c)及(d)分别为本发明制备的纯丝素药膜纤维、低剂量药膜纤维、中剂量药膜纤维及高剂量药膜纤维的扫描电镜显微镜(sem)的测试结果。从图中可以看出,各组纤维直径依次为756±25nm、524±46nm、631±57nm及1239±136nm。其中,前3组纤维直径粗细均匀,无明显粘连现象。随着溶解药物的浓度增加至高剂量,peg含量增加,导致纺丝液粘度增大,并且其电导率降低,纤维在纺丝过程中牵伸作用减弱,出现珠状物、纤维粘结及纤维粗细不匀等现象。
请参阅图2,图2为本发明中所述的一种抗肿瘤纳米纤维药膜的制备方法所制备的不同配方的抗肿瘤纳米纤维药膜的缓释曲线图。其表示不同配方纳米药膜的药物释放动力学(hplc)的测试结果,在图2中(a)、(b)、(c)和(d)为姜黄素、5-氟尿嘧啶在本发明制备的高、中及低剂量药膜中的缓释情况。其中,药物缓释条件为:37~40℃,ph=7.4~7.9,对比得出,随着药物含量的增加,缓释速度增大,缓释量增多。同时,在缓释至200h左右时,药物缓释量达到80%,其在400h左右缓释结束。整体过程,没有出现明显的“突释”现象,药物可以持续、稳定的释放。
表1为本发明实施例1中所述的抗肿瘤纳米纤维药膜的机械性能的测试结果(平均断裂强度和平均断裂伸长率)。由表1得出,药物及peg的添加,有助于增强纤维膜的机械性能。原因为纤维直径的增加(如sem图);添加物有可能使丝素的无规卷曲silki结构趋向稳定的silkii结构,从而使单根纤维的机械性能增加。结果表明,可以调控药膜的机械性能,从而为下一步的临床治疗创造条件。
表1纺丝膜的平均断裂强度和平均断裂伸长率
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和实施例进一步说明本发明的技术方案。但是本发明不限于所列出的实施例,还应包括在本发明所要求的权利范围内其他任何公知的改变。
首先,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
其次,本发明利用结构示意图等进行详细描述,在详述本发明实施例时,为便于说明,示意图会不依一般比例作局部放大,而且所述示意图只是实例,其在此不应限制本发明保护的范围。此外,在实际制作中应包含长度、宽度及深度的三维空间。
实施例一
本实施案例按如下步骤展示一种抗肿瘤纳米纤维药膜的制备方法:
姜黄素、5-氟尿嘧啶溶于peg/丝素蛋白(w/w=3:50)混合溶剂中,分别配置成质量分数为2~3%、4~5%、6~7%的静电纺丝溶液。配制好的静电纺丝溶液倒入10~60ml塑料注射针管,针头直径为0.1~0.5mm,安装在高速滚筒静电纺丝机。纺丝过程中工作参数设定为:纺丝电压15~30kv,极距150~250mm,注速0.1~0.3ml/h,纺丝结束后得到静电喷射纺丝膜。将纺丝膜进行真空干燥抽滤(温度60~80℃、压力10~15mpa、时间24~30h),去除残留有机溶剂。
成型的纳米纤维药膜置于玻璃干燥器内,同时向干燥器内加入100~200ml的乙醇溶液,使用循环水式真空泵进行抽真空,维持真空度在0.01mpa以下,进行乙醇蒸汽处理。促使药膜的二级结构发生转变,增加形成β折叠结晶结构,使之不溶于水,便于后期药物的控制释放。
实施例二
本实施案例按如下步骤展示一种抗肿瘤纳米纤维药膜的制备方法:
姜黄素、5-氟尿嘧啶溶于氯仿(无水乙醇、甲醇)/丝素蛋白(w/w=3:50)混合溶剂中,分别配置成质量分数为2~3%、4~5%、6~7%的静电纺丝溶液。配制好的静电纺丝溶液倒入储液池,通过金属电机连接高压电源,利用导气管不断吹入高速气流,带动纺丝液进入高压电场完成纤维的牵伸,从而达到纳米级纤维的效果。气泡纺丝过程中工作参数设定为:纺丝电压15~30kv,极距250~300mm,气流速度0.2~0.6l/min,纺丝结束后得到静电喷射纺丝膜。将纺丝膜进行真空干燥抽滤(温度60~80℃、压力10~15mpa、时间24~30h),去除残留有机溶剂。对纺丝膜进行水蒸气处理6~9h,降低其在水中的溶解度。
成型的纳米纤维药膜置于玻璃干燥器内,同时向干燥器内加入100~200ml的乙醇溶液,使用循环水式真空泵进行抽真空,维持真空度在0.01mpa以下,进行乙醇蒸汽处理。促使药膜的二级结构发生转变,增加形成β折叠结晶结构,使之不溶于水,便于后期药物的控制释放。
实施例三
本实施案例按如下步骤展示一种抗肿瘤纳米纤维药膜的制备方法:
姜黄素、5-氟尿嘧啶分别单独溶于聚乙二醇/丝素蛋白(w/w=1~3:50)混合溶剂中,分别配置成药物质量分数为4%的静电纺丝溶液。使用磁力搅拌器密闭搅拌10~20min,转速为600~800r/min,超声分散1~2h,保证药物完全溶解,得到均匀稳定溶液,室温静置24h进行脱泡处理后进行纺丝,本实施例采用双通道恒流注射泵,两针管分别推注含姜黄素、5-氟尿嘧啶的纺丝液。工作参数设定为:纺丝电压25±0.5kv,极距220±5mm,注速0.2±0.05ml/h,时间9~12h。本实施例为双针头喷射纺丝纤维,利用牵伸过程中的易卷曲、易交叉的特性,完成纤维的均匀分布,形成表面光滑、尺寸均匀的纺丝喷射薄膜。
将纺丝膜进行真空干燥抽滤(温度60~80℃、压力10~15mpa、时间24~30h),去除残留有机溶剂。对纺丝膜进行水蒸气处理6~9h,降低其在水中的溶解度。成型的纳米纤维药膜置于玻璃干燥器内,同时向干燥器内加入100~200ml的乙醇溶液,使用循环水式真空泵进行抽真空,维持真空度在0.01mpa以下,进行乙醇蒸汽处理。促使药膜的二级结构发生转变,增加形成β折叠结晶结构,使之不溶于水,便于后期药物的控制释放。
通过水蒸气/甲醇处理可以促使纳米纤维药膜的水中溶解度降低,并且纤维膜的力学性能增强,有利于促进药物的控制释放,可以满足复合膜及植入人体内所需的力学强度要求,后期适合挖掘其在组织工程领域的潜力。
综上所述,本发明公开了一种抗肿瘤纳米纤维药膜的制备方法,其制得的抗肿瘤纳米纤维药膜主要治疗肠道、喉部及鼻腔等肿瘤,上述部位均可以借助外部作用,植入抗肿瘤药物输送系统。例如:喉部肿瘤,采用自膨式支架外部裹覆抗肿瘤纳米缓释药膜,借助光学仪器将覆膜支架准确植入至喉腔,使之贴合病灶部位,利用通透性和滞留效应将药物输送至肿瘤部位,达到靶向治疗的效果,降低其对正常组织的毒副作用。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!