纯化胶原7的方法与流程
本申请要求2016年3月16日提交的美国临时专利申请号62/309,030的权益,并且依赖于其提交日期,其全部公开内容通过引用并入本文。
本公开涉及捕获和纯化胶原7的方法和包含纯化的胶原7的组合物,包括可施用至人的纯化的胶原7。
背景技术
胶原7(“c7”)是结构蛋白,其用于增强和稳定皮肤,并且是固着性原纤维的主要组分,其帮助将皮肤的顶层(表皮)锚定到下面的真皮。c7单体组装成约900kda的同源三聚体,其含有一个nc-1和一个nc-2结合结构域。同源三聚体通过α螺旋卷曲保持在一起。同源三聚体中,这些c7蛋白前体排列成反平行二聚体,分子量增加至1.8mda。反平行二聚体的侧向组装导致固着性原纤维的形成(约800nm长)。
大疱性表皮松解症(eb)是一类遗传病症,其导致皮肤非常脆弱并且容易起疱。对轻微的损伤或摩擦(例如摩或刮)反应而产生疱和皮肤糜烂。营养不良性大疱性表皮松解症(deb)是大疱性表皮松解症的主要形式之一。这种病症的体征和症状在受影响的个体中差异很大。在轻微的情况下,疱可能主要影响手、脚、膝和肘。这种病症的严重情况涉及广泛的疱,可导致视力丧失、毁容和其它严重的医疗问题。营养不良性大疱性表皮松解症可分为三大类:隐性营养不良性大疱性表皮松解症(rdeb)、非hallopeau-siemens型(非hsrdeb)和常染色体显性遗传型(ddeb)。虽然这些类型的严重程度不同,但它们的特征显著重叠,它们都是由col7a1基因突变引起的,该基因编码蛋白胶原7。
还可以通过使用胃蛋白酶溶解羊膜来纯化c7同源三聚体[2]。通过差异盐沉淀部分分级溶解的胶原,其中c7与胶原5(“c5”)共沉淀。在通过dea-纤维素色谱法去除污染的蛋白聚糖后,可以通过cm-纤维素色谱法从c5中分离c7。该产品纯度足以供常规实验室使用。如果需要进一步纯化,可以通过制备型速度沉降获得纯天然结构。在hplc反相色谱后可以获得纯的变性α链。
通过用硫酸铵沉淀然后进行阴离子交换色谱法,在实验室规模上纯化rc7[2]。然而,该纯化方法的产率和纯度不足以用于治疗目的的rc7的商业规模纯化。先前尝试开发rc7的商业规模纯化方法具有仅约1%的总产率。
技术实现要素:
本公开提供了制备纯化的rc7的方法。与先前的方法相比,这些纯化方法显著提高了rc7的产率,并且可用于制备可用于向人施用的高纯度商业规模的rc7组合物。
一方面,本公开涉及用于从细胞培养上清液收集rc7并浓缩为未纯化大量液体的捕获方法,液体任选是冷冻的(“上游加工”)。另一方面,本公开涉及在未纯化的大量液体中纯化rc7的方法(“下游加工”)。还可以组合上游和下游加工步骤以获得适于施用至人的纯化胶原7。在某些实施方案中,捕获和纯化方法是商业规模的方法。
上游加工包含澄清步骤(例如,深度过滤器)和浓缩/缓冲液交换步骤。对于上游加工,一个实施方案涉及捕获由细胞培养物生产的重组人胶原7的方法,该方法包括:
a)使从细胞培养物中收获的上清液接触深度过滤器,其中所述上清液含有重组人胶原7;
b)收集流过所述深度过滤器的溶液;
c)将来自步骤b)的所述溶液进行超滤步骤,其中所述重组人胶原7浓缩于与超滤膜相邻的层中;
d)丢弃第一截留物,其中所述第一截留物包含步骤(b)所述溶液中含有的杂质;
e)使与超滤膜相邻的层接触增溶剂和/或表面活性剂以回收重组人胶原7,并获得含有重组人胶原7的第二截留物;
f)使所述第二截留物进行渗滤步骤以获得包含重组人胶原7的未纯化的大量液体;以及
g)任选地,冷冻所述未纯化的大量液体。
在某些实施方案中,该方法在步骤a)之前还包括步骤:
a)培养生产重组人胶原7的宿主细胞;以及
b)从培养的宿主细胞中收获上清液。
在某些实施方案中,未纯化的大量液体在澄清的上清液中含有40-80%的重组胶原7。在一个实施方案中,未纯化的大量液体在澄清的上清液中平均含有约60%的重组胶原7。
在某些实施方案中,细胞培养包括在生物反应器中培养宿主细胞,其体积为至少200升,优选至少1500升。在某些实施方案中,生物反应器是灌注生物反应器或补料分批生物反应器。
在某些实施方案中,未纯化的大量液体含有超过50克的重组人胶原7。
在某些实施方案中,增溶剂包括尿素、硫脲、精氨酸、丁醇、乙醇、高氯酸锂、乙酸锂、乙酸镁、苯酚、丙醇、十二烷基硫酸钠、天冬氨酸、谷氨酸、抗坏血酸、谷氨酰胺、天冬酰胺和胍中的至少一种。在一个实施方案中,增溶剂包含精氨酸。
对于下游加工,一个实施方案涉及纯化重组人胶原7的方法,该方法包括:
a)使含有重组人胶原7的样品接触混合模式流过树脂,其中所述混合模式流过树脂包括配体活化核和非活性壳,其中所述非活性壳防止重组人胶原7进入配体活化核,并且其中足够小的杂质通过非活性壳并与配体活化核结合;
b)收集流过混合模式流过树脂的且含有重组人胶原7的第一流出物(effluent);
c)在允许所述重组人胶原7与阳离子交换色谱树脂结合的条件下,使来自步骤b)的所述第一流出物接触阳离子交换色谱树脂;
d)从阳离子交换色谱树脂中洗脱重组人胶原7;
e)使步骤d)洗脱的重组人胶原7接触流过模式的疏水相互作用色谱树脂,并收集流过疏水相互作用色谱树脂的第二流出物;
f)使步骤e)的第二流出物进行超滤步骤以浓缩重组人胶原7;
g)用缓冲液对来自步骤f)的浓缩的重组人胶原7进行渗滤;以及
h)回收纯化的重组人胶原7,
其中该方法包括一个或多个病毒减少步骤和内切核酸酶处理步骤。
在某些实施方案中,超滤步骤包括切向流过滤器,并且其中切向流过滤器包括亲水膜。
在某些实施方案中,该方法在步骤f)之前还包括将增溶剂和/或表面活性剂添加到来自步骤e)的第二流出物中的步骤。
在某些实施方案中,所述一个或多个病毒减少步骤在步骤a)之前包括辐射(例如,uv辐射)含有重组人胶原7的样品的步骤,向来自步骤b)的第一流出物添加表面活性剂的步骤,以及将来自步骤e)的第二流出物接触多孔过滤器的步骤。在一个实施方案中,多孔过滤器包含多个平均直径为35nm的孔。
在某些实施方案中,内切核酸酶处理步骤包括用内切核酸酶处理来自步骤d)的洗脱的重组人胶原7。
在某些实施方案中,缓冲液包含至少一种盐、增溶剂和糖。
在某些实施方案中,所述至少一种盐是氯化钠、柠檬酸盐和磷酸钠中的一种或多种,所述增溶剂是精氨酸,并且所述糖是蔗糖。
在某些实施方案中,步骤h)的纯化重组人胶原7含有平均15-30%的来自步骤a)样品中的重组人胶原7的量。
在某些实施方案中,步骤a)中的样品含有至少25克重组人胶原7。
在某些实施方案中,在步骤h)中回收至少4.0克纯化的重组人胶原7。
在某些实施方案中,步骤h)的纯化重组人胶原7含有不超过2000ng的宿主细胞蛋白每mg重组人胶原7,优选不超过1000ng/mg,更优选不超过600ng/mg。
在某些实施方案中,步骤h)的纯化重组人胶原7含有不超过42pg的宿主细胞dna每mg重组人胶原7,优选不超过25pg/mg,更优选不超过15pg/mg。
在某些实施方案中,步骤h)的纯化重组人胶原7含有不超过1.0eu/mg内毒素每mg重组人胶原7,优选不超过0.70eu/mg,更优选不超过0.50eu/mg。
在某些实施方案中,该方法在步骤a)之前还包括步骤:
a)使从细胞培养物中收获的上清液接触深度过滤器,其中所述上清液含有重组人胶原7;
b)收集流过深度过滤器的溶液;
c)使来自步骤b)的溶液进行超滤步骤,其中重组人胶原7浓缩于与超滤膜相邻的层中;
d)丢弃第一截留物,其中所述第一截留物包含来自步骤(b)的溶液中所含的杂质;
e)使与超滤膜相邻的层接触增溶剂和/或表面活性剂以回收重组人胶原7并获得含有重组人胶原7的第二截留物;
f)使第二截留物进行渗滤步骤,以获得包含重组人胶原7的未纯化的大量液体;以及
g)任选地,冷冻所述未纯化的大量液体。
在某些实施方案中,增溶剂包含尿素、硫脲、精氨酸、丁醇、乙醇、高氯酸锂、乙酸锂、乙酸镁、苯酚、丙醇、十二烷基硫酸钠、天冬氨酸、谷氨酸、抗坏血酸、谷氨酰胺、天冬酰胺和胍中的至少一种。在一个实施方案中,增溶剂包含精氨酸。
另一方面涉及通过本文所述方法获得的纯化的rc7组合物。纯化的rc7组合物优选适合人使用。在某些实施方案中,rc7组合物含有:
·不超过2000ng的宿主细胞蛋白每mgrc7,优选不超过1000ng/mg,更优选不超过600ng/mg;
·不超过42pg宿主细胞dna每mgrc7,优选不超过25pg/mg,更优选不超过15pg/mg;和/或
·不超过1.0eu/mg内毒素每mgrc7,优选不超过0.70eu/mg,更优选不超过0.50eu/mg。
前述一般性概述和以下的详细描述都仅仅是示例性的,并不是对本公开的限制。
附图说明
包含在本说明书中并构成本说明书一部分的附图说明了某些实施方案,并与书面描述一起用于解释本文公开的组合物和方法的某些原理。
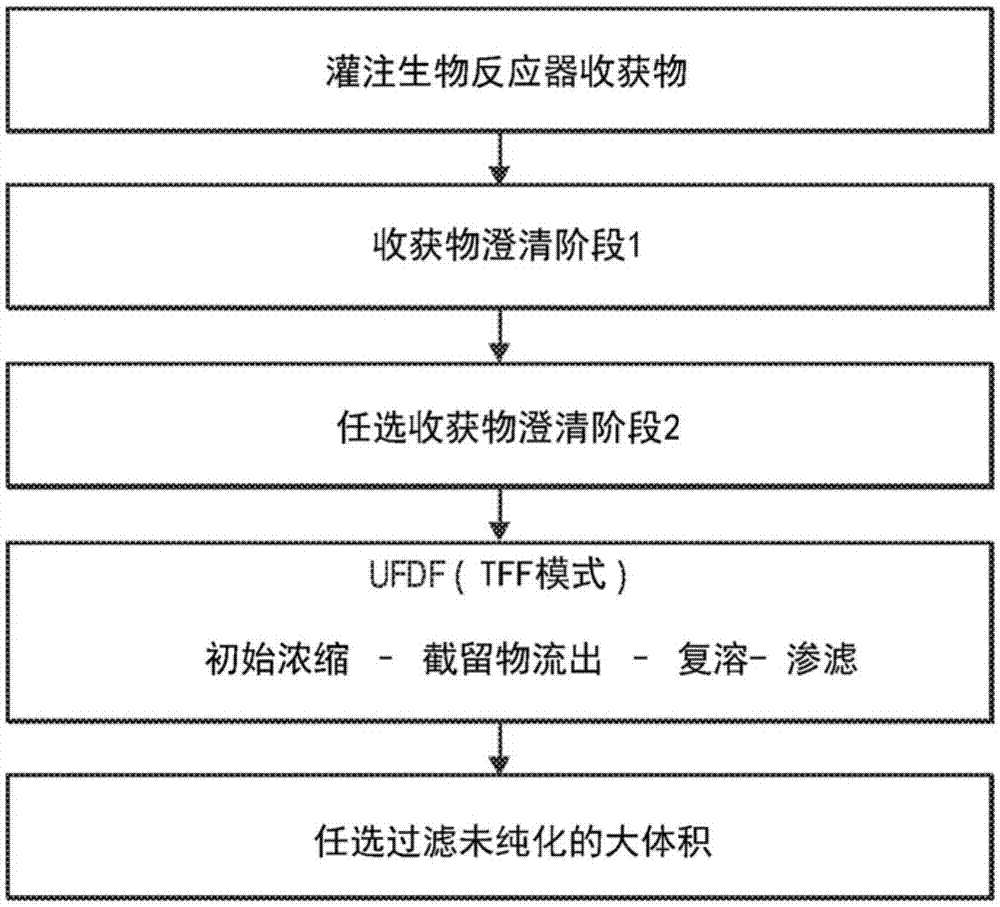
图1是流程图,其显示用于收集、澄清以及将rc7浓缩(uf/df)成未纯化的大量液体的一般上游方法的一个实施方案。
图2是流程图,其显示用于收集、澄清以及将rc7浓缩(uf/df)成未纯化的大量液体的具体上游方法的一个实施方案。
图3是流程图,其显示通过使rc7接触混合模式流过树脂、然后进行阳离子交换色谱、流过模式的疏水相互作用色谱树脂以及最终的uf/df步骤,用于纯化rc7的一般下游方法的实施方案。
图4显示在澄清和uf/df步骤(上游方法)之后,获自第一次和第二次生产运行收获(每次运行总共20个每日收获)的未纯化大体积(upb)中rc7的回收百分比。还提供了来自中试运行的平均rc7产率比(以及最大值和最小值)。
图5显示在澄清和uf/df步骤(上游方法)之后,获自第一次和第二次生产运行收获(总共20个每日收获)的未纯化大体积(upb)中rc7/宿主细胞蛋白(hcp)。还提供了来自中试运行的平均rc7/hcp比率(以及最大值和最小值)。
图6是显示rc7纯化方法(下游方法)的一个实施方案的示意图。
具体实施方式
1.定义
为了更容易理解本发明,首先在下面定义某些术语。通过说明书阐述了以下术语和其它术语的附加定义。
如在本说明书和所附权利要求中所使用的,单数形式“一”、“一个”和“该”包括复数指代,除非上下文另有明确说明。因此,例如,提及“一种方法”时,包括一种或多种方法,和/或本文所述类型的步骤和/或阅读本公开等时对于本领域技术人员显而易见的步骤。
大约:如本文所使用的,当应用于一个或多个感兴趣的值时,术语“大约”或“约”是指与所述参考值类似的值。在某些实施方案中,除非另有说明或从上下文中显而易见(除非此数字超过可能值的100%),则术语“大约”或“约”是指所述参考值的任一方向(大于或小于)落入25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小之内的值的范围。
商业规模:如本文所用,术语“商业规模”用于区分大规模生产方法和实验室规模方法,实验室规模方法通常难以扩展以获得足以用于商业目的的rc7生产水平。商业规模的捕获和纯化方法生产克量的rc7。
赋形剂:如本文所用,术语“赋形剂”是指可以包含在药物组合物中的非治疗剂,例如以提供或有助于所需的稠度或稳定作用。合适的药物赋形剂包括,例如,缓冲液(例如,磷酸盐缓冲液如磷酸钠、tris缓冲液)、盐水、盐(例如氯化钠)、乳酸林格氏液、电解质、表面活性剂(例如表面活性剂,例如聚山梨醇酯、tritonx-100)、稳定剂、防腐剂如抗菌剂或抗氧化剂、淀粉、糖(如葡萄糖、乳糖、蔗糖、林格氏葡萄糖和右旋糖)、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、甘油单硬脂酸酯、滑石、脱脂乳、甘油、丙烯、乙二醇、水、乙醇等。
宿主细胞:如本文所用,短语“宿主细胞”是指其中已引入外源dna(重组或其它)的细胞,例如编码人胶原7的dna。宿主细胞可用于通过标准重组技术生产目的多肽,例如人胶原7。阅读本公开内容后,技术人员将理解,这些术语不仅指特定的受试细胞,而且指这种细胞的后代。因为由于突变或环境影响而在后代中可能发生某些修饰,所以这些后代事实上可能与亲本细胞不同,但仍包括在本文所用的术语“宿主细胞”的范围内。在一些实施方案中,宿主细胞包括适于表达外源dna(例如,重组核酸序列)的任何原核和真核细胞。示例性细胞包括非人动物细胞、人细胞或细胞融合物例如杂交瘤或四倍体。在一些实施方案中,细胞是人、猴、猿、仓鼠、大鼠或小鼠细胞。在一些实施方案中,细胞是真核细胞,并且选自以下细胞:cho(例如chok1、dxb-11cho、veggie-cho)、cos(例如cos-7)、视网膜细胞、vero、cv1、肾(例如hek293、293ebna、msr293、mdck、hak、bhk)、hela、hepg2、wi38、mrc5、colo205、hb8065、hl-60(例如bhk21)、jurkat、daudi、a431(表皮)、cv-1、u937、3t3、l细胞、c127细胞、sp2/0、ns-0、mmt060562、塞尔托利氏(sertoli)细胞、brl3a细胞、ht1080细胞、骨髓瘤细胞、肿瘤细胞和源自上述细胞的细胞系。
药学上可接受的载体:可用于本公开的药学上可接受的载体(载体(vehicles))是常规的。remington'spharmaceuticalsciences,e.w.martin,mackpublishingco.,easton,pa,第15版(1975)描述了适用于药物递送一种或多种治疗组合物(例如一种或多种流感疫苗)和其它药剂的组合物和制剂。通常,载体的性质取决于所采用的特定给药方式。例如,肠胃外制剂通常包含可注射的流体,其包括药学上和生理学上可接受的流体,例如水、生理盐水、平衡盐溶液、葡萄糖水溶液、甘油等作为载体。对于固体组合物(例如,粉末、丸剂、片剂或胶囊形式),常规的无毒固体载体可包括例如药物级的甘露醇、乳糖、淀粉或硬脂酸镁。除生物中性载体外,待施用的药物组合物可含有少量无毒辅助物质,例如润湿剂或乳化剂、防腐剂和ph缓冲剂等,例如乙酸钠或脱水山梨糖醇单月桂酸酯。
重组体:如本文所用,术语“重组”意指通过重组方式设计、改造、制备、表达、生产或分离的多肽(例如,如本文所述的胶原7多肽)或其编码核酸,例如使用转染到宿主细胞中的重组表达载体所表达的多肽、从重组组合多肽文库中分离的多肽、或通过任何涉及将所选序列元件剪接成其它序列元件的其它方式而制备、表达、生产或分离的多肽。标准技术可用于重组核酸、寡核苷酸合成和组织培养和转化(例如,电穿孔、脂质转染)。可以根据制造商的说明书、或者如本领域中通常实现的、或如本文所述的来执行酶促反应和纯化技术。通常可以根据本领域熟知的常规方法进行前述技术和程序。参见例如sambrook等人,molecularcloning:alaboratorymanual(第四版,coldspringharborlaboratorypress,coldspringharbor,n.y(2012)),其通过引用并入本文。
表面活性剂:如本文所用,术语“表面活性剂”是指降低两种液体之间或液体和固体之间的表面张力的化合物。表面活性剂的实例包括但不限于聚氧乙烯脱水山梨糖醇酯(通常称为吐温),特别是聚山梨醇酯20和聚山梨醇酯80;环氧乙烷(eo)、环氧丙烷(po)、氧化丁烯(bo)的共聚物(如dowfax);具有不同重复的乙氧基(氧-1,2-乙二基)基团的辛苯聚醇,特别是辛苯聚醇-9(tritonx-100);乙基苯氧基聚乙氧基乙醇(igepalca-630/np-40);磷脂如卵磷脂;壬基酚乙氧基化物如tergitolnp系列;月桂基、十六烷基、硬脂基、油醇衍生的聚氧乙烯脂肪醚(brij表面活性剂),特别是三乙二醇单月桂醚(brij30);脱水山梨醇醚,称为span,特别是脱水山梨糖醇三油酸酯(span85)和脱水山梨糖醇单月桂酸酯。
2.概述
为了将rc7的发展推进到动物模型之外并进入临床研究,开发了能够生产供人使用的rc7的可扩展方法。当试图从大规模细胞培养开发纯化rc7的方法时,本发明人发现rc7表现出“粘性”,并且在较高的蛋白浓度时倾向于沉淀,特别是配制在pbs缓冲液中时,限制了rc7的溶解度并且在商业规模的纯化方法中导致大量蛋白的损失。rc7在pbs缓冲液中的溶解度限于约0.4mg/ml,高于0.4mg/ml时则出现显著的沉淀和粘度问题。可以将rc7在pbs缓冲液中的溶解度增加至约0.8mg/ml,但仅在非常特定的实验室条件下,其不可扩展或不与常规纯化方法(例如超滤/渗滤(uf/df))兼容。
本发明人开发了rc7纯化方法,实现了比先前方法显著更高的产率。纯化的rc7高度纯化并保持效力。纯化方法分为两部分:上游方法捕获从大规模细胞培养物中收获的rc7,接着是下游方法以纯化捕获的rc7。捕获方法包括澄清步骤和浓缩步骤(通常是超滤/渗滤或“uf/df”步骤),其中将收获的含有rc7的细胞培养上清液通过超滤膜。不是在截留物中收集rc7(如我们先前尝试开发用于rc7的商业规模纯化方法中进行的),而是丢弃初始截留物以去除杂质。不受任何理论的束缚,似乎在这些条件下,rc7浓缩在与超滤膜相邻的层中而不是在截留物中。在丢弃初始截留物后,使该层接触增溶剂和/或表面活性剂以回收rc7。不受任何理论的束缚,似乎增溶剂和/或表面活性剂有助于溶解层中的rc7。以这种方式,将rc7从层中释放并收集在第二截留物中,将其进行渗滤步骤以获得包含重组人胶原7的未纯化的大量液体。该初始uf/df步骤的产率平均为约60%(参见例如图4),而使用较早的内部捕获方法时约为24%,其中rc7被收集在超滤膜的初始截留物中,导致产率显著降低。
通过使来自上游加工的未纯化的大量液体进入混合模式流过树脂,然后是结合和洗脱模式的阳离子交换色谱树脂,然后是流过模式的疏水相互作用色谱树脂,以及最后的uf/df步骤,可以进一步纯化rc7。在某些实施方案中,纯化方法还包含一个或多个病毒减少步骤和内切核酸酶处理步骤。从该纯化方法中回收的rc7是高度纯化的并且保留了纤连蛋白结合活性。下游方法的总产率平均为20%,与通过用于rc7商业规模纯化的早期内部下游方法获得的约2%相比,得到显著改善。此外,相对于残留的宿主细胞dna和蛋白,该纯化方案生产足够纯的rc7,可用于在人中测试或使用(即,每治疗剂量小于100pg宿主细胞dna,更优选每剂量小于10pg)。本文公开的方法主要设计用于商业规模的捕获和纯化rc7。
在一个方面,本公开提供了捕获rc7的方法,该方法包括:
a)澄清收获的含有rc7的细胞培养上清液(例如,使用深度过滤器);
b)浓缩澄清的rc7组合物(例如,使用超滤膜)
c)渗滤浓缩的rc7组合物;以及
g)任选地冷冻未纯化的大量液体。
在某些实施方案中,该方法在步骤a)之前还包括以下步骤:
a)培养生产rc7的宿主细胞;以及
b)从培养的宿主细胞中收获上清液。
另一方面,本公开提供了一种纯化rc7的方法,该方法包括:
a)使含有rc7的样品进行:
·混合模式色谱,流过树脂;
·阳离子交换色谱树脂;
·流过模式的疏水相互作用色谱(hic)树脂;
b)将rc7浓缩在来自hic树脂的流出物中(例如,使用超滤膜);
c)渗滤浓缩的rc7组合物;以及
d)回收纯化的rc7。
纯化方法任选地包括一个或多个病毒减少步骤和内切核酸酶处理步骤。
这些捕获和纯化方法的各种特征和实施方案在下面进一步详细描述。
3.细胞培养
可以使用本领域技术人员已知的标准细胞培养方法以商业规模生产rc7。通常,将编码rc7的核酸引入宿主细胞中,并在适当的细胞培养条件下繁殖宿主细胞。胶原7优选为人胶原7。编码人胶原7的核酸序列是本领域已知的。rc7分泌到细胞培养上清液中。对于rc7的商业规模生产,培养细胞通常在大型生物反应器中生长。在某些实施方案中,生物反应器是灌注生物反应器。在其它实施方案中,生物反应器是补料分批生物反应器。在某些实施方案中,细胞培养包括在生物反应器中培养宿主细胞,其具有至少200、至少500、至少1000、至少1500、至少2000、至少2500、至少5000、至少10,000、至少15,000、或至少20,000升的细胞培养体积。在某些实施方案中,生物反应器是灌注生物反应器,并且灌注生物反应器中细胞培养体积为至少200升,更优选至少1500升。
通常,在连续细胞系中表达rc7。更典型地,连续细胞系是哺乳动物细胞系。合适的连续细胞系包括,例如中国仓鼠卵巢(cho)、小鼠骨髓瘤(例如ns0)、幼仓鼠肾(bhk)、人胚肾(例如,hek-293)、c127、vero、hela、cos和madin-darby犬肾上皮细胞(mdck)。参见例如美国专利no.6,632,637,其通过引用整体并入本文。其它合适的宿主细胞是本领域技术人员已知的。在一个实施方案中,rc7在cho细胞中表达。在另一个实施方案中,rc7在hek-293细胞中表达。
4.上游方法
一方面,本公开涉及用于从细胞培养上清液收集rc7并浓缩到未纯化的大量液体中的捕获方法,所述未纯化的大量液体任选地进行冷冻。该方面也称为上游加工,其中rc7经收获、澄清和浓缩。显示一般上游方法的一个实施方案的流程图,显示在图1中。图2显示了用于捕获获得rc7的特定上游方法的一个实施方案。
a.收获
来自生物反应器的上清液被收集并保持在合适的储存温度,通常为2-8℃。通常,未加工的上清液在开始澄清方法之前保持不到1天。如果细胞在灌注生物反应器中生长,则每天批量收获上清液,持续5-30、10-25或15-20天,优选20天。
b.澄清
可以澄清收获的上清液以去除例如完整的细胞和细胞碎片,并在uf/df步骤之前减少生物负载和其它颗粒。可以使用普通技术人员已知的任何澄清方法,包括过滤、微滤、离心、色谱等。
通常,过滤用于从收获的上清液中去除细胞碎片和完整细胞。如本领域所知,过滤方法的选择部分地取决于相对于待截留蛋白大小的污染物尺寸分布。所需的过滤选项将优化去除不需要的残余颗粒之间的平衡,同时保持高rc7产率。合适的过滤器包括纤维素过滤器、再生纤维素纤维、结合无机助滤剂的纤维素纤维、结合无机助滤剂和有机树脂的纤维素纤维,或其任何组合。
在一些实施方案中,使用深度过滤程序进行收获的上清液的澄清。如本领域所理解的,深度过滤是指使用多孔过滤介质来澄清含有大量大颗粒(例如,完整细胞或细胞碎片)的溶液,与膜过滤相比,在这种条件下膜过滤可能迅速堵塞。深度过滤步骤可以包括使流体通过一个或多个,两个或更多个或三个或更多个深度过滤器。在某些实施方案中,上游加工包括两个澄清步骤,其中第一澄清步骤通常使用具有较大孔径(例如,65μm)的深度过滤器,第二澄清步骤通常使用具有较小孔径(例如,0.45和/或0.2μm)的灭菌级膜过滤器。
不同孔径的各种深度过滤介质可从各种制造商商购,例如millipore、pall、generalelectric和sartorious。例如,可以使用millistak/d0hc和millistak/de50(emdmillipore,darmstadt,德国)和sartopuregfplus(0.65μm深度过滤器)。各种孔径的各种膜过滤器可从各种制造商商购,例如millipore、pall、generalelectric和sartorious。例如,可以使用sartoguardpes1.2/0.2μm、sartoporepesplatinum0.45/0.2μm过滤器(sartoriousstedim,goettingen,德国)。
c.浓缩和缓冲液交换
在上游方法的某些实施方案中,通过本领域普通技术人员已知的许多方法中的任何一种方法浓缩rc7组合物,例如渗滤、色谱、超滤等。
在一个实施方案中,在进行渗滤步骤(“uf/df”)之前,通过超滤浓缩rc7组合物。uf/df是超滤和渗滤的组合操作。该步骤去除分子尺寸小于膜的孔隙率或分子量截留值(mwco)的杂质和/或组分,浓缩rc7,并交换/改变rc7组合物的水性或缓冲组合物。尽管在本领域中是众所周知的,但为了清楚起见,术语“超滤”是指通过使组合物通过一个或多个特定孔径直径的半透过滤器(或膜或介质)从rc7中分离杂质的方法,其中较大的分子截留在过滤器上,而水和较低分子量的分子通过过滤器。这些较低分子量的分子可以是培养基组分、肽片段和/或其它污染物(杂质)例如脂多糖、较小分子量的宿主细胞蛋白。基于靶分子的大小选择膜孔径。通常,大于mwco的颗粒将被膜截留,而小于mwco的颗粒将通过。该方法还浓缩rc7组合物。
当提及过滤时,术语“渗透物流”是指在过滤期间通过过滤器孔的组合物的分数。当提及过滤时,术语“截留物流”是指在过滤期间截留在过滤器上或不通过过滤器孔的组合物的分数。
在我们先前的内部大规模捕获方法中,rc7被收集在滞留物流中,而杂质在被丢弃的渗透物流中。相反,在目前的方法中,在上游方法的超滤步骤中,初始截留物流与渗透物流一起被丢弃。不受任何理论的束缚,似乎在这些条件下,rc7浓缩在与超滤膜相邻的层中,并且既不收集在初始滞留物流中也不收集在渗透物流中。弃去初始截留物后,使该层接触增溶剂和/或表面活性剂以回收rc7。不受任何理论的束缚,似乎增溶剂和/或表面活性剂有助于溶解层中的rc7。以这种方式,将rc7从层中释放并收集在第二截留物中,将其进行渗滤步骤以获得包含rc7的未纯化的大量液体。
合适类型的uf/df膜和装置是本领域技术人员已知的,并且可以基于各种因素进行选择,例如待过滤的蛋白的分子量、待过滤的组合物组分的量和大小、待过滤的组合物的体积、以及待过滤的组合物的细胞密度和活力。在一些实施方案中,可以使用过滤器例如膜超滤器、板超滤器、筒式超滤器、袋式超滤器或真空超滤器。在某些实施方案中,超滤膜或过滤器的mwco为250-50kda,优选约200kda或100kda。在某些实施方案中,超滤膜或过滤器包含乙酸纤维素、再生纤维素、聚偏二氟乙烯(pvdf)或聚醚砜(pes)。在上游方法中uf/df步骤的一个实施方案中,超滤膜包含纤维素或再生纤维素。
在某些实施方案中,超滤步骤生产rc7组合物,其中rc7的浓度大于存在于收获上清液中rc7浓度的10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍、120倍、150倍或200倍。
可以使用的市售超滤膜或过滤器由各种供应商制造,例如milliporecorporation(billerica,mass.)、pallcorporation(easthills,ny)、gehealthcaresciences(piscataway,nj)和sartoriuscorporation(goettingen,德国)。例如,可以使用satoriuseco再生纤维素(100kda)。
通常,通过切向流过滤(tff)模式进行超滤/渗滤。tff(也称为交叉流过滤(cff))对于本领域普通技术人员来说是公知的,并且用于在各种情况下实施的设备和方案可从各种制造商而商业获得,包括但不限于pallcorporation(portwashington,ny)和spectrumlabs(ranchodominguez,ca)。通常,tff涉及截留物跨膜表面的再循环。这种温和的交叉流动进料可最大限度地减少膜污染,保持高过滤率并提供高产品回收率。在一个实施例中,tff可以用平板系统实现。在另一个实施方案中,tff可以用中空纤维系统实施,如本文所例示的。
渗滤用于制备用于最终用途的rc7组合物,例如储存、冻干、肠胃外制剂等。通常通过添加/去除/替换缓冲剂和/或其浓度来交换和/或改变缓冲系统,以便生产包含rc7的未纯化的大量液体。可以引入额外的添加剂,例如以调节ph、张力、溶解度和/或稳定性。稳定性可以指在液体状态下稳定rc7组合物或在冻干或重构期间保护rc7。在某些实施方案中,未纯化的大量液体包含重组胶原7、tris缓冲液、增溶剂(例如精氨酸)、氯化钠和表面活性剂(例如tritonx-100)。可以储存或冷冻未纯化的大量(upb)液体用于后续使用。
在某些实施方案中,upb液体在从细胞培养物收获的上清液中含有40-80%的rc7。在某些实施方案中,澄清和捕获步骤的平均rc7回收率为约40-45%,即合并的upb在从细胞培养物收获的上清液中含有约40-45%的rc7。在某些实施方案中,upb液体含有超过5、10、15、20、25、30、35、40、45、50、60、70、80、90或100克的rc7。
d.无菌过滤
无菌过滤步骤也可包括在本方法中,这有助于消除生物负载。例如,在uf/df步骤之后,可以使用例如0.22微米过滤器,例如改性的聚偏二氟乙烯(pvdf)膜(emdmillipore)对upb进行无菌过滤。除了改进的pvdf之外,无菌过滤器可以由本领域公知的并且普通技术人员可获得的各种其它材料构成。这些可包括但不限于聚丙烯、纤维素、纤维素酯、尼龙、聚醚砜或任何其它材料,这与低产物结合一致。无菌过滤的rc7组合物可以冷冻并储存或保持在2-8℃直至备随后使用。
5.下游方法
任何rc7样品,包括通过任何捕获方法收集的rc7,可以通过使rc7样品进行混合模式流过树脂,然后进行阳离子交换色谱,流过模式中的疏水相互作用色谱树脂,以及最终进行浓缩和可选的缓冲液交换(例如uf/df)步骤来进一步纯化。图3.纯化方法还优选含有一个或多个病毒减少步骤和内切核酸酶处理步骤。从该纯化方法中回收的rc7是高度纯化的并且保留了纤连蛋白结合活性。纯化的rc7优选适合人使用。
a.混合模式色谱法
混合模式流过树脂结合了两种通用的纯化技术:尺寸排阻和结合分离。混合模式的流过树脂包括配体活化核和非活性壳。非活性壳用作尺寸排阻组分并防止较大分子(例如rc7)进入配体活化核。非活性壳具有不同的孔径以设定所需的分子量截止值。在某些实施方案中,非活性壳的截留分子量为200-1500kda,更优选500-900kda,最优选约700kda。
较大的分子,如rc7,被收集在柱流过物(flowthrough)中,而较小的杂质通过非活性壳进入配体活化核,并与内部配体结合。用配体对核进行官能化,而配体决定结合相互作用。“配体”是连接到色谱基质上并确定基质的结合特性的官能团。“配体”的实例包括但不限于离子交换基团(阴离子或阳离子交换基团)、疏水相互作用基团、亲和基团或其组合(多模(multimodal))。多模配体在广泛的ph和盐浓度范围内促进与大多数杂质的强结合。通过使用标准试剂(例如naoh)以及在大多数情况下使用溶剂的原位清洗程序,从核配体中去除结合的杂质。
可以使用的市售混合模式流过树脂由各种供应商制造,例如gehealthcaresciences(piscataway,n.j.)、bio-rad(hercules,ca)和thermofisherscientific(waltham,ma)。例如,可以使用gehealthcaresciencescaptotmcore700柱。
b.阳离子交换色谱法
阳离子交换色谱法的原理在本领域中是公知的,但是简而言之,该方法依赖于待分离的颗粒与所用树脂之间的静电相互作用。阳离子交换柱含有固定的带负电荷的部分。因为rc7在生理ph范围内带正电荷,所以柱以结合和洗脱模式操作,其中rc7与阳离子交换色谱树脂结合。
为了优化带正电荷的分子的结合,流动相通常是低至中等离子强度(即,低至中盐浓度)溶液。分子对固体支持物的吸附由样品分子中和载体上官能配体带相反电荷的离子基团之间的离子相互作用驱动。相互作用的强度取决于分子上和官能团上电荷的数量和位置。通过增加盐浓度(通常通过使用线性盐梯度或阶梯等度洗脱),具有最弱离子相互作用的分子首先开始从柱洗脱。具有更强离子相互作用的分子需要更高的盐浓度并且在梯度中稍后洗脱。
阳离子交换基质通常包含共价结合的带负电荷的部分。可以使用弱或强阳离子交换树脂。通常,强阳离子交换树脂包含负载的有机基团,包括磺酸或磺酸盐(酯)基团或磷酰基,这取决于ph。弱阳离子交换树脂通常包含负载的有机基团,包括羧酸或羧酸盐(酯)基团,这取决于ph。在某些实施方案中,可以使用多模阳离子交换树脂,其涉及额外的结合机制以及离子相互作用,例如氢键相互作用和疏水相互作用中的一种或多种。合适的阳离子交换树脂的实例包括但不限于fractogel、羧甲基(cm)、磺乙基(se)、磺丙基(sp)、磷酸盐(酯)(p)和磺酸盐(酯)(s)、propacwcx-10tm(dionex)、captos、fractogelemdso3m、toyopearlmegacapiisp550c、poros50hs和sp-sepharoseff基质。在某些实施方案中,阳离子树脂包含磺丙基。
对于rc7,阳离子交换色谱步骤应以结合和洗脱模式使用。在结合和洗脱模式中,rc7被吸附到阳离子交换基质上,而一种或多种杂质流过基质,从而将rc7与杂质分离。在一些实施方案中,在从阴离子交换基质中去除吸附的rc7之前,用缓冲液洗涤阳离子交换基质一次或多次以去除额外的杂质。在使用结合模式的阳离子交换色谱法从组合物中去除一种或多种杂质后,可以从阳离子交换基质中去除(洗脱)吸附的rc7。
c.疏水相互作用色谱
疏水相互作用色谱(hic)基于它们的疏水性来分离分子。hic通过利用这些分子与hic树脂疏水表面(例如,疏水配体修饰的聚合基质)之间的可逆相互作用,根据其表面疏水性的差异来分离分子。通常,疏水分子和hic基质的配体之间的相互作用受运行缓冲液中存在的亲液盐(kosmotropicsalt)的影响。高盐浓度增强了相互作用,而降低盐浓度则减弱了相互作用。随着缓冲液的离子强度降低,分子与基质之间的相互作用被逆转,并且具有最低疏水性程度的分子首先被洗脱。最疏水的分子最后洗脱,这需要更大的盐浓度降低以逆转相互作用。
大多数蛋白质,且至较小程度的亲水性分子(例如dna和碳水化合物),在其表面上具有疏水区域或区块(patch)。这些区块的溶剂化在能量上是不利的,并导致在水性流动相中形成疏水腔。促进疏水作用(通过添加亲液盐)促使蛋白上的疏水区域吸附到固定相上的疏水区域(例如,含有疏水配体的那些基质区域)。这在热力学上是有利的,因为它减少了各个疏水腔的数量和体积。在常规hic中,通过降低亲液盐的浓度来减少疏水相互作用导致从固体载体上的解吸附。常规hic与其它色谱分离方法的不同之处在于蛋白在高盐浓度下与固定相结合并在低盐浓度下洗脱。
hic也可用于“流过模式”。流过模式中的hic可用于去除聚集体和其它杂质。这些杂质具有与rc7非常相似的化学性质,但它们通常比rc7更疏水。在适当的条件下,杂质与hic树脂结合,使rc7流过。在hic流过模式中,疏水色谱/hic树脂与水性流动相缓冲液组合,通常具有5.0至约7.0、5.5至约6.5、或约6.0的ph。
最广泛使用的hic基质是亲水性碳水化合物:交联琼脂糖和合成共聚物材料。尽管配体可能相同,但不同基质之间的选择性将不相同。hic基质的实例包括但不限于琼脂糖(agarose)、琼脂糖(sepharose)和甲基丙烯酸聚合物。
hic基质可以用疏水配体基团(例如,共价键合)修饰,分子的疏水区域吸附在疏水配体基团上。分子的吸附行为取决于固定化配体的类型。通常,直链烷基配体显示疏水特性,而芳基配体显示混合模式行为,其中芳香和疏水相互作用都是可能的。在某些情况下,配体类型的选择可以凭经验确定。可用于本文的疏水性配体的实例包括但不限于醚基、聚丙二醇基、苯基、丁基、己基和辛基。具有这些官能团的hic树脂的实例包括但不限于苯基sepharose、丁基sepharose、辛基sepharose、capto苯基、toyopearl丁基、toyopearl苯基、toyopearl己基、toyopearl醚和toyopearlppg。在某些实施方案中,hic树脂包含用聚醚配体改性的甲基丙烯酸聚合物,例如聚丙二醇。
d.浓缩和缓冲液交换
在下游方法的某些实施方案中,通过本领域普通技术人员已知的许多方法中的任何一种方法浓缩rc7组合物,例如渗滤、色谱、超滤等。
在一个实施方案中,在进行渗滤步骤(“uf/df”)之前,通过超滤浓缩rc7组合物。如上所述,uf/df步骤去除分子尺寸小于膜孔隙率的杂质和/或组分,浓缩rc7,并交换/改变rc7组合物的水性或缓冲组合物。在某些实施方案中,uf/df步骤包括使用具有减小的表面积的膜的第一超滤、渗滤和第二超滤。
在某些实施方案中,在uf/df步骤之前,用增溶剂和/或表面活性剂如精氨酸处理来自疏水相互作用色谱步骤的流出物。在这些实施方案中,丢弃渗透物流,同时将rc7浓缩在初始截留物中,初始截留物进行随后的渗滤步骤。
在其它实施方案中,如果在uf/df步骤之前不将增溶剂和/或去污剂添加到rc7组合物中,则可以像在上游方法中一样丢弃初始截留物流以及渗透物流。在丢弃初始截留物后,该层可以接触增溶剂和/或表面活性剂(例如精氨酸)来回收第二截留物中的rc7,第二截留物进行渗滤步骤以获得纯化的rc7。
合适类型的uf/df膜和装置是本领域技术人员已知的,并且可以基于各种因素进行选择,例如待过滤的蛋白的分子量、待过滤的组合物组分的量和大小、待过滤的组合物的体积、以及待过滤的组合物的细胞密度和活力。在一些实施方案中,可以使用过滤器例如膜超滤器、板超滤器、筒式超滤器、袋式超滤器或真空超滤器。在某些实施方案中,超滤膜或过滤器的mwco为250-50kda,优选约200kda或100kda。在某些实施方案中,超滤膜或过滤器包含乙酸纤维素、再生纤维素、聚偏二氟乙烯(pvdf)或聚醚砜(pes)。在一个实施方案中,超滤膜是亲水的。在下游方法中uf/df步骤的一个实施方案中,亲水性超滤膜包含pes。
在某些实施方案中,超滤步骤生产rc7组合物,其中rc7的浓度大于存在于uf/df步骤之前rc7组合物中的rc7浓度的10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍、120倍、150倍或200倍。在某些实施方案中,下游方法uf/df步骤之后获得的纯化rc7在进行混合模式色谱步骤的样品中平均含有15-30%、或17-21%、或约20%的rc7量。在某些实施方案中,进行混合模式色谱步骤的样品含有至少15、20、25、30或50克的rc7,更优选至少20-30克、或至少25克。在某些实施方案中,在下游方法中从uf/df步骤回收至少2.5、3.0、3.5、4.0、4.5或5.0克的rc7,更优选至少3.0至5.0克,或至少4.0克rc7。纯化的rc7保留纤连蛋白结合活性。
可以使用的市售超滤膜或过滤器由各种供应商制造,例如emdmillipore(darmstadt,德国)、pallcorporation(easthills,ny)、gehealthcaresciences(piscataway,nj)和sartoriuscorporation(goettingen,德国)。例如,可以使用biomaxpellicon2100kda(emdmillipore,darmstadt,德国)。
渗滤用于制备用于最终用途的rc7组合物,例如储存、冻干、肠胃外制剂等。通常通过添加/去除/替换缓冲剂和/或其浓度来交换和/或改变缓冲系统,以便生产纯化的rc7组合物,优选适合人使用的rc7组合物。
渗滤不需要将组合物置于最终的药物形式中,也不需要提供每种赋形剂。在uf/df之后可以进行额外的赋形剂或完全改变组合物。然而,uf/df步骤通常将rc7组合物置于接近最终的形式。可以引入额外的添加剂,例如以调节ph、张力、溶解度和/或稳定性。稳定性可以指在液体状态下稳定rc7组合物或在冻干或重构期间保护rc7。纯化的rc7可以储存或冷冻用于后续使用。或者,可以将纯化的rc7冻干并储存用于随后的使用。
e.无菌过滤
无菌过滤步骤也可包括在本方法中,这有助于消除生物负载。例如,在uf/df步骤之后,可以使用例如0.22微米过滤器,例如改性的聚偏二氟乙烯(pvdf)膜(例如,emdmillipore)对纯化的rc7组合物进行无菌过滤。除了改进的pvdf之外,无菌过滤器可以由本领域公知的并且普通技术人员可获得的各种其它材料构成。这些可包括但不限于聚丙烯、纤维素、纤维素酯、尼龙、聚醚砜或任何其它材料,这与低产物结合一致。在某些实施方案中,在无菌过滤之前或之后,优选在之前,将表面活性剂(例如聚山梨醇酯)加入到rc7组合物中。在某些实施方案中,加入表面活性剂(例如聚山梨醇酯)至终浓度为2至0.01%v/v,1.0至0.05%v/v,或约0.05%v/v。如果需要,可以将无菌过滤的rc7组合物冷冻并储存或保持在2-8℃用于随后的配制。
f.病毒减少
在某些实施方案中,下游方法包括一个或多个病毒减少步骤。当病毒从组合物中灭活或物理去除时(或两者),病毒被“减少”。在一些实施方案中,在混合模式流过步骤之前进行病毒减少步骤。在一些实施方案中,在混合模式流过步骤之后进行病毒减少步骤。在一些实施方案中,在混合模式流过步骤之前和之后进行病毒减少步骤。在一些实施方案中,病毒减少步骤在疏水相互作用色谱步骤之后和uf/df步骤之前进行。在一些实施方案中,在混合模式流过步骤之前进行第一病毒减少步骤,在混合模式流过步骤之后和疏水相互作用色谱步骤之前进行第二病毒减少步骤,并且第三病毒减少步骤是在疏水相互作用色谱步骤之后和uf/df步骤之前进行。
当提及病毒的灭活时,病毒可以保留在最终产品中,但是以非感染形式存在。病毒灭活步骤可包括ph灭活步骤和/或化学灭活步骤。化学灭活步骤可包括用表面活性剂(例如去污剂)处理、辐射和/或短暂暴露于足以灭活病毒的高温。这些病毒灭活方法是本领域技术人员已知的,并且本领域技术人员可以选择合适的处理条件。在某些实施方案中,下游加工包括辐射步骤,优选在混合模式流过步骤之前。在某些实施方案中,下游加工包括向rc7组合物中加入表面活性剂(例如去污剂)的步骤,优选向来自混合模式流过步骤的含rc7的流出物中。在某些实施方案中,下游加工包括在混合模式流过步骤之前的辐射步骤和将表面活性剂(例如,去污剂)添加到来自混合模式流过步骤的流出物中的步骤。
当病毒减少步骤包括从组合物中物理去除病毒时,通常涉及过滤。具体地,纳米过滤包括使组合物通过孔径为例如75nm或更小、50nm或更小、35nm或更小、或15nm或更小的基质,以将病毒与rc7分离。在某些实施方案中,下游加工在疏水相互作用色谱步骤之后和uf/df步骤之前包括病毒去除步骤,优选使用平均孔径为35nm的多孔过滤器。各种纳米过滤器可商购获得并且是本领域已知的。
在某些实施方案中,下游加工包括第一病毒减少步骤,包括在混合模式流过步骤之前辐射组合物,第二病毒减少步骤包括将表面活性剂(例如去污剂)添加到来自混合模式流出步骤的流出物中,第三病毒减少步骤包括使来自疏水相互作用色谱树脂的流过物(流出物)接触过滤器,优选平均孔径为35nm的多孔过滤器。
g.内切核酸酶
在某些实施方案中,下游加工包括用内切核酸酶处理含rc7的组合物的步骤。内切核酸酶优选是降解dna和rna的核酸内切酶。在一个实施方案中,内切核酸酶是来自粘质沙雷氏菌(serratiamarcescens)的基因工程核酸内切酶(eaves,g.n等人,j.bact,1963,85,273-278;nestle,m等人,j.biol.chem1969,244,5219-5225),以
在cgmp条件下生产的其它内切核酸酶同样可以用于本申请公开的纯化方法,包括但不限于denerase(sartoriusstedimbiotech,gottingen,德国)、cyanase(ribosolution,cedarcreek,tx,美国)和pierceuniversalnuclease(thermoscientific,waltham,ma,usa)。
在某些实施方案中,内切核酸酶处理步骤在疏水相互作用色谱步骤之前发生。在某些实施方案中,内切核酸酶处理步骤在阳离子交换色谱步骤后发生。在某些实施方案中,内切核酸酶处理步骤发生在阳离子交换色谱步骤之后在疏水相互作用色谱步骤之前。
6.药物组合物
可以根据已知方法配制根据本发明纯化的rc7以制备药学上有用的组合物。可以使用本领域已知的技术配制本公开的组合物用于施用于哺乳动物受试者,优选人。特别地,可以配制用于肌肉内、皮内、粘膜、皮下、静脉内、可注射的贮库型装置或局部施用的递送系统。当递送系统配制成溶液或悬浮液时,递送系统在可接受的载体中,优选含水载体。可以使用各种含水载体,例如水、缓冲水、0.8%盐水、0.3%甘氨酸、透明质酸等。这些组合物可以通过常规的熟知的灭菌技术灭菌,或者可以无菌过滤。所得水溶液可以包装使用或者经冻干,冻干制剂在施用前与无菌溶液混合。
组合物可含有接近生理条件所需的药学上可接受的辅助物质,例如ph调节剂和缓冲剂、张力调节剂、润湿剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙、单月桂酸山梨醇酐酯、油酸三乙醇胺等。该组合物还可含有其它药学上可接受的赋形剂,包括例如氧化铝、硬脂酸铝、卵磷脂、血清蛋白如人血清白蛋白、磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、纤维素基物质、聚乙烯乙二醇、羧甲基纤维素钠、聚丙烯酸酯、聚乙烯-聚氧丙烯聚苯乙烯嵌段聚合物和聚乙二醇。
在某些实施方案中,通过本文所述的纯化方法获得的药物组合物包含rc7、磷酸钠、柠檬酸钠、氯化钠、精氨酸、糖(例如蔗糖)和表面活性剂(例如聚山梨醇酯)。
在某些实施方案中,通过本文所述的纯化方法获得的药物组合物包含不超过2000ng宿主细胞蛋白每mgrc7,优选不超过1000ng/mg,更优选不超过600ng/mg。
在某些实施方案中,通过本文所述的纯化方法获得的药物组合物含有不超过42pg宿主细胞dna每mgrc7,优选不超过25pg/mg,更优选不超过15pg/mg。
在某些实施方案中,通过本文所述的纯化方法获得的药物组合物含有不超过1.0eu/mg内毒素每mgrc7,优选不超过0.70eu/mg,更优选不超过0.50eu/mg。
相对于病毒而言,药物组合物也具有高纯度。本文描述的方法生产显著的病毒log10减少值(lrv)。例如,对于异种小鼠白血病病毒和猪细小病毒,该方法分别递送lrv>18和lrv>4。
通过参考以下实施例将更全面地理解本公开。
实施例
实施例1:上游加工
通过20次澄清收获,通过超滤/渗滤(uf/df)进行10次捕获,成功完成第一次和第二次运行,以生产未纯化的大体积(upb)。通过切向流过滤(tff)进行uf/df。总共2241l的upb(其包含来自第一次运行的102.9克rc7)以及1052l的upb(其包含来自第二次运行的92.1克rc7)得以生产而用于下游加工,对于澄清而言代表70%的平均产率,以及对于捕获方法而言代表60%的平均产率。
用种子培养物接种2000l生产型生物反应器。接种后,以分批阶段、无灌注培养rc7生产型生物反应器培养物(1500l工作体积)。在分批阶段结束时,开始灌注生长阶段,然后是生产阶段(连续20天)和每日收获物收集。对于每次运行,每天对每个单独的收获池(pool)进行澄清操作。
在uf/df捕获之前,澄清收获物以去除细胞、细胞碎片并减少生物负载以及其它颗粒。将来自生物反应器的未加工大体积收集在夹套袋(jacketedtote)内的3000l袋中。收获物收集完成后,未澄清的收获物保持在2-8℃。每天使用澄清列(train)将各收获物澄清作为一批,澄清列包括millipored0hcpod深度过滤器、milliporede50pod深度过滤器、sartoriussartopuregf加0.65μm深度过滤器、sartoriussartoguardpes标称1.2/0.2μm膜过滤器和sartoriussartoporepesplatinum0.45/0.2μm灭菌级过滤器。
然后通过超滤(uf)接着进行渗滤(df)浓缩澄清的收获物,并进一步浓缩以产生未纯化的大量液体用于下游纯化。使用由再生纤维素(sartorius-stedim)组成的uf膜进行uf/df步骤。uf膜包含在具有eco筛网(screen)通道设计的tffhydrosart盒中(100kdamwcohydrosarteco)。uf/df步骤去除低分子组分,降低澄清收获物中存在的宿主细胞蛋白水平,减少澄清收获物的体积并实现所需的upbph和电导率。每个uf/df捕获操作结合了两个连续的澄清收获池。因此,在20次澄清收获中,共进行了10次捕获运行。由膜截留的材料称为截留物。在该系统中,意外地发现rc7浓缩在与膜相邻的层中而不是收集在截留物中。因此,初始截留物从系统中排出。通过加入0.02mtris、0.15mnacl、0.1ml-精氨酸、0.01%tritonx-100ph8.0将该层中的rc7重新溶解,并在整个系统中再循环以获得包含rc7的第二截留物。
使用相同的溶液(0.02mtris、0.15mnacl、0.1ml-精氨酸、0.01%tritonx-100,ph8.0)对第二截留物中的rc7进行渗滤,并且通过100kda膜截留rc7。然后将渗滤的产物浓缩至75l未纯化大体积(upb)的目标体积。通过转移到混合站从系统中回收浓缩和渗滤的收获物。接下来,再次使用相同的缓冲溶液进行系统冲洗(目标添加35l)以从系统中回收残余产物,然后用于将更浓缩的产物稀释至约105l的最终目标。将稀释的产物混合并通过0.45/0.2μm过滤器过滤,并装入20l生物方法袋中至体积为7-11l。将填充的袋在-20±5℃的冰箱中储存少于5天,然后在-50±5℃下长期储存直至下游加工。
在两次运行之间,总共捕获含有195克rc7的3292.3lupb,代表澄清步骤的平均回收产率约为70%、捕获(uf/df)步骤约为60%。相比之下,我们之前内部上游加工中捕获(uf/df)步骤的rc7回收率(其中rc7收集在初始截留物中)仅为约24%。因此,当前捕获步骤在rc7的商业规模生产期间提供了rc7回收的重要改进,导致产率和成本节省的显著增加。澄清和uf/df捕获(上游方法)的总rc7生产总结在表1和图4中。
表1:rc7滴度结果和总upb生产
最后,作为upb质量的量度,将rc7与宿主细胞蛋白(hcp)的比率评估为纯度的简单量度。图5总结了两次运行的rc7:hcp比率,显示了早期和晚期收获的rc7:hcp值更高。
实施例2:下游加工
图6中显示了rc7纯化方法的一般示意图。将来自实施例1的未纯化大体积(upb)解冻,合并至目标captocore700(gehealthcarelifesciences)指定的负载。预期目标captocore700(gehealthcarelifesciences)负载为每l树脂1.0grc7(假设upb过滤和uv-c操作的滴度产率为100%)。负载细节详见下表2。
表2upb合并以及captocore柱负载
将合并的upb通过0.45和0.2μm过滤器进行过滤以去除颗粒并减少用于下游加工的制剂中的生物负载。使用uvivatec(sartorius)系统对经过滤的upb进行紫外线c辐射。合并灭活病毒的upb并通过0.2μm过滤器进行过滤。
用于纯化方法的第一下游柱步骤是混合模式树脂,例如流过模式的captocore700(gehealthcarelifesciences)柱。当rc7流过时,杂质与树脂结合。用于柱平衡和洗涤的溶液包含0.02mtris、0.15mnacl、0.1ml-精氨酸和0.01%triton-x。
在室温下用1%tritonx-100对来自captocore700(gehealthcaresciences)的流过物处理3至24小时,以靶向包膜病毒颗粒并生产病毒灭活(vi)池。
第二色谱步骤是阳离子交换色谱步骤。在该步骤中使用磺丙基(sp)sepharosefastflow(gehealthcaresciences)树脂。通过加入6m尿素稀释vi池至最终目标浓度为2m。然后使用1m乙酸将该池进一步调节至ph4.8,并在加载到sp树脂上之前用0.45和0.2μm过滤器过滤。平衡sp柱,并用包含0.066ml-精氨酸、0.1mnacl、2m尿素和0.02m乙酸盐(酯)的溶液洗涤。以结合和洗脱模式操作sp柱,其中rc7与阳离子交换色谱树脂结合。加载、洗涤和洗脱均以恒定流速进行。用含有0.066ml-精氨酸、0.22mnacl、2m尿素和0.02m乙酸盐(酯)的溶液从柱上洗脱rc7。没有进行洗脱池的分馏。
在sp色谱步骤之后,使用1mtris碱将sp洗脱池调节至ph8.0。然后用1mmgcl2进一步调节池至终浓度为2mm。然后将中间体进行0.45/0.2μm过滤并加热至30℃。加入benzonasetm(emdmillipore)内切核酸酶以开始dna消化反应,并将反应混合物保持16-20小时。
第三色谱步骤是疏水相互作用柱。按照流过模式使用toyopearlppg600m(tosohbiosciences)树脂。将benzonasetm处理的池冷却至18℃,然后使用1mmes酸调节至ph6.0。然后加入5mnacl至终浓度为1.5m并通过0.45/0.2μm过滤器过滤,然后加载到ppg柱上。杂质与树脂结合,而rc7在ph6.0下在0.02mmes、1.5mnacl中流过柱子。在负载开始后在0.4cv开始流过物收集,并在1.5cv洗涤后结束。
用0.75ml-精氨酸、hcl调节收集的ft/w池至终浓度0.1m,并通过0.45/0.2μm过滤器过滤,然后通过planova-n35纳米过滤器(asahikaeimedical,日本)从工序流(processstream)中去除表面上大于35nm的病毒样颗粒。
最终制剂和浓缩步骤是uf/df步骤。将过滤过病毒的池加载到4m2tff系统上,浓缩至0.2mg/ml,并使用biomaxpellicon2100kdauf/df膜(emdmillipore)用6-8倍透析体积的0.07mnacl、0.005m柠檬酸盐、0.01m磷酸钠、0.1ml-精氨酸和0.05m蔗糖进行渗滤。完成渗滤后,通过排出和系统冲洗回收材料,然后合并。然后使用2.5m2tff系统将合并的产物进一步浓缩至1.4mg/ml。
从20%储备溶液中加入聚山梨醇酯80至终浓度为0.05%。将得到的rc7池通过0.5/0.2μm过滤器过滤,然后分散至1l瓶中至目标填充体积为300ml,并储存在-65至-85℃之间。
分别从ds-1和ds-2运行获得5.4和4.7克rc7,与upb中rc7的量相比,rc7回收率分别为21%和17%,总结于下表3中。相比之下,我们之前的内部下游纯化方法中的rc7回收率仅为约2%。因此,当前rc7下游纯化方法的回收率比我们之前内部方法的回收率高约10倍,提供了产率和成本节省的显著进步。
表3:下游rc7回收
通过该纯化方法回收的所得rc7也满足所有质量规格,包括纤连蛋白结合和纯度要求,如下表4中所总结的。
表4:rc7纯度
在权利要求中使用诸如“第一”、“第二”、“第三”等的序数术语来修饰权利要求要素,本身并不意味着一个权利要求要素的优先性、位次或顺序优于另一个要素,或者方法行为按照时间顺序进行,而仅标注以将具有特定名称的一个权利要求元素区别于另一个具有相同名称的元素(但用于使用序数术语),以区分权利要求要素。
除非另有说明,否则说明书和权利要求书中使用的所有数字应理解为在所有情况下均由术语“约”修饰,无论是否如此陈述。还应该理解,说明书和权利要求中使用的精确数值形成本公开的额外的实施方案,任何指定的端点内的所有范围和子范围也是如此。另外,应注意,在公开步骤的情况下,除非明确说明,否则不需要以该顺序执行步骤。
考虑到本公开的说明书和实践,其它实施方案对于本领域技术人员将是显而易见的。
参考文献
1.burgesonr.e.,chapter4c.typeviicollageninextracellularmatrixapracticalapproach,haralsonm.a.andhassellj.r.eds.,oxforduniversitypress,1995。
2.chenm.etal,j.biol.chem.277(2002)2118-2124。
- 还没有人留言评论。精彩留言会获得点赞!