7‑位取代的汉防己乙素衍生物、及其制备方法和应用与流程
7-位取代的汉防己乙素衍生物、及其制备方法和应用技术领域本发明属于天然药物及药物化学领域,并涉及新型汉防己乙素衍生物,特别是7-位取代的汉防己乙素衍生物,及制备这些化合物的方法、包含该化合物的组合物及其在制备抗肿瘤药物中的用途。
背景技术:
汉防己乙素(Fangchinoline,FAN),别名防己诺林碱,是从中药材粉防己根中提取而来的双苄基异喹啉生物碱。天然存在于防己科植物粉防己(StephaniatetrandraS.Moore)的根,盾状轮环藤(CycleapeltataDiels)的根及唐松草人字果的根和根茎中。汉防己乙素是一种天然的钙拮抗剂,对多种疾病有显著的治疗效果,如具有广谱消炎抗菌作用,抗高血压、糖尿病、肝纤维化,对脑细胞具有保护作用。近年来的研究发现它还有明显的抗肿瘤作用,如对W-256,艾氏腹水癌,S-45均有显著的抑制作用,对KB细胞和Hela细胞也有抑制作用,对人体移植性肝癌7402和7405细胞株呈较强的抑制作用。有研究报道了汉防己乙素对人类结肠癌细胞系LoVo的抑制作用。实验对荷瘤裸鼠连续给药60天,结果显示,用药组与对照组相比,肿瘤明显缩小,生长减慢,微血管密度明显低于对照组。且用药期间,小鼠未出现不良反应。说明汉防己乙素具有体内抑制肿瘤的作用,而且副作用很小。(王振军等,防己诺林碱在抑制血管生成药物中的应用[P].CN1511528A.2004.)ChangdongWang等人研究了汉防己乙素对人前列腺癌细胞PC3的抑制作用。研究结果显示,汉防己乙素对PC3细胞的抑制作用呈剂量和时间依赖性。对细胞周期进程研究表明,汉防己乙素对PC3细胞的抑制作用与G1/S期细胞的增加有关。此外,汉防己乙素具有体内抗肿瘤的活性,缩小肿瘤体积和促进凋亡,以及对裸鼠移植瘤PC3的抑制作用。(ChangdongWang,etal.FangchinolineinducedG1/Sarrestbymodulatingexpressionofp27,PCNA,andcyclinDinhumanprostatecarcinomacancerPC3cellsandtumorxenograft[J].Biosci.Biotechnol.Biochem.2010,74(3):488-493.)唐亚林等人研究了将G-四链体DNA与汉防己乙素结合,增加G-四链体的稳定性,从而减弱细胞的增殖能力,促进细胞凋亡。体外抗癌细胞增殖实验结果表明,G-四链体DNA与汉防己乙素结合后,对于人白血病细胞系HL-60,人胃癌细胞系BGC-823,人肝癌细胞系Bel-7402以及人鼻咽癌细胞系KB均有比较好的抑制效果。(唐亚林等,双苄基异喹啉类生物碱的新用途[P].CN101371839A.2009.)目前,汉防己乙素的结构修饰及活性报道甚少,近年来有王锋鹏等人对汉防己乙素进行了结构修饰研究,但尚未见有相关的药效活性数据报道(王锋鹏等,双苄基异喹啉类生物碱及其制备方法和药物组合物[P].CN1293196A.2001.)。本发明对汉防己乙素7-位羟基进行结构修饰和抗肿瘤活性的测定,发现部分新化合物的抗肿瘤活性有明显的提高。
技术实现要素:
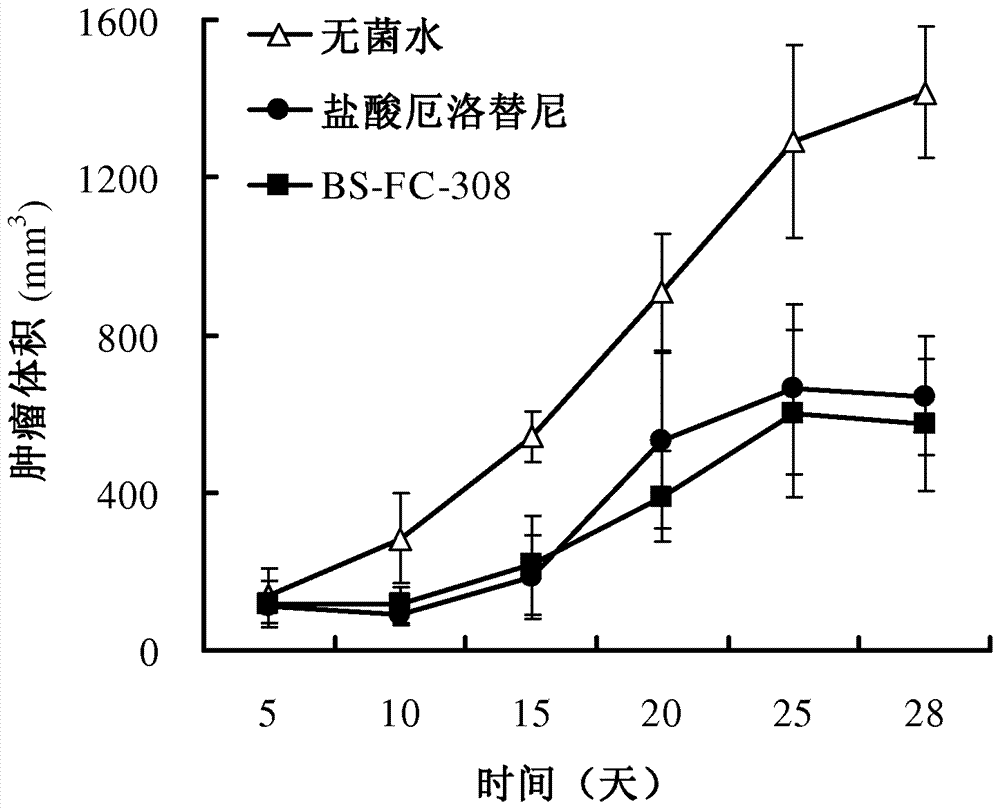
本发明的目的之一是提供特别是通式(I)的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,其中,W为-OCHR1-、-OSO2-、-OC(O)-;Z选自氢、任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基、R2R3NCH2CH(OH)-、或者Z与R1以及它们连接的碳原子一起形成任选由取代基取代的C3-C7环烷基;R1为氢或与Z以及它们连接的碳原子一起形成任选由取代基取代的C3-C7环烷基;R2和R3独立地为氢,任选地由羟基、C1-C6烷基氧基、卤素、C3-C7环烷基或环烯基、芳基或杂芳基取代的C1-C6烷基,C2-C6烯基,或者R2和R3以及它们所连接的氮原子一起形成3-7元含氮杂环;所述含氮杂环任选地含有选自氧、硫和氮的另外的杂原子,且任选地被取代基取代;其中,所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基;对于所述芳基、杂芳基、C3-C7环烷基或环烯基、杂环基和含氮杂环基而言所述取代基还选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基;其中,当W为-OCH2-时,Z不为乙基、正丙基或异丙基;当W为-OC(O)-时,Z不为乙基或丙基。本发明的目的之二是提供制备本发明通式(I)7-位取代的汉防己乙素衍生物的方法:式(I-1)的7-位取代汉防己乙素衍生物由汉防己乙素(FAN)与相应的烷基或芳香族磺酰氯(R1’SO2Cl)在有碱的存在下,于室温下反应生成,其中R1’选自氢、任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基,所述取代基如权利要求1所定义;式(I-2)的7-位取代汉防己乙素衍生物由汉防己乙素(FAN)先与强碱反应,再与相应的卤代烃(R2’X)在有碱的存在下,于室温或加热条件下反应生成,其中R2’为-CHR1Z,R1和Z如权利要求1中所定义,但Z不为R2R3NCH2CH(OH)-;式(I-3)的7-位取代汉防己乙素衍生物由汉防己乙素(FAN)与相应的有机酸(R3’CO2H)在有缩合剂和碱的存在下,于室温下反应生成,其中R3’为任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基,所述取代基如权利要求1所定义;式(I-4)的7-位取代汉防己乙素衍生物可由两步反应制取:先由汉防己乙素与叔丁醇钾和氯甲基环氧丙烷反应生成中间体,再由此中间体与相应的有机胺反应即得产物,其中R4’和R5’如权利要求1中对R2和R3的定义。本发明的目的之三是提供包含本发明化合物的药物组合物,所述药物组合物包括至少一种本发明化合物,和任选的药学上可以接受的赋形剂。本发明的目的之四是提供本发明化合物或包含该化合物的药物组合物在制备药物、特别是抗肿瘤药物中的用途。相应地,本发明提供一种治疗肿瘤患者的方法,包括给予需要治疗的患者治疗有效量的至少一种本发明的化合物。所述肿瘤特别选自白血病、多发性骨髓瘤、淋巴瘤、肝癌、胃癌、乳腺癌、胆管细胞癌、胰腺癌、肺癌、大肠癌、骨肉瘤、黑色素瘤、人宫颈癌、神经胶质瘤、鼻咽癌、喉癌、食管癌、中耳肿瘤、前列腺癌等。本发明还涉及用于治疗肿瘤的本发明的化合物。附图简要说明图1是BS-FC-308对裸鼠体重影响的动态曲线;图2是BS-FC-308对裸鼠HepG2移植瘤体积影响的动态曲线;图3显示BS-FC-308对裸鼠HepG2移植瘤大小的影响;图4显示BS-FC-308对裸鼠HepG2移植瘤重量的影响;图5显示BS-FC-308对裸鼠HepG2移植瘤的抑制作用;图6是BS-FC-308对裸鼠体重影响的动态曲线;图7是BS-FC-308对裸鼠KCL-22M移植瘤体积影响的动态曲线;图8显示BS-FC-308对裸鼠KCL-22M移植瘤大小的影响;图9显示BS-FC-308对裸鼠KCL-22M移植瘤重量的影响;图10显示BS-FC-308对裸鼠KCL-22M移植瘤的抑制作用。具体实施方式本发明涉及一类具有抗肿瘤活性的新型汉防己乙素衍生物,特别是通式(I)的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,其中,W为-OCHR1-、-OSO2-、-OC(O)-;Z选自氢、任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基、R2R3NCH2CH(OH)-、或者Z与R1以及它们连接的碳原子一起形成任选由取代基取代的C3-C7环烷基;R1为氢或与Z以及它们连接的碳原子一起形成任选由取代基取代的C3-C7环烷基;R2和R3独立地为氢,任选地由羟基、C1-C6烷基氧基、卤素、C3-C7环烷基或环烯基、芳基或杂芳基取代的C1-C6烷基,C2-C6烯基,或者R2和R3以及它们所连接的氮原子一起形成3-7元含氮杂环;所述含氮杂环任选地含有选自氧、硫和氮的另外的杂原子,且任选地被取代基取代;其中,所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基;对于所述芳基、杂芳基、C3-C7环烷基或环烯基、杂环基和含氮杂环基而言所述取代基还选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基;其中,当W为-OCH2-时,Z不为乙基、正丙基或异丙基;当W为-OC(O)-时,Z不为乙基或丙基。当W为-OSO2-时,本发明式(I)化合物相当于式(I-1)其中Z=R1’,选自氢、任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基,所述取代基如上述式(I)中所定义。当W为W为-OCHR1-,R1和Z如上述式(I)中所定义,但Z不为R2R3NCH2CH(OH)-时,本发明的式(I)化合物为式(I-2),其中R2’为-CHR1Z。当W为-OC(O)-时,本发明式(I)化合物相当于式(I-3),其中R3’=Z,为任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基,所述取代基如上述式(I)中所定义当W为-OCH2-,Z为R2R3NCH2CH(OH)-时,本发明式(I)化合物为式(I-4),其中R4’和R5’如上述式(I)中对R2和R3的定义。根据第一种实施方案,本发明涉及式(I)的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,其中W为-OSO2-;Z选自氢、任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基;其中所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基;对于所述芳基、杂芳基、C3-C7环烷基或环烯基、杂环基而言所述取代基还选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基。上述实施方案中,优选其中Z选自任选由取代基取代的C1-C6烷基、任选由取代基取代的芳基或杂芳基;其中所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基;对于所述芳基、杂芳基而言所述取代基还选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基。上述实施方案中,更优选其中Z选自任选由取代基取代的C1-C6烷基、任选由取代基取代的苯基;其中所述取代基选自卤素、C1-C6烷氧基和C1-C6卤代烷氧基;所述苯基还可以被选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基的取代基取代。上述实施方案中,最优选其中Z为任选由C1-C6烷基取代的苯基。在第二种实施方案中,本发明涉及式(I)的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,其中W为-OCH2-;Z选自任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基、R2R3NCH2CH(OH)-;R2和R3独立地为氢,任选地由羟基、C1-C6烷基氧基、卤素、C3-C7环烷基或环烯基、芳基或杂芳基取代的C1-C6烷基,C2-C6烯基,或者R2和R3以及它们所连接的氮原子一起形成3-7元含氮杂环;所述含氮杂环任选地含有选自氧、硫和氮的另外的杂原子,且任选地被取代基取代;其中,所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基;对于所述芳基、杂芳基、C3-C7环烷基或环烯基、杂环基和含氮杂环基而言所述取代基还选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基。上述实施方案中,优选其中Z选自任选由取代基取代的芳基或杂芳基;所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基、C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基。上述实施方案中,更优选其中Z选自任选由卤素、C1-C6烷基、C1-C6卤代烷基、C1-C6烷氧基、羟基C1-C6烷基和C1-C6卤代烷氧基的取代基取代的苯基。在第二种实施方案中,优选其中Z为R2R3NCH2CH(OH)-;R2和R3独立地为氢,任选地由羟基、C1-C6烷基氧基、卤素、C3-C7环烷基或环烯基、芳基或杂芳基取代的C1-C6烷基,C2-C6烯基,或者R2和R3以及它们所连接的氮原子一起形成3-7元含氮杂环;所述含氮杂环任选地含有选自氧、硫和氮的另外的杂原子,且任选地被取代基取代;其中,所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基、C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基。在上述优选实施方案中,优选其中所述含氮杂环为哌啶子基、哌嗪基、吗啉基、噻嗪基、吡咯烷基、噁唑烷基或噻唑烷基,任选地所述基团由选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基、C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基的基团取代;更优选其中所述含氮杂环为任选由C1-C6烷基取代的哌啶子基、C1-C6烷基取代的噻嗪基、任选N-氰基取代的哌嗪基。在上述优选实施方案中,优选其中所述R2和R3独立地为氢、甲基、乙基、羟乙基、环丙基甲基、烯丙基、甲氧基丙基、呋喃甲基。在上述第二实施方案中,优选其中Z为C2-C6烯基或C3-C7环烷基或环烯基,更优选Z为乙烯基、1-甲基乙烯基或环丙基。在第三种实施方案中,本发明涉及式(I)的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,其中W为-OCHR1-,Z与R1以及它们连接的碳原子一起形成任选由取代基取代的C3-C7环烷基,其中所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基、C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基。优选,所述Z与R1以及它们连接的碳原子一起形成环戊基或环己基。在第四种实施方案中,本发明涉及式(I)的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,其中,W为-OC(O)-;Z选自任选由取代基取代的C1-C6烷基、任选由取代基取代的C2-C6烯基、任选由取代基取代的C3-C7环烷基或环烯基、任选由取代基取代的杂环基、任选由取代基取代的芳基或杂芳基;其中所述取代基选自卤素、氨基、C1-C6烷基氨基、二(C1-C6烷基)氨基、硝基、氰基、羟基、C1-C6烷氧基、C1-C6卤代烷氧基、巯基、C1-C6烷硫基;对于所述芳基、杂芳基、C3-C7环烷基或环烯基和杂环基而言所述取代基还选自C1-C6烷基、羟基C1-C6烷基和C1-C6卤代烷基在上述第四种实施方案中,优选其中Z为苯基、吡啶基、哒嗪基,各自任选地被选自甲基、乙基、异丙基、氨基、甲基氨基、二甲氨基、二乙基氨基、甲氧基、三氟甲氧基、卤素的取代基所取代。本发明的部分7-位取代的汉防己乙素衍生物如下所示。经测定发现,它们具有优于或至少与汉防己乙素相当的抗肿瘤活性。这些实施例举只对本发明做进一步说明,并不对本发明的范围构成任何限制。上面所列化合物的部分数据如下表所示:本发明特别优选如下的化合物:BS-FC-102、BS-FC-104、BS-FC-204、BS-FC-207、BS-FC-208、BS-FC-213、BS-FC-216、BS-FC-220、BS-FC-221、BS-FC-304、BS-FC-308、BS-FC-311、BS-FC-315、BS-FC-403、BS-FC-405、BS-FC-409、BS-FC-410、BS-FC-417、BS-FC-421。发现它们至少对于一种肿瘤的抗肿瘤活性显著优于未修饰的汉防己乙素。本发明最优选以下化合物,它们具有优良的、全面超越汉防己乙素的抗肿瘤活性。本发明涉及以下形式的本发明的式(I)化合物:它们的盐、溶剂化物、水合物、加成物、复合物、多晶型物或前药。如本文所使用,术语“烷基”是指含有指定碳原子数的直链或支链的烷基。所述烷基可以包含1-6个、1-5个、1-4个或1-3个碳原子。烷基的例子包括但不限于甲基、乙基、正丙基、异丙基、叔丁基、正戊基和正己基。术语“烯基”是指含有指定碳原子数的直链或支链的烯基。所述烯基可以包含2-6个、2-5个、2-4个或2-3个碳原子。烯基的例子包括但不限于乙烯基、烯丙基、丁烯基、异丁烯基。术语“炔基”是指含有指定碳原子数的直链或支链的炔基。所述炔基可以包含2-6个、2-5个、2-4个或2-3个碳原子。炔基的例子包括但不限于乙炔基和丙炔基。术语“C3-C7环烷基或环烯基”是指具有饱和或不饱和环的3-7元单环系统的烃基。C3-C7环烷基或环烯基可以为环丙基、环丁基、环戊基、环己基、环庚基、环丙烯基和环己烯基。术语“芳基”是指含有6-14个(例如6-12个、6-20个)碳原子的单碳环芳香基或稠合或非稠合的多碳环芳香基,在多碳环的情况下,只要一个碳环是芳香的即可。芳基也包括与杂环基稠合的芳基。所述芳基的例子有苯基、联苯基、萘基、5,6,7,8-四氢萘基、2.3-二氢苯并呋喃基等。术语“杂芳基”是指在环中含有1-4个杂原子(例如1、2、3或4个杂原子)作为环成员的芳香环基团。杂原子是指氮、氧或硫。杂芳基可以是具有5-7个环原子的单环杂芳基,或者具有7-11个环原子的双环杂芳基。所述双环芳基中只要一个环是芳香杂环即可,另一个可以是芳香的或非芳香的、含杂原子的或不含杂原子的。杂芳基的例子有例如吡咯基、吡唑基、咪唑基、噁唑基、吡啶基、嘧啶基、呋喃基、噻吩基、异噁唑基、吲哚基等。术语“杂环基”是指含有1-4个杂原子(例如1、2、3或4个杂原子)作为环成员的非芳香环基团。杂原子是指氮、氧或硫。杂环基可以是具有4-8个环原子的单环杂环基(例如4-7元环、5-7元环、5-6元环),或者具有7-11个环原子的双环杂环基。杂环基可以是芳香或非芳香的。杂环基的例子有氮杂环丁基、吡咯烷基、吡咯啉基、四氢呋喃基、二氢呋喃基、哌嗪基、哌啶基、吗啉基、硫代吗啉基、四氢吡喃基、四氢噻吩基等。术语“含氮杂环基”指至少一个环原子为氮原子的如上所定义的杂环基。术语“卤素”是指氟、氯、溴或碘。术语“烷基氨基”是指被一个或两个如上所定义的烷基取代的氨基。术语“烷氧基”包括烷基-O-基团,其中所述烷基如上所定义。术语“烷硫基”烷基-S-基团,其中所述烷基如上所定义。术语“式(I)化合物的药学上可以接受的加合物和复合物”是指本发明的化合物进一步与其他小分子或生物大分子以非化学键或者非共价分子间力结合的产物。如本文所使用,术语“式(I)化合物的药学上可以接受的盐”的例子是由形成药学上可以接受的阴离子的有机酸形成的有机酸盐;这些有机酸盐包括但不限于甲苯磺酸盐、甲磺酸盐、苹果酸盐、醋酸盐、柠檬酸盐、丙二酸盐、酒石酸盐、琥珀酸盐、苯甲酸盐、抗坏血酸盐、α-酮戊二酸盐和α-甘油磷酸盐;也可形成合适的无机盐;这些无机酸盐包括但不限于盐酸盐、硫酸盐、硝酸盐、碳酸氢盐和碳酸盐、磷酸盐、氢溴酸盐、氢碘酸盐等。药学上可以接受的盐可使用本领域熟知的标准程序获得。例如,通过将足量的碱性化合物和提供药学上可以接受的阴离子的合适的酸反应生成。如本文所使用,术语“多晶型物”是指本发明的化合物或其复合物的固体晶体形式。相同化合物的不同的多晶型物可以显示不同的物理、化学和/或光谱性质。不同的物理性质包括但不限于稳定性(例如,对热或光)、可压缩性和密度(对于配制制剂和产品生产是重要的)和溶解速率(其可以影响生物吸收度和利用度)。稳定性的不同会造成化学反应性(例如差异氧化,使得当由一种多晶型物构成时比由另一多晶型物构成时剂型更快地褪色)或机械性能(例如,储存时作为动力学有利的多晶型物的片剂碎末转化成热力学更加稳定的多晶型物)或两者(例如,一种多晶型物的片剂在高潮湿度时更加容易破碎)中的变化。多晶型物的不同的物理性质可以影响它们的加工。例如,一种多晶型物可能比另一种更可能形成溶剂化物或可能比另一种更加难以过滤或洗去杂质,这是由于例如其颗粒的形状或大小分布不同的缘故。如本文所使用,术语“水合物”是指本发明的化合物或其盐,其进一步包含通过非共价分子间力结合的化学计量的或非化学计量的水。如本文所使用,除非另外说明,术语“前药”是指可以在生物学条件(体外或体内)下水解、氧化或进行其他反应以提供本发明的化合物的衍生物。前药仅在生物学条件下经过该反应成为活性化合物,或者它们在它们不反应的形式中具有活性。通常可以使用公知的方法制备前药,例如1Burger′sMedicinalChemistryandDrugDiscovery(1995)172-178,949-982(ManfredE.Wolffeditor,5thEd)和J.Rautio’sProdrugsandTargetedDelivery(2011)31-60(Wiley-VCH,MethodsandPrinciplesinMedicinalChemistry,Vol.47)和G.Thomas’sFundamentalsofMedicinalChemistry(2003)195-200(Wiley)中描述的那些方法。本发明化合物中7-位取代的汉防己乙素衍生物的两个手性中心具有式(I)结构式所显示的立体化学结构。本文使用的立体化学的定义和约定一般遵循MCGRAW-HILLDICTIONARYOFCHEMICALTERMS(S.P.Parker,Ed.,McGraw-HillBookCompany,NewYork,1984);ELIEL,E.和WILEN,S.,STEREOCHEMISTRYOFORGANICCOMPOUNDS(JohnWiley&Sons,Inc.,NewYork,1994)。许多有机化合物以光学活性形式存在,即它们具有旋转平面偏光的平面的能力。本文所述“抗肿瘤活性”是指对肿瘤细胞或组织的直接抑制或杀伤作用。本申请实施例部分测定了本发明化合物的抗肿瘤活性。本文使用的术语“治疗”一般是指获得需要的药理和/或生理效应。该效应根据完全或部分地预防疾病或其症状,可以是预防性的;和/或根据部分或完全稳定或治愈疾病和/或由于疾病产生的副作用,可以是治疗性的。本文使用的“治疗”涵盖了对患者疾病的任何治疗,包括:(a)预防易感染疾病或症状但还没诊断出患病的患者所发生的疾病或症状;(b)抑制疾病的症状,即阻止其发展;或(c)缓解疾病的症状,即,导致疾病或症状退化。本发明的化合物可以按照常规的有机化学合成方法制备。例如,本发明的式(I)7-位取代的汉防己乙素衍生物的制备方法如下:式(I:I-1)的7-位取代汉防己乙素衍生物可由汉防己乙素(FAN)与相应的烷基或芳香族磺酰氯(R1’SO2Cl)在有碱的存在下,于室温下反应生成。上述反应使用的碱可以是有机碱或无机碱。例如:三乙胺,二异丙基乙胺,氢氧化钠等。有机磺酰氯可以是商购的反应原料,也可使用有机磺酸自己制备。上述反应一般在溶剂中进行。反应的溶剂包括但不限于二氯甲烷,乙氰,N,N-二甲基甲酰胺,四氢呋喃等。式(I:I-2)的7-位取代汉防己乙素衍生物可由汉防己乙素(FAN)先与强碱反应,再与相应的卤代烃(R2’X)在有碱的存在下反应生成。上述反应使用的碱包括但不限于有机碱。例如:叔丁醇钾,乙醇钠,乙醇钾。氯代烃可以是商购的反应原料。上述反应的温度取决于氯代烃的反应活性,可以是室温或加热条件,如30-80℃.上述反应一般在溶剂中进行。反应的溶剂包括但不限于二甲亚砜,乙氰,N,N-二甲基甲酰胺,四氢呋喃。式(I:I-3)的7-位取代汉防己乙素衍生物可由汉防己乙素(FAN)再与相应的有机酸(R3’CO2H)在有缩合剂和碱的存在下,于室温下反应生成。上述反应使用的碱包括但不限于有机碱。例如:三乙胺,二异丙基乙基胺,二甲基胺基吡啶。有机酸可以是商购的反应原料。有机酰氯也可用于此反应。上述反应的温度取决于有机酸的反应活性,可以是室温或加热条件,如30-60℃.上述反应一般在有缩合剂存在下进行。这里缩合剂可以是但不限于有机缩合剂。例如:二异丙基碳二亚胺,二环己基碳二亚胺等。酯化反应一般在溶剂中进行,也可在无溶剂存在下进行。使用的溶剂包括但不限于有机极性溶剂。例如:二氯甲烷(DCM),四氢呋喃(THF),N,N-二甲基甲酰胺(DMF),二甲亚砜(DMSO)等。式(I:I-4)的7-位取代汉防己乙素衍生物可由两步反应制取:(1)将汉防己乙素与叔丁醇钾在低温下反应,而后将氯甲基环氧丙烷在冰浴温度下滴加,反应30分钟至2小时。经萃取分离得到取代的的中间体。(2)此中间体与相应的有机胺反应即得产物。胺化反应的温度取决于有机胺的反应活性。一般需要加热,如80-120℃.胺化反应一般在极性溶剂中进行。使用的溶剂包括但不限于乙醇,四氢呋喃(THF),N,N-二甲基甲酰胺(DMF),二甲亚砜(DMSO)等。式(I:I-1,I-2,I-3,I-4)中R1,R2,R3和R4与上文在通式(I)中的定义相同.上述反应的原料:有机酸、有机胺、有机磺酰氯、有机酰氯全部可以在市场上购买获得。汉防己乙素原料由天然产物提取分离得到,也可从市场购买获得。常规的化学转换可用于实施本发明。本领域的技术人员可以决定用于这些化学转换的适当的化学试剂、溶剂、保护基和反应条件。相关信息描述于R.Larock,ComprehensiveOrganicTransformations,VCHPublishers(1989);T.W.GreeneandP.G.M.Wuts,ProtectiveGroupsinOrganicSynthesis,3rdEd,JohnWileyandSons(1999);L.FieserandM.Fieser,FieserandFieser’sReagentsforOrganicSynthesis,JohnWileyandSons(1994);L.A.Paquetteeditor,EncyclopediaofReagentsforOrganicSynthesis,JohnWileyandSons(1995)及其后来的版本。保护基指那些一旦连接活性部分(例如,羟基或氨基),防止这些部分被后来的反应干扰并可在反应后通过常规的方法去除的基团。羟基保护基的例子包括但不限于,烷基、苯甲基、烯丙基、三苯甲基(即,三苯基甲基)、酰基(例如,苯甲酰基、乙酰基或HOOC-X”-CO-,X”为亚烷基、亚链烯基、亚环烷基或亚芳基)、甲硅烷基(例如,三甲基硅烷基、三乙基硅烷基和叔丁基二甲基硅烷基)、烷氧基羰基、氨基羰基(例如,二甲基氨基羰基、甲基乙氨基羰基和苯基氨基羰基)、烷氧甲基、苯甲氧甲基和烷基巯甲基。氨基保护基的例子包括但不限于,烷氧基羰基、烷酰基、芳氧基羰基、芳基取代的烷基等。羟基和氨基保护基已在T.W.GreeneandP.G..M.Wuts,ProtectiveGroupsinOrganicSynthesis,2ndEdition,JohnWileyandSons(1991)中讨论。羟基和氨基保护基都可在反应后通过常规的方法去除。本发明还提供了包含本发明式I化合物的药物组合物。本发明提供了这样的药物组合物,其中包含至少一种如上所述的本发明的式I化合物,和任选的药学上可以接受的赋形剂。制备各种含有一定量的活性成分的药物组合物的方法是已知的,或根据本发明的公开内容对于本领域技术人员是显而易见的。如REMINGTON’SPHARMACEUTICALSCIENCES,Martin,E.W.,ed.,MackPublishingCompany,19thed.(1995)所述。制备所述药物组合物的方法包括掺入适当的药学赋形剂、载体、稀释剂等。以已知的方法制造本发明的药物制剂,包括常规的混合、溶解或冻干方法。本发明的化合物可以制成药物组合物,并向患者以适于选定的施用方式的各种途径施用,例如口服或肠胃外(通过静脉内、肌内、局部或皮下途径)。因此,本发明的化合物结合药学上可以接受的载体(如惰性稀释剂或可食用的载体)可以全身施用,例如,口服。它们可以封闭在硬或软壳的明胶胶囊中,可以压为片剂。对于口服治疗施用,活性化合物可以结合一种或多种赋形剂,并以可吞咽的片剂、颊含片剂、含片、胶囊剂、酏剂、悬浮剂、糖浆、圆片等的形式使用。这种组合物和制剂应该包含至少0.1%的活性化合物。这种组合物和制剂的比例当然可以变化,可以占给定的单位剂型重量的大约1%至大约99%。在这种治疗有用的组合物中,活性化合物的量使得能够获得有效剂量水平。片剂、含片、丸剂、胶囊剂等也可以包含:粘合剂,如黄蓍胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,如磷酸氢二钙;崩解剂,如玉米淀粉、马铃薯淀粉、藻酸等;润滑剂,如硬脂酸镁;和甜味剂,如蔗糖、果糖、乳糖或阿司帕坦;或调味剂,如薄荷、冬青油或樱桃香味。当单位剂型是胶囊时,除了上面类型的材料,它还可以包含液体载体,如植物油或聚乙二醇。各种其他材料可以存在,作为包衣,或以其他方式改变固体单位剂型的物理形式。例如,片剂、丸剂或胶囊剂可以用明胶、蜡、虫胶或糖等包衣。糖浆或酏剂可以包含活性化合物,蔗糖或果糖作为甜味剂,对羟苯甲酸甲酯或对羟苯甲酸丙酯作为防腐剂,染料和调味剂(如樱桃香料或桔子香料)。当然,用于制备任何单位剂型的任何材料应该是药学上可以接受的且以应用的量基本上无毒。此外,活性化合物可以掺入缓释制剂和缓释装置中。活性化合物也可以通过输注或注射到静脉内或腹膜内施用。可以制备活性化合物或其盐的水溶液,任选可混的无毒的表面活性剂。也可以制备在甘油、液体聚乙二醇、甘油三乙酸酯及其混合物以及油中的分散剂。在普通的储存和使用条件下,这些制剂包含防腐剂以防止微生物生长。适于注射或输注的药物剂型可以包括包含适于无菌的可注射或可输注的溶液或分散剂的即时制剂的活性成分(任选封装在脂质体中)的无菌水溶液或分散剂或无菌粉末。在所有情况下,最终的剂型在生产和储存条件下必须是无菌的、液体的和稳定的。液体载体可以是溶剂或液体分散介质,包括,例如水、乙醇、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)、植物油、无毒的甘油酯及其合适的混合物。可以维持合适的流动性,例如,通过脂质体的形成,通过在分散剂的情况下维持所需的粒子大小,或通过表面活性剂的使用。可以通过各种抗细菌剂和抗真菌剂(如对羟苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等)产生预防微生物的作用。在许多情况下,优选包括等渗剂,如糖、缓冲剂或氯化钠。通过使用延缓吸收剂的组合物(例如,单硬脂酸铝和明胶)可以产生可注射的组合物的延长吸收。通过将合适的溶剂中的需要量的活性化合物与需要的上面列举的各种其他成分结合,然后进行过滤灭菌,制备无菌可注射溶液。在用于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,这会产生活性成分加上任何另外需要的以前无菌过滤溶液中存在的成分的粉末。有用的固体载体包括粉碎的固体(如滑石、粘土、微晶纤维素、二氧化硅、氧化铝等)。有用的液体载体包括水、乙醇或乙二醇或水-乙醇/乙二醇混合物,本发明的化合物可以任选在无毒的表面活性剂的帮助下以有效含量溶解或分散在其中。可以加入佐剂(如香味)和另外的抗微生物剂来优化对于给定用途的性质。增稠剂(如合成的聚合物、脂肪酸、脂肪酸盐和酯、脂肪醇、改性纤维素或改性无机材料)也可和液体载体用于形成可涂覆的糊剂、凝胶、软膏、肥皂等,直接用于使用者的皮肤上。化合物或其活性盐或衍生物的治疗需要量,不仅取决于选择的特定的盐,而且取决于施药方式、待治疗的疾病的本质和患者的年龄和状态,最终取决于在场医师或临床医生的决定。上述制剂可以以单位剂型存在,该单位剂型是含有单位剂量的物理分散单元,适于向人体和其它哺乳动物体给药。单位剂型可以是胶囊或片剂,或是很多胶囊或片剂。根据所涉及的具体治疗,活性成分的单位剂量的量可以在大约0.1到大约1000毫克或更多之间进行变化或调整。本发明还提供本发明的化合物或包含该化合物的组合物在制备药物、特别是抗肿瘤药物中的用途。相应地,本发明提供一种治疗肿瘤患者的方法,包括给予需要治疗的患者治疗有效量的至少一种本发明的化合物。本发明的7-位取代的汉防己乙素衍生物或其药学上可接受的盐,例如可用于治疗白血病、多发性骨髓瘤、淋巴瘤、肝癌、胃癌、乳腺癌、胆管细胞癌、胰腺癌、肺癌、大肠癌、骨肉瘤、黑色素瘤、人宫颈癌、神经胶质瘤、鼻咽癌、喉癌、食管癌、中耳肿瘤、前列腺癌等肿瘤。在下列实施例中,将更加具体地解释本发明。但应理解,下列实施例旨在说明本发明而不对本发明的范围构成任何限制。以下实施例中所用的化学原料均为商购获得或通过本领域熟知的合成方法获得。实施例1:化合物(BS-FC-102)的合成式中,DIPEA:N,N-二异丙基乙胺向二氯甲烷(2mL)中加入汉防己乙素(120mg,0.2mmol),对甲苯磺酰氯(56mg,0.29mmol),随后加入N,N-二异丙基乙胺(51mg,0.39mmol),反应液加热升温至40℃,搅拌反应2小时,反应结束后,反应液经饱和食盐水洗,分离得到的有机相用无水硫酸钠干燥,旋干,得到的粗产物经制备薄层色谱(二氯甲烷∶甲醇=8∶1)分离纯化后得到亮黄色粉末状化合物BS-FC-102(73mg,收率49%)。LC-MS:保留时间:1.11min(95.24%);m/z763[M+H]+,382[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.23(s,3H,CH3),2.41(s,3H,N-CH3),2.90(s,3H,N-CH3),3.15(s,3H,OCH3),3.41(s,3H,OCH3),3.92(s,3H,12-OCH3),5.84(s,1H,8′-H),6.17(s,1H,5-H),6.28(d,1H,J=9Hz,11′-H),6.43(s,1H,H-苯环),6.59(s,1H,H-苯环),6.88(m,3H,H-苯环),7.11-7.17(m,3H,H-苯环),7.41-7.50(m,3H,H-苯环).按照BS-FC-102的方法,使用上述同样的试剂,将汉防己乙素与苯磺酰氯反应,制备了BS-FC-104:LC-MS:保留时间:0.99min(100%);m/z749.0[M+H]+,374.9[1/2M+H]+按照BS-FC-102的方法,使用上述同样的试剂,将汉防己乙素与三氟甲基磺酰氯反应,制备了BS-FC-105:LC-MS:保留时间:1.03min(90.45%);m/z741.0[M+H]+,371.1[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.73(s,3H,N-CH3),3.01(s,3H,N′-CH3),3.53(s,3H,6′-OCH3),3.83(s,3H,6-OCH3),3.96(s,3H,12-OCH3),6.05(s,1H,8′-H),6.42(m,2H,H-苯环),6.55(s,1H,H-苯环),6.71(s,1H,H-苯环),6.96(m,2H,2H-苯环),7.52(m,1H,14′-H).实施例2:化合物(BS-FC-206)的合成式中,t-BuOK:叔丁基醇钾.向二甲基亚砜(2mL)中加入汉防己乙素(80mg,0.13mmol),随后在0℃条件下加入叔丁基醇甲(22.5mg,0.1971mmol),升至室温后搅拌0.5小时。将溶有3-氟-4-氯氯苄(26.5mg,0.12mmol)的二甲基亚砜逐滴加入反应液中,反应液加热升温至40℃,搅拌反应2小时。反应结束后,向反应液中加水(20mL),用二氯甲烷(5mL×3)萃取,合并有机相,经饱和食盐水洗,旋干后得到的粗产物经制备薄层色谱(二氯甲烷∶甲醇=10∶1)分离纯化后得到亮黄色粉末状化合物BS-FC-206(23.6mg,收率24%)。LC-MS:保留时间:1.10min(99.12%);m/z751[M+H]+,376[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.55(s,3H,N-CH3),3.48(s,3H,6′-OCH3),3.76(s,3H,6-OCH3),3.94(s,3H,12-OCH3),5.81(s,1H,8′-H),6.60(s,1H,H-苯环),6.74(m,1H,H-苯环).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与对氟氯苄反应,制备了BS-FC-201:LC-MS:保留时间:1.13min(85.98%);m/z717.0[M+H]+,359.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.53(s,3H,N-CH3),2.59(s,3H,N-CH3),3.41(s,3H,6′-OCH3),3.61(s,3H,6-OCH3),3.92(s,3H,12-OCH3),5.77(s,1H,8′-H),6.36(s,1H,H-苯环),6.46(s,1H,H-苯环),6.53(s,1H,H-苯环),6.78-6.89(m,5H,H-苯环),7.11-7.36(m,3H,H-苯环).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与3-溴甲基吡啶反应,制备了BS-FC-202:LC-MS:保留时间:0.79min(92.16%);m/z700.1[M+H]+,350.5[1/2M+H]+.按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与对三氟甲氧基溴苄反应,制备了BS-FC-203:LC-MS:保留时间:1.21min(94.06%);m/z782.9[M+H]+,392.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.43(s,3H,N-CH3),2.52(s,3H,N-CH3),3.49(s,3H,6′-OCH3),3.75(s,3H,6-OCH3),3.94(s,3H,12-OCH3),4.34(d,1H,J=8.1Hz),4.70(d,1H,J=8.1Hz),5.89(s,1H,8′-H),6.31(d,1H,J=8.4,11′-H),6.40(s,1H,H-苯环),6.47(s,1H,H-苯环),6.60(s,1H,H-苯环),6.86(d,2H,J=8.7Hz,H-苯环),6.93(m,3H,H-苯环),7.06(d,1H,J=8.4Hz,13′-H),7.13(d,1H,J=8.1Hz,13′-H),7.42(d,1H,J=8.1Hz,14′-H).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与2,3-二氟溴苄反应,制备了BS-FC-204:LC-MS:保留时间:1.11min(99.35%);m/z735.0[M+H]+,368.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.36(s,3H,N-CH3),2.55(s,3H,N-CH3),3.37(s,3H,6′-OCH3),3.74(s,3H,6-OCH3),3.92(s,3H,12-OCH3),4.46(d,1H,J=8.1Hz),4.65(d,1H,J=8.1Hz),5.75(s,1H,8′-H),6.27(d,1H,J=8.4,11′-H),6.35(s,1H,H-苯环),6.46(s,1H,H-苯环),6.51(s,1H,H-苯环),6.86(m,2H,H-苯环),6.95-7.13(m,4H,H-苯环),7.15(dd,1H,J=2.1,8.1Hz,13′-H),7.36(dd,1H,J=2.1,8.1Hz,14′-H).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与3-氯-4-氟溴苄反应,制备了BS-FC-205:LC-MS:保留时间:1.09min(96.28%);m/z751.2[M+H]+,376.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.41(s,3H,N-CH3),2.61(s,3H,N′-CH3),3.41(s,3H,6′-OCH3),3.75(s,3H,6-OCH3),3.94(s,3H,12-OCH3),5.79(s,1H,8′-H),6.32(m,1H,11′-H),6.36(s,1H,5-H),6.49(s,1H,H-苯环),6.54(s,1H,H-苯环),6.82-6.99(m,3H,H-苯环),7.11(m,2H,H-苯环),7.34(m,1H,14′-H).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与溴甲基环丙烷反应,制备了BS-FC-208:LC-MS:保留时间:1.06min(95.93%);m/z663.0[M+H]+,332.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.71(s,3H,N′-CH3),3.41(s,3H,6′-OCH3),3.75(s,3H,6-OCH3),3.94(s,3H,12-OCH3),5.79(s,1H,8′-H).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与溴丙烯反应,制备了BS-FC-213:LC-MS:保留时间:1.04min(97.48%);m/z649.1[M+H]+,324.9[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.39(s,3H,N-CH3),2.62(s,3H,N′-CH3),3.39(s,3H,6′-OCH3),3.75(s,3H,6-OCH3),3.93(s,3H,12-OCH3),5.97(s,1H,8′-H),6.30(m,2H,H-苯环),6.53(m,2H,H-苯环),6.87(m,3H,H-苯环),7.15(m,1H,13′-H),7.38(m,1H,14′-H).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与对甲氧基溴苄反应,制备了BS-FC-215:LC-MS:保留时间:1.03min(89.37%);m/z729.2[M+H]+,365.1[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.56(s,3H,N-CH3),3.38(s,3H,6′-OCH3),3.75(s,6H,OCH3),3.93(s,3H,12-OCH3),5.79(s,1H,8′-H),6.39(m,1H,H-苯环),6.51(m,2H,H-苯环),6.79(m,1H,H-苯环),6.91(m,H-苯环).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与对三氟甲氧基溴苄反应,制备了BS-FC-216:LC-MS:保留时间:1.08min(94.44%);m/z767.1[M+H]+,384.0[1/2M+H]+.按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与6-氯-2-氟溴苄反应,制备了BS-FC-217:LC-MS:保留时间:1.06min(95.06%);m/z751.2[M+H]+,376.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.46(s,3H,N-CH3),2.76(s,3H,N′-CH3),3.34(s,3H,6′-OCH3),3.79(s,3H,6-OCH3),3.93(s,3H,12-OCH3),6.26(m,1H,11′-H),6.34(s,1H,5-H),6.44(s,1H,H-苯环),6.50(s,1H,H-苯环),6.74(m,1H,10′-H),6.80(m,2H,H-苯环),7.16(m,3H,H-苯环),7.40(m,2H,H-苯环).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与碘代环戊烷反应,制备了BS-FC-220:LC-MS:保留时间:1.00min(99.74%);m/z677.1[M+H]+,339.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.42(s,3H,N-CH3),2.72(s,3H,N′-CH3),3.37(s,3H,6′-OCH3),3.74(s,3H,6-OCH3),3.93(s,3H,12-OCH3),5.89(s,1H,8′-H),6.35(m,2H,H-苯环),6.51(s,1H,H-苯环),6.53(s,1H,H-苯环),6.83(m,1H,H-苯环),6.89(d,1H,J=8.1Hz,H-苯环),7.16(dd,1H,J=2.1,8.1Hz,13′-H),7.42(dd,1H,J=2.1,8.1Hz,14′-H).按照BS-FC-206的方法,使用上述同样的试剂,将汉防己乙素与3-溴-2-甲基丙烯反应,制备了BS-FC-221:LC-MS:保留时间:1.00min(99.72%);m/z663.2[M+H]+,332.0[1/2M+H]+.实施例3:化合物(BS-FC-304)的合成式中,DIC:N,N′-二异丙基碳二亚胺;DMAP:4-二甲氨基吡啶向二氯甲烷(2mL)中加入汉防己乙素(80mg,0.13mmol),环丙甲酸(17mg,0.2mmol),随后加入N,N′-二异丙基碳二亚胺(34mg,0.26mmol),4-二甲氨基吡啶(16mg,0.26mmol),N,N-二异丙基乙胺(34mg,0.26mmol)。反应液加热升温至40℃,搅拌反应2小时。反应结束后,向反应液中加入二氯甲烷(20mL),饱和食盐水洗。分离得到的有机相经无水硫酸钠干燥,旋干,得到的粗产物经制备薄层色谱分离纯化后得到灰白色粉末状化合物BS-FC-304(54.7mg,收率52%)。LC-MS:保留时间:0.80min(100.0%);m/z677[M+H]+,338[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.52(s,3H,N-CH3),2.77(s,3H,N-CH3),3.45(s,3H,6′-OCH3),3.85(s,3H,6-OCH3),3.93(s,3H,12-OCH3),5.99(s,1H,8′-H),6.29(m,1H,11′-H),6.40(s,1H,H-苯环),6.48(s,1H,H-苯环),6.56(s,1H,H-苯环),6.87(m,1H,H-苯环),6.90(d,1H,J=8.1Hz,H-苯环),6.95-7.13(m,4H,H-苯环),7.13(d,1H,J=8.7Hz,13′-H),7.36(d,1H,J=8.7Hz,14′-H).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与3-吡啶甲酸反应,制备了BS-FC-301:LC-MS:保留时间:0.92min(96.55%);m/z714.2[M+H]+,357.6[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ3.73(s,3H,6-OCH3),3.95(s,3H,12-OCH3),6.45(s,2H,H-苯环),6.90-7.12(m,3H,H-苯环),7.35(m,1H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与4-吡啶甲酸反应,制备了BS-FC-302:LC-MS:保留时间:0.96min(98.29%);m/z714.0[M+H]+,357.5[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.03(s,3H,N-CH3),2.53(s,3H,N′-CH3),3.48(s,3H,6′-OCH3),3.71(s,3H,6-OCH3),3.93(s,3H,12-OCH3),6.46(s,2H,H-苯环),6.79(m,1H,H-苯环),6.90(m,1H,H-苯环),7.09-7.29(m,2H,H-苯环),8.69(m,2H,).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与N-甲基-D-丙氨酸反应,制备了BS-FC-305:LC-MS:保留时间:0.75min(99.65%);m/z694.2[M+H]+,347.5[1/2M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与N,N-二甲基甘氨酸反应,制备了BS-FC-307:LC-MS:保留时间:0.92min(95.29.00%);m/z694.0[M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与N,N-二甲氨基苯甲酸反应,制备了BS-FC-308:LC-MS:保留时间:1.13min(91.31%);m/z756.0[M+H]+,378.5[1/2M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与对三氟甲氧基苯甲酸反应,制备了BS-FC-309:LC-MS:保留时间:1.15min(91.13%);m/z797.2[M+H]+,399.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.07(s,3H,N-CH3),2.39(m,3H,N-CH3),3.54(s,3H,6′-OCH3),3.72(s,3H,6-OCH3),3.95(s,3H,12-OCH3),6.42(s,2H,H-苯环),6.87(m,2H,H-苯环),7.10(m,1H,H-苯环),7.17(m,1H,H-苯环),7.20(m,1H,H-苯环),7.66(m,1H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与3,5-二氟苯甲酸反应,制备了BS-FC-310:LC-MS:保留时间:1.11min(98.02%);m/z748.9[M+H]+,374.9[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.12(s,3H,N-CH3),2.23(s,3H,N-CH3),3.67(s,3H,6-OCH3),3.90(s,3H,12-OCH3),6.37(s,1H,H-苯环),6.86(m,3H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与3,5-二甲氧基苯甲酸反应,制备了BS-FC-311:LC-MS:保留时间:1.11min(99.22%);m/z773.0[M+H]+,387.0[1/2M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与4-哒嗪羧酸反应,制备了BS-FC-313:LC-MS:保留时间:0.89min(95.53%);m/z715.1[M+H]+,358.1[1/2M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与四氢吡喃-4-羧酸反应,制备了BS-FC-314:LC-MS:保留时间:0.89min(97.72%);m/z721.1[M+H]+,361.0[1/2M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与6-氯-2-氟苯甲酸反应,制备了BS-FC-315:LC-MS:保留时间:1.04min(99.51%);m/z765.2[M+H]+,383.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.38(s,3H,N-CH3),3.47(s,3H,6′-OCH3),3.69(s,3H,6-OCH3),3.94(s,3H,12-OCH3),6.03(s,1H,8′-H),6.50(m,3H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与氨基甲酸反应,制备了BS-FC-318:LC-MS:保留时间:0.73min(95.42%);m/z666.1[M+H]+,333.5[1/2M+H]+.按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与戊二酸酐反应,制备了BS-FC-324:LC-MS:保留时间:0.97min(98.81%);m/z723.0[M+H]+,362.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.84(s,3H,N′-CH3),3.50(s,3H,6′-OCH3),3.73(s,3H,6-OCH3),3.95(s,3H,12-OCH3),6.00(s,1H,8′-H),6.30(m,2H,H-苯环),6.36(m,1H,H-苯环),6.40(m,1H,H-苯环),6.56(m,1H,H-苯环),6.90(s,2H,H-苯环),7.25-7.37(m,3H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与苯甲酸反应,制备了BS-FC-501:LC-MS:保留时间:2.30min(96.19%);m/z713.0[M+H]+,357.1[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.87(s,3H),2.49(s,3H),2.73-2.62(m,2H),2.90(s,3H),3.54(d,4H),3.71(dd,J=8.6,5.2Hz,10H),3.76(s,1H),3.93(s,3H),6.84(dd,9H,H-苯环),7.87-7.30(m,6H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与对甲基苯甲酸反应,制备了BS-FC-502:LC-MS:保留时间:2.44min(97.24%);m/z727.1[M+H]+,364.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.25(s,1H),1.32(s,1H),1.96-1.87(m,2H),2.36(s,6H),3.06-2.44(m,9H),3.21(s,1H),3.51(t,6H),3.68(s,3H),3.92(s,3H),7.20-5.66(m,12H,H-苯环),7.75-7.41(m,2H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与对甲氧基苯甲酸反应,制备了BS-FC-503:LC-MS:保留时间:2.36min(95.46%);m/z743.0[M+H]+,372.1[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.03(s,4H),2.39(s,3H),2.84-2.50(m,7H),3.00(s,2H),3.24(s,1H),3.52(t,6H),3.69(s,3H),3.83(s,3H),3.92(s,3H),7.18-5.69(m,12H,H-苯环),7.66(d,2H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与对甲氨基苯甲酸反应,制备了BS-FC-504:LC-MS:保留时间:2.32min(100%);m/z742.0[M+H]+,372.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.05(s,3H),2.17(s,3H),3.27-2.38(m,15H),3.48(s,1H),3.63(s,1H),3.69(s,3H),3.87-3.72(m,3H),3.92(s,3H),7.23-5.72(m,10H,H-苯环),8.12-7.31(m,4H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与4-(二乙氨基)苯甲酸反应,制备了BS-FC-505:LC-MS:保留时间:2.66min(92.21%);m/z784.1[M+H]+,392.6[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.18(t,J=7.0Hz,6H),7.60(dddd,4H),1.39-1.27(m,4H),1.67(dd,1H),2.36(s,3H),2.65(dd,5H),2.98(dd,2H),3.45(dd,6H),3.67(s,3H),3.90(d,J=16.6Hz,3H),4.31-4.11(m,1H),7.25-5.53(m,10H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与对异丙基苯甲酸反应,制备了BS-FC-506:LC-MS:保留时间:2.72min(99.20%);m/z755.0[M+H]+,378.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.26-1.17(m,9H),2.02-1.52(m,4H),3.08-2.40(m,13H),3.48(s,1H),3.63(s,2H),3.68(s,3H),3.93(s,3H),4.34-4.09(m,1H),7.24-5.38(m,11H,H-苯环),8.25-7.29(m,3H,H-苯环).按照BS-FC-304的方法,使用上述同样的试剂,将汉防己乙素与对氨基苯甲酸反应,制备了BS-FC-507:LC-MS:保留时间:2.16min(100%);m/z728.0[M+H]+,364.0[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.42-1.26(m,9H),1.79-1.59(m,2H),2.80-2.48(m,4H),3.04(s,3H),3.56(d,3H),3.77-3.67(m,3H),3.95(d,3H),4.25-4.18(m,3H),6.60-5.69(m,4H,H-苯环),6.83(dd,2H,H-苯环),7.13(s,1H,H-苯环),7.34(d,J=8.1Hz,1H,H-苯环),7.65-7.42(m,3H,H-苯环),7.70(dd,J=5.7,3.3Hz,1H,H-苯环),8.23-8.02(m,1H,H-苯环).实施例4:化合物(BS-FC-400)的合成向二甲基亚砜(5mL)中加入汉防己乙素(1g,1.64mmol),随后在0℃条件下,加入叔丁基醇钾(560mg,4.91mmol),混合液室温下搅拌0.5小时后,逐滴加入溶有环氯乙烷(180mg,1.97mmol)的二甲基亚砜(2mL),反应液加热升温至40℃,搅拌3小时。反应结束后,在0℃条件下,向反应液中加入水(50mL),用二氯甲烷(10mL*4)萃取,合并有机相,经饱和食盐水洗,干燥,旋干后得到的产物BS-FC-400不经纯化直接用于下一步反应。LC-MS:保留时间:0.88min(92.01%);m/z665.0[M+H]+,333.1[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.38(s,3H,N-CH3),2.70(s,3H,N′-CH3),3.38(s,3H,6′-OCH3),3.70(s,3H,6-OCH3),3.90(s,3H,12-OCH3),6.00(m,1H,8′-H),6.24(m,2H,H-苯环),6.46(m,2H,H-苯环),6.86-7.00(m,3H,H-苯环),7.11(m,1H,13′-H),7.36(m,1H,14′-H)实施例5:化合物(BS-FC-418)的合成向乙醇(2mL)中加入上一步得到的化合物BS-FC-400(100mg,0.15mmol),随后加入N-甲基-哌嗪(30mg,0.3mmol),密闭条件下,反应液加热升温至120℃,反应3小时。反应结束后,将反应液浓缩得到的粗产物经制备薄层色谱分离纯化(二氯甲烷∶甲醇=8∶1)后得到白色粉末状化合物BS-FC-418(30mg,收率26%)。LC-MS:保留时间:0.7min(96%);m/z764.9[M+H]+.383.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.34-2.15(m,10H),2.59-2.40(m,10H),2.65(t,J=4.4Hz,4H),2.80-2.70(m,3H),2.96-2.83(m,4H),3.36-3.22(m,6H),3.45-3.37(m,2H),3.58-3.45(m,3H),3.73(t,J=3.2Hz,5H),3.91(s,5H),5.98(d,J=2.2Hz,1H),6.32-6.27(m,2H),6.52-6.47(m,2H),6.88-6.77(m,3H),7.13(dd,J=8.2,2.4Hz,1H),7.34(dt,J=8.1,2.5Hz,1H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与4-二甲氨基哌啶反应,制备了BS-FC-401:LC-MS:保留时间:0.71min(95.72%);m/z793.1[M+H]+,397.4[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.30(s,3H,N-CH3),2.38(s,6H,N-(CH3)2)2.64(s,3H,N′-CH3),3.35(s,3H,6′-OCH3),3.74(s,3H,6-OCH3),3.92(s,3H,12-OCH3),5.98(s,1H,8′-H),6.30(m,2H,H-苯环),6.52(m,2H,H-苯环),6.84-6.86(m,3H,H-苯环),7.14(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与3-羟基哌啶反应,制备了BS-FC-402:LC-MS:保留时间:0.74min(93.36%);m/z766.1[M+H]+,383.8[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.29(s,3H,N-CH3),3.33(s,3H,6′-OCH3),3.70(s,3H,6-OCH3),3.89(s,3H,12-OCH3),6.03(m,1H,8′-H),6.27(m,2H,5,11′-H),6.46(m,1H,H-苯环),6.52(m,1H,H-苯环),6.80(m,3H,H-苯环),7.12(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与哌啶反应,制备了BS-FC-403:LC-MS:保留时间:0.75min(88.00%);m/z750.0[M+H]+,375.7[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.30(s,3H,N-CH3),2.62(s,3H,N′-CH3),3.34(s,3H,6′-OCH3),3.71(s,3H,6-OCH3),3.92(s,3H,12-OCH3),5.97(s,1H,8′-H),6.25(m,2H,H-苯环),6.48(m,2H,H-苯环),6.77(m,3H,H-苯环),7.09(m,1H,13′-H),7.33(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-异丙基哌嗪反应,制备了BS-FC-404:LC-MS:保留时间:0.73min(95.62%);m/z793.1[M+H]+,397.4[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ1.16(m,6H,CH3),2.29(s,3H,N-CH3),2.67(s,3H,N′-CH3),3.39(s,3H,6′-OCH3),3.70(s,3H,6-OCH3),389(s,3H,12-OCH3),5.98(m,1H,8′-H),6.24(m,2H,H-苯环),6.48(m,2H,H-苯环),6.86(m,3H,H-苯环),7.11(m,1H,13′-H),7.33(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与环丙甲胺反应,制备了BS-FC-405:LC-MS:保留时间:0.78min(96.5%);m/z736.1[M+H]+,368.8[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.32(s,3H,N-CH3),2.91(m,3H,N′-CH3),3.38(s,3H,6′-OCH3),3.68(s,3H,6-OCH3),3.90(s,3H,12-OCH3),6.08(d,1H,8′-H),6.29(m,2H,H-苯环),6.50(s,2H,H-苯环),6.76(m,1H,10′-H),6.83(m,2H,H-苯环),7.14(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-乙基甲基胺反应,制备了BS-FC-406:LC-MS:保留时间:0.72min(86.27%);m/z723.9[M+H]+,362.7[1/2M+H]+.按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-甲基乙醇胺反应,制备了BS-FC-407:LC-MS:保留时间:0.73min(93.23%);m/z740.1[M+H]+,370.8[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.28(s,3H,N-CH3),2.38(s,3H,N-CH3),2.68(m,3H,N-CH3),3.35(s,3H,6′-OCH3),3.73(s,3H,6-OCH3),3.91(s,3H,12-OCH3),6.02(m,1H,8′-H),6.28(m,2H,H-苯环),6.45(m,1H,10-H),6.52(s,1H,5′-H),6.84(m,3H,H-苯环),7.13(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-甲基高哌嗪反应,制备了BS-FC-408:LC-MS:保留时间:0.69min(94.45%);m/z779.0[M+H]+,390.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.31(s,3H,N-CH3),2.39(s,3H,N-CH3),2.53(m,3H,N-CH3),3.34(s,3H,6′-OCH3),3.72(s,3H,6-OCH3),3.89(s,3H,12-OCH3),6.01(d,1H,J=8.1Hz,8′-H),6.29(m,2H,H-苯环),6.49(m,2H,H-苯环),6.76-6.83(m,3H,H-苯环),7.13(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-烯丙基甲胺反应,制备了BS-FC-409:LC-MS:保留时间:0.76min(91.38%);m/z736.1[M+H]+,368.8[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.33(s,6H,N-CH3),2.60(m,3H,N-CH3),3.35(s,3H,6′-OCH3),3.73(s,3H,6-OCH3),3.91(s,3H,12-OCH3),6.02(s,1H,8′-H),6.30(m,2H,H-苯环),6.50(m,2H,H-苯环),6.79-6.88(m,1H,H-苯环),7.13(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与3-甲基哌啶反应,制备了BS-FC-410:LC-MS:保留时间:0.80min(100.00%);m/z764.1[M+H]+,382.9[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.28(s,6H,N-CH3),2.61(m,3H,N-CH3),3.25(s,3H,6′-OCH3),3.64(s,3H,6-OCH3),3.90(s,3H,12-OCH3),5.99(s,1H,8′-H),6.27(m,2H,H-苯环),6.50(m,2H,H-苯环),6.75-6.83(m,3H,H-苯环),7.12(m,1H,13′-H),7.31(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与三氟乙胺反应,制备了BS-FC-413:LC-MS:保留时间:0.70min(81.20%);m/z763.8[M+H]+,382.7[1/2M+H]+.按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与乙醇胺反应,制备了BS-FC-414:LC-MS:保留时间:0.71min(80.58%);m/z725.9[M+H]+,363.7[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.32(s,3H,N-CH3),2.69(m,3H,N-CH3),3.35(s,3H,6′-OCH3),3.72(s,3H,6-OCH3),3.91(s,3H,12-OCH3),6.02(d,1H,J=8.7Hz,8′-H),6.28(m,2H,H-苯环),6.48(s,1H,H-苯环),6.52(d,1H,J=1.8Hz,H-苯环),6.85(m,3H,H-苯环),7.11(m,1H,13′-H),7.36(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与吗啉反应,制备了BS-FC-416:LC-MS:保留时间:0.75min(90.99%);m/z752.1[M+H]+,376.8[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.32(s,3H,N-CH3),2.63(m,3H,N′-CH3),3.36(s,3H,6′-OCH3),3.66(s,3H,6-OCH3),3.93(s,3H,12-OCH3),5.98(m,1H,8′-H),6.33(m,2H,H-苯环),6.51(m,2H,H-苯环),6.85(m,3H,H-苯环),7.13(m,1H,13′-H),7.35(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与硫代吗啉反应,制备了BS-FC-417:LC-MS:保留时间:0.78min(100%);m/z768.0[M+H]+,384.8[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.31(s,3H,N-CH3),2.64(m,3H,N′-CH3),3.31(s,3H,6′-OCH3),3.73(s,3H,6-OCH3),3.91(s,3H,12-OCH3),5.98(s,1H,8′-H),6.28(m,2H,H-苯环),6.50(m,2H,H-苯环),6.83(m,3H,H-苯环),7.11(m,1H,13′-H),7.35(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与4-羟基哌啶反应,制备了BS-FC-419:LC-MS:保留时间:0.71min(88.32%);m/z765.9[M+H]+,383.7[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.27(s,3H,N-CH3),2.62(m,3H,N′-CH3),3.33(s,3H,6′-OCH3),3.71(s,3H,6-OCH3),3.90(s,3H,12-OCH3),5.97(s,1H,8′-H),6.28(m,2H,H-苯环),6.50(m,2H,H-苯环),6.83(m,3H,H-苯环),7.09(m,1H,13′-H),7.34(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-乙基哌嗪反应,制备了BS-FC-420:LC-MS:保留时间:0.72min(94.99%);m/z779.1[M+H]+,390.3[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.29(s,3H,N-CH3),2.50(m,3H,N′-CH3),3.35(s,3H,6′-OCH3),3.73(s,3H,6-OCH3),3.91(s,3H,12-OCH3),5.97(m,1H,8′-H),6.29(m,2H,H-苯环),6.50(m,2H,H-苯环),6.84(m,1H,10′-H),6.84(m,2H,H-苯环),7.14(m,1H,13′-H),7.31(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-氰基哌嗪反应,制备了BS-FC-421:LC-MS:保留时间:0.77min(92.20%);m/z775.1[M+H]+,388.3[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.31(s,3H,N-CH3),2.66(m,3H,N′-CH3),3.34(s,3H,6′-OCH3),3.71(s,3H,6-OCH3),3.89(s,3H,12-OCH3),5.96(s,1H,8′-H),6.29(s,2H,H-苯环),6.50(m,2H,H-苯环),6.90(m,3H,H-苯环),7.09(m,1H,13′-H),7.32(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与N-羟乙基哌嗪反应,制备了BS-FC-422:LC-MS:保留时间:0.67min(92.80%);m/z794.9[M+H]+,398.2[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.28(s,3H,N-CH3),2.66(m,3H,N′-CH3),3.34(s,3H,6′-OCH3),3.71(s,3H,6-OCH3),3.89(s,3H,12-OCH3),5.96(s,1H,8′-H),6.28(s,2H,H-苯环),6.48(m,2H,H-苯环),6.82(m,3H,H-苯环),7.09(m,1H,13′-H),7.32(m,1H,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与3-甲氧基丙胺反应,制备了BS-FC-424:LC-MS:保留时间:0.74min(85.62%);m/z753.9[M+H]+,377.7[1/2M+H]+.1HNMR(301MHz,partialassignmentofsignalsinCDCl3)δ2.30(s,3H,N-CH3),2.67(m,3H,N′-CH3),3.30(s,3H,O-CH3),3.44(s,3H,O-CH3),3.73(s,3H,6-OCH3),3.92(s,3H,12-OCH3),6.00(d,1H,J=9.6Hz,8′-H),6.29(m,2H,H-苯环),6.50(s,1H,H-苯环),6.53(s,1H,H-苯环),6.78(m,1H,10′-H),6.86(s,2H,13,14-H),7.19(dd,1H,J=2.1,8.4Hz,13′-H),7.36(dd,1H,J=2.1,8.4Hz,14′-H).按照BS-FC-418的方法,使用上述同样的试剂,将化合物BS-FC-4与糠胺反应,制备了BS-FC-425:LC-MS:保留时间:0.77min(87.94%);m/z761.9[M+H]+,381.7[1/2M+H]+.实施例6:本发明的7-位取代的汉防己乙素衍生物抗白血病的活性测定(1)实验材料白血病细胞株:白血病细胞株:K562/adr(耐药慢性髓系白血病,CML)、NB4(急性早幼粒细胞白血病,AML)、Kasumi-1(急性髓系白血病M2型,AML-M2)、Jurkat(急性淋巴细胞白血病,ALL),以上细胞系均受赠于浙江大学肿瘤研究所;H9(急性淋巴细胞白血病,ALL),购自中国典型培养物保藏中心。试剂:汉防己乙素(FAN)标准品购自陕西慈缘生物技术有限公司,本发明的7-位取代的汉防己乙素衍生物。主要仪器:细胞培养箱(型号:ThermoScientific3111),酶标仪(型号:Bio-RadiMark)。(2)实验方法取生长良好的白血病细胞6000个,接种到96孔细胞培养板孔内。培养液为含10%胎牛血清的RPMI-1640细胞培养液。第二天加入不同浓度的7-位取代的汉防己乙素衍生物,混匀后,置于二氧化碳(5%CO2)细胞培养箱37℃培养72小时。然后用MTT法测定活细胞浓度。在本实验中对照组(不加化合物处理)细胞活力设为100%,并计算出化合物作用后细胞活力(%)和72小时白血病细胞半数生长抑制浓度(72小时IC50值,μg/mL)。(3)实验结果实验结果见表1。表1显示本发明的7-位取代的汉防己乙素衍生物能诱导人慢性髓系白血病、急性髓系白血病和急性淋巴细胞白血病细胞死亡和抑制这些白血病细胞生长,与汉防己乙素本身比较,本发明的7-位取代的汉防己乙素衍生物抗白血病细胞活性明显增强,其中本发明的7-位取代的汉防己乙素衍生物BS-FC-403,BS-FC-410抗K562/adr(耐药慢性髓系白血病,CML)活性尤为明显,活性较汉防己乙素提高7倍以上;BS-FC-308抗Jurkat(急性淋巴细胞白血病)和H9(急性淋巴细胞白血病)活性分别提高4倍及3倍以上;BS-FC-104,BS-FC-311和BS-FC-410抗NB4(急性早幼粒细胞白血病)活性提高2倍以上;此外,BS-FC-311抗Kasumi-1(急性髓系白血病M2型)活性较汉防己乙素也提高将近2倍。表1:汉防己乙素衍生物对白血病细胞,人多发性骨髓瘤和淋巴瘤细胞生长抑制浓度测定(72小时,IC50(μg/mL)值和IC90(μg/mL)值)。实施例7:本发明的7-位取代的汉防己乙素衍生物抗人多发性骨髓瘤细胞活性测定(1)实验材料骨髓瘤细胞株:RPMI8226(多发性骨髓瘤),购自上海复祥生物科技有限公司。试剂:同实施例6。主要仪器:ThermoScientific3111细胞培养箱,Bio-RadiMark酶标仪。(2)实验方法取生长良好的上述肿瘤细胞6000个,接种到96孔细胞培养板孔内。培养液为含10%胎牛血清的RPMI-1640细胞培养液。第二天加入不同浓度的7-位取代的汉防己乙素衍生物,混匀后,置于二氧化碳(5%CO2)细胞培养箱37℃培养72小时。然后用MTT法测定活细胞浓度。在本实验中对照组(不加化合物处理)细胞活力设为100%,并计算出化合物作用后细胞活力(%)和72小时白血病细胞半数生长抑制浓度(72小时IC50值,μg/mL)。(3)实验结果实验结果见表2。表2显示本发明的部分7-位取代的汉防己乙素衍生物能诱导人骨髓瘤细胞死亡和抑制这些肿瘤细胞生长。其中7-位取代的汉防己乙素衍生物BS-FC-417抗RPMI8226(多发性骨髓瘤)活性与汉防己乙素相比,提高2倍实施例8:本发明的7-位取代的汉防己乙素衍生物抗人实体瘤作用测定(1)实验材料人实体瘤细胞株:Hep-2(喉癌)、A549(人肺癌)、CaEs-17(食道癌细胞)、PC-3(前列腺癌)、CNE(鼻咽癌细胞)、SK-OV-3(卵巢癌细胞)均购自中国典型培养物保藏中心;RKO(人结肠腺癌细胞)、MGC-803(人胃癌细胞)、MG-63(骨肉瘤)、U87-MG(恶性脑胶质瘤细胞)均购自上海复祥生物科技有限公司;PANC-1(胰腺癌)、Becap-37(人乳腺癌细胞)、Hela(人宫颈癌细胞)、HepG2(人肝癌细胞)均受赠于浙江大学肿瘤研究所。试剂:同实施例6.主要仪器:ThermoScientific3111细胞培养箱,Bio-RadiMark酶标仪。(2)实验方法取生长良好的人实体瘤细胞6000个,接种到96孔细胞培养板孔内。培养液为含10%胎牛血清的DMEM高糖细胞培养液。置于二氧化碳(5%CO2)细胞培养箱37℃培养24小时,然后,加入不同浓度的7-位取代的汉防己乙素衍生物,混匀后,继续置二氧化碳(5%CO2)细胞培养箱37℃培养72小时。然后用MTT法测定活细胞浓度。在本实验中对照组(不加化合物处理)细胞活力设为100%,并计算出化合物作用后细胞活力(%)和72小时白血病细胞半数生长抑制浓度(72小时IC50值)。(3)实验结果实验结果见表2。表2显示本发明的7-位取代的汉防己乙素衍生物能诱导人实体瘤细胞死亡和抑制这些肿瘤细胞生长,与汉防己乙素本身比较,本发明7-位取代的汉防己乙素衍生物抗实体瘤细胞活性明显增强,其中本发明的7-位取代的汉防己乙素衍生物BS-FC-403,BS-FC-405和BS-FC-410尤为显著,抗PANC-1(胰腺癌),Becap-37(人乳腺癌细胞)和HepG2(人肝癌细胞)活性较汉防己乙素本身提高近3倍或3倍以上;抗U87-MG(恶性脑胶质瘤细胞)活性提高1.5倍以上;BS-FC-403抗PC-3(前列腺癌),SK-OV-3(卵巢癌细胞)和RKO(人结肠腺癌细胞)活性较汉防己乙素本身提高近3倍或3倍以上;BS-FC-308抗A549(人肺癌)活性提高3倍以上;BS-FC-221和BS-FC-403抗MG-63(骨肉瘤)活性提高2倍以上;BS-FC-311抗Hela(人宫颈癌细胞),BS-FC-403和BS-FC-405CaEs-17(食道癌细胞)活性均提高近4倍;BS-FC-403,BS-FC-405和BS-FC-421抗CNE(鼻咽癌细胞)活性提高近3倍;BS-FC-311,BS-FC-403,BS-FC-405和BS-FC-409抗Hep-2(喉癌)活性提高2倍以上;此外,BS-FC-403和BS-FC-410抗MGC-803(人胃癌细胞)活性较汉防己乙素本身也提高了2倍以上。表2汉防己乙素衍生物对人实体瘤细胞半数生长抑制浓度测定(72小时,IC50(μg/mL)值和IC90(μg/mL)值)。表2(续)表2(续)表2(续)实施例9:本发明汉防己乙素7-位取代的衍生物BS-FC-308抗体内肿瘤的活性测定和毒性的初步测试实验9-1:BS-FC-308对裸鼠肝癌移植瘤的抑制作用(1)实验材料:肝癌细胞株:HepG2(人肝癌细胞株);动物:BALB/c-nu裸鼠(免疫缺陷鼠),8周,雌性,购自中国科学院上海实验动物中心。(2)试剂:BS-FC-308(实验合成);盐酸厄洛替尼(山东淄博凯美远医药技术有限公司)(3)主要仪器:细胞培养箱(ThermoScientific,3111);层流架(苏杭实验动物设备厂,DJ-2)。(4)实验方法无菌条件下分别收集对数生长期HepG2细胞,以2.3×107/0.2mL/只裸鼠的细胞量(活细胞率>90%),经皮下注射于裸鼠左腋下,建立肝癌的裸鼠移植瘤模型。接种后第二天开始用药,实验组按实验设计量灌胃,阴性对照组用无菌水灌胃,阳性对照以盐酸厄洛替尼灌胃,每只鼠每次灌胃0.4mL,每天用药3次,用药时间为8点,14点,20点,间隔时间为6小时,连续用药10天。以用药前一天为第0天,每5天测体重及瘤径,做出体重及肿瘤生长动态图(实验结果以mean±SD表示)。第28天解剖取出瘤体称重,以对照组抑瘤率为0,计算出药物作用后的肿瘤抑制率(%)。各组实验数据采用SPSS19.0统计软件中的One-wayANOVA法分析,与对照组比较具有差异显著性。表3BS-FC-308对裸鼠体重的影响表4BS-FC-308对裸鼠HepG2移植瘤的影响注:与对照组比较,*为P<0.05图1显示了BS-FC-308对裸鼠体重影响的动态曲线。图2显示了BS-FC-308对裸鼠HepG2移植瘤体积影响的动态曲线。图3显示了BS-FC-308显著减小了裸鼠HepG2移植瘤的重量。图4显示了BS-FC-308对裸鼠HepG2移植瘤重量的影响。图5显示了BS-FC-308对裸鼠HepG2移植瘤的抑制作用。如上述表和图所示,在动物体内试验中,BS-FC-308在剂量35mg/kg/次下,一天三次的给药能够有效抑制肝癌细胞HepG2移植瘤的生长,对肝癌抑瘤率达到55.82%;给药期间,动物体重有降低,显示该化合物对动物有一定的毒副作用,但是停用后,动物体重会有所回升。实验9-2:BS-FC-308对裸鼠白血病移植瘤的影响(1)实验材料:白血病细胞株:KCL-22M(人慢性粒细胞白血病突变株)动物:BALB/c-nu裸鼠(免疫缺陷鼠),8周,雌性,购自中国科学院上海实验动物中心。(2)试剂:BS-FC-308(实验合成)。(3)主要仪器:细胞培养箱(ThermoScientific,3111);层流架(苏杭实验动物设备厂,DJ-2)。(4)实验方法无菌条件下分别收集对数生长期KCL-22M细胞,以1×107/0.2ml/只裸鼠的细胞量(活细胞率>90%),经皮下注射于裸鼠左腋下,建立白血病的裸鼠移植瘤模型。接种后第二天开始用药,实验组按实验设计量灌胃,阴性对照组用无菌水灌胃,每只鼠每次灌胃0.4mL,每天用药3次,用药时间为上午8点,14点,20点,连续用药10天。以用药前一天为第0天,每5天测体重及瘤径,做出体重及肿瘤生长动态图(实验结果以mean士SD表示)。第25天解剖取出瘤体称重,以对照组抑瘤率为0,计算出药物作用后的肿瘤抑制率(%)。各组实验数据采用SPSS19.0统计软件中的One-wayANOVA法分析,与对照组比较具有差异显著性。表5BS-FC-308对裸鼠体重的影响表6BS-FC-308对裸鼠KCL-22M移植瘤的影响注:与对照组比较,*为P<0.05图6显示了BS-FC-308对裸鼠体重影响的动态曲线图7显示了BS-FC-308对裸鼠KCL-22M移植瘤体积影响的动态曲线。图8显示了BS-FC-308对裸鼠KCL-22M移植瘤大小的影响。图9显示了BS-FC-308对裸鼠KCL-22M移植瘤重量的影响。图10显示了BS-FC-308对裸鼠KCL-22M移植瘤的抑制作用。如上表和图所示,在体内试验中,本实验检测了BS-FC-308所用剂量30mg/kg/次的剂量下,一天三次的给药能够有效抑制白血病细胞KCL-22M移植瘤的生长,抑瘤率达到74.45%。给药期间,动物体重有降低,显示该化合物对动物有一定的毒副作用,但是停用后,动物体重会有所回升。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1