一种强化丝状真菌蛋白质生产的方法与流程
本发明属于基因工程领域,一种提高丝状真菌生产纤维素酶、半纤维素酶或其它蛋白的方法,涉及5个基因(五个转录因子基因分别为NCU10006、NCU06487、NCU05383、NCU05994、NCU05051),特别是提供脉孢菌属、毁丝霉属宿主。
背景技术:
木质纤维素是自然界中存在最广泛、最丰富的碳水化合物。随着地球资源的快速消耗、环境污染和能源危机的日益加剧,纤维素作为潜力巨大、环境友好的可再生能源成为研究的重点。作为地球上数量最大的可再生资源,纤维素的利用效率却远远低于社会发展的要求,若能将其高效地转化为可利用的能源、食料和化学原料等,势必将会对人类社会的健康发展起到关键作用。要利用这些储量巨大的生物质资源,需要糖化和发酵两个基本步骤。其中,糖化过程中所需要的木质纤维素水解酶(纤维素酶、半纤维素酶等)的生产成本过高已成为制约整个生物炼制产业发展的核心问题,如何高效、廉价的生产这些酶制剂或是如何低成本的将生物质高效地降解为可发酵的单体化合物(葡萄糖、木糖等)、低聚化合物(纤维寡糖、木寡糖等)已成迫切需要解决的问题。
在自然界中,多种微生物都具有降解、利用纤维素的能力,特别是子囊菌和担子菌等丝状真菌可以分泌多种木质纤维素水解酶,与其它微生物相比,其具有完整的纤维素酶系,这种特性使其成为研究纤维素利用和纤维素酶生产过程中的热点。在提高生物质降解效率的研究中,传统诱变技术已经取得了重大进步。尽管纤维素水解酶的产量已经达到100 g/L以上水平,但在整个工艺成本中占有极大比重,不符合工业大规模生产的基本要求。近年来,研究表明丝状真菌木质纤维素水解酶的表达与转录水平密切相关。通过对相关转录因子的表达水平的调控可以大幅提高水解酶的表达水平。此外,丝状真菌是工业蛋白质最主要的生产宿主之一,其具有强大的分泌能力和高等真核细胞中的蛋白质修饰功能,而且具有发酵工艺简单经济等特点。因此,高分泌型宿主和众多强启动子(如纤维素酶CBH I启动子等)使得丝状真菌宿主在生产其它蛋白质具有很大的潜力。专利WO2011151515提供了一种在里氏木霉中通过过表达调节因子来达到提高纤维素酶表达水平的方法。参与木质纤维素水解酶基因表达的这一途径的基因众多,然而目前为止仅有数十个相关转录因子被克隆、鉴定。因此,本领域迫切需要鉴定这一途径中其它关键调控因子,从而开发能够提高纤维素酶等蛋白质生产的技术和方法。
技术实现要素:
本发明的目的是提供一种提高木质纤维素降解及纤维素酶、半纤维素酶表达的方法及其应用。
本发明第一方面,提供了一种提高丝状真菌纤维素酶和/或半纤维酶的表达、和/或提高丝状真菌的纤维素降解活性的方法,包括步骤:
强化丝状真菌的纤维素降解相关锌指转录因子或其基因的表达和/或活性,从而提高丝状真菌纤维素和/或半纤维酶的表达、和/或提高丝状真菌的纤维素降解活性。
在另一优选例中,所述的丝状真菌包括:脉孢菌(Neurospora)、或侧孢霉(Sporotrichum)。
在另一优选例中,所述的丝状真菌还包括曲霉(Aspergillus)、木霉(Trichoderma)、青霉(Penicillium)、镰刀霉(Fusarium)、或毁丝酶(Myceliophthora)。
在另一优选例中,所述纤维素降解相关锌指转录因子包括:
(a)SEQ ID NO: 1、3、5、7、或9所示序列的一种或多种。
在另一优选例中,所述的纤维素降解相关锌指转录因子还包括:
(b)与SEQ ID NO: 1、3、5、7、或9所示序列同源性为50%以上,较佳地为60%以上,更佳地为65%以上的纤维素降解相关锌指转录因子。
在另一优选例中,所述强化包括过表达和/或上调所述的纤维素降解相关锌指转录因子的表达和/或活性。
在另一优选例中,所述的纤维素降解相关锌指转录因子至少包括SEQ ID NO: 1、3、5、7、或9所示序列的一种或多种。
在另一优选例中,所述的丝状真菌为脉胞菌,较佳地,为粗糙脉胞菌。
在另一方面,本发明提供降低一组蛋白质的生产的方法,所述蛋白质为分泌蛋白质,达到在生产例如异源蛋白质时降低不期望得到的副产品的生产。
本发明第二方面,提供了一种用于降解纤维素的工程菌,所述工程菌中纤维素降解相关锌指转录因子被强化表达。
在另一优选例中,所述的工程菌中纤维素降解相关锌指转录因子的表达和/或活性得到提高。
在另一优选例中,所述的“强化表达”指的是与野生型菌株相比,所述工程菌纤维素降解相关锌指转录因子的表达量至少提高了10%,较佳地,至少提高了20-90%,更佳地,至少提高了100-600%。
在另一优选例中,与野生型菌株相比,所述工程菌纤维素酶和/或半纤维素酶的表达量和/或活性至少提高了20%,较佳地,至少提高了50-80%,更佳地,至少提高了100-500%。
在另一优选例中,所述的纤维素降解相关锌指转录因子包括选自SEQ ID NO: 1、3、5、7、或9所示序列的一种或多种。
在另一优选例中,所述工程菌包括改造自以下野生菌的菌株:脉孢菌(Neurospora)、或侧孢霉(Sporotrichum)、曲霉(Aspergillus)、木霉(Trichoderma)、青霉(Penicillium)、镰刀霉(Fusarium)、或毁丝酶(Myceliophthora)。
本发明第三方面,提供了一种生产纤维素酶和/或半纤维素酶的方法,在纤维素原料的存在下,培养本发明第三方面所述的工程菌,并从培养物中分离提纯所述的纤维素酶和/或半纤维素酶。
在另一优选例中,所述的诱导物即纤维素原料包括木质纤维素、结晶纤维素、木聚糖、木质纤维素水解物、木寡糖、纤维寡糖、木糖、或阿拉伯糖。
本发明第四方面,提供了一种降解纤维素并获得纤维素降解产物的方法,在木质素原料的存在下,培养本发明第三方面所述的工程菌,从而降解木质素并获得木质素降解产物。
本发明第五方面,提供了本发明第三方面所述工程菌的用途,用于制备纤维素酶和/或半纤维素酶、和/或用于提高纤维素的降解。
该方法是利用强化锌指转录因子基因表达的微生物菌株降解木质纤维素或是生产纤维素酶、半纤维素酶的方法,所述微生物为脉孢菌(Neurospora)、曲霉(Aspergillus)、木霉(Trichoderma)、青霉(Penicillium)、镰刀霉(Fusarium)或侧孢霉(Sporotrichum)。
所述锌指转录因子基因包括NCU10006、NCU06487、NCU05383、NCU05994和NCU05051,过表达其中的任意转录因子,或突变任意一个转录因子的部分碱基提高其活性。
所述锌指家族转录因子基因NCU10006的核苷酸序列如序列表中序列2所示,编码序列表中序列1所示蛋白;所述锌指家族转录因子基因NCU06487的核苷酸序列如序列表中序列4所示,编码序列表中序列3所示蛋白;所述锌指家族转录因子基因NCU05383的核苷酸序列如序列表中序列6所示,编码序列表中序列5所示蛋白。所述锌指家族转录因子基因NCU05994的核苷酸序列如序列表中序列8所示,编码序列表中序列7所示蛋白。所述锌指家族转录因子基因NCU05051的核苷酸序列如序列表中序列10所示,编码序列表中序列9所示蛋白。
具体的,该方法利用以下任一菌株:以脉孢菌(Neurospora)为出发菌株构建过表达转录因子NCU10006基因的菌株;以脉孢菌(Neurospora)为出发菌株构建过表达转录因子NCU06487基因的菌株;以脉孢菌(Neurospora)为出发菌株构建过表达转录因子NCU05383基因的菌株;以脉孢菌(Neurospora)为出发菌株构建过表达转录因子NCU05994基因的菌株;以脉孢菌(Neurospora)为出发菌株构建过表达转录因子NCU05051基因的菌株。
本发明提供的提高木质纤维素降解和纤维素酶、半纤维素酶表达的方法,是以微生物为出发菌株,过表达其中锌指家族转录因子基因而得到,或是提高任意锌指家族转录因子的活性而得到。所述微生物为脉孢菌(Neurospora)、曲霉(Aspergillus)、木霉(Trichoderma)、青霉(Penicillium)、镰刀霉(Fusarium)或侧孢霉(Sporotrichum)。所述过表达基因是针对锌指家族转录因子基因NCU10006、NCU06487、NCU05383、NCU05994和NCU05051。
本发明方法的应用是广泛的,其为高效表达生产纤维素酶、半纤维素酶或其它蛋白质。其中:
生产纤维素酶的方法,是以木质纤维素、结晶纤维素、经过预处理的木质纤维素、纤维寡糖为诱导物,发酵所述的方法得到纤维素酶。
生产半纤维素酶的方法,是以木质纤维素、木聚糖、经过预处理的木质纤维素、阿拉伯糖、木寡糖、木糖为诱导物,发酵所述方法得到半纤维素酶。
生产其它蛋白的方法,包括将编码蛋白功能片段的基因导入所述受体菌中形成工程菌,再发酵该工程菌生产蛋白的过程。
因此,本发明还涉及这些转录因子基因在构建功能性工程菌中的应用。该应用是将编码蛋白功能片段的基因导入所述的出发菌株中形成的工程菌。
由此形成的高效表达蛋白的工程菌也属于本发明的技术内容。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1:NCU10006和NCU06487过表达菌株在2%微晶纤维素培养基上培养7天,取发酵液上清液,测量蛋白浓度、木聚糖酶活和纤维素内切酶酶活。
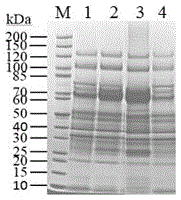
图2:NCU10006和NCU06487过表达菌株在2%微晶纤维素培养基上培养7天,发酵液上清液中蛋白SDS-PAGE分析(1和4为出发菌株,2为TCG-10006,3为TCG-6487)。
图3:NCU05383和NCU05994过表达菌株在2%微晶纤维素培养基上培养4天,取发酵液上清液,测量蛋白浓度、木聚糖酶活和纤维素内切酶酶活。
图4:NCU05383过表达菌株在2%微晶纤维素培养基上培养4天,发酵液上清液中蛋白SDS-PAGE分析。
图5:NCU05994过表达菌株在2%微晶纤维素培养基上培养4天,发酵液上清液中蛋白SDS-PAGE分析。
图6: NCU05051在2%微晶纤维素培养基上培养7天后,取发酵液上清液,测量蛋白浓度、纤维素内切酶酶活以及木聚糖酶活。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,丝状真菌中存在一系列与纤维素降解酶表达调控相关的锌指转录因子。实验证明,当这些锌指转录因子的表达提高时,丝状真菌中的纤维素酶或半纤维素酶的表达量会上升,从而能够提高菌株对木质纤维素的利用,并增强木质纤维素的降解。在此基础上,完成了本发明。
纤维素降解相关锌指转录因子
如本文所用,术语“纤维素降解相关锌指转录因子”、“本发明转录因子”、“本发明锌指蛋白”均指在丝状真菌中属于锌指家族且具有调控(半)纤维素酶表达或活性从而与纤维素降解相关的蛋白或其编码基因。
实验证明,当过表达本发明转录因子后,能够有效地提高丝状真菌中(半)纤维素酶的表达,并进一步提高丝状真菌对木质纤维素的利用从而加强其降解。
优选地,本发明转录因子指的是在脉胞菌中的锌指转录因子,例如,如SEQ ID NO: 1、3、5、7、或9所示序列的一种或多种。编码这些转录因子的核苷酸序列分别如SEQ ID NO: 2、4、6、8、或10所示。
此外,本发明转录因子还包括来自多种丝状真菌的锌指家族的转录因子。例如,所述的丝状真菌包括曲霉、木霉、青霉、镰刀霉或毁丝酶。在这些丝状真菌的转录因子中,可以找到与本发明SEQ ID NO: 1、3、5、7、或9所示序列具有一定同源性的转录因子。优选地,这些转录因子中与本发明SEQ ID NO: 1、3、5、7、或9所示序列同源性大于30%,较佳地大于50%,更佳地大于65%的转录因子与纤维素降解有密切的相关性。
同时,本领域技术人员可以根据本发明在其他丝状真菌中找到同源性较高且与纤维素降解相关的锌指家族转录因子。
过表达基因
通过向真菌宿主中引入另一份或多份拷贝的目标基因,或通过另一个启动子使所述基因的表达增加,或将宿主进行遗传操作使基因表达水平更高或基因产物的活性提高。
纤维素、纤维素酶、半纤维素酶
纤维素是自然界中存在最广泛、最丰富的碳水化合物。多种微生物都具有降解、利用纤维素的能力,其可以分泌多种纤维素水解酶。
纤维素酶是一种多酶体系,由多种组份组成。按底物特异性可将纤维素酶分为以下组分:(1)外切β-1,4-葡萄糖酶(exo-beta-1,4-glucanase,EC.3.2.1.91)简称为外切酶,又称为纤维二糖水解酶(cellobiohydrolases)。纤维二糖水解酶可以水解纤维素结晶区,从纤维素链的非还原端/还原端开始水解并释放纤维二糖。(2)内切β-1,4-葡聚糖酶(endo-beta-1,4-glucanase,EC3.2.1.74)简称内切酶。纤维素内切酶能够在纤维素多糖链上无定形部分随机切断糖苷键,产生新的糖链末端和长度不一的纤维寡糖。(3)β-1,4-葡萄糖苷酶(beta-1,4-glucosidase,EC3.2.1.21)简称纤维二糖酶。纤维二糖水解酶水解可溶性的纤维糊精和纤维二糖生成葡萄糖。(4)其它组分,除了以上三大组分外还有纤维二糖脱氢酶、纤维二糖醌氧化还原酶、磷酸化酶、纤维素酶小体等都会参与纤维素降解过程。
半纤维素具有与纤维素一样的负责结构,其降解需要多种半纤维素酶的共同作用。其中主要有两种:β-1,4-木聚糖酶和β-木糖苷酶。前者从半纤维素主链内部作用于木糖苷键,分解成低聚木糖,后者作用于低聚木糖的末端,释放出单糖。除此之外,降解半纤维素还需要多种侧链裂解酶的共同作用,主要有乙酰木聚糖酯酶、α-葡萄糖醛酸糖苷酶、α-阿拉伯呋喃糖苷酶等。
宿主菌
本发明“宿主菌”、“突变体”可互换使用,均是指将出发菌株中纤维素降解相关锌指转录因子过表达后获得的具有(增强的)降解纤维素活性的工程菌株。其中,本发明宿主菌在改造后,纤维素降解相关锌指转录因子表达显著提高。
本领域技术人员应理解,当获得了锌指转录因子的序列后,可以通过多种常规技术使某出发菌株中的锌指转录因子的表达得到提高。通常,可采用随机整合的方法,采用某标记(或抗性)基因将锌指转录因子基因整合至出发菌株基因组中一个或多个位点上。
应用
通过过表达本发明锌指蛋白,可以人为地提高丝状真菌中(半)纤维素酶的表达量和/或活性,从而增加菌株对纤维素(尤其是木质纤维素)的利用。
例如,当获得了本发明的工程菌后,可以通过加入纤维素原料的诱导,对所述的工程菌进行培养。此时,所述的菌株会分泌纤维素酶和半纤维素酶,对其进行分离并提纯后,就可以获得较纯的纤维素酶和半纤维素酶。
由于产生纤维素酶和半纤维素酶的过程中,纤维素原料受其降解,形成降解产物。因此当进一步对培养物进行分离时,就可以获得纤维素的多种降解产物,例如多种单体化合物:葡萄糖、木糖等。
本发明有益效果
本发明通过改造丝状真菌在纤维素降解的调控因子及调控网络,增强了丝状真菌对纤维素的利用,提高了生物质降解,从而成为能量利用中的新途径。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人, 分子克隆:实验室手册(New York: Cold Spring Harbor Laboratory Press, 1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
本发明所采用的原始出发菌株商购于美国Fungal Genetics Stock Center(FGSC),其余所用材料均为商购。
实施例1 NCU10006和NCU06487过表达菌株的构建
以粗糙脉胞菌组氨酸营养缺陷型菌株(FGSC #6103)(购自FGSC)出发,根据同源重组的原理,将NCU10006的整个开放阅读框(Open Reading Frame, ORF)整合至his-3位点。
开放阅读框特异性引物:
NCU10006F: TCTAGAATGCTGAGCTCACAGAACCCG (SEQ ID NO: 11);
NCU10006R: TTAATTAACGAAGCCAATCGCGCC (SEQ ID NO: 12)
NCU06487F:TCTAGAATGAGTACGACGGCCGCTT (SEQ ID NO: 13)
NCU06487R:TTAATTAAGCTTGGCCCACCTCTTCGT (SEQ ID NO: 14)
扩增NCU10006和NCU06487的开放阅读框;然后分别通过酶切插入质粒pMF272中Xba I和Pac I酶切位点间,得到质粒pMF272-10006和pMF272-6487。将10 µg pMF272-10006电击转化至组氨酸营养缺陷型菌株(FGSC #6103,A),通过平板筛选阳性转化子。提取转化子基因组DNA,以其为模板,利用引物Pccg1-F和NCU10006R或进行扩增,如果可以扩增得到目的片段,则说明目标基因的开放阅读框已整合到基因组中。引物如下所示:
Pccg1-F:GTCCTCCCACCTCCCCAAT (SEQ ID NO: 15)
将10 µg pMF272-6487电击转化至组氨酸营养缺陷型菌株(FGSC #6103,A),通过平板筛选阳性转化子。提取转化子基因组DNA,以其为模板,利用引物Pccg1-F和NCU06487R或进行扩增,如果可以扩增得到目的片段,则说明目标基因的开放阅读框已整合到基因组中。
将上述所获得的转化子与野生型菌株杂交(FGSC #4200,a),将杂交得到的子囊孢子热激(60℃, 45min)后,稀释涂布在平板上,萌发后挑至斜面上,生长7天后,提取基因组,利用PCR进行鉴定,从而获得过表达菌株的纯合子TCG-10006和TCG-6487。
实施例2 NCU05383和NCU05994过表达菌株的构建
NCBI Database搜索粗糙脉胞菌全基因组序列,设计引物扩增组成型强启动子tef片段,以及扩增NCU05383和NCU05994开放阅读框所需引物,引物如下所示:
NCU05383F:GCTCTAGAATGTCCAATCATCATGAGAATCCTG (SEQ ID NO: 16)
NCU05383R:GGACTAGTAACGGGTGCGAAAACCGCAG (SEQ ID NO: 17)
NCU05994F:GCTCTAGAATGTCCGTTCCCAGTGCCGTC (SEQ ID NO: 18)
NCU05994R:GGACTAGTGTCCGCCAGCCCAGCCATTC (SEQ ID NO: 19)
tef-F:GAATGCGGCCGCTCATCAACAGTCGCTTGTCCAC (SEQ ID NO: 20)
tef-R:TGCTCTAGATTTGACGGTTGATGTGCTGACTG (SEQ ID NO: 21)
利用引物tef-F和tef-R扩增粗糙脉孢菌tef启动子片段,将其插入至质粒pMF272的Xba I和Not I酶切位点之间,替换原有ccg-1启动子片段,得到质粒pMF272-tef。扩增NCU05383和NCU05994的开放阅读框;然后分别通过酶切插入质粒pMF272-tef中Xba I和Pac I酶切位点间,得到质粒pMF272-tef-5383和pMF272-tef-5994。
将10 µg 质粒电击转化至组氨酸营养缺陷型菌株(FGSC #6103,A),通过平板筛选阳性转化子。提取转化子基因组DNA,以其为模板,利用引物tef-F /NCU05383R和tef-F /NCU05994R进行扩增,如果可以扩增得到目的片段,则说明目标基因的开放阅读框已整合到基因组中。引物如下所示:
将上述所获得的转化子与野生型菌株杂交(FGSC #4200,a),将杂交得到的子囊孢子热激(60℃, 45min)后,稀释涂布在平板上,萌发后挑至斜面上,生长7天后,提取基因组,利用PCR进行鉴定,从而获得过表达菌株的纯合子TCG-5383和TCG-5994。
实施例3 NCU05051过表达菌株的构建
以粗糙脉胞菌组氨酸营养缺陷型菌株(FGSC #6103)(购自FGSC)出发,根据同源重组的原理,将NCU05051的整个开放阅读框(Open Reading Frame, ORF)整合至his-3位点。
开放阅读框特异性引物:
NCU05051F: TCTAGAATGCTGAGCTCACAGAACCCG (SEQ ID NO: 22);
NCU05051R: CCTTAATTAATTGATAGCCTGGCATCTGAGGGTTG (SEQ ID NO: 23)
扩增NCU05051的开放阅读框;然后分别通过酶切插入质粒pMF272中Xba I和Pac I酶切位点间,得到质粒pMF272-5051。将10 µg pMF272-5051电击转化至组氨酸营养缺陷型菌株(FGSC #6103,A),通过平板筛选阳性转化子。提取转化子基因组DNA,以其为模板,利用引物Pccg1-F和NCU05051R或进行扩增,如果可以扩增得到目的片段,则说明目标基因的开放阅读框已整合到基因组中。引物如下所示:
Pccg1-F:GTCCTCCCACCTCCCCAAT (SEQ ID NO: 15)
将上述所获得的转化子与野生型菌株杂交(FGSC #4200,a),将杂交得到的子囊孢子热激(60 ℃,45 min)后,稀释涂布在平板上,萌发后挑至斜面上,生长7天后,提取基因组,利用PCR进行鉴定,从而获得过表达菌株的纯合子TCG-5051。
实施例4过表达菌株产纤维素酶、半纤维素酶实验
转录因子工程菌和野生型粗糙脉孢菌分别在2%结晶纤维素培养基上培养7天,取培养基上清,离心后进行一系列验证试验。
4.1 方法:
4.1.1 蛋白浓度测定:
1. 标准蛋白溶液蛋白标准曲线制定:于1 mL去离子水中加入10 mg牛血清蛋白,得到10 mg/mL 标准贮液。以标准贮液稀释浓度为0.2 mg/mL,0.4 mg/mL,0.6 mg/mL,0.8 mg/mL,1.0 mg/mL,1.2 mg/mL 的标准蛋白溶液,取20 µL标准蛋白溶液于1 mL Bradford 溶液中,混匀,室温静置5 min,测其OD595,得到纵坐标值,作为横坐标值为BSA标准蛋白溶液浓度,以此制作标准曲线。
2. 待测蛋白溶液准备:吸取丝状真菌发酵不同时间的发酵液于1.5 mL离心管,14000 rpm离心5 min,取上清置于新离心管中。
3. 蛋白浓度测定:1 mL Bradford中加入上述20 µL发酵液,对照为1 mL Bradford加入20 µL超纯水。上下颠倒混匀后静置反应5 min,在OD595条件下测定吸光度值。
4.1.2 CMCase(内切β-1,4-葡聚糖酶)酶活测定方法:
1. 反应酶液准备:根据蛋白浓度测定值,待测定发酵酶液以0.1 M pH 4.6醋酸钠缓冲液稀释至合适范围。
2. 酶液与底物反应:0.2 mL稀释的发酵液酶液与0.2 mL AZO-CMC底物分别于45 ℃预热5 min。
3. 酶液与AZO-CMC底物混匀,45 ℃条件下水浴10 min,取1 mL沉淀剂,剧烈震荡10 s终止酶和底物的反应,常温静置10 min,振荡混匀,常温下1000 g离心10 min。
4. 取上清于比色皿中OD590测定吸光度值Abs。空白对照采用灭活的发酵酶液。
5. 内切β-1,4-葡聚糖酶酶活(U/mL)计算公式: Units/mL=milli U/assay=(412.5×Abs-6)×2×1/1000×N
4.1.3 XYLANase(木聚糖酶)酶活测定方法:
1. 反应酶液准备:根据蛋白浓度测定值,待测定发酵酶液以0.1 M pH 4.6醋酸钠缓冲液稀释至合适范围。
2. 酶液与底物反应:0.2 mL稀释的发酵液酶液与0.2 mL AZO-XYLAN底物分别于45 ℃预热5 min,酶液与AZO-XYLAN底物混匀,45 ℃温度下反应10 min。
3. 取1 mL无水乙醇于上述离心管,剧烈振荡10 s终止酶和底物的反应,室温静置5 min,振荡混匀,常温下1500 g离心10 min。
4. 取上清于比色皿中OD590测定吸光度值Abs。空白对照采用灭活的发酵酶液。
5. 木聚糖酶酶活(U/mL)计算公式: Units/ml= milli U/assay=(66.6×Abs2+105×Abs+3.9)×2×1/1000×N。
4.1.4 蛋白质SDS-PAGE实验:
实验中所用的蛋白预制胶均购自Life technologies公司,样品制备操作如下:等体积上样量(60 µL体系)蛋白电泳中所有样品都取相同体积,NuPAGE RLDS Sample Buffer添加15 µL,NuPAGE Reducing Agent添加6 µL,剩余体积用超纯水补齐。混匀后的蛋白上样液体置于70 ℃条件下10 min。
1×SDS Runing Buffer电泳缓冲液配置如下:取50 mL NuPAGERMES Running Buffer 于950 mL超纯水中混合均匀,向电泳槽中加入600 mL电泳缓冲液,取200 mL电泳缓冲液中加入500 µL NuPAGERAntioxidant,混合均匀后加入上层电泳槽中。上样完成后采用电压200V,电泳45 min。
上述使用蛋白胶快速染色液考马斯亮蓝购自Solarbio公司,具体染色方法如下:
(1)溶液B 100 mL,与溶液A 2 mL充分混匀,染色液制备完成。
(2)将电泳完成后的蛋白胶置于容器中,加入100 mL超纯水微波加热至沸腾1 min,脱色摇床放振荡5 min,弃液体。
(3)用双蒸水轻轻冲洗两次,加入适量染色液,微波至沸腾后持续1 min,脱色摇床振荡5 min。弃染色液。
(4)双蒸水冲洗两次,加入50 mL双蒸水加热至沸腾1 min,置脱色摇床上振荡10 min,弃液体,用双蒸水冲洗两次,再加入双蒸水,置脱色摇床上振荡过夜。
(5)蛋白胶置于凝胶成像仪中白光观察,拍照。
4.2 结果:
在2%结晶纤维素条件下培养7天,Pc-10006过表达菌株TCG-10006培养基上清液中的蛋白浓度、纤维素酶酶活以及木聚糖酶酶活显著提高,分别为出发菌株的2.4倍、1.5倍和1.7倍(图1)。而Pc-6487过表达菌株TCG-6487培养基上清液中的蛋白浓度、纤维素酶酶活及木聚糖酶活也显著升高,分别为出发菌株的1.8倍、1.2倍和1.7倍(图1)。SDS-PAGE分析显示,过表达菌株与出发菌株相比,蛋白条带有所加深,尤其是72 kDa左右的纤维素酶CBH I和CBH II条带变化最为明显(图2)。
NCU05383过表达菌株TCG-5383和NCU05994过表达菌株TCG-5994的摇瓶发酵实验表明,在以2%结晶纤维素为碳源的条件下发酵4天后,其发酵液中蛋白含量分别提高了85%和120%。与出发菌株相比,TCG-5383和TCG-5994的纤维素酶酶活分别提高了90%和105%,并且其木聚糖酶活分别提高了150%和200%(图3)。SDS-PAGE分析也证实了这一现象,与出发菌株相比,过表达菌株在72 KD处外切纤维素酶CBH I和CBH II的条带加深(图4-图5)。
另外,在2%结晶纤维素条件下培养7天,与出发菌株相比较,NCU05051过表达菌株TCG-5051培养基上清液中的蛋白浓度和纤维素酶酶活分别提高了20%和80%,而木聚糖酶酶活显则无明显差异(图6)。
此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!