用于预防和治疗出血的半衰期延长的因子FVIIA以及为此的给药方案的制作方法
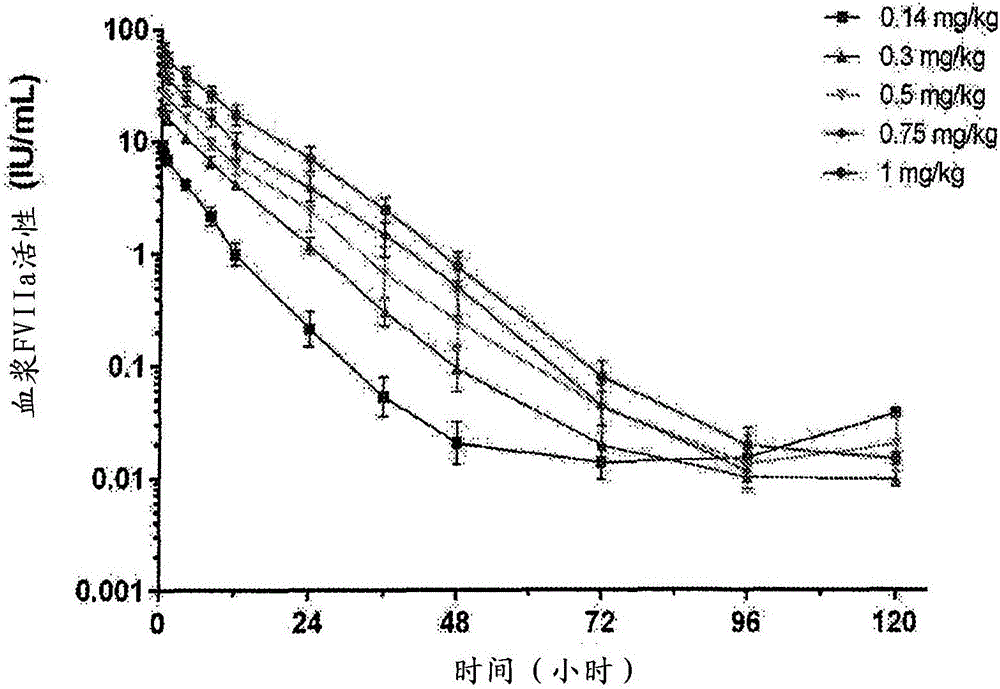
本申请要求2014年4月11日提交的美国专利申请No.61/978218,2014年5月9日提交的欧洲专利申请No.14167612.2和2014年5月15日提交的欧洲专利申请No.14168389.6的优先权。序列表本申请提交了电子形式的序列表。所述序列表的完整内容在此通过引用并入。发明领域本发明涉及用半衰期延长的因子VIIa(FVIIa)用于出血的预防性和“按需”治疗以及用于预防先天性或后天性出血障碍的患者在手术中或手术后的出血发作的给药方案。本发明进一步涉及半衰期延长的FVIIa用于治疗或预防没有出血障碍的患者在出血发作(即,由于外伤或手术引起的)下的失血的用途。本发明的另一个方面是后天性血友病的治疗。发明背景血友病A是遗传性凝血障碍。其是由凝血因子VIII的染色体X染色体连锁缺陷引起的,并且几乎专门影响男性,每10,000人中有一到两个个体的发病率。X-染色体缺陷由自身在临床上无症状的女性携带者传递。血友病A的临床表现是增高的出血趋势。在引入使用因子VIII浓缩物的替代治疗前,严重血友病的人的平均寿命少于20年。从血浆产生的因子VIII的浓缩物以及后来的重组形式的因子VIII的使用显著改善了血友病患者的状况,显著延长了平均寿命并且使大部分人可以或多或少地正常生活。发病率比血友病A低5倍的血友病B由无功能或缺失的因子IX引起并且用来自血浆的因子IX浓缩物或重组形式的因子IX治疗。血友病的治疗目标是治疗或预防出血,由此降低失能关节和组织损伤,并且提高生活质量(QoL)。在血友病A和血友病B中,治疗该疾病中最严重的医学问题是针对替代因子的抑制性自身抗体的产生。所有血友病A患者中高达30%产生因子VIII的抑制性抗体。因子IX的抑制性抗体较低程度地产生,但具有更严重的结果,因为他们对免疫耐受性诱导治疗不太易感并且当结合FIX时具有更高的引发过敏反应的潜能。对已经产生了FVIII或FIX的抑制性抗体(具有抑制剂的先天性血友病,CHwI)的血友病A(FVIII缺陷)或血友病B(FIX缺陷)的患者的治疗是具有挑战性的,因为使用因子VIII或IX的正常替代是无效的。导致抑制因子VIII或FIX活性或功能的自身抗体形成的因子VIII或因子IX的另一种免疫反应分别称为后天性血友病A或后天性血友病B。这种病症通常发生在不具有因子VIII或因子IX的任何缺陷的患者中。后天性血友病是罕见的病症,每年的发病率为每百万人群0.2-1.0。大部分病例是由于因子VIII的自身抗体引起的,只报道了少数后天性血友病B的病例。自身抗体主要是IgG4抗体,其结合凝血因子并且部分或完全地中和其活化或功能或加速其清除。这导致了高比例的患病人群中的致命性出血。常见的出血部位是皮肤、粘膜、肌肉和腹膜后腔,与遗传性血友病的患者形成对照,他们主要出血到关节和肌肉中。与CHwI相似,可以用激活的凝血酶原复合物浓缩物或重组激活的因子VII(NovoNordisk)治疗获得性血友病以控制出血发作。目前的凝血模型表明凝血的生理触发器是TF表达细胞表面上组织因子(TF)和因子VIIa(FVIIa)之间的复合物的形成,其通常位于脉管系统外部。这导致因子IX和因子X的激活,最终产生一些凝血酶。在正反馈环中,凝血酶激活因子VIII和因子IX,即所谓的凝血级联的“内在”臂,因此扩大了因子Xa的产生,这是产生全凝血酶爆发以获得完全的止血所必需的。显示了通过给药超生理浓度的因子VIIa,绕过对因子VIIIa和因子IXa的需求获得了止血。因子VII的cDNA的克隆(US4,784,950)使得研发激活的因子VII作为药物成为可能。在1988年,因子VIIa首次成功给药。FVII是单链糖蛋白,具有约50kDa的分子量,其由肝细胞分泌至血流中,作为406个氨基酸的无活性酶原。其含有10个定位于该蛋白质的N-末端Gla结构域中的γ-羧基-低谷期氨酸残基(位置6、7、14、16、19、20、25、26、29和35)。Gla残基需要维生素K用于其生物合成。位于Gla结构域C-末端的是两个表皮生长因子结构域,接着是胰岛素-型丝氨酸蛋白酶结构域。FVII的更多翻译后修饰包括羟基化(Asp63)、N-(Asn145和Asn322)以及O-型糖基化(Ser52和Ser60)。FVII通过Arg152-Ile153的单个肽键的蛋白水解转化成活性形式的因子VIIa,导致两条肽链,即N-末端轻链(24kDa)和C-末端重链(28kDa)的形成,这两条链由一个二硫桥连接在一起。与其他维生素K依赖性凝血因子形成对照,已经针对FVII描述了无激活肽,其在这些其他维生素K依赖性凝血因子激活过程中被切割掉。Arg152-Ile153切割位点和一些氨基酸下游显示出与其他维生素K依赖性多肽的激活切割位点的同源性。获得因子VIIa的活性构象所必需的是Ile153和Asp343之间的激活切割后盐桥的形成。通过因子Xa、因子XIIa、因子IXa、因子VIIa、因子七激活蛋白酶(FSAP)和凝血酶,可以在体外获得因子VII的激活切割。Mollerup等,1995(Biotechnol.Bioeng.48:501-505)报道了在Arg290和或Arg315重链中也发生一些切割。(NovoNordisk)是美国和欧洲都批准治疗CHwI中的出血的重组因子VIIa产品(AuerswaldG和MorfiniM,2010,JCD;2:(1):1-8)。然而,具有非常短的半衰期(非出血状态下2.89小时,和出血发作下2.30小时),因此推荐在急性出血发作的初始治疗过程中以2小时的间隔注射rFVIIa(BrackmannH-H等,2000(BloodCoagulationandFibrinolysis(凝血和纤维蛋白溶解),11(增补1):S39-S44)。rFVIIa的临床使用已经受到其极短的半衰期的阻碍。对频繁静脉内(IV)注射的需求给患者和治疗其疾病的医生带来明显的负担。尤其是在年幼的儿童中,这样的治疗方案常常(但不总是)需要静脉输液装置的插入,所述装置必须保持非常干净,以避免传染性并发症和防止管线中血凝块的产生。与这样的装置相关的风险和发病率可能阻止一些非常小的患有CHwI的儿童接受适当的护理。存在几种使用rFVIIa作为用于CHwI的预防剂的尝试(BiancoRP等,2010.Medicina(BuenosAires).70:209-214;AuerswaldG和MorfiniM,2010.JCD.2(1):1-8)。具有延长的半衰期和更好的治愈率的FVIIa产品将允许患者使用较少的注射来获得适当的止血。预防的许多益处之一是降低的关节出血的年数量,和因此,降低的严重性关节病的发病率。已经进行了各种研究来提供半衰期延长形式的FVIIa(参见WO2004/101740、WO2007/090584、WO2007/022512、WO2010/091122和WO2011/092242)。WO2007/090584涉及因子VII和因子VIIa白蛋白相关联的多肽。这些白蛋白融合体显示出保留了因子VII/FVIIa生物活性并且在体内呈现出因子VII/VIIa的功能性血浆半衰期的明显延长。US2014/0004095还涉及FVIIa-白蛋白融合蛋白。LjungR等2013(JournalofThrombosisandHaemostasis.11:1260-1268)显示出多剂量的40K糖PEG化重组因子VIIa(rFVIIa)旁绕剂(bypassingagent)(N7-FP),与rFVIIa相比具有延长的半衰期,在CHwI患者中充分耐受,并且观察到没有严重的不良影响。然而,尽管看到了出血发作数量的整体下降,但是没有剂量响应关系能够被确定,即,高剂量的功效不能与最低剂量区分,并且出血发作在所有测试的剂量继续出现。因此,中止了在抑制剂患者的预防中N7-GP的临床研发。MahlanguJN等,2012(JournalofThrombosisandHaemostasis.10:773-780)发表了为了高促凝血活性和较长作用研发的单剂量变体人重组因子VIIa变体(BAY86-6150)显示出在具有或不具有抑制剂的患有中等或严重血友病A或B的非出血性男性中没有安全性问题。BAY86-6150的半衰期是5-7小时,比rFVIIa的半衰期长。然而,由于在试验中检测到了针对变体rFVIIa的中和抗体,中止了II/III期试验。FVIIa多肽也可以用作治疗与具有正常凝血系统的受试者中的围手术期和外伤性失血相关的出血的治疗剂。例如,可以将FVIIa给药于患者,以促进凝血和降低与外伤和手术相关的失血,并且进一步降低对输血的需求。FVIIa多肽还可以用于促进具有作为外伤性损伤结果的出血的受试者的凝血和防止失血。这些患者可以具有或不具有遗传性或后天性血友病。然而,评价rFVIIa作为指引严重外伤中的止血的佐剂的功效和安全性的3期临床试验早期就被终止了(HauserCJ等,2010.TheJournalofInjury,Infection,andCriticalCare(受伤、感染和临床护理),69(3):489-500)。持续需要使用半衰期延长的FVIIa变体的有效给药方案,并且特别地,使用这样的变体的预防性给药方案将是非常有利的。本发明涉及使用包含FVIIa部分和半衰期增强部分(HLEM)的半衰期延长的因子VIIa(FVIIa)(例如,rFVIIa-白蛋白)的给药方案,用于预防受试者出血(“预防性治疗”)、治疗受试者出血发作(“按需治疗”),包括外伤后,以及预防具有或不具有先天性或获得性出血障碍的患者在手术中或手术后的出血发作。特别地,本发明涉及使用半衰期延长的FVIIa的预防性治疗。这样的预防性治疗可减轻患者的不适并且降低需要向医学专业人员就诊的数量。这些优势将正面地影响患者顺从性并且因此正面地影响用于血友病的预防性治疗的有效性。有效的预防可以导致降低的关节出血的年数量,和因此,降低的严重性关节病的发病率和/或延迟其发作。发明概述本发明的一个重要方面是提供使用半衰期延长的FVIIa蛋白的预防性治疗出血的方案。本发明涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于预防受试者出血(“预防性治疗”)的方法中,其中要将半衰期延长的FVIIa蛋白以导致至少约30IU/ml血液的Cmax的剂量、以至少每天一次的给药间隔给药于受试者,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-160IU/ml血液的Cmax。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约35-130IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约40-105IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约46-92IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-70IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约36-56IU/ml血液的Cmax。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约41-51IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约70-110IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约80-105IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约82-102IU/ml血液的Cmax。在再另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约87-97IU/ml血液的Cmax。本发明还涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于预防受试者出血(“预防性治疗”)的方法中,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约200-800μg/kg,以每天至少一次的给药间隔给药。在优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约300-700μg/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约320-650μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约310-330μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约630-650μg/kg。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于预防受试者出血(“预防性治疗”)的方法中,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1750-8000IU/kg,以每天至少一次的给药间隔给药,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1800-7000IU/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2500-6500IU/kg。在进一步优选的实施方案中,FVIIa部分的剂量为约3200-5800IU/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2800-3200IU/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约5800-6200IU/kg。在以上实施方案中的任一个中,给药间隔可以为约每1至5天一次,包括每1至4天一次,1至3天一次,优选,约每2至4天一次或约每2至3天一次。给药间隔最优选约每隔每天一次(即,每2天一次)。在以上实施方案中,方法优选涉及预防性给药方案。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于治疗受试者出血发作(“按需治疗”)的方法中,其中要将半衰期延长的FVIIa蛋白以导致至少约30IU/ml血液的Cmax的剂量给药于受试者,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-160IU/ml血液的Cmax。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约35-130IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约40-105IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约46-92IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-70IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约36-56IU/ml血液的Cmax。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约41-51IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约70-110IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约80-105IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约82-102IU/ml血液的Cmax。在再另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约87-97IU/ml血液的Cmax。在优选实施方案中,第一次给药导致至少30%患者的出血终止。任选地,半衰期延长的FVIIa蛋白的第二次给药以等于第一次剂量的剂量给药于受试者,以约5-10小时给药间隔来给药。给药间隔优选约6-8小时。在优选实施方案中,第二次给药导致至少60%患者的出血终止。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于治疗受试者出血发作(“按需治疗”)的方法中,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约200-800μg/kg。在优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约300-700μg/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约320-650μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约310-330μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约630-650μg/kg。在优选实施方案中,第一次给药导致至少30%患者的出血终止。任选地,半衰期延长的FVIIa蛋白的第二次给药以等于第一次剂量的剂量给药于受试者,以约5-10小时给药间隔来给药。给药间隔优选约6-8小时。在优选实施方案中,第二次给药导致至少60%患者的出血终止。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于治疗受试者出血发作(“按需治疗”)的方法中,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1750-8000IU/kg,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1800-7000IU/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2500-6500IU/kg。在进一步优选的实施方案中,FVIIa部分的剂量为约3200-5800IU/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2800-3200IU/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约5800-6200IU/kg。在优选实施方案中,第一次给药导致至少30%患者的出血终止。任选地,半衰期延长的FVIIa蛋白的第二次给药以等于第一次剂量的剂量给药于受试者,以约5-10小时给药间隔来给药。给药间隔优选约6-8小时。在优选实施方案中,第二次给药导致至少60%患者的出血终止。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于治疗受试者出血发作的方法中,其中要将半衰期延长的FVIIa蛋白以导致至少约30IU/ml血液的Cmax的剂量给药于受试者,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-160IU/ml血液的Cmax。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约35-130IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约40-105IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约46-92IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-70IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约36-56IU/ml血液的Cmax。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约41-51IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约70-110IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约80-105IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约82-102IU/ml血液的Cmax。在再另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约87-97IU/ml血液的Cmax。在优选实施方案中,第一次给药导致给药后24小时内红细胞(RBC)和/或新鲜冷冻血浆(FFP)的输血需求降低至少20%。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于治疗受试者出血发作的方法中,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约200-800μg/kg。在优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约300-700μg/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约320-650μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约310-330μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约630-650μg/kg。在优选实施方案中,第一次给药导致给药后24小时内的输血需求(RBC和/或FFP)降低至少20%。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于治疗受试者出血发作的方法中,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1750-8000IU/kg,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1800-7000IU/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2500-6500IU/kg。在进一步优选的实施方案中,FVIIa部分的剂量为约3200-5800IU/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2800-3200IU/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约5800-6200IU/kg。在优选实施方案中,第一次给药导致给药后24小时内的输血需求(RBC和/或FFP)降低至少20%。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于预防手术中或手术后受试者的出血发作的方法中,其中在手术前、手术中和/或手术后,将半衰期延长的FVIIa蛋白以导致至少约30IU/ml血液的Cmax的剂量给药于受试者,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-160IU/ml血液的Cmax。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约35-130IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约40-105IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约46-92IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-70IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约36-56IU/ml血液的Cmax。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约41-51IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约70-110IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约80-105IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约82-102IU/ml血液的Cmax。在再另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约87-97IU/ml血液的Cmax。半衰期延长的FVIIa蛋白可以以等于第一次剂量的剂量再次给药于受试者,以约5-10小时,优选约6-8小时的给药间隔来给药。或者,半衰期延长的FVIIa蛋白可以在手术过程中以持续输注来使用。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于预防手术中或手术后受试者的出血发作的方法中,其中在手术前、手术中和/或手术后,要将半衰期延长的FVIIa蛋白给药于受试者,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约200-800μg/kg。在优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约300-700μg/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约320-650μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约310-330μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约630-650μg/kg。半衰期延长的FVIIa蛋白可以以等于第一次剂量的剂量再次给药于受试者,以约5-10小时,优选约6-8小时的给药间隔来给药。或者,半衰期延长的FVIIa蛋白可以在手术过程中以持续输注来使用。本发明进一步涉及半衰期延长的FVIIa蛋白,包含a)因子VIIa(FVIIa)部分,和b)半衰期增强部分(HLEM)用于预防手术过程中或手术后受试者的出血发作的方法中,其中在手术前、手术中和/或手术后,要将半衰期延长的FVIIa蛋白给药于受试者,其中待给药于受试者的所述半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1750-8000IU/kg,其中使用测定法测定活性(IU)。在优选实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1800-7000IU/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2500-6500IU/kg。在进一步优选的实施方案中,FVIIa部分的剂量为约3200-5800IU/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2800-3200IU/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约5800-6200IU/kg。半衰期延长的FVIIa蛋白可以以等于第一次剂量的剂量再次给药于受试者,以约5-10小时,优选约6-8小时的给药间隔来给药。或者,半衰期延长的FVIIa蛋白可以在手术过程中以持续输注来使用。在优选实施方案中,在整个给药间隔中,止血潜能维持在高于基线至少约1%,优选至少约2%的低谷期,并且更优选在整个给药间隔中,高于基线5至15%。本发明的半衰期延长的FVIIa蛋白优选具有大于约5小时的半衰期。在以上实施方案中的任一个中,半衰期增强部分(HLEM)可以是聚亚烷基二醇部分,优选PEG。或者,半衰期增强部分(HLEM)是半衰期增强多肽(HLEP)。在一个实施方案中,半衰期增强多肽(HLEP)是羧基末端肽(CTP)。在另一个实施方案中,半衰期增强多肽(HLEP)是FcRn结合伴侣。优选,半衰期增强多肽(HLEP)FcRn结合伴侣是白蛋白或不具有抗原结合结构域(例如,Fc)的免疫球蛋白。最优选,半衰期增强多肽(HLEP)是白蛋白。在这个实施方案中,半衰期延长的FVIIa蛋白的剂量为至少约500μg/kg。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约500-2500μg/kg。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约750-2000μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1000-1500μg/kg。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1100-1600μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1200-1500μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1300-1500μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1400-1500μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量为约740-760μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量为约1490-1510μg/kg。对于用于预防受试者出血(“预防性治疗”)的方法中,给药间隔可以为约每1至5天一次,包括每1至4天一次,每1至3天一次,优选约每2至4天一次或约每2至3天一次,最优选约每隔每天一次(即,每2天一次)。对于用于治疗受试者出血发作(“按需治疗”)的方法中,半衰期延长的FVIIa蛋白的第二次给药可以以等于第一次剂量的剂量给药于受试者,以约5-10小时,优选约6-8小时的给药间隔来给药。对于用于预防手术中或手术后受试者的出血发作的方法中,半衰期延长的FVIIa蛋白可以以等于第一次剂量的剂量再次给药于受试者,以约5-10小时,优选约6-8小时的给药间隔来给药。如以上讨论的,对于FVIIa变体的给药,延长治疗间隔特别有利。因此,在另一个方面中,本发明涉及半衰期延长的因子VIIa(FVIIa)蛋白,包含a)FVIIa部分,和b)半衰期增强多肽(HLEP)用于以约每2至4天的给药间隔预防受试者出血的方法中。在一个实施方案中,半衰期增强多肽(HLEP)是羧基末端肽(CTP)。在另一个实施方案中,半衰期增强多肽(HLEP)是FcRn结合伴侣、优选,半衰期增强多肽(HLEP)FcRn结合伴侣是白蛋白或不具有抗原结合结构域(例如,Fc)的免疫球蛋白。在更优选的实施方案中,半衰期增强多肽(HLEP)是白蛋白。给药间隔可以为约每1至5天一次,包括每1至4天一次,每1至3天一次。优选,延长的给药间隔为约2至4天一次或每2至3天一次。给药间隔最优选为每隔每天一次(即,每2天一次)。在这个实施方案中,所述方法优选涉及预防性给药方案。对于本发明的目的,给药半衰期延长的FVIIa蛋白的优选受试者是人。特别优选的是患有血友病A或血友病B的人,并且尤其是已经产生了针对FVIII和/或FIX的抑制剂(抗体)的血友病A或血友病B患者(即,具有抑制剂的先天性血友病,CHwI)。在另一个优选实施方案中,人患有获得性血友病。获得性血友病可以是获得性血友病A或B。在再另一个实施方案中,人患有遗传性因子VII缺陷。在特别优选的实施方案中,静脉内给药所述剂量。在本发明的任一个治疗方法中,受试者优选具有针对FVIII和/或FIX的抑制性抗体。受试者优选患有具有抑制剂的先天性白血病(CHwI)。根据本发明的半衰期延长的FVIIa的使用在这样的患者中特别有利。值得注意的是,在外伤的治疗中,不需要受试者具有先天性或获得性出血障碍。关于治疗外伤,本发明涉及将半衰期延长的FVIIa蛋白给药于不具有预先存在的出血障碍的患者,如车祸受害者或战争中受伤的士兵。本发明半衰期延长的FVIIa蛋白具有SEQIDNO:1中所列的序列。FVII激活成FVIIa时(分子仍然由二硫桥连接在一起),粗体序列中下划线的氨基酸序列RI在氨基酸R后切割。FVIIa部分(粗体)接着是SSGGSGGSGGSGGSGGSGGSGGSGGSGGSGS(其是31个aa弹性衔接物),其后是从DAHHK至人白蛋白的C末端(全长)。或者,融合蛋白的序列与SEQIDNO:1所列序列具有至少70%同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少75%同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少80%百分比同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少85%百分比同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少90%百分比同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少95%百分比同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少98%百分比同一性。融合蛋白的序列可以与SEQIDNO:1所列序列具有至少99%百分比同一性。附图描述图1:CONSORT图,显示了整个研究中研究参与者的流动和分配。图2:显示了每个剂量组接受了rVIIa-FP的受试者中基线校正的FVIIa血浆水平的图。图3:用于血液稀释、治疗、实验性肾外伤和止血作用评价的研究程序。缩写:HES,羟乙基淀粉;rVIIa-FP(CSL689(SEQIDNO:1)),具有人白蛋白的融合蛋白连接激活的因子VIIa;rFVIIa激活的重组因子VII。图4:用盐水(正对照)、CSL689(SEQIDNO:1)(rVIIa-FP)或(rFVIIa)治疗后,血液稀释的兔子中标准化肾损伤后的总失血。图5:用盐水(正对照)、CSL689(SEQIDNO:1)(rVIIa-FP)或(rFVIIa)治疗后,血液稀释的兔子中标准化肾损伤后的止血时间。发明详述本发明提供针对半衰期延长的FVIIa蛋白的预防性、“按需”和手术给药方案,所述蛋白优选包括HLEP白蛋白,其中因子VIIa(FVIIa)部分通过31个氨基酸多甘氨酸-丝氨酸(GS)不可切割的肽衔接物连接白蛋白。给药间隔可以为至少每天一次,如每隔每天一次,但也可以实现比之前设想的更长时间段的预防性给药,如每3、4或5天一次。与其他已知FVIIa产品相比,半衰期延长的FVIIa蛋白(例如,rVIIa-白蛋白)的较长半衰期和延长的生物活性令人惊讶地允许使用显著长于现有技术针对rFVIIa(例如,)建议的给药间隔来预防性地治疗血友病。CSL689(SEQIDNO:1)(在本文中也称为“rVIIa-白蛋白”或“rVIIa-FP”)是由通过31个氨基酸多甘氨酸-丝氨酸(GS)衔接物肽连接人白蛋白的活性形式(FVIIa)的人凝血因子VII(FVII)组成的纯化重组蛋白。与一些其他已经评价的分子不同,没有交换氨基酸来提高功效或延长FVIIa的半衰期,使得其基本上是通过不可切割的衔接物与人白蛋白融合的野生型FVIIa。I期研究已经完成,其在用华法令抗凝的健康成年男性受试者中检测了单剂量的CSL689(GolorG等,2013.JournalofThrombosisandHaemostasis.11:1977-1985)。结果证明FVIIa的半衰期和生物活性都延长了。具有6.1至9.7小时的延长的半衰期(提高了3-4倍)。本发明的技术优势是半衰期延长的FVIIa蛋白(例如,rVIIa-白蛋白/rVIIa-FP)具有比其他已知的FVIIa产品更长的半衰期和延长的生物活性。这令人惊讶地允许使用显著长于现有技术针对rFVIIa建议的给药间隔来预防和治疗血友病。需要较低频率的给药在患者中获得相同的FVIIa峰和低谷期活性水平。在优选实施方案中,在整个给药间隔中,止血潜能维持在高于基线至少约0.5%,或至少约1%,或至少约2%,或至少约3%,或至少约4%的低谷期,优选在整个给药间隔中,高于基线5至15%。外伤后,半衰期延长的FVIIa提高的特性与rFVIIa相比,还提高了“按需治疗”的功效。这些患者可能具有或不具有先天性或获得性出血障碍。通过在外伤的兔子模型中的实验证明了这种优势(参见实施例3)。半衰期延长的FVIIa提高的特性与rFVIIa相比,还提高了获得性血友病治疗的功效。这通过猴子模型中的实验得到了支持(参见实施例4)。本文中提供的半衰期延长的FVIIa蛋白可以在外伤后给药或以更高的功效、更低的剂量、更低的频率和/或较低可能的不良反应用于治疗获得性血友病。定义如本文中使用的,“预防性治疗”,表示在一定的时间过程中,给药多剂量的半衰期延长的因子VIIa蛋白,以提高受试者血浆中因子VIIa活性的水平。优选,提高的水平足以降低自发性出血的发病率或预防意外损伤情况下的出血。预防性治疗降低或防止了出血发作,例如,按需治疗下描述的那些。预防性治疗可以是固定的或可以是个别化的,如“给药间隔”下讨论的,以补偿患者间的可变性。从使用>1IU/dl(>1%)的凝血因子水平调节血友病患者很少经历自发性出血和具有好得多的关节功能的保持的观察来设想预防。因此,为了防止出血和关节损伤,治疗的目的是保持正常的肌肉骨骼功能(GUIDELINESFORTHEMANAGEMENTOFHEMOPHILIA(血友病控制指南),第2版,由治疗指南工作小组(TreatmentGuidelinesWorkingGroup)制备,代表世界血友病联合会(WFH))。应当对应于整个治疗期间高于1%的止血潜能来维持患者中使用FVIIa活性的预防。高于1%的止血潜能是参照缺失或功能上缺陷的凝血因子或针对其存在抑制性抗体的凝血因子的健康人的正常水平。如本发明中使用的,1%的功能性FVIII或功能性FIX的残留水平或患者中99%的正常FVIII或正常FIX活性被抑制性抗体的抑制对应于1%止血潜能。如本文中使用的,“按需治疗”,表示给药半衰期延长的因子VIIa蛋白,来控制受试者的出血发作。出血发作可以是自发产生的或可以是外伤的结果。受试者可以具有或不具有先天性或获得性出血障碍。优选,给药的半衰期延长的因子VIIa蛋白足以降低出血。可能需要剂量等于第一次给药的第二次给药或多次给药来控制出血。按需治疗可以是固定的或可以是个别化的,如“给药间隔”下讨论的,以补偿患者间的可变性。如本文中使用的,“给药间隔”,表示待给药于受试者的多个剂量之间经过的时间量。使用嵌合FVIIa-HLEM(例如,FVIIa-HLEP)的本发明的方法中的给药间隔可以比等量(以IU/kg计)的没有HLEM(例如,白蛋白)的所述因子VIIa(即,由所述FVIIa组成的多肽)需要的给药间隔长至少约一倍和一倍半至八倍。给药时,例如,本发明的半衰期延长的因子VIIa蛋白(例如,rVIIa-白蛋白/rVIIa-FP)的给药间隔可以比等量的没有HLEM(例如,白蛋白)的所述因子VIIa需要的给药间隔长至少约一倍和一倍半至八倍。给药间隔可以为至少每天一次,约每1至5天一次,约每1至4天一次,约每1至3天一次,优选约每2至4天一次或约每2至3天一次。特别地,考虑每隔一天(即,每2天一次)的给药间隔。或者,给药间隔可以是基于药物动力学数据或关于受试者的其他信息针对每位受试者测定的个体化间隔。个体化剂量/给药间隔组合可以与之前段落中针对固定间隔方案的那些相同,或可以不同。所述方案可以最初是固定的给药间隔,然后可以变成个体化的给药间隔。所述方案可以最初是固定剂量(例如,IU/kg或μg/kg)和给药间隔,然后可以变成使用固定剂量的个体化给药间隔。所述方案可以最初是固定的给药间隔和剂量(例如,IU/kg或μg/kg),然后可以变成使用相同的固定给药间隔的个体化剂量。如本文中使用的,“中值剂量”表示一半研究受试者使用高于所述剂量和一半研究受试者使用低于所述剂量。“中值剂量”表示平均剂量(通过将所有剂量加起来并除以总的剂量数来计算)。对于给定的剂量,“约”表示所示的剂量加或减1、2、5、10、15或20%的所示剂量。对于约每1至5天一次的给药间隔,“约”表示加或减12小时。对于约每1至4天一次或约每2至4天一次的给药间隔,“约”表示加或减10小时。对于约每1至3天一次或约每2至3天一次的给药间隔,“约”表示加或减8小时。对于约每隔每天一次或每天一次的给药间隔,“约”表示加或减6小时。对于本发明的目的,在给药FVIIa或半衰期延长的FVIIa蛋白的内容中的“半衰期”限定为血浆中FVIIa活性降低一半需要的时间量,如使用测定法测定的。“Cmax”限定为给药FVIIa后测量的最大血浆FVIIa活性,如使用测定法测定的。“半衰期延长的”是指与重组FVIIa(即,)相比具有较长半衰期的FVIIa蛋白。本发明的方法中使用的半衰期延长的FVIIa蛋白的治疗剂量在至少每天一次的给药间隔下导致约至少约30IU/ml血液的Cmax。优选,半衰期延长的FVIIa蛋白的剂量导致约30-160IU/ml血液的Cmax。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量导致约35-130IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约40-105IU/ml血液的Cmax。在高度优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约46-92IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约30-70IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约36-56IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约41-51IU/ml血液的Cmax。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约70-110IU/ml血液的Cmax。在再另一个优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约80-105IU/ml血液的Cmax。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约82-102IU/ml血液的Cmax。在再另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量导致约87-97IU/ml血液的Cmax。使用测定法测定了半衰期延长的FVIIa蛋白的活性。或者,本文发明的方法中使用的半衰期延长的FVIIa蛋白的FVIIa部分的治疗剂量在至少每天一次的给药间隔下为约200-800μg/kg。对于本发明的目的,以μg/kg计的剂量是指每kg受试者体重的半衰期延长的FVIIa蛋白μg数。优选,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约300-700μg/kg。在优选实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约320-650μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约310-330μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约630-650μg/kg。作为进一步的替换方案,本发明的方法中使用的半衰期延长的FVIIa蛋白的FVIIa部分的治疗剂量在每天至少一次的给药间隔下为约1750-8000IU/kg。优选,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约1800-7000IU/kg。在另一个优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2500-6500IU/kg。在进一步优选的实施方案中,FVIIa部分的剂量为约3200-5800IU/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约2800-3200IU/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的FVIIa部分的剂量为约5800-6200IU/kg。使用测定法测定了半衰期延长的FVIIa蛋白的活性。作为再进一步的替换方案,本发明的方法中使用的包括白蛋白作为半衰期增强多肽(HLEP)的半衰期延长的FVIIa蛋白的治疗剂量为约500μg/kg。在优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约500-2500μg/kg。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约750-2000μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1000-1500μg/kg。在另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1100-1600μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1200-1500μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1300-1500μg/kg。在再另一个优选实施方案中,半衰期延长的FVIIa蛋白的剂量为约1400-1500μg/kg。在更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量为约740-760μg/kg。在另一个更优选的实施方案中,半衰期延长的FVIIa蛋白的剂量为约1490-1510μg/kg。优选的剂量和给药间隔如下:在约每隔每天一次的给药间隔下导致约41-51IU/ml血液的Cmax的半衰期延长的FVIIa蛋白的剂量;在约每隔每天一次的给药间隔下导致约87-97IU/ml血液的Cmax的半衰期延长的FVIIa蛋白的剂量;半衰期延长的FVIIa蛋白的FVIIa部分的剂量在约每隔每天一次的给药间隔下为310-330μg/kg;半衰期延长的FVIIa蛋白的FVIIa部分的剂量在约每隔每天一次的给药间隔下为630-650μg/kg;半衰期延长的FVIIa蛋白的FVIIa部分的剂量在约每隔一天的给药间隔下为2800-3200IU/kg;和半衰期延长的FVIIa蛋白的FVIIa部分的剂量在约每隔一天的给药间隔下为5800-6200IU/kg。如本申请中使用的“因子VII/VIIa”表示由非激活形式(因子VII)或激活形式(因子VIIa)或其混合物组成的治疗性多肽。以上定义内的因子VII/VIIa包括具有天然人因子VII/VIIa的氨基酸序列的多肽。还包括具有轻微修饰的氨基酸序列的多肽,例如,修饰的N-末端或C-末端,包括末端氨基酸删除或添加,只要多肽实质性地保留因子VIIa的生物活性。以上定义内的“因子VII”还包括可能存在的并且从一个个体出现在另一个个体的天然等位基因变化。以上定义内的因子VII进一步包括FVII/FVIIa的变体。这样的变体与野生型序列存在一个或多个氨基酸不同。这样的差异的实例包括N-和/或C-末端有一个或多个氨基酸残基(例如,1至10个氨基酸残基)的平截,或N-和/或C-末端一个或多个额外残基的添加,以及保守性氨基酸置换,即,在具有相似特征的氨基酸组内进行的置换,例如(1)小氨基酸,(2)酸性氨基酸,(3)极性氨基酸,(4)碱性氨基酸,(5)疏水性氨基酸,和(6)芳香族氨基酸。这样的保守性置换的实例显示于下表中。表1(1)丙氨酸甘氨酸(2)天冬氨酸低谷期氨酸(3a)天冬酰胺低谷期酰胺(3b)丝氨酸苏氨酸(4)精氨酸组氨酸赖氨酸(5)异亮氨酸亮氨酸甲硫氨酸缬氨酸(6)苯丙氨酸酪氨酸色氨酸本发明的半衰期延长的FVIIa蛋白的体内半衰期,通常作为末端半衰期或β-半衰期来测定,通常比非融合多肽的体内半衰期高至少约25%,优选至少约50%,和更优选超过100%。使用测量半衰期延长的FVIIa蛋白的FVIIa活性。如本文中使用的,测定法是VIIa-rTF(DiagnosticaStago,法国,参见http://www.stago-cn.com/en/products-services/catalogue/reagents/fiche-produit/selection/type-reagents/reference/staclotR-viia-rtf)。基于Morissey等,1993.Blood.81:734-744描述的方法,按照ELISA测量的,以每100IU因子VII/VIIa抗原的国际单位(IU),激活半衰期延长的FVIIa蛋白后,在测定法中测量活性。如本文中使用的,术语“FVIIa部分”或“FVII部分”表示半衰期延长的FVIIa或FVII分子的一部分,所述部分全部源自“FVII/VIIa”下限定的天然人因子VII/VIIa或其变体的氨基酸序列,并且不是源自半衰期增强部分。通过SEQIDNO:1中的非限制性实例,“FVIIa部分”是从位置1至位置406的多肽链(包括位置1和406)。如本文中使用的,术语“FVIIa部分的剂量”表示以接受所述剂量的受试者(例如,人)的每kg体重的半衰期延长的FVIIa分子的剂量计“FVII部分”的重量。例如在CSL689(SEQIDNO:1)中,CSL689中的FVIIa部分具有51000Da的分子量。CSL689的衔接物和白蛋白具有68.689Da的分子量。因此,CSL689的FVIIa部分为42,6%。因此,750μg/kg的CSL689剂量对应于320μg/kg的FVIIa部分和1500μg/kg的CSL689剂量对应于640μg/kg的FVIIa部分。野生型形式的人因子VIIa的体内功能性半衰期在人体中大约为2小时。连接本发明的白蛋白多肽的因子VIIa的功能性半衰期通常为至少约4小时,优选至少约6小时,更优选至少约12小时。如本申请中使用的,“半衰期增强部分”(HLEM)表示延长FVIIa半衰期的任何部分。HLEM可以是聚亚烷基二醇部分,优选PEG。或者,HLEM是半衰期增强多肽(HLEP)。HLEP可以是羧基末端肽(CTP)。在一个实施方案中,本发明的羧基末端肽(CTP)肽包括人绒膜促性腺激素的氨基酸112至位置145的氨基酸序列。在另一个实施方案中,本发明的CTP序列包括人绒膜促性腺激素的氨基酸118至位置145的氨基酸序列,如SEQIDNO:2中所列(SSSSKAPPPSLPSPSRLPGPSDTPILPQ)。在另一个实施方案中,CTP序列还从人绒膜促性腺激素的位置112-118之间的任一个位置开始并且在位置145终止。在一些实施方案中,CTP序列肽为28、29、30、31、32、33或34个氨基酸长并且在CTP氨基酸序列的位置112、113、114、115、116、117或118开始。或者,HLEP是FcRn结合伴侣,如白蛋白或不具有抗原结合结构域(例如,Fc)的免疫球蛋白。本发明优选的HLEP是白蛋白。如本文中使用的,“白蛋白”总地是指白蛋白多肽或氨基酸序列,或具有一种或多种白蛋白功能活性(例如,生物活性)的白蛋白片段或变体。特别地,“白蛋白”是指人白蛋白或其片段,尤其是成熟形式的人白蛋白。例如,白蛋白可以具有如US2008260755A1中所述的序列或其变体,将其全部通过引用并入本文中。半衰期延长的FVIIa蛋白的白蛋白部分可以包括全长的HA序列,或可以包括其能够稳定或延长治疗活性的一个或多个片段。这样的片段可以是10个或更多个氨基酸长或可以包括约15、20、25、30、50或更多个来自HA序列的连续氨基酸或可以包括HA的特定结构域的一部分或全部。术语人血清白蛋白(HSA)和人白蛋白(HA)在本文中可互换使用。术语“白蛋白”和“血清白蛋白”更宽泛,并且包括人血清白蛋白(及其片段和变体)以及来自其他物种的白蛋白(及其片段和变体)。替代白蛋白,也可以使用其他白蛋白样蛋白,如不限于人α胎蛋白(如WO2005/024044中所述的)及其功能性片段或变体。本发明的半衰期延长的FVIIa蛋白的白蛋白部分可以是正常的天然或人工HA的变体。本发明的半衰期延长的FVIIa蛋白的治疗性多肽部分也可以是本文中所述的相应治疗性多肽的变体。术语“变体”包括插入、删除和置换,保守性的或非保守性的,天然或人工的,其中这样的改变基本上没有改变给予治疗性多肽的治疗活性的活性位点,或活性结构域,如US2008260755A1中所述,将其全部按引用并入本文中。IgG和IgG片段也可以用作HLEP,只要HLEP片段与非融合的凝血因子相比提供至少25%的半衰期延长。治疗性多肽部分可以通过衔接物,优选不可切割的衔接物连接IgG或IgG片段。本发明意义上的“凝血相关测定法”是测定凝血过程中相关的酶或辅因子活性或能够测定已经激活的内在或外部凝血级联的任何测定法。因此“凝血相关”测定法可以是直接的凝血测定法,如aPTT、PT,或凝血酶生成测定法。然而,还包括其他测定法,如例如,适用于特定凝血因子的发色测定法。这样的测定法或相应试剂的实例是使用相应的凝血因子缺陷血浆(DadeBehring)的SL(aPTT测定法,DadeBehring)或S(凝血酶原时间测定法,DadeBehring),使用例如凝血因子缺陷血浆的凝血酶生成测定试剂盒(Technoclone,Thrombinoscope),发色测定法,如Biophen因子IX(HyphenBioMed)、FVIIa-rTF(RocheDiagnosticsGmbH),因子VIII:C/4(Chromogenix),或其他。尽管对于未激活的凝血因子期望具有高的体内恢复和长的半衰期,有利的是在其激活后或其辅因子激活后限制凝血因子的半衰期,以避免血栓形成的风险。因此,在已经启动凝血过程后,活性凝血因子的半衰期应当再次降低。这可以通过增强凝血相关模式的灭活或通过消除凝血因子来实现。根据本发明的灭活表示治疗性多肽的活性的降低,其可以例如通过凝血因子和相应凝血因子的抑制剂的复合物形成或通过已知的进一步的蛋白水解切割(例如,在FVIII和FV的情况下)来引起。激活的治疗性半衰期延长的FVIIa蛋白的灭活速率限定为例如通过与抑制剂的反应或通过蛋白水解灭活的活性降低的速率。可以按照激活的凝血因子在生理量的这种凝血因子的抑制剂的存在下随着时间的摩尔比活性来测量灭活速率。或者,可以在将激活产品给药于动物后,通过使用活性和抗原测试在合适的时间框中测试血浆样品来测定灭活速率。激活的治疗性半衰期延长的FVIIa蛋白的消除速率限定为多肽从人或动物循环中消除的速率。可以在静脉内给药后,通过测量激活的治疗性半衰期延长的FVIIa蛋白的药物动力学来测定消除速率。使用抗原测试,可以测定通过从循环直接去除的消除。此外,使用活性测试,可以测定特定的去除和灭活速率。如本文中使用的,“获得性血友病”是指在之前没有遭受过FVIII或FIX缺陷的受试者中,通常在成年期从抑制FVIII或FIX的活性或功能的自身抗体的产生或加速FVIII或FIX清除产生的血友病类型,分别导致获得性血友病A或B。其中半衰期延长的FVII可以用作降低外围出血治疗的外科程序的非限制性实例包括,但不限于,贲门瓣手术(AlDouri等,2000.BloodCoagFibrinol.11:S121-S127)、主动脉瓣替换术(Kastrup等,2002.AnnThoracSurg.74:910-912)、复发的血管外皮细胞瘤切除术(Gerlach等,2002.JNeurosurg.96:946-948)、癌症手术(Sajdak等,2002.EurJGynaecolOncol.23:325-326)和十二指肠溃疡手术(Vlot等,2000.AmJMed.108:421-423)。经历手术的受试者可以在早期手术期给予治疗量的FVII的静脉造影剂团注射,以通过增强手术部位的凝血来降低外围失血。半衰期延长的FVIIa多肽可以给药于经历其他类型手术的具有正常凝血的患者,以实现快速止血和防止失血。用半衰期延长的FVIIa蛋白的治疗可以促进手术部位的止血和降低或防止失血,由此降低或消除输血的需求。“外伤”限定为外部动因引起的活组织损伤。外伤分类为钝伤(导致内部压缩、器官损伤和内出血)或穿刺伤(刺穿身体并破坏组织、血管和器官的动因结果,导致外部出血)。外伤可以由几种事件引起,包括,但不限于,交通事故(引起钝伤和/或穿刺伤)、枪伤(引起穿刺伤)、戳伤(引起穿刺伤)、机械事故(引起穿刺和/或钝伤)以及从显著高度跌落(引起穿刺伤和/或钝伤)。通过给药治疗量的FVIIa的治疗可以促进凝血病降低外伤患者的失血。例如,呈现大量失血的枪伤患者,除了手术干预外,给药FVIIa来控制凝血病出血。用FVIIa的凝血剂治疗可以有效地降低具有损伤和穿刺伤的患者的失血和出血(Rizoli等,2006.CritCare.10:R178)。药物组合物和给药方式本发明的半衰期延长的FVIIa蛋白可以掺入适用于给药的药物组合物中。这样的组合物通常包括蛋白和药物学上可接受的载体。如本文中使用的,“药物学上可接受的载体”用来包括与药物给药相容的任何溶剂、分散介质、涂层、抗细菌和抗真菌剂、等渗和吸收延迟剂等。合适的载体描述于Remington’sPharmaceuticalSciences的最新版本中,这是该领域的标准参考书,将其按引用并入本文中。这样的载体和稀释剂的优选实例包括,但不限于,水、盐水、finger’s溶液、右旋糖溶液和5%人血清白蛋白。脂质体和非水性载体,如固定油,也可以使用。用于药物活性物质的这样的介质和试剂的使用是本领域公知的。除了任何与活性化合物不相容的任何常规介质或试剂,否则考虑其在组合物中的使用。补充性活性物质也可以掺入组合物中。本发明的药物组合物配制成与其计划的给药途径相容。给药途径的实例包括非肠道的,例如,静脉内、皮内、皮下、口服(例如,吸入)、经皮(局部);经粘膜和直肠给药。用于非肠道、皮内或皮下施用的溶液或悬浮液可以包括以下组分:无菌稀释剂,如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌剂,如苄醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸(EDTA);缓冲剂,如醋酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,如氯化钠或右旋糖。可以用酸或碱调节pH;如盐酸或氢氧化钠。非肠道制剂可以包装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。作为静脉内注射的给药是优选的给药途径。适用于注射使用的药物组合物包括无菌水溶液(在水溶性的情况下)或分散体和用于无菌注射液或分散体的临时制备的无菌粉末。对于静脉内给药,无菌载体包括生理盐水、抑菌水、CremophorEL(BASF,Parsippany,N.J.)或磷酸盐缓冲盐水(PBS)。在所有情况下,组合物必须是无菌的并且应当是存在容易的注射器能力程度的流体。在制造和存储条件下必须是稳定的并且必须针对微生物(如细菌和真菌)的污染作用来保存。载体可以是溶剂或分散介质,含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等),及其合适的混合物。可以通过使用涂层,如卵磷脂,通过在分散体的情况下维持所需的颗粒大小和通过使用表面活性剂来维持适当的流动性。可以通过各种抗细菌和抗真菌剂,例如,对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等来实现微生物作用的防止。在许多情况下,将优选在组合物中包括等渗剂,例如,糖类,多元醇,如甘露糖醇、山梨糖醇,氯化钠。通过在组合物中包括延迟吸收的物质,例如,单硬脂酸铝和明胶,使得注射组合物延长吸收。通过将所需量的活性化合物(例如,rVIIa-白蛋白/rVIIa-FP)掺入合适的溶剂以及按照需要的上述的一种成分或成分组合中,接着过滤灭菌,来制备无菌注射液。通常,通过将活性化合物掺入含有基础分散介质和来自上述那些的所需其他成分的无菌载体中来制备分散体。在用于制备无菌注射液的无菌粉末的情况下,制备方法是产生活性成分加上来自其之前的无菌过滤溶液的任何其他所需成分的粉末的真空干燥和冷冻干燥。对于易于给药和剂量的均一性,将药物组合物(如注射用组合物)配制成单位剂型尤为有利。本文中使用的单位剂型是指适合作为用于待治疗受试者单一剂量的物理上分开的单位;每个单位含有预定含量的计算来产生所需治疗效果的活性化合物,并结合所需的药物载体。通过活性化合物的独特特征和待获得的特定治疗效果来控制单位剂型的规格并且单位剂型的规格直接取决于活性化合物的独特特征和待获得的特定治疗效果。药物组合物可以与给药说明书一起包括在容器、包装袋或分配器中。现在已经详细描述了本发明,通过参照以下实施例将更清楚地理解本发明,在此包括所述实施例只是为了说明的目的而不是用来限制本发明。本文中提及的所有专利和出版物特意通过引用并入。实施例使用包括重组FVIIa和白蛋白的半衰期延长的因子VIIa蛋白(称为“rVIIa-FP”或“CSL689”)进行以下的实施例。这种蛋白(rVIIa-FP/CSL689)具有SEQIDNO:1的氨基酸序列。实施例1-用华法林抗凝的40名健康男性受试者中半衰期延长的因子VIIa蛋白的单剂量、安慰剂对照、剂量增加安全性和PK研究筛选了总共103名年龄在18至35岁之间的健康男性志愿者,在这个研究中登记了40名受试者。筛选失败的最相关原因是偏离实验室安全性参数内限定的参与/排除标准,特别是升高的高半胱氨酸、降低的蛋白S和升高的LFT,或在华法林运行期间不能达到稳定的INR。研究过程中研究受试者的流动显示于图1中。受试者特征描述于表2中。表2:试验中的受试者的特征N=受试者的总数。Min=最小。Max=最大。BMI=身体质量指数。安全性评价(主要终点):rVIIa-FP的总耐受性在所有受试者中良好。观察到总共34个AE,无SAE。安慰剂组中出现了三个AE(头疼、输注部位血肿和肠胃气胀)。在rVIIa-FP组中出现了三十一个AE,在任何剂量水平没有特别的累积。除了4个,所有AE都是轻度的;四个AE报告为中度(鼻咽炎[2x],韧带扭伤和前臂出现了几个血管脂肪瘤)。一个AE(注射1000μg/kg后输注部位疼痛)判断为与rVIIa-FP相关。在研究药物给药之前、研究药物给药后第8天或第28天,没有受试者测试到针对药物抗体或抑制剂是阳性的。一名500μg/kg剂量的rVIIa-FP受试者报告了在左前臂和右上臂突然出现了几个皮下结节。该名受试者在两个前臂具有多个预先存在的脂肪瘤。新报告的结节是手可移动的皮下结节并且显示出没有发炎的体征。进行了活检,并且组织学显示出由具有单独的微血栓的毛细管增殖交叉的脂肪细胞的结节肿瘤。这些结果与血管脂肪瘤(毛细管扩张型脂肪瘤)一致,认为这对于该年龄的男性是正常的。此外,免疫组织化学研究表明脂肪细胞中没有增殖活性(Ki-67)。在血管脂肪瘤内的毛细管增殖的一些内皮细胞内存在核表达(<5%)。这一结果与导致受试者报告的突然出现的快速生长不一致。没有确定与rVIIa-FP给药的关联。所有AE都解决了而没有后遗症,除了血管脂肪瘤,其尺寸减小,但在研究结束时仍然是可检测的。安全性分析揭示了对血栓栓塞并发症的特别关注。在研究过程中没有观察到血栓栓塞事件。一名受试者(接受1000μg/kg剂量的rVIIa-FP)在输注部位经受了疼痛,但这与血栓性静脉炎或血栓形成反应无关。rVIIa-FP的药物动力学谱的评价(次级终点):在rVIIa-FP输注前,FVIIa活性在所有受试者中低于测试的定量水平(7.8mU/mL),除了一名具有8.6mU/mL的基线FVIIa活性。PK参数概括于表3中。表3.PK参数的描述性概述-基线校正的(PK群)单次IV输注140μg/kg至1000μg/kg后,在接近输注结束时,FVIIa活性达到峰值(图2)。中值tmax在剂量水平中为0.267至0.500小时,这对应于大约一半受试者的输注结束。FVIIa基线校正的平均Cmax(SD)值以剂量成比例方式提高,在剂量提高7倍过程中,Cmax提高大约7倍(从140μg/kg剂量的9240(515)mU/mL至1000μg/kg剂量的63520(13515)mU/mL)。因此,IR在剂量水平中相当一致并且范围从500μg/kg剂量水平下的56.35[(mU/mL)/(μg/kg)]至300μg/kg剂量水平下的71.58[(mU/mL)/(μg/kg)]。这与报道的rFVIIa行为一致(LindleyCM等,1994.Clinicalpharmacologyandtherapeutics.55(6):638-48)。基线校正的平均FVIIaAUC0-t在剂量范围中以略高于剂量成比例方式提高,从140μg/kg剂量的49546(7109)h*mU/mL至1000μg/kg剂量的616638(125522)h*mU/mL。证明了平均半衰期的单独值在6.1至13.5小时的范围中。300μg/kg和500μg/kg剂量组的半衰期的CV%高(分别为92%和70%)。这是由于每个群中有一名受试者与那些剂量组中的其他受试者相比具有长t1/2。对于较低的3个剂量组中每一个中的1名受试者,由于基线周围的最后几个时间点的变化,不可以估算消除速率常数和相关的PK参数。在所述剂量范围中,中值t1/2非常恒定,范围从6.1小时至9.7小时。在最高剂量(1000μg/kg)下,中值t1/2为8.5小时。使用幂律模型估算剂量比例表明了基线校正的和未校正的Cmax在140μg/kg至1000μg/kg剂量水平中以剂量成比例方式提高;斜率估算为0.9351,具有(0.8606-1.0095)的相应95%置信区间。相反,AUC0-t以高于剂量成比例的方式提高,因为基线校正的斜率估算为1.2205,具有(1.1250-1.3160)的相应置信区间。因此,与相应的剂量提高相比,平均AUC0-t的提高比预期的高22%。CL在剂量水平中是一致的,范围从7.62至12.74[mL/h/kg]。分配的体积(Vss)也是一致的,范围从81.70至97.97[mL/kg]。实施例2:半衰期延长的因子VIIa蛋白的预防性给药将提供参与CSL689按需研究的受试者参与预防性试验。预防性试验将比较预防情况下的按年计算的出血率与CSL689_2001研究中证明的按年计算的出血率。预防性试验概括于以下的表4中。表4:临床试验由于CSL689的性质,预期1.5mg/kg的预防剂量可以是有效的并且给药间隔可以大于之前用rVIIa获得的,例如,每两天一次(即,每隔每天一次)。潜在地,较低剂量在这样的预防性给药方案中也可能是有效的,如1mg/kg或0.75mg/kg。实施例3-在稀释性凝血病的兔子模型中标准化肾损伤(用于手术和外伤中出血的模型)后,与rFVIIa相比,半衰期延长的FVIIa蛋白更有效地控制了出血材料&方法动物将称重为2.0-4.0kg的3-4个月大的雌性CHB兔子(Bauer,Neuental,德国)以每笼一只圈养在钢丝笼里,在21-23℃和50%相对湿度,12小时/12小时光-暗周期下圈养。给动物提供随意饮用的自来水并饲喂兔子饲料球(DeutscheTiernahrungCremerGmbH&Co.KG,杜塞尔多夫,德国)。所有兔子都接受了符合欧洲动物保护公约(EuropeanConventiononAnimalCare)的照料,并且研究由组织伦理委员会批准。血液稀释所有处理在麻醉的动物中进行。通过克他命和甲苯噻嗪的组合来诱导麻醉并且通过吸入异氟醚麻醉来维持。然后给动物插管并且放置在呼吸机上(HeyerAccess,HeyerMedicalAG,BadEms,德国)。通过从颈动脉取出30mL·kg-1血液并输注30mL·kg-1预先温热至37℃的羟乙基淀粉(HES)200/0.5(Infukoll6%,SchwarzPharmaAG,曼海姆,德国),将动物接受血液稀释阶段(图3)。将该程序重复45分钟。在30分钟时,在血液取出和HES输注的两个循环之间的间隔过程中,动物接受了15mL·kg-1回收的红细胞,所述红细胞通过在800×g离心10分钟从取出的兔子全血制得,在生理盐水中洗涤并重悬浮于Ringer’s乳酸盐中,给药于外颈动脉。肾损伤在血液稀释开始后60分钟时,在侧肾柱以15mm长和5mm深的手术刀切口的形式给予标准化肾损伤(图3)。治疗就在肾切口损伤前立即将动物随机分配来接受i.v.给药的等渗盐水、0.75mg/kg或1.5mg/kg剂量的rVIIa-FP(CSLBehringGmbH。马尔堡,德国)或90μg/kg或180μg/kg剂量的rFVIIa(NovoNordiskA/S,丹麦)(图3)。实验组每组由5只兔子组成。基于测定法,选择剂量水平来获得相当的rVIIa-FP或rFVIIa的FVIIa活性水平。因此,基于FVIIa活性,0.75mg/kgrVIIa-FP与90μg/kgrFVIIa相关联,而基于FVIIa活性,1.5mg/kgrVIIa-FP与180μg/kgrFVIIa相关联。终点主要研究终点是标准化肾切口损伤后长达30分钟时观察到的止血时间和失血(图3)。止血时间限定为从肾切口直至可观察到的出血或渗出停止的时间。失血是通过抽吸从切口部位收集的血液体积。在切口后立即开始用于失血和止血时间的30分钟观察期。结果如图4中所示,90和180μg/kg剂量的能够将标准化肾损伤后的总失血从平均的115mL(未治疗的;阳性对照)分别降至77和80mL,因此没有呈现任何明显的剂量响应。相反,CSL689(rVIIa-FP)在0.75mg/kg剂量同等有效(平均失血为76mL),在较高的1.5mg/kg剂量甚至更有效,其导致失血降至仅为49mL。因此,CSL689关于血液稀释兔子中的出血逆转显示出明显的剂量响应效果,并且与相当剂量的rFVIIa相比更有效。此外,只有rVIIa-FP能够显著降低这些动物标准化肾损伤后获得完全止血需要的时间(图5)。相反,用rFVIIa治疗后,没有观察到效果或只观察到小的效果,证实了CSL689关于急性外伤后出血逆转提高的功效。实施例4-半衰期延长的FVIIa蛋白在获得性血友病的猴子模型中的功效介绍/目的进行该研究来评价连接激活的因子VII和人白蛋白的重组融合蛋白(即,rVIIa-FP(CSL689(SEQIDNO:1))在具有循环抗因子VIII抗体的猕猴中的功效,所述猕猴模拟获得性血友病A患者的临床状况。此外,包括了关于有效的出血预防需要的给药频率,rVIIa-FP和重组激活的因子VII(rFVIIa;)之间的直接比较。材料和方法动物管理所有生命实验程序由当地动物福利机构批准。在开始处理前,将处理开始时至少2岁大的雌性猕猴(食蟹猴;目的繁殖)适应灵长类动物建筑中的圈养条件长达4周。在开始处理前,通过兽医评价动物的健康状况并且证实是可接受的。基于伪随机体重和基线血浆因子VIII(FVIII)活性和FVIII活性基线水平,将动物(n=4/组)分配给处理组。给予动物唯一的新识别数字。将动物成对圈养在温度和湿度受控区域中,使用12小时光,12小时暗光。每只动物给予限制膳食(200g标准干膳食和饼干和水果补充剂)并且自由饮水。处理在第1天通过皮下给药FVIII和佐剂的混合物,使猕猴免疫。通过血浆中的FVIII活性水平表明产生了获得性血友病表型后,动物接受了静脉内弹丸剂量的rVIIa-FP(1.5mg/kg)或rFVIIa(90μg/kg)至头静脉或大隐静脉,分别以8和3小时的给药间隔开始。一旦基于至少48小时或2个随后剂量的临床观察和血液学获得了令人满意的出血控制,无论哪个更长,提高给药间隔。使用了以下的给药间隔:rVIIa-FP:8、12、16、32小时rFVIIa:3、6、12、24小时评价的终点连续观察包括临床观察、死亡率、体重(至少每周一次和尸检前)、食物消耗、血液学,包括测定血浆中的FVIII活性水平、血细胞比容、血红蛋白浓度、凝血酶原时间(PT)和激活的部分促凝血酶原激酶时间(aPTT)、血液化学、骨髓涂片、抗FVIII抗体;抗FVII抗体;中和FVIII抗体;FVIIa活性(测定法);肉眼可见的病状、组织病理学。结果通过皮下给药因子VIII和佐剂之间的混合物,使猕猴免疫。随后,动物产生了抗因子VIII抗体,其与内源性猴因子VIII交叉反应,导致出血表型,所述表型密切地反映出基于不存在治疗的情况下的临床观察、血液学和宏观以及微观评价的获得性血友病A患者中观察到的临床出血表型。结果证实了血浆中的FVIII活性水平是预测这种获得性血友病A表型的成功诱导的最灵敏的终点,与猴FVIII交叉反应的抗FVIII抗体的出现充分关联。因此,一旦FVIII活性水平降低至低于10%(0.1IU/m),就开始预防性rVIIa-FP或rFVIIa治疗。总之,结果证实了对于1.5mg/kg剂量的rVIIa-FP治疗,有效地保护了所有动物在抑制剂存在的情况下免于产生任何出血症状的最大给药间隔为8小时。比较而言,有效地保护所有治疗的动物需要的90μg/kg剂量的最大给药间隔为3小时。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1