用于对EZH2抑制剂的应答的生物标志物的制作方法
本申请要求2014年6月19日提交的系列号为62/014,594的美国临时专利申请的优先权,其全部内容引入本文以供参考。
授予信息
本发明是在由美国国立卫生研究院(National Institutes of Health)授予的资助号为F31CA180642-01的政府资助下做出的。政府对本发明享有一定的权利。
1.技术领域
本发明涉及可用于评估EZH2抑制剂在受试者中产生抗癌作用的可能性的生物标志物。因此,这些生物标志物可用于治疗癌症患者的方法中。
2.
背景技术:
BRCA1相关蛋白-1(BAP1)是参与从蛋白质中除去泛素的泛素羧基末端水解酶。BAP1通过乳腺癌1型易感蛋白(BRCA1)的RING指结构域结合BRCA1,并且可以充当肿瘤抑制子。BAP1参与转录的调节、细胞周期和生长的调节、对DNA损伤和染色质动力学的应答。基因组测序研究表明BAP1的种系突变可以与肿瘤易感综合征(TPDS)相关联,这涉及增加的癌症风险,包括恶性间皮瘤、葡萄膜黑色素瘤和皮肤黑色素瘤。进一步的研究已经确定种系BAP1突变与其他癌症包括肺腺癌和肾细胞癌相关。一些BAP1突变的患者的预后相当差,没有确认的有效治疗,同时许多恶性间皮瘤的患者将死于他们的疾病。肾细胞癌患者的BAP1突变预测预后不良,葡萄膜黑色素瘤患者的BAP1突变预测更高的风险组和转移。
zeste同系物2增强子(EZH2)是Polyeomb-组(PcG)家族的成员,该家族成员通过组蛋白蛋白质的甲基化来参与调节基因的转录状态。已经开发了特异性靶向EZH2的药物,并且这种药物在具有多种肿瘤的患者中的效果已经成为研究的活跃领域。目前EZH2抑制剂正在具有活化EZH2的突变的淋巴瘤患者中临床测试。因此,本领域需要治疗BAP1突变的患者,并需要生物标志物,其将用于确定何时应当使用EZH2抑制剂来治疗癌症。
3.
技术实现要素:
本发明涉及一种或多种生物标志物用于评价EZH2抑制剂在受试者中产生抗癌作用的可能性的用途。其至少部分基于以下发现:BAP1活性的丧失导致EZH2表达和活性的上调。
因此,在非限制性实施方式中,本发明提供用于测定患者的样品中一种或多种生物标志物例如BAP1生物标志物的存在的检测方法和试剂盒,以及在选择癌症患者的治疗方案中和在治疗癌症患者的方法中使用这种测定的方法。
本发明提供一种用于测定EZH2抑制剂是否可能在癌症中产生抗癌作用的方法。在非限制性实施方式中,该方法包括测定癌症的一个或多个细胞中BAP1生物标志物的表达,其中如果BAP1生物标志物与参考对照水平相比在癌症中不存在或以更低水平表达,则施用治疗有效量的EZH2抑制剂以产生抗癌作用。在某些非限制性实施方式中,可以通过免疫荧光、蛋白质印迹(Western Blot)、原位杂交或聚合酶链式反应来测定BAP1生物标志物的表达。在某些实施方式中,该方法可以进一步包括测定样品中EZH2、SUZ12和/或L3MBTL2的表达水平。
本发明还提供用于治疗患有癌症的受试者的方法。在某些非限制性实施方式中,该方法包括从受试者获得癌症样品,并测定样品中BAP1生物标志物的表达水平和/或EZH2和/或SUZ12的表达水平,其中如果BAP1生物标志物不存在或以低于BAP1参考对照水平的水平表达和/或如果EZH2和/或SUZ12的表达与EZH2和/或SUZ12参考对照水平相比增加,则开始用治疗有效量的EZH2抑制剂治疗所述受试者。
本发明还提供用于测定EZH2抑制剂是否可能在癌症中产生抗癌作用的方法。在非限制性实施方式中,该方法包括从受试者获得癌症样品,并且测定样品中BAP1生物标志物的表达水平,其中如果BAP1生物标志物与参考对照水平相比在癌症中不存在或以更低水平表达,则EZH2抑制剂更可能对癌症具有抗癌作用。在某些实施方式中,BAP1生物标志物是BAP1蛋白质生物标志物。在某些实施方式中,BAP1生物标志物是BAP1核酸生物标志物。
本发明还提供预测患者中癌症对EZH2抑制剂的敏感性的方法。在非限制性实施方式中,该方法包括从所述患者获得癌症样品,并且测定样品包含的细胞中BAP1蛋白质生物标志物的表达水平,其中如果BAP1生物标志物与参考对照水平相比不存在或表达水平降低,则预测癌症对EZH2抑制剂敏感。
在某些实施方式中,癌症可以是恶性间皮瘤、葡萄膜黑色素瘤、肾细胞癌、皮肤黑色素瘤、肺癌、乳腺癌、卵巢癌、非黑色素瘤皮肤癌、脑膜瘤、胆管癌(cholangiocarcinoma)、平滑肌肉瘤、神经内分泌肿瘤、胰腺癌、副神经节瘤、恶性纤维组织细胞瘤、黑素细胞BAP1突变的非典型皮内肿瘤(MBAIT)、急性骨髓性白血病、骨髓增生异常综合征或膀胱癌。
本发明提供用于测定EZH2抑制剂是否可能在癌症中产生抗癌作用的试剂盒。在非限制性实施方式中,试剂盒包含用于检测BAP1生物标志物的工具。在某些实施方式中,用于检测BAP1生物标志物的工具包括一种或多种包装的引物、探针、阵列/微阵列、生物标志物特异性抗体和/或珠。在某些实施方式中,用于检测BAP1生物标志物的工具包括用于检测BAP1生物标志物的一种或多种抗体或其抗原结合片段。在某些实施方式中,试剂盒还包含用于检测EZH2和/或SUZ12表达的一种或多种引物、探针、阵列/微阵列、生物标志物特异性抗体和/或珠。
4.附图说明
图1.体外BAP1缺失上调组蛋白H3K27me3。
图2.EZH2在BAP1突变型间皮瘤细胞中过表达。
图3.BAP1表达的获得/缺失导致PRC2亚基表达的改变。
图4.EZH2的抑制降低了间皮瘤异种移植物中的肿瘤体积。
图5A-L.条件造血缺失Bap1的表征。(a)TCGA AML(急性骨髓性白血病)和(b)间皮瘤患者中BAP1、ASXL1、ASXL2和ASXL3的平均基因表达,其表示为归一化读数的具有标准误差的算术平均值。(c)通过qRT-PCR在C57/B6H小鼠的造血细胞的纯化群体中的Bap1表达。LT-HSC,长期造血干细胞(HSC),(Lin-Sca-1+c-Kit+CD150+CD48-);ST-HSC,短期HSC(Lin-Sca-1+c-Kit+CD150+CD48+);MPP,多能祖细胞(Lin-Sca-1+c-Kit+CD150-CD48+);LSK,Lin-Sca-1+c-Kit+;MP,髓样祖细胞(Lin-Sca-1-c-Kit+);GMP,粒细胞巨噬细胞祖细胞(Lin-Sca-1-c-Kit+CD34+Fcγ+);CMP,共同髓样祖细胞(Lin-Sca-1-c-Kit+CD34+Fcγ1o);MEP,巨噬细胞红细胞祖细胞(Lin-Sca-1-c-Kit+CD34-Fcγ-);MONO,单核细胞(Macl+Gr1-);PMN,(多形核中性粒细胞,Macl+Gr1+);T细胞,CD3+,和B细胞,B220+。(d)从EUCOMM联合会获得的鼠胚胎干细胞中的Bap1靶向方案。在嵌合体产生后,将小鼠与转基因FLPE小鼠杂交以切除提前终止盒(premature stop cassette)。然后将小鼠杂交成Mx1-Cre转基因小鼠。在polyIpolyC(pIpC)处理后4周确认基因型和切除的基因分型方案。(e)在用(pIpC)处理以诱导切除的对照和Bap1KO小鼠的外周血中白细胞的计数和(f)骨髓细胞(Macl+Gr1+)的流式细胞术计数。在pIpC诱导的切除后,对照和Bap1KO小鼠骨髓中红细胞前体(CD71+Ter119+)(g)在外周血中的红细胞压积的百分比和(h)流式细胞术计数。(i)对照和Bap1KO骨髓髓样祖细胞群体(Lin-c-Kit+Scal-)的相对频率。在活的谱系-阴性群体上设门细胞。(j)在对照和Bap1KO小鼠中骨髓髓样祖细胞群体(GMP、CMP、MEP)的相对定量。(k)表明祖细胞和GMP扩增的示例对照和骨髓动物的流量图(Flow plot)。(l)循环祖细胞(Ki67/DAPI染色)的流式细胞术计数;对于所有实验:n=5只CON小鼠和n=8只Bap1KO小鼠。
图6A-L.Bap1缺失与Asxl1缺失相比导致差异通路激活,和增加的H3K27me3。(a)在条件缺失Bap1并通过对照(同窝出生的Bap1f/f小鼠,CON)和Bap1敲除(Mx1-Cre Bap1f/f小鼠,Bap1KO)骨髓的蛋白质印迹验证Bap1缺失之后三周的脾脏图像。(b)比较Bap1和Asxl1KO小鼠中髓样祖细胞基因表达的维恩图(Venn Diagrams),p<0.05;比较包括在相同方向上的基因重叠和基因改变。(c)在Bap1KO和对照小鼠(n=3)的分选的粒细胞巨噬细胞祖细胞(GMP;Lin-c-Kit+Sca1-CD34+Fcγ+)中的HoxA簇实时定量qPCR(qRT-PCR)。(d)归一化到总组蛋白H3的来自Bap1KO以及对照的c-Kit+富集的骨髓细胞的纯化组蛋白的质谱分析。(e)来自Bap1KO和对照骨髓的纯化组蛋白中H3K27me3和总H3的蛋白质印迹。(f)在CON和Bap1KO样品中得出(call)的H3K27me3宽结构域(broad domain)的数目。维恩图显示出独特且重叠的宽结构域。(g)显示在c-Kit富集的骨髓细胞(n=2)中的归一化H3K27me3读数的箱型图(Box plot)。(h)绘制宽结构域密度,其作为与CON和Bap1KO样品中得出的H3K27me3结构域的距离的函数。(i)GSEA显示与下调基因的基因表达相关性。(j)H3K27me3ChIP-seq在HOXA基因座处的局部图。(k)如通过比率(KO/CON)对p值显示的火山图(volcano plot)中显示的分选的GMP细胞中的H3K27me3ChIP-Seq得出的峰(peak calling)。(l)指定的基因标记(signature)对H3K27me3结合基因和RNA-Seq的显著性。统计学用Student t检验计算;*p<0.05,**p<0.005;报告±标准误差(SEM)值。
图7A-C.Bap1和Asxl1缺失导致相反的基因表达变化。(a)对照与Bap1KO小鼠粒细胞-巨噬细胞祖细胞(GMP;Lin-c-Kit+Sca1-CD34+Fcγ+)中的差异表达基因的RNA-Seq数据;用DESeq2分析的细胞(cutoff p值p<0.05)。热图(Heatmap)表示基因表达的增加(红色)和减少(蓝色)。(b)GSEA分析Bap1KO和Asxl1KO的正向和负向富集的基因集(geneset)的数目,达到FDR<0.25(上图)。通过RNA-Seq描述在Bap1KO和Asxl1KO髓样祖细胞中相反富集的基因集的维恩图(底部)。(c)在Bap1KO和Asxl1KO祖细胞中相反富集和统计学显著的HoxA簇基因集的GSEA,显示p值和FDR值。
图8A-C.Bap1缺失增强PRC2活性。(a)从Bap1KO和对照小鼠的骨髓细胞纯化的组蛋白中归一化到H3的H3K27me3的EL1SA,(b)相关于基因转录起始位点(启动子、外显子、内含子、下游(+/-2kb)、远端(2-5kb)和基因间(>50kb))得出的H3K27me3-宽结构域的百分比。(c)分析来自分选的骨髓群体的已公布的RNA-Seq(Lara-Astiaso等人,2014),并与使用GSEA分析Bap1缺失后差异下调且标记有H3K27me3的基因进行比较。下调并且由H3K27me3标记的基因只与造血祖细胞群体相关,表明这些可能是相关的目标群体。这些数据是在Bap1KO小鼠模型中观察到的祖细胞扩增的解释。
图9A-C.体外BAP1扰动导致H3K27me3的变化。(a)用两个独立的BAP1shRNA转导的SET2细胞的蛋白质印迹,其显示纯化的组蛋白和全细胞提取物的BAP1敲减中的H3K27me3水平。(b)用对照和Bap1KO骨髓细胞进行的甲基纤维素检测。将BAP1cDNA构建体重新引入对照和Bap1缺失的细胞中。对H3K27me3进行组蛋白ELISA检测。用于评估BAP1构建体表达的定量qPCR。(c)在Bap1缺陷型鼠细胞中重新引入BAP1和去泛素化酶突变体BAP1C91A。对H3K27me3和总H3进行组蛋白的蛋白质印迹。显示构建体表达水平的定量qPCR。
图10A-D.Bap1/Ezh2化合物KO小鼠的表征。(a)各种Bap1/Ezh2基因型的骨髓病理学。(b)对所指基因型(CD71、Ter119)中的红细胞的流式细胞术染色和定量。(I-IV)表示红细胞分化的阶段,其中I是最不成熟的,IV是最成熟的。在右侧的代表性流量图对这些表型的定量。(c)pIpC后4周,所指基因型的脾脏大小。(d)pIpC后4周,所指基因型的白细胞计数。
图11A-K.Bap1缺失诱导的增殖由Ezh2的缺失解除。(a)自Bap1KO、Ezh2KO、Bap1/Ezh2KO和对照小鼠的骨髓纯化的组蛋白中H3K27me3水平的蛋白质印迹。pIpC后3周,小鼠的指示基因型的(b)脾脏的代表性图像和(c)脾脏重量的计数。通过Hemavet定量的(d)外周血白细胞计数和(e)红细胞压积的百分比。(f)髓样祖细胞(Lin-c-Kit+Sca1-)和(g)成熟髓样细胞(Macl+Grl+)的流式细胞术计数。(h)使用Ki67和DAPI染色(n=3/组)在髓样祖细胞中的细胞周期分析。(i)每天两次500mg/kg EPZ011989治疗16天的小鼠(n=5/组)中的H3K27me3水平的蛋白质印迹。(j)治疗后的脾脏重量和(k)白细胞计数。除非另有说明,n=5/CON,n=5/Ezh2KO,n=8/Bap1KO和n=11/Bap1/Ezh2KO,统计学用Student t检验计算;*p<0.05,**p<0.005;报告±SEM值。
图12A-C.在Bap1KO动物中的组蛋白分析。(a)如通过qPCR评估的对照和Bap1KO细胞中的EZH2转录。将细胞用空载体或BAP1过表达构建体转导。(b)在对照和Bap1KO动物c-kit富集的骨髓细胞中的组蛋白质谱,n=2。(c)在过表达FLAG标记的BAP1、ASXL1和Bmi1的293T细胞中的H4K20me1ChIP-qPCR实验。
图13A-L.BAP1耗尽导致PRC2组分表达的增加、增加的H4K20me1和L3MBTL2的去泛素化。(a)在SET2细胞中内源性EZH2和BAP1的免疫共沉淀,然后通过蛋白质印迹分析(在核酸酶(benzonase)存在下进行以抑制依赖于DNA的相互作用)。(b)通过qRT-PCR的分选的粒细胞-巨噬细胞祖细胞(GMP;Lin-c-Kit+Sca-1-CD34+Fcγ+)中的Bap1、Ezh2和Suz12表达。(c)Bap1KO和对照小鼠的骨髓细胞中Bap1和Ezh2的蛋白质印迹分析。(d)组蛋白质谱实验的H4K20me1定量。BAP1野生型(MSTO-211H、Meso10)和缺失的突变型细胞系H226、催化突变型H2452中(e)通过Cell Titer Glo活性检测所评估的细胞活力和(f)SETD8过表达实验的膜联蛋白V(Annexin V)检测。(g)SETD8过表达的BAP1突变型细胞中SETD8和EZH2的定量qPCR。(h)BAP1野生型细胞系中SETD8和EZH2的蛋白质印迹分析。(i)用DMSO或5、10、20μM BVT594治疗的细胞的Cell Titer Glo测定。(j)在BAP1野生型(Met5a、JMN)和突变型间皮瘤细胞系(H226、H2452、H28)中的L3MBTL2和BAP1表达。(k)过表达Myc-His标记的泛素和L3MBTL2cDNA和不同水平的BAP1(0、5μg、2.5μg和1μg)的293T细胞。使用Ni-珠和一系列严格洗涤进行免疫共沉淀实验。(l)描述BAP1的调节导致对染色质和基因表达的作用的模型。统计学用Student t检验计算;*p<0.05,**p<0.005;报告±SEM值。
图14A-B.BAP1、ASXL1、HCF-1和OGT结合的分析。(a)BAP1、ASXL1、HCF-1和OGT ChIP-Seq的K-均值聚类分析。(b)在BAP1结合簇中的Homer从头(de novo)基序分析。
图15A-I.L3MBTL2和BAP1共调节EZH2。(a)在对照和Bap1KO骨髓细胞中Bap1和L3mblt2的表达。(b)通过qPCR在GMP中L3mbtl2的表达。(c)用25μM MG132处理的H226和H2452细胞的蛋白质印迹。使用含有2%SDS的裂解缓冲液提取不溶性组分。(d)在过表达L3MBTL2的细胞系中EZH2的表达。(e)用含有1.9kB EZH2启动子的构建体和海肾(Renilla)对照载体瞬时转染到具有空载体、BAP1或L3MBTL2表达载体的293T细胞中,进行EZH2启动子活性测定。在这些情况的每一个中,萤火虫荧光素酶活性归一化为海肾活性。(f)两种独立的发夹结构(hairpin)用于在SET2细胞中敲减L3MBTL2蛋白。对L3MBTL2、EZH2和肌动蛋白进行包括短和长时间曝光的蛋白质印迹分析。(g)L3MBTL2的ChIP,然后是293T细胞中的EZH2、SUZ12、E2F6(阳性对照)、PHF20(阳性对照)和MORC3(阴性对照)基因座的qPCR。(h)抗FLAG ChIP,然后是在过表达FLAG-L3MBTL2或FLAG-BAP1的293T细胞中的EZH2基因座处的qPCR。JAM2是阳性对照。与没有FLAG过表达的293T细胞比较。(i)在293T细胞中各自IP后的L3MBTL2和BAP1的蛋白质印迹。包括琼脂糖DNA凝胶以显示DNA消化。
图16A-H.BAP1突变型间皮瘤细胞系和异种移植模型对EZH2抑制敏感。(a)与匹配的正常对照相比,TCGA间皮瘤患者中EZH2转录物的表达。(b)在BAP1野生型和表达空载体或靶向EZH2的发夹结构的突变型细胞系中的膜联蛋白V测定。(c)间皮瘤细胞系中膜联蛋白V实验的定量。(d)植入NOD-SCID小鼠中的表达EZH2发夹结构的Meso10和H226细胞系的肿瘤大小,n=6/组。(e)用1.25μM EPZ011989治疗2周后的2D Cell Titer Glo活力测定。(f)用1.25μM EPZ011989治疗3周后的3D Cell Titer Glo活力测定。植入NOD-SCID小鼠并用载体或500mg/kg BID EPZ011989治疗的(g)BAP1突变型(MSTO和Meso10)或(h)野生型细胞(H226和H2452)的肿瘤大小形成。每周3次测量肿瘤,n=6/组。通过提取的肿瘤中的组蛋白蛋白质印迹评估靶抑制(在各个图中显示)。用载体和EPZ011989治疗的H2452细胞的肺部病理学。箭头指示大量转移的肿瘤。统计学用Student t检验计算;*p<0.05,**p<0.005;报告±SEM值。
图17.在分选的群体和整个骨髓中PRC2组分表达增加。
图18.在BAP1KO小鼠中H3K27me3局部和全局增加。通过在对照和BAP1KO骨髓上进行酸提取然后进行蛋白质印迹来评估BAP1KO动物中的组蛋白甲基化。染色质免疫沉淀测序(ChIP-Seq)也在cKit富集的骨髓上完成。用RNA测序数据与ChIP-Seq叠合分析,表明在BAP1KO小鼠中下调的基因越来越多地标记有H3K27me3。在BAP1KO小鼠中,观察到H3K27me3在EZH2靶基因如HOXA基因座处增加。
图19.在BAP1KO细胞中H3K27me2/3的上调以H3K27me0/1为代价发生。
图20A-D.BAP1突变型细胞系对EZH2抑制最敏感。(a)过表达EZH2的Meso10细胞系在注射到NOD-SCID小鼠的侧部后逐渐增殖,(b)EZH2在MSTO-211H和Meso10细胞系中过表达。随着EZH2过表达,细胞系对EZP011989变得越来越敏感。(c)当用EZH2抑制剂GSK126治疗时,BAP1突变型细胞的侵袭性变得更小。(d)用GSK126治疗后细胞系H226中E-钙粘蛋白(E-Cadherin)表达增加。
图21A-C.BAP1突变型间皮瘤细胞系和异种移植模型对EZH2抑制敏感。(a)每天用150mg/kg的GSK126或载体(每组n=10只小鼠)治疗的H2452异种移植物的肿瘤体积。每组的5只小鼠在治疗16天后安乐死以评估H3K27me3缺失。剩余的小鼠在试验的剩余时间进行治疗。(b)体内治疗小鼠治疗16天后的肿瘤中H3K27me3水平的组蛋白ELISA和蛋白质印迹分析。(c)从载体治疗和GSK126治疗的小鼠中提取的肿瘤的H&E染色、Ki67染色和TUNEL染色,10倍放大。
5.具体实施方式
为了清楚而不是当作限制,将本发明的详细描述分为以下子部分:
(i)BAP1生物标志物;
(ii)EZH2抑制剂;
(iii)癌症靶标;
(iv)生物标志物检测;
(v)使用方法;和
(vi)试剂盒。
5.1BAP1生物标志物
本文使用的术语“生物标志物”包括与受试者中的BRCA1相关蛋白-1的活性水平相关的核酸和蛋白质,所述BRCA1相关蛋白-1在本文中表示为BAP1。
本文可互换使用的“患者”或“受试者”是指人或非人受试者。非人受试者的非限制性实例包括非人灵长类、狗、猫、小鼠、大鼠、豚鼠、兔、猪、家禽、马、牛、山羊、绵羊、鲸类等。
在某些非限制性实施方式中,公开的BAP1生物标志物可以是核酸。例如但不限于,生物标志物可以是脱氧核糖核酸(DNA)或核糖核酸(RNA),例如mRNA。
在某些非限制性实施方式中,BAP1核酸生物标志物可以是具有如NCB1数据库登录号NG_031859.1或NM_004656所示序列的人BAP1核酸,或编码具有如NCB1数据库登录号NP_004647所示氨基酸序列的BAP1蛋白分子的核酸。
在具体的非限制性实施方式中,BAP1核酸生物标志物可以是具有如NCB1数据库登录号NM_027088所示序列的小鼠BAP1核酸,或编码具有如NCB1数据库登录号NP_081364.1所示氨基酸序列的BAP1蛋白分子的核酸。
在具体的非限制性实施方式中,BAP1核酸生物标志物是具有如NCB1数据库登录号NM_001107292.1所示序列的大鼠BAP1核酸,或编码具有如NCB1数据库登录号NP_001100762.1所示氨基酸序列的BAP1蛋白分子的核酸。
在某些非限制性实施方式中,BAP1生物标志物可以是蛋白质。
在具体的非限制性实施方式中,BAP1蛋白质生物标志物可以是具有如NCB1数据库登录号NP_004647所示氨基酸序列的人BAP1蛋白。
在具体的非限制性实施方式中,BAP1蛋白质生物标志物是具有如NCB1数据库登录号NP_081364.1所示氨基酸序列的小鼠BAP1蛋白。
在具体的非限制性实施方式中,BAP1蛋白质生物标志物是具有如NCB1数据库登录号NP_001100762.1所示氨基酸序列的大鼠BAP1蛋白。
在某些实施方式中,将BAP1生物标志物的水平与参考对照水平进行比较。本文可互换使用的BAP1的“参考对照水平”或“参考对照表达水平”可以使用例如参考对照样品来确立。参考对照样品的非限制性实例包括具有野生型BAP1活性的正常和/或健康细胞。在某些实施方式中,BAP1的参考对照水平可以使用例如位于患者肿瘤附近的正常细胞,例如良性细胞来确立。
在本发明的某些非限制性实施方式中,可以通过评价BAP1功能来评价BAP1生物标志物的水平,其中BAP1表达水平与BAP1功能水平直接成正比。在一个非限制性实例中,BAP1的功能可以是EZH2表达(例如,EZH2蛋白表达或核酸表达)的下调。例如但不限于,可以通过测定与EZH2参考对照水平相比受试者的癌细胞中EZH2的表达水平来测定BAP1生物标志物的水平。在某些实施方式中,可以使用具有野生型和/或正常EZH2活性和/或正常BAP1活性的正常和/或健康细胞确立EZH2参考对照水平。在某些非限制性实施方式中,EZH2是具有如NCBI数据库登录号NG_032043.1、NM_004456.4、NM_001203249.1、NM_152998.2、NM_001203247.1和/或NM_001203248.1所示序列的人EZH2核酸,或编码具有如NCBI数据库登录号NP_001190176.1、NP_001190177.1、NP_001190178.1、NP_004447.2和/或NP_694543.1所示氨基酸序列的EZH2蛋白分子的核酸。在一个具体的非限制性实施方式中,EZH2是具有如NCBI数据库登录号NP_001190176.1、NP_001190177.1、NP_001190178.1、NP_004447.2和/或NP_694543.1所示氨基酸序列的人EZH2蛋白。
在一个非限制性实例中,BAP1的功能可以是SUZ12表达(例如,SUZ12蛋白表达或核酸表达)的调节。在某些非限制性实施方式中,可以通过测定与SUZ12参考对照水平相比受试者的癌细胞中SUZ12的表达水平来测定BAP1生物标志物的水平。在某些实施方式中,可以使用具有野生型和/或正常SUZ12活性和/或正常BAP1活性的正常和/或健康细胞来确立SUZ12参考对照水平。在某些非限制性实施方式中,SUZ12是具有如NCBI数据库登录号NM_015355.2所示序列的人SUZ12核酸,或编码具有如NCBI数据库登录号NP_056170.2所示氨基酸序列的SUZ12蛋白分子的核酸。在一个具体的非限制性实施方式中,SUZ12是具有如NCBI数据库登录号NP_056170.2所示氨基酸序列的人SUZ12蛋白。
其中与参考对照表达水平的比较在本文中是指相对于相同物种内的参考对照表达水平来评估生物标志物。例如,将人BAP1生物标志物表达水平和/或存在与人BAP1参考对照水平进行比较。
在特定的非限制性实施方式中,BAP1生物标志物的不存在和/或降低的表达是指检测到相对于参考对照水平小于约90%、小于约80%、小于约70%、小于约60%、小于约50%、小于约40%、小于约30%的表达。
5.2EZH2抑制剂
EZH2抑制剂的非限制性实例包括抑制和/或降低EZH2的表达和/或活性的化合物、分子、化学品、多肽、蛋白质。EZH2抑制剂的另外的非限制性实例包括S-腺苷基-甲硫氨酸竞争性小分子抑制剂。在特定的非限制性实施方式中,EZH2抑制剂衍生自四甲基哌啶基化合物。其它非限制性实例包括UNC1999、3-去氮腺嘌呤A(DZNep)、EI1、EPZ-5676、EPZ-6438、GSK343、EPZ005687、EPZ011989和GSK126。
EZH2抑制剂的其它非限制性实例描述于Garapaty-Rao等,Chemistry and Biology,20:第1-11页(2013),PCT专利申请号WO2013/138361、WO 2013/049770和WO 2003/070887,以及美国专利申请号US 2014/0275081、US 2012/0071418、US 2014/0128393和US2011/0251216中,其内容是将其全部内容引入本文以供参考。
EZH2抑制剂的其它非限制性实例包括特异性抑制EZH2的表达或活性的核酶、反义寡核苷酸、shRNA分子和siRNA分子。EZH2抑制剂的一个非限制性实例包括与EZH2核酸序列的至少一部分同源的反义、shRNA或siRNA核酸序列,其中所述部分相对于EZH2序列的同源性为至少约75%或至少约80%或至少约85%或至少约90%或至少约95%或至少约98%,其中百分比的同源性可以通过例如BLAST或FASTA软件测定。在某些非限制性实施方式中,互补部分可以构成至少10个核苷酸或至少15个核苷酸或至少20个核苷酸或至少25个核苷酸或至少30个核苷酸,并且反义核酸、shRNA或siRNA分子的长度可以至多15或至多20或至多25或至多30或至多35或至多40或至多45或至多50或至多75或至多100个核苷酸。反义、shRNA或siRNA分子可以包含DNA或非典型或非天然存在的残基,例如但不限于硫代磷酸酯残基。
在某些非限制性实施方式中,EZH2抑制剂可以单独使用或与一种或多种抗癌剂组合使用。抗癌剂可以是具有抗癌作用的任何分子、化合物化学品或组合物。抗癌剂包括但不限于化疗剂、放疗剂、细胞因子、抗血管生成剂、细胞凋亡诱导剂或抗癌免疫毒素比如抗体。“与...组合”是指作为治疗方案或计划的一部分将EZH2抑制剂和一种或多种抗癌剂施用给受试者。这些术语不要求EZH2抑制剂和一种或多种抗癌剂在施用前物理结合,也不要求它们在相同的时间范围内施用。
5.3癌症靶标
属于本发明公开的主题的癌症的非限制性实例包括恶性间皮瘤、葡萄膜黑色素瘤、肾细胞癌、皮肤黑色素瘤、肺癌、乳腺癌、卵巢癌、非黑色素瘤皮肤癌、脑膜瘤、胆管癌、平滑肌肉瘤、神经内分泌肿瘤、胰腺癌、副神经节瘤、恶性纤维组织细胞瘤、骨髓增生异常综合征、急性骨髓性白血病、黑素细胞BAP1突变的非典型皮内肿瘤(MBAIT)和膀胱癌。
5.4生物标志物检测
定性和定量地检测和/或测定BAP1核酸生物标志物、EZH2核酸、L3MBTL2核酸或SUZ12核酸的表达水平的方法包括但不限于,包括常规PCR、qPCR和数字PCR的聚合酶链式反应(PCR)、原位杂交(例如但不限于荧光原位杂交(“FISH”))、凝胶电泳、测序和序列分析、微阵列分析和本领域已知的其它技术。
在某些实施方式中,检测方法可以是实时PCR(RT-PCR)、定量PCR、荧光PCR、RT-MSP(RT甲基化特异性聚合酶链式反应)、DNA的PicoGreenTM(Molecular Probes,Eugene,OR)检测、放射免疫测定或DNA的直接放射性标记。例如但不限于,可以将核酸生物标志物反转录成cDNA,然后进行聚合酶链式反应(RT-PCR);或者,如在美国专利号为5,322,770中所述的,单一酶可用于两个步骤,或者如R.L.Marshall等人,PCR Methods and Applications 4:80-84(1994)所述,可以将生物标志物反转录成cDNA,然后进行对称缺口连接酶链式反应(RT-AGLCR)。用于所公开方法的引物的非限制性实例在表1中示出。
在某些实施方式中,实时定量聚合酶链式反应(qRT-PCR)用于评价生物标志物的mRNA水平。生物标志物和对照mRNA的水平可以在癌组织或细胞以及相邻的良性组织中定量。在某些实施方式中,一种或多种生物标志物的水平可以在生物样品中定量。
在非限制性实施方式中,进行本发明的检测方法可以不依赖于扩增,例如不产生靶序列的任何拷贝或复制、不涉及任何聚合酶、或不需要任何热循环。在某些实施方式中,本发明的检测可以使用在2006年6月19日提交的系列号为11/471,025的美国申请中描述的QuantiGeneTM方法所示的原理来进行,并且该申请引入本文以供参考。
在某些实施方式中,可以使用原位杂交可视化,其中放射性标记的反义RNA探针与生物样品例如活检样品的薄切片杂交、洗涤、用RNA酶切割并暴露于敏感性乳剂用于放射自显影。样品可以用苏木精染色以显示样品的组织学组成,并且用合适的滤光器的暗场成像显示显影的乳剂。也可以使用非放射性标记比如地高辛。
在某些非限制性实施方式中,可以通过荧光原位杂交(FISH)进行核酸生物标志物表达的评价。FISH是可以直接鉴定细胞中DNA或RNA的特定区域的技术,因此使得能够目测测定组织样品中的生物标志物表达。FISH方法具有以下优点,如更客观的评分系统和内置的内部对照的存在,该内部对照由相同样品中的所有非肿瘤细胞中存在的生物标志物基因信号组成。FISH是一种可以相对快速和灵敏、并且也可以自动化的直接的原位技术。当单独通过FISH难以测定生物标志物的表达水平时,可以将免疫组织化学与FISH方法相结合。
在某些实施方式中,可以在DNA阵列、芯片或微阵列上检测核酸生物标志物的表达。将生物标志物对应的寡核苷酸固定在芯片上,然后将芯片与从受试者获得的生物样品例如肿瘤样品的标记核酸杂交。包含生物标志物转录物的样品获得阳性杂交信号。制备DNA阵列的方法及其应用是本领域公知的。(参见,例如美国专利号6,618,6796、6,379,897、6,664,377、6,451,536、548,257;美国专利申请号20030157485和Schena等人1995Science 20:467-470;Gerhold等人1999Trends in Biochem.Sci.24,168-173;和Lennon等人2000Drug discovery Today 5:59-65,其全部内容引入本文以供参考)。也可以进行基因表达的连续分析(SAGE)(参见,例如美国专利申请号20030215858)。
在某些实施方式中,为了监测核酸生物标志物例如BAP1mRNA的表达水平,可以从待测生物样品中提取mRNA、逆转录并可以产生荧光标记的cDNA探针。然后将标记的cDNA探针应用于能够与生物标志物杂交的微阵列,允许探针与微阵列杂交并扫描载玻片以测量荧光强度。该强度与杂交强度和生物标志物的表达水平相关。
用于检测核酸生物标志物的探针的类型包括cDNA、核糖核酸探针、合成的寡核苷酸和基因组探针。使用的探针的类型通常由具体情况决定,例如,比如核糖核酸探针用于原位杂交,而cDNA用于RNA印迹法。在某些非限制性实施方式中,探针针对具体生物标志物RNA独特的核苷酸区域。探针可以所需的一样短,以差异性识别具体生物标志物mRNA转录物,并且可以短至例如15个碱基。也可以使用至少17个碱基、18个碱基和20个碱基的探针。在某些实施方式中,引物和探针在严格条件下与具有对应于靶基因的核苷酸序列的核酸片段特异性杂交。本文使用的术语“严格条件”是指只有在序列之间存在至少95%或至少97%的同一性时才会发生杂交。
探针标记的形式可以是任何合适的形式,比如使用例如32P和35S的放射性同位素、或荧光团。可以通过使用适当的标记的碱基来实现用放射性同位素的标记,无论所述探针是化学合成还是生物合成的。
用于检测和/或测定蛋白质生物标志物例如BAP1蛋白质生物标志物、EZH2蛋白、L3MBTL2蛋白或SUZ12蛋白的水平的方法,对本领域技术人员而言是熟知的,并且包括但不限于质谱技术、一维或二维凝胶分析系统、色谱、酶联免疫吸附试验(ELISA)、放射免疫测定法(RIA)、酶免疫测定法(EIA)、蛋白质印迹、免疫沉淀和免疫组织化学。这些方法使用抗体或抗体等同物来检测蛋白质,或使用生物物理技术。也可以使用抗体阵列或蛋白质芯片,参见,例如美国专利申请号2003/0013208、2002/0155493、2003/0017515以及美国专利号6,329,209和6,365,418,其全部内容引入本文以供参考。
在某些非限制性实施方式中,用于测量蛋白质生物标志物表达的检测方法包括以下步骤:将生物样品例如组织样品与选择性结合生物标志物的抗体或其变体(例如,片段)接触,以及检测抗体或其变体是否结合样品。该方法还可以包括将样品与第二抗体例如标记的抗体接触。该方法还可以包括例如一个或多个洗涤步骤,以除去一种或多种试剂。
在某些非限制性实施方式中,蛋白质印迹可用于检测和定量生物标志物蛋白质表达水平。细胞可以在裂解缓冲液中匀浆以形成裂解物,然后进行SDS-PAGE并印迹至膜,比如硝酸纤维素滤膜。然后将抗体(未标记的)与膜接触,并通过二次免疫试剂例如标记的蛋白A或抗免疫球蛋白(合适的标记包括125I、辣根过氧化物酶和碱性磷酸酶)来分析。也可以使用色谱检测。在某些实施方式中,可以使用增强的化学发光系统(例如,来自PerkinElmer Life Sciences,Boston,Mass.),用抗生物标志物的抗体进行免疫检测。然后可以将膜剥离,并用对照蛋白例如肌动蛋白特异性的对照抗体再印迹。
免疫组织化学可用于检测例如在活检样品中的生物标志物的表达和/或存在。可以将合适的抗体与例如细胞薄层接触,接着洗涤以除去未结合的抗体,然后与标记的第二抗体接触。可以通过荧光标志物、比如过氧化物酶的酶类、抗生物素蛋白或放射性标记进行标记。该试验可以使用显微镜可视地评分,并且可以对结果进行定量。基于机器或自动成像系统也可用于测量生物标志物的免疫染色结果。
适合用于免疫组织化学的各种自动化的样品处理、扫描和分析系统在本领域中是可获得的。这样的系统可以包括自动化的染色(参见,例如Benchmark系统,Ventana Medical Systems,Inc.)和显微镜扫描、计算机化的图像分析、连续切片比较(以对样品的方向和大小中的变量进行控制)、数字报告生成,以及样品(比如放置组织切片的载玻片)的存档和跟踪。细胞成像系统是商业上可获得的,其将常规光学显微镜与数字图像处理系统相结合以对细胞和组织包括免疫染色的样品进行定量分析。参见,例如CAS-200系统(Becton,Dickinson&Co.)。
针对生物标志物的标记抗体也可以用于成像目的,例如,以检测受试者的细胞中生物标志物的存在。合适的标记包括放射性同位素,碘(125I、121I)、碳(14C)、硫(35S)、氚(3H)、铟(112In)和锝(99mTc),荧光标记比如荧光素和罗丹明,以及生物素。可以使用不同的酶比如过氧化物酶、碱性磷酸酶或不同的色原体比如DAB、AEC或Fast Red来显现免疫酶相互作用。标记的抗体或抗体片段将优先聚集在包含生物标志物的细胞的位置处。然后可以使用已知的技术检测标记的抗体或其变体,例如抗体片段。
抗体包括与待检测的生物标志物足够有力并特异性结合的、无论天然或合成的、全长或其片段、单克隆或多克隆的任何抗体。抗体可以具有至多约10-6M、10-7M、10-8M、10-9M、10-10M、10-11M和10-12M的Kd。短语“特异性结合”是指,例如抗体与表位或抗原或抗原决定簇的结合,其结合方式为可以用相同或相似的表位、抗原或抗原决定簇的第二制备物置换或竞争该结合。
可以使用的抗体及其衍生物包括多克隆或单克隆抗体、合成的和工程化的抗体、嵌合的、人的、人源化的、灵长类化的(CDR移植)、镶嵌化的(veneered)或单链抗体、相产生的抗体(phase produced antibody)(例如,来自噬菌体展示文库)、以及抗体的功能性结合片段。例如,可以使用能够结合生物标志物或其部分的抗体片段,其包括但不限于Fv、Fab、Fab’和F(ab’)2片段。这样的片段可以通过酶剪切或通过重组技术产生。市售的BAP1抗体的非限制性实例包括来自Santa Cruz Biotechnology(Santa Cruz,CA)的SC-8132、SC-48386、SC-13576、SC-28236、SC-8133和SC-28383,来自Abcam(Cambridge,England)的Ab167250和来自Sigma-Aldrich(St.Louis,MO)的HPA028814。市售的EZH2抗体的非限制性实例包括来自Active Motif(Carlsbad,CA)的Cat No.39933、39875和39901,来自Millipore(Billerica,MA)的07-689,和来自Thermo Fisher Scientific(Waltham,MA)的PA1-46476和PA5-24594。市售的SUZ12抗体的非限制性实例包括来自Abcam的Ab12073。市售的L3MBTL2抗体的非限制性实例包括来自Active Motif的39569。
在某些非限制性实施方式中,使用除抗体之外的特异性结合多肽的试剂,比如肽。可以通过本领域已知的任何方法,例如肽噬菌体展示文库,来鉴定特异性结合的肽。通常,可以使用能够检测生物标志物多肽的一种试剂,从而检测生物标志物的存在和/或进行定量。本文定义的“试剂”是指能够鉴定或检测生物样品中的生物标志物(例如,鉴定或检测生物标志物的mRNA、生物标志物的DNA、生物标志物的蛋白质)的物质。
此外,可以使用质谱比如MALDI/TOF(飞行时间)、SELDI/TOF、液相色谱-质谱(LC-MS)、气相色谱-质谱(GC-MS)、高效液相色谱-质谱(HPLC-MS)、毛细管电泳-质谱、核磁共振光谱或串联质谱(例如MS/MS、MS/MS/MS、ESI-MS/MS等)来检测生物标志物。参见,例如美国专利申请号2003/0199001、2003/0134304、2003/0077616,其全部内容引入本文以供参考。
质谱方法是本领域公知的,并且已经用于定量和/或鉴定生物分子,比如蛋白质(参见,例如Li等人(2000)Tibtech 18:151-160;Rowley等人(2000)Methods 20:383-397;和Kuster和Mann(1998)Curr.Opin.Structural Biol.8:393-400)。而且,已经开发了允许对分离的蛋白质进行至少部分从头测序的质谱技术。Chait等人,Science 262:89-92(1993);Keough等人,Proc.Natl.Acad.Sci.USA.96:7131-6(1999);综述见Bergman,EXS 88:133-44(2000)。
检测生物标志物或其它物质的存在通常包括检测信号强度。这可以依次反映结合于底物的多肽的数量和特性。例如,在某些实施方式中,可以比较(例如,可视化地或通过计算机分析)来自第一样品和第二样品的光谱的峰值的信号强度,以测定具体生物标志物的相对量。软件程序比如Biomarker Wizard程序(Ciphergen Biosystems,Inc.,Fremont,Calif.)可用于帮助分析质谱。
用于测定样品中的核酸和/或蛋白质生物标志物表达的其它方法描述于例如美国专利号6,271,002;美国专利号6,218,122;美国专利号6,218,114;和美国专利号6,004,755;和Wang等人,J.Clin.Oncol.,22(9):1564-1671(2004);和Schena等人,Science,270:467-470(1995);所有这些的全部内容引入本文以供参考。
5.5使用方法
在某些非限制性实施方式中,本发明提供了确定EZH2抑制剂是否可能在癌症中产生抗癌作用的方法,其包括测定BAP1生物标志物例如BAP1核酸和/或蛋白质生物标志物的存在、不存在和/或表达水平。用于测定BAP1生物标志物的存在、不存在和/或表达水平的方法在上文5.4节中阐述。适合于治疗的癌症在上文5.3节中描述。EZH2抑制剂在上文5.2节中描述。
在某些实施方式中,本公开提供在癌症中产生抗癌作用的方法,其包括测定癌症细胞是否包含BAP1生物标志物,其中如果BAP1生物标志物与参考对照水平相比在癌症中不存在和/或以更低水平表达,则施用治疗有效量的EZH2抑制剂以产生抗癌作用。或者,如果发现BAP1生物标志物以相对于参考对照水平相同或更高的水平表达,则施用不是EZH2抑制剂的试剂进行替代疗法。
“治疗有效量”是指能够实现一种或多种抗癌作用、延长存活和/或延长直至复发的时期的量。
“抗癌作用”是指聚集的癌细胞块的减少、癌细胞生长速率的降低、癌细胞增殖的减少、肿瘤块的减少、肿瘤体积的减少、肿瘤细胞增殖的减少、肿瘤生长速率的降低和/或肿瘤转移的减少。在某些实施方式中,抗癌作用可以指被诊断患有癌症的患者的完全应答、部分应答、稳定的疾病(无进展或复发)、具有更晚的复发或无进展存活的应答。
在某些实施方式中,本公开提供在癌症中产生抗癌作用的方法,其包括测定癌症的一个或多个细胞中BAP1生物标志物的表达水平,其中如果BAP1蛋白质生物标志物与参考对照水平相比在细胞中不存在和/或以更低水平表达,则施用治疗有效量的EZH2抑制剂以产生抗癌作用。在某些实施方式中,参考对照是位于癌症邻近处的正常细胞例如良性细胞中的BAP1水平。
在某些非限制性实施方式中,癌症样品和/或参考对照样品中的BAP1水平可针对两种样品中存在的核酸和/或蛋白质进行归一化,例如参考蛋白或核酸比如管家基因和/或蛋白质,以允许比较。例如,但不限于,参考蛋白或核酸可以是肌动蛋白或微管蛋白。
在某些非限制性实施方式中,本公开提供预测患者中的癌症对EZH2抑制剂的敏感性的方法,其包括从患者获得癌症的样品,并且测定样品包含的细胞中BAP1蛋白质生物标志物的表达水平,其中如果BAP1蛋白质生物标志物与参考对照水平相比不存在或表达降低,则预测癌症对EZH2抑制剂敏感。在某些实施方式中,如果预测患者的癌症对EZH2抑制剂敏感,则可以用EZH2抑制剂治疗患者。在某些实施方式中,如果预测患者的癌症对EZH2抑制剂不敏感,则可以用不是EZH2抑制剂的试剂治疗患者。
在某些非限制性实施方式中,本公开提供治疗患有癌症的受试者的方法。例如但不限于,该方法包括从受试者获得癌症的样品,并测定样品中BAP1生物标志物的表达水平,其中如果BAP1生物标志物不存在或以低于BAP1参考对照水平的水平表达,则用治疗有效量的EZH2抑制剂开始治疗受试者。或者,如果发现BAP1生物标志物以相对于参考对照水平相同或更高的水平表达,则可用不是EZH2抑制剂的试剂治疗受试者。
在某些实施方式中,本发明的方法还包括检测样品中EZH2、L3MBTL2和/或SUZ12的表达水平。例如但不限于,可以检测EZH2、L3MBTL2和/或SUZ12的mRNA和/或蛋白质表达水平。在某些实施方式中,用于治疗患有癌症的受试者的方法包括,从受试者获得癌症的样品,并且测定样品中BAP1生物标志物的表达水平以及EZH2、L3MBTL2和/或SUZ12的表达水平,其中如果BAP1生物标志物不存在或以低于BAP1参考对照水平的水平表达,并且EZH2和/或SUZ12的表达与EZH2和/或SUZ12参考对照水平相比增加(和/或L3MBTL2的表达与L3MBTL2参考对照水平相比降低),则用治疗有效量的EZH2抑制剂开始治疗受试者。在某些实施方式中,可以在用EZH2抑制剂治疗之前和之后收集样品,并且可以比较样品的EZH2表达水平。
在某些非限制性实施方式中,样品包括但不限于培养中的细胞、细胞上清液、细胞裂解物、血清、血浆、生物流体(例如血液、血浆、血清、粪便、尿、淋巴液、腹水、导管冲洗液、乳头抽吸液、唾液、支气管肺泡灌洗液、眼泪和脑脊液)和组织样品。样品来源可以是实体组织(例如,来自新鲜、冷冻和/或保存的器官或肿瘤样品、组织样品、活体组织切片或抽吸物)、血液或任何血液成分、体液(比如,例如尿、淋巴、脑脊髓液、羊水、腹水或组织间液)、或来自个体的细胞,包括循环肿瘤细胞。在某些非限制性的实施方式中,样品获自肿瘤。在某些实施方式中,样品可以是“临床样品”,其是来自患者的样品。
5.6试剂盒
在某些非限制性实施方式中,本发明提供了用于确定EZH2抑制剂是否可能在癌症中产生抗癌作用的试剂盒,其包含用于检测前述部分所示的BAP1生物标志物的工具。所述试剂盒还包括描述使用试剂盒以测定EZH2抑制剂是否可能在癌症中产生抗癌效果的说明书或支持材料,和/或提及描述其的网站或出版物。
试剂盒的类型包括但不限于包装的生物标志物特异性的探针和引物组(例如TaqMan探针/引物组)、阵列/微阵列、生物标志物特异性的抗体、生物标志物特异性的珠,其还包含一个或多个探针、引物或用于检测本发明的一种或多种生物标志物的其它试剂。
在某些非限制性实施方式中,本发明提供了用于测定EZH2抑制剂是否可能在癌症中产生抗癌作用的试剂盒,其包含用于检测BAP1核酸生物标志物的存在的工具。
在具体的非限制性实施方式中,试剂盒可包含适合于聚合酶链式反应(PCR)或核酸测序的一对寡核苷酸引物,用于检测待鉴定的核酸生物标志物。一对引物可包含与上述生物标志物互补的核苷酸序列,并且具有足够长度以与所述生物标志物选择性杂交。或者,互补核苷酸可选择性地与生物标志物位置5’和/或3’足够接近的特定区域杂交,以进行PCR和/或测序。试剂盒中可包含多种生物标志物特异性的引物,以同时检测多于一种生物标志物。试剂盒还可以包含一种或多种聚合酶、逆转录酶和核苷酸碱基,其中核苷酸碱基还可以被可检测地标记。
在某些非限制性实施方式中,引物的长度可以是至少约10个核苷酸或至少约15个核苷酸或至少约20个核苷酸,和/或至多约200个核苷酸或至多约150个核苷酸或至多约100个核苷酸或至多约75个核苷酸或至多约50个核苷酸。引物的非限制性实例在表1中提供。例如但不限于,本公开的引物可以包含表1中公开的一个或多个序列。
在另一个非限制性实施方式中,寡核苷酸引物可固定在固体表面、基板或支持物上,例如固定在核酸微阵列上,其中每个寡核苷酸引物与固体表面或支持物结合的位置是已知的和可鉴定的。寡核苷酸可以固定到基板,比如玻璃、塑料、纸、尼龙或其它类型的膜、滤器、芯片、珠或任何其它合适的固体支持物上。多核苷酸可以直接在基板上合成,或者分离于基板合成,然后固定在基板上。使用已知的方法制备阵列。
在具体的非限制性实施方式中,试剂盒可包含至少一种适于原位杂交或原位荧光杂交的核酸探针,用于检测待鉴定的生物标志物。此类试剂盒通常包含一种或多种对各种生物标志物具有特异性的寡核苷酸探针。用于测试多种生物标志物的工具可任选地包含在单一试剂盒中。
在某些实施方式中,试剂盒可包括容器(包括适用于在本方法的自动化实施中使用的微量滴定板),每个容器具有方法中使用的各种试剂(通常为浓缩形式)一种或多种,包括例如,预制的微阵列、缓冲液、适当的三磷酸核苷(例如dATP、dCTP、dGTP和dTTP,或rATP、rCTP、rGTP和UTP)、逆转录酶、DNA聚合酶、RNA聚合酶、以及一个或多个本发明的探针和引物(例如,适当长度的连接到与RNA聚合酶反应的启动子的聚(T)或随机引物)。
在非限制性实施方式中,本发明提供用于测定EZH2抑制剂是否可能在癌症中产生抗癌作用的试剂盒,其包含用于检测BAP1蛋白质生物标志物水平的工具。
在非限制性实施方式中,试剂盒可包含至少一种抗体或其抗原结合片段,用于待鉴定的生物标志物的免疫检测。可以使用如本领域技术人员通常已知的常规的免疫技术制备特异性靶向生物标志物的多克隆和单克隆抗体。试剂盒的免疫检测试剂可包括与给定抗体或抗原本身相关的或连接的可检测标记。此类可检测标记包括例如化学发光或荧光的分子(若丹明、荧光素、绿色荧光蛋白、荧光素酶、Cy3、Cy5或ROX)、放射性标记(3H、35S、32P、14C或131I)或酶(碱性磷酸酶、辣根过氧化物酶)。
在另一个非限制性实施方式中,可提供一种或多种生物标志物特异性的抗体结合于固体支持物,比如柱基质、阵列或微量滴定板的孔。或者,支持物可以作为试剂盒的单独元件提供。
在某些非限制性实施方式中,当试剂盒中的测量工具使用阵列时,上述生物标志物的组可构成呈现在微阵列上的生物标志物的种类的至少10%或至少20%或至少30%或至少40%或至少50%或至少60%或至少70%或至少80%。
在某些非限制性实施方式中,本公开的试剂盒可包含用于检测样品中EZH2表达水平的一种或多种探针、引物、抗体或其他检测试剂。例如,试剂盒可以包含用于检测生物样品中EZH2的蛋白质表达水平的抗体或其片段。
在某些非限制性实施方式中,本公开的试剂盒可包含用于检测样品中SUZ12表达水平的一种或多种探针、引物、抗体或其它检测试剂。例如,试剂盒可以包含用于检测生物样品中SUZ12的蛋白质表达水平的抗体或其片段。
在某些非限制性实施方式中,本公开的试剂盒可包含用于检测样品中L3MBTL2的表达水平的一种或多种探针、引物、抗体或其它检测试剂。例如,试剂盒可以包含用于检测生物样品中L3MBTL2的蛋白质表达水平的抗体或其片段。
试剂盒还可包含用于允许在癌症样品中的生物标志物水平与参考对照样品中的生物标志物水平之间进行比较的工具。例如但不限于,本公开的试剂盒包含一种或多种用于检测参考蛋白或mRNA的探针、引物、抗体或其它检测试剂,其可以用于将样品中一种或多种生物标志物的表达水平归一化以允许比较。参考蛋白例如管家蛋白的非限制性实例包括α-或β-微管蛋白、肌动蛋白、丝切蛋白、黏着斑蛋白和GADPH。
在某些非限制性实施方式中,试剂盒还可以包括使用试剂盒检测目的生物标志物的说明书。例如,说明书可以描述,与参考对照水平相比,本文所述的来自患者的癌症样品中的BAP1生物标志物的不存在和/或更低的表达提示着EZH2抑制剂在癌症中产生抗癌作用的可能性增加。
在某些实施方式中,本公开的试剂盒还可以包含一种或多种EZH2抑制剂。EZH2抑制剂的非限制性实例公开于5.2节中。
提供以下实施例以更充分地说明本公开,但不应解释为限制本公开的范围。
6.实施例1:体外BAP1的缺失导致EZH2表达和活性增加
在该实施例中,在体外研究了BAP1活性的丧失导致疾病状态的机制。
6.1.结果
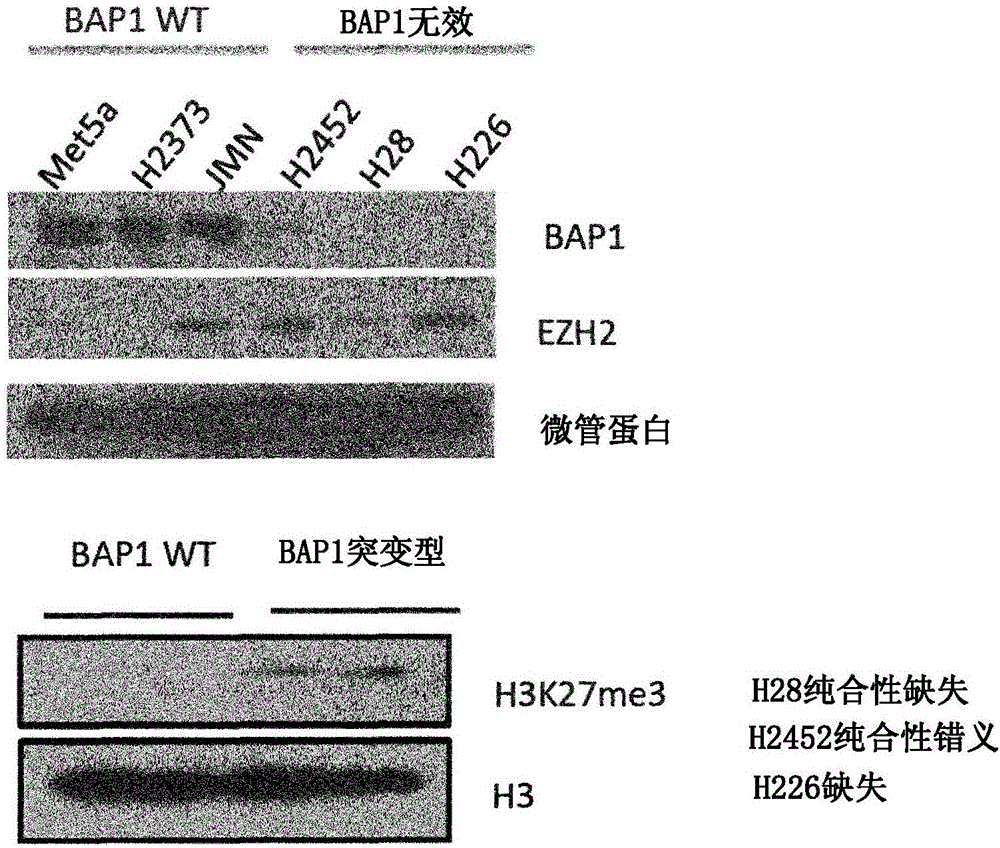
用靶向BAP1的shRNA转导SET2细胞,以在体外减少BAP1表达。如通过蛋白质印迹验证的,BAP1表达的降低导致组蛋白3在K27的三甲基化(H3K27me3)增加(图1)。也参见图9A。BAP1蛋白表达在BaF3细胞中耗减,同时通过蛋白质印迹证实了BAP1缺失,并进行组蛋白质谱。BaF3细胞中的BAP1敲减显示H3K27me3增加(图1)。
已经显示BAP1在实体瘤比如在恶性间皮瘤和葡萄膜黑色素瘤中高度突变(Carbone等人,2012)。与具有野生型BAP1活性的细胞相比,在BAP1中具有突变例如H28纯合性缺失、H2452纯合性错义和H226缺失突变的间皮瘤细胞中,观察到EZH2表达的上调(图2)。此外,BAP1在293T细胞中的体外过表达导致EZH2和SUZ12表达的减少,而BAP1表达的丧失导致SUZ12表达的上调(图3)。
6.2.讨论
如上所述,BAP1蛋白表达的丧失导致由EZH2引起的抑制性染色质标志H3K27me3的增加,以及在体外癌细胞系体系中EZH2和SUZ12的表达的增加。目前EZH2抑制剂正在具有EZH2激活性突变的淋巴瘤患者中进行临床测试。因此,BAP1突变状态可以有助于鉴定可能对EZH2抑制剂治疗应答的患者,这可能有效地延长BAP1-突变患者的存活。
7.实施例2:体内BAP1的缺失导致EZH2表达和活性增加
7.1方法和材料
引物:
表1
动物:所有动物都来自纪念斯隆凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)。所有动物程序根据实验动物的护理和使用指南完成,并由纪念斯隆凯特琳癌症中心的机构动物护理和使用委员会批准。
Bap1-缺陷型和Bap1/Ezh2-缺陷型小鼠的产生:
靶向Bap1的外显子6-12的胚胎干细胞获自欧洲条件性小鼠联盟(European Conditional Mouse Consortium)。上游插入包含lacZ和新霉素盒的Frt-侧翼过早终止盒。将ES细胞克隆扩增并注射到原代胚泡中。将产生的小鼠与Flp-缺失子种系(The Jackson Laboratory)杂交以切除Frt-侧翼盒。随后将这些小鼠与IFN-α可诱导的Mx1-cre转基因小鼠(The Jackson Laboratory)杂交,以评估造血系统中Bap1的诱导性缺失的影响。通过使用引物BAP1-上游(actgcagcaatgtggatctg(SEQ ID NO.1))、BAP1-下游(gaaaaggtctgacccagatca(SEQ ID NO.2),使用以下参数:95℃10分钟,然后94℃10秒、65℃40秒和72℃1分钟进行40个循环,然后72℃5分钟,进行PCR,对Bap1fl/fl、Bap1fl/+和Bap1+/+同窝小鼠进行分型。通过PCR在300bp检测WT等位基因,同时在500bp检测敲入的(floxed)等位基因。通过使用引物的PCR来确认IFN-α诱导后的切除,以检测敲入的和切除的条带:BAP1-F(actgcagcaatgtggatctg(SEQ ID NO.1))、BAP1-F2(gcgcaacgcaattaatgata(SEQ ID NO.3))和BAP1-R(cagtgtccagaatggctcaa(SEQ ID NO.4)),使用上面列出的相同PCR参数。将Mx1-Cre-Bap1f/f小鼠与Ezh2f/f小鼠12杂交。Mx-cre Bap1f/f条件和Bap1f/f对照小鼠接受200μL的1mg/mL polyI:polyC溶液的四次腹膜内注射。切除两周后,使用肝素化的微红细胞压积毛细管(Thermo Fisher Scientific)通过眼眶后出血收集外周血。根据标准制造商的说明书使用HemaVet确认切除并获得外周血计数。用苏木精-伊红(H&E)对福尔马林固定的石蜡包埋的组织切片进行染色。通过PCR基因组切割和蛋白质印迹分析证实Bap1的缺失。将尾部提交给Transnetyx基因分型服务(Cordova,TN),用于敲入的和切除的Ezh2等位基因的基于qPCR的基因分型。通过蛋白质印迹证实切除。
异种移植物和体内施用EPZ011989:用在基质胶和培养基的1:1混合物中的6×106~10×106间质瘤细胞系(MSTO-211H、Meso10、H226和H2452)在侧部皮下注射10周龄NOD-SCID小鼠组。当肿瘤达到约60~80mm3的尺寸时,开始用载体(0.5%NaCMC+0.1%Tween-80的水溶液)或EPZ011989治疗。在实验期间,将EPZ011989或载体给予浓度为500mg/kg的口服BID。使用卡尺在三维中评估肿瘤体积。治疗后提取肿瘤或肺组织,并用于蛋白质印迹以评估靶标抑制。产生预先建立的标准以在如果在移植后没有形成肿瘤(比相同组的移植动物的平均值小75%)时排除小鼠异种移植物实验。药物试验不排除动物。对于所有异种移植物药物研究,跟踪肿瘤大小10天,并且在此时用于肿瘤大小跟踪的小鼠是随机的。在polyI:polyC之后3周,利用CBC分析随机化进行遗传性Bap1KO EPZ011989试验,并确认WBC计数平均值在载体和治疗组中是相等的。每组5只动物用载体(如上所述)或500mg/kg EPZ011989BID口服治疗16天。研究者在这些实验中未被盲化。
组织学分析:将小鼠处死并尸检,然后将切开的组织样品在4%多聚甲醛中固定24小时,脱水,并包埋在石蜡中。将石蜡块以4μm切片并用H&E、Ki67、E-钙粘蛋白或TUNEL染色。使用Axio Observer Al显微镜(Carl Zeiss)获取图像。
细胞培养:293T细胞在补充有10%胎牛血清(FBS)和非必需氨基酸的杜尔伯科改良伊格尔培养基(Dulbecco’s modified Eagle’s medium)(DMEM)中培养。将人白血病细胞系(SET2)和人间皮瘤细胞系(JMN、Met5a、MSTO-211H、H2373、H226、H2452)在补充有10%FBS的RPMI-1640培养基中培养。MSTO-211H获自ATCC,而其余间皮瘤系是来自Prasad Adusumilli的慷慨惠赠。
RNA分离、SMARTer扩增、质子转录组(Proton Transcriptome)测序和分析:使用FACS Aria对骨髓细胞进行GMP(Lin-c-Kit+Sca1-CD34+Fcγ+)的FACS分选。使用TRIzol RNA Isolation Reagents(cat#15596-026,Life Technologies)提取来自200-500K细胞的总RNA。通过使用RNA 6000pico试剂盒和bioAnalyzer(Agilent)分析20~50pg的每个样品,在扩增前确保RNA的质量。随后使用 Universal Low Input RNA Kit for Sequencing(Clonetech Laboratory,cat#634940),根据制造商提供的说明扩增10ng高质量(RIN>8)总RNA。根据Ion Total RNA-Seq Kit v2方案(Life Technologies),用16个循环的PCR,将扩增材料进行全转录组文库(Library)制备。将样品编码并使用离子一触式系统II和ION PITM Template OT2 200kit v2Kit(Life Technologies)制备模板阳性ION PITMION SPHERETM颗粒(ISP)。在质子(Proton)测序系统上使用200bp版本2化学,对富集的颗粒进行测序。平均每个样品产生七~八千万个读数,并且76~82%的读数映射至mRNA碱基。RAW输出BAM使用PICARD Sam2Fastq转换回FASTQ。然后首先使用rnaStar将读数映射到小鼠基因组。使用的基因组是MM9,其与来自ENSEMBL的基因组(Mus_musculus.NCBIM37.67)接合并具有49的读取短悬端(read overhang)。然后使用BWA MEM(版本0.7.5a)将任何未映射读数映射到MM9。然后将两个映射的BAM合并和分选,并使用htseq计数(htseq-count)(选项-s y-m intersection-strict)和相同的基因模型(Mus_musculus.NCBIM37.67)计算基因水平计数。将原始数据以下列登录号GSE61360上传到GEO数据库。
组蛋白提取、组蛋白ELISA、组蛋白蛋白质印迹和组蛋白LC/MS:通过标准提取技术或使用Active Motif Histone Extraction Minikit(40026)过夜提取组蛋白。使用三甲基K27Elisa Kit(Active Motif,53106),归一化到H3K27me3标准曲线和总H3蛋白进行组蛋白ELISA。用3~5μg组蛋白进行组织蛋白质印迹。对于组蛋白LC/MS,裂解1200万的对照和Bap1KO细胞,分离核,并使用0.4N H2SO4提取组蛋白,并使用丙酸酐进行化学衍生化,如前所述26。然后用胰蛋白酶消化组蛋白,并通过纳米-液相色谱(75μm i.d.,15cm长,填充有MagicC 18aq介质,dp 3μ)与TSQ Quantum Ultra质谱仪偶联进行分离。使用Skyline27分析数据,并通过峰面积进行相对定量。
染色质制备和免疫沉淀、ChIP文库制备和测序以及ChIP-Seq数据的分析:使用EasySep Mouse Hematopoietic cell富集试剂盒(Stem Cell Technologies,19756)将骨髓细胞富集c-kit+细胞。将5×106细胞固定在1%无甲醇的甲醛溶液中,然后重悬于SDS裂解缓冲液中。在E220聚焦超声发生器(Covaris)中将裂解物超声处理成100~500个碱基对的所需片段大小分布。如先前所述(Krivtsov等人,2008),使用各自在约400,000个细胞上的抗三甲基H3K27(Cell Signaling,9733)、抗单甲基H4K20(Abcam,9051)和IgG(Santa Cruz,2027)进行IP反应。使用如其他地方所述的Direct ChIP方案(O’Geen等人,2011),在SX-8G IP-STAR Compact Automated System(Diagenode)上进行ChIP试验。然后将洗脱的染色质片段去交联,并使用Agencourt AMPure XP珠(Beckman Coulter)纯化DNA片段。
在SX-8G IP-STAR Compact Automated System(Diagenode)上,根据制造商的说明书,使用用于Illumina(New England Biolabs)和TruSeq Adaptors(Illumina)的NEBNext ChIP-Seq Library Prep Master Mix Set从ChIP富集和输入的DNA制备编码文库。使用Phusion High-Fidelity DNA Polymerase(New England Biolabs)和TruSeq PCR Primers(Illumina)扩增文库,然后使用AMPure XP珠纯化以去除接头二聚体,并在HiSeq 2000(Illumina)上多重化。
在使用bowtie2采用默认参数对齐到小鼠集mm9之前,使用‘trim galore’将读数优质化并适当剪掉(adapter-trimmed)。具有相同起始位置和取向的比对的读数重叠成单次读取,随后进行分析。通过将每个读数扩展到平均文库片段大小,然后使用BEDTools套件计算密度来创建密度分布图。使用具有默认参数的MACS 1.4发现富集区域,并对匹配的输入库评分。将所有基因组浏览器轨迹和读取密度表归一化至测序深度。为了比较对照和KO条件中的ChIP-seq样品,使用曼-惠特尼U检验(Mann-Whitney U test)或t检验来测试每个条件三个重复的信号。在具有kmeans聚类软件包的Matlab中对归一化计数数据进行聚类分析。在Homer中使用findMotifsGenome程序的默认参数进行基序分析。
蛋白质印迹和免疫沉淀:在以下缓冲液中:150mM NaCl、20mM Tris(pH 7.4)、5mM EDTA、1%Triton、蛋白酶抑制剂(protease arrest)(EMD)和磷酸酶抑制剂(Calbiochem),将细胞裂解用于蛋白质印迹和免疫沉淀实验。为了在核酸酶(benzonase)存在下进行免疫沉淀,将细胞在BC-300缓冲液:20mM Tris(pH 7.4)、10%甘油、300mM KCl、0.1%NP-40中裂解。将澄清的裂解物用MgCl2处理至2.5mM,并以1250U/mL加入核酸酶(benzonase)。裂解物在旋转下孵育1小时,通过加入5mM EDTA终止反应。在开始免疫沉淀实验之前,通过将裂解物在溴化乙锭凝胶上跑胶来确认DNA消化。使用的抗体包括:BAP1(C-4;Santa Cruz sc-28383)、EZH2(Active Motif,39933;Active Motif,39901或Millipore,07-689)、SUZ12(Abcam,Ab12073)、ASXL1(N-13;Santa Cruz sc-85283)、L3MBTL2(Active Motif,39569)、Myc-Tag(Cell Signaling,2276)、微管蛋白(Sigma,T9026)、H3K27me3(Abcam,6002或Millipore,07-449)、H3(Abcam,Ab1791)和H4K20me1(Abcam,Ab9051)。
流式细胞术分析和抗体:活的骨髓和脾脏细胞的表面标志物染色通过首先用氯化铵-碳酸氢钾裂解缓冲液裂解细胞然后用磷酸盐缓冲液(PBS)洗涤细胞来进行。在冰上将细胞用PBS中的抗体染色20分钟。对于造血干细胞和祖细胞染色,细胞用包括CD4(RM4-5)、CD3(17A2)、B220(RA3-6B2)、NK1.1(PK136)、Gr-1(RB6-8C5)、Cd11b(M1/70)和Ter119的谱系联用来染色,允许成熟谱系排除在分析之外。细胞也用针对c-Kit(2B8)、Sca-1(D7)、FcγRII/III(2.4G2)和CD34(RAM34)的抗体染色。为了评估成熟单核细胞的组成,使用Mac1、Gr-1、B220和CD4/CD3。通过用上述造血干细胞和祖细胞混合物染色细胞进行细胞周期分析。使用FIX和PERM试剂盒(Invitrogen cat#GAS-003)固定细胞。固定后,用Ki67染色细胞,然后在LSR Fortessa上分析前,用DAPI染色细胞。
质粒:人FLAG-L3MBTL2的cDNA全长克隆获得自Addgene(Plasmid 28232)。Myc-His标签的泛素构建体是来自Xuejun Jiang的慷慨惠赠。HA-FLAG BAP1的cDNA人全长克隆获得自Addgene(Plasmid 22539)。3X FLAG标签的BAP1构建体是来自Marc Ladanyi的慷慨惠赠。去泛素酶突变构建体(C91A、C91S)使用Agilent定点诱变试剂盒产生,并通过全长DNA测序确认。短发夹RNA获自在pLKO.1嘌呤霉素载体中的RNAi Consortium(TRC)。短发夹序列如下:人BAP1(TRC寡核苷酸ID:TRCN0000078702和TRCN0000078698)、小鼠BAP1(TRCN0000030719和TRCN0000030720)、人L3MBTL2(TRCN0000021724和TRCN0000021726)以及编码荧光素酶的shRNA(shLUC)的对照pLKO.1-嘌呤霉素载体。
泛素试验:将HEK293T细胞接种在10-cm培养皿中,24小时后用4μg Myc-His-Ubi表达构建体和对照、1μg L3MBTL2和/或1~10μg BAP1-GFP过表达构建体进行转导。转染后48小时,将细胞在基于盐酸胍的裂解缓冲液:6M胍、0.1M NaH2PO4、10mM Tris(pH 8.0)和10mM BME中裂解。His-Ubi蛋白通过在室温下通过20μL Ni-NTA琼脂糖(Qiagen)孵育4小时来纯化。珠子用1mL的4种洗涤缓冲液:缓冲液A:6M胍、0.1M NaH2PO4、10mM Tris(pH 8.0)、10mM BME和0.2%Triton-X;缓冲液B:8M脲、0.1M NaH2PO4、10mM Tris(pH8.0)、10mM BME和0.2%Triton-X;缓冲液C:0.1M NaH2PO4、10mM Tris(pH 6.3)、10mM BME和0.2%Triton-X;以及缓冲液D:0.1M NaH2PO4、10mM Tris(pH 6.3)、10mM BME和0.1%Triton-X依次洗涤。所有缓冲液补充有15mM咪唑。通过用补充有咪唑的2x SDS Laemmli缓冲液煮沸,从珠中纯化His-标签的蛋白质。然后通过蛋白质印迹分析蛋白质。
体外集落形成试验:使用FACSAria将细胞进行Lin-c-Kit+Sca1+细胞分选。一式两份将100个细胞铺板在甲基纤维素(MethoCult GF M3434,Stem Cell Technologies)中。在铺板后14天计数菌落,并通过用PBS洗涤收集菌落,然后裂解细胞用于RNA和组蛋白提取。
瞬时转染:用指定的构建体用X-treme基因转染试剂(Roche)转染293T细胞。转染后48~72小时提取蛋白质和/或组蛋白。
侵袭试验:将间皮瘤细胞(MSTO-211H、H2373、H226和H2452)接种在T75烧瓶(100,000个细胞)中。12小时后,将铺板的细胞用GSK126(0~2μM)(Chemitek)处理,然后让其增殖7天。然后将250,000个处理的细胞置于无血清培养基中的Matrigel侵袭室(BD Biosciences,cat#354480)的顶部,而下室含有具有血清的培养基。22小时后,膜底部的细胞用结晶紫染色并用ImageJ定量。
荧光素酶试验:除了EV、BAP1和L3MBTL2构建体外,用pGL3EZH2启动子报告构建体(来自Naomi Goldfinger的慷慨惠赠)和Switchgear Renilla对照构建体瞬时转染293T细胞。使用DualLuciferase Reporter Assay System(Promega)评估细胞的荧光素酶活性。将细胞接种在24孔板中,并用200ng pGL3-EZH2-荧光素酶、200ng海肾荧光素酶对照构建体和500ng实验构建体共转染。在转染后将细胞孵育48小时,在室温下裂解15分钟,并在发光计上评价荧光素酶活性。将萤火虫荧光素酶读数归一化到海肾转染对照。
统计分析:除非在上下文中有所描述,否则使用具有Welch校正的Student t检验来分析统计学显著性。使用Prizm GraphPad软件用于统计计算。使用SEM计算误差,*p<0.05,**p<0.005。
7.2结果
基因组研究确定在不同恶性肿瘤中肿瘤抑制基因ASXL1和BAP1的体细胞突变。果蝇(Drosophila)ASXL1同源物Asx和BAP1同源物Calypso形成一个去除H2AK119Ub的复合物(Scheuermann等人,2010)。然而,BAP1-ASXL1复合物未显示在BAP1突变体转化中起作用。ASXL1中的失活突变最常见于髓性恶性肿瘤中(Abdel-Wahab等人,2011;Bejar等人,2011;Gelsi-Boyer等人,2009),而重复发生的BAP1突变通常在间皮瘤(Bott等人,2011)、肾细胞癌(Pena-Llopis等人,2012)和转移性葡萄膜黑色素瘤(Harbour等人,2010)中观察到,提示着BAP1和ASXL1在肿瘤抑制中具有不同的作用。这些突变谱不能由差异组织特异性的BAP1和ASXL1表达来解释(图5A-C)。本实施例鉴定BAP1缺失导致转化的机制,不依赖于ASXL1,并鉴定在BAP1突变癌细胞中的治疗缺陷。
最近的研究表明,Bap1的体细胞缺失可以促进造血转化(Dey等人,2012)。研究了条件Bap1缺失对造血细胞中基因表达和染色质状态的影响(图5A、B)。Bap1的条件缺失使用图5D中所示的方案产生。使用成年动物诱导后驱动造血组织中的Bap1缺失的重组酶MX-Cre。Bap1缺失导致具有脾肿大(图6A)、白细胞增多(图5E、F)、贫血(图5G、H)和粒细胞巨噬细胞祖细胞(GMP)扩增(图5I-K)的完全渗透性骨髓增生性疾病。例如,在Bap1敲除(KO)小鼠中,观察到脾脏的大小(例如重量和长度)在尺寸上大于BAP1野生型小鼠(图6A、10C和11C)。还观察到Bap1缺陷型髓样祖细胞的增殖和细胞周期进展的增加(图5L)。RNA测序分析揭示Bap1缺陷型GMP中大多数差异表达的基因具有降低的表达(p-adj<0.001)(图7A)。尽管观察到在Bap1和Asxl1KO祖细胞中的差异表达的基因集之间的显著重叠,但是在许多情况下观察到对基因表达的矛盾的反作用(图6B)。基因集富集分析(GSEA)鉴定了Bap1和Asxl1KO祖细胞中富集的逆向影响基因集(Abdel-Wahab等人,2013)(图7B)。ASXL1沉默导致HoxA簇基因的表达增加,与PRC2活性降低一致(Abdel-Wahab等人,2012)。相比之下,在Bap1缺陷性细胞中观察到HoxA基因成员的表达降低(图6C)和HoxA基因标志物的表达降低(图7C)。这些数据表明Asxl1和Bap1的缺失对基因调节具有相反的作用。
ASXL1与PRC2复合物直接相互作用,并且ASXL1耗减使全局和位点特异性的H3K27me3减少(Abdel-Wahab等,2012)。鉴于Asxl1和Bap1缺失对基因表达的不同影响,研究了Bap1缺失对H3K27me3的影响。通过组蛋白质谱(图6D)、蛋白质印迹(图6E)和ELISA(图8A),在Bap1KO细胞中H3K27me3水平增加。H3K27me3染色质免疫沉淀测序(ChIP-Seq)显示Bap1KO小鼠中H3K27me3的全面增加(图6F)、H3K27me3宽结构域数目增加(Beguelin等人,2013)(图6G),以及“扩展”到附近基因座的H3K27me3宽结构域增加(图6H)。这种H3K27me3增加和扩展在Bap1KO细胞的HoxA基因座中很好地呈现(图6I)。在Bap1KO细胞中标记有H3K27me3的位点主要发生在基因启动子区域(图8B),并且具有H3K27me3-占据的启动子的基因富集以增强抑制(FDR<0.001)(图6J)。在纯化的GMP中观察到类似发现(图6K)。由Bap1KO相关的H3K27me3和基因抑制而失调的基因参与EZH2依赖性调节、谱系定向/分化和增殖(图6L、图8C)。BAP1沉默增加H3K27me3(图9A),并且在Bap1缺陷型细胞中BAP1的重新表达降低H3K27me3水平(图9B)。相比之下,去泛素化酶缺陷型BAP1等位基因不减少H3K27me3(图9C),证明H3K27me3中的改变是由于BAP1催化活性。
接下来,PRC2介导的H3K27me3对BAP1依赖性转化的作用通过研究Ezh2缺失(Su等人,2003)对体内转化的影响来评估。与Bap1敲除小鼠相比,Ezh2缺失减少Bap1/Ezh2缺陷型小鼠中的H3K27me3水平(图11A)。Ezh2缺失消除由Bap1缺失诱导的髓性恶性肿瘤(图10A),具有具有减少的脾肿大(图11B、C)、白细胞增多(图11D)和贫血(图11E)。伴随的Bap1/Ezh2缺失减少了髓样祖细胞扩张(图11F)、减少了Macl+Gr1+髓样细胞的比例(图11G)并且恢复红细胞分化(CD71+Ter119+)(图10B)。观察到Bap1/Ezh2缺陷型祖细胞的减少的增殖(图11H)。Ezh2单倍体不足使Bap1缺陷型骨髓增生减弱,但并没有消除(图10C、10D),与Ezh2的剂量依赖性需求一致。与遗传数据一致,用小分子抑制剂EPZ011989(Campbell等,2015)治疗Bap1KO小鼠减少H3K27me3、脾肿大和白细胞计数(图11I-K)。这些数据表明PRC2,特别是Ezh2活性,是Bap1缺陷型骨髓转化所需的。
接下来,研究了Bap1缺失使H3K27me3水平增加的机制。与报道的ASXL1和BAP1之间以及ASXL1和PRC2之间的相互作用相比,通过免疫共沉淀(co-IP)没有鉴定到BAP1和EZH2之间的相互作用(图13A)。观察到Ezh2和Suz12的mRNA和蛋白质表达的增加(图13B、C),与Bap1在调节PRC2表达中的作用一致。此外,与野生型BAP1小鼠相比,来自Bap1KO小鼠的整个骨髓的分选的Lin-Sca+Kit+细胞(含有造血干细胞的群体)的分析显示出Suz12和Ezh2RNA表达的显著增加(图17)。而且,与对照细胞相比,在Bap1KO细胞中,全骨髓蛋白质印迹显示EZH2和SUZ12的蛋白质表达增加(图17)。在Bap1KO骨髓细胞中再表达BAP1,将Ezh2mRNA表达降低至正常水平(图12A)。假设Bap1缺失可能直接改变其他组蛋白标志,这将随后改变包括EZH2的关键靶基因座的染色质状态。与其它测量的组蛋白标志(图12B)相比,组蛋白质谱显示Bap1KO细胞中H4K20me1的显著减少(图13D)。不是ASXL1或BMI1,而是BAP1的表达增加了EZH2基因座处的H4K20me1(图12C)。因此假设,H4K20me1标志物的丧失可能在BAP1-依赖性基因表达中具有重要的作用。SETD8是唯一已知的评价H4K20me1的甲基转移酶(Nishioka等人,2002)。在BAP1突变型间皮瘤细胞(H226、H2452)中SETD8的表达增加细胞凋亡并减少增殖,而野生型(MSTO-21H和Meso10)细胞不受影响(图13E、F)。在间皮瘤细胞中SETD8的过表达降低EZH2mRNA和蛋白质表达(图13G、H)。BAP1野生型细胞系对SETD8抑制剂(Blum等人,2014)(BVT594)比BAP1-突变型细胞系更敏感(图13I)。
假设BAP1使调节H4K20me1的染色质调节子去泛素化。ChIP-Seq数据的分析(Abdel-Wahab等人,2013;Dey等人,2012)鉴定了具有Bap1占据但不具有Asxl1结合的基因簇(簇1),并富集用于E盒基序(图14A、B)。先前的研究表明,非典型多梳蛋白L3MBTL1和L3MBTL2结合E盒基序,并且可以结合和维持H4K20me1(Guo等人,2009;Qin等人,2012;Trojer等人,2011;Trojer等人,2007)。L3mbtl1缺陷型小鼠没有明显的表型(Qin等人,2010),而L3mbtl2缺陷型小鼠是胚胎致死的,类似于在Bap1缺失的时候(Dey等人,2012;Qin等人,2012)。因此,研究了Bap1缺失是否导致L3mbtl2表达的改变。与BAP1野生型间皮瘤细胞相比,在BAP1KO造血细胞(图15A、B)和BAP1突变型间皮瘤细胞中,L3mbt12蛋白质而不是RNA表达降低(图13J)。L3MBTL2泛素化在表达BAP1的细胞中减少(图13K),并且蛋白酶体抑制剂治疗增加了L3MBTL2在BAP1突变型细胞中的稳定性(图15C)。L3MBTL2表达降低具有和不具有BAP1共表达的EZH2蛋白水平(图15D),并且BAP 1的表达或L3MBTL2过表达降低EZH2启动子活性(图15E)。相反,L3MBTL2沉默增加EZH2的表达(图15F)。在表达L3MBTL2和BAP1的细胞中观察到在EZH2基因座处L3MBTL2和BAP1的富集(图15G、H)。不受特定理论的束缚,这些数据表明BAP1和L3MBTL2相互作用(图15I)并共占据EZH2基因座。BAP1缺失导致L3MBTL2稳定性降低和EZH2转录输出增加(图13L)。
TCGA数据的分析揭示,EZH2mRNA表达在间皮瘤中增加(图16A)。接下来,评估EZH2抑制是否可能抑制BAP1突变型间皮瘤细胞系的存活。EZH2沉默诱导BAP1突变型细胞系中的凋亡,而野生型细胞系继续增殖(图16B、C)。EZH2沉默消除BAP1突变型而非野生型细胞系的体内肿瘤形成(图16D)。EZH2在BAP1野生型细胞系中的过表达增加了增殖(图20A)以及对EZH2抑制的敏感性(图20B)。BAP1突变型细胞系在体外2D(图16E)和3D培养(图16F)中对EZH2抑制(EPZ011989)更敏感。接下来,评估EZH2抑制在体内的影响。与载体治疗的小鼠相比,EZH2抑制显著降低了BAP1突变型肿瘤大小(图16G),而尽管对H3K27me3具有类似的作用,野生型肿瘤对EZH2抑制较少/不应答(图16H)。EZH2抑制在具有转移潜能的BAP1突变型间皮瘤细胞系中消除肺转移(图16G),与BAP1/EZH2在转移中的作用一致(Harbour等人,2010)。EZH2抑制在体外减少侵袭并增加E-钙粘蛋白表达(图20C-D)。接下来,评估使用BAP1抑制剂GSK126的EZH2抑制的影响。将BAP1突变型间皮瘤细胞注射到NOD-SCID小鼠的侧腹中,然后在肿瘤形成后用载体或150mg/kg GSK126开始治疗。与载体治疗的小鼠相比,EZH2抑制显著降低肿瘤大小(图21A和图4)。GSK126治疗在体内显著减少BAP1突变型细胞中的H3K27me3(图21B)。病理学分析显示EZH2抑制与减少的Ki67染色和增加的TUNEL染色相关(图21C)。这些数据表明EZH2代表BAP1突变型癌细胞中的潜在治疗靶标。
致癌性EZH2突变的鉴定(Morin等人,2010;Morin等人,2011;Pasqualucci等人,2011)已引起突变特异性表观遗传治疗的发展。然而,表观遗传调节子中的大多数突变导致功能丧失,使得它们无法作为易处理的直接治疗靶标。最近,EZH2抑制剂已进入临床试验(McCabe等人,2012),并且所公开的数据表明BAP1缺失导致PRC2中的突变特异性的依赖性,这应当在临床前和临床研究中进一步探讨。这些数据与最近研究引起共鸣,表明PRC2抑制在SWI/SNF突变型横纹肌样瘤中的作用(Alimova等人,2013;Knutson等人,2013)并且分析显示BAP1突变与SWI/SNF突变是互相排斥的(Wilson等人,2010)。这些数据表明,表观遗传调节子突变的详细研究可用于预示治疗的发展,其在不同恶性背景下逆转对表观遗传状态的突变特异性作用。
7.3讨论
BAP1和ASXL1相互作用以形成多梳去泛素化酶复合物,其可以从组蛋白H2A赖氨酸119中去除单泛素(H2AK119Ub)。然而,BAP1和ASXL1在不同的癌症类型中突变,与调节表观遗传状态和恶性转化中的独立作用一致。在该实施例中,证明BAP1缺失导致增加的三甲基化组蛋白H3赖氨酸27(H3K27me3)、升高的Ezh2表达和增强的多梳抑制复合物2(Polycomb Repressive Complex 2)(PRC2)靶标的抑制。这些发现与在Asxl1缺失中观察到的H3K27me3的减少形成对比。条件性Bap1和Ezh2缺失在体内消除由单独的Bap1缺失诱导的髓样祖细胞扩张。Bap1的缺失导致H4K20单甲基化(H4K20me1)的显著降低。与H4K20me1在EZH2转录调节中的作用一致,H4K20mel甲基转移酶SETD8的表达减少EZH2表达和消除BAP1突变型细胞的增殖。而且,缺乏BAP1的间皮瘤细胞对EZH2药理学抑制敏感,表明BAP1突变型恶性肿瘤的新型治疗方法。
8.参考文献
Abdel-Wahab,O.,Adli,M.,LaFave,L.M.,Gao,J.,Hricik,T.,Shih,A.H.,Pandey,S.,Patel,JP.,Chung,Y.R.,Koche,R.,et al.(2012).ASXL1 mutations promote myeloid transformation through loss of PRC2-mediated gcne repression.Cancer Cell 22,180-193.
Abdel-Wahab,O.,Gao,J.,Adli,M.,Dey,A.,Trimarchi,T.,Chung,Y.R.,Kuscu,C.,Hricik,T.,Ndiaye-Lobry,D.,Lafave,L.M.,etal.(2013).Deletion of Asxll results in myelodysplasia and severe developmental defects in vivo.J Exp Med 210,2641-2659.
Abdel-Wahab,O.,Pardanani,A.,Patel,J.,Wadleigh,M.,Lasho,T.,Heguy,A.,Beran,M.,Gilliland,D.G.,Levine,R.L.,and Tefferi,A.(2011).Concomitant analysis of EZH2and ASXL1mutations in myelofibrosis,chronic myelomonocytic leukemia and blast-phase myeloproliferative neoplasms.Leukemia25,1200-1202.
Alimova,I.,Birks,D.K.,Harris,P.S.,Knipstein,J.A.,Venkataraman,S.,Marquez,V.E.,Foreman,N.K.,and Vibhakar,R.(2013).Inhibition of EZH2suppresses self-renewal and induces radiation sensitivity in atypical rhabdoid teratoid tumor cells.Neuro Oncol15,149-160.
Beguelin,W.,Popovic,R.,Teater,M.,Jiang,Y.,Bunting,K.L.,Rosen,M.,Shen,H.,Yang,S.N.,Wang,L.,Ezponda,T.,et al.(2013).EZH2is required for germinal center formation and somatic EZH2mutations promote lymphoid transformation.Cancer Cell 23,677-692.
Bejar,R.,Stevenson,K.,Abdel-Wahab,O.,Galili,N..Nilsson,B.,Garcia-Manero,G.,Kantarjian,H.,Raza,A.,Levine,R.L.,Neuberg,D.,et al.(2011).Clinical effect ofpoint mutations in myelodysplastic syndromes.The New England journal of medicine 364,2496-2506.
Blum,G.,Ibanez,G.,Rao,X.,Shum,D.,Radu,C.,Djaballah,H.,Rice,J.C..and Luo,M.(2014).Small-molecule inhibitors of SETD8with cellular activity.ACS Chem Biol9,2471-2478.
Bott,M.,Brevet,M.,Taylor,B.S.,Shimizu,S.,Ito,T.,Wang,L.,Creaney,J.,Lake,R.A.,Zakowski,M.F.,Reva,B..et al.(2011).The nuclear deubiquitinase BAP1is commonly inactivated by somatic mutations and 3p21.1losses in malignant pleural mesothelioma.Nature genetics 43,668-672.
Campbell,J.E.,Kuntz,K.W.,Knutson,S.K.,Warholic,N.M.,Keilhack,H.,Wigle,T.J.,Raimondi,A.,Klaus,C.R.,Rioux,N.,Yokoi,A.,et al.(2015).EPZ011989,A Potent,Orally-Available EZH2Inhibitor with Robust in Vivo Activitv.ACS Med Chem Lett 6491-495.
Dey,A.,Seshasayee,D.,Noubade,R.,French,D.M.,Liu,J.,Chaurushiya,M.S.,Kirkpatrick,D.S.,Pham,V.C.,Lill,J.R.,Bakalarski,C.E.,et al.(2012).Loss of the tumor suppressor BAP1 causes myeloid transformation.Science337,1541-1546.
Garcia,B.A.,Mollah,S.,Ueberheide,B.M.,Busby,S.A.,Muratore,T.L.,Shabanowitz,J.,and Hunt,D.F.(2007).Chemical derivatization of histones for facilitated analysis by mass spectrometry.Nat Protoc 2,933-938.
Gelsi-Boyer,V.,Trouplin,V.,Adelaide,J.,Bonansea,J.,Cervera,N.,Carbuccia,N.,Lagarde,A.,Prebet,T.,Nezri,M.,Sainty,D.,et al.(2009).Mutations of polycomb-associated gene ASXL1 in myelodysplastic syndromes and chronic myelomonocytic leukaemia.British journal of haematology 145,788-800.
Guo,Y.,Nady,N.,Qi,C.,Allali-Hassani,A.,Zhu,H.,Pan,P.,Adams-Cioaba,M.A.,Amaya,M.F.,Dong,A.,Vedadi,M.,et al.(2009).Methylation-state-specific recognition of histones by the MBT repeat protein L3MBTL2.Nucleic Acids Res 37,2204-2210.
Harbour,J.W.,Onken,M.D.,Roberson,E.D.,Duan,S.,Cao,L.,Worley,L.A.,Council,M.L.,Matatall,K.A.,Helms,C.,and Bowcock,A.M.(2010).Frequent mutation of BAP1in metastasizing uveal melanomas.Science 330,1410-1413.
Knutson,S.K.,Warholic,N.M.,Wigle,T.J.,Klaus,C.R.,Allain,C.J.,Raimondi,A.,Porter Scott,M.,Chesworth,R.,Moyer,M.P.,Copeland,R.A.,et al.(2013).Durable tumor regression in genetically altered malignant rhabdoid tumors by inhibition of methyltransferase EZH2.Proc Natl Acad Sci USA 110,7922-7927.
Krivtsov,A.V.,Feng,Z.,Lemieux,M.E.,Faber,J.,Vempati,S.,Sinha,A.U.,Xia,X.,Jesneck,J.,Bracken,A.P.,Silverman,L.B.,et al.(2008).H3K79methylation profiles define murine and human MLL-AF4leukemias.Cancer Cell 14,355-368.
Lara-Astiaso,D.,et al.Immunogenetics.Chromatin state dynamics during blood formation.Science 345,943-949(2014).
Love,M.I.,Huber,W.,and Anders,S.(2014).Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2.Genome biology15,550.
MacLean,B.,Tomazela,D.M.,Shulman,N.,Chambers,M.,Finney,G.L.,Frewen,B.,Kem,R.,Tabb,D.L.,Liebler,D.C.,and MacCoss,M.J.(2010).Skyline:an open source document editor for creating and analyzing targeted proteomics experiments.Bioinformatics 26,966-968.
McCabe,M.T.,Ott,H.M.,Ganji,G.,Korenchuk,S.,Thompson,C.,Van Aller,G.S.,Liu,Y.,Graves,A.P.,Della Pietra,A.,3rd,Diaz,E.,et al.(2012).EZH2inhibition as a therapeutic strategy for lymphoma with EZH2-activating mutations.Nature492,108-112.
Morin,R.D.,Johnson,N.A.,Severson,T.M.,Mungall,A.J.,An,J.,Goya,R.,Paul,J.E.,Boyle,M.,Woolcock,B.W.,Kuchenbauer,F.,et al.(2010).Somatic mutations altering EZH2(Tyr641)in follicular and diffuse large B-cell lymphomas of germinal-center origin.Nature genetics 42,181-185.
Morin,R.D.,Mendez-Lago,M.,Mungall,A.J.,Goya,R.,Mungall,K.L.,Corbett,R.D.,Johnson,N.A.,Severson,T.M.,Chiu,R.,Field,M.,et al.(2011).Frequent mutation of histone-modifying genes in non-Hodgkin lymphoma.Nature476,298-303.
Nishioka,K.,Rice,J.C.,Sarma,K.,Erdjument-Bromage,H.,Werner,J.,Wang,Y.,Chuikov,S.,Valenzuela,P.,Tempst,P.,Steward,R.,et al.(2002).PR-Set7is a nucleosome-specific methyltransferase that modifies lysine 20of histone H4and is associated with silent chromatin.Mol Cell9,1201-1213.
O′Geen,H.,Echipare,L.,and Farnham,P.J.(2011).Using ChIP-seqtechnology to generate high-resolution protiles of histone modificatiohs.Methods Mol Biol 791,265-286.
Pasqualucci,L.,Trifonov,V.,Fabbri,G.,Ma,J.,Rossi,D.,Chiarenza,A.,Wells,V.A.,Grunn,A.,Messina,M.,Elliot,O.,et al.(2011).Analysis of the coding genome of diffuse large B-cell lymphoma.Nat Genet 43,830-837.
Pena-Llopis,S.,Vega-Rubin-de-Celis,S.,Liao,A.,Leng,N.,Pavia-Jimenez,A.,Wang,S.,Yamasaki,T.,Zhrebker,L.,Sivanand,S.,Spence,P.,et al.(2012).BAP1loss defines a new class of renal cell carcinoma.Nat Genet 44,751-759.
Phung,Y.T.,Barbone,D.,Broaddus,V.C.,and Ho,M.(2011).Rapid generation of in vitro multicellular spheroids for the study of monoclonal antibody therapy.Journal of Cancer 2,507-514.
Qin,J.,Van Buren,D.,H uang,H.S.,Zhong,L.,Mostoslavsky,R.,Akbarian,S.,and Hock,H.(2010).Chromatin protein L3MBTL1 is dispensable for development and tumor suppression in mice.J Biol Chem 285,27767-27775.
Qin,J.,Whyte,W.A.,Anderssen,E.,Apostolou,E.,Chen,H.H.,Akbarian,S.,Bronson,R.T.,Hochedlinger,K.,Ramaswamy,S.,Young,R.A.,et al.(2012).The polycomb group protein L3mbtl2assembles an atypical PRC1-family complex that is essential in pluripotent stem cells and early development.Cell Stem Cell 11,319-332.
Scheuermann,J.C.,de Ayala Alonso,A.G.,Oktaba,K.,Ly-Hartig,N.,McGinty,R.K.,Fraterman,S.,Wilm,M.,Muir,T.W.,and Muller,J.(2010).Histone H2A deubiquitinase activity of the Polycomb repressive complex PR-DUB.Nature465,243-247.
Skarnes,W.C.,Rosen,B.,West,A.P.,Koutsourakis,M.,Bushell,W.,Iyer,V.,Mujica,A.O.,Thomas,M.,Harrow,J.,Cox,T.,et al.(2011).A conditional knockout resource for the genome-wide study of mouse gene function.Nature 474,337-342.
Su,I.H.,Basavaraj,A.,Krutchinsky,A.N.,Hobert.O.,Ullrich,A.,Chait,B.T.,and Tarakhovsky,A.(2003).Ezh2controls B cell development through histone H3methylation and Igh rearrangement.Nat Immunol 4,124-131.
Suraokar,M.B.,Nunez,M.I.,Diao,L.,Chow,C.W.,Kim,D.,Behrens,C.,Lin,H.,Lee,S.,Raso,G.,Moran,C.,et al.(2014).Expression profiling stratifies mesothelioma tumors and signifies deregulation of spindle checkpoint pathway and microtubule network with therapeutic implications.Annals of oncology:official journal of the European Society for Medical Oncology/ESMO25,1184-1192.
Trojer,P.,Cao,A.R.,Gao,Z.,Li,Y.,Zhang,J.,Xu,X.,Li,G.,Losson,R.,Erdjument-Bromage,H.,Tempst,P.,et al.(2011).L3MBTL2protein acts in concert with PcG protein-mediated monoubiquitination of H2A to establish a repressive chromatin structure.Mol Cell 42,438-450.
Trojer,P.,Li,G.,Sims,R.J.,3rd,Vaquero,A.,Kalakonda,N.,Boccuni,P.,Lee,D.,Erdjument-Bromage,H.,Tempst,P.,Nimer,S.D.,et al.(2007).L3MBTL1,a histone-methylation-dependent chromatin lock.Cell 129,915-928.
Wilson,B.G.,Wang,X.,Shen,X.,McKenna,E.S.,Lemieux,M.E.,Cho,Y.J.,Koellhoffer,E.C.,Pomeroy,S.L.,Orkin,S.H.,and Roberts,C.W.(2010).Epigenetic antagonism between polycomb and SWI/SNF complexes during oncogenic transformation.Cancer Cell 18,316-328.
本文引用了各种参考文献,其全部内容引入本文以供参考。本文引用了各种核酸和氨基酸序列登录号,并且由那些登录号引用的完整序列的全部内容引入本文以供参考。
- 还没有人留言评论。精彩留言会获得点赞!