甘蓝型油菜波里马细胞质雄性不育恢复基因Rfp及其应用的制作方法
本发明属于油菜育种技术领域。具体涉及甘蓝型油菜波里马细胞质雄性不育恢复基因rfp及其应用。本发明涉及的显性基因rfp是隐性基因rfp的功能获得性变异的同源基因。恢复基因rfp的克隆、验证和应用可以加快油菜等作物细胞质雄性不育系、保持系和恢复系的选育,从而大大缩短育种的周期。
背景技术:
植物雄性不育是指雄配子发育异常,而雌配子发育正常,能接受外来正常花粉结实的现象(hanson,m.r.ands.bentolila,interactionsofmitochondrialandnucleargenesthataffectmalegametophytedevelopment.plantcell,2004.16:p.s154-s169)。这一现象最早由德国人科勒在1763年发现,目前已在600多种植物中有相关报道。根据遗传模式的差异,植物雄性不育主要分为核不育(genicmalesterility,gms)和胞质不育(cytoplasmicmalesterility,cms)。细胞核雄性不育的遗传方式符合孟德尔遗传规律,而细胞质雄性不育则以母系遗传的形式存在(kaul,m.l.h.,malesterilityinhigherplants.monographsontheoreticalandappliedgenetics;vol.10.1988,berlin[etc.]:springer)。而依据败育的时期和花药组织细胞学特征,细胞质雄性不育又分为绒毡层和花粉无细胞发育异常的孢子体不育(sporophyticmale-sterility)和小孢子或花粉粒发育异常的配子体不育(gametophyticmale-sterility)两种形式(guo,j.x.andy.g.liu,molecularcontrolofmalereproductivedevelopmentandpollenfertilityinrice.journalofintegrativeplantbiology,2012.54(12):p.967-978.)。
细胞质雄性不育是利用杂种优势极为有效的方式,在水稻、小麦、油菜、玉米、高粱等主要农作物的杂交育种中起了很大的作用,但是其机理仍没有被人们研究透彻(chase,c.d.,cytoplasmicmalesterility:awindowtotheworldofplantmitochondrial-nuclearinteractions.trendsingenetics,2007.23(2):p.81-90)。细胞质雄性不育现象与育性恢复是受细胞核和细胞质基因双重调控的一种母性遗传性状,是研究植物细胞质遗传和核质互作的一个极好的材料,对cms机理的研究有助于加强对核质互作的认识(chen,l.t.andy.g.liu,malesterilityandfertilityrestorationincrops,inannualreviewofplantbiology,vol65,s.s.merchant,editor.2014,annualreviews:paloalto.p.579-606),同时对成花机制和花粉发育等植物花发育过程中的事件的研究无疑将起到推动作用。因此,研究cms分子机理不仅具有重要的生产利用价值,还具有重要的理论意义,cms/rf系统也自然成为当今一个科研热点。目前,世界上可以用于油菜杂种优势利用的cms系统有ogu、kos、tour和波里马。其中,波里马cms是目前国际上公认的最有实用价值的cms系统(傅廷栋,杂交油菜的育种与利用.2000:湖北科学技术出版社)。采用常规育种手段利用波里马cms系统需要培育不育系、保持系和恢复系以实现三系配套,而在三系选育过程中伴随着大量的杂交和多代回交需要大量的人力成本和漫长的育种周期。克服这一缺陷的可行策略是克隆波里马细胞质雄性不育恢复基因,开发恢复基因的功能标记用于分子标记辅助选择,或者在此基础上直接通过基因工程技术直接创制所需的育种材料。
技术实现要素:
本发明的目的本旨在克隆得到甘蓝型油菜波里马细胞质雄性不育恢复基因rfp,利用该基因恢复甘蓝型油菜波里马细胞质雄性不育系的育性,并在此基础上开发出功能标记,用于细胞质雄性不育系、保持系和恢复系的选育,从而加快育种进程,同时本发明克隆的基因也可通过转基因的技术直接用于恢复系的培育。
申请人通过分离和克隆技术,从甘蓝型油菜中分离得到甘蓝型油菜波里马细胞质雄性不育恢复基因rfp,该基因的核苷酸序列如序列表seqidno:1所示,其编码的蛋白质序列如seqidno:2所示。
分离得到不具备恢复功能的甘蓝型油菜波里马细胞质雄性不育恢复基因的隐性等位基因rfp,其核苷酸序列如序列表seqidno:3所示;该基因编码的蛋白质序列如序列表seqidno:4所示。
可以采用已经克隆的多核苷酸作探针,从cdna和基因组文库中筛选得到本发明的基因或同源基因。同样,采用pcr(polymerasechainreaction)技术,也可以从基因组、mrna和cdna中扩增得到本发明的基因以及任何感兴趣的一段多核苷酸或与其同源的一段多核苷酸。
本发明为甘蓝型油菜波里马细胞质雄性不育遗传改良提供了新的技术方案,其中包括作为恢复甘蓝型油菜波里马细胞质雄性不育不育系的育性;或作为新的不育系、保持系或者恢复系辅助选育的分子标记及其应用。
在本发明的实施例部分,申请人阐述了显性基因rfp和隐性基因rfp的分离、功能验证和应用过程以及这两个基因的特点。
附图说明
序列表seqidno:1是本发明分离的甘蓝型油菜波里马细胞质雄性不育恢复基因rfp的核苷酸序列,序列长度为1953bp,该基因来源于甘蓝型油菜波里马细胞质雄性不育恢复系bing409。
序列表seqidno:2是本发明分离的甘蓝型油菜波里马细胞质雄性不育恢复基因rfp编码的蛋白质序列,编码650个氨基酸,该基因来源于甘蓝型油菜甘蓝型油菜波里马细胞质雄性不育恢复系bing409。
序列表seqidno:3是本发明分离的不具备恢复功能的甘蓝型油菜波里马细胞质雄性不育恢复基因的隐性等位基因rfp的序列,序列长度为1953bp,该基因来源于甘蓝型油菜甘蓝型油菜波里马细胞质雄性不育不育系6330a。
序列表seqidno:4是本发明分离的不具备恢复功能的甘蓝型油菜波里马细胞质雄性不育恢复基因的隐性等位基因rfp编码的蛋白质序列,编码650个氨基酸,该基因来源于甘蓝型油菜甘蓝型油菜波里马细胞质雄性不育不育系6330a。
图1.本发明鉴定、分离、克隆并验证甘蓝型油菜波里马细胞质雄性不育恢复基因rfp和它的基因功能的流程图。
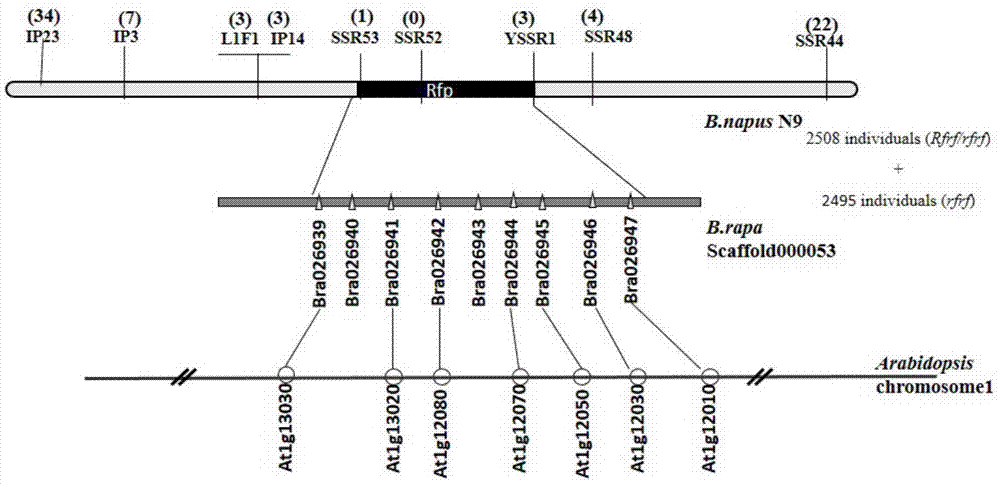
图2.覆盖甘蓝型油菜波里马细胞质雄性不育恢复基因rfp区段的物理图谱。附图标记说明:图2中:椭圆形线表示rfp基因精细定位的遗传图谱;分子标记下面的数字表示在近等基因系群体中检测到的rfp点与分子标记之间发生重组交换的单株数;矩形实线表示白菜基因组测序拼接的scaffold;线上的三角形代表相应区域白菜基因组图谱上注释的基因;连接分子标记和scaffold的竖线表示通过序列比较分析证实了相对应的分子标记和scaffold具有同源性;直线表示拟南芥染色体;线上的圆形代表相应区域拟南芥基因组图谱上注释的基因。
图3.拟南芥启动子分析载体pbi-rfpro的构建图。附图标记说明:nptⅱ(kanr):新霉素磷酸转移酶ⅱ基因;gus:β-葡萄糖苷酸酶基因。
图4.拟南芥t1代遗传转化植株花蕾gus染色结果。恢复基因rfp的启动子分析载体pbiprfpro-gus转化后的t1代遗传转化植株花蕾可看到明显的gus着色。
图5.甘蓝型油菜功能互补测验表达载体pc2300-rfp的构建图。
图6.具有6330a遗传背景的t1代遗传转化甘蓝型油菜植株开花后育性表型与6330a表型的比较。6330a遗传转化t1代植株携带显性基因rfp的候选基因,表现为花丝伸长,育性恢复,扫描电镜下花药饱满,花粉粒醋酸洋红染色正常。
图7.分离群体中可育株和不育株半薄切片显微解剖结构。附图标记说明:图7中的a图、b图、c图、d图、e图和f图分别是正常可育花药孢原细胞时期、花粉母细胞时期、减数分裂前期与减数分裂后期和四分体时期的半薄切片显微照片;图7中的g图、h图、i图、j图、k图和l图分别是不育花药对应时期的半薄切片显微照片;图7中的e图为表皮,ar为孢原细胞,ppc为初生造孢细胞,psc为初生周缘细胞,spc为初生周缘细胞,sp为小孢子母细胞,v为微管组织,en为药室内壁,ml为中层,t为绒毡层,tds为四分体,st为隔膜。
图8.开发的功能标记用于恢复系和保持系的选育。附图标记说明:r表示恢复系,b表示保持系,m表示maker。
图9.开发的功能标记用于杂交种纯度鉴定。附图标记说明:a表示假杂种,m表示maker。
具体实施方式
以下结合具体实施例,进一步定义本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克编著的《分子克隆:实验室指南》(newyork:coldspringharborlaboratory,1989)中所述的条件,或者按照生产厂商提供的操作手册中建议的条件。
实施例1:构建含甘蓝型油菜波里马细胞质雄性不育恢复基因rfp区段的物理图谱并精细定位不育恢复基因rfp
1.实验材料
本实施例所用的原始材料为油菜波里马细胞质雄性不育系6330a(zeng,f.q.,etal.,identificationofaflpandscarmarkerslinkedtothemalefertilityrestorergeneofpolcms(brassicanapusl.).euphytica,2009.165(2):p.363-369)及另一个油菜波里马细胞质雄性不育恢复系bing409(文献同上:zeng,f.q.,etal.,2009),选择恢复系bing409作供体亲本,并用6330a作为轮回亲本,通过多代回交然后兄妹交后得到的近等基因系(zeng,f.q.,etal.,2009)。
波里马细胞质雄性不育基因的定位群体不育株和可育株姊妹交后构建的近等基因系(近等基因系的构建方法请参见文献:zeng,f.q.,etal.,2009),2010年秋播种于武汉,2011年春天提取2508个来源于近等基因系的单株的dna,2011年秋播种于武汉,2012年春天提取2495个来源于近等基因系的不育单株的dna(提取dna的方法请参见stewart,c.n.,jr.andl.e.via,arapidctabdnaisolationtechniqueusefulforrapdfingerprintingandotherpcrapplications.biotechniques,1993.14(5):p.748-50),用于基因的精细定位。
2.精细定位不育恢复基因rfp
根据初步定位的结果该基因定位于甘蓝型油菜n18连锁群的scar(sequencecharacterizedamplifiedregion)标记ar23和ar48之间(zeng,f.q.,etal.,2009)。即rfp位点位于sc02和sc03之间。
设计的引物的核苷酸序列如下所示:
sc02f正向引物tagaatacgtcaaacgaggc,
sc02r反向引物ttgatcagagcgatgtactt;
sc03f正向引物tgatgcaggaaccttgaagc,
sc04r反向引物gagcatcttgcatggaggtc。
为了进一步缩小目标基因区域的范围,基于简单重复序列和内含子的多态性,申请人根据目标区域的序列设计了特异引物(或称之为分子标记),发现5个ssr和4个ip分子标记(或称引物)在亲本间表现多态性。进一步测序分析发现这些标记位于甘蓝型油菜的n9连锁群上与n18连锁群同源的一段区间。分子标记ssr44和ip23在5003个单株中分别检测到22个和34个重组单株,这些单株在标记和rfp位点间发生了重组(图2)。然后用其余的标记对交换单株进行分析,发现两侧最近的分子标记是引物ssr48和ssr53,两个标记分别有1个单株和3个单株在标记与rfp间发生重组,并有1个ssr标记与rfp基因表现为共分离,将rfp基因定位于分子标记yssr1和ssr53之间,与ssr52共分离。对与目标区段共线的白菜区域进行分析,发现该区域内有10个候选基因。用于精细定位的引物多的核苷酸序列如下所示:
ip23ftgctttcggaaatgtcactct(seqidno:5)
ip23rtgatatgcgtaatgaccaacg(seqidno:6)
ip3fagtcttcccttcaggcaacc(seqidno:7)
ip3rccccaaaactccacccatta(seqidno:8)
ip14faccacggatcatctgaaagg(seqidno:9)
ip14rccaaagcccaagcgtaagta(seqidno:10)
l1fgacatcgtcgtgatctcatc(seqidno:11)
l1rcaaagatgtgactactgtgg(seqidno:12)
ssr53fttaaagattaaacggcccagt(seqidno:13)
ssr53rccaatcgtaggcatggatgt(seqidno:14)
ssr52ftcaacaacaacagcctttcg(seqidno:15)
ssr52rggaagaagtcgcttcctgtg(seqidno:16)
yssr1ftgtcattggcttctgctgtc(seqidno:17)
yssr1ratatggagagtgccgctacg(seqidno:18)
ssr48fcatgcacgcttgttcttgat(seqidno:19)
ssr48rcttctttgcctccagctcag(seqidno:20)
ssr44ftgatgcattgtttgtgaatga(seqidno:21)
ssr44rtcatccaaaattcaagttgagc(seqidno:22)
注引物名称中最后一个英文字母含义分别为:f为正向引物;r为反向引物。
实施例2:显性基因rfp的分离和功能验证
1.rfp候选基因的确定
本实施例中采用模式生物是从拟南芥网站的报道的blast10(http://www.arabidopsis.org/blast)软件对分子标记ssr48和ssr53之间、包含rfp的甘蓝型油菜的序列进行分析,显示该区段可能存在10个基因,其中1个基因为ppr(pentatricopeptiderepeat,登陆号ipr002885)家族成员。通过对参考基因组序列进行分析确定这个基因的转录起始位点,利用高保真pcr聚合酶(phusiontmhigh-fidelitydnapolymerse,购自newenglandbiolads公司)分离基因上游非翻译区(即包含该基因启动子区域)约1.5kb的片段,将扩增片段克隆到pmd18-t(购自宝生物工程大连有限公司)载体上,测序结果表明序列完全准确,没有错配碱基存在。提取插入片段序列正确的克隆的融合质粒,分别用hindⅲ和kpnⅰ酶切组合处理质粒和双元载体pbi121(jefferson,r.a.,t.a.kavanagh,andm.w.bevan,gusfusions:beta-glucuronidaseasasensitiveandversatilegenefusionmarkerinhigherplants.emboj,1987.6(13):p.3901-7),分别回收目标片段后连接并转化大肠杆菌dh5α(购自宝生物工程大连有限公司),在含有50ug/ml卡那霉素的lb培养基上筛选转化子,挑选单菌落提取质粒,酶切检测准确的克隆所包含的载体就是包含正确启动子的融合载体pbirfpro-gus(见图3)。构建的启动子分析载体用农杆菌沾花的方法转化拟南芥野生型植株(zhang,x.r.,etal.,agrobacterium-mediatedtransformationofarabidopsisthalianausingthefloraldipmethod.natureprotocols,2006.1(2):p.641-646)。在含25mg/l卡那霉素的medium0培养基(成分见表1)上筛选转化拟南芥植株的种子,发现转基因的拟南芥即抗性植株根长,植株较大,子叶和真叶的颜色为鲜绿色;非转基因即抗性植株根很短,植株矮小,子叶黄化。当转基因植株长到3-5片真叶后移植到土中培养,得到约20株转基因植株。提取转基因阳性植株叶片总dna(stewart,c.n.,etal.,1993),用pbi121载体(见图3)上存在的nptⅱ基因(基因登陆号nc_004564.1)的cds序列设计的引物npt-f和npt-r(如下所示)通过pcr进一步鉴定转化植株。在开花期取转化植株的花蕾用90%丙酮处理后,再用x-glue染色液(jefferson,r.a,etal.,1987)在37℃避光条件下染色过夜,用70%浓度的酒精脱色后观察,发现具有pbirfpro-gus遗传背景的拟南芥花蕾有gus着色信号(见图4)。说明该基因与花发育相关,因此推测该基因为rfp基因。
npt-f(正向引物):gccacagtcgatgaatccag,
npt-r(反向引物):atggtggagcacgacactct。
2.rfp油菜转基因试验
本实施例采用植物表达载体pcambia2300(华中农业大学作物遗传改良国家实验室林拥军教授赠送,见图5)作为甘蓝型油菜转基因载体。该载体编码一个细菌复制起点(ori)、卡那霉素抗性基因(kan’)、camv35s启动子、nos基因的终止子以及限制性内切酶多克隆位点。通过分析携带候选基因的参考基因组序列的酶切位点和候选基因的关系,利用引物rfp-f、rfp-r和高保真pcr技术(phusiontmhigh-fidelitydnapolymerse,来自newenglandbiolads公司)扩增获得一个约7.8kb的片段。
rfp-f(正向引物):gctctagaccataactgccactaccacctccataactgccact;
rfp-r(反向引物):ggggtaccatgaagaagctcgaactgacgaacgaagacgagaa。
扩增获得该片段包含kpnⅰ和xbaⅰ酶切位点。片段包括基因上游非翻译区3834bp的序列、基因区间1,953bp的序列和下游非翻译区的2070bp的序列。将所得的扩增片段用胶回收试剂盒(购自上海生工生物工程技术服务有限公司)回收,用kpnⅰ和xbaⅰ双酶切后回收7.8kb的片段,连接到经kpnⅰ和xbaⅰ双酶切的表达载体pcambia2300上(图5),连接产物转化大肠杆菌菌株dh5α,在含有50ug/ml卡那霉素的lb培养基上筛选转化子,挑选单菌落提取质粒,并用通过测序检测确定核苷酸序列完全正确,成功构建了转化载体pc2300-rfp(见图5)。将正确的重组质粒通过冻融法(陈苇等,甘蓝型油菜fad2基因的rna干扰及无筛选标记高油酸含量转基因油菜新种质的获得.植物生理与分子生物学学报,2006(06):p.665-671)导入农杆菌菌株gv1301。甘蓝型油菜遗传转化采用常规的农杆菌转化法(陈苇等,2006)转化油菜波里马雄性不育系6330a,将6330a种子灭菌用70%浓度的酒精浸泡种子15min,0.1%升汞消毒15min,无菌水清洗3次,每次间隔5min。将灭过菌的种子播于medium0培养基(配方见表3),于25℃暗培养7d。在超净工作台内将获得的试管幼苗下胚轴切成0.5cm-0.8cm的小段,接种至含有农杆菌(悬浮过夜至对数生长期)的medium1上(配方见表3)浸染25min-30min后,吸干液体,于25℃黑暗条件下共培养3d。将外植体转到medium2愈伤组织诱导培养基(配方见表3)上,于25℃光照培养15-18d(光照强度800-1000lx)。再将外植体转入medium3分化培养基上培养(medium3中每15-18d继代1次),直至分化出幼苗。当幼苗长至2-3cm高时,将幼苗转入medium4生根培养基上诱导生根。转化植株生根后,假植于混有腐质土的细土纸杯中,保持70%相对湿度,一个月后移入大田。
提取转基因阳性植株叶片总dna,用引物npt-f和npt-r通过pcr方法进一步鉴定转化植株。用转基因t0代观察育性的表现,验证导入的候选基因的功能。结果显示在20株转基因t0代植株中,有15株表现为花丝伸长,育性恢复(见图6)。将t0代植株自交后代播于大田中,开花后调查植株育性,并提取叶片总dna,用引物m13-47(cgccagggttttcccagtcacgac)和rf47t(cgttccggagaacctacaaa)进行pcr鉴定:pcr扩增的反应体系是:30ng模板dna,各35ng正向和反向特异引物,1×pcr缓冲液,1utaq酶,0.15mmol/ldntps和2.0mmol/lmg2+,加ddh2o到总体积为15μl。pcr循环参数为94℃(30s)-58℃(30s)-72℃(1min),共32个循环。1.2%琼脂凝胶检测扩增产物。可确定遗传转化插入的片段与植株育性恢复共分离。
表3在遗传转化步骤中所用的各种培养基的配方
实施例3:细胞学切片分析
为了进一步确定波里马细胞质雄性不育败育的细胞学特点,并阐明rfp基因的功能,本发明对花药进行半薄切片观察,重点观察了造孢细胞时期至四分体时期过程中小孢子和绒毡层发育情况,比较了可育花药和不育花药绒毡层和小孢子在各时期发育的差异。半薄切片结果表明败育时期出现在孢原细胞分化时期(图7中的c图和图7中的i图),不育单株花药中l2层细胞不能正常分化出的药室内壁,中层,绒毡层以及小孢子母细胞;不育单株花药在发育至花粉母细胞时期(图7中的d图和图7中的j图)已经不能形成四个正常的角隅,向后发育至减数分裂时期(图7中的e图和图7中的k图)也不能形成药室或者形成1-2个异常的药室,而形成的药室中四分体的发育异常(图7中f图),最终不能形成产生花粉或者产生干瘪的花粉。rfp的主要功能可能是在花药发育过程中影响l2层细胞的分化,对其特化出的药室内壁,中层,绒毡层以及小孢子母细胞(小孢子)的发育起着至关重要的作用。
实施例4:恢复基因功能标记的开发和应用
通过比较克隆到的恢复基因及其隐性等位基因的序列开发了恢复基因的功能标记(如下所示),该标记可以在含有恢复基因的甘蓝型油菜dna中扩增出大约400bp的条带(见图8)。pcr扩增的反应体系是:30ng模板dna,各35ng正向和反向特异引物,1×pcr缓冲液,1utaq酶,0.15mmol/ldntps和2.0mmol/lmg2+,加ddh2o到总体积为15μl。pcr循环参数为94℃(30s)-60℃(30s)-72℃(1min),共32个循环。1.2%琼脂凝胶检测扩增产物。
rt5f(正向引物):gggatgcgatcctgatatttg
rt5r(反向引物):gagagaggctacagaacaaact
目前利用该标记从甘蓝型油菜自交系中筛选出大量的恢复系和保持系材料(见图8),这些材料可直接用于甘蓝型油菜强优势杂交组合的配制,可以有效的节约材料选育的时间,大大缩短育种了周期。同时由于该标记能够精确地区分波里马细胞质雄性不育恢复基因的有无,它可用于快速准确的鉴定利用波里马系统进行制种的杂交种纯度(见图9)。
在本发明所提及的所有文献都在本申请中引用作为参考文献,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明所讲述内容后,本领域的技术人员可以对本发明做各种改动或者修改,这些等价形式同样属于本申请所附的权利要求书所限定的范围。
主要参考文献
1.hanson,m.r.ands.bentolila,interactionsofmitochondrialandnucleargenesthataffectmalegametophytedevelopment.plantcell,2004.16:p.s154‐s169.
2.傅廷栋,杂交油菜的育种与利用.2000:湖北科学技术出版社.
3.stewart,c.n.,jr.andl.e.via,arapidctabdnaisolationtechniqueusefulforrapdfingerprintingandotherpcrapplications.biotechniques,1993.14(5):p.748‐50.
4.zeng,f.q.,etal.,identificationofaflpandscarmarkerslinkedtothemalefertilityrestorergeneofpolcms(brassicanapusl.).euphytica,2009.165(2):p.363‐369.
5.altschul,s.f.,etal.,gappedblastandpsi‐blast:anewgenerationofproteindatabasesearchprograms.nucleicacidsresearch,1997.25(17):p.3389‐402.
6.jefferson,r.a.,t.a.kavanagh,andm.w.bevan,gusfusions:beta‐glucuronidaseasasensitiveandversatilegenefusionmarkerinhigherplants.emboj,1987.6(13):p.3901‐7.
7.zhang,x.r.,etal.,agrobacterium‐mediatedtransformationofarabidopsisthalianausingthefloraldipmethod.natureprotocols,2006.1(2):p.641‐646.
8.陈苇等,甘蓝型油菜fad2基因的rna干扰及无筛选标记高油酸含量转基因油菜新种质的获得.植物生理与分子生物学学报,2006(06):p.665‐671。
- 还没有人留言评论。精彩留言会获得点赞!