抑制或突变TFIIAγ基因在农作物抗病中的应用的制作方法
本发明属于植物基因工程
技术领域:
。具体涉及抑制或突变tfiiaγ基因在农作物抗病中的应用。所述的应用涉及植物的转录因子iiaγ亚单位(transcriptionfactoriiagammasubunit,tfiiaγ)基因在抗细菌性病害中的应用。tfiiaγ基因是抗病反应中的负调控因子。抑制tfiiaγ基因表达的植株对携带转录激活类效应子(transcriptionactivator-likeeffector,tale)病原菌的能力显著提高。
背景技术:
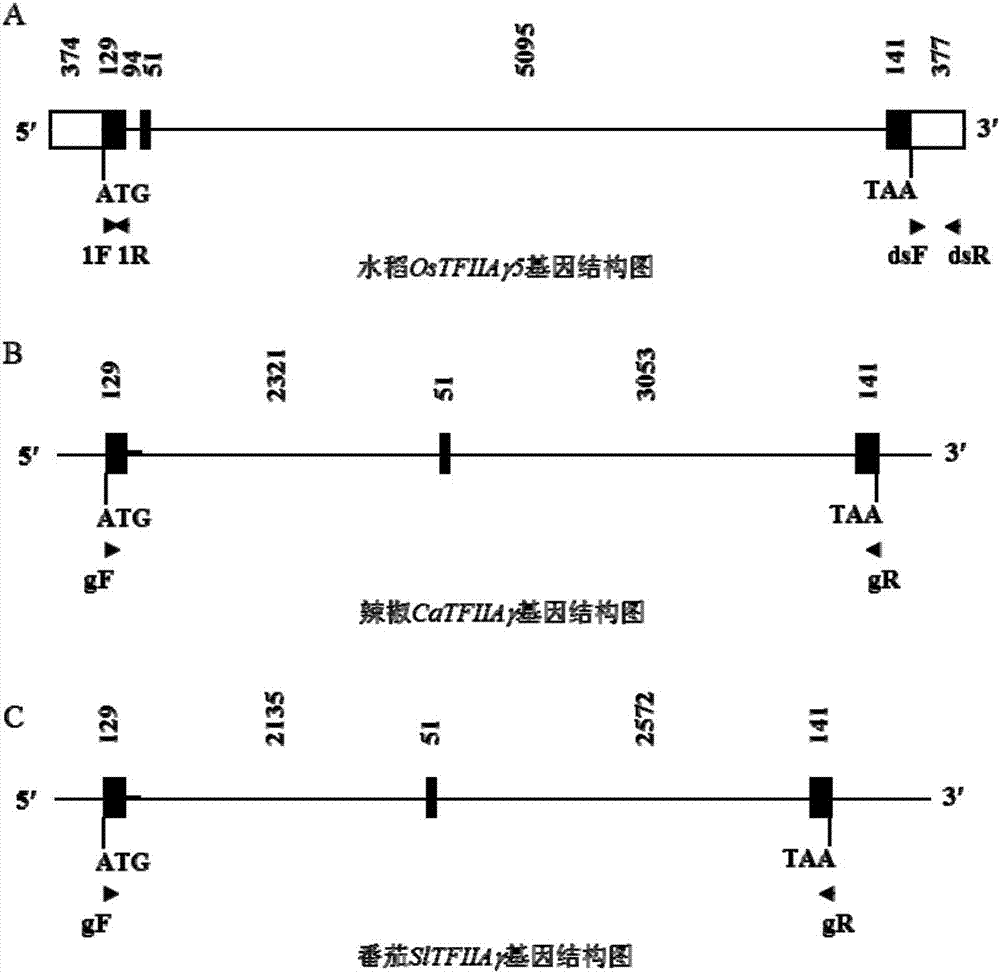
:黄单胞菌属(xanthomonas)是原核生物假单胞菌科的革兰氏阴性菌属,所有的黄单胞菌属的细菌都是植物病原菌,它包括很多致病变种,是世界性的病原菌,可以危害至少27个植物属的超过400多种类型植物(ryanetal.2011)。每年给各种植物安全生产带来严重的危害,不仅危害重要粮食作物,还严重危害重要经济作物和蔬菜,比如黄单胞菌属的水稻致病变种白叶枯病菌(xanthomonasoryzaepv.oryzae,xoo)和细菌性条斑病菌(xanthomonasoryzaepv.oryzicola,xoc)分别引起水稻的白叶枯病和细菌性条斑病;野油菜黄单胞菌(xanthomonascampestrispv.vesicatoria,xcv)可以引起番茄和辣椒的番茄细菌性疮痂病和辣椒斑点病;柑橘溃疡病菌(xanthomonasaxonopodispv.citri,xac)可以引起柑橘溃疡病;棉花角斑病菌(xanthomonascampestrispv.malvacearum,xcm)可以引起棉花角斑病;十字花科蔬菜黑腐病菌(xanthomonascampestrispv.armoraciae,xca)可以引起十字花科蔬菜黑腐病;木薯细菌性萎蔫病菌(xanthomonasaxonopodispv.manihotis,xam)可以引起木薯细菌性萎蔫病;香蕉细菌性萎蔫病菌(xanthomonascampestrispv.musacearum)可以引起香蕉细菌性萎蔫病;甘蔗流胶病菌(xanthomonascampestrispv.vasculorum)可以引起甘蔗流胶病;大豆斑疹病菌(xanthomonasaxonopodispv.glycines)可以引起大豆斑疹病(schornacketal.2006;ryanetal.2011;bartetal.2012)。黄单胞菌属危害植物主要是在侵染植物细胞后,通过iii型分泌系统将自身的转录激活类效应子(transcriptionactivator-likeeffector,tale)分泌进入植物细胞核内。黄单胞杆菌属不同致病变种携带不同数目的tale,这些tale通常直接结合在目标基因的启动子区的特定区域,通过激活诱导宿主的目标基因的表达,来达到使宿主致病的目的(scholzeandboch2011)。真核生物的mrna在转录过程中,最具特征化的内核启动子单元是tata框,其首先被基本转录因子tata框结合蛋白所识别,然后其它基本转录因子像tfiia(basaltranscriptionfactoriia)和tfiib顺序与之结合,形成转录的前起始复合物。tfiia和tata框结合蛋白互作,使tata框结合蛋白更加稳定结合在tata框上,以启动基因转录成mrna(yudkovskyetal.2000)。真核生物依赖于转录酶ii的转录都需要tfiia。tfiia由α、β、γ三个亚基组成,它们由两个基因编码;一个基因编码tfiiaαβ,另一个基因编码tfiiaγ(lietal.1999)。来源于不同真核生物的tfiiaγ 氨基酸序列高度相似。水稻中的一个tfiiaγ基因位于第5号染色体命名为ostfiiaγ5,它编码的ostfiiaγ5由106个氨基酸组成,当其第39位氨基酸由缬氨酸突变成谷氨酸后,即为xa5,由隐性抗白叶枯病主效基因xa5编码(iyerandmccouch2004;jiangetal.2006)。目前,人们知道含转录激活类效应子的黄单胞菌属细菌侵染它们宿主植物后,会分泌tale进入宿主细胞并结合在宿主目标感病基因的启动子的特定区域,激活宿主感病基因的表达,造成病害(bochetal.2014)。但是这个过程是否需要其它蛋白参与,或者宿主的基本转录因子在此过程中如何发挥作用都不清楚。技术实现要素:本发明的目的在于克服现有技术存在的缺陷,抑制或突变tfiiaγ基因在农作物抗病中的应用。本发明发现白叶枯病菌和细菌性条斑病菌的不同tale可以与宿主水稻的ostfiiaγ5结合,而与xa5结合减弱。携带隐性xa5基因的水稻不仅产生对白叶枯病的广谱抗性,同时也产生了对细菌性条斑病的广谱抗性。进一步,本发明发现抑制水稻的ostfiiaγ5基因的表达可以增强转基因水稻对白叶枯病菌和细菌性条斑病菌的广谱抗性;抑制辣椒的catfiiaγ基因的表达可以增强对辣椒斑点病的抗性;抑制番茄的sltfiiaγ基因的表达可以增强对番茄细菌性疮痂病的抗性。本发明涉及对不同植物的tfiiaγ基因的cdna片段进行遗传操作鉴定其功能,该片段赋予水稻对白叶枯病菌和细菌性条斑病菌所引起的病害产生抗病反应,赋予辣椒对辣椒斑点病菌所引起的病害产生抗病反应,赋予番茄对番茄细菌性疮痂病菌所引起的病害产生抗病反应。分离的水稻、辣椒和番茄的tfiiaγ基因的蛋白质序列如序列表seqidno:5、seqidno:7和seqidno:9所示,或者基本上相当于seqidno:5、seqidno:7和seqidno:9所示所示的蛋白质序列。对它们序列进行分析表明它们是一类转录因子。抑制seqidno:4所示序列的表达可以增强水稻对白叶枯病菌和细菌性条斑病菌的抗性;抑制seqidno:6所示序列的表达可以增强辣椒对辣椒斑点病菌的抗性;抑制seqidno:8所示序列的表达可以增强番茄对番茄细菌性疮痂病菌的抗性,在本发明的实施例部分,申请人阐述了对水稻、辣椒和番茄的遗传操作,功能验证和应用过程以及上述三个基因的特点。附图说明seqidno:1是本发明分离克隆的水稻ostfiiaγ5基因的核苷酸序列,序列长度为6261bp。其中5′utr区段是1-374位,长度是374bp;第一个外显子区段是375-503位,长度为129bp;第二个外显子区段是598-648位,长度为51bp;第三个外显子区段是5744-5884位,长度为141bp;3′utr区段是5885-6261位,长度是377bp;第一个内含子区段是是504-597位,长度为94bp;第二个内含子区段是649-5743位,长度为5095bp。seqidno:2是本发明分离克隆的辣椒catfiiaγ基因的核苷酸序列,序列长度为5695bp。其中:第一个外显子区段是1-129位,长度为129bp;第二个外显子区段是2451-2501位,长度为51bp;第三个外显子区段是5555-5695位,长度为141bp;第一个内含子区段是130-2450位,长度为2321bp;第二个内含 子区段是2502-5554位,长度为3053bp。序列表seqidno:3是本发明分离克隆的番茄sltfiiaγ基因的核苷酸序列,序列长度为5028bp。其中:第一个外显子区段是1-129位,长度为129bp;第二个外显子区段是2265-2315位,长度为51bp;第三个外显子区段是4888-5028位,长度为141bp;第一个内含子区段是130-2264位,长度为2135bp;第二个内含子区段是2316-4887位,长度为2572bp。序列表seqidno:4是拼接的水稻ostfiiaγ5基因的编码序列(cds)。序列表seqidno:5是水稻ostfiiaγ5基因的蛋白质序列。序列表seqidno:5是拼接的辣椒catfiiaγ基因的编码序列(cds)。序列表seqidno:7是辣椒catfiiaγ基因的蛋白质序列。序列表seqidno:8是拼接的番茄sltfiiaγ基因的编码序列(cds)。序列表seqidno:9是番茄sltfiiaγ基因的蛋白质序列。图1.本发明分离克隆水稻、番茄、辣椒tfiiaγ基因以及验证tfiiaγ基因功能的流程图。图2.水稻、番茄和辣椒中ostfiiaγ5基因的结构。附图标记说明:黑色长方形示外显子,黑色横线示内含子,白色长方形示5′和3′非翻译区(untranslatedregion,utr)。“atg”和“taa”分别是翻译起始密码和终止密码。数字示每一种结构的核苷酸数目。箭头示pcr扩增引物1f、1r、gf、gr、dsf和dsr的位置和方向。图3.携带ostfiiaγ5基因的遗传转化载体pds1301的结构。它是在pds1301载体的多克隆位点插入了ostfiiaγ5基因的cdna片段的反向重复序列。附图标记说明:rb和lb代表t-dna右和左边界;hpt代表潮霉素磷酸转移酶基因(筛选基因);35s代表花椰菜花叶病毒启动子;adhi代表玉米乙醇脱氢酶基因内含子i;waxy-a代表水稻waxy基因内含子;ocs代表章鱼碱合成酸基因终止子;gus代表β-葡萄糖苷酸酶基因(标记基因)。图4.t0代遗传转化植株中的ostfiiaγ5基因表达量和对白叶枯病菌株pxo99的反应。对照为水稻品种中花11(遗传转化的受体)。遗传转化植株中ostfiiaγ5基因的表达量是相对于对照中花11中ostfiiaγ5基因的表达量。图5.抑制表达ostfiiaγ5基因的t1代遗传转化植株中的ostfiiaγ5基因的表达量与表型共分离。对照为水稻品种中花11(遗传转化的受体)。遗传转化植株中ostfiiaγ5基因的表达量是相对于对照中花11中ostfiiaγ5基因的表达量。图6.t1代遗传转化家系ostfiiaγ5-rnai1、ostfiiaγ5rnai-3和ostfiiaγ5-rnai7植株接种8种菲律宾白叶枯病菌生理小种、1种日本白叶枯病菌生理小种、1种韩国白叶枯病菌生理小种和4种中国白叶枯病菌生理小种两周后的表型。图7.t1代遗传转化家系ostfiiaγ5-rnai1、ostfiiaγ5-rnai3和ostfiiaγ/5-rnai7植株接种5种中国细菌性条斑病菌生理小种两周后的表型。图8.携带隐性xa5(编码xa5或突变ostfiiaγ5的水稻品种和携带ostfiiaγ5的水稻品种接种9种菲律宾白叶枯病菌生理小种、1种日本白叶枯病菌生理小种、1种韩国白叶枯病菌生理小种和4种中国白叶枯病菌生理小种两周后的表型。图9.携带隐性xa5(编码xa5或突变ostfiiaγ5的水稻品种和携带ostfiiaγ5的水稻品种和携带ostfiiaγ5的水稻品种接种5种中国细菌性条斑病菌生理小种两周后的表型。图10.携带番茄sltfiiaγ基因的转化载体ptrv2-sltfiiaγ的结构。它是在ptrv2载体的多克隆位点插入了番茄sltfiiaγ基因的cdna片段的一部分序列。附图标记说明:rb和lb代表t-dna右和左边界;35s代表花椰菜花叶病毒启动子;cp代表烟草脆裂病毒衣壳蛋白;rz代表自剪切核酶;waxy-a代表水稻waxy基因内含子;nost代表胭脂碱合成酶基因终止子。图11.利用烟草脆裂病毒诱导的基因沉默技术抑制番茄的sltfiiaγ基因表达量和对番茄细菌性疮痂病23-1的反应。对照为利用烟草脆裂病毒诱导的基因沉默技术在番茄中抑制绿色荧光蛋白gfp基因。图11中的a图是抑制番茄的sltfiiaγ基因表达可以增强番茄对番茄细菌性疮痂病23-1的抗病性;图11中的b图是利用烟草脆裂病毒诱导的基因沉默技术抑制番茄的sltfiiaγ基因表达量检测结果;图11中的c图是利用烟草脆裂病毒诱导的基因沉默技术抑制番茄的sltfiiaγ基因后接种番茄细菌性疮痂病23-1后第0天和第3天叶片中细菌生长数量。图12.携带辣椒catfiiaγ基因的转化载体ptrv2-catfiiaγ的结构。它是在ptrv2载体的多克隆位点插入了辣椒catfiiaγ基因的cdna片段的一部分序列。rb和lb代表t-dna右和左边界;35s代表花椰菜花叶病毒启动子;cp代表烟草脆裂病毒衣壳蛋白;rz代表自剪切核酶;waxy-a代表水稻waxy基因内含子;nost代表胭脂碱合成酶基因终止子。图13.利用烟草脆裂病毒诱导的基因沉默技术抑制辣椒的catfiiaγ基因表达量和对辣椒斑点病23-1的反应。对照为利用烟草脆裂病毒诱导的基因沉默技术在辣椒中抑制绿色荧光蛋白gfp基因。图13中的a图是抑制辣椒的catfiiaγ基因表达可以增强辣椒对辣椒斑点病23-1的抗病性;图13中的b图是利用烟草脆裂病毒诱导的基因沉默技术抑制辣椒的catfiiaγ基因表达量检测结果;图13中的c图是利用烟草脆裂病毒诱导的基因沉默技术抑制辣椒的catfiiaγ基因后接种辣椒斑点病23-1后第0天和第3天叶片中细菌生长数量。具体实施方式以下实施例中进一步定义本发明,图1描述了分离克隆水稻ostfiiaγ5基因以及验证水稻ostfiiaγ5基因功能的流程,分离番茄sltfiiaγ基因和辣椒catfiiaγ基因以及验证功能的流程。根据以上的描述和下面的实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用各种用途和条件。实施例1:tfiiaγ基因的序列和结构分析1.tfiiaγ基因结构的预测申请人用白叶枯病菌pxo99的一个tale基因pthxo1(genbank注册号:acd58243)的一段dna序列(2944bp~3345bp)作为诱饵蛋白筛选水稻品种中花11的cdna文库(yuan等,2010),筛选到一条cdna序列,用blast方法(altschul等1997)检索核苷酸数据库genbank(http://www.ncbi.nlm.nih.gov), 发现该cdna序列与来自水稻品种日本晴的一条位于水稻5号染色体上的序列高度同源。在水稻基因组数据库tigr(http://rice.plantbiology.msu.edu/)中,这段水稻序列被注释为一个基因,其编号是loc_os05g01710,即本发明涉及的基因ostfiiaγ5。2.从水稻品种中花11中分离克隆ostfiiaγ5基因水稻中花11是科学研究中常用的一个水稻品种(cao等,2007)。申请人根据ostfiiaγ5基因在粳稻日本晴基因组中的位置和结构(水稻基因组数据库tigr),以ostfiiaγ5基因两侧的基因组序列为模板,设计了两条pcr引物tfiiaγgf(5′-ggcgtaaaataaagagaaatctgg-3′)和tfiiaγgr(5′-taatgtaaaggtaccattaacatagg-3′),从中花11中扩增包含ostfiiaγ5基因、全长6261bp的dna片段。利用美国appliedbiosystems公司的测序试剂盒,以双脱氧核苷酸末端终止法(美国appliedbiosystems公司)分别从pcr扩增片段两端测序。序列拼接后得到一长6261bp的dna序列,它包括完整的ostfiiaγ5基因序列。3.ostfiiaγ5基因结构分析为了获得ostfiiaγ5基因全长cdna序列,申请人提取水稻品种中花11的总rna(zhou等2002)。取1~5μg总rna用dnasei(美国invitrogen公司)处理15分钟以去除基因组dna污染,然后参照zhou等(2002)的方法,使用oligo(dt)15寡聚引物和m-mlv反转录酶(美国promega公司)进行反转录成cdna。然后利用pcr引物tfiiaγcdnaf(5′-ccggaattcatggccaccttcgagctc-3′)和tfiiaγcdnar(5′-cgcggatccttattggctgagtagtttg-3′),以总cdna为模板,扩增出ostfiiaγ5基因的全长cdna。然后将pcr产物与t-a克隆载体pgem-t(美国promega公司)连接,将连接好的载体电转化(电转化仪为eppendorf公司产品,本实施例所用电压为1800v,具体操作参考该仪器的使用说明书)进入大肠杆菌菌株dh10b(sun等,2004),通过酶切筛选阳性克隆。对阳性克隆进行测序,获得ostfiiaγ5基因的cdna序列(见seqidno:1)。比较分析ostfiiaγ5基因的基因组序列和cdna序列,确定ostfiiaγ5基因由6261个核苷酸组成(见seqidno:1所示),包含三个外显子,两个内含子(见图2)。第一个外显子由129个核苷酸组成(位于序列表seqidno:1的375-503位),5’utr(位于序列表seqidno:1的1-374位);第一个内含子由94个核苷酸组成(位于序列表seqidno:1的504-597位);第二个外显子由51个核苷酸组成(位于序列表seqidno:1的598-648位);第二个内含子由5095个核苷酸组成(位于序列表seqidno:1的649-5743位);第三个外显子由141个核苷酸组成(位于序列表seqidno:1的5744-5884位,3’utr位于序列表seqidno:1的5885-6261位,由377个核苷酸组成。4.ostfiiaγ5基因编码产物分析ostfiiaγ5基因的编码区由321个核苷酸组成,编码一个长度为106个氨基酸的蛋白质。该蛋白质属于转录因子。5.从番茄中分离克隆sltfiiaγ基因以及基因结构分析申请人根据水稻ostfiiaγ5基因在国际公共核苷酸数据库检索番茄基因序列,设计了两条pcr引物sltfiiaγf(5′-cgcggatccatggcgacttttgagctatac-3′)和sltfiiaγr(5′-ccgctcgagtcactgtgtgagcagctttgag-3′),从番茄(例如番茄品种ailsacraig,但不限于该 品种))的总rna反转录得到的cdna中扩增包含番茄sltfiiaγ基因的完整cdna片段。利用美国appliedbiosystems公司的测序试剂盒,以双脱氧核苷酸末端终止法(美国appliedbiosystems公司)分别从pcr扩增片段两端测序。序列拼接后得到一长321bp的dna序列,它包括完整的sltfiiaγ基因cdna序列。利用pcr引物sltfiiaγvf(5′-ccggaattctttgacaagtcaatgactg-3′)和sltfiiaγvr(5′-cgcggatcctcactgtgtgagcagctttg-3′),从包括完整的番茄sltfiiaγ基因cdna序列克隆中pcr扩增包含201bp的部分cdna序列。申请人根据sltfiiaγ基因在番茄基因组中的位置和结构,以sltfiiaγ基因两侧的基因组序列为模板,设计了两条pcr引物sltfiiaγgf(5′-atggcgacttttgagctatacag-3′)和tfiiaγgr(5′-tcactgtgtgagcagctttgag-3′),从ailsacraig中扩增包含sltfiiaγ基因、长5028bp的dna片段。利用美国appliedbiosystems公司的测序试剂盒,以双脱氧核苷酸末端终止法(美国appliedbiosystems公司)分别从pcr扩增片段两端测序。序列拼接后得到一长5028bp的dna序列,它包括完整的sltfiiaγ基因序列。比较分析sltfiiaγ基因的基因组序列和cdna序列,确定sltfiiaγ基因由5028个核苷酸组成,包含三个外显子,两个内含子(图2)。第一个外显子由129个核苷酸组成(位于序列表seqidno:3的1-129位);第一个内含子由2135个核苷酸组成(位于序列表seqidno:3的130-2264位);第二个外显子由51个核苷酸组成(位于序列表seqidno:3的2265-2315位);第二个内含子由2572个核苷酸组成(位于序列表seqidno:3的2316-4887位);第三个外显子由141个核苷酸组成(位于序列表seqidno:3的4888-5028位)。6.从辣椒中分离克隆catfiiaγ基因以及基因结构分析申请人根据水稻ostfiiaγ5基因在国际公共核苷酸数据库检索辣椒基因序列,设计了两条pcr引物catfiiaγf(5′-cgcggatccatggcgacttttgagctatac-3′)和catfiiaγr(5′-ccgctcgagtcactgtgtgagcagctttgag-3′),从辣椒(例如辣椒品种华50,但不限于该品种)的总rna反转录得到的cdna中扩增包含辣椒catfiiaγ基因的完整cdna片段。利用美国appliedbiosystems公司的测序试剂盒,以双脱氧核苷酸末端终止法(美国appliedbiosystems公司)分别从pcr扩增片段两端测序。序列拼接后得到一长321bp的dna序列,它包括完整的catfiiaγ基因cdna序列。利用pcr引物catfiiaγvf(5′-ccggaattctttgacaagtcaatgactg-3′)和catfiiaγvr(5′-cgcggatcctcactgtgtgagcagctttg-3′),从包括完整的辣椒catfiiaγ基因cdna序列克隆中pcr扩增包含201bp的部分cdna序列。申请人根据catfiiaγ基因在辣椒基因组中的位置和结构,以catfiiaγ基因两侧的基因组序列为模板,设计了两条pcr引物catfiiaγgf(5′-atggcgacttttgagctatacagg-3′)和catfiiaγgr(5′-tcactgtgtgagcagctttg-3′),从辣椒品种华50中扩增包含catfiiaγ基因、长5695bp的dna片段。利用美国appliedbiosystems公司的测序试剂盒,以双脱氧核苷酸末端终止法(美国appliedbiosystems公司)分别从pcr扩增片段两端测序。序列拼接后得到一长5695bp的dna序列,它包括完整的catfiiaγ基因序列。比较分析catfiiaγ基因的基因组序列和cdna序列,确定catfiiaγ基因由5695个核苷酸组成,包含三个外显子,两个内含子(见图2)。第一个外显子由129个核苷酸组成(位于序列表seqidno:2的1-129位);第一个内含子由2321个核苷酸组成(位于序列表seqidno:2的130-2450位;第二个外显子由51个核苷酸组成(位于序列表seqidno:2的2451-2501位);第二个内含子由3053个核苷酸组成(位于序列表seqidno:2 的2502-5554位);第三个外显子由141个核苷酸组成(位于序列表seqidno:1的5555-5695位)。基因组序列对比分析发现,番茄sltfiiaγ基因和辣椒catfiiaγ基因的cdna序列一致,它们编码相同的蛋白质。它们的蛋白质序列和水稻的不同。实施例2:抑制表达水稻ostfiiaγ5基因验证其在水稻抗病中的功能1.抑制表达遗传转化载体的构建本发明采用rna干扰(rnainterference,rnai)技术(smith等,2000)、通过抑制水稻品种中花11中ostfiiaγ5基因的表达,验证该基因的功能。这个技术途径的主要机理:将目标基因的部分片段以反向重复的形式与能够表达双链rna(doublestrandrna,dsrna)的载体连接,通过遗传转化将该载体导入植物中。获得的转化植株大量表达与目标基因部分片段同源的dsrna。这些dsrna迅速形成短干扰rna(shortinterferingrna,sirna)。这些sirna与目标基因的转录子(mrna)互补配对,在细胞内特殊酶的作用下使目标基因的转录子降解,从而在mrna水平上抑制目标基因的功能。研究者可以通过转基因植株表型的改变,验证目标基因的功能。rna干扰技术已被广泛用于基因功能的验证(smith等,2000)。本发明利用能够表达dsrna的农杆菌介导的遗传转化载体是pds1301(chu等,2006,图3),通过上述农杆菌介导的遗传转化方法将ostfiiaγ5基因的cdna片段转入水稻品种中花11,抑制中花11中ostfiiaγ5基因的表达。具体操作步骤如下:用限制性内切酶bamhi和kpni消化tfiiaγ/xa5基因的cdna克隆(图2)、中间载体pgem-g(美国promega公司)和遗传转化载体pds1301,酶切完全后在65℃水浴10min灭活限制性内切酶。将酶切片段在0.8%琼脂糖凝胶电泳后切胶回收目的条带。用t4-dna连接酶将cdna克隆的外源片段分别与中间载体pgem-gz和遗传转化载体pds1301进行连接。将连接好的载体电转化进入大肠杆菌菌株dh10b,电转化后获得的克隆质粒经bamhi和kpni酶切筛选验证阳性克隆。用限制性内切酶saci和spei消化携带cdna克隆外源片段的中间载体质粒和已经连入第一链外源片段的pds1301载体质粒。酶切完全后在65℃水浴10min灭活限制性内切酶。用t4-dna连接酶将cdna克隆的外源片段连接到携带ostfiiaγ5片段的pds1301质粒的saci/spei酶切位点。用saci和spei双酶切反应筛选阳性质粒克隆,并命名阳性克隆为pds1301-tfiiaγ(图3)。2.遗传转化和t0代遗传转化植株分析采用农杆菌介导的遗传转化方法(lin和zhang,2005)将pds1301-tfiiaγ导入水稻品种中花11。获得的遗传转化植株被命名为ostfiiaγ5-rnai。本发明共获得独立转化植株10株。对全部转化植株在成株期阶段接种白叶枯病菌株pxo99(菌株pxo99由菲律宾国际水稻研究所惠赠,sun等,2004),与对照中花11及遗传转化阴性植株相比8株阳性遗传转化植株的抗性显著增强(p<0.01)(表1)。表1t0代遗传转化植株(pds1301-tfiiaγ)对白叶枯病菌株pxo99的反应(1)每株遗传转化基因植株接种5-7片叶,14天后调查病斑长度,每个数据来自于多个叶片的平均值。(2)阴性转化植株,其它植株为阳性转化植株。为进一步验证遗传转化植株的抗病能力增强是否与ostfiiaγ5基因表达量相关,本发明采用上述实时定量rt-pcr方法检测了其中10株t0代遗传转化植株中ostfiiaγ5基因的表达量。实验结果显示转化植株中ostfiiaγ5基因的表达量变化与植株的病斑长度呈极显著负相关(相关系数为0.8748,α=0.01,n=10)(图4)。抗病性增强的遗传转化植株中ostfiiaγ5基因的表达量与对照材料中花11相比显著减少(p<0.01)。而抗病表型无明显变化的阴性转化植株中ostfiiaγ5基因表达量与中花11相比无显著变化(p>0.05)。该结果说明遗传转化植株对白叶枯病菌的抗性增强是因为ostfiiaγ5基因的表达量降低;ostfiiaγ5基因的编码产物在水稻抗白叶枯病反应中发挥负调控因子的作用;抑制水稻中ostfiiaγ5基因的表达,可增强水稻对白叶枯病的抗性。3.分析t1代遗传转化植株对在t0代抗性增强的两株遗传转化植株(ostfiiaγ5-rnai3和ostfiiaγ5-rnai7)的t1代家系进行分析。在孕穗期时于田间接种白叶枯病菌pxo99,同时用遗传转化载体pds1301上的特异pcr引物pmcg-f(5′-ggctcaccaaaccttaaacaa-3′)和pmcg-r(5′-ctgagctacacatgctcaggtt-3′)。检测阳性植株。结果显示与对照中花11相比所有抗性显著增强的植株都携带pds1301载体序列;而抗性与对照相比无显著变化的植株都不携带pds1301载体序列(表2、图5)。说明遗传转化植株抗病表型与转入的可以形成双链rna的ostfiiaγ5基因片段共分离,进一步证明抑制ostfiiaγ5基因表达可增强水稻抗病性。表2t1代遗传转化植株(pds1301-tfiiaγ)对白叶枯病菌株pxo99的反应(1)每株遗传转化基因植株接种5-7片叶,14天后调查病斑和病叶长度,每个数据来自于多个叶片的平均值。4.遗传转化植株对白叶枯病菌抗谱分析对在t0代抗性增强的三株遗传转化植株(ostfiiaγ5-rnai1、ostfiiaγ5-rnai3和ostfiiaγ5-rnai7)的t1代家系进行分析。用遗传转化载体pds1301上的特异pcr引物pmcg-f(5′-ggctcaccaaaccttaaacaa-3′)和pmcg-r(5′-ctgagctacacatgctcaggtt-3′)检测阳性植株。在孕穗期时于田间接种菲律宾白叶枯病菌生理小种pxo99、pxo61、pxo71、pxo79、pxo86、pxo112、pxo341和pxo347,日本白叶枯病菌生理小种t7174,韩国白叶枯病菌生理小种kacc10331,中国白叶枯病菌生理小种zhe173、fuj23、ks-1-21和yn11。结果显示与对照中花11相比所有携带pds1301载体序列植株的抗性都显著增强(图6)。证明抑制ostfiiaγ5基因表达可增强水稻对白叶枯病的广谱抗性。5.遗传转化植株对细菌性条斑病抗性分析对在t0代抗性增强的三株遗传转化植株(ostfiiaγ5-rnai1、ostfiiaγ5-rnai3和ostfiiaγ5-rnai7)的t1代家系进行分析。用遗传转化载体pds1301上的特异pcr引物pmcg-f(5′-ggctcaccaaaccttaaacaa-3′)和pmcg-r(5′-ctgagctacacatgctcaggtt-3′)检测阳性植株。在4-5叶期时采用针刺法接种中国细菌性条斑病菌生理小种rh3、rs85、rs105、jsb2-24和hnb8-47,接种14天后检测发表情况(chen等,2006)。结果显示与对照中花11相比所有携带pds1301载体序列植株的抗性都显著增强(图7)。证明抑制ostfiiaγ5基因表达也可增强水稻对细菌性条斑病的抗病性。实施例3:水稻ostfiiaγ5基因点突变赋予其在广谱抗病中的功能1.水稻ostfiiaγ5基因点突变赋予其广谱抗白叶枯病水稻家系irbb5和ir24是近等基因系。ir24携带ostfiiaγ5基因,其编码的ostfiiaγ5蛋白的第39位氨基酸是缬氨酸(v);irbb5携带突变的ostfiiaγ5基因,即隐性xa5基因。隐性xa5基因编码突变的ostfiiaγ5蛋白(ostfiiaγ5v39e或xa5),其第39位氨基酸由缬氨酸突变成谷氨酸(e)。在孕穗期时于田间接种菲律宾白叶枯病菌生理小种pxo99、pxo339、pxo61、pxo71、pxo79、pxo86、pxo112、pxo341和pxo347,日本白叶枯病菌生理小种t7174,韩国白叶枯病菌生理小种kacc10331,中国白叶枯病菌生理小种zhe173、fuj23、ks-1-21和yn11。结果显示irbb5对这些白叶枯病菌生理小种抗性都 显著增强(图8)。证明突变ostfiiaγ5基因可增强水稻对白叶枯病的抗病性。2.水稻ostfiiaγ5基因点突变赋予其广谱抗细菌性条斑病对irbb5和ir24接种细菌性条斑病菌。在4-5叶期时采用针刺法接种中国细菌性条斑病菌生理小种rh3、rs85、rs105、jsb2-24和hnb8-47,接种14天后检测发表情况。结果显示与ir24相比,irbb5对这些细菌性条斑病菌生理小种抗性都显著增强(图9)。证明突变ostfiiaγ5基因也可增强水稻对细菌性条斑病菌的抗病性。3.突变ostfiiaγ5不影响水稻的产量性状对irbb5和ir24在大田自然种植,正常水肥管理,调查农艺性状。结果显示携带ostfiiaγ5基因的ir24和携带xa5基因的irbb5的各项农艺性状统计学上没有差别(表3)。表3水稻品种ir24和irbb5农艺性状比较农艺性状ir24(ostfiiaγ5)irbb5(xa5)抽穗期(天)98.00±2.0097.50±3.50剑叶长(厘米)41.30±1.2341.42±1.32每株穗数16.00±1.6016.40±1.10穗长(厘米)24.32±0.8324.52±0.47每穗粒数198.50±8.00199.50±7.00千粒重(克)24.80±1.7824.73±1.27每株产量(克)32.15±4.3032.00±2.30结实率(%)90.40±4.3090.10±1.60粒长(毫米)6.34±0.136.35±0.16粒宽(毫米)2.13±0.092.12±0.17粒厚(毫米)1.85±0.221.83±0.17实施例4:抑制表达番茄sltfiiaγ基因验证其在抗病中的功能1.抑制表达瞬时转化载体的构建本发明采用病毒诱导的基因沉默干扰(virusinducedgenesilencing,vigs)技术、通过抑制番茄品种ailsacraig中sltfiiaγ基因的表达,验证该基因的功能。这个技术途径的主要机理是:将目标基因的部分片段与烟草脆裂病毒诱导的基因沉默载体连接,通过瞬时转化将该载体导入番茄中可诱导番茄体内该目标基因的沉默。vigs技术已被广泛用于番茄基因功能的验证(liu等,2002)。本发明利用的烟草脆裂病毒诱导的基因沉默载体是ptrv2(liu等,2002),改造后的表达载体ptrv2-sltfiiaγ的构建图见图10),通过农杆菌介导的瞬时转化方法将番茄sltfiiaγ基因的cdna片段转入番茄品种ailsacraig中,抑制ailsacraig中sltfiiaγ基因的表达。具体操作步骤如下:用限制性内切酶ecori和bamhi酶切番茄sltfiiaγ基因的cdna克隆和转化载体ptrv2,酶切完全 后在65℃水浴10min灭活限制性内切酶。将酶切片段在0.8%琼脂糖凝胶电泳后切胶回收目的条带。用t4-dna连接酶将cdna克隆的外源片段与转化载体ptrv2进行连接。将连接好的载体电转化进入大肠杆菌菌株dh10b,电转化后获得的克隆质粒经ecori和bamhi酶切筛选验证阳性克隆,并命名阳性克隆为ptrv2-sltfiiaγ(图10)。2.瞬时转化和遗传转化植株分析采用烟草脆裂病毒诱导的基因沉默的瞬时转化方法(liu等,2002)将ptrv2-sltfiiaγ导入番茄品种ailsacraig中(但不限于该品种),同时将ptrv2-gfp(绿色荧光蛋白基因)导入番茄品种ailsacraig(但不限于该品种)中作为对照(liu等,2002)。30天后对全部瞬时转化植株接种番茄细菌性疮痂病(xanthonmonascampestrispv.vesicatoria)23-1(本菌株与下述测试辣椒斑点病的菌株为同一个菌株,可以同时危害辣椒和番茄,但是引起的病害名称叫法不一样;sun等,1999)。与携带ptrv2-gfp瞬时转化植株相比,携带ptrv2-sltfiiaγ瞬时转化植株的抗性显著增强(p<0.01)(见图11中的a图)。为进一步验证携带ptrv2-sltfiiaγ瞬时转化植株的抗病能力增强是否与sltfiiaγ基因表达量相关,本发明采用上述实时定量rt-pcr方法检测了瞬时转化植株中sltfiiaγ基因的表达量。试验结果显示抗病性增强的瞬时转化植株中sltfiiaγ基因的表达量与对照相比显著减少(p<0.01b)(见图11中的图b)。同时接种番茄细菌性疮痂病3天后,抗病性增强的瞬时转化植株中细菌的数量与对照相比也显著减少(p<0.01)(见图11中的c图)。该结果说明番茄sltfiiaγ基因的编码产物在番茄抗细菌性疮痂病反应中发挥负调控因子的作用。抑制番茄中sltfiiaγ基因的表达,可增强番茄对细菌性疮痂病的抗性。实施例5:抑制表达辣椒catfiiaγ基因验证其在抗病中的功能1.抑制表达瞬时转化载体的构建本发明采用病毒诱导的基因沉默干扰技术、通过抑制辣椒品种华50(不限于该品种)中catfiiaγ基因的表达,验证该基因的功能。这个技术途径的主要机理是:将目标基因的部分片段与烟草脆裂病毒诱导的基因沉默载体连接,通过瞬时转化将该载体导入辣椒中可诱导辣椒体内该目标基因的沉默。vigs技术已被广泛用于辣椒基因功能的验证(chung等,2004)。本发明利用的烟草脆裂病毒诱导的基因沉默载体是ptrv2(liu等,2002),改造后的表达载体为ptrv2-sltfiiaγ(见图12),通过农杆菌介导的瞬时转化方法将辣椒catfiiaγ基因的cdna片段转入辣椒品种华50中,抑制华50中catfiiaγ基因的表达。具体操作步骤如下:用限制性内切酶ecori和bamhi酶切辣椒catfiiaγ基因的cdna克隆和转化载体ptrv2,酶切完全后在65℃水浴10min灭活限制性内切酶。将酶切片段在0.8%琼脂糖凝胶电泳后切胶回收目的条带。用t4-dna连接酶将cdna克隆的外源片段与转化载体ptrv2进行连接。将连接好的载体电转化进入大肠杆菌菌株dh10b,电转化后获得的克隆质粒经ecori和bamhi酶切筛选验证阳性克隆,并命名阳性克隆为ptrv2-catfiiaγ(图12)。2.瞬时转化和遗传转化植株分析采用烟草脆裂病毒诱导的基因沉默的瞬时转化方法(chung等,2004)将ptrv2-catfiiaγ导入辣椒品种华50中,同时将ptrv2-gfp导入辣椒品种华50中作为对照(chung等,2004)。30天后对全部瞬时 转化植株接种辣椒斑点病(xanthonmonascampestrispv.vesicatoria)23-1(见sun等,1999)。与携带ptrv2-gfp瞬时转化植株相比,携带ptrv2-catfiiaγ瞬时转化植株的抗性显著增强(p<0.01)(图13中的a图)。为进一步验证携带ptrv2-catfiiaγ瞬时转化植株的抗病能力增强是否与catfiiaγ基因表达量相关,本发明采用上述实时定量rt-pcr方法检测了瞬时转化植株中catfiiaγ基因的表达量。试验结果显示抗病性增强的瞬时转化植株中catfiiaγ基因的表达量与对照相比显著减少(p<0.01)(见图13中的b图)。同时接种辣椒斑点病3天后,抗病性增强的瞬时转化植株中细菌的数量与对照相比也显著减少(p<0.01)(见图13中的c图)。该结果说明辣椒catfiiaγ基因的编码产物在辣椒抗辣椒斑点病反应中发挥负调控因子的作用。抑制辣椒中catfiiaγ基因的表达,可增强辣椒对辣椒斑点病的抗性。本发明通过对水稻ostfiiaγ5基因、番茄sltfiiaγ基因和辣椒catfiiaγ基因在植物-病原互作中的功能验证,以及实施例的分析,发现在水稻中抑制ostfiiaγ5基因的表达可以显著增强水稻对白叶枯病菌和细菌性条斑病菌各生理小种的广谱抗性;在番茄中抑制sltfiiaγ基因的表达可以增强番茄对细菌性疮痂病的抗性;在辣椒中抑制catfiiaγ基因的表达可以增强辣椒对辣椒斑点病的抗性。同时,我们发现突变水稻ostfiiaγ5基因,即隐性xa5基因,可增强水稻对白叶枯病菌和细菌性条斑病菌各生理小种的广谱抗性。因此,可以在水稻种质资源中寻找携带隐性xa5基因的水稻品种,作为水稻抗白叶枯病菌和细菌性条斑病菌的育种资源。同时,也可以通过基因组dna编辑技术将栽培水稻品种中的ostfiiaγ5基因其第39位氨基酸由缬氨酸编辑突变成谷氨酸,以赋予水稻对白叶枯病菌和细菌性条斑病菌的广谱抗性。参考文献altschulsf,maddentl,schafferaa,zhangj,zhangz,millerw,lipmandj(1997)gappedblastandpsi-blast:anewgenerationofproteindatabasesearchprograms.nucl.acidsres.25:3389-3402.bart,r.,cohn,m.,kassen,a.,mccallum,e.j.,shybut,m.,petriello,a.,krasileva,k.,dahlbeck,d.,medina,c.,alicai,t.,etal.(2012)high-throughputgenomicsequencingofcassavabacterialblightstrainsidentifiesconservedeffectorstotargetfordurableresistance.proc.natl.acad.sci.usa109:e1972-1979.bochj,bonasu,lahayet(2014)taleffector-pathogenstrategiesandplantresistanceengineering.newphytologist204:823-832.caoy,dingx,caim,zhaoj,liny,lix,xuc,wangs(2007)theexpressionpatternofaricediseaseresistancegenexa3/xa26isdifferentiallyregulatedbythegeneticbackgroundsanddevelopmentalstagesthatinfluenceitsfunction.genetics177:523-533.chenc,zhengw,huangx,zhangd,linx(2006)majorqtlconferringresistancetoricebacterialleafstreak.agri.sci.china5:216-220.chuz,yuanm,yaoj,gex,yuanb,xuc,lix,fub,liz,bennetzenjl,zhangq,wangs(2006)promotermutationsofanessentialgeneforpollendevelopmentresultindiseaseresistanceinrice.gene.dev.20:1250-1255.chunge,seonge,kimyc,chungej,ohsk,lees,parkjm,joungyh,choid(2004)amethodofhighfrequencyvirus-inducedgenesilencinginchilepepper(capsicumannuuml.cv.bukang).molcells.17: 377-380.iyeras,mccouchsr(2004)thericebacterialblightresistancegenexa5encodesanovelformofdiseaseresistance.molplant-microbeinteract.17:1348-1354.jianggh,xiazh,zhouyl,wanj,lidy,chenrs,zhaiwx,zhulh(2006)testifyingthericebacterialblightresistancegenexa5bygeneticcomplementationandfurtheranalyzingxa5(xa5)incomparisonwithitshomologtfiiag1.molgenetgenomics.275:354-366.liyf,legourierrecj,torkim,kimyj,guerineauf,zhoudx(1999)characterizationandfunctionalanalysisofarabidopsistfiiarevealthattheevolutionarilyunconservedregionofthelargesubunithasatranscriptionactivationdomain.plantmol.biol.39:515-525.liny,zhangq(2005)optimisingthetissuecultureconditionsforhighefficiencytransformationofindicarice.plantcellrep.23:540-547.liuy,schiffm,dinesh-kumarsp(2002)virus-inducedgenesilencingintomato.plantj.31:777-786.ryan,r.p.,f.j.,potnis,n.,jones,j.b.,vansluys,m.a.,bogdanove,a.j.,anddow,j.m.(2011)pathogenomicsofxanthomonas:understandingbacterium-plantinteractions.nat.rev.microbiol.9:344-355.scholze,h.,andboch,j.(2011)taleffectorsareremotecontrolsforgeneactivation.curr.opin.microbiol.14:47-53.schornack,s.,meyer,a.,p.,jordan,t.,andlahaye,t.(2006)gene-for-gene-mediatedrecognitionofnuclear-targetedavrbs3-likebacterialeffectorproteins.j.plantphysiol.163:256-272.smithna,singhsp,wangmb,stoutjesdijkpa,greenag,waterhousepm(2000)geneexpression-totalsilencingbyintron-splicedhairpinrnas.nature407:319-320.sunf,duz,jiaoz,zhaot,chengb(1999)pathogenandraceidentificationofbacterialspotofpepperandtomato.actaphytopathologicasinica29:265-269.sunx,caoy,yangz,xuc,lix,wangs,zhangq(2004)xa26,ageneconferringresistancetoxanthomonasoryzaepv.oryzaeinrice,encodingalrrreceptorkinase-likeprotein.plantj.37:517-527.yuanm,chuz,lix,xuc,wangs(2010)thebacterialpathogenxanthomonasoryzaeovercomesricedefensesbyregulatinghostcopperredistribution.plantcell.22:3164-3176.yudkovsky,n.,ranish,j.a.,andhahn,s.(2000)atranscriptionreinitiationintermediatethatisstabilizedbyactivator.nature408:225-229.zhoub,pengkm,chuzh,wangsp,zhangqf(2002)thedefense-responsivegenesshowingenhancedandrepressedexpressionafterpathogeninfectioninrice(oryzasatival.).sci.chinaserc45:449-467。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1