抗FGFR2-IIIc单克隆抗体、杂交瘤细胞株和应用的制作方法
本发明涉及基因工程和免疫学
技术领域:
,更具体地,涉及单克隆抗体
技术领域:
,特别是指一种抗fgfr2-iiic单克隆抗体、相关杂交瘤细胞株和应用。
背景技术:
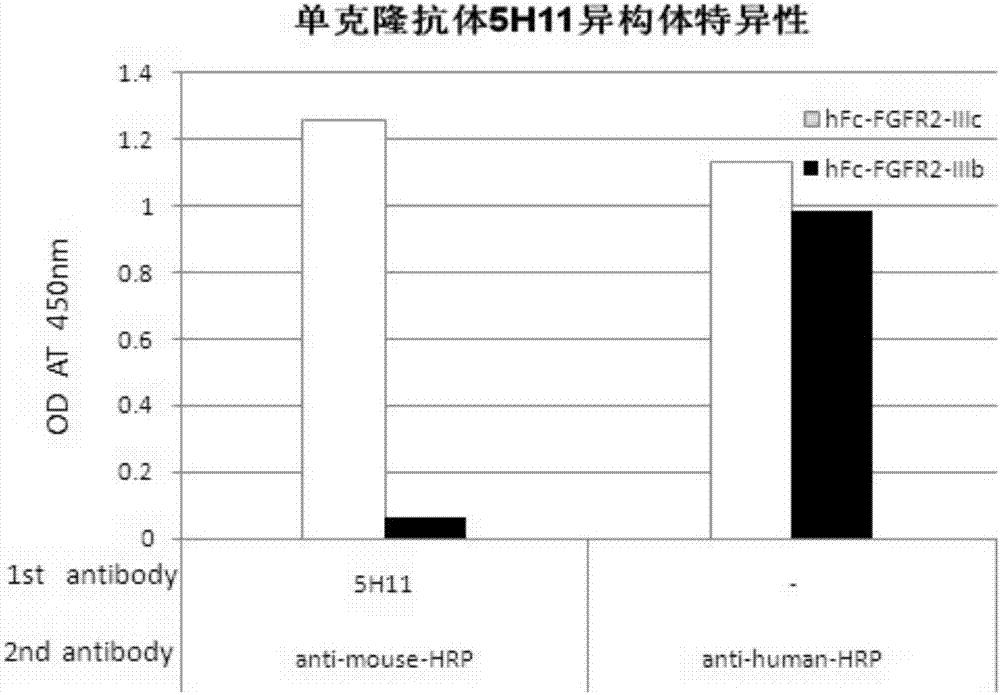
:成纤维细胞生长因子受体2(fibroblastgrowthfactorreceptors2,fgfrs)是一类跨膜的酪氨酸激酶受体,由胞外区、跨膜区和胞浆区三部分组成。fgfr2介导成纤维细胞生长因子家族(fibroblastgrowthfactors,fgfs)信号传递入胞内。fgfs信号通路对多种细胞的增殖、分化以及凋亡具有强烈调节作用。前列腺癌、乳腺癌、肺癌、肝癌、胃癌、黑色素瘤等多种肿瘤细胞均可表达fgf。fgfr2基因由于编码胞外第三个ig样环(loop-iii)的内含子-外显子区域的选择性剪接产生fgfr2-iiib(seqidno.5)和fgfr2-iiic(seqidno.4)两种蛋白异构体,因此loop-iii决定了这两种蛋白异构体的配体结合特异性。前列腺癌(prostatecancercap)是男性生殖系统常见的一种恶性肿瘤,在40岁之后其发病率随着年龄增长而增加。因此随着人类平均寿命的延长、诊断技术的不断提高,前列腺癌的发病率也在不断上升。前列腺癌从雄性激素敏感到雄性激素不敏感肿瘤的演变过程在大鼠模型中伴随着fgfr2可变剪接体的改变。这个改变导致fgfr2-iiib异构体的丢失,而存在大量的fgfr2-iiic异构体。fgfr2-iiic异构体在前列腺癌中表达的临床相关性已经在几个研究中揭示。leung(leunghy,mehtap,graylb,collinsat,robsoncnandnealde.1997.oncogene15(9):1115-20.keratinocytegrowthfactorexpressioninhormoneinsensitiveprostatecancer.)等报道65%的cap都有fgfr2-iiic的表达,但是在良性前列腺增生(bph)中并未检测到其表达。相反,iiib在大多数良性肿瘤(76%)包括bph中都有表达。kwabi-addo(kwabi-addob,ozenmandittmannm2004.endocrine-relatedcancer11709-724.theroleoffibroblastfactorsandtheirreceptorsinprostatecancer.)等通过免疫组化采用一种多克隆抗体检测到了fgfr2-iiic在前列腺癌组织间质细胞中的表达。sahadevan(sahadevank,darbys,leunghy,mathersme,robsoncnandgnanapragasamvj.2007.jpathol.213(1):82-90.selectiveover-expressionoffibroblastgrowthfactorreceptors1and4inclinicalprostatecancer.)等通过激光捕获显微切割138列恶性cap的组织微阵列前列腺上皮细胞。这些分析表明在在恶化的上皮细胞中主要表达的异构体由fgfr2-iiib向fgfr2-iiic转变。这些新的临床数据与先前的研 究结果是一致的,fgfr2异构体由iiib向iiic转变是前列腺癌演变的一个标志。fgfr2异构体由iiib向iiic转变所伴随着的表型改变定义为上皮间质转化(emt)。emt提高了细胞的迁移和侵入,方便了多个癌瘤类型的转移。以fgfr2-iiic异构体作为治疗靶标阻断肿瘤的演变,该研究通过在小鼠膀胱癌模型中对fgfr2-iiic基因进行基因沉默和基因敲除。利用反义rna下调iiic的表达使小鼠存活率从0%上升到50%(持续50天),并且下调了肿瘤向肺和骨的转移。先前的研究表明fgfr2-iiic在上皮癌中表达,fgfr2-iiic在前列腺癌的emt中起着决定和驱动的作用(chaffercl,brennanjp,slavinjl,blickt,thompsonewwilliamsed.2006.cancerres.66:11271-11279mesenchymal-to-epithelialtransitionfacilitatesbladdercancermetastasis:roleoffibroblastgrowthfactorreceptor-2.)。肿瘤细胞通过血液或淋巴转移为“循环肿瘤细胞(ctc)”,ctc在患有良性疾病的病人中较为罕见而在多种转移癌症中频繁出现(allardetal.(2004)clincancerres.10:6897-6904)。一些临床研究表明ctc能够辅助医生检测和预知癌症进程,评估转移性癌症的治疗效果(berrepootetal.,(2004)annoncol.15:139-145;aquinoetal.,(2002)j.chemother.14:412-416;katohetal.,(2004)anticancerres.24:1421-1425)。目前的ctc检测主要基于上皮肿瘤标记,例如ep-cam,这将会遗漏fgfr2-iiic阳性的ctc,因为前列腺癌细胞中fgfr2-iiic的表达伴随着上皮肿瘤标记的减少并获得间质肿瘤标志(moffaandethier(2007)jcellphysiol.210(3):720-31)。因此,需要提供一种抗fgfr2-iiic异构体特异性单克隆抗体及分泌抗fgfr2-iiic单克隆抗体的杂交瘤细胞,该杂交瘤细胞能稳定分泌抗fgfr2-iiic异构体,尤其是特异性的针对fgfr2-iiic蛋白中loop-iii区域的单克隆抗体,能够特异性的用于治疗前列腺癌相关的转移癌的ctc检测,并为进一步研究fgfr2-iiic的功能,用于其他癌症治疗癌症检测和的研究奠定基础。技术实现要素:本发明的目的在于提供一种抗fgfr2-iiic单克隆抗体、杂交瘤细胞株和应用。本发明的第一方面,提供了一种抗fgfr2-iiic单克隆抗体,所述抗fgfr2-iiic单克隆抗体特异性识别和结合seqidno:4所示的蛋白。在另一优选例中,所述抗fgfr2-iiic单克隆抗体与参照抗体竞争性结合seqidno:4所示的蛋白;所述参照抗体为保藏号为cgmccno.6905杂交瘤细胞株产生的单克隆抗体。在另一优选例中,所述抗fgfr2-iiic单克隆抗体不与seqidno:5所示的蛋白结合。在另一优选例中,所述抗fgfr2-iiic单克隆抗体具有选自下组的一种或多种 特性:(1)所述抗fgfr2-iiic单克隆抗体的重链可变区的三个cdr区与所述参照抗体的重链可变区的三个cdr区相同;(2)所述抗fgfr2-iiic单克隆抗体的轻链可变区的三个cdr区与所述参照抗体的轻链可变区的三个cdr区相同;(3)所述抗fgfr2-iiic单克隆抗体的重链可变区与所述参照抗体的重链可变区相同;和(4)所述抗fgfr2-iiic单克隆抗体的轻链可变区与所述参照抗体的轻链可变区相同。在另一优选例中,所述抗fgfr2-iiic单克隆抗体为保藏号为cgmccno.6905杂交瘤细胞株产生的单克隆抗体。本发明的第二方面,提供了一种杂交瘤细胞株,保藏编号:cgmccno.6905;所述杂交瘤细胞株能够产生抗fgfr2-iiic单克隆抗体,该抗fgfr2-iiic单克隆抗体是对seqidno:4所示的蛋白能特异性结合的单克隆抗体。本发明的第三方面,提供了一种重组蛋白,所述的重组蛋白具有:(i)如本发明第一方面所述的的单克隆抗体;以及(ii)任选的协助表达和/或纯化的标签序列。本发明的第四方面,提供了一种免疫偶联物,该免疫偶联物含有:(a)如本发明第一方面所述的单克隆抗体;和(b)选自下组的偶联部分:可检测标记物、药物、毒素、细胞因子、放射性核素、或酶。在另一优选例中,所述偶联物选自:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2等)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl))、化疗剂(例如,顺铂)或任何形式的纳米颗粒等。本发明的第五方面,提供了一种药物组合物,它含有:(i)如本发明第一方面所述的单克隆抗体、或如本发明第三方面所述的重组蛋白、或如本发明第四方面所述的免疫偶联物;以及(ii)药学上可接受的载体。在另一优选例中,所述的药物组合物为注射剂型。在另一优选例中,所述的药物组合物用于制备治疗肿瘤的药物,所述的肿 瘤选自下组:乳腺癌、前列腺癌、胃癌、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、大肠癌、宫颈癌、肾上腺肿瘤、或膀胱肿瘤,或相关的转移癌。本发明的第六方面,提供了如本发明第一方面所述的单克隆抗体、如本发明第三方面所述的重组蛋白、或如本发明第四方面所述的免疫偶联物的用途,用于制备药剂、试剂、检测板或试剂盒;所述试剂、检测板或试剂盒用于:(1)检测样品中seqidno:4所示的蛋白;和/或(2)检测肿瘤细胞中seqidno:4所示的蛋白;和/或(3)检测表达seqidno:4所示的蛋白的肿瘤细胞;所述药剂用于治疗或预防表达seqidno:4所示的蛋白的肿瘤。本发明的第七方面,提供了一种产生抗fgfr2-iiic单克隆抗体的杂交瘤细胞株的制备方法,包括以下步骤:(1)以seqidno:3所示的融合蛋白作为抗原,免疫哺乳动物;(2)制备表达seqidno:6所示融合蛋白的cho-fgfr2-iiic-δc细胞株;(3)将cho-fgfr2-iiic-δc细胞株对所述哺乳动物进行加强免疫;(4)将加强免疫后的哺乳动物的脾细胞与骨髓瘤细胞进行融合,培养;筛选,得到分泌对seqidno:4所示的蛋白有特异性反应的单克隆抗体的杂交瘤细胞株。在另一优选例中,所述cho-fgfr2-iiic-δc细胞株的制备为:通过hindiii/xbai酶切位点将seqidno:2所示的序列克隆至pcdna3.0载体中,构建成pcdna3.0-flag-fgfr2-iiic-δc表达载体;再将pcdna3.0-flag-fgfr2-iiic-δc表达载体转染到cho细胞,培养;筛选得到表达seqidno:6所示融合蛋白的cho-fgfr2-iiic-δc细胞株。在另一优选例中,所述融合比率是脾细胞:骨髓瘤细胞sp2/0为4.5—5.5:1。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1是融合小鼠9次免疫后血清效价的elisa检测结果。图2是单克隆抗体5h11区分hfc-fgfr2-iiic和hfc-fgfr2-iiib特异性的elisa检测结果。图3是单克隆抗体5h11区分fgfr2-iiic-δc和fgfr2-iiib-δc的facs检测结果。图4是单克隆抗体5h11检测caki细胞和caki-fgfr2-iiic-δc稳定株表达fgfr2-iiic的facs检测结果。图5是单克隆抗体5h11对fgfr2-iiic-δc和fgfr2-iiib-δc瞬转293t细胞进行免疫细胞化学染色实验的结果。图6是单克隆抗体5h11对乳腺癌细胞株bt549进行免疫荧光染色检测实验的结果。具体实施方式本发明人经过广泛而深入的研究,获得一种抗fgfr2-iiic单克隆抗体,该fgfr2-iiic单克隆抗体对fgfr2-iiic异构体,尤其是胞外配体结合区的loop-iii区域具有优异的特异性结合作用。在此基础上完成了本发明。在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。虽然在本发明的实施或测试中可以使用与本发明中所述相似或等价的任何方法和材料,本文在此处例举优选的方法和材料。本发明的目的之一在于提供一种抗fgfr2-iiic单克隆抗体杂交瘤细胞株及其制备方法。本发明的另一目的是提供一种抗fgfr2-iiic单克隆抗体。本发明的另一个目的是一种上述抗fgfr2-iiic单克隆抗体的制备方法。本发明的进一步目的是提供上述抗fgfr2-iiic单克隆抗体在检测和抗肿瘤药物中的应用,该抗fgfr2-iiic单克隆抗体能特异性检测fgfr2-iiic异构体,可用于fgfr2iiic高表达肿瘤细胞的检测,可以用于进行癌症治疗的研究,开发靶向治疗药物特异性高,反应灵敏,成本低,适于大规模推广应用。为了解决上述目的,在本发明提供了一种杂交瘤细胞株,该杂交瘤细胞株能够产生抗fgfr2-iiic单克隆抗体,该抗fgfr2-iiic单克隆抗体是对具有loop-iii区域的seqidno:4所示的蛋白能特异性结合的单克隆抗体。所述杂交瘤细胞株已保藏在国际保藏单位之一“中国微生物菌种保藏管理委员会普通微生物中心”(chinageneralmicrobiologicalculturecollectioncenter),地址:中国北京市朝阳区大屯路,中国科学院微生物研究所,邮政编码:100101),保藏日期:2012年11月26日,保藏编号:cgmccno.6905,分类 命名为小鼠杂交瘤细胞(mousehybridoma),分泌抗fgfr2-iiic单克隆抗体的杂交瘤细胞株系。本发明还提供了一种抗fgfr2-iiic单克隆抗体杂交瘤细胞株的制备方法,包括以下步骤:(1)以seqidno:3所示的融合蛋白作为抗原,免疫哺乳动物;(2)制备能表达seqidno:6所示融合蛋白的cho-fgfr2-iiic-δc细胞株;(3)将cho-fgfr2-iiic-δc细胞株对哺乳动物进行加强免疫;(4)收集免疫哺乳动物的脾细胞与骨髓瘤细胞进行融合,培养;筛选,得到稳定分泌对seqidno:4所示的蛋白有特异性反应的单克隆抗体的杂交瘤细胞株。本发明还提供了一种抗fgfr2-iiic单克隆抗体,其能对seqidno:4所示的蛋白能特异性识别和结合,但不与seqidno:5所示的蛋白结合。本发明中所述“特异性”是指单克隆抗体能够准确区分同一基因编码因剪接不同而产生的不同蛋白异构体。因此,上述的抗fgfr2-iiic单克隆抗体能够特异性识别和结合seqidno:4所示的蛋白而不与seqidno:5所示的蛋白结合。本发明所述的seqidno:3和seqidno:4和seqidno:5所示的蛋白可以直接合成,也可以通过基因工程克隆转染真核细胞上清纯化制备获得。本发明还提供了一种上述抗fgfr2-iiic单克隆抗体制备方法,包括以下步骤:(1)以seqidno:3所示的融合蛋白作为抗原,免疫哺乳动物;(2)制备能表达seqidno:6所示融合蛋白的cho-fgfr2-iiic-δc细胞株;(3)将cho-fgfr2-iiic-δc细胞株对哺乳动物进行加强免疫;(4)收集加强免疫后的哺乳动物的脾细胞与骨髓瘤细胞进行融合,培养;筛选,得到稳定分泌对seqidno:4所示的蛋白有特异性反应的单克隆抗体的杂交瘤细胞株;(5)从所述杂交瘤细胞的培养上清液中或从注射所述杂交瘤细胞后的动物腹水中获取所述抗fgfr2-iiic单克隆抗体。在本发明的一具体实施例中,所述表达seqidno:6所示融合蛋白的cho-fgfr2-iiic-δc细胞株的制备如下:通过hindiii/xbai酶切位点将seqidno:2所示的基因序列克隆至pcdna3.0载体中,构建成含pcdna3.0-flag-fgfr2-iiic-δc表达载体;再将pcdna3.0-flag-fgfr2-iiic-δc表达载体转染到cho细胞,培养,筛选到表达seqidno:6所示融合蛋白的cho-fgfr2-iiic-δc细胞株。在本发明的一具体实施例中,上述哺乳动物是小鼠;上述骨髓瘤细胞是骨髓瘤细胞sp2/0。在其中一个实施例中,所述融合比率:脾细胞:骨髓瘤细胞sp2/0为4.5—5.5:1。在本发明的一具体实施例中,seqidno:3所示的蛋白可以是通过bamhi/ecori酶切位点将seqidno:1所示核苷酸序列克隆至pgex-4t1载体中表达产生的。在本发明的一具体实施例中,以mt-fgfr2-iiic-128aa融合蛋白(seqidno:3)和cho-fgfr2-iiic-δc细胞稳定株作为抗原免疫小鼠,取小鼠的脾细胞与同系动物的骨髓瘤细胞进行融合。筛选能够产生目的抗体的杂交瘤细胞,进行克隆化培养,并建立杂交细胞株。上述方法仅是示例性的,例如可以用同样的方法免疫其他哺乳动物,将其脾细胞作为免疫细胞。还可以选择适宜的骨髓瘤细胞用于融合,例如用来自大鼠、小鼠或仓鼠的骨髓瘤细胞。免疫细胞与骨髓瘤细胞的融合可以按照常规方法进行。筛选产生目的抗体的杂交瘤细胞进行单克隆化。得到的产生本发明单克隆抗体的杂交瘤细胞株,可以在普通培养基中传代培养或者在液氮中长时间保存。从杂交瘤细胞收集本发明的单克隆抗体时,可以从杂交瘤细胞体外培养上清液中获得抗体,或者将杂交瘤细胞注入适宜的哺乳动物并从动物腹水中获取抗体。前一种方法适于获得高纯度的抗体,后一种方法适于大量获取抗体。通过上述方法获得的抗体,可以用常规方法纯化,例如盐析、凝胶过滤、亲和层析等方法。在本发明的另一方面,提供了上述的抗fgfr2-iiic单克隆抗体在制备检测和/或辅助诊断seqidno:4所示的蛋白高表达人类癌症的试剂盒的应用。在本发明的另一方面,本发明提供了抗fgfr2-iiic单克隆抗体在制备治疗fgfr2-iiic高表达人类癌症药物的应用。利用抗fgfr2-iiic单克隆抗体与高表达肿瘤细胞表面fgfr2-iiic受体的结合,从而抑制了fgf的信号,有效的抑制了肿瘤细胞的增殖。在本发明的另一方面,本发明提供了上述的杂交瘤细胞株在制备检测和/或辅助诊断具有seqidno:4所示的蛋白表达的人类癌症的试剂盒的应用。在本发明的另一方面,本发明提供了上述的杂交瘤细胞株在制备治疗具有seqidno:4所示的蛋白表达的人类癌症药物的应用。在本发明的一具体实施例中,所述癌症为乳腺癌或前列腺癌或前列腺癌相关的转移癌。本发明采用蛋白纯度大于90%的重组蛋白和cho稳定细胞株作为抗原免疫小鼠,采用杂交瘤技术,经过细胞融合并筛选得到一株能够持续、稳定分泌抗fgfr2-iiic抗体的杂交瘤细胞株。利用在原核生物中表达含有编码本发明的抗原的多核苷酸序列,产生seqidno:2所示的蛋白与已知标签形成的seqidno:3所示的融合蛋白作为抗原,小鼠加强免疫所采用的是seqidno:6序列稳定转染的cho细胞。如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nihpubl.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。脊椎动物抗体(免疫球蛋白)的“轻链”可根据其恒定区的氨基酸序列归为明显不同的两类(称为κ和λ)中的一类。根据其重链恒定区的氨基酸序列,免疫球蛋白可以分为不同的种类。主要有5类免疫球蛋白:iga,igd,ige,igg和igm,其中一些还可进一步分成亚类(同种型),如igg1,igg2,igg3,igg4,iga和iga2。对应于不同类免疫球蛋白的重链恒定区分别称为α、δ、ε、γ、和μ。不同类免疫球蛋白的亚单位结构和三维构型是本领域人员所熟知的。如本文所用,术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常是具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,本文中的兔单克隆抗体是通过噬菌体文库筛选后通过分子生物的方法构建全长兔单克隆抗体基因表达载体,将该载体转入真核表达系统,培养后收取细胞上清而获得,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。本发明还包括具有所述的抗seqidno.4所示蛋白单克隆抗体的相应氨基酸序列的单克隆抗体、具有所述的抗seqidno.4所示蛋白单克隆抗体可变区链的单克隆抗体,以及具有这些链的其他蛋白质或蛋白质偶联物及融合表达产物。具体地,本发明包括具有含超变区(互补决定区,cdr)的轻链和重链的任 何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该超变区与本发明的轻链和重链的超变区相同或至少90%同源性,较佳地至少95%同源性。如本领域技术人员所知,免疫偶联物及融合表达产物包括:药物、毒素、细胞因子(cytokine)、放射性核素、酶和其他诊断或治疗分子与所述的抗seqidno.4所示蛋白单克隆抗体或其片段结合的而形成的偶联物。本发明还包括与所述的抗seqidno.4所示蛋白单克隆抗体或其片段结合的细胞表面标记物或抗原。本发明不仅包括完整的单克隆抗体,还包括具有免疫活性的抗体片段,如fab或(fab')2片段;抗体重链;抗体轻链。本发明还提供了具有本发明抗体的其他蛋白质或融合表达产物。具体地,本发明包括具有含可变区的重链和轻链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该可变区与本发明抗体的重链和轻链的可变区相同或至少90%同源性,较佳地至少95%同源性。一般,抗体的抗原结合特性可由位于重链和轻链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。本发明抗体的重链和/或轻链的可变区特别令人感兴趣,因为它们中至少部分涉及结合抗原。因此,本发明包括那些具有带cdr的单克隆抗体轻链和重链可变区的分子,只要其cdr与此处鉴定的cdr具有90%以上(较佳地95%以上,最佳地98%以上)的同源性。本发明提供了保藏编号为cgmccno.6905的杂交瘤细胞株及其所产生的单克隆抗体,本领域技术人员可以采用本领域中常规技术对获得该单克隆抗体的cdr区及其完全的氨基酸序列和编码基因序列进行鉴定。因此,本发明的抗体,包含了具有与保藏编号为cgmccno.6905的杂交瘤细胞株所产生的单克隆抗体相同的cdr区的单克隆抗体。本发明不仅包括完整的单克隆抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成 熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。本发明抗体指具有seqidno.4所示蛋白结合活性的、包括上述cdr区的多肽。该术语还包括具有与本发明抗体相同功能的、包含上述cdr区的多肽的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明抗体的活性片段和活性衍生物。该多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严紧度条件下能与本发明抗体的编码dna杂交的dna所编码的蛋白、以及利用抗本发明抗体的抗血清获得的多肽或蛋白。本发明还提供了其他多肽,如包含人抗体或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了本发明抗体的片段。通常,该片段具有本发明抗体的至少约50个连续氨基酸,较佳地至少约50个连续氨基酸,更佳地至少约80个连续氨基酸,最佳地至少约100个连续氨基酸。在本发明中,“本发明抗体的保守性变异体”指与本发明抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。表a本发明还提供了编码上述抗体或其片段或其融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码本发明的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。本发明的抗体的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。一种可行的方法是用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。此外,还可将重链的编码序列和表达标签(如6his)融合在一起,形成融合蛋白。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中 分离得到有关序列。本发明所涉及的生物分子(核酸、蛋白等)包括以分离的形式存在的生物分子。目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇s2或sf9的昆虫细胞;cho、cos7、293细胞的动物细胞等。用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔,脂质体包装等。获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。本发明的抗体可以单独使用,也可与可检测标记物(为诊断目的)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。用于诊断目的的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。可与本发明抗体结合或偶联的治疗剂包括但不限于:1.放射性核素(koppe等,2005,癌转移评论(cancermetastasisreviews)24,539);2.生物毒(chaudhary等,1989,自然(nature)339,394;epel等,2002,癌症免疫学和免疫治疗(cancerimmunologyandimmunotherapy)51,565);3.细胞 因子如il-2等(gillies等,1992,美国国家科学院院刊(pnas)89,1428;card等,2004,癌症免疫学和免疫治疗(cancerimmunologyandimmunotherapy)53,345;halin等,2003,癌症研究(cancerresearch)63,3202);4.金纳米颗粒/纳米棒(lapotko等,2005,癌症通信(cancerletters)239,36;huang等,2006,美国化学学会杂志(journaloftheamericanchemicalsociety)128,2115);5.病毒颗粒(peng等,2004,基因治疗(genetherapy)11,1234);6.脂质体(mamot等,2005,癌症研究(cancerresearch)65,11631);7.纳米磁粒;8.前药激活酶(例如,dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl));10.化疗剂(例如,顺铂)或任何形式的纳米颗粒等。本发明还提供了一种组合物。在优选例中,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):瘤内、腹膜内、静脉内、或局部给药。本发明的药物组合物可直接用于结合seqidno.4所示蛋白分子,因而可用于预防和治疗肿瘤。此外,还可同时使用其他治疗剂。本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的单克隆抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克/千克体重-约5毫克/千克体重。此外,本发明的多肽还可与其他治疗剂一起使用。使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约8毫克/千克体重,较佳地该剂量是约10微克/千克体重-约1毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。杂交瘤细胞株本发明还提供了可生产本发明针对seqidno.4所示蛋白的单克隆抗体的杂交瘤细胞株;优选的,本发明提供了高效价的单克隆抗体的杂交瘤细胞株。优选地,所述杂交瘤细胞株已保藏在国际保藏单位之一“中国微生物菌种保藏管理委员会普通微生物中心”(chinageneralmicrobiologicalculturecollectioncenter),地址:中国北京市朝阳区大屯路,中国科学院微生物 研究所,邮政编码:100101),保藏日期:2012年11月26日,保藏编号:cgmccno.6905,分类命名为小鼠杂交瘤细胞(mousehybridoma),分泌抗fgfr2-iiic单克隆抗体的杂交瘤细胞株系。在获得生产本发明的单克隆抗体的杂交瘤之后,本领域技术人员可以方便地利用该杂交瘤细胞株制备抗体。此外,本领域技术人员还可很方便地获知本发明的抗体的结构(比如抗体的重链可变区和轻链可变区),然后可通过重组方法来制备本发明的单克隆抗体。标记的免疫球蛋白在本发明的一个优选例中,所述免疫球蛋白带有可检测标记物。更佳地,所述的标记物选自下组:胶体金标记物、有色标记物或荧光标记物。胶体金标记可采用本领域技术人员已知的方法进行。在本发明的一个优选的方案中,单克隆抗体用胶体金标记,得到胶体金标记的单克隆抗体。本发明的单克隆抗体具有很好的特异性,很高的效价。检测板及其材料本发明的检测板可采用本领域常用的检测板材料,采用常规的检测板制备方法制成。本发明检测seqidno.4所示蛋白的免疫检测板,包括测试条和支撑测试条的支撑板,如可采用pvc聚脂胶板等;所述的测试条由滤样纸、层析材料、硝酸纤维素膜和吸水纸依次搭接组成,搭接部位可以采用常规的方法,如胶带等固定连接;其中:层析材料预包被胶体金标记或有色标记的单克隆抗体或多克隆抗体,优选被胶体金标记的单克隆抗体,硝酸纤维素膜上吸附检测线和质控线。在一个优选的方案中:层析材料上预包被胶体金标记的单克隆抗体是采用浓度为0.5-1.5mg/ml胶体金标记的单克隆抗体溶液进行预包被的,包被量为50μl/cm2;优选的浓度为0.5或1.5mg/ml,50μl/cm2;检测方法与结果判定平放检测板,将试样滴在滤样纸上,试样约120μl,3~5min内观察层析结果。根据出现的条纹位置来判断结果。阴性:质控区、检测区均出现明显的色带,示为阴性;阳性:只在质控区出现明显色带,而在检测区无色带,示为阳性;无效:质控区、检测区无任何色带或在质控区未出现色带而在检测区出现色带,表明检测方法错误或检测板变质或失效,应重新换取检测板检测。方法和样本本发明涉及用于在以细胞和/或组织溶解的样本检测宫颈癌的方法。该方法步骤大致如下:获得细胞和/或组织样本;将样本溶解在介质中;检测在所述溶解的样本中seqidno.4所示蛋白的水平。本发明方法所使用的样本可以是存在于细胞保存液中的包括细胞的任何样本,正如在液基细胞检测法中所使用的。本发明中所采用的样本(样品)包括细胞、组织样本和活检标本。本发明使用的术语“活检”应包括本领域技术人员已知的所有种类的活检。因此本发明中使用的活检可以包括例如肿瘤的切除样本、通过内窥镜方法或器官的穿刺或针刺活检制备的组织样本。本发明中使用的样本可以包括固定的或保存的细胞或组织样本。细胞或组织样本可以例如被保存在标准的样本收集、储存或运输介质中,例如那些本领域技术人员已知的商业可以获得保存介质(福尔马林、cytyc“preservcyt”或tripathimaging“cytorich”等)。合适的细胞保存介质可以包括一个或多个选自醇、醛、酮、酸、金属离子或汞、醚等的用于保存细胞组分的混合物。醇包括甲醇、乙醇、(正或异)丙醇、(正、异或叔)丁醇或高支链或无支链的醇。醛包括甲醛、乙醛、戊二醛等。也可以使用诸如丙酮的酮类。在标准的样本介质中使用的酸包括有机酸(乙酸、三氯乙酸、水杨酸和苦味酸)或诸如铬酸的无机酸。标准的样本溶液中可以包括金属例如银、铜、铬、汞、锇和铀。诸如乙酸铀酰、二铬酸钾、硫酸铵等的盐溶液可以是保存介质的组分。另外,在本文公开的方法中可以使用获得后立即进行细胞裂解的样本。样本获得后立即进行裂解,在此过程中形态学信息已丢失,而样本的蛋白分子信息被保存。样本可以直接从个体的躯体转移到含有合适的去垢剂和保存剂的溶液中。在裂解介质中使用合适的试剂,可以保存原材料的分子组分,并且不发生降解。例如通过使用酶抑制剂而是酶活力降解最小化。因此,在该裂解介质中的检测样本的溶液可以在溶解时显示检测样本的蛋白分子特性。根据本发明,样本可以溶解在任何合适的裂解介质中。该裂解介质例如可以是尿素、甲酰胺,去垢剂的水溶液,例如阴离子去垢剂(如sds,n-十二烷醇肌酸钠,去氧胆酸钠,烷芳基磺酸盐,长链(脂肪族)醇硫酸盐,烯烃硫酸盐和磺酸盐,α-烯烃硫酸盐和磺酸盐,硫酸盐甘油—酸酯,硫酸醚,硫代琥珀酸盐,链烷基磺酸盐,磷酸酯,烷基异硫代硫酸盐,蔗糖酯),阳离子去垢剂(如,氯化十六烷基三甲基铵),非离子去垢剂(如,吐温20,nonidetp-40,tritonx-100,np-40,lgepalca-630,n-辛基-配糖物)或两性去垢剂(如,chaps,3-十二烷基-二甲基胺-丙烷-1-磺酸,十二烷醇二甲基胺氧化物)和/或氢氧化物碱,例如氢氧化钠或氢氧化钾。通常任何合适的液体可以用作本发明裂解介质的溶剂。液体可以是有机或无机的,并且可以是纯液体,液体混合物或含物质溶液的液体并可以含有其他物质以增强溶剂的性质。在本发明的实施方案中,裂解介质的配方是50mmtris-hcl,150mmnacl,1%np-40,0.5% 脱氧胆酸钠,0.1%sds。根据本发明用于溶解样本的裂解介质可以进一步含有一个或多个防止原材料中组分降解的试剂。该组分例如包括酶抑制剂,例如蛋白酶抑制剂。在本发明的实施方案中,样本直接裂解。蛋白酶抑制剂例如可以包括丝氨酸蛋白酶抑制剂,半胱氨酸蛋白酶抑制剂,天门冬氨酸蛋白酶抑制剂,金属蛋白酶抑制剂,酸性蛋白酶抑制剂,碱性蛋白酶抑制剂或中性蛋白酶抑制剂。在本发明的实施方案中,蛋白酶抑制剂采用的是pepstatin(胃蛋白酶抑制剂),leupeptin(亮抑制肽),(抑蛋白酶肽)以及100μg/mlpmsf(苯甲基磺酰氟)。试剂盒本发明还提供了一种指含有本发明的抗体(或其片段)或本发明的检测板的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。本发明进一步设计用于检测seqidno.4所示蛋白水平的检测试剂盒,该试剂盒包括识别seqidno.4所示蛋白的抗体,用于溶解样本的裂解介质,检测所需的通用试剂和缓冲液,如各种缓冲液、检测标记、检测底物等。该检测试剂盒可以是体外诊断装置。本发明的主要优点在于:1、本发明的抗fgfr2-iiic单克隆抗体是对seqidno:4所示的蛋白有特异性的单克隆抗体,可以特异性地结合seqidno:4所示的蛋白,从而抗fgfr2-iiic单克隆抗体对于fgfr2-iiic高表达肿瘤细胞,可提供特异性检测,特异性高。2、本发明的抗fgfr2-iiic单克隆抗体对fgfr2-iiic异构体有特异性,而不识别seqidno:5所示的fgfr2-iiib异构体,从而可以进行fgfr2-iiic高表达前列腺癌或其他癌细胞的特异性检测,弥补目前尚无fgfr2-iiic异构体特异性检测方法之不足,利用抗fgfr-iiic单克隆抗体进行检测特异性高,反应灵敏。3、本发明的免疫测定法可用于fgfr-iiic高表达肿瘤细胞的特异性检测,弥补目前尚fgfr2-iiic特异性检测方法之不足。抗fgfr2-iiic单克隆抗体可以特异性结合肿瘤细胞中的生物标志物,fgfr2-iiic受体蛋白。提供特异性高,反应灵敏,成本低诊断技术,适于高通量检测和大规模推广应用。4、本发明的抗fgfr2-iiic单克隆抗体可以应用于制备抗肿瘤药物。本发明所述的优选的杂交瘤细胞株保藏在“中国微生物菌种保藏管理委员会普通微生物中心”(chinageneralmicrobiologicalculturecollectioncenter,cgmcc),保藏日期:2012年11月26日,保藏编号:cgmccno.6905下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。实施例1、杂交瘤细胞系的建立1、抗原制备:1)蛋白表达质粒的构建:通过bamhi/ecori酶切位点将表达seqidno:3所示的氨基酸序列的核苷酸序列(seqidno:1)克隆至pgex-4t1载体中,表达出具有gst-tag的gst-mt-fgfr2-iiic-128aa(验证为seqidno:3)融合蛋白作为免疫抗原,该融合蛋白特异的表达fgfr2-iiic异构体胞外loop-iii区域的128个氨基酸;通过ecori/bglii酶切位点将表达seqidno:4所示的氨基酸序列的核苷酸序列克隆至pfuse-higg1e2-fc2(il2ss)表达载体中,能够表达出hfc-tag的hfc-fgfr2-iiic融合蛋白(验证为seqidno:4)作为检测抗原;通过ecori/bglii酶切位点将能够表达seqidno:5所示的氨基酸序列的核苷酸序列克隆至pfuse-higg1e2-fc2(il2ss)表达载体中,能够表达出hfc-tag的hfc-fgfr2-iiib融合蛋白(验证为seqidno:5)作为检测抗原;通过hindiii/xbai酶切位点将能够表达seqidno:6所示的氨基酸序列的核苷酸序列(seqidno:2)克隆至pcdna3.0载体中,构建成含flag-tag的pcdna3.0-flag-fgfr2-iiic-δc表达载体;通过hindiii/xbai酶切位点将能够表达seqidno:7所示的氨基酸序列的核苷酸序列克隆至pcdna3.0载体中,构建成含flag-tag的pcdna3.0-flag-fgfr2-iiib-δc((验证为seqidno:7))表达载体。2)cho-fgfr2-iiic-δc稳定株筛选:将重组载体pcdna3.0-flag-fgfr2-iiic-δc用脂质体法转染预铺于10cm培养皿中的cho细胞,整个过程按试剂盒lipofectaminetm2000操作手册进行。37℃转染4-6h后,更换为添加10%fbs的dmem培养基至10ml,继续37℃,co2培养箱培养,48h后,用0.25%的胰酶消化细胞,按照1:10,1:50,1:100,1:500比例进行传代,降低细胞密度,培养液中加入终浓度为500μg/ml的g418进行筛选。继续培养7到10天,中间每隔3天更换含终浓度为500μg/ml的g418抗生素的培养液。直至在培养皿上能看到明显的细胞群落,小心挑取细胞克隆,放入96孔细胞培养板中培养。将挑取的克隆在96孔板中进行有限稀释,至每孔长出一个单克隆。将克隆扩大培养后收集细胞做wb检测,筛选出能稳定高表达flag-fgfr2-iiic-δc融合蛋白(确定其组成如seqidno:6所示)的cho-fgfr2-iiic-δc细胞株。2、小鼠免疫程序1)基础免疫:以gst-mt-fgfr2-iiic-128aa融合蛋白(确定其组成如seqidno:3所示)为免疫原,免疫4~6周龄雌性balb/c小鼠,购买于扬州大学实验动物中心。免疫程序见表1。表1小鼠免疫程序注:在三免后7天采血测效价经过8次免疫后,如图1所示血清效价的elisa检测结果表明当血清稀释比例为1:10,000时od450值大于1.0。2)加强免疫:加强免疫采用cho-fgfr2iiic-δc稳定株细胞3x106个,用0.1ml生理盐水稀释后腹腔注射。3、细胞融合与培养按常规方法收集免疫小鼠的脾细胞与骨髓瘤细胞sp2/0进行融合,融合比率脾细胞:sp2/0=5:1,融合细胞分装于96孔培养板,置于37℃,5%co2恒温培养箱中选择性培养。融合后用hat培养基全换液3次;待杂交瘤细胞长满一个显微镜视野时,进行elisa检测。4、阳性杂交瘤的筛选检测时,采用间接elisa筛选:抗原选用hfc-fgfr2-iiic融合蛋白,2μg/ml,100μl每孔包板,4℃过夜,pbst洗涤拍干后,加入5%脱脂奶粉封闭,37℃作用2h或4℃过夜,pbst洗涤拍干后,加入杂交瘤上清并设置阳性(+ctrl)、阴性(-ctrl)及空白对照(blank),37℃反应1h,pbst洗涤拍干后再加入辣根过氧化物酶标记羊抗鼠igg(goatanti-mouseigg-hrplot﹟15-035-164)(1:10,000稀释),37℃反应45~60min,pbst洗涤拍干后tmb显色和2mh2so4终止。elisa筛选结果以od450值大于阴性对照2倍以上者,即可初步判定为阳性克隆。5、杂交瘤细胞系的建立对间接elisa初步判定为阳性的克隆进行复检,抗原分别选用hfc-fgfr2-iiic融合蛋白和hfc-fgfr2-iiib融合蛋白,经过两次连续检测hfc-fgfr2-iiic融合蛋白阳性而hfc-fgfr2-iiic融合蛋白阴性的克隆为所需的阳性克隆,将该阳性孔细胞进行扩增,及时冻存和亚克隆。采用有限稀释法对阳性孔进行3次亚克隆和间接elisa筛选,得到一株稳定分泌单克隆的杂交瘤细胞株5h11。6、应用杂交瘤细胞株5h11所得单抗的效价测定细胞培养液上清效价测定:将5h11杂交瘤细胞按1x105接种量种到10ml含15%胎牛血清的dmem培养基中,在37℃含5%co2的细胞培养箱中培养3天;然后将细胞培养液在800rpm下离心10min,收集上清,用hfc-fgfr2-iiic包被间接elisa法测定上清中单抗效价,结果表明上清效价为1:1,000以上。7、5h11细胞株的传代培养将5h11细胞株在含15%胎牛血清的dmem培养基继续进行培养、传代,培养到50代后,杂交瘤细胞株5h11仍然能生长良好、稳定传代,培养上清效价仍然达1:1,000以上。以上结果表明,所得的5h11细胞株能够稳定传代,可以持续、稳定分泌抗fgfr2-iiic单克隆抗体。5h11细胞株即是保藏号为cgmccno.6905的杂交瘤细胞,保藏在“中国微生物菌种保藏管理委员会普通微生物中心”,保藏日期:2012年11月26日。实施例2、应用5h11细胞株制备抗hfc-fgfr2-iiic的单克隆抗体一、抗体制备大量培养杂交瘤细胞(5h11),8-10周龄的balb/c雌性小鼠预先用液体石蜡致敏,然后腹腔注射1x106杂交瘤细胞/只,约10天左右待小鼠腹部明显膨大到一定程度后,用9号针头抽取腹水。收获的腹水用hfc-fgfr2-iiic包被通过elisa检测腹水效价达到1:10,000以上。腹水液经去除纤维蛋白和盐析处理后,以proteing亲和柱层析法纯化。收集蛋白峰流出液,用磷酸盐缓冲液(pbs)透析后用紫外分光光度计od260,280测定抗体蛋白浓度为0.7-1.5mg/ml,间接elisa检测结果表明:纯化的单克隆抗体的效价在1:1000以上。二、单克隆抗体5h11的特性鉴定1、抗体纯度鉴定纯化后单克隆抗体5h11经12%sds-page鉴定结果,得到纯度在95%以上的单抗5h11抗体,重链(hc)和轻链(lc)。2、抗体igg亚类鉴定采用sigma公司的鼠单克隆抗体亚类分型试剂盒(mousemonoclonal antiboayisotypingreagents,058k4836)。试验步骤按厂家说明书操作,测定结果表明单克隆抗体5h11的igg类型为igg1。3、单克隆抗体5h11识别异构体特异性及交叉反应鉴定检测单克隆抗体对hfc-fgfr2-iiic,hfc-fgfr2-iiib两种蛋白的反应。采用elisa方法进行鉴定:抗原选用hfc-fgfr2-iiic,hfc-fgfr2-iiib融合蛋白,抗原均2μg/ml包板,4℃过夜,pbst洗涤拍干后,加入5%脱脂奶粉封闭,37℃作用2h或4℃过夜,pbst洗涤拍干后,加入克隆5h11杂交瘤上清并设置空白对照(空白直接加入酶标二抗),37℃反应1h,pbst洗涤拍干后再加入辣根过氧化物酶标记羊抗鼠igg二抗(1:10,000稀释)或辣根过氧化物酶标记羊抗人igg(goatanti-humanigg,(fcγ),peroxidaseconjugated,lot#mb1394934)(1:60,000稀释)购自thermoscientific公司,二抗37℃反应45~60min,pbst洗涤拍干后tmb显色和2mh2so4终止。结果发现:辣根过氧化物酶标记羊抗人igg检测hfc-fgfr2-iiic和hfc-fgfr2-iiib的包被量,两者包被量大致相同,而单克隆抗体5h11特异的结合hfc-fgfr2-iiic异构体而与hfc-fgfr2-iiib无交叉反应(图2)。三、单克隆抗体5h11的生物活性鉴定1、流式细胞术(facs)检测细胞表面fgfr2-iiic受体蛋白1.1单克隆单抗结合cho瞬转fgfr2-iiic-δc受体蛋白检测选用瞬转fgfr2-iiic-δc或fgfr2-iiib-δc的cho细胞与单克隆抗体孵育进行流式细胞术检测。具体实验方法如下:1.1.1cho细胞瞬转fgfr2-iiic-δc和fgfr2-iiib-δc将重组载体pcdna3.0-flag-fgfr2-iiic-δc或pcdna3.0-flag-fgfr2-iiib-δc用脂质体法转染预铺于10cm培养皿中的cho细胞,整个过程按试剂盒lipofectaminetm2000操作手册进行。37℃转染4-6h后,更换为添加10%fbs的dmem培养基至10ml,继续37℃,co2培养箱培养。1.1.2流式细胞术检测cho瞬转fgfr2-iiic-δc受体蛋白①使用无酶消化液收集细胞(cho细胞株,cho-fgfr2-iiic-δc瞬转细胞株,cho-fgfr2-iiib-δc瞬转细胞株),在1.5ml的离心管里用1%bsa/pbs洗涤液洗涤2次,离心:1500rpm,5min。②重悬细胞,并用1%bsa/pbs调整细胞密度为1x107/ml,每个样品100μl,用1.5ml离心管分装成4管。③1500rpm,5min,小心的将上清吸干净。④按下表加入抗体,各100μl,4℃,1h,每隔15min弹匀一次,保证细胞不沉积在离心管底。编号1234抗体及对照blankmigganti-flag5h11浓度(μg/ml)-55细胞上清⑤细胞用500μl洗涤液洗涤2次⑥1500rmp,5min,去除上清,加入二抗fitc标记的羊抗鼠igg(购自rockland公司)(1:200)。4℃,45min,避光,每 隔15min弹匀一次。⑦用500μl洗涤液洗涤2次,1500rpm,5min,去上清,每管加入pbs100μl,再加入2%的多聚甲醛混合,使最终的多聚甲醛浓度为1%。⑧将细胞混合液转移至facs管子中,准备检测。facs结果如图3显示:由于瞬转的fgfr2-iiic-δc或fgfr2-iiib-δc融合蛋白带有flag标签,anti-flag与cho瞬转的细胞孵育后能够使部分表达flag-fgfr2-iiic-δc或flag-fgfr2-iiib-δc的细胞发生峰的偏移,而cho空细胞没有,同时单克隆抗体5h11仅使表达fgfr2-iiic-δc的cho细胞发生峰的偏移。1.2单克隆抗体结合caki细胞,caki-fgfr2-iiic-δc稳定株表面fgfr2-iiic受体蛋白选用caki空细胞(购自atcc)或稳定表达flag-fgfr2-iiic-δc的caki-fgfr2-iiic-δc稳定株与单克隆抗体孵育进行流式细胞术检测。具体实验方法如下:1.2.1caki-fgfr2-iiic-δc稳定株筛选将重组载体pcdna3.0-flag-fgfr2-iiic-δc用脂质体法转染预铺于10cm培养皿中的caki细胞,整个过程按试剂盒lipofectaminetm2000操作手册进行。37℃转染4-6h后,更换为添加10%fbs的dmem培养基至10ml,继续37℃,co2培养箱培养。48h后,用0.25%的胰酶消化细胞,按照1:10,1:50,1:100,1:500比例进行传代,降低细胞密度,培养液中加入终浓度为500μg/ml的g418进行筛选。继续培养7到10天,中间每隔3天更换含终浓度为500μg/ml的g418抗生素的培养液。直至在培养皿上能看到明显的细胞群落,小心挑取细胞克隆,放入96孔细胞培养板中培养。将挑取的克隆在96孔板中进行有限稀释,至每孔长出一个单克隆。将克隆扩大培养后收集细胞做wb检测,筛选出能稳定高表达flag-fgfr2-iiic-δc融合蛋白的caki-fgfr2-iiic-δc细胞株。1.2.2流式细胞术检测caki细胞,caki-fgfr2-iiic-δc稳定株表面fgfr2-iiic受体蛋白①使用无酶消化液收集细胞(caki细胞株,caki-fgfr2-iiic-δc稳定细胞株),在1.5ml的离心管里用1%bsa/pbs洗涤液洗涤2次,离心:1500rpm,5min。②重悬细胞,并用1%bsa/pbs调整细胞密度为1x107/ml,每个样品100μl,用1.5ml离心管分装成5管。③1500rpm,5min,小心的将上清吸干净。④按下表加入抗体,各100μl,4℃,1h.每隔15min弹匀一次,保证细胞不沉积在离心管底。⑤细胞用500μl洗涤液洗涤2次⑥1500rpm,5min,去除上清,加入二抗fitc标记的羊抗鼠igg(购自rockland公司)(1:200),4℃,45min,避光,每隔15min 弹匀一次。⑦用500μl洗涤液洗涤2次,1500rpm,5min,去上清,每管加入pbs100μl,再加入2%的多聚甲醛混合,使最终的多聚甲醛浓度为1%。⑧将细胞混合液转移至facs管子中,准备检测。facs结果如图4所示:由于转染的fgfr2iiic-δc融合蛋白带有flag标签anti-flag与caki-fgfr2iiic-δc稳定株细胞孵育后能够使表达flag-fgfr2-iiic-δc的caki细胞形成峰的偏移,而caki空细胞没有,同时单克隆抗体5h11能使caki细胞和稳定表达flag-fgfr2-iiic-δc的caki-fgfr2iiic-δc稳定株均发生峰值偏移。2、免疫细胞化学染色(icc)检测单克隆抗体结合293t瞬转fgfr2-iiic-δc受体:选用瞬转fgfr2-iiic-δc或fgfr2-iiib-δc的293t细胞与单克隆抗体孵育进行免疫细胞化学染色试验。具体实验方法如下:2.1293t细胞瞬转将重组载体pcdna3.0-flag-fgfr2-iiic-δc或pcdna3.0-flag-fgfr2-iiib-δc用脂质体法转染预铺于10cm培养皿中的293t细胞,整个过程按试剂盒lipofectaminetm2000操作手册进行。37℃转染4-6h后,更换为添加10%fbs的dmem培养基至10ml,继续37℃,co2培养箱培养。2.2免疫细胞化学染色检测293t-fgfr2iiic-δc瞬转细胞表面fgfr2-iiic-δc受体:①瞬转24h后,细胞分于96孔板中,贴壁生长2天;②4%多聚甲醛固定后用3%h2o2处理10min;③5%牛血清37℃封闭2小时后加入抗体(5μg/ml),37℃反应2小时;④pbs洗3遍后加入过氧化物酶偶联的羊抗鼠二抗1:2,000稀释,37℃反应1小时;⑤pbs洗3遍后dab显色,37℃孵育10min,拍照。利用anti-flag抗体,单克隆5h11对瞬转fgfr2-iiic-δc或fgfr2-iiib-δc的293t细胞进行免疫细胞化学染色鉴定。如图5所示:由于瞬转的fgfr2-iiic-δc或fgfr2-iiib-δc融合蛋白带有flag标签,anti-flag与293t瞬转细胞孵育后能够使部分表达fgfr2-iiic-δc或fgfr2-iiib-δc的293t细胞染色,而293t空细胞不染色,而单克隆抗体5h11能够特异地使仅表达fgfr2-iiic-δc的部分293t细胞染色,而表达fgfr2-iiib-δc或293t空细胞则无染色。3、免疫荧光染色检测单克隆抗体结合乳腺癌细胞株bt549:肿瘤细胞株mcf-7,bt549,pc3购自atcc与单克隆抗体孵育进行免疫荧光染色检测。具体实验方法如下:①肿瘤细胞贴壁生长后,采用4%多聚甲醛进行固定;②细胞固定后采用,pbs洗1遍,5%fbs/pbs37℃封闭2h;③细胞封闭后加入单克隆抗体(1μg/ml)4℃孵育1h;④pbs洗3遍后加入二抗fitc标记的羊抗鼠igg(购自rockland公司)(1:200),4℃避光反应45min;⑤pbs洗3遍后加入hoechest荧光染料室温避光孵育10-30min;⑥pbs洗3遍荧光显微镜分别在405nm和488nm处观察,拍照。结果如图6所示:单克隆抗体5h11能特异地使表达fgfr2-iiic 的乳腺癌细胞株bt549呈现强荧光,而不能结合仅表达fgfr2-iiib的乳腺癌细胞株mcf或表达fgfr2的前列腺癌细胞株pc3,进一步证明了该单克隆抗体5h11能够特异地识别肿瘤细胞中的fgfr2-iiic异构体。综上所述,本发明的fgfr2-iiic单克隆抗体能特异性识别fgfr2-iiic异构体,可用于fgfr2-iiic异构体高表达癌变细胞,包括癌前病变或前列腺癌细胞的特异性检测。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1