用于表达EGFR的单细胞分选和多基因位点检测的微流控芯片的制作方法
本发明涉及微流控芯片技术领域,具体地说,涉及一种方于表达EGFR的单细胞分选和多基因位点检测的微流控芯片。
背景技术:
近年来,肺癌的发病率和死亡率迅速上升,成为中国第一大癌症,虽然治疗技术有了很大提高,但5年的生存率并没有明显改善。在肺癌中,非小细胞肺癌(NSCLC)最为代表性,占80%左右。目前,针对EGFR的靶向治疗成为人们研究的热点,并且起到了很好的疗效。EGFR(Epidermal Growth Factor Receptor)是上皮生长因子(EGF)细胞增殖和信号传导的受体。EGFR属于ErbB受体家族的一种,该家族包括EGFR(ErbB-1),HER2/c-neu(ErbB-2),Her 3(ErbB-3)和Her 4(ErbB-4)。目前已证实,EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。
由于EGFR络氨酸激酶是信号传导的必要条件,因此也成为肿瘤治疗的重要靶分子。通过选择性的酶抑制剂或者单克隆抗体竞争性结合细胞外配体结合位点来阻断络氨酸激酶活化,从而抑制EGFR的激活。而目前的研究主要是针对EGFR的第18、19、20和21外显子进行。自从2004年发现上皮生长因子受体(EGFR)基因活化突变(以Del19或L858R为主)与EGFR酪氨酸激酶抑制剂(TKI)治疗非小细胞肺癌的疗效相关以来,已有多项前瞻性临床研究证实,EGFR活化突变阳性的NSCLC患者对EGFR-TKI的反应率显著高于EGFR野生型NSCLC患者,无进展生存(PFS)期和总生存(OS)期也显著延长。因此,在临床中也开始基于病人EGFR突变检测进行精准治疗。
但是由于检测方法的灵敏度不够以及分选技术的限制,长期以来EGFR基因突变分析只能进行细胞群体分析。有研究表明,不同细胞之间的基因也存在差异尤其是在癌细胞中。而通过细胞群体分析获得的统计平均结果,掩盖了单个细胞之间的差异并且会受到大量非目的细胞的影响,使生物学及医学等很多领域的发展受到限制。
传统的EGFR检测多集中在蛋白水平,如以免疫组化(IHC)和酶联反应吸附(ELISA)为代表的检测方法。但是上述两种方法只能大致反应EGFR蛋白的表达情况,并不能直接检测基因的突变信息,无法直接指导靶向用药。因此,一大批直接检测基因突变的技术也用于EGFR突变检测中,包括基因扩增后直接测序法(DS)、突变富集PCR法、扩增阻碍突变系统(ARMS)法、蝎形探针扩增阻滞突变系统(SARM)法、集落杂交法(CH)等。但这些技术也只是反应样本群体信息,无法在单个细胞水平上进行检测。由于细胞极小,直径一般为5-500μm,体积为fL至nL级,组分含量少(fmol至zmol)、种类繁多,使得获取操纵、扩增和分析单细胞的难度很大。在单细胞样品的处理过程中也很容易造成样品的遗失和损失,对后续分析造成影响,成功率较低。由于单细胞DNA的数量极其微小,对其分析之前必须进行DNA的扩增。而基于热循环以PCR(聚合酶链式反应)为基础的全基因组扩增技术,PCR过程中,在起始样本非常稀少时,会向序列中引入很多错误和非特异性扩增产物,使扩增质量大大降低,并且一次只能通过特定引物对单个基因位点进行检查,无法对同一样品进行多位点基因扩增。
目前已公开的技术中,均没有涉及高度集成针对EGFR肿瘤细胞筛选、鉴定、裂解,扩增和多基因位点分析的,从而实现对肿瘤细胞进行单细胞水平上的多位点EGFR基因突变检测。
技术实现要素:
本发明的目的是提供一种用于表达EGFR的单细胞分选和多基因位点检测的微流控芯片。
本发明的另一目的是提供一种用于EGFR基因多个突变位点单细胞水平检测的系统。
为了实现本发明目的,本发明提供的一种用于表达EGFR的单细胞分选和多基因位点检测的微流控芯片,所述微流控芯片包括依次叠放在一起并相互密封的四层结构,由上至下分别为顶盖、微流体通道层、带有微柱和微孔阵列的基板以及带有腔体组的底板;
所述顶盖上设有一个样品入口、一个样品出口以及一个废液口;所述样品入口与微流体通道层的U形主流道上的样品进入口连通,所述样品出口与微流体通道层的U形主流道上的样品流出口连通,所述废液出口与微流体通道层的分支流道上的废液口连通;
所述微流体通道层上设有一条U形主流道,U形主流道的一端设有样品进入口,另一端设有样品流出口;带有样品进入口一侧的主流道的前段较宽,设有过滤区,用于过滤样品,除去较大杂质;主流道的中段是分选区,用于分离肿瘤细胞;带有样品流出口一侧的主流道的后段较窄,设有捕获区,用于限定液体流动进行单细胞捕获;主流道上还设有一条与分选区垂直设置的分支流道,分支流道的另一端设有废液口,其与顶盖上的废液出口连通,用于废液的流出(如图1所示,水平宽度不同的单条流道,左边的上下两端分别作为入口和出口,右边为废液口);所述主流道的过滤区,分选区以及捕获区分别位于基板上的过滤区、分选区和捕获区上方;样品在基板上流动,流道用于限制流体样品的运动方向;
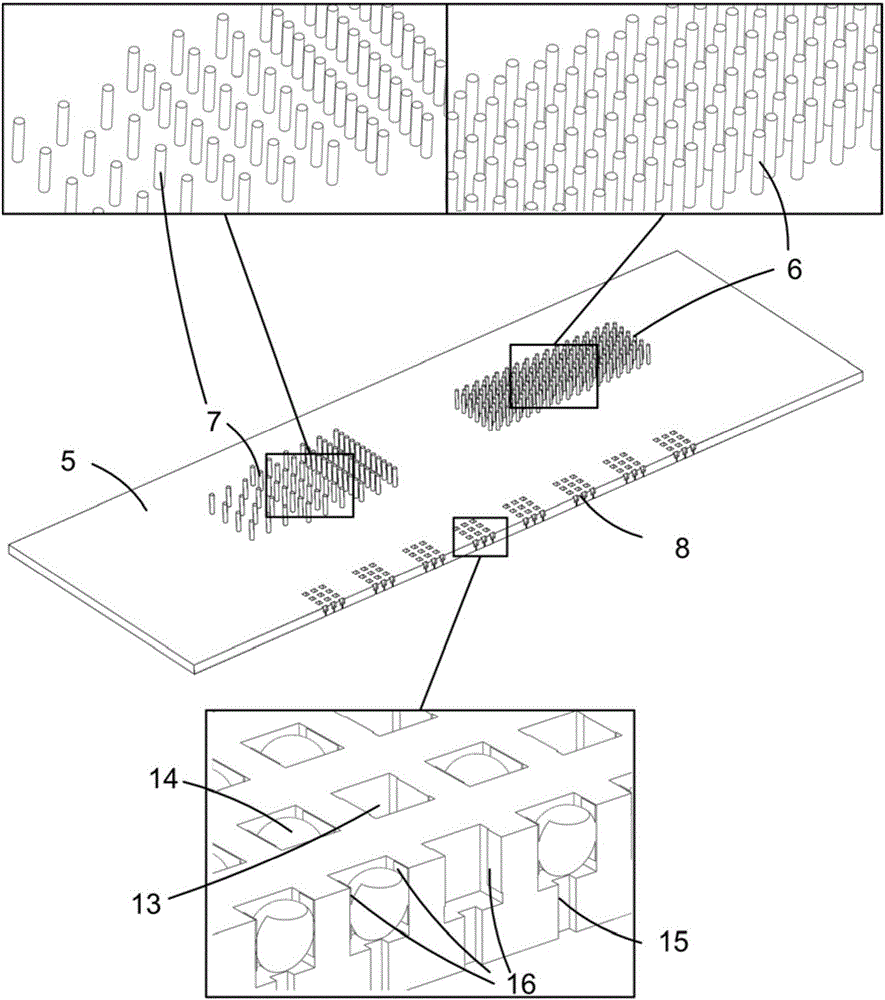
所述带有微柱和微孔阵列的基板上设有过滤区、分选区和捕获区;过滤区由间距渐变的排状分布的微柱阵列组成;分选区由大小和间距统一的微柱阵列组成;捕获区带有微孔阵列,所有微柱和微孔的位置与相应的微流体通道层上各分区相匹配,即过滤区的微柱阵列设置在微流体通道层的主流道过滤区下方,分选区的微柱阵列设置在微流体通道层的主流道分选区下方,捕获区的微孔阵列设置在微流体通道层的主流道捕获区下方(图1),微孔的内部设有电极,阴极和阳极成对设置在微孔侧壁上;每个微孔具有与下层底板相连通的通道(即连通孔);每个分区由流道相连接,在流体的作用下依次进入过滤区、分选区和捕获区;
所述带有腔体组的底板上设有多个腔体,每个腔体由收集腔和扩增腔组成,收集腔通过连通孔与基板捕获区对应的微孔相连,用于分开收集不同微孔中的细胞裂解液;收集腔和扩增腔之间用可以控制开关的微阀连接;扩增腔内预置有多重置换扩增(MDA)试剂和/或PCR扩增试剂,用于扩增细胞裂解液中的DNA以及检测EGFR基因上的多个突变位点。
所述微流体通道层上设有的通道深度为10~200微米,主流道过滤区宽度为1~10毫米;主流道分选区宽度为1~10毫米,主流道捕获区宽度为10~5000微米。流道(即微流体通道)过滤区、分选区和捕获区的长度与对应基板上各分区的长度相匹配。优选地,过滤区、分选区长度为1000~22000微米,捕获区长度为1000~42000微米。
所述带有微柱和微孔阵列的基板,其每个微孔中的电极可以分别控制其是否通电。
所述带有微柱和微孔阵列的基板,过滤区的微柱阵列由直径为5~200微米,高为10~200微米的圆柱排状分布组成,其微柱阵列的间距渐变,为50~500微米;分选区的微柱阵列由直径为5~50微米,高为10~200微米的圆柱排状分布组成,微柱间距为10~200微米;捕获区的微孔深度为5~100微米,是边长为5~100微米的正方形或长方形,或直径为5~100微米的圆形。所述微孔阵列,其每个微孔与下层腔体相连通的通道(连通孔)直径为1~10微米。
优选地,基板的过滤区、分选区长度为1000~20000微米,捕获区的长度为1000~40000微米。
所述带有腔体组的底板,其腔体组数量可变,可以多个微孔对应一个腔体,也可以每个腔体对应一个微孔,从而分别收集不同微孔中的细胞裂解液。
所述顶盖是透明的。所述顶盖、微流体通道层、带有微孔阵列的基板以及带有腔体组的底板由绝缘材料制成,或者由绝缘材料包裹着非绝缘材料制成。
所述样品是来自于活体组织、血液或体外培养的细胞悬液。
所述带有腔体组的底板,其扩增腔内所含PCR扩增试剂中包含EGFR基因第18、19、20和/或21外显子特异性PCR扩增引物。
本发明的微流控芯片可以分别捕获单个细胞,并实现对细胞的原位荧光鉴定、裂解和扩增。
图1为本发明微流控芯片的结构示意图。
本发明还提供一种用于EGFR基因多个突变位点单细胞水平检测的系统,该系统集成了EGFR肿瘤细胞筛选、鉴定、裂解、扩增和多基因位点分析等功能。所述系统包括上述微流控芯片,荧光探针,荧光显微镜,图像处理设备,注射泵,微阀控制器,恒温水浴箱,电压发生器和PCR扩增仪等。
所述荧光探针是指标记了荧光分子的抗体或多肽,可以单独使用一种荧光探针来实现对单一蛋白(如EGFR)的鉴定,也可以同时使用多种荧光探针来实现对多种目的蛋白的鉴定。
本发明进一步提供一种用于表达EGFR的单细胞分选和多基因位点检测的方法,向上述微流控芯片中流加细胞悬液,细胞经过基板上过滤区,大的杂质和细胞团被过滤掉,细胞以单细胞形式进入分选区,肿瘤细胞被分选出进入捕获区,当所有细胞都落入微孔中后,向微流控芯片中通入带有荧光的分子探针,使用荧光显微镜从芯片正面观察微孔阵列,对于发出荧光的微孔施加电压,在细胞两侧产生电场,该电场使得细胞膜发生破裂,细胞内容物流出,通过微孔底部的通道,流入下层底板的收集腔体内,将收集腔和扩增腔之间的连接阀打开,使细胞内容物与多重置换扩增(MDA)试剂混合,进行细胞基因组DNA扩增,最后分别加入针对EGFR基因不同位点设计的特异性引物进行PCR扩增,并对扩增产物进行测序,获得突变信息。
如图1和2所示,向微流控芯片中通入细胞悬液,样品流经过滤区时,由于微柱的间距限制,大于微柱间距的杂质将被限制在微柱结构上,只有小于微柱间距的单个细胞可以通过过滤区,用于去除样品中较大杂质;在流经芯片分选区时,由于流体力学作用,不同大小的细胞在流经微柱时的流动方向不同,因此,利用不同的出口位置可以收集较大的细胞(肿瘤细胞)进入后续捕获区,而较小的细胞(非肿瘤细胞)从废液口流出。进入捕获区的肿瘤细胞在重力和流体的作用下会落入微孔中。当所有细胞都落入微孔阵列中以后,再向微流控芯片中通入带有荧光标记的EGFR抗体(或多肽),EGFR抗体(或多肽)会与肿瘤细胞表面的EGFR蛋白结合,使用荧光显微镜从芯片正面观察微孔阵列,确定哪些微孔中的细胞带有EGFR蛋白,从而对细胞进行鉴定。根据鉴定结果,对特定微孔的电极施加电压,在细胞两侧产生电场,该电场使细胞膜破裂,细胞内液流出,通过微孔底部的通道,流入下层底板的腔体内。然后打开连接底盖上连接收集腔和扩增腔的微阀,将MDA试剂与细胞内DNA混合。将芯片放入恒温水浴箱中,进行MDA扩增。最后从扩增腔室取出扩增好的基因产物。利用特殊设计的四种PCR引物,对MDA扩增后的基因产物分别进行PCR基因扩增,并直接对PCR扩增产物测序,检测EGFR的不同突变信息。
本发明通过引入微加工技术和微流控芯片技术,开发出一种多层微结构芯片,实现了针对表达EGFR肿瘤细胞样品进行单细胞筛选、捕获、鉴定和全基因片上扩增,并对其EGFR基因位点进行检测。为单细胞水平上的EGFR多位点突变检测提供了一种新方法,能够更高效,更准确,更高通量的对单细胞水平的多个EGFR位点突变进行检测。
本发明具有以下优点:
(一)实现了单细胞水平上的分选、原位鉴定、裂解和扩增,特别是在非小细胞肺癌EGFR突变检测的医学诊断领域中,对单细胞的精确分析带来了几个显著的优势:首先,单细胞内的DNA量很少,非常容易遗失和损失,本发明提出的原位裂解、扩增技术,可以最大程度的减少在样品液转移过程中的损失,大大提高的检测的可靠性;其次,和传统技术相比,大大提高了分析的精确度,从而可以在大量细胞中筛选出极少的细胞,并对其EGFR突变信息进行分析;最后,所有的筛选、捕获和裂解方法基于物理原理进行,而鉴定步骤利用特异性荧光探针来识别细胞表面的蛋白,均不会影响细胞内的DNA,从而减少对后续基因分析的影响。
(二)实现了多个实验步骤的高度集成化,本发明利用微流控技术将繁琐的细胞筛选、捕获、鉴定、裂解和扩增步骤集成到一个微流控芯片上,与原有技术相比,大大减少了操作步骤,从而也提高了实验成功率和可靠性。同时,依赖于高度集成化的芯片和简化的操作步骤,本发明涉及的光学鉴定和基于注射泵对反应的控制都可以通过摄像、图像分析、单片机处理及编程等自动化手段完成,在提高处理速度的同时大大提高了准确率,缩短了实验时间,提高了样品处理效率。
(三)本发明提供的微流控芯片、相应的检测系统和检测方法,可以同时检测EGFR基因的不同位点,涵盖了绝大多数对临床有意义的突变位点,适用范围广,可以完全满足目前临床检测需求。并且根据需要,可以通过更改检测引物来对其他肿瘤基因进行检测,而这些改变对本领域技术人员来说,是很容易实现的且几乎不增加成本,大大拓展了该芯片及检测系统的应用领域。
附图说明
图1为本发明微流控芯片的结构示意图。
图2为本发明实施例1中图1微流控芯片的基板沿AA’的剖面图,展示了芯片中过滤区、分选区和捕获区的具体结构。
图3为本发明实施例1中细胞捕获、鉴定及裂解的过程示意图。
图中,1-分别为样品入口(E1)和样品出口(E2);2-顶盖;3-废液出口;4-U形微流体通道(主流道);5-带有微柱和微孔阵列的基板;6-分选微柱;7-过滤微柱;8-捕获微孔阵列;9-细胞内容物收集腔;10-带有腔体组的底板;11-MDA试剂预置腔(扩增腔);12-控制微阀;13-单细胞捕获微孔;14-细胞;15-连通孔;16-微孔内的电极;17-分支流道;18-过滤区;19-分选区;20-捕获区;21-废液口。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例1用于表达EGFR的单细胞分选和多基因位点检测的微流控芯片及其制备方法
本实施例提供的微流控芯片包括依次叠放在一起并相互密封的四层结构,由上至下分别为顶盖、微流体通道层、带有微孔阵列的基板以及带有腔体组的底板。
1、顶盖和流体通道
在对细胞进行鉴定时,需要光线透过顶盖,因此顶盖需要采用透明材质;同时,顶盖需要制作流体进入和流出的接口,所以需要能够开孔;最后,顶盖需要和流体通道封接在一起,并且实现密封,所以材质的选择上要考虑和流体通道的兼容性。
基板材料可以是通过蒸镀、切割及热塑成型制成特定规格及形状的材料。特别优选的是较薄并透明的绝缘聚合物。
流体通道起到约束细胞流动的作用,其特征尺寸在毫米级别,所以需要采用便于加工,成本低廉,生物相容性好的材料。
顶盖和流体通道的外廓尺寸要与微孔阵列基板相匹配。流体通道的宽度同样也要与基板上结构的特征尺寸(边长或直径)相匹配。
在图1所示的优选实施方式中,顶盖采用玻璃材料,而流体通道采用PDMS(聚二甲基硅氧烷)材料,二者采用键合的方式密封连接。在其它实施方式中,顶盖和流体通道也可以采用同样的材料(例如PDMS)一次成型,不需要分别制造再封接在一起。
在图1所示的优选实施方式中,微流体过滤区通道的长为10毫米,宽度为10毫米;分选区流道长为15毫米,宽度为5毫米;捕获区流道长为25毫米,宽为4毫米,所有流道高度均为40微米,这是应用于肿瘤细胞的最优条件。当需要处理其它细胞时,可由本领域技术人员自行选择合适的微流体通道尺寸。
2、带有微结构阵列的基板
在本实施例中,微孔阵列是用来容纳细胞并对其进行处理的关键部件。为了适应细胞的尺寸,必须选择能够兼容现有微加工技术的材料。在图2所示的优选实施方式中,选择硅作为微柱和微孔阵列的材料,是因为硅可以很好的兼容基于光刻刻蚀和腐蚀的微加工工艺,从而很容易获得与细胞尺寸相符的微孔阵列。本领域技术人员也可以根据需求选择玻璃、PDMS等可加工的材料。值得注意的是,最终加工完成的微孔阵列表面需要是绝缘的,图2所示的优选实施方式中采用对硅材料表面进行氧化以形成绝缘的二氧化硅层来满足这一要求。
在图2所示的优选实施方式中,过滤区域的微柱阵列直径为50微米,高为40微米。不同排之间的间距为200微米,在同一排内的微柱间距按梯度变化排列(500微米、200微米、100微米和50微米)。
在图2所示的优选实施方式中,分选区的微柱阵列如图所示交错排列,每个微柱的直径为15微米,间距为30微米。
在图2所示的优选实施方式中,每个微孔都是边长为25微米的立方体,每两个微孔之间的间距为25微米。每个阵列组为1毫米长,微孔阵列的整体由多个组构成,每个阵列组间距1毫米,整个捕获阵列长20毫米,宽为4毫米,共有20000个微孔。上述是应用于肿瘤细胞的最优条件。当需要处理其它细胞时,可由本领域技术人员自行选择合适的微孔尺寸及数量。
在每个微孔的侧壁上,都设有相对布置的电极,分别作为阴极和阳极,用于细胞的裂解。电极可以由适当的导电材料或这些材料的复合物制成。优选材料为生物兼容性好的材料,例如金、钛和掺有银离子的PDMS(聚二甲基硅氧烷,一种常用的聚合物)。当采用多种材料时,例如一种导电材料(如金)镀在另一种导电材料(如铜)上,最外层的材料优选为生物兼容性好的材料。
在如图3所示的微流控芯片中,电极材料为铬和金。首先在基板上溅射一层厚度为0.1微米的铬,再溅射一层厚度为0.5微米的金。然后对整个基板进行光刻(溅射和光刻均为半导体加工工艺中常用的方法)得到需要的电极形状。接着腐蚀掉金层和铬层上不需要的部分,最终得到所需的电极。当然,电镀等本领域公知的加工金属的方法也可以用来制造电极。如图3所示的实施方式中,采用铬和金来制作电极,是因为金的生物兼容性很好,而铬是为了增加金和基板材料之间的黏附性。根据不同的需求,其它的导电材料,例如铝、铜或者导电聚合物都可以用来制造电极。如图3所示的微流控芯片中,电极宽20微米,深25微米(和微孔阵列深度相同),厚度为0.6微米。
在每个微孔的底部,都有一条通往下层收集腔的通道,该通道起到阻挡细胞通过并让细胞内容物通过的作用,所以其特征尺寸要小于细胞的特征尺寸,在图3所示的优选实施方式中,该通道的截面为正方形,边长为5微米。这是应用于EGFR非小细胞肺癌肿瘤细胞的最优条件,既可以保证细胞不通过,也可以保证细胞裂解液顺畅通过。当需要处理其它细胞时,可由本领域技术人员自行选择合适的通道尺寸。
3、底板
本实施例中,底板上有容纳细胞裂解液的微腔。图1及图2所示的优选实施方式中,底板上有多个腔体组,每个腔体组由收集腔和扩增腔构成;底板的收集腔体与上面微孔阵列相对应;扩增腔与收集腔并排布置,收集腔和扩增腔用可控制开关的微阀连接。
图1和图3所示的优选实施方式中,底板的材料是玻璃。而硅、PDMS或不锈钢亦可以很方便的用作底板材料。对于底板上有多个腔体的情况来说,硅和PDMS更易加工。
4、封接方法
在图1所示的优选实施方式中,顶盖、微流体通道、阵列基板、底板的材料分别为玻璃、PDMS、硅、PDMS。采用氧等离子辅助键合的方法可以很好的实现玻璃和PDMS、硅和PDMS之间的良好密封封接;采用阳极键合的方法可以实现硅和玻璃之间的密封封接。
在其它实施方法中,可以根据顶盖、微流体通道、微流体通道、底板的材料来选择合适的封接方法。
5、芯片配套系统
本实施例中还提供用于EGFR基因多个突变位点单细胞水平检测的系统。除了微流控芯片之外,还需要荧光探针(Probe)、荧光显微镜、图像处理设备、MDA扩增试剂、注射泵、电压发生器以及后续的PCR系统和特定PCR扩增引物来构成完整的系统。
荧光探针用于鉴定细胞,在图2所示的优选实施方式中,采用标记了绿色荧光(FITC)的EGFR抗体作为荧光探针,用来识别肿瘤细胞表面的EGFR蛋白。在其它实施方式中,也可以针对不同的蛋白选择不同的抗体或者多肽作为探针。
荧光显微镜用于检测微孔阵列中的细胞是否有荧光,图像处理设备用于分析荧光显微镜获取的图像并对电压发生器发出指令,控制特定微孔中的电极完成细胞裂解。
注射泵用于驱动微流体;电压发生器用于产生电压裂解细胞。
MDA扩增用于细胞DNA的全基因组扩增,预置在检测芯片的扩增腔室中。细胞裂解液收集到收集腔之后,打开中间的控制阀,将两者混合,将细胞裂解液中的DNA进行全基因组扩增。
PCR系统和特定检测引物,用于扩增经MDA初扩增然后的EGFR不同位点,进行测序,检测突变信息。在其它实施方式中,也可以针对不同的基因位点设计不同的引物进行其他位点的突变检测。
6、芯片的具体制作方法
采用以下两套不同的制作工艺成功制造出所述微流控芯片及检测系统。对于具体的制作方法是为了帮助本领域技术人员理解本发明的技术方案,而并不是对本发明所述器件的材料,尺寸和制造方法做出限定。
制作方法A:
顶盖:采用4英寸Pyrex7740玻璃片(康宁公司),按照长4厘米,宽2厘米的外形尺寸切成长方形小片,用激光在每块小片的特定位置打三个孔。
微流体通道:采用N型4英寸硅片,在光刻出流道的平面形状后,使用半导体常用的ICP干法刻蚀(感应等离子刻蚀,即使用六氟化硫和四氟化碳的高能等离子来刻蚀硅)出40微米深的槽。将液态PDMS倒入槽中,待其凝固后脱模取出,切除PDMS多于部分,按照长4厘米,宽2厘米的外形尺寸切成长方形小片,即得微流体通道。
带有硅微柱和微孔阵列的基板:采用N型4英寸硅片,在硅片正面光刻出微柱的平面位置,采用氢氧化钾湿法腐蚀的方法将非微柱区域都向下腐蚀40微米,形成过滤区和分选区结构。然后对其采用湿法氧化,在硅片表面获得一层0.5微米厚的氧化层,然后再利用干法刻蚀的技术,在捕获区向下刻蚀25微米的微孔。在硅片正面溅射0.1微米厚的铬金属层,再于铬金属层上溅射0.5微米厚的金层,溅射时将硅片倾斜45度并旋转,以保证金属对微孔侧壁的覆盖。对硅片正面进行真空辅助涂胶和光刻,形成所需电极的形状,然后再使用碘化钾溶液腐蚀金层,使用硝酸铈铵腐蚀铬层,这样就得到了微孔中的电极。对硅片背面进行光刻,形成硅微孔底部的通道位置,采用ICP干法刻蚀穿通该硅片,最终获得完整的硅微孔阵列。
底板:采用4英寸Pyrex7740玻璃片,光刻出腔体的位置,使用氢氟酸腐蚀玻璃,形成腔体组,加入控制阀将收集腔室和扩增腔室连接。
封接:首先将硅基板和玻璃底板阳极键合在一起,再按长4厘米,宽2厘米的外形尺寸切成长方形小片,使用氧等离子体处理透明玻璃顶盖的底面,微流体通道的两面,硅基板的顶面,将它们依次键合在一起,最终获得完整的芯片。
芯片系统:在微流体芯片的基础上,使用普通塑料管连接泵和顶盖上的流体出入口,在基板上外露的金电极上通过超声波焊接进行电缆的引出,将电缆连接到图像处理设备和电压发生器上,再将电压发生器和图像处理设备连接在一起,并将芯片放置在荧光显微镜下,在需要MDA扩增时,将芯片密封,放入恒温水浴锅内,即可完成整套系统的构建。
制作方法B:
顶盖和微流体通道:采用N型4英寸硅片,在光刻出流道的平面形状后,使用ICP干法刻蚀出40微米深的槽。将液态PDMS倒入槽中,待其凝固后脱模取出,按照长4厘米,宽2厘米的外形尺寸切成长方形小片,使用钻头在所需位置打孔,得到一体式的顶盖和微流体通道。
带有硅微孔阵列的基板:采用N型4英寸硅片,在硅片正面光刻出微柱的平面位置,采用ICP干法刻蚀的方法将非微柱区全部向下刻蚀40微米,形成微柱结构。然后采用CVD(化学气相沉积)的方法,在硅片表面获得一层2微米厚的氧化层,再利用光刻和干法刻蚀技术,在微孔区向下刻蚀25微米深。在硅片正面溅射0.1微米厚的铬金属层,再于铬金属层上电镀3微米厚的金层,以保证对微孔侧壁的覆盖。对硅片正面进行真空辅助涂胶和光刻,形成所需电极的形状,然后再使用碘化钾溶液腐蚀金层,使用硝酸铈铵腐蚀铬层,得到微孔中的电极。对硅片背面进行光刻,形成硅微孔底部的通道位置,采用激光刻蚀穿通该硅片,最终获得完整的硅微孔阵列。将4英寸硅片按照长4厘米,宽2厘米的外形尺寸切成长方形小片。
底板:基于玻璃模板的加工技术制作出位置与芯片微孔区对应的,带有多个腔室的模具。将PDMS浇筑成型后脱模切割成长4厘米,宽2厘米的长方形,加入控制阀将收集腔室和扩增腔室连接。
封接:用紫外固化粘合剂将微流体通道、硅阵列基板和底板依次密封粘合在一起,即获得完整的微流控芯片。
芯片系统:在微流体芯片的基础上,使用聚四氟乙烯管连接泵和顶盖上的流体出入口,在基板上外露的金电极上通过超声波焊接进行电缆的引出,将电缆连接到电压发生器上,再将电压发生器和图像处理设备连接在一起,并将芯片放置在荧光显微镜下,在需要MDA扩增时,将芯片密封,放入恒温水浴锅内,即可完成整套系统的构建。
7、具体应用方法
采用以下方法已将本发明所述微流控芯片及相应检测系统成功应用于单细胞EGFR基因多位点检测。提供的具体方法是为了帮助本领域技术人员理解本发明的功能及应用方法,而并不是对本发明所述装置的适用范围做出限定。
将NCI-1975、NCI-1650、A549三种细胞掺入未经处理的血液中制成混合样本。稀释10倍,通入微流控芯片中。在过滤区,大的细胞杂质和细胞团簇将被滤掉,不能进入下一部分。在分选区,血液中的白细胞等较小的非肿瘤细胞在流体与微柱的作用下将向下方移动,从废液口流出,而直径较大的肿瘤细胞将从上部流入捕获区,经过静置,待细胞捕获完成后,向芯片内通入带有绿色荧光的EGFR抗体对捕获的细胞进行染色,使用荧光显微镜拍摄图像并进行处理,不发荧光的细胞不加处理;发绿色荧光的说明是表达EGFR蛋白的目的肿瘤细胞。确认位置后,对相应细胞通电加以裂解,裂解液通过微孔下的连通孔进入下面的腔室中,打开底板的控制阀,裂解液与预置的MDA扩增试剂混合。将芯片放入30℃的恒温水浴箱扩增3小时。然后取出扩增产物,分成4份,分别加入设计的EGFR基因第18、19、20和/21外显子扩增的特异性引物进行PCR扩增。然后将扩增产物直接进行测序,得到突变信息。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!