一种用于检测不同基因型鸡新城疫病毒的试剂盒的制作方法
本发明涉及分子生物学领域,特别是涉及一种用于检测不同基因型鸡新城疫病毒的通用试剂盒及其应用。
背景技术:
新城疫病毒(Newcastle disease virus,NDV),属副黏病毒科、禽腮腺炎病毒属(Rubulavirus)。NDV只有一个血清型,病毒粒子呈多形性,直径约为100~250nm,有囊膜的病毒粒子一般呈圆形,但常因囊膜破损而形态不规则。NDV为单股、负链、不分节段的RNA,全长约15.2kb。在NDV基因组上依次排列着NP、P、M、F、HN和L基因,分别编码核衣壳蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素-神经氨酸酶(HN)和大分子蛋白(L),其中F、HN蛋白与NDV的致病性密切相关。F蛋白具有使病毒囊膜与宿主细胞融合,进而病毒核酸进入宿主细胞作用。核苷酸序列分析表明,F蛋白基因编码一个由553个氨基酸组成的多肽。F蛋白首先以非活性前体F0(68KD)的形式存在,此时无融合活性,当其经高尔基体运输时被裂解为由二硫键连接的F1(55.OKD)+F2(12.5KD)后,才使得病毒具有感染力,可以看出F蛋白与NDV的致病性密切相关。
传统的NDV检测方法主要有血凝和血凝抑制(HI)试验,酶联免疫吸附试验(ELISA)和病原分离。确诊通常需要接种鸡胚进行病毒分离,有时还需要进行病毒毒力测定以及动物回归实验等。病毒分离方法,对采集病料的时机和病料的新鲜程度要求较高,且检测周期往往要几周以上,具有明显的局限性。
生物技术的飞速发展极大地推动了生命科学各个领域的发展,疾病的诊断、病原的检测已从细胞水平进入分子水平。NDV分子结构与致病性关系研究的日益深入为副粘病毒的诊断技术研究奠定了基础。根据不同致病性毒株存在的分子结构差异,相继建立了特异、快速的分子诊断技术,包括单克隆抗体技术、核酸探针技术、限制性核酸内切酶分析、基因片段的体外扩增技术和寡核苷酸指纹图谱技术等。这些技术不仅应用于NDV的检测、鉴定和特性研究及致病性的检测,还可以追踪病毒的来源及流行情况。
聚合酶链式反应(PCR)是一种体外扩增特异性基因片段的技术,在疾病的检测方面有着广阔的应用前景,现已被广泛应用。反转录-聚合酶链式反应(RT-PCR)能够选择性地将NDV基因组的一个特异性短片段放大10万倍以上,极大地增强了检测的敏感性。1991年Jestin首次发展了NDV的RT-PCR检测方法,扩增F蛋白基因的238bp的目的片段。Veronique(1991)等用RT-PCR方法扩增出约275bp的F基因产物并绘制酶切图谱,证明这些病毒株都具有NDV的共同抗原表位。Seal等(1995)用PCR扩增M基因和F基因裂解位点编码片段,通过对病毒分子进行同源进化分析,并预测了每株病毒的致病性。Kant(1998)利用4条引物配成三对,分别对通过组织匀浆提取的NDV-RNA进行RT-PCR,结果扩增出362bp、254bp、254bp的三个目的片段。该方法不需要接种鸡胚,24h之内便可出结果,为NDV诊断提供了技术手段。大量研究结果证明,设计特异性引物对NDV进行RT-PCR扩增不失为一种快速、准确的检测方法。
技术实现要素:
本发明的第一个目的在于提供特异性引物用于检测不同基因型鸡新城疫病毒。
本发明的第二个目的在于提供检测不同基因型鸡新城疫病毒的试剂盒。
本发明以NCBI数据库中NDV-La Sota株(GenBank登录号为JF950510)基因组序列作为参考,上游引物在4988nt-5006nt之间,下游引物在5428nt-5448nt之间。在众多备选的引物中,经过多次筛选,比对试验,以排除引物与其他物种序列可能存在的非特异性匹配,最终获得优化后的引物对。
本发明提供的优选的特异性引物对,其序列为:
上游引物为5’-GCCAACATCCT(C/T)CGGCT(C/T)A-3’(SEQ ID NO.1);以及下游引物为5’-TAGGTGGCACGCATATTATTT-3’(SEQ ID NO.2)。
提取样本总RNA并进行反转录(RT)合成cDNA后,利用上述引物进行聚合酶链式反应(PCR),采用下列反应程序:起始变性94℃5min,30个循环(94℃45s,54℃45s,72℃30s),最后经过72℃10min延伸,对PCR产物进行琼脂糖凝胶电泳分析,利用紫外凝胶成像仪检测目的条带,如果扩增出目的条带则证明为NDV阳性,否则为阴性。
本发明提供了上述特异性引物对在制备检测不同基因型鸡新城疫病毒试剂盒中的应用。
含有SEQ ID NO.1-2所示特异性引物对的检测试剂属于本发明的保护范围。
含有SEQ ID NO.1-2所示特异性引物对的试剂盒属于本发明的保护范围。
进一步地,本发明的试剂盒其PCR阶段的工作程序为:94℃5min;94℃45s,54℃45s,72℃30s,30个循环;72℃10min。
本发明的上述试剂盒是对待测样本进行RT-PCR检测后,扩增产物若有461bp大小的条带,则待测样本中含有鸡新城疫病毒。
本发明还提供了一种检测不同基因型鸡新城疫病毒的非诊断目的方法,包括以下步骤:
(1)提取待测样本的总RNA,反转录,得到cDNA;
(2)利用SEQ ID NO.1-2所示特异性引物对对步骤(1)的cDNA进行PCR扩增,根据扩增结果判断待测样本中是否有鸡新城疫病毒。
其中,步骤(2)中阳性样本扩增的目的片段为461bp。
本发明的优点在于,1)扩增的目的片段位于NDV F蛋白的保守区,长度为461bp,敏感性好、操作方便、对不同基因型的NDV均有较好检出(通用性);2)将NDV病毒样本cDNA进行10倍系列稀释后,发现进行10000倍稀释后利用本方法仍能检测到NDV特异性条带,表明该方法具有较高的灵敏度;3)该方法对其它常见禽病病原,如禽流感病毒、传染性支气管炎病毒、传染性法氏囊病毒、禽呼肠孤病毒、禽腺病毒和禽传染性喉气管炎病毒的检测结果皆为阴性,没有交叉反应,表明该方法亦具有良好的特异性;4)本发明方法适用于养禽生产中进行NDV的检测,具有高特异性、高灵敏度、高效率、低成本的特点,可在6h内对临床病料进行快速鉴别诊断,克服了传统检测方法耗时较长的缺点。此方法适合大批量临床样本的分析与检测,对NDV的早期快速诊断和分子流行病学调查研究提供技术手段。
附图说明
图1是最佳扩增引物筛选电泳结果。点样顺序为M:Marker II;1:引物1(461bp);2:引物2(442bp);3:引物3(566bp);4:引物4(499bp);5:引物5(554bp)。
图2是RT-PCR反应最佳退火温度筛选电泳结果。点样顺序为M:Marker II;1:52℃;2:53℃;3:54℃;4:55℃;5:56℃。
图3是RT-PCR反应最佳循环数筛选电泳结果。点样顺序为M:Marker II;1:27循环;2:28循环;3:29循环;4:30循环;5:31循环;6:32循环。
图4是根据新城疫F基因绘制遗传进化树,●显示用于本方法通用性检测的不同基因型毒株。
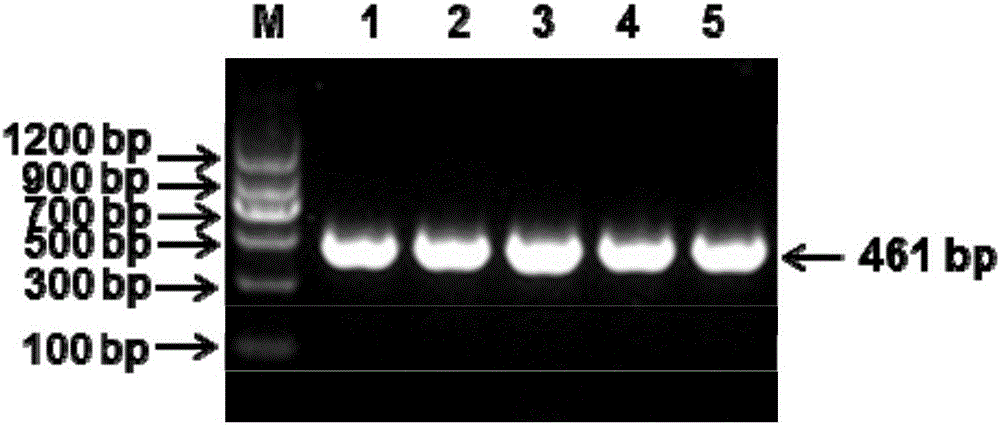
图5是对不同基因型鸡新城疫病毒进行检测的电泳结果。加样顺序为M:DNA Maker II;P:阳性对照;N:阴性对照;1:BJ14(基因VI型);2:La Sota(基因II型);3:aSG10(基因VII型);4:F48E8(基因IX型)。
图6是对该引物检测鸡新城疫病毒的灵敏度电泳结果。加样顺序为M:DNA maker II;P:阳性对照;N:阴性对照;1:cDNA稀释10倍;2:cDNA稀释102倍;3:cDNA稀释103倍;4:cDNA稀释104倍;5:cDNA稀释105倍。
图7为采用现有技术的引物进行RT-PCR通用性检测结果,样品顺序:M:Marker II;P:阳性对照;N:阴性对照;1:PPMV-1(基因VI型);2:La Sota(基因II);3:aSG10(基因VII型);4:F48E8(基因IX)。
图8为采用现有技术的引物进行RT-PCR敏感性检测结果,样品顺序:M:Marker II;P:阳性对照;N:阴性对照;1:cDNA稀释10倍;2:cDNA稀释102倍;3:cDNA稀释103倍;4:cDNA稀释104倍;5:cDNA稀释105倍。
图9是对其它常见禽病病原进行检测的电泳结果。其中M:DNA Maker II;P:阳性对照;N:阴性对照;1:H5亚型禽流感病毒;2:H7亚型禽流感病毒;3:H9亚型禽流感病毒;4:传染性支气管炎病毒(IBV);5:传染性法氏囊病毒(IBDV);6:禽呼肠孤病毒(REOV);7:禽腺病毒(FAdV);8:传染性喉气管炎病毒(ILTV)。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
下列实施例中常规的实验方法,参见Sambrook等编写的分子克隆。仪器的使用参照仪器操作说明。LEGEND MICRO 17R低温台式离心机,为Thermo公司产品;VS-1涡旋振荡器购自鼎昊源科技有限公司;TL-2010S组织研磨震荡器购自鼎昊源科技有限公司。反转录酶(Reverse Transcriptase)200U/μl(Promega)、核酸酶抑制剂(Rnase Inhibitor)50U/μl(Takara)、5倍体积的反应缓冲液(5×Reaction Buffer)、dNTP混合物2.5mM和随机引物(Random Primer)500μg/ml(Promega),购自北京爱普锐晟科技有限公司;DEPC处理水,购自北京明豪至远有限公司。Marker II DNA Ladder购自中科瑞泰(北京)生物科技有限公司。Veriti 96-Well Thermal Cycler PCR扩增仪为Applied Biosystems公司产品,购自北京诚茂兴业科技发展有限公司;MINI-Smart小型台式离心机为HERO公司产品;HW·SYII-KP3型电热恒温水槽购自北京长风仪器仪表公司。
本发明实施例中选用的生物材料如下:禽流感病毒、传染性法氏囊病毒、禽传染性支气管炎病毒、禽呼肠孤病毒、禽腺病毒和禽传染性喉气管炎病毒,新城疫病毒BJ14(基因VI型)、La Sota(基因II型)、aSG10(基因VII型)、F48E8(基因IX型)均由中国农业大学动物医学院保藏和提供。
实施例1用于检测不同基因型鸡新城疫病毒的特异性引物的设计
NCBI数据库中NDV-La Sota株(GenBank登录号为JF950510)基因组序列作为参考,设计特异性引物。在众多备选的引物中(表1所示),经过多次筛选,比对试验,以排除引物与其他物种序列可能存在的非特异性匹配,经反复筛选和验证,最终获得优化后的引物对,各引物扩增电泳结果如图1所示。选择扩增目的条带最亮,无非特异性杂带的引物对1为最佳引物,上游引物在登录号为JF950510序列的4988nt-5006nt之间,下游引物在5428nt-5448nt之间。
表1用于检测不同基因型NDV备选引物序列
本发明提供的优选特异性引物对,其序列为:上游引物:5’-GCCAACATCCT(C/T)CGGCT(C/T)A-3’(SEQ ID NO.1);以及下游引物:5’-TAGGTGGCACGCATATTATTT-3’(SEQ ID NO.2)。
实施例2检测新城疫病毒的RT-PCR检测方法最佳退火温度的摸索
1、检测样品的预处理
(1)组织样品处理:取100mg脏器组织样品加入0.5ml灭菌生理盐水并用研磨器进行研磨混悬,组织悬液3000rpm离心30min后取上清用于检测分析。
(2)泄殖腔或口咽拭子样品处理:将拭子样品加入0.5ml灭菌生理盐水并用涡旋振荡器振荡混悬,样品悬液3000rpm离心30min后取上清用于检测。
2、样品总RNA的提取
参照Trizol RNA提取试剂盒(Invitrogen)说明书进行提取。
3、反转录为cDNA
在0.2ml离心管内加入下列成分:RNA溶液4μl,随机引物1μl,轻轻混匀,70℃水浴5min,冰浴2min,然后依次加入下列成分:5×反应缓冲液 4μl,dNTP混合物2μl,核酸酶抑制剂 1μl,反转录酶0.5μl,DEPC处理水7.5μl,轻轻混匀,37℃作用1h,得到样本cDNA。
4、PCR检测
利用实施例1最终确定的引物对进行聚合酶链式反应(PCR),设计不同的退火温度梯度(52℃、53℃、54℃、55℃和56℃)对NDV进行RT-PCR。在0.2ml离心管中加入下列成分:
轻轻混匀后,以不同退火温度分别进行如下反应:起始变性94℃5min,94℃45s,(52℃、53℃、54℃、55℃和56℃)45s,72℃30s,进行30个循环,循环结束72℃延伸10min,PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe,取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30min,电泳结束后将凝胶块置于紫外凝胶成像仪上观察并拍照,根据电泳结果确定样品中能否扩增出目的条带,如果扩增出目的条带长度为461bp则证明待测样品为NDV检测阳性,否则为检测阴性。
电泳结果如图2所示,54℃为扩增目的条带最亮,结合退火温度过高不利于引物与模板结合,所以选择该温度为最佳温度。
实施例3检测新城疫病毒的RT-PCR检测方法最佳循环数摸索
检测样品的预处理、样品总RNA的提取、反转录为cDNA参见实施例2对应的方法。利用实施例1和2确定的条件,设计6个不同的循环数(27、28、29、30、31和32)对NDV进行RT-PCR。
在0.2ml离心管中加入成分参见实施例2。轻轻混匀后,以不同循环数分别进行如下反应:起始变性94℃5min,94℃45s,54℃45s,72℃30s,进行不同的循环数(27、28、29、30、31和32),循环结束72℃延伸10min。
PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe。取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30分钟,电泳结束后将凝胶块置于凝胶成像仪上观察并拍照,根据电泳结果确定样品中能否扩增出目的条带461bp,如果扩增出目的条带则证明为鸡新城疫病毒检测阳性,否则为鸡新城疫病毒检测阴性。电泳结果如图3所示,30个循环数扩增目的条带与更多循环数亮度相似,且没有非特异性杂带,能节省时间、提高检测效率,因此选择其为最佳循环数。
实施例4检测不同基因型鸡新城疫病毒的RT-PCR检测方法的建立
检测样品的预处理、样品总RNA的提取、反转录为cDNA参见实施例2对应的方法。
在0.2ml离心管中加入成分参见实施例2。轻轻混匀后,以不同循环数分别进行如下反应:起始变性94℃5min,94℃45s,54℃45s,72℃30s,进行30个循环,循环结束72℃延伸10min。
PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe。取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30分钟,电泳结束后将凝胶块置于凝胶成像仪上观察并拍照,根据电泳结果确定样品中能否扩增出目的条带461bp,如果扩增出目的条带则证明为鸡新城疫病毒检测阳性,否则为鸡新城疫病毒检测阴性。
利用上述方法分别对不同基因型(图4所示)NDV进行检测,结果均有较好的检出,如图5所示,表明本方法具有良好的通用性。
实施例5检测鸡新城疫病毒的RT-PCR检测方法的敏感性检测
按照实施例4建立的方法进行。将cDNA溶液进行10倍系列稀释,稀释度为10、102、103、104和105倍,分别以稀释后的模板进行PCR反应。94℃预变性5min,94℃45s,54℃45s,72℃30s,进行30个循环,循环结束72℃延伸10min。
PCR反应结束后,用1×TAE电泳缓冲液制备1%琼脂糖凝胶并按照参考比例混入荧光染料Gelsafe。取7μl PCR产物加入凝胶孔中,选择合适的电压(4V/cm-10V/cm)进行电泳,电泳时间为20-30分钟,电泳结束后将凝胶块置于凝胶成像仪上观察并拍照,根据电泳结果确定样品中能否扩增出目的条带461bp,如果扩增出目的条带则证明为鸡新城疫病毒检测阳性,否则为鸡新城疫病毒检测阴性。
利用上述方法分别对鸡新城疫病毒进行检测,结果显示对反转录的鸡新城疫病毒cDNA稀释104倍后,仍能检测到病毒DNA,如图6所示,表明本方法具有良好的敏感性。
与现有技术鸡新城疫病毒检测方法的通用性、灵敏度比较
国标GB/T 16550-2008的新城疫诊断技术推荐使用的引物序列:ND-535-F:ATGGGCYCCAGAYCTTCTAC,ND-535-R:CTGCCACTGCTAGTTGTGATAATCC。发明人采用上述引物对NDV进行了检测,结果见图7。图7中1-4为不同基因型NDV毒株。与本发明实施例1确定的最佳引物相比,该文献所用引物通用性差,未扩增出PPMV-1(基因VI型)的目的片段。灵敏度结果见图8,上述文献推荐的引物仅能检测到稀释103倍后的NDV cDNA,因此,其敏感性远不如本发明方法的敏感性(104倍)。
实施例6检测鸡新城疫病毒的RT-PCR检测方法对禽常见病病原的特异性检测
利用实施例4建立方法对其它常见的禽病病原:禽流感病毒、禽传染性支气管炎病毒、传染性法氏囊病毒、禽呼肠孤病毒、禽腺病毒和禽传染性喉气管炎病毒进行检测,结果如图9所示,结果显示,除阳性对照外,其他实验对象皆为阴性,表明本方法在检测禽类常见的其他病原体过程中,实施例4建立的方法针对不同基因型NDV具有良好的特异性。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!