发酵罐底物流加生产二十二碳六烯酸的方法与流程
本发明涉及二十二碳六烯酸,尤其是涉及一种发酵罐底物流加生产二十二碳六烯酸的方法。
背景技术:
二十二碳六烯酸(Docosahexaenoic acid,DHA)是主要的高度不饱和脂肪酸之一,属于ω-3系列多不饱和脂肪酸。其分子式为C22H32O2,相对分子质量为328.49,又称为“脑黄金”,具有促进婴幼儿脑部发育、保护视力和预防、治疗心血管疾病等多种重要的生理功能(Crawford P.1987;Birch EE.et al.2002;Uauy R.et al.2006),常作为功能性因子添加到保健食品和功能食品中而受到了广泛关注(Agren JJ.et al.1996;Smith Jr SC.et al.2006)。由于它的广泛用途,其全球市场需求量也大大增加。当前鱼油是商业DHA的主要来源,特别是寒冷海域生活的鱼类,被认为是丰富、廉价的DHA资源。但因其鱼腥味重、DHA含量较低、脂肪酸组成复杂、纯化困难、资源有限及不利于环境保护等缺点(Song XJ.et al.2007),难以满足市场需求,因此寻找微生物来源的DHA越来越迫切。微生物发酵法生产DHA可克服传统鱼油提取的不足,可用于大量生产DHA,具有广阔的应用前景,因此备受国内外学者关注(Bailey RB.et al.2003;Gill I.et al.1997)。国外对DHA的发酵研究比较早,且其生产在一些欧美国家和日本已进入工业化生产阶段(Bailey RB.et al.2003)。近年来,国内一些研究机构对微生物发酵法生产DHA进行了研究,并取得一定进展(Ren LJ.et al.2009;Zhou L.et al.2007)。
目前,合成DHA的微生物主要是一些海洋甲藻类生物,如隐甲藻(Crythecodinium)、破囊壶菌(Thraustochytrium)、裂殖壶菌(Schizochytrium)等(Sijtsma L.et al.2004)。这些微生物为异养型微生物,可以通过发酵罐培养实现高密度发酵,进而规模化生产DHA。由于海洋甲藻类培养对于光要求较高,难以实现批量生产和利益最大化,故破囊壶菌目来源的DHA生产技术得到更为广泛的关注,并主要集中于两种菌:破囊壶菌和裂殖壶菌。由于裂殖壶菌生长繁殖较快,又比其他破囊壶菌耐受机械搅拌,对剪切力抵抗作用更强,且脂质中PUFAs含量高,故适宜发酵罐大规模培养。此外,裂殖壶菌产生的脂质中PUFAs含量高,且成分、比例与母乳中的脂质组成相近,已被美国及欧洲有关食品权利机构批准添加至相关食物中使用,因此裂殖壶菌被认为是产DHA较有前景的微生物资源(Bailey RB.et al.2003;Zhang L.et al.2013)。
目前关于微生物来源DHA的研究主要集中在筛选优良菌株、DHA的生物合成、培养基及培养条件的优化和工业化大规模生产工艺的探索上。除菌株本身对微生物代谢产物的影响外,培养基的组成和培养条件对其生长及产物积累都有很大的影响,如最佳的碳源、氮源、碳氮比、培养温度、pH和溶氧等。只有选择了经济的培养基组成和最佳的培养条件,才有利于工业化的发酵生产。
不同种类和浓度的碳源对微生物发酵生产DHA效果显著。破囊壶菌目的微生物在利用碳源的能力上有很大的区别,一般认为葡萄糖、果糖和甘油是最适的碳源(Raghukumar S.et al.2008)。Yokochi等(Yokochi T.et al.1998)对Schizochytrium limacinum SR21菌的培养条件进行了优化,发现以葡萄糖、果糖或甘油作为碳源,细胞能较好的生长,能达到较高的DHA产量,且DHA占总脂量的比例达到30%,产生的其它不饱和酸只有DPA和1%的EPA和AA;而且还发现麦芽糖和淀粉明显不利于合成DHA。Wu等(Wu ST.et al.2005)同样认为葡萄糖是裂殖壶菌生长繁殖的最佳碳源,果糖,蔗糖,乳糖和麦芽糖次之,对可溶性淀粉利用较难。Chi等(Chi Z.et al.2007)用含甘油的生物柴油工业副产品来培养Schizochytrium Limacinu,DHA产量可达4.9g/L。总之,不同的微生物因自身酶系构成不同,其吸收利用碳源能力也大大的不同,因此选择适宜、经济的碳源非常重要。尽管在前人的研究基础上DHA的产量已有所提高,但若要满足工业化生产的需求,建立一种有效的DHA生产新策略,进一步提高DHA的产量,从而降低生产成本,这对于满足市场需求和促进我国食品与生物工业的发展具有重要意义。
技术实现要素:
本发明的目的在于提供一种发酵罐底物流加生产二十二碳六烯酸的方法。
本发明包括以下步骤:
1)菌种活化:将菌种转接于平板培养基中培养,得活化的菌种,所述菌种为裂殖壶菌(Schizochytrium sp.)LU310,已于2016年07月05日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101,保藏中心登记入册编号:CGMCC No.12528;
在步骤1)中,所述平板培养基的组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,琼脂15,pH调至6.5;所述培养的条件可为:28℃培养24~48h。
2)一级种子培养:将步骤1)得到的平板菌落中活化的菌种接入装有种子培养基的锥形瓶培养,得一级种子培养液;
在步骤2)中,所述种子培养基的组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5;所述培养的条件可为28℃、200rpm培养24~48h。
3)二级种子培养:将步骤2)得到的一级种子培养液接入装有种子培养基的锥形瓶培养,得二级种子培养液;
在步骤3)中,所述种子培养基的组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5;所述接入装有种子培养基的锥形瓶培养的一级种子培养液的接种量按体积百分比可为一级种子培养液的4%;所述培养的条件可为28℃、200rpm培养24h。
4)摇瓶发酵:将步骤3)得到的二级种子培养液,以4%的接种量接入装有发酵培养基的锥形瓶中培养;
在步骤4)中,所述发酵培养基的组成为(g/L):葡萄糖120,谷氨酸钠5,玉米浆粉5,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,FeSO4·7H2O 10,泛酸钙3.2,MnCl2·4H2O 3,ZnSO4·7H2O 3,NiSO4·6H2O 2,CuSO4·5H2O 2,CoCl2·6H2O 0.04,Na2MoO4·2H2O 0.04;维生素组成(mg/L):VB1 9.5,VB12 0.1,pH调至6.5;所述培养的条件可为28℃、200rpm培养120h。
5)发酵罐培养:将步骤4)得到发酵培养液,以4%接种量接种于发酵培养基中培养,通过流加2M NaOH或1M柠檬酸(CA)自动控制发酵液pH,每4h取样测定葡萄糖浓度,每12h取样测定生物量、油脂和DHA产量。
在步骤5)中,所述发酵培养基的组成为(g/L):葡萄糖120(5L罐)或葡萄糖40(1T罐),谷氨酸钠5,玉米浆粉5,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,FeSO4·7H2O 10,泛酸钙3.2,MnCl2·4H2O 3,ZnSO4·7H2O 3,NiSO4·6H2O 2,CuSO4·5H2O 2,CoCl2·6H2O 0.04,Na2MoO4·2H2O 0.04;维生素组成(mg/L):VB19.5,VB12 0.1,pH调至6.5;所述培养的条件可在28℃和2vvm的通气量下培养。
所述的高密度发酵生产DHA的工艺可用于工业化生产DHA。
通过发酵过程中底物的添加提高裂殖壶菌(Schizochytrium sp.)LU310产DHA产量的方法,且通过培养基中复合氮源的利用,大大缩短发酵周期。葡萄糖是工业生产中一种经济易得的碳源,通过葡萄糖的分批补料策咯,以获得裂殖壶菌高密度生产DHA。实验首先通过摇瓶实验对DHA的生产菌株裂殖壶菌(Schizochytrium sp.)LU310进行分批补料浓度的优化,在摇瓶实验基础上,在5L发酵罐,1T发酵罐中进行裂殖壶菌的流加分批发酵实验。通过流加高浓度的葡萄糖溶液,控制发酵过程参数,研究底物对发酵过程的影响,得到最佳的补料工艺条件。采用该发酵工艺生产DHA,可以实现高密度发酵,有效提高多不饱和脂肪酸和DHA的产量,能够在较短发酵周期内实现DHA的高产量积累,从而降低生产成本,有利于工业化应用。
本发明主要是对新发酵工艺的开发,采用的DHA菌株是从浙江温州乐清湾西门岛南岙山红树林分离筛选获得,经由18s rRNA测序及演化树比对后确定为裂殖壶菌(Schizochytrium sp.)LU310。最终在1T生产罐中裂殖壶菌的生物量可达100g/L以上,总油占56%,DHA产量占总油的57.1%,生产成本低,发酵周期短,生产工艺简单,具有很大的应用前景。
附图说明
图1为实施例中DHA生产菌裂殖壶菌(Schizochytrium sp.)LU310在不补加糖策略下发酵生产DHA的过程曲线(对照组)。
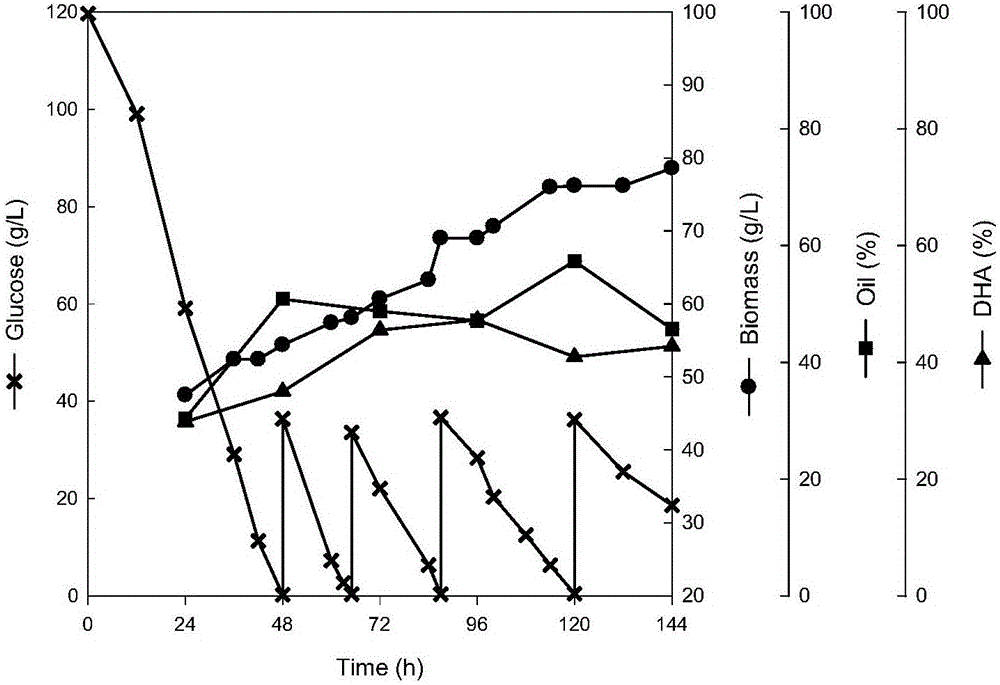
图2为实施例中DHA生产菌裂殖壶菌(Schizochytrium sp.)LU310在补加糖后维持残糖浓度为30g/L左右下发酵生产DHA的过程曲线。
在图1和2中,横坐标为时间Time(h),左纵坐标为葡萄糖浓度Glucose(×),第一右纵坐标为菌体生物量Biomass(●),第二右纵坐标为油脂产量Lipid(■),第三右纵坐标为DHA产量(▲)。
图3为实施例中DHA生产菌裂殖壶菌(Schizochytrium sp.)LU310在优化的补糖策略条件下5L发酵罐分批发酵的生长曲线。
图4为实施例中DHA生产菌裂殖壶菌(Schizochytrium sp.)LU310在优化的补糖策略条件下1T发酵罐分批发酵的生长曲线。
在图3和 4中,横坐标为时间Time(h),左纵坐标为葡萄糖浓度Glucose(×),第一右纵坐标为菌体生物量Biomass(●),第二右纵坐标为油脂产量Lipid(■),第三右纵坐标为DHA产量(▲)。
具体实施方式
下面通过实施例对本发明作详细说明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
实施例1
1)菌种活化:将保藏于-70℃的菌种裂殖壶菌(Schizochytrium sp.)LU310转接于平板培养基中,28℃培养24~48h,得活化的菌种,观察菌落形态。平板培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O0.17,琼脂15,pH调至6.5。
2)一级种子培养:将步骤1)中的平板菌落,选择形态良好的菌落,用接种环挑取接入装有50mL种子培养基的250mL平底锥形瓶中,28℃、200rpm培养24~48h;种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得一级种子培养液。
3)二级种子培养:将步骤2)中的一级种子培养液,以4%的接种量,接入装有50mL种子培养基的250mL平底锥形瓶,28℃、200rpm培养24h,用于接种摇瓶发酵。种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得二级种子培养液。
4)摇瓶发酵:将步骤3)中的二级种子培养液,以4%的接种量接入装有50mL发酵培养基的250mL锥形瓶中,28℃、200rpm培养144h。发酵培养基组成为(g/L):葡萄糖120,谷氨酸钠5,玉米浆粉5,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,FeSO4·7H2O 10,泛酸钙3.2,MnCl2·4H2O 3,ZnSO4·7H2O 3,NiSO4·6H2O2,CuSO4·5H2O 2,CoCl2·6H2O 0.04,Na2MoO4·2H2O 0.04。维生素组成(mg/L):VB19.5,VB12 0.1,pH调至6.5。每4h取样测定葡萄糖浓度,每12h取样测定生物量、油脂和DHA产量。
油脂提取及甲酯化方法:取一定量的油脂置于50mL磨口锥形瓶中,加入5mL的0.5M的KOH-CH3OH溶液于65℃水浴回流10min进行皂化;待油珠溶解冷却后,加入5mL 30%的三氟化硼乙醚反应30min;冷却后加入5mL正己烷和50μL 40g/L的二十烷酸甲酯,混匀振荡,接着加入2mL饱和氯化钠溶液防止乳化,静置分层后取上层正己烷相并加入无水硫酸钠脱水,最后使用0.22μm有机滤膜过滤后即可进行气相色谱分析。
GC检测条件:Agilent 7890A气相色谱仪,Supelco SP-2560(100m×0.25mm ID,0.20μm film)色谱柱,柱长100m,直径0.25mm;进样量1μL,进样温度260℃,分流比100:1;程序升温:初始温度140℃,维持5min;然后以3℃/min速度升温至240℃,并维持10min;载气:氦气,20cm/s;检测器温度:260℃。
经过以上色谱条件测定,菌体生物量可达58.9g/L,总油产量可达57%,DHA产量可达46.9%(发酵过程曲线如图1)。
实施例2
1)菌种活化:将保藏于-70℃的菌种裂殖壶菌(Schizochytrium sp.)LU310转接于平板培养基中,28℃培养24~48h,得活化的菌种,观察菌落形态。平板培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O0.17,琼脂15,pH调至6.5。
2)一级种子培养:将步骤1)中的平板菌落,选择形态良好的菌落,用接种环挑取接入装有50mL种子培养基的250mL平底锥形瓶中,28℃、200rpm培养24~48h;种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得一级种子培养液。
3)二级种子培养:将步骤2)中的一级种子培养液,以4%的接种量,接入装有50mL种子培养基的250mL平底锥形瓶,28℃、200rpm培养24h,用于接种摇瓶发酵。种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得二级种子培养液。
4)摇瓶发酵:将步骤3)中的二级种子培养液,以4%的接种量接入装有50mL发酵培养基的250mL锥形瓶中,28℃、200rpm培养144h。发酵过程中当残糖浓度降至1g/L时就开始流加高浓度的葡萄糖溶液,使残糖浓度维持在30g/L左右,发酵培养基组成为(g/L):葡萄糖120,谷氨酸钠5,玉米浆粉5,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,FeSO4·7H2O 10,泛酸钙3.2,MnCl2·4H2O 3,ZnSO4·7H2O 3,NiSO4·6H2O 2,CuSO4·5H2O 2,CoCl2·6H2O 0.04,Na2MoO4·2H2O 0.04。维生素组成(mg/L):VB19.5,VB12 0.1,pH调至6.5。每4h取样测定葡萄糖浓度,每12h取样测定生物量、油脂和DHA产量。
油脂提取及甲酯化方法:取一定量的油脂置于50mL磨口锥形瓶中,加入5mL的0.5M的KOH-CH3OH溶液于65℃水浴回流10min进行皂化;待油珠溶解冷却后,加入5mL 30%的三氟化硼乙醚反应30min;冷却后加入5mL正己烷和50μL 40g/L的二十烷酸甲酯,混匀振荡,接着加入2mL饱和氯化钠溶液防止乳化,静置分层后取上层正己烷相并加入无水硫酸钠脱水,最后使用0.22μm有机滤膜过滤后即可进行气相色谱分析。
GC检测条件:Agilent 7890A气相色谱仪,Supelco SP-2560(100m×0.25mm ID,0.20μm film)色谱柱,柱长100m,直径0.25mm;进样量1μL,进样温度260℃,分流比100:1;程序升温:初始温度140℃,维持5min;然后以3℃/min速度升温至240℃,并维持10min;载气:氦气,20cm/s;检测器温度:260℃。
经过以上色谱条件测定,菌体生物量可达78.6g/L,总油产量可达57.3%,DHA产量可达47.2%(发酵过程曲线如图2)。
实施例3
1)菌种活化:将保藏于-70℃的菌种裂殖壶菌(Schizochytrium sp.)LU310转接于平板培养基中,28℃培养24~48h,得活化的菌种,观察菌落形态。平板培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O0.17,琼脂15,pH调至6.5。
2)一级种子培养:将步骤1)中的平板菌落,选择形态良好的菌落,用接种环挑取接入装有50mL种子培养基的250mL平底锥形瓶中,28℃、200rpm培养24~48h;种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得一级种子培养液。
3)二级种子培养:将步骤2)中的一级种子培养液,以4%的接种量,接入装有50mL种子培养基的250mL平底锥形瓶,28℃、200rpm培养24h,用于接种摇瓶发酵。种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得二级种子培养液。
4)发酵罐培养:将步骤3)中的二级种子培养液,以4%的接种量接入装有2L发酵培养基的5L发酵罐中,在温度28℃,转速500rpm和2vvm的通气量下培养120h。通过流加2M NaOH或1M柠檬酸(CA)自动控制发酵液pH。发酵过程中当残糖浓度降至1g/L时就开始流加高浓度的葡萄糖溶液,使残糖浓度维持在30g/L左右,发酵培养基组成为(g/L):葡萄糖120,谷氨酸钠5,玉米浆粉5,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO40.65,KCl 0.5,CaCl2.2H2O 0.17,FeSO4·7H2O 10,泛酸钙3.2,MnCl2·4H2O 3,ZnSO4·7H2O3,NiSO4·6H2O 2,CuSO4·5H2O 2,CoCl2·6H2O 0.04,Na2MoO4·2H2O 0.04。维生素组成(mg/L):VB1 9.5,VB12 0.1,pH调至6.5。每4h取样测定葡萄糖浓度,每12h取样测定生物量、油脂和DHA产量。
油脂提取及甲酯化方法:取一定量的油脂置于50mL磨口锥形瓶中,加入5mL的0.5M的KOH-CH3OH溶液于65℃水浴回流10min进行皂化;待油珠溶解冷却后,加入5mL 30%的三氟化硼乙醚反应30min;冷却后加入5mL正己烷和50μL 40g/L的二十烷酸甲酯,混匀振荡,接着加入2mL饱和氯化钠溶液防止乳化,静置分层后取上层正己烷相并加入无水硫酸钠脱水,最后使用0.22μm有机滤膜过滤后即可进行气相色谱分析。
GC检测条件:Agilent 7890A气相色谱仪,Supelco SP-2560(100m×0.25mm ID,0.20μm film)色谱柱,柱长100m,直径0.25mm;进样量1μL,进样温度260℃,分流比100:1;程序升温:初始温度140℃,维持5min;然后以3℃/min速度升温至240℃,并维持10min;载气:氦气,20cm/s;检测器温度:260℃。
经过以上色谱条件测定,菌体生物量可达128.7g/L,总油产量可达59.3%,DHA产量可达49.8%(发酵过程曲线如图3)。
实施例4
1)菌种活化:将保藏于-70℃的菌种裂殖壶菌(Schizochytrium sp.)LU310转接于平板培养基中,28℃培养24~48h,得活化的菌种,观察菌落形态。平板培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O0.17,琼脂15,pH调至6.5。
2)一级种子培养:将步骤1)中的平板菌落,选择形态良好的菌落,用接种环挑取接入装有50mL种子培养基的250mL平底锥形瓶中,28℃、200rpm培养24~48h;种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得一级种子培养液。
3)二级种子培养:将步骤2)中的一级种子培养液,以4%的接种量,接入装有50mL种子培养基的250mL平底锥形瓶,28℃、200rpm培养24h,用于接种摇瓶发酵。种子培养基组成为(g/L):葡萄糖30,酵母粉10,Na2SO4 12,MgSO4 2,KH2PO4 1,(NH4)2SO4 1,K2SO4 0.65,KCl 0.5,CaCl2.2H2O 0.17,pH调至6.5,得二级种子培养液。
4)发酵罐培养:将步骤3)中的二级种子培养液,以4%的接种量接入装有400L发酵培养基的1T发酵罐中,在温度28℃、搅拌转速160rpm、罐压0.04Mpa和20m3/h的通气量下培养84h。通过流加2M NaOH或1M柠檬酸(CA)自动控制发酵液pH。发酵过程中当残糖浓度降至1g/L时就开始流加高浓度的葡萄糖溶液,使残糖浓度维持在30g/L左右,发酵培养基组成为(g/L):葡萄糖40,谷氨酸钠5,玉米浆粉5,Na2SO4 12,MgSO4 2,KH2PO41,(NH4)2SO4 1,K2SO40.65,KCl 0.5,CaCl2.2H2O 0.17,FeSO4·7H2O 10,泛酸钙3.2,MnCl2·4H2O 3,ZnSO4·7H2O 3,NiSO4·6H2O 2,CuSO4·5H2O 2,CoCl2·6H2O 0.04,Na2MoO4·2H2O 0.04。维生素组成(mg/L):VB1 9.5,VB12 0.1,pH调至6.5。每4h取样测定葡萄糖浓度,每12h取样测定生物量、油脂和DHA产量。
油脂提取及甲酯化方法:取一定量的油脂置于50mL磨口锥形瓶中,加入5mL的0.5M的KOH-CH3OH溶液于65℃水浴回流10min进行皂化;待油珠溶解冷却后,加入5mL 30%的三氟化硼乙醚反应30min;冷却后加入5mL正己烷和50μL 40g/L的二十烷酸甲酯,混匀振荡,接着加入2mL饱和氯化钠溶液防止乳化,静置分层后取上层正己烷相并加入无水硫酸钠脱水,最后使用0.22μm有机滤膜过滤后即可进行气相色谱分析。
GC检测条件:Agilent 7890A气相色谱仪,Supelco SP-2560(100m×0.25mm ID,0.20μm film)色谱柱,柱长100m,直径0.25mm;进样量1μL,进样温度260℃,分流比100:1;程序升温:初始温度140℃,维持5min;然后以3℃/min速度升温至240℃,并维持10min;载气:氦气,20cm/s;检测器温度:260℃。
经过以上色谱条件测定,菌体生物量可达104.4g/L,总油产量可达56%,DHA产量可达57.1%(发酵过程曲线如图4)。
- 还没有人留言评论。精彩留言会获得点赞!