一种具有胞外组蛋白毒性抑制作用的多肽制备方法及用途与流程
本发明属于生物技术领域,具体地说,本发明描述了具有胞外组蛋白毒性抑制作用的多肽A--人源性白蛋白多肽,以及该多肽的氨基酸序列。本发明还涉及此多肽的制备方法和应用。
背景技术:
组蛋白是真核生物细胞中染色质的结构蛋白,包括H1、H2A、H2B、H3和H4。其中H2A、H2B、H3、H4作为核心组蛋白与DNA结合形成核小体,H1则结合在核小体之间的DNA上。组蛋白一旦由胞内异位至胞外则成为胞外组蛋白。组蛋白作为一种普遍存在的核蛋白可以在多种病理情况下通过主动和被动运输方式被释放到胞外。胞外组蛋白主要来自如下两方面:一是由死亡的实质组织细胞释放。此时,染色质降解,细胞膜破裂、细胞溶解,大量核内组蛋白释至胞外;二是由白细胞、特别是中性粒细胞释放。在急性期反应中性粒细胞大量急剧增加而形成中性粒细胞胞外诱捕网(NETs)时,组蛋白随DNA和高迁移率族蛋白B(HMGB1)等一起释放至细胞外。对组蛋白的研究涉及多种临床疾病,包括癌症、炎症性疾病、缺血性发作、自身免疫性疾病等,主要用于疾病的诊断分期、预后及监测判断疗效等方面。早在1958年James的研究中就指出组蛋白的毒性作用。越来越多的研究表明胞外组蛋白对机体的不利主要在于诱导组织细胞尤其是血管内皮细胞损伤、激活白细胞和血小板、促进异常凝血过程与血栓形成、直接或间接造成炎症反应与免疫反应,导致弥散性血管内凝血、急性呼吸窘迫综合征甚至多器官功能障碍综合征。因此,以组蛋白为靶点进行干预对于胞外组蛋白相关疾病的预防与治疗具有重要的临床应用价值。
白蛋白是肝实质细胞合成的血浆中含量最多的蛋白质,占总蛋白的40~60%。本发明建立在白蛋白可抑制胞外组蛋白诱导的血管内皮细胞死亡的发现之上。此外,本发明根据该白蛋白序列信息,鉴定并化学合成一条多肽,即多肽A,研究了其对胞外组蛋白毒性的抑制作用,提出了利用多肽A进行人类组蛋白相关疾病例如败血症诊治的药用价值及临床应用价值。
技术实现要素:
本发明的第一个目的在于公开一种可抑制胞外组蛋白细胞毒性的人类血清白蛋白来源的多肽A。
所述的多肽A,其氨基酸序列如SEQ ID NO.1所示,具体为:Lys-Phe-Gln-Asn-Ala-Leu-Leu-Val-Arg-Tyr。
本发明的第二个目的在于提供一种所述人源性多肽A的制备方法。
它包括如下步骤:(1)多肽合成顺序是从C端到N端。将2-Chlorotrityl Chloride Resin放入反应管中,加15 ml/g(毫升/克)DCM(二氯甲烷),震荡30分钟。
(2)接第一个氨基酸。通过沙芯抽滤掉溶剂,加入3倍摩尔过量的Fmoc-Thr(tBu)-OH氨基酸,加入DMF(二甲基甲酰胺)溶解,再加入10倍摩尔过量的DIEA(N,N-二异丙基乙胺),震荡60分钟。用甲醇封闭。
(3)脱保护。去掉DMF,加15 ml/g 20%哌啶DMF溶液,洗涤5分钟后,去掉,再在15 ml/g 20%哌啶DMF溶液,洗涤15分钟。
(4)检测。抽调哌啶溶液,取十几粒树脂,用乙醇洗涤三次,加入检测试剂检测。105ºC-110ºC加热5分钟,颜色变为深蓝色即为阳性反应。
(5)冲洗树脂。分别依次用DMF(10 ml/g),DCM(10 ml/g),DMF(10 ml/g)冲洗树脂两次。
(6)缩合。保护氨基酸三倍过量,HBTU(苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸酯)三倍过量,均用少量DMF溶解,加入反应管,立刻加入DIEA十倍过量,反应30分钟。
(7)检测。取十几粒树脂,用乙醇洗涤三次,加入检测试剂检测,105ºC-110ºC加热5分钟,无色即为阴性反应。
(8)冲洗树脂。分别依次用DMF(10 ml/g),DCM(10 ml/g),DMF(10 ml/g)冲洗树脂两次。
(9)重复(3)至(6)操作,从右到左依次连接序列中的氨基酸。
(10)抽干,并按照下列方法洗树脂:DMF(10 ml/g)两次,甲醇(10 ml/g)两次,DMF(10 ml/g)两次,DCM(10 ml/g)两次,抽干10分钟。
(11)从树脂上切割多肽。所用切割液成分为:95% TFA(三氟乙酸),1%水,2% EDT(巯基乙醇),2%TIS(三异丙基硅烷);切割时间为:120分钟。
(12)吹干洗涤。将裂解液用氮气吹干,乙醚洗涤六次,然后放置常温挥发。
(13)分析提纯冻干。用高效液相色谱提纯多肽粗品;收集多肽溶液放入冻干机中进行浓缩,并冻干制成白色粉末。
本发明的第三个目的在于提供所述人源性多肽A在胞外组蛋白毒性抑制中的应用。多肽A可以直接抑制胞外组蛋白诱导的HUVEC细胞死亡及HUVEC细胞膜损伤,因而可用于研制多肽相关药物,从而防治胞外组蛋白相关的炎症、缺血、免疫、肿瘤等疾病(如脓毒症、败血症等)。另外,由于多肽A是人体血清白蛋白的小分子片段,没有一般化学药物的毒副作用,却具有化学药物不可取代的生物相容性和血液相容性。多肽A可以有效抑制HUVEC细胞中炎症通路的激活,从而发挥其对胞外组蛋白毒性的抑制作用,提高胞外组蛋白相关疾病的长期疗效与安全性。因此,多肽A具有较大的药用价值和广泛的应用前景。
附图说明
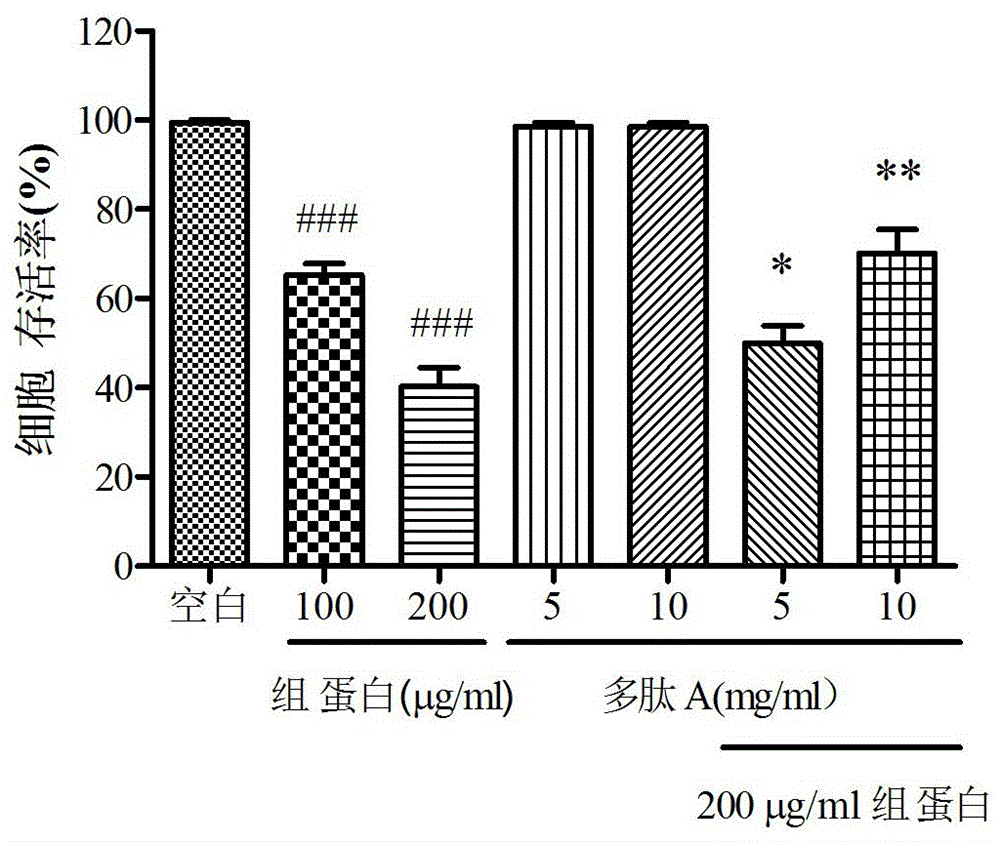
图1是本发明检测细胞存活率的结果图。###表示与空白组相比,p<0.001,有显著性差异;*表示与200 μg/ml组蛋白处理组相比,p<0.05,有显著性差异;**表示与200 μg/ml组蛋白处理组相比,p<0.01,有显著性差异。
图2是本发明扫描电镜下观察细胞膜损伤的结果图。
图3是本发明的Western Blot方法检测IκB、p38、及磷酸化p38(p-p38)的蛋白表达水平。
图4是本发明的ELISA方法检测炎症因子TNFα、IL-6的表达水平。##表示与空白组相比,p<0.01,有显著性差异;###表示与空白组相比,p<0.001,有显著性差异;*表示与200 μg/ml组蛋白处理组相比,p<0.05,有显著性差异;**表示与200 μg/ml组蛋白处理组相比,p<0.01,有显著性差异。
序列表为多肽A序列。
具体实施方式
以下结合附图和具体实施例对本发明作进一步的详细描述。
实施例1:多肽A的固相合成。
1.多肽合成顺序是从C端到N端。将2-Chlorotrityl Chloride Resin放入反应管中,加15 ml/g(毫升/克)DCM(二氯甲烷),震荡30分钟。
2.接第一个氨基酸。通过沙芯抽滤掉溶剂,加入3倍摩尔过量的Fmoc-Thr(tBu)-OH氨基酸,加入DMF(二甲基甲酰胺)溶解,再加入10倍摩尔过量的DIEA(N,N-二异丙基乙胺),震荡60分钟。用甲醇封闭。
3.脱保护。去掉DMF,加15 ml/g 20%哌啶DMF溶液,洗涤5分钟后,去掉,再在15 ml/g 20%哌啶DMF溶液,洗涤15分钟。
4.检测。抽调哌啶溶液,取十几粒树脂,用乙醇洗涤三次,加入检测试剂检测。105ºC-110ºC加热5分钟,颜色变为深蓝色即为阳性反应。
5.冲洗树脂。分别依次使用DMF(10 ml/g)两次,DCM(10 ml/g)两次,DMF(10 ml/g)冲洗树脂两次。
6.缩合。保护氨基酸三倍过量,HBTU(苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸酯)三倍过量,均用少量DMF溶解,加入反应管,立刻加入DIEA十倍过量,反应30分钟。
7.检测。取十几粒树脂,用乙醇洗涤三次,加入检测试剂检测,105ºC-110ºC加热5分钟,无色即为阴性反应。
8.冲洗树脂。分别依次使用DMF(10 ml/g),DCM(10 ml/g),DMF(10 ml/g)冲洗树脂两次。
9.重复(3)至(6)操作,从右到左依次连接序列中的氨基酸。
10.抽干,并按照下列方法洗树脂:DMF(10 ml/g)两次,甲醇(10 ml/g)两次,DMF(10 ml/g)两次,DCM(10 ml/g)。两次,抽干10分钟。
11.从树脂上切割多肽。所用切割液成分为:95% TFA(三氟乙酸),1%水,2% EDT(巯基乙醇),2%TIS(三异丙基硅烷);切割时间为:120分钟。
12.吹干洗涤。将裂解液用氮气吹干,乙醚洗涤六次,然后放置常温挥发。
13.分析提纯冻干。用高效液相色谱提纯多肽粗品;收集多肽溶液放入冻干机中进行浓缩,并冻干制成白色粉末。
实施例2:多肽A抑制胞外组蛋白对HUVEC细胞的细胞毒性作用。
1.原代人内皮细胞HUVECs购自ATCC,培养于LSGS-M200培养基。实验组为接受5 mg/ml或10 mg/ml多肽A及200 μg/ml小牛胸腺组蛋白处理的HUVECs细胞;对照组为分别接受5 mg/ml或10 mg/ml多肽A、100 μg/ml或200 μg/ml小牛胸腺组蛋白处理的HUVECs细胞,接受1小时处理后,通过统计细胞存活率,发现组蛋白处理导致HUVECs细胞存活率显著下降,并呈现浓度依赖性效应,而接受多肽A处理后能抑制胞外组蛋白导致的细胞存活率下降现象。
2.原代人内皮细胞HUVECs购自ATCC,培养于LSGS-M200培养基。实验组为接受10 mg/ml多肽A和200 μg/ml小牛胸腺组蛋白处理的HUVECs细胞;对照组为分别接受200 μg/ml小牛胸腺组蛋白或200 μg/ml小牛胸腺组蛋白联合20 mg/ml白蛋白处理的HUVECs细胞,接受1小时处理后,经扫描电镜的观察发现,组蛋白处理导致HUVECs细胞膜的严重损伤,而接受白蛋白或白蛋白来源的多肽A处理后均能抑制组蛋白导致的细胞膜损伤现象。
以上数据(见图1,图2)显示了多肽A作为组蛋白毒性抑制剂的潜力。
3.针对步骤1中各组HUVECs细胞,进一步提取总蛋白,并进行Western Blot验证外源给予多肽A对胞外组蛋白诱导的炎症反应的影响。实验结果表明,胞外组蛋白可导致IκB的表达量下降,p38磷酸化水平升高,而外源给予多肽A可显著降低胞外组蛋白诱导的NF-κB/p38炎症信号通路的激活(图3);胞外组蛋白可诱导下游炎症因子TNF-α和IL-6的表达,而外源给予多肽A可显著抑制胞外组蛋白的这种作用(图4)。
4.针对步骤1中各组HUVECs细胞血清培养基,进行ELISA检测进一步验证步骤3中的外源给予多肽A对组蛋白诱导的炎症因子TNF-α和IL-6释放的影响。实验结果表明,胞外组蛋白可诱导炎症因子TNF-α和IL-6的释放,而外源给予多肽A可显著抑制胞外组蛋白的这种作用。
综合以上结果说明,外源性给予合成的多肽A可明显抑制胞外蛋白对HUVEC细胞的细胞毒性作用,包括组蛋白诱导细胞损伤及炎症反应,用于临床治疗胞外组蛋白相关疾病具有良好的临床应用前景。
[0001]
<110> 上海懿贝瑞生物医药科技有限公司
<120> 一种具有胞外组蛋白毒性抑制作用的多肽制备方法及用途
<130> 2016
<160> 1
<210> 1
<211> 10
<212> PRT
<213> 人工序列
<400> 1
Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!
- 一种高效刺激活化t细胞的方法
- 一种基于细胞表型的高内涵多指标肾毒性的检测方法及其应用
- 管花肉苁蓉苯乙醇苷在制备抗黑色素瘤药物中的应用
- 一种提升安全性、用于表达密码子优化的Anti-MART-1 TCR基因的慢病毒载体的制备及其应用
- 表达α1,3半乳糖转移酶的癌细胞/树突状细胞融合肿瘤疫苗及其制备方法
- 异源融合基因修饰的癌细胞/树突状细胞融合肿瘤疫苗及其制备方法
- 用于癌症治疗的免疫刺激性hiv tat衍生多肽的制作方法
- 用于癌症治疗的免疫刺激性hiv tat衍生多肽的制作方法
- 用于治疗hbv感染和相关病症的结合免疫效应细胞表面抗原和hbv抗原的双或多特异性多肽的制作方法
- 一种经腺病毒基因修饰的肿瘤特异性细胞毒性t淋巴细胞的培养方法