一种小分子多肽、及其编码基因和应用的制作方法
本发明涉及生物医药技术领域,具体涉及一种小分子多肽及其编码基因,以及该小分子多肽在制备治疗慢性炎症疾病(抑制肠上皮细胞异常凋亡)药物中的应用。
背景技术:
克罗恩(Crohn’s diseases CD)是一种胃肠道慢性炎性肉芽肿性疾病。近年来,CD发病率逐年增加,且有终生复发倾向,重症患者迁延不愈,预后不良,严重影响患者的生活质量。长久以来克罗恩病的治疗是临床上的难点之一,本病尚无特殊治疗方法。无并发症时,支持疗法和对症治疗十分重要,可缓解有关症状。常用药物有水杨酸类和肾上腺皮质激素,其中柳氮磺胺吡啶和5-氨基水杨酸(5-ASA)适用于慢性期和轻、中度活动期病人,肾上腺皮质激素常用于中、重症或暴发型患者,许多病人出现并发症,需手术治疗,手术治疗用于完全性肠梗阻、肠瘘与脓肿形成、急性穿孔或不能控制的大出血,以及难以排除癌肿的患者。以上治疗方法中药物治疗用于抑制炎症活动,控制炎症缓解症状,改善全身状况,但是近年来大量临床观察发现5-ASA药物对缓解期维持疗效不肯定,抗生素因长期使用出现胃肠道副作用,糖皮质激素可以使患者免疫功能下降,对人体造成一系列毒副作用。而手术治疗的术后复发率很高。因此寻找新的克罗恩病的治疗手段十分重要。
基于CD的发生发展及治疗预后的机制研究中,普遍认为在遗传易感的基础上,各种内外源性诱因的作用下肠道免疫系统发生异常,导致肠道的屏障结构破坏,最终导致疾病的发生。完整的肠黏膜上皮细胞组成重要的肠道屏障抵御外界毒素和抗原物质入侵,选择性允许营养物质、电解质和水的吸收,维持机体内环境稳态,所以肠上皮细胞异常凋亡是肠黏膜机械屏障破坏的主要发生机制。因此控制肠上皮细胞异常凋亡成为减轻炎症诱导上皮屏障破坏的关键环节。
在炎症诱导肠道上皮细胞异常凋亡的同时,肠上皮细胞炎症环境下由细胞因子激活产生细胞因子信号通道抑制剂-1(SOCS1)表达增高,非磷酸化SOCS1抑制JAK1/STAT1信号通道,从而抑制下游靶caspase3,9的表达是抑制细胞凋亡修复肠道上皮抑制疾病进展的关键。但在CD发展过程中SOCS1被磷酸化,磷酸化的SOCS1失去抑制JAK1/STAT1信号通道作用,同时抑制凋亡能力受损,肠上皮细胞持续凋亡。近期研究表明,在炎症环境中还会发生严重的氧化应激反应,氧化应激诱导产生Fyn,CD发展过程中FYN表达增高,与肠上皮细胞凋亡密切相关,FYN属蛋白酪氨酸激酶家族(SRC家族),通过调节多种细胞信号通道参与调节细胞凋亡等过程,主要通过磷酸化下游靶基因发挥作用。
关于细胞因子信号通道抑制剂-1(SOCS1)由IL-1beta诱导抑制软骨代谢方面的相关报道,可参考文献(1、Arthritis Res Ther.2013;15(6):R191.Cytokine signaling-1suppressor is inducible by IL-1beta and inhibits the catabolic effects of IL-1beta in chondrocytes:its implication in the paradoxical joint-protective role of IL-1beta.;2、Choi YS,Park JK,Kang EH,Lee YK,Kim TK,Chung JH,Zimmerer JM,Carson WE,Song YW,Lee YJ.)。
技术实现要素:
本发明的目的在于提供一种小分子多肽及其编码基因,以及该小分子多肽在制备治疗慢性炎症疾病药物中的应用。
本发明基于非受体酪氨酸激酶(Fyn)与细胞因子信号通道抑制剂-1(SOCS1)的相互作用结构域的确立,构建出了多肽(SS2),并通过细胞生物学实验证明本发明的小分子多肽(SS2)具有抑制肠上皮细胞异常凋亡的作用。
本发明的目的主要通过以下技术方案实现:
本发明的第一目的在于提供一种小分子多肽,具有如SEQ ID No:1所示的氨基酸序列。
本发明的第二目的在于提供编码上述小分子多肽的基因,具有如SEQ ID No.2所示的核苷酸序列。
本发明的第三目的在于提供小分子多肽在制备治疗慢性炎症疾病药物中的应用。
进一步的,所述的慢性炎症疾病为克罗恩病、骨关节炎、肺炎、肝炎等。
进一步的,所述的慢性炎症疾病是指肠上皮细胞在炎症环境下,由细胞因子激活产生的SOCS1被氧化应激诱导产生Fyn磷酸化,使SOCS1失去抑制细胞凋亡能力的疾病。
进一步的,本发明还提供该小分子多肽及其编码基因在制备抑制肠上皮细胞异常凋亡药物中的应用。
本发明的再一目的在于提供一种药物组合物,其包含上述小分子多肽以及药学上可接受的载体。
进一步的,所述药学上可接受的载体为药学上可接受的赋形剂,悬浮剂,填充剂和/或稀释剂。
本发明是基于CD发展中肠上皮细胞凋亡机制和治疗难点,通过抗凋亡基因治疗途径发明一段重组多肽,证明其具有抗凋亡的应用价值,并提供一段抗凋亡肽的特异的氨基酸序列和核苷酸序列。
本发明的小分子多肽抑制肠上皮细胞异常凋亡的具体机理是:在肠上皮细胞炎症环境下由细胞因子激活产生的SOCS1本身具有抑制细胞因子信号通道的作用从而抑制JAK1/STAT1信号通道,抑制下游靶基因Caspase-3等分子表达从而抑制细胞凋亡,但是在炎症环境中还会发生严重的氧化应激反应,氧化应激诱导产生Fyn,分子Fyn磷酸化SOCS使其失去抑制细胞凋亡能力,研究发现Fyn与SOCS1发生作用的主要区域即为SS2区域,SS2过表达的细胞或组织内,SS2可以和Fyn发生竞争性的结合,抑制SOCS1与Fyn的结合,抑制SOCS1的磷酸化,恢复和维持SOCS1的抑制炎症反应和细胞凋亡的作用。
本发明利用生物工程技术,基因重组一段71个氨基酸(amino acid)多肽对应的DNA序列到GFP真核表达载体。经酶切和序列分析证明重组成功后,将此真核表达重组多肽转染到肠上皮细胞,免疫印迹证明多肽的蛋白表达,实现了多肽的重组。接着对多肽的抗凋亡功能进行了研究,细胞学和小鼠体内实验表明此多肽具有抑制肠上皮细胞凋亡和缓解小鼠克罗恩病的发生发展的功能。
本发明发现CD发生部位FYN表达增高并且与SOCS1存在相互作用,分子Fyn磷酸化SOCS使其失去抑制细胞凋亡能力,研究发现Fyn与SOCS1发生作用的主要区域即为SS2区域,SS2抑制肠上皮细胞异常凋亡的具体机理是:SS2过表达的细胞或组织内,SS2可以和Fyn发生竞争性的结合,抑制SOCS1与Fyn的结合,抑制SOCS1的磷酸化,恢复和维持SOCS1的抑制炎症反应和细胞凋亡的作用。该多肽的设计为CD等慢性炎症疾病发生过程中缓解抑制炎症因子介导的肠上皮细胞凋亡提供新的药物设计和治疗靶点。
附图说明
图1为疾病活动指数(DAI)的检测;
图2为大体观察及评分;
图3为组织学评分;
图4为Western Blot检测SOCS1和FYN表达;其中,A为组织中两分子相互作用,B为细胞中两分子相互组作用;
图5为Western Blot检测SOCS1的SS2结构域和FYN之间的相互作用;
图6为小分子多肽在细胞模型中的流式细胞术检测HT-29及凋亡情况;其中,a表示没有处理的细胞;b表示单独使用H2O2处理的细胞;c表示H2O2+SOCS1S1处理的细胞;d表示H2O2+SS2处理的细胞;e表示H2O2+SOCS1S3;f表示统计学;
图7为小分子多肽在细胞模型中的FACS检测细胞周期;其中,其中,a表示没有处理的细胞;b表示单独使用H2O2处理的细胞;c表示H2O2+SOCS1S1处理的细胞;d表示H2O2+SS2处理的细胞;e表示H2O2+SOCS1S3;f表示统计学;
图8为小分子多肽在细胞模型中的CCK8试剂盒检测HT-29细胞活性,*表示P小于0.05,与对照组比较;
图9为小分子多肽和SOCS1分子全长采用流式细胞术检测HT-29及凋亡情况;
图10为小分子多肽在其他凋亡相关慢性炎症疾病中对细胞凋亡的作用。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1:小分子多肽的制备
小分子多肽的氨基酸序列如SEQ ID NO.1所示,小分子多肽合成在ABI 431A型固相多肽合成仪(美国PE公司)上进行。方法采用标准芴甲氧羰基(Fmoc)方案,精氨酸采用两次偶联。起始选用0.125mmol对羟甲基苯氧甲基聚苯乙烯树脂(HMP树脂),按照多肽序列使肽链从羧基端逐个向氨基端延伸,每种氨基酸的用量为0.5mmol,与树脂的摩尔比为4∶1.各种氨基酸的α-氨基酸为Fmoc保护,其余侧链保护基团为:Ser(tBu)、Glu(OtBu)、Arg(Pmc)。第一个氨基酸连接到树脂上用4-二甲基吡啶,氨基酸活化用1-羟基苯并三唑和二环乙基碳,偶联后用体积分数为20%的
哌啶水溶液去除Fmoc保护基。多肽粗品合成后,将树脂-粗肽在冰冷浴条件下混合于10ml切割液A(由结晶苯酚0.75g、1,2-乙二硫醇0.25ml、苯甲硫醚0.5ml、去离子水0.25ml和三氟乙酸10ml组成)中,待切割液温度上升至室温后,搅拌2小时,使肽链从树脂上裂解下来,同时去除多种保护基团,将反应混合液经G4玻砂漏斗过滤后以除去树脂,先后用1ml三氟乙酸,10ml二氯甲烷反复冲洗反应瓶,树脂和漏斗。将滤液在常温低压下蒸发至1-2ml,加入50ml预冷乙醚蒸发小分子多肽粗品,-20°保存备用。
将小分子多肽粗品用二甲基亚砜溶解成浓度为20mg/ml的溶液,经孔径为0.45um的绿孔滤膜过滤后,在AKTA explorer 100型中压液相色谱仪(瑞典amerssam bioscience)上用SOURCE凝胶柱上纯化。流动相A有体积百分比为10%的乙醇和体积百分含量为0.1%三氟乙酸组成,流动相B由体积百分含量为90%的乙醇和体积百分含量为0.1%三氟乙酸组成。先用流动相A 1.5个柱体积洗脱,再用流动相A和流动相B的混合液。(流动相B占混合液的体积分数在8个柱体积内由0%逐渐增加至80%)洗脱,再用流动相A和流动相B的混合液(流动相B占混合液的体积分数在0.5个柱体积内由0%逐渐增加至80%)洗脱,在主峰处收集多肽溶液,冷却干燥,即得小分子多肽纯品,用二甲基亚砜溶解,-20°保存备用。
将小分子多肽纯品用Delta 600型高压液相色谱仪(美国waters公司)鉴定纯度,采用symmetry shield C18柱,流动相由体积百分含量为10%到60%的乙和体积百分含量为0.1%的三氟乙酸组成,梯度洗脱,流速为1ml/min。结果显示,合成多肽的纯度达到90%以上。同时,将小分子多肽纯品用API2000LC/MS型电喷雾离子化质谱仪测定分子量。结果显示,合成的小分子多肽的分子量与理论值相符。
实施例2小分子多肽在治疗小鼠克罗恩病中的应用
1、动物:
雌性BalB/C小鼠,体重13-14克,购于南通大学动物实验室,正常饲养于清洁动物房。2、药物:
小分子多肽治疗组:给予如SEQ ID NO:1所示的小分子多肽20nmol/kg体重进行腹腔注射,共计6只;
空白组:给予与治疗组等体积的PBS进行腹腔注射,共计6只。
3、实验方法:
结肠灌注TNBS是克罗恩病常用动物建模方法,本实验用于验证多肽小分子对克罗恩病的治疗作用。结肠灌注TNBS方法,具体为:
1)成年健康的13-14g BALB/C雌鼠,禁食24小时,腹腔注射全身麻醉;
2)给予上述小鼠进行戊巴比妥钠腹腔麻醉;
3)将TNBS于无水乙醇1:2混合,取0.10ml用导管插入肛门内4cm注入,在导入药液的时候采取头低尾高的体位,防止灌注液体外溢;
4)轻轻去除导管,将小鼠倒提60s,使药液达到全结肠;
5)造模后小鼠平躺,自然清醒,常规饲养。
手术后立即经腹腔分别给空白组小鼠注射PBS,小分子多肽组小鼠注射小分子多肽,随后每24小时注射一次,共注射7次。
疾病活动指数(DAI)的检测:
每天观察小鼠的粪便性状、进食情况和精神状态,并记录体重、粪便性状和便血情况。进行小鼠DAI(疾病活动指数)评分。克罗恩小鼠DA1评分标准如表1所示:
表1小鼠TNBS结肠炎DAI评分标准
【DAI=(体重下降分数+大便性状分数+便血分数)/3】
克罗恩小鼠DA1评分结果如图1所示,可见经SEQ ID NO:1所示的小分子多肽治疗的克罗恩小鼠DA1评分明显低于PBS对照治疗的克罗恩小鼠,表明如SEQ IDNO:1所示的小分子多肽均能显著改善克罗恩小鼠的粪便性状、进食情况和精神状态,具有治疗保护作用(*表示P小于0.05,与空白组比较)。
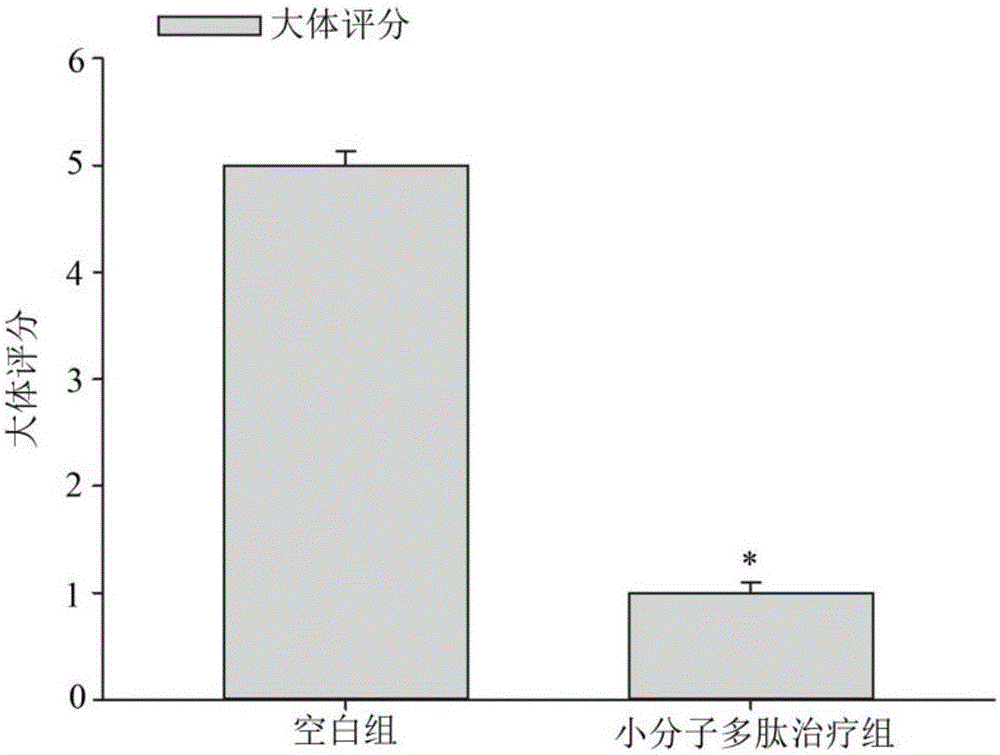
大体观察及评分:
小鼠处死后,75%酒精浸泡,固定于鼠板之上。沿腹中线逐层剪开皮肤、皮下组织、腹膜,钝性分离肠系膜及脂肪组织,自回盲部剪断。测量小鼠自回盲部至直肠的结肠长度,与对照小鼠比较。沿肠壁长轴纵向剪开结肠、直肠,在高压灭菌PBS液中充分洗涤,肉眼观察肠粘膜有无损伤、充血水肿及溃疡,对结肠进行大体评分。克罗恩小鼠大体评分标准如表2所示:
表2小鼠TNBS结肠炎大体评分标准
克罗恩小鼠大体评分结果如图2所示,可见经SEQ ID NO:1所示的小分子多肽治疗的克罗恩小鼠大体评分明显低于PBS对照治疗的克罗恩小鼠,表明如SEQ IDNO:1所示的小分子多肽均能显著改善克罗恩肠粘膜有损伤、充血水肿及溃疡,具有治疗保护作用(*表示P小于0.05,与空白组比较)。
组织学评分:
为了考察损伤肠道粘膜组织损伤情况,取结肠组织中病变最明显的部位,进行病理切片制作,HE染色,观察结肠白细胞浸润程度、杯状细胞形态、血管密度及肠壁厚度,进行组织学评分。克罗恩小鼠大体评分标准如表3所示:
表3小鼠TNBS结肠炎组织学评分标准
克罗恩小鼠组织学评分结果如图3所示,可见经SEQ ID NO:1所示的小分子多肽治疗的克罗恩小鼠组织学评分明显低于PBS对照治疗克罗恩小鼠,表明如SEQ IDNO:1所示的小分子多肽均能显著改善克罗恩炎性细胞浸润,具有治疗保护作用(*表示P小于0.05,与对照组比较)。
实施例3 SOCS1和FYN的相互作用
1、细胞:HT-29细胞,购买于上海奥陆生物公司,所用培养基为1640完培。使用时用加入终浓度为10%的胎牛血清,并且每毫升加入100单位青霉素和100ug链霉素。于37℃、5%CO2、湿润空气的细胞培养箱中进行培养。培养基每两天更换一次,每4-5天进行传代。传代时用EDTA消化液(PBS/EDTA:2g乙二胺四乙酸二钠(EDTA-Na2)加至1000mlPBS中,NaOH调节pH值至7.8,直至EDTA-Na2完全溶解,高压灭菌后4℃保存)消化细胞至大部分贴壁细胞脱落后终止消化,吹打离心后取适量细胞传入新的培养瓶。
2.材料方法:
1)H2O2刺激HT-29细胞,用EDTA/PBS缓冲液消化收集至少1×107细胞,PBS洗涤2次,加入1ml预冷RIPA裂解液,充分混匀,在冰上静置裂解10分钟。
2)轮转仪中4℃轮转2小时。
3)再次将细胞裂解混合液在冰上静置5分钟,4℃离心机中12000rpm离心10分钟,取上清蛋白液用于后续实验,BCA法检测蛋白浓度,取30μg做为input备用。
4)取300μg蛋白样品,加入SOCS1单克隆抗体(rabbit;1:50,Santa Cruz,USA),于旋转器上缓慢旋转混匀,4℃冰箱中过夜。
5)第二天蛋白抗体混合液中加入30μL磁珠,4℃旋转器上混匀孵育3小时。
6)随后在磁珠分离仪上用PBS小心洗涤磁珠3次,用RIPA裂解液重悬磁珠,并加入LDS上样缓冲液,于70℃加热10分钟。
7)上清蛋白用10%Bis-Tris胶分离,Western Blot检测SOCS1和FYN表达。用同样方法在4步骤中加入FYN单克隆抗体(mouse;1:50,Santa Cruz,USA),最后Western Blot检测SOCS1和FYN的表达。
3.结果如图4所示SOCS1和FYN存在明显的相互作用。
实施例4 SOCS1和FYN相互作用的结构域
1、细胞:293T细胞,购买于中国科学院细胞库,所用培养基为DMEM完培。使用时用加入终浓度为10%的胎牛血清,并且每毫升加入100单位青霉素和100ug链霉素。于37℃、5%CO2、湿润空气的细胞培养箱中进行培养。培养基每两天更换一次,每4-5天进行传代。传代时用PBS吹打离心后取适量细胞传入新的培养瓶。
2.材料方法:
1)HA-FYN分别和GFP-SOCS1、GFP-SOCS1S1、GFP-SS2、GFP-SOCS1S3共转染293T细胞24h;EDTA/PBS缓冲液消化收集293T细胞,至少1×107细胞,PBS洗涤2次,加入1ml预冷RIPA裂解液,充分混匀,在冰上静置裂解10分钟。其中,SOCS1S1、SS2、SOCS1S3分别是SOCS1的不同截短多肽,SOCS1具有如SEQ ID No:3所示的氨基酸序列,SOCS1S1具有如SEQ ID No:4所示的氨基酸序列,SS2具有如SEQ ID No:1所示的氨基酸序列,SOCS1S3具有如SEQ ID No:5所示的氨基酸序列。
2)轮转仪中4℃轮转2小时。
3)再次将细胞裂解混合液在冰上静置5分钟,4℃离心机中12000rpm离心10分钟,取上清蛋白液用于后续实验,BCA法检测蛋白浓度,取30μg做为input备用。
4)取300μg蛋白样品,加入GFP单克隆抗体(rabbit;1:50,Santa Cruz,USA),于旋转器上缓慢旋转混匀,4℃冰箱中过夜。
5)第二天蛋白抗体混合液中加入30μL磁珠,4℃旋转器上混匀孵育3小时。
6)随后在磁珠分离仪上用PBS小心洗涤磁珠3次,用RIPA裂解液重悬磁珠,并加入LDS上样缓冲液,于70℃加热10分钟。
7)上清蛋白用10%Bis-Tris胶分离,Western Blot检测HA。
3.结果如图5所示SOCS1的SS2结构域和FYN存在明显的相互作用。
实施例5小分子多肽在细胞模型中的功能试验
1.细胞:HT-29细胞,购买于上海奥陆生物公司,所用培养基为1640完培。使用时用加入终浓度为10%的胎牛血清,并且每毫升加入100单位青霉素和100ug链霉素。于37℃、5%CO2、湿润空气的细胞培养箱中进行培养。培养基每两天更换一次,每4-5天进行传代。传代时用EDTA消化液(PBS/EDTA:2g乙二胺四乙酸二钠(EDTA-Na2)加至1000mlPBS中,NaOH调节p H值至7.8,直至EDTA-Na2完全溶解,高压灭菌后4℃保存)消化细胞至大部分贴壁细胞脱落后终止消化,吹打离心后取适量细胞传入新的培养瓶
2.材料方法:H2O2刺激HT-29细胞是克罗恩病常用细胞建模方法,本实验用于验证多肽小分子对克罗恩病的治疗作用。采用H2O2进行刺激,同时使用GFP-SS2、GFP-SOCS1S1、GFP-SOCS1S3转染刺激细胞72h。以H2O2刺激同时GFP-SS2转染为实验组,H2O2刺激同时无转染、H2O2刺激同时GFP-SOCS1S1、GFP-SOCS1S3转染为对照组,control是指未处理细胞作为空白组。
①流式细胞术检测HT-29及凋亡情况。胰酶消化转染刺激后HT-29细胞,3min后加入完培终止消化。PBS洗涤细胞后将单细胞悬浮液放于3mmol/L Newport Green以及0.2nmol/L Tetramethylrhodamine ethyl ester(TMRE)37℃条件下孵育45min,洗涤之后加入1g/L PI 4℃孵育15min。将细胞悬浮液用流式细胞仪(Beckerman FC500)分析。
结果如图6所示,与对照组、空白组相比,实验组SS2转染抑制细胞凋亡。
②FACS检测细胞周期,细胞转染72h后收集细胞,以75%乙醇固定,-20℃保存24h后,以1000r·min-1离心5min,弃上清,加入3ml PBS,弹松细胞,静置15min,离心后弃上清。加入500μl×binding buffer重悬细胞。细胞悬液中加入5μl AnnexinⅤ-FITC试剂,混匀后4℃避光孵育15min,加入10μl PI,轻轻混匀,4℃避光孵育5min,1h内送检。
结果如图7所示,与对照组、空白组相比,实验组SS2转染抑制细胞凋亡。
③CCK8试剂盒检测HT-29细胞活性接种于96孔板的转染刺激后的HT-29细胞,加入CCK8试剂10l/孔(每组均设置6个复孔),置于CO2细胞培养箱37℃、5%CO2条件下孵4h后,在酶联免疫检测仪上测450nm的吸光度(A)值;计算细胞相对活力:细胞相对活力=(实验组(A)平均值/对照组(A)平均值)
结果如图8所示(*p<0.05,与对照组比较),与对照组、空白组相比,SS2转染抑制细胞凋亡。
3.综上,SS2序列高表达抑制H2O2刺激下的细胞凋亡,而SOCS1的其他截短序列S1、S3则没有这一作用。
实施例6小分子多肽和SOCS1分子全长在细胞中发挥功能的比较
1.细胞:HT-29细胞,购买于上海奥陆生物公司,所用培养基为1640完培。使用时用加入终浓度为10%的胎牛血清,并且每毫升加入100单位青霉素和100ug链霉素。于37℃、5%CO2、湿润空气的细胞培养箱中进行培养。培养基每两天更换一次,每4-5天进行传代。传代时用EDTA消化液(PBS/EDTA:2g乙二胺四乙酸二钠(EDTA-Na2)加至1000mlPBS中,Na OH调节p H值至7.8,直至EDTA-Na2完全溶解,高压灭菌后4℃保存)消化细胞至大部分贴壁细胞脱落后终止消化,吹打离心后取适量细胞传入新的培养瓶。
2.材料方法:本实验用于比较多肽小分子与SOCS1对克罗恩病的治疗作用。采用H2O2进行刺激,同时使用GFP-SS2、GFP-SOCS1转染刺激细胞72h。流式细胞术检测HT-29及凋亡情况。胰酶消化转染刺激后HT-29细胞,3min后加入完培终止消化。PBS洗涤细胞后将单细胞悬浮液放于3mmol/L Newport Green以及0.2nmol/L Tetramethylrhodamine ethylester(TMRE)37℃条件下孵育45min,洗涤之后加入1g/L PI 4℃孵育。
3.结果如图9所示(*p<0.05,与对照组比较),SS2序列相比于GFP-SOCS1对细胞凋亡的抑制作用更为明显。
实施例7小分子多肽在其他凋亡相关慢性炎症疾病中对细胞凋亡的作用
1.细胞:SW1353人软骨肉瘤细胞(Institute of Biochemistry andell Biology,Shanghai,China),所用培养基为DMEM完培。使用时用加入终浓度为10%的胎牛血清,并且每毫升加入100单位青霉素和100ug链霉素。于37℃、5%CO2、湿润空气的细胞培养箱中进行培养。培养基每两天更换一次,每4-5天进行传代。
2.材料方法:人类骨关节炎与克罗恩病都属凋亡相关的慢性炎症疾病,IL-1β刺激SW1353是骨关节炎的常用细胞建模手段,IL-1β刺激可以导致SW1353细胞发生显著的凋亡。本实验使用10ng/ml IL-1β(SigmaAldrich)刺激细胞,并使用GFP-SOCS1、GFP-SOCS1S1、GFP-SS2、GFP-SOCS1S3转染细胞72小时,后用流式细胞术检测细胞凋亡情况。(具体方法同上)
3.结果如图10所示(*p<0.05,与对照组比较),SS2小分子多肽对IL-1β诱导的SW1353凋亡同样具有抑制作用,SS2在多种凋亡相关疾病中都可能发挥抑制疾病进展的作用。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
SEQUENCE LISTING
<110> 南通大学
<120> 一种小分子多肽、及其编码基因和应用
<130> 权利要求书、说明书
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 71
<212> PRT
<213> 人工序列
<400> 1
Gly Phe Tyr Trp Gly Pro Leu Ser Val His Gly Ala His Glu Arg Leu
1 5 10 15
Arg Ala Glu Pro Val Gly Thr Phe Leu Val Arg Asp Ser Arg Gln Arg
20 25 30
Asn Cys Phe Phe Ala Leu Ser Val Lys Met Ala Ser Gly Pro Thr Ser
35 40 45
Ile Arg Val His Phe Gln Ala Gly Arg Phe His Leu Asp Gly Ser Arg
50 55 60
Glu Ser Phe Asp Cys Leu Phe
65 70
<210> 2
<211> 206
<212> DNA
<213> 人工序列
<400> 2
actgggggcc cctgagcgtg cacggggcgc acgagcggct gcgcgccgag cccgtgggca 60
ccttcctggt gcgcgacagc cgccagcgga actgcttttt cgcccttagc gtgaagatgg 120
cctcgggacc cacgagcatc cgcgtgcact ttcaggccgg ccgctttcac ctggatggca 180
gccgcgagag cttcgactgc ctcttc 206
<210> 3
<211> 211
<212> PRT
<213> 人工序列
<400> 3
Met Val Ala His Asn Gln Val Ala Ala Asp Asn Ala Val Ser Thr Ala
1 5 10 15
Ala Glu Pro Arg Arg Arg Pro Glu Pro Ser Ser Ser Ser Ser Ser Ser
20 25 30
Pro Ala Ala Pro Ala Arg Pro Arg Pro Cys Pro Ala Val Pro Ala Pro
35 40 45
Ala Pro Gly Asp Thr His Phe Arg Thr Phe Arg Ser His Ala Asp Tyr
50 55 60
Arg Arg Ile Thr Arg Ala Ser Ala Leu Leu Asp Ala Cys Gly Phe Tyr
65 70 75 80
Trp Gly Pro Leu Ser Val His Gly Ala His Glu Arg Leu Arg Ala Glu
85 90 95
Pro Val Gly Thr Phe Leu Val Arg Asp Ser Arg Gln Arg Asn Cys Phe
100 105 110
Phe Ala Leu Ser Val Lys Met Ala Ser Gly Pro Thr Ser Ile Arg Val
115 120 125
His Phe Gln Ala Gly Arg Phe His Leu Asp Gly Ser Arg Glu Ser Phe
130 135 140
Asp Cys Leu Phe Glu Leu Leu Glu His Tyr Val Ala Ala Pro Arg Arg
145 150 155 160
Met Leu Gly Ala Pro Leu Arg Gln Arg Arg Val Arg Pro Leu Gln Glu
165 170 175
Leu Cys Arg Gln Arg Ile Val Ala Thr Val Gly Arg Glu Asn Leu Ala
180 185 190
Arg Ile Pro Leu Asn Pro Val Leu Arg Asp Tyr Leu Ser Ser Phe Pro
195 200 205
Phe Gln Ile
210
<210> 4
<211> 77
<212> PRT
<213> 人工序列
<400> 4
Met Val Ala His Asn Gln Val Ala Ala Asp Asn Ala Val Ser Thr Ala
1 5 10 15
Ala Glu Pro Arg Arg Arg Pro Glu Pro Ser Ser Ser Ser Ser Ser Ser
20 25 30
Pro Ala Ala Pro Ala Arg Pro Arg Pro Cys Pro Ala Val Pro Ala Pro
35 40 45
Ala Pro Gly Asp Thr His Phe Arg Thr Phe Arg Ser His Ala Asp Tyr
50 55 60
Arg Arg Ile Thr Arg Ala Ser Ala Leu Leu Asp Ala Cys
65 70 75
<210> 5
<211> 63
<212> PRT
<213> 人工序列
<400> 5
Glu Leu Leu Glu His Tyr Val Ala Ala Pro Arg Arg Met Leu Gly Ala
1 5 10 15
Pro Leu Arg Gln Arg Arg Val Arg Pro Leu Gln Glu Leu Cys Arg Gln
20 25 30
Arg Ile Val Ala Thr Val Gly Arg Glu Asn Leu Ala Arg Ile Pro Leu
35 40 45
Asn Pro Val Leu Arg Asp Tyr Leu Ser Ser Phe Pro Phe Gln Ile
50 55 60
- 还没有人留言评论。精彩留言会获得点赞!