一种苯并呋喃苷类化合物及其制备方法和应用与流程
本发明属于医药及保健食品领域,具体涉及一种苯并呋喃苷类化合物及其制备方法和应用。
背景技术:
炎症是机体对于刺激的一种防御反应,是具有血管系统的活体组织对损伤因子所发生的防御反应。主要分为急性炎症和慢性炎症两种。参与炎症反应的物质有组胺、5-羟色胺等胺类物质,舒缓激肽、赖氨酰舒缓激肽等多肽类,血纤维溶解酶、激肽释放酶蛋白酶等。
炎症与动脉硬化、心脏病、中风、癌症、糖尿病等多种疾病密切相关,是引起多种疾病的重要因素。因此,具有高效低毒特点的抗炎药物的不断研发十分重要。
自然界的植物和微生物的次级代谢产物一直是新药发现的重要源泉,因为天然产物具有重要的结构多样性和生物活性多样性,很多化合物的结构事先无法预测并且难以用合成的方法获得。虽然随着合成药物化学的发展,现在越来越多的新药是化药,但仍然有相当比例的新药是直接或间接来源于天然产物。因此,天然产物仍然是新药研发过程中不可或缺的一个重要化合物宝库。
兴安独活(Heracleum dissectum)主要分布于东北地区,是菊科牛防风属多年生草本植物,鄂语称为坎库拉,坎库拉作为鄂伦春族重要的药食两用的野生植物,春夏季节其幼嫩的茎叶被当地人用作美味的蔬菜食用,其根作为传统的鄂族药材用于祛风除湿、止痛止泻等。因此,鄂伦春族人将坎库拉视为珍宝,只有贵宾到来时才用坎库拉炖煮袍子肉招待客人。但到目前为止对其化学成分的研究极少,也无药理活性研究报道。
技术实现要素:
本发明的目的在于克服现有技术中存在的问题,提供一种苯并呋喃苷类化合物及其制备方法和应用,能够制得一种新的苯并呋喃苷类化合物,以用于抗炎。
为了达到上述目的,本发明采用如下技术方案:其分子式为C23H30O13或C22H28O13。
进一步地,其结构通式为:
其中,R为-H或-CH3。
本发明制备方法,包括以下步骤:
1)取兴安独活的干燥根进行回流提取若干次,将提取液减压浓缩,得到总浸膏或浓缩液;
2)将总浸膏混悬于水中,得到浸膏液,浸膏液或浓缩液经乙酸乙酯萃取若干次后分离出有机层,剩余水层通过正丁醇萃取若干次后合并萃取液,减压除去正丁醇得到正丁醇萃取层;
3)将正丁醇萃取层上样于硅胶柱,以氯仿-甲醇系统作为洗脱液,按体积比(100:0)~(0:100)进行梯度洗脱,对流出液进行检测,将洗脱液体积比为10:1的流份合并,除去溶剂,得到样品a1;将洗脱液体积比为8:1的流份合并,除去溶剂,得到样品b1;
4)将样品a1上样于反相硅胶层析柱,以甲醇-水系统作为洗脱液,按体积比(0:100)~(100:0)进行梯度洗脱,将洗脱液体积比为100:0的流份合并,除去溶剂,得到样品a2;
将样品b1上样于反相硅胶层析柱,以甲醇-水系统作为洗脱液,按体积比(0:100)~(100:0)进行梯度洗脱,将洗脱液体积比为70:30的流份合并,除去溶剂,得到样品b2;
5)将样品a2和样品b2分别上样于高效液相色谱分离柱,用流动相进行等度洗脱,得到苯并呋喃苷类化合物。
进一步地,步骤1)的回流提取中采用甲醇、水或体积分数10~95%的乙醇作为提取剂,兴安独活的干燥根与提取剂的质量体积比为1kg:(1~8)L;当提取剂为甲醇或体积分数10~95%的乙醇时,将得到的提取液中溶剂回收得到总浸膏;当提取剂为水时,将提取液的体积浓缩至六分之一到十分之一,得到浓缩液。
进一步地,步骤1)中提取次数为1~6次,每次1~4小时。
进一步地,步骤2)中总浸膏和水的体积比为1:1~1:5。
进一步地,步骤2)中浸膏液或浓缩液直接经过乙酸乙酯萃取;或者先依次经石油醚和氯仿萃取后,再经过乙酸乙酯萃取;每次萃取均是等体积萃取;每种溶剂分别萃取1~6次。
进一步地,步骤3)中梯度洗脱后每300~800mL收集一个流份;步骤4)中梯度洗脱后每200~500mL收集一个流份;步骤3)和步骤4)中对流出液均是进行TLC检测;步骤5)中等度洗脱的流速为3~6mL/min。
进一步地,步骤5)中流动相是甲醇-0.5%醋酸水系统或乙腈-0.5%醋酸水系统;对样品a2进行等度洗脱时,采用的甲醇-0.5%醋酸水系统中甲醇、水和醋酸的体积比为45:55:0.5,采用的乙腈-0.5%醋酸水系统中乙腈、水和醋酸的体积比为42:58:0.5,得到的苯并呋喃苷类化合物分子式为C23H30O13;对样品a2进行等度洗脱时,采用的甲醇-0.5%醋酸水系统中甲醇、水和醋酸的体积比为35:65:0.5,采用的乙腈-0.5%醋酸水系统中乙腈、水和醋酸的体积比为31:69:0.5,得到的苯并呋喃苷类化合物分子式为C22H28O13。
如上所述的苯并呋喃苷类化合物在制备抗炎药物和/或保健品中方面的应用。
与现有技术相比,本发明的有益效果是:
本发明中的新的苯并呋喃苷类化合物具有抗炎作用,经试验证明,对小鼠RAW264.7细细胞具有良好的抗炎作用,该化合物具有高效、低毒的特点,有望开发成新的抗炎药物,或者用于制备具有预防和治疗炎症的保健食品。
由于本发明中的化合物的极性较大,用一般的方法难以纯化得到,如用一般的反相色谱柱该化合物无法保留,随流动相一起流出,不能达到和其它化合物分离的目的,本发明中利用亲水作用色谱将苯并呋喃苷类化合物分离得到,且纯度较高(>98.5%),是分离纯化大极性的小分子苷元连多个糖类化合物的有效手段。
【附图说明】
图1为本发明化合物1的1H-NMR图谱;
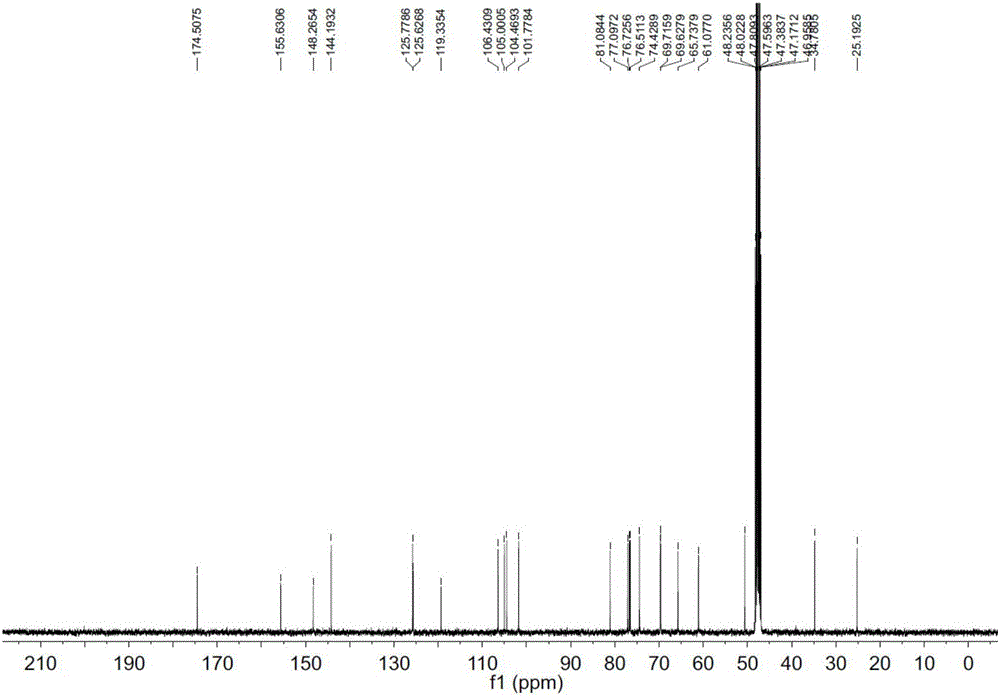
图2为本发明化合物1的13C-NMR图谱;
图3为本发明化合物1的DEPT图谱;
图4为本发明化合物1的1H-1H COSY图谱;
图5为本发明化合物1的HMQC图谱;
图6为本发明化合物1的HMBC图谱;
图7为本发明化合物2的1H-NMR图谱;
图8为本发明化合物2的HMQC图谱;
图9为本发明化合物2的1H-1H COSY图谱。
【具体实施方式】
下面结合具体实施例对本发明作进一步的说明,但并不局限于此。
本发明新的苯并呋喃苷类化合物的结构式如下:
其中,结构式中的R为:-H或-CH3。
本发明新的苯并呋喃苷类化合物的制备方法,包括以下步骤:
1)取一定质量(kg)的兴安独活干燥根,用体积为兴安独活干燥根质量1~8倍量的甲醇、体积分数为10~95%的乙醇或水(L)在各自沸点附近加热回流提取1~6次,每次1~4小时,当提取剂为甲醇或体积分数10~95%的乙醇时,合并提取液减压回收除去溶剂,得到总浸膏,当提取剂为水时,合并提取液并将其体积浓缩至六分之一到十分之一,得到浓缩液;
2)将总浸膏混悬于水中,总浸膏和水的体积比为1:1~1:5,得到浸膏液,浸膏液或浓缩液分别依次用等体积的有机溶剂萃取,其中,第一次萃取时用石油醚对浸膏液或浓缩液进行等体积萃取,之后每次萃取均是分离出上一次萃取后的有机层,将剩余的水层用有机溶剂等体积进行下一次萃取;每种溶剂各萃取1~6次,合并萃取液,常压或减压蒸馏除去有机溶剂,分别得到各萃取层和水层。有机溶剂包括石油醚、氯仿、乙酸乙酯和正丁醇等,且萃取次序为先用极性小的溶剂,再用极性大的有机溶剂,石油醚和氯仿可以省去。
3)取正丁醇萃取层,通过采用柱层析纯化等分离方法,得到本发明的苯并呋喃苷类化合物。
柱层析包括以下三个阶段:
第一阶段:将正丁醇萃取层上样于硅胶柱,以氯仿-甲醇系统作为洗脱液,按体积比(100:0)~(0:100)进行梯度洗脱,每300~800ml收集一个流份,对流出液进行TLC检测,合并相同流份,共得到30个流份,分别命名为FrB1-FrB30,常压或减压蒸干溶剂,取其中的FrB20流份和FrB24流份,即洗脱液体积比分别为10:1和8:1的流份,作为第一次过柱部分;
第二阶段:将第一次过柱部分中的FrB20流份和FrB24流份,分别上样于反相硅胶层析柱,以甲醇-水系统作为洗脱液,按体积比(0:100)~(100:0)进行梯度洗脱,每200~500mL收集一个流份,对流出液进行TLC检测,合并相同流份,得到4个亚流份(FrB20.1-FrB20.4)和2个亚流份(FrB24.1-FrB24.2),减压除去溶剂,得到第二次过柱部分;
第三阶段:将第二次过柱部分FrB20.4流份,即洗脱液体积比为100:0的流份;FrB24.1流份,即洗脱液体积比为70:30的流份,分别上样于高效液相色谱分离柱,分离得到苯并呋喃苷类化合物。其中,高效液相色谱分离柱为江苏汉邦的Megres C18柱,高效液相色谱分离是用示差折光检测器,以甲醇-0.5%醋酸水系统或乙腈-0.5%醋酸水系统作为流动相,按3~6mL/min进行等度洗脱。
甲醇-0.5%醋酸水系统中甲醇、水和醋酸的体积比分别为45:55:0.5和35:65:0.5;乙腈-0.5%醋酸水系统中乙腈、水和醋酸的体积比分别为42:58:0.5和31:69:0.5。
本发明中的新的苯并呋喃苷类化合物能在制备抗炎药物和/或保健品中应用。
实施例1
1.苯并呋喃苷类化合物的分离纯化
1)取坎库拉干燥根6kg,用30L的甲醇加热回流提取3次,每次2小时,此时,和甲醇的体积是兴安独活干燥根的质量的5倍,合并甲醇提取液减压回收溶剂,得总浸膏;
2)将总浸膏混悬于3倍体积量水中,用石油醚等体积萃取4次,然后依次经氯仿,乙酸乙酯和正丁醇等体积萃取,每种有机溶剂萃取4次,将有机层常压或减压蒸馏除去溶剂后分别得到石油醚层、氯仿层、乙酸乙酯层、正丁醇层和余下的水层。
3)取正丁醇萃取层100g,上样于硅胶柱色谱,以氯仿-甲醇系统作为洗脱液,按体积比(v/v)为(0:100)~(100:0)进行梯度洗脱,每500mL收集一次,常压蒸馏回收溶剂,TLC检识合并相同流份,共得到30个流份,分别命名为FrB1-FrB30,取其中的FrB20流份和FrB24流份,即洗脱液体积比分别为10:1和8:1的流份,作为第一次过柱部分。
其中,FrB20流份经反相硅胶柱色谱,用甲醇-水系统作为洗脱液,按体积比(v/v)为0:100~100:0梯度洗脱,每200mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到4个亚流份,分别命名为FrB20.1-FrB20.4。然后FrB20.4流份,即洗脱液体积比为100:0的流份,用半制备高效液相色谱仪,使用Megres C18色谱柱,以甲醇和0.5%的醋酸水作为流动相等度洗脱(45:55),流速为3mL/min,得到苯并呋喃苷类化合物1(保留时间为27min)。
FrB24流份经反相硅胶柱色谱,用甲醇-水梯度洗脱(30:70,45:55,70:30,100:0,v/v),每200mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到2个亚流份分别命名为FrB24.1-FrB24.2。然后FrB24.1流份,即洗脱液体积比为70:30的流份,用半制备高效液相色谱仪,使用Megres C18色谱柱,以甲醇和0.5%的醋酸水作为流动相等度洗脱(35:65),流速为3mL/min,得到苯并呋喃苷类化合物2(保留时间为20min)。
4)本发明通过理化常数和现代波谱学技术手段(HR-ESI-MS,1D-NMR,2D-NMR)鉴定化合物的结构,化合物1为6-methoxycarbonylethyl-benzofuran-5-O-β-D-xylopyranosyl(1→2)-β-D-glucopyranoside,化合物2为6-hydroxycarbonylethyl-benzofuran-5-O-β-D-xylopyranosyl(1→2)-β-D-glucopyranoside。化合物1和2的结构鉴定过程如下所述。
2.新的苯并呋喃苷类化合物的结构鉴定
(1)新化合物1的结构鉴定
化合物1为黄色油状物,其HR-ESIMS显示准分子离子峰为[M+Na]+at m/z 537.1584(calcd 537.1579),因此确定分子式为C23H30O13。红外光谱显示有羟基吸收带(3403cm-1),烷基吸收带(2933cm-1),羰基吸收带(1718cm-1)等。在图1的1H NMR中,四个氢质子信号δH 7.64(1H,d,J=2.2Hz),7.18(1H,m),7.11(1H,d,J=8.4Hz),7.19(1H,m)表明分子中存在二取代苯并呋喃结构,且两个取代基处于邻位二取代。在图2的13C NMR中,除了一个羰基外(δC 174.8),还有八个芳香碳信号,包括四个次甲基,四个季碳,与前述推测的邻位二取代苯并呋喃结构片段一致。结合图3的DEPT谱,图4的1H-1H COSY谱和图5的HMQC,两组多重峰质子信号δH 3.30(1H,m),3.01(1H,m),δH 2.72(1H,m),2.65(1H,m)和他们相应的碳信号(δC 25.2和δC 34.9)表明分子中存在两个直接相连的亚甲基。在图6的HMBC谱中,这两个亚甲基和一个羰基碳(δC 174.8)相关,而此羰基碳与一个甲氧基相连(δH 3.68,δC50.6)。在1H和13C NMR谱中,两个端基质子信号δH 5.09(1H,d,J=7.6Hz)and 4.79(1H,d,J=7.3Hz)和他们相应的碳信号(δC 101.8,δC 104.5)表明分子中有两个糖单位,酸水解后用GC分析鉴定这两种糖为D-葡萄糖和D-木糖,这两个糖的端基构型均为β构型,因为他们的端基质子的偶合常数为7.6Hz和7.3Hz。取代基以及糖的取代位置和连接顺序通过综合解析1H–1H–COSY,HMQC和HMBC得以确定。
因此,该化合物鉴定为:6-methoxycarbonylethyl-benzofuran-5-O-β-D-xylopyranosyl(1→2)-β-D-glucopyranoside,即6-甲氧基羰基乙基-苯并呋喃-5-O-β-D-吡喃木糖-(1→2)-β-D-吡喃葡萄糖苷,它是一个未见文献报道的具有新苷元的新化合物。其结构见下式:
核磁数据见表1。
(2)新化合物2的结构鉴定
化合物2为黄色油状物,其HR-ESIMS显示准分子离子峰为[M+Na]+at m/z 523.1427(calcd 523.1422),确定分子式为C22H28O13。其图7的氢谱和图8的碳谱数据与化合物1十分相似,只是氢谱中少了一个甲氧基信号,因此推测化合物2是酸而不是甲酯的结构,这与分子量一致。综合解析图9的1H–1H–COSY,HMQC和HMBC谱,确定化合物2为6-hydroxycarbonylethyl-benzofuran-5-O-β-D-xylopyranosyl(1→2)-β-D-glucopyranoside,即6-甲氧基羰基乙基-苯并呋喃-5-O-β-D-吡喃木糖-(1→2)-β-D-吡喃葡萄糖苷,是一个未见文献报道的新化合物。化合物2结构式如下:
表1本发明中化合物1和2的1H NMR和13C NMR数据
下面对本发明中所分离鉴定的化合物1和2进一步做药理活性检测。
3.体外抗炎实验
实验方法:
将RAW264.7细胞接种于96孔板中,培养24h后加入LPS(脂多糖)。接着不同组分别加入不同浓度的样品(本发明化合物1和2、阳性药物吲哚美辛),空白组加入等体积vehicle。50μL细胞培养液混合等体积Griess试剂I加入上述96孔板中,接着加入Griess试剂II。酶标仪测定各组样品在546nm波长下的OD值,利用下列公式计算NO产生抑制率,并用SPSS软件计算被测试样品的半数抑制浓度(IC50值,μM)。
NO抑制率(%)=[1–(样品组/空白组)]×100%。
实验结果:
表2本发明化合物1和2对LPS刺激的细胞RAW264.7产生NO的抑制作用
结果分析:表2的数据表明,本发明中的化合物1和2具有很好的体外抗炎作用,对脂多糖LPS刺激小鼠RAW264.7细胞产生NO具有较好的抑制作用,其半数抑制浓度IC50分别为28.6±1.6μM、32.9±2.1μM,均优于阳性对照药物吲哚美辛的39.5±3.2μM。说明本发明中的苯并呋喃苷类化合物1和2具有较好的抗炎作用。
实施例2
1)取坎库拉干燥根10kg,用40L的70%乙醇加热回流提取3次,每次2小时,合并提取液并减压回收溶剂,得总浸膏;
2)将总浸膏混悬于4倍量体积水中,先用乙酸乙酯萃取3次后,再用正丁醇等体积萃取4次,减压除去有机溶剂后分别得到乙酸乙酯层和正丁醇层。
3)取正丁醇萃取层200g,上样于硅胶柱色谱,以氯仿-甲醇系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每800mL收集一次,常压蒸馏回收溶剂,TLC检识合并相同流份,共得到30个流份,分别命名为FrB1-FrB30,取其中的FrB20流份和FrB24流份,即洗脱液体积比分别为10:1和8:1的流份,作为第一次过柱部分。
其中,FrB20流份经反相硅胶柱色谱,用甲醇-水系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每400mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到4个亚流份,分别命名为FrB20.1-FrB20.4。然后FrB20.4流份,即洗脱液体积比为100%甲醇洗脱部分,用半制备高效液相色谱仪,使用Megres C18色谱柱,以乙腈和0.5%的醋酸水作为流动相等度洗脱(42:58),流速为3mL/min,得到苯并呋喃苷类化合物1(保留时间为25min)。
FrB24流份经反相硅胶柱色谱,用甲醇-水体积比(v/v)为100:0~0:100进行梯度洗脱,每400mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到2个亚流份分别为FrB24.1-FrB24.2。然后FrB24.1流份,即洗脱液体积比为70:30的流份,用半制备高效液相色谱仪,使用Megres C18色谱柱,以乙腈和0.5%的醋酸水作为流动相等度洗脱(31:69),流速为3mL/min,得到苯并呋喃苷类化合物2(保留时间为18min)。
实施例3
1)取坎库拉干燥根10kg,用30L的水加热回流提取1次,每次4小时,合并提取液并减压回收溶剂,得总浸膏;
2)将总浸膏混悬于2倍量体积水中,先用乙酸乙酯萃取3次后,再用正丁醇等体积萃取6次,减压除去有机溶剂后分别得到乙酸乙酯层和正丁醇层。
3)取正丁醇萃取层200g,上样于硅胶柱色谱,以氯仿-甲醇系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每800mL收集一次,常压蒸馏回收溶剂,TLC检识合并相同流份,共得到30个流份,分别命名为FrB1-FrB30,取其中的FrB20流份和FrB24流份,即洗脱液体积比分别为10:1和8:1的流份,作为第一次过柱部分。
其中,FrB20流份经反相硅胶柱色谱,用甲醇-水系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每500mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到4个亚流份,分别命名为FrB20.1-FrB20.4。然后FrB20.4流份,即洗脱液体积比为100%甲醇洗脱部分,用半制备高效液相色谱仪,使用Megres C18色谱柱,以乙腈和0.5%的醋酸水作为流动相等度洗脱(42:58),流速为3mL/min,得到苯并呋喃苷类化合物1(保留时间为25min)。
FrB24流份经反相硅胶柱色谱,用甲醇-水按体积比(v/v)为100:0~0:100进行梯度洗脱,每400mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到2个亚流份分别为FrB24.1-FrB24.2。然后FrB24.1流份,即洗脱液体积比为70:30的流份,用半制备高效液相色谱仪,使用Megres C18色谱柱,以乙腈和0.5%的醋酸水作为流动相等度洗脱(31:69),流速为3mL/min,得到苯并呋喃苷类化合物2(保留时间为18min)。
实施例4
1)取坎库拉干燥根10kg,用80L的10%乙醇加热回流提取6次,每次1小时,合并提取液并减压回收溶剂,得总浸膏;
2)将总浸膏混悬于5倍量体积水中,先用石油醚萃取2次后,再依次用氯仿、乙酸乙酯和正丁醇等体积萃取1次,减压除去有机溶剂后分别得到乙酸乙酯层和正丁醇层。
3)取正丁醇萃取层200g,上样于硅胶柱色谱,以氯仿-甲醇系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每300mL收集一次,常压蒸馏回收溶剂,TLC检识合并相同流份,共得到30个流份,分别命名为FrB1-FrB30,取其中的FrB20流份和FrB24流份,即洗脱液体积比分别为10:1和8:1的流份,作为第一次过柱部分。
其中,FrB20流份经反相硅胶柱色谱,用甲醇-水系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每300mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到4个亚流份,分别命名为FrB20.1-FrB20.4。然后FrB20.4流份,即洗脱液体积比为100%甲醇洗脱部分,用半制备高效液相色谱仪,使用Megres C18色谱柱,以乙腈和0.5%的醋酸水作为流动相等度洗脱(42:58),流速为3mL/min,得到苯并呋喃苷类化合物1(保留时间为25min)。
FrB24流份经反相硅胶柱色谱,用甲醇-水按体积比(v/v)为100:0~0:100进行梯度洗脱,每400mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到2个亚流份分别为FrB24.1-FrB24.2。然后FrB24.1流份,即洗脱液体积比为70:30的流份,用半制备高效液相色谱仪,使用Megres C18色谱柱,以乙腈和0.5%的醋酸水作为流动相等度洗脱(31:69),流速为3mL/min,得到苯并呋喃苷类化合物2(保留时间为18min)。
实施例5
1)取坎库拉干燥根10kg,用35L的95%乙醇加热回流提取4次,每次3小时,合并提取液并减压回收溶剂,得总浸膏;
2)将总浸膏混悬于1倍量体积水中,先用石油醚萃取1次后,再依次用氯仿、乙酸乙酯和正丁醇等体积萃取2次,减压除去有机溶剂后分别得到乙酸乙酯层和正丁醇层。
3)取正丁醇萃取层200g,上样于硅胶柱色谱,以氯仿-甲醇系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每600mL收集一次,常压蒸馏回收溶剂,TLC检识合并相同流份,共得到30个流份,分别命名为FrB1-FrB30,取其中的FrB20流份和FrB24流份,即洗脱液体积比分别为10:1和8:1的流份,作为第一次过柱部分。
其中,FrB20流份经反相硅胶柱色谱,用甲醇-水系统作为洗脱液,按体积比(v/v)为100:0~0:100进行梯度洗脱,每200mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到4个亚流份,分别命名为FrB20.1-FrB20.4。然后FrB20.4流份,即洗脱液体积比为100%甲醇洗脱部分,用半制备高效液相色谱仪,使用Megres C18色谱柱,以甲醇和0.5%的醋酸水作为流动相等度洗脱(45:55),流速为3mL/min,得到苯并呋喃苷类化合物1(保留时间为27min)。
FrB24流份经反相硅胶柱色谱,用甲醇-水按体积比(v/v)为100:0~0:100进行梯度洗脱,每400mL收集一次,减压除去溶剂,TLC检识合并相同流份,得到2个亚流份分别为FrB24.1-FrB24.2。然后FrB24.1流份,即洗脱液体积比为70:30的流份,用半制备高效液相色谱仪,使用Megres C18色谱柱,以甲醇和0.5%的醋酸水作为流动相等度洗脱(35:65),流速为3mL/min,得到苯并呋喃苷类化合物2(保留时间为20min)。
结合以上实验及其实验结果,表明本发明中的苯并呋喃苷类化合物具有很好的体外抗炎的作用,有望开发为新的抗炎药物;或者用于制备预防和治疗炎症的保健食品。
对比例1
将步骤5)中的流动相换成其它流动相或者其他比例的相同流动相(或者色谱柱替换成普通反相硅胶色谱柱),其它步骤和条件与实施例1相同。发现无法分离出苯并呋喃苷类化合物。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺