由多能干细胞向角膜上皮细胞的分化诱导的制作方法
相关申请
本申请基于日本专利申请2015-006074(申请日为2015年1月15日)主张优先权,其内容通过参考并入本说明书中。
本发明涉及从多能干细胞(pluripotentstemcells)分化诱导角膜上皮细胞的方法。更详细而言,涉及下述方法:在不使用饲养细胞的情况下,在无血清培养基中使多能干细胞(尤其是人工多能干细胞)自主地分化为外胚层系细胞种类(日文:細胞種),并将得到的眼表外胚层系列细胞分化诱导为角膜上皮细胞。
背景技术:
近年来,通过对未分化的细胞(干细胞)进行分化诱导而实现对受损的组织器官加以修补的再生医疗(细胞医疗)的研究正在不断发展。尤其是胚胎干细胞(es细胞)因能分化为除胎盘以外的所有细胞,因此,对其向各细胞谱系的分化诱导、对其分化决定因子的鉴定受到瞩目,但是,由于在建立时破坏受精卵这样的伦理性问题,导致其研究、利用受到颇多制约,另外,由于无法建立来源于接受移植的患者的es细胞,所以还存在排斥反应的问题,因此,现状是胚胎干细胞的适用疾病受限,其在临床中的有用性尚未明确。
相对于此,通过向体细胞、未分化的干细胞导入特定的因子而建立了具有与es细胞同样的分化多能性的人工多能干细胞。作为其代表,有山中等人所建立的ips细胞。利用了这些人工多能干细胞的再生医疗不仅不存在伦理性问题,而且,通过以来源于患者的细胞作为细胞源(source),还能够避免排斥反应的问题。
有报道称,能够利用人ips细胞、es细胞来分化诱导上皮细胞(专利文献1、非专利文献1~2)。经诱导的上皮细胞中有很多表达角蛋白14、p63这样的复层上皮细胞的标志物,并且,也可能使其分化为皮肤上皮等复层上皮系列细胞。本申请的发明人对于向复层上皮中的角膜上皮的分化进行了报道(专利文献2~3、非专利文献3),但是,对于临床应用而言,无法片化、无法诱导增殖能力高的角膜上皮前体细胞、以及使用了饲养细胞均成为问题。
为了进行临床应用,期望能够在不使用饲养细胞的情况下由人ips细胞制备具有复层化的功能性组织结构、标志物的表达(尤其是角蛋白12、pax6、muc16)的角膜上皮片,但迄今为止尚未有这样的报道。
现有技术文献
专利文献
专利文献1:wo2012/073238号
专利文献2:wo2010/134619号
专利文献3:wo2012/144582号
非专利文献
非专利文献1:guenou,h.,etal.,.thelancet374,(2009)p1745-1753.
非专利文献2:metallo,c.m.,etal.,stemcells(2008)26,372-380.
非专利文献3:r.hayashietal.,volume7,issue9,e45435,plosone,2012
技术实现要素:
发明所要解决的课题
本发明的课题在于,提供在不使用饲养细胞、血清的情况下将多能干细胞(尤其是人工多能干细胞)分化诱导为角膜上皮、结膜上皮等眼表上皮系列的方法,以及,利用多能干细胞(尤其是人工多能干细胞)而提供复层化的功能性培养角膜上皮细胞片。
用于解决课题的手段
为了解决上述课题,本申请的发明人进行了锐意研究,结果发现,在不使用血清、饲养细胞的情况下于含有ksr等的分化培养基中培养人ips细胞时,细胞在4周左右时自主地分化,形成包含由各不相同的外胚层系细胞种类构成的同心圆状的层的(多层状的)集落(colony)。此外,还发现通过下述方法能够得到复层化的角膜上皮细胞:从得到的集落中分离包含上皮干细胞的眼表外胚层系列细胞,对角膜上皮前体细胞进行分化诱导、并将其单独分离出,进而进行成熟培养。得到的角膜上皮细胞能够以片状回收并进行移植,并确认到其与来源于体细胞的角膜上皮细胞同样地能在体外(invitro)及体内(invivo)作为角膜上皮而发挥功能。
本发明是基于上述的见解而完成的,其涉及以下(1)~(15)。
(1)制备下述集落的方法,所述集落包含由各不相同的外胚层系细胞种类构成的同心圆状的层,所述方法中,在不使用饲养细胞的情况下于无血清培养基中对多能干细胞进行二维培养,由此制备所述集落;
(2)如上述(1)所述的方法,其特征在于,通过多能干细胞的自主分化,形成由不同的外胚层系细胞种类构成的同心圆状的层;
(3)如上述(1)或(2)所述的方法,其特征在于,无血清培养基不含有0.5nm以上的bmp4(骨形态发生蛋白4,bonemorphogeneticprotein4)、转化生长因子(transforminggrowthfactor)、及激活素(activin);
(4)如上述(3)所述的方法,其特征在于,无血清培养基还不含有选自高浓度视黄酸、bmp抑制剂、tgfβ抑制剂、及头蛋白(noggin)中的至少1种以上;
(5)如上述(1)~(4)中任一项所述的方法,其特征在于,使用经选自胶原蛋白、纤连蛋白、层粘连蛋白(laminin)或层粘连蛋白片段、玻连蛋白、基底膜基质、明胶、透明质酸、多聚赖氨酸(polylysine)、玻连蛋白、及透明质酸中的任意一种以上包被的容器来培养多能干细胞;
(6)如上述(1)~(5)中任一项所述的方法,其中,集落包含分别由神经外胚层系列细胞、神经嵴系列细胞/眼胚系列细胞、眼表外胚层(ocularsurfaceectoderm)系列细胞、及表面外胚层(surfaceectoderm)系列细胞构成的层;
(7)眼相关细胞的制备方法,其包括下述步骤:
通过上述(1)~(6)中任一项所述的方法制备集落的步骤,所述集落包含由各不相同的外胚层系细胞种类构成的同心圆状的层;
从所述集落中分离特定的层中包含的细胞的步骤;及
将所述细胞分化诱导为眼相关细胞的步骤;
(8)如上述(7)所述的方法,其中,眼相关细胞为选自角膜上皮细胞、视网膜色素上皮细胞、神经视网膜细胞、结膜上皮细胞、角膜缘上皮细胞、角膜内皮细胞、角膜基质细胞、虹膜基质细胞、巩膜细胞、虹膜色素上皮细胞、睫状体上皮细胞、视神经细胞、角膜缘下成纤维细胞、结膜下成纤维细胞、泪腺、睑板腺、杯状细胞、晶状体上皮细胞、及眼睑上皮细胞中的任一种;
(9)角膜上皮细胞的制备方法,其包括下述步骤:
通过上述(1)~(6)中任一项所述的方法制备集落的步骤,所述集落包含由各不相同的外胚层系细胞种类构成的同心圆状的层;
在含有生长因子的培养基中培养所述集落的步骤;
分离由眼表外胚层系列细胞构成的层中包含的细胞,在含有kgf、rock抑制剂、及血清替代物的培养基中进行培养,从而分化诱导为角膜上皮前体细胞的步骤;及
将角膜上皮前体细胞单独分离出,分化诱导为角膜上皮细胞的步骤;
(10)如上述(9)所述的方法,其特征在于,以选自itgβ4、ssea4、tra-1-60、及cd200中的1种或2种以上的标志物有无表达(优选为itgβ4阳性及ssea4阳性,更优选为tra-1-60或cd200阴性、且itgβ4阳性及ssea4阳性,进一步优选为cd200阴性、且itgβ4阳性及ssea4阳性)作为指标,来单独分离角膜上皮前体细胞;
(11)角膜上皮细胞,其特征在于,所述角膜上皮细胞是通过上述(9)或(10)所述的方法制备的,并且为k12、pax6、及p63阳性;
(12)角膜细胞片的制备方法,其包括下述步骤:通过上述(9)或(10)所述的方法制备角膜上皮细胞的步骤;将得到的角膜上皮细胞进一步进行复层化培养的步骤;
(13)集落,其包含由来源于多能干细胞(尤其是人工多能干细胞)的各不相同的外胚层系细胞种类构成的同心圆状的层;
(14)如上述(13)所述的集落,其是利用上述(1)~(6)中任一项所述的方法制备的;
(15)复层化角膜上皮细胞片,其特征在于,所述复层化角膜上皮细胞片来源于多能干细胞(尤其是人工多能干细胞),并且,角膜上皮细胞为k12、pax6、及muc16阳性;
(16)角膜上皮细胞,其是通过将上述(13)或(14)所述的集落的由眼表外胚层系列细胞构成的层中包含的细胞进行分离·培养而制备的来源于多能干细胞(尤其是人工多能干细胞)的角膜上皮细胞,其特征在于,所述角膜上皮细胞为k12、pax6、及p63阳性。
发明效果
尽管此前报道过从人ips细胞诱导上皮细胞的方法,但从未制制得保持有角蛋白12、pax6、muc16这样的角膜上皮细胞特异性标志物的复层化功能性细胞。通过本发明的方法得到的上皮细胞表达这些标志物,能够进行移植,并且,与来源于体细胞的角膜上皮细胞同样地能在体外及体内作为角膜上皮细胞而发挥功能。另外,对于本发明的方法而言,由于不使用来源于动物的饲养细胞、血清,因此,得到的细胞的安全性高,适合临床应用。
此外,利用通过本发明的方法得到的集落(其包含由不同的外胚层系细胞种类构成的同心圆状的层),不仅能够制备角膜上皮细胞,而且还能够制备结膜上皮细胞、视网膜细胞、泪腺细胞等构成眼的各种细胞。
附图说明
图1是表示由人ips细胞向眼表上皮·角膜上皮细胞的分化诱导方法的路线的图。
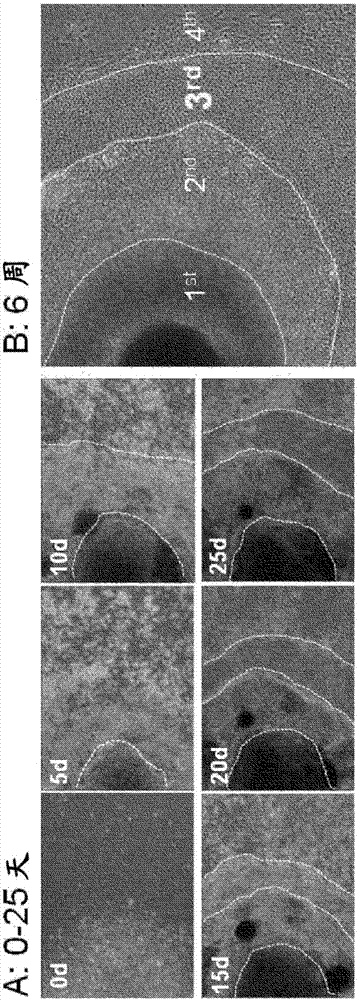
图2是表示由人ips细胞向眼表上皮·角膜上皮细胞的分化诱导步骤的图(a:自左上起,为第0天、第5天、第10天、第15天、第20天、第25天;b:6周)。
图3是表示由人ips细胞自主分化诱导而成的外胚层系细胞的各层中包含的细胞的特征的图(a:第1-3层的pax6、p63表达,b:第2-4层的pax6、p63表达,c:第1-3层的e-钙粘蛋白、p63表达,d:第1-3层的βiii-微管蛋白(tublin)、p63表达)。根据这些结果,仅在第3层中确认到p63和pax6均为阳性的眼表上皮细胞。
图4是表示由人ips细胞自主分化诱导而成的外胚层系细胞的各层中包含的细胞的特征的图(a:2层中的内层出现chx10阳性的神经视网膜细胞,外层出现mitf阳性的视网膜色素上皮细胞。b:在分化第2周左右,在预定为2层的区域出现p75、sox10均为阳性的神经嵴细胞,c:在分化第4周,在2-3层间出现晶状体细胞,观察到其经过分化诱导过程而广泛分散于2-3层部分中。
图5是表示由人ips细胞自主分化诱导而成的外胚层系细胞的各层中的标志物表达的图(第1层(1st):神经外胚层系列(sox2+、tubb3+、sox6+),第2层(2nd):神经嵴/视泡细胞系列(pax6+、sox10+、rx+),第3层(3rd):眼表外胚层系列(pax6+、p63+、e-钙粘蛋白+、k18),第4层(4th):表面外胚层系列(p63+、e-钙粘蛋白+、k18+)。
图6是表示分化诱导期间(1-12周)的角膜上皮相关标志物表达的图。
图7是表示小鼠眼发生(e9.5-18.5)时的角膜上皮相关标志物表达的图(pce:角膜上皮预定区域,osepi:眼表上皮,ce:角膜上皮,cs:角膜基质,lv:晶状体泡,le:晶状体,ac:前房,el:眼睑,ov:视泡)。
图8是表示在第3层组分(日文:画分)细胞的分化培养第12周时利用facs对角膜上皮前体细胞进行单独分离的图(p1:第1组分,p2:第2组分,p3:第3组分,p4:第4组分)。
图9是表示第2组分(p2)和第3组分(p3)中的角膜上皮标志物的表达的图。
图10是基于通过标志物表达而观察由人ips细胞分化诱导的角膜上皮细胞的特性的结果的图。在第3组分(p3)中确认到角膜上皮细胞,在第2组分(p2)中确认到结膜上皮和其他pax6阴性的复层上皮细胞。
图11是表示由人ips细胞分化诱导的角膜上皮细胞(来源于第3组分(p3))的成熟培养后的标志物表达的图。a:来源于人ips细胞的角膜上皮细胞呈现铺路石(日文:敷石)状的形态,复层化为3-4层。b:成熟培养后的细胞表达了对于角膜屏障功能而言必需的标志物zo-1、muc1、muc4、muc16。c:针对来源于人ips细胞的角膜上皮细胞进行了k14和k12的facs分析,结果,各自的阳性细胞约有99%、60%。
图12是表示将来源于人ips细胞的角膜上皮细胞片移植至家兔眼的结果的图。来源于人ips细胞的角膜上皮细胞片能够以片状进行回收(左)。移植后的狭缝(slit)观察中,根据荧光素染色(右上)及免疫组织化学分析(右下)可知,来源于人ips细胞的角膜上皮细胞片在移植后于角膜基质面上成活,并发挥角膜屏障功能。
图13是表示在角膜上皮培养用培养基中长期培养期间出现的结膜杯状细胞样细胞及泪腺样细胞。a:pas阳性、pax6阳性的细胞群体表达了作为结膜胚(杯状)细胞标志物的muc5ac、k7。b:将呈现腺样结构的细胞凝集体在matrigel中三维培养而得到的腺组织表达了作为泪腺·唾液腺的标志物的aqp5、ltf及muc7。
图14是表示眼周神经嵴细胞的诱导的图。a:由多层结构体诱导的细胞块表达了眼周神经嵴细胞标志物pitx2、ap2b。b:rt-pcr的结果,初始神经嵴标志物sox10经过4周而消失,然后,诱导了pitx2、foxc1等眼周神经嵴标志物的表达。
图15是表示利用由ips细胞诱导的角膜上皮前体细胞的阴性标志物(cd200)进行的单独分离的图。cd200阴性细胞中,作为ssea4阳性及itgβ4阳性细胞(p3组分)而单独分离的细胞形成复层,表达了k12、p63、pax6,显示出分化的角膜上皮细胞的特征。
具体实施方式
1.定义
以下,对本发明中使用的一些术语进行说明。
(1)多能干细胞
本发明涉及的所谓“多能干细胞”,包括所有具有分化多能性(能够分化为胎盘以外的所有细胞的性能)的细胞,除了es细胞、es细胞株以外,也包括ips细胞等人工多能干细胞。
所谓“人工多能干细胞”,是指通过向哺乳动物体细胞或未分化干细胞导入特定的因子来进行重编程(reprogramming)(初始化)、使其具有与es细胞同样的分化多能性而得到的细胞。
“人工多能干细胞”是由yamanaka等人通过向小鼠成纤维细胞导入oct3/4·sox2·klf4·c-myc这4个因子而首次建立的,被命名为“ips细胞(inducedpluripotentstemcell,诱导性多能干细胞)”(takahashik,yamanakas.,cell,(2006)126:663-676)。之后,通过将相同的4个因子导入人成纤维细胞,建立了人ips(takahashik,yamanakas.,etal.cell,(2007)131:861-872.;okita,k.,ichisaka,t.,andyamanaka,s.(2007).nature448,313-317.),此外,还成功确立了不包括c-myc的方法等(nakagawam,yamanakas.,etal.naturebiotechnology,(2008)26,101-106)因肿瘤形成诱导较低而安全性高的建立ips细胞的方法。
wisconsin大学的thomson等人成功建立了人工多能干细胞,所述细胞是通过向人成纤维细胞导入oct3/4、sox2、nanog、lin28这4个基因而制备的(yuj.,thomsonja.etal.,science(2007)318:1917-1920.)。另外,哈佛大学的daley等人报道了人工多能干细胞的建立,所述细胞是向皮肤细胞导入oct3/4、sox2、klf4、c-myc、htert、sv40larget这6个基因而制备的(parkih,daleygq.etal.,nature(2007)451:141-146)。
sakurada等人报道了下述人工多能干细胞:通过以存在于出生后的组织的未分化干细胞(而非体细胞)作为细胞源,导入oct3/4、sox2、klf4及c-myc等,从而更高效地被诱导(日本特开2008-307007)。
除此以外,还报道了下述细胞:向小鼠神经前体细胞等中导入oct3/4、klf4、低分子化合物而制备的人工多能干细胞(shiy.,dings.,etal.,cellstemcell,(2008)vol3,issue5,568-574);向内源性表达sox2、c-myc的小鼠神经干细胞导入oct3/4、klf4而制备的人工多能干细胞(kimjb.,scholerhr.,etal.,nature,(2008)454,646-650);不使用c-myc、而利用dnmt抑制剂、hdac抑制剂制备的人工多能干细胞(huangfud.,melton,da.,etal.,naturebiotechnology,(2008)26,no7,795-797)。
包括上述在内,作为涉及人工多能干细胞的已知专利,可举出日本特开2008-307007号、日本特开2008-283972号、us2008-2336610、us2009-047263、wo2007-069666、wo2008-118220、wo2008-124133、wo2008-151058、wo2009-006930、wo2009-006997、wo2009-007852等。
本发明中使用的“人工多能干细胞”符合本说明书开头记载的定义,在不损害本发明的目的的范围内,包括所有已知的人工多能干细胞及与其等同的人工多能干细胞,细胞源、导入因子、导入方法等没有特别限定。
优选地,细胞源来源于人(人类人工多能干细胞),更优选地,来源于需要利用由该细胞分化诱导的上皮系前体细胞·干细胞群或包括角膜上皮的上皮细胞群、表皮细胞群进行治疗的患者自身。
(2)外胚层系列细胞种类
人的胚胎在发生的阶段形成3个胚层,即内胚层、中胚层、外胚层。即形成内胚层、中胚层、外胚层。其中,内胚层形成胃、小肠的粘膜上皮、肝脏、胰腺等,中胚层形成肌肉、骨、血管、血液、皮下组织、心脏、肾脏等,外胚层形成神经、眼、表皮等。本发明涉及的“外胚层系列细胞种类”表示来源于外胚层的细胞系列类型,即,将来会形成中枢神经系统·感觉器官、表皮、眼的细胞。
作为“外胚层系列细胞种类”,可举出神经外胚层系列细胞、神经嵴系列细胞/眼胚系列细胞、眼表外胚层系列细胞、及表面外胚层系列细胞。
“神经外胚层系列细胞”是将来会分化为神经相关细胞的细胞,表征为sox2+、tubb3+、sox6+。
“神经嵴系列细胞”是会分化为末梢神经细胞、神经胶质细胞、色素细胞、角膜内皮细胞、角膜基质细胞等神经嵴相关细胞的细胞,表征为sox10阳性、pax6阴性。
“视杯系列细胞”是会分化为视网膜、视网膜色素上皮、虹膜色素上皮等视杯相关细胞的细胞,表征为rx+。
“眼表外胚层系列细胞”是会分化为角膜上皮、结膜上皮等眼表细胞的细胞,表征为pax6+、p63+、e-钙粘蛋白+。
(3)眼相关细胞
本发明涉及的所谓“眼相关细胞”,是来源于外胚层的形成眼的细胞,可举出角膜上皮细胞、视网膜色素上皮细胞、神经视网膜细胞、结膜上皮细胞、角膜缘上皮细胞、角膜内皮细胞、角膜基质细胞、虹膜基质细胞、巩膜细胞、虹膜色素上皮细胞、睫状体上皮细胞、视神经细胞、角膜缘下成纤维细胞、结膜下成纤维细胞、泪腺、睑板腺、杯状细胞、晶状体上皮细胞、及眼睑上皮细胞等。
(4)角膜上皮细胞及角膜上皮系前体细胞
角膜自表面起,具有角膜上皮层、角膜基质层、角膜内皮层这3层结构。“角膜上皮细胞”是构成该角膜的最外侧的层的细胞,由4~5层的角膜上皮细胞层构成。可以认为,“角膜上皮细胞”来源于表皮外胚层,而角膜的基质和内皮来源于神经嵴,分别存在独立的干细胞。本发明中,“角膜上皮细胞”的特征在于,除了pax6及p63以外,还表达作为角膜上皮分化标志物的角蛋白12。
所谓“角膜上皮前体细胞”,是未分化的角膜上皮细胞,其表征为pax6及p63的表达,而作为分化标志物的角蛋白12(k12)几乎不表达。
(5)细胞标志物
本发明中,为了鉴定分化诱导而成的细胞,利用对于各细胞种类具有特异性的标志物。以下,对代表性的标志物进行说明。
角蛋白14(cytokeratin14:k14):角蛋白14是基底上皮细胞的代表性标志物。
p63:p63是属于p53基因家族的细胞核蛋白质,也是上皮前体细胞·干细胞的代表性标志物,可在正常人表皮及毛囊基底细胞等中确认到其表达。
角蛋白12(cytokeratin12:k12):角蛋白12及角蛋白3是角膜上皮的代表性的特异性分化标志物。
pax6(pairedhomeobox-6):pax6是转录调控因子,与眼的形成有关,是角膜上皮、以及晶状体上皮、视网膜细胞的代表性标志物。
muc16(mucin16):muc16是一种膜结合型粘蛋白,在角膜上皮细胞中选择性表达,在眼表的粘蛋白层的维持及屏障功能发挥方面具有重要作用。
2.多能干细胞的自主分化
本发明中,首先使多能干细胞自主地分化,形成包含由各不相同的外胚层系细胞种类构成的同心圆状的层的集落。所谓“自主分化(自主地分化)”,是指细胞自行分化,而无需从外部接受分化诱导剂、分化诱导促进剂等的刺激。
(1)培养基
本发明中使用无血清培养基进行培养。所谓“无血清培养基”,是指不含有未调节或未纯化的血清的培养基,混合有经过纯化的来源于血液的成分、来源于动物组织的成分(例如,增殖因子)的培养基属于无血清培养基。
作为分化培养基的基础培养基,只要是dmem培养基、bme培养基、αmem培养基、无血清dmem/f12培养基、bgjb培养基、cmrl1066培养基、glasgowmem培养基、improvedmemzincoption培养基、imdm培养基、medium199培养基、eaglemem培养基、ham’s培养基、rpmi1640培养基、fischer’s培养基、mccoy’s培养基、williamse培养基等能够用于动物细胞的培养的培养基即可,可使用任意培养基,优选knockouttmdmem、medium154、stempro(注册商标)hescsfm等干细胞用培养基。
作为用于维持的基础培养基,更优选不含有来源于动物·人的成分的多能干细胞用培养基,作为这样的培养基,可使用mtesrtm1(日本bd公司)、stemfit(注册商标)等市售的培养基。
培养基可含有“血清替代物”。作为血清替代物,可举出例如白蛋白(例如,富脂白蛋白)、转铁蛋白、脂肪酸、胶原蛋白前体、微量元素(例如锌、硒)、b-27(注册商标)添加剂、n2添加剂、knockout血清替代物(ksr:invitrogen公司制)、2-巯基乙醇、3’-硫代甘油(3’-thiolglycerol)等。对于培养基中的浓度而言,b-27添加剂的情况下,为0.01~10重量%,优选为0.5~4重量%。
培养基中可适当添加细胞的维持增殖所必需的各种营养源、分化诱导所必需的各成分。例如,作为营养源,可含有甘油、葡萄糖、果糖、蔗糖、乳糖、蜂蜜、淀粉、糊精等碳源,以及,脂肪酸、油脂、卵磷脂、醇类等烃类、硫酸铵、硝酸铵、氯化铵、尿素、硝酸钠等氮源、食盐、钾盐、磷酸盐、镁盐、钙盐、铁盐、锰盐等无机盐类、磷酸二氢钾、磷酸氢二钾、硫酸镁、氯化钠、硫酸亚铁、钼酸钠、钨酸钠及硫酸锰、各种维生素类、氨基酸类等。
本发明中,由于多能干细胞自主分化为外胚层系细胞种类,因此,培养基无需含有bmp4(骨形态发生蛋白4)、转化生长因子、及激活素这样的分化诱导剂。即,培养基实质上不含有1种以上、优选为2种以上、更优选为全部的上述分化诱导剂。就bmp4而言,尽管其可以以低于0.5nm的程度被含有,但优选完全不含bmp4。
另外,培养基也无需含有高浓度视黄酸、bmp抑制剂、tgfβ抑制剂、及头蛋白等分化诱导促进剂。需要说明的是,所谓高浓度视黄酸,是指1μm、尤其是10μm左右的视黄酸。即,不含有1种以上、优选为2种以上、更优选为全部的上述分化诱导促进剂。此外,培养基也无需含有wnt、wnt信号激活剂、腱蛋白(chordin)等。
配合上述的成分而得到的培养基的ph为5.5~9.0,优选为6.0~8.0,更优选为6.5~7.5的范围。
(2)培养条件
本发明中,不使用饲养细胞地对多能干细胞进行二维培养。对于容器而言,只要是可用于细胞培养的容器即可,没有特别限定,可使用烧瓶、组织培养用烧瓶、皿、有盖培养皿(petridish)、组织培养用皿、多用途培养皿(multidish)、微板(microplate)、微孔板(microwellplate)、多孔板(multiplate)、多孔培养板(multiwellplate)、载玻片、腔室载玻片、培养皿、管、托盘、培养袋、及滚瓶。
对于容器的内表面而言,为了促进细胞的粘着、延伸,优选包被有选自胶原蛋白、纤连蛋白、层粘连蛋白或层粘连蛋白片段、玻连蛋白、基底膜基质、明胶、透明质酸、多聚赖氨酸、玻连蛋白、及透明质酸中的任意1种以上。其中,更优选使用层粘连蛋白、层粘连蛋白e8片段、层粘连蛋白511e8片段这样的层粘连蛋白片段。
培养在36℃~38℃、优选为36.5℃~37.5℃、1%~25%o2、1%~15%co2的条件下进行。
用于自主分化的培养时间最长为1周~8周、优选为2周~6周、更优选为3周~5周。
(3)集落形成
在不使用饲养细胞的情况下于无血清培养基中进行二维培养,得到的多能干细胞自主地分化,形成由外胚层系细胞种类构成的层状的集落。对于集落而言,自中心部起朝向周边部,包含由各不相同的外胚层系细胞种类构成的同心圆状的层,包括第1层(神经外胚层系列细胞(sox2+,tubb3+,sox6+))、第2层(神经嵴系列细胞/眼胚系列细胞(pax6+,sox10+,rx+))、第3层(眼表外胚层系列细胞(pax6+,p63+,e-钙粘蛋白+)、及第4层(表面外胚层系列细胞(p63+,e钙粘蛋白+))。
3.由集落向眼相关细胞的分化诱导
通过多能干细胞的自主分化而形成的集落包含由各不相同的外胚层系细胞种类构成的同心圆状的层,分为由第1层(神经外胚层系列细胞)、第2层(神经嵴系列细胞/眼胚系列细胞)、第3层(眼表外胚层系列细胞)、及第4层(表面外胚层系列细胞)构成的层状的细胞群。集落的各层中包含的细胞种类为不同的系列,因此,可以利用这一点,分离(单独分离)特定的层中包含的细胞,进行分化诱导,从而得到作为目标的眼相关细胞。
即,本发明提供眼相关细胞的制备方法,所述方法包括下述步骤:通过前项中记载的方法制备包含由各不相同的外胚层系细胞种类构成的同心圆状的层的集落,并从上述集落中分离特定的层中包含的细胞,将上述细胞分化诱导为眼相关细胞。
例如,结膜上皮细胞的情况下,与角膜上皮的情况同样地,由第三层细胞的眼表上皮细胞系列进行分化。在角膜上皮分化培养基中培养后,使用facs,可从作为ssea4阴性、itgb4阳性的细胞而被单独分离的细胞中单独分离作为pax6阳性、k13阳性、k12阴性的细胞的结膜上皮细胞。
视网膜色素上皮细胞是来源于神经外胚层的细胞,因此,分化诱导过程中能够在1-2层观察到具有色素的铺路石状上皮细胞。色素细胞可在显微镜下通过目视进行单独分离,并可将挑选(pick-up)的色素上皮集落在例如包被有明胶的培养皿上、于含有10%fbs的dmem等培养基中进行单独分离培养。
神经嵴细胞的情况下,在分化诱导的初期(2周左右)出现于第2层,因此,在2周以后,回收细胞,利用facs,可使用p75ntr及itga4等神经嵴细胞标志物进行单独分离。得到的神经嵴细胞可分化诱导为角膜内皮细胞。另外,初始神经嵴细胞可通过持续培养而被诱导为眼周神经嵴细胞。眼周神经嵴细胞可通过pitx2、foxc1等眼周神经嵴标志物的表达来确认。
4.由多能干细胞向角膜上皮细胞的分化诱导
能够分化为角膜上皮的上皮前体细胞存在于集落的第2层和第3层,尤其是角膜上皮前体细胞存在于第3层(眼表外胚层系列细胞)。因此,可将第3层的眼表外胚层系列细胞分化诱导为角膜上皮前体细胞,并将其单独分离,进行成熟培养,由此得到角膜上皮细胞。
具体而言,由多能干细胞自主分化而形成同心圆状的集落后,更换为含有生长因子的上皮用分化培养基并进行培养。由此,在第3层出现表征为pax6+、p63+、e-钙粘蛋白+的眼表上皮干细胞。
将该眼表上皮干细胞通过吹吸(pipetting)等而分离,进而在角膜上皮培养用培养基中培养,分化诱导为角膜上皮前体细胞。接下来,使用facs等单独分离角膜上皮前体细胞,进行成熟培养而得到角膜上皮细胞。
在分化诱导的任一步骤中,培养均利用无血清培养基进行,且不使用饲养细胞。以下,对培养基和培养条件进行说明。
(1)培养基
(1-1)上皮用分化培养基
为了促进向上皮系干细胞的分化,上皮用分化培养基含有kgf、rock抑制剂、bfgf、血清替代物等生长因子。基础培养基为自主分化中使用的dmem培养基、bme培养基、αmem培养基等能够用于上皮细胞的培养的培养基(无血清培养基)即可,可使用任意培养基。另外,优选knockouttmdmem、medium154、stempro(注册商标)hescsfm等干细胞用培养基、cnt20、cnt50、cnt-pr、ksfm等上皮细胞培养用培养基、或将它们混合而得到的培养基。后述的实施例中,将50%的自主分化用无血清培养基和50%的cnt20或cntpr混合而使用。
(1-2)角膜上皮培养用培养基
为了促进向角膜上皮前体细胞的分化诱导,角膜上皮培养用培养基可含有kgf、rock抑制剂、及血清替代物(例如,b27-添加剂(b27-supplement)等)。此外,也可含有fgf2、胰岛素、转铁蛋白。需要说明的是,所谓“rock抑制剂”,是指抑制rho激酶(rock:rho相关卷曲螺旋蛋白激酶(rho-associated,coiled-coilcontainingproteinkinase))的物质,可利用例如n-(4-吡啶基)-4β-[(r)-1-氨基乙基]环己烷-1α-甲酰胺(y-27632)、fasudil(ha1077)、(2s)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]六氢-1h-1,4-二氮杂卓(h-1152)、4β-[(1r)-1-氨基乙基]-n-(4-吡啶基)苯-1α-甲酰胺(1ゼンカルボアミド)(wf-536)、n-(1h-吡咯并[2,3-b]吡啶-4-基)-4β-[(r)-1-氨基乙基]环己烷-1α-甲酰胺(n-(1h-ピロロ[2,3-b]ピリジン-4-イル)-4per(r)-1-アミノエチル]シクロヘキサン-1ロヘカルボアミド)(y-30141)、n-(3-{[2-(4-氨基-1,2,5-噁二唑-3-基)-1-乙基-1h-咪唑并[4,5-c]吡啶-6-基]氧基}苯基)-4-{[2-(4-吗啉基)乙基]-氧基}苯甲酰胺(gsk269962a)、n-(6-氟-1h-吲唑-5-基)-6-甲基-2-氧代-4-[4-(三氟甲基)苯基]-3,4-二氢-1h-吡啶-5-甲酰胺(gsk429286a)。
作为基础培养基,可使用与上皮用分化培养基相同的培养基。
(1-3)成熟培养用培养基
对于角膜上皮而言,可使用上述的角膜上皮培养基进行复层化·成熟化,若在最后1周左右使用含有血清的成熟培养用培养基进行培养,则可进一步促进复层化、成熟化。上述成熟培养用培养基优选含有血清(根据需要)、kgf、rock抑制剂、胰岛素、转铁蛋白、硒。作为基础培养基,可使用与角膜上皮培养用培养基相同的培养基。
任一种培养基(上皮用分化培养基、角膜上皮培养用培养基、成熟培养用培养基)均可含有“血清替代物”。作为血清替代物,可举出前项中记载的那样的替代物,例如,白蛋白(例如,富脂白蛋白)、转铁蛋白、脂肪酸、胶原蛋白前体、微量元素(例如锌、硒)、b-27(注册商标)添加剂、n2添加剂等。对于培养基中的浓度而言,b-27添加剂的情况下为0.01~10重量%,优选为0.5~4重量%。
另外,培养基中可适当添加细胞的维持增殖所必需的各种营养源、分化诱导所必需的各成分。例如,作为营养源,可含有甘油、葡萄糖、果糖、蔗糖、乳糖、蜂蜜、淀粉、糊精等碳源;以及,脂肪酸、油脂、卵磷脂、醇类等烃类;硫酸铵、硝酸铵、氯化铵、尿素、硝酸钠等氮源;食盐、钾盐、磷酸盐、镁盐、钙盐、铁盐、锰盐等无机盐类;磷酸二氢钾、磷酸氢二钾、硫酸镁、氯化钠、硫酸亚铁、钼酸钠、钨酸钠及硫酸锰、各种维生素类、氨基酸类等。
(2)培养条件
任一个步骤均不使用饲养细胞地进行培养。对于容器而言,只要是可用于细胞培养的容器即可,没有特别限定,可使用烧瓶、组织培养用烧瓶、皿、有盖培养皿、组织培养用皿、多用途培养皿、微板、微孔板、多孔板、多孔培养板、载玻片、腔室载玻片、培养皿、管、托盘、培养袋、及滚瓶。
对于容器的内表面而言,为了促进细胞的粘着、延伸,优选包被有选自胶原蛋白、纤连蛋白、层粘连蛋白或层粘连蛋白片段、玻连蛋白、基底膜基质、明胶、透明质酸、多聚赖氨酸、玻连蛋白、及透明质酸中的任意1种以上。其中,更优选使用层粘连蛋白、层粘连蛋白e8片段、层粘连蛋白511e8片段这样的层粘连蛋白片段。
培养在36℃~38℃、优选为36.5℃~37.5℃、1%~25%o2、1%~15%co2的条件下进行。
对于培养时间而言,以分化诱导眼表上皮干细胞为目的、在上皮用分化培养基中的培养为至少1周~8周,优选为2周~6周,更优选为3周~5周。
以分化诱导角膜上皮前体细胞为目的、在角膜上皮培养用培养基中的培养为至少1周~12周,优选为1周~8周,更优选为2周~6周。
单独分离角膜上皮前体细胞后的角膜上皮培养用培养基中的复层化·成熟培养为至少4天,优选为1周以上,更优选为2周~3周。
(3)角膜上皮前体细胞的单独分离
对于角膜上皮前体细胞而言,可按照常规方法、使用针对各标志物的特异性抗体而容易地实施。例如,采用基于经抗体标记的磁珠、将抗体固相化的柱、利用经荧光标记的抗体的细胞分选仪(facs)的分离而进行单独分离即可。抗体可利用市售的抗体,也可按照常规方法制备。
例如,角膜上皮前体细胞可以以itgβ4及/或ssea4的表达作为指标,利用facs等简便地进行单独分离。优选的是,在基于itgβ4、ssea4的阳性选择之前,进行基于tra-1-60或cd200的阴性选择。需要说明的是,本发明中首次发现,ssea4及cd200能够用于角膜上皮前体细胞的单独分离。已知除了畸胎瘤、人的胚胎生殖细胞(eg)、人es细胞以外,ssea4(阶段特异性胚胎抗原4(stage-specificembryonicantigen-4))还在间充质干细胞、红细胞等中表达。由于ssea4在人es细胞中的表达伴随分化而降低,因此,其广泛应用于利用人es细胞分化监控进行的评价。对于cd200而言,迄今为止其在多能干细胞中表达、在角膜上皮中不表达等情况都是未知的,是能够以比已知的tra-1-60更宽泛的范围除去杂质的极其优异的标志物。
若在角膜上皮培养用培养基中持续培养角膜上皮前体细胞,则能够分化为结膜杯状细胞及泪腺细胞。结膜杯状细胞可通过作为结膜胚细胞标志物的muc5ac、k7的表达来确认。泪腺细胞可通过作为泪腺·唾液腺的标志物的aqp5、ltf、muc7的表达来确认,通过进行三维培养,可构建腺组织。
(4)角膜上皮细胞的特性
通过对角膜上皮前体细胞进行成熟培养,可得到能够进行移植的、复层化的角膜上皮细胞。得到的角膜上皮细胞为k12、pax6、及p63阳性,并且,在体外及体内与来源于体细胞的角膜上皮细胞同样地作为角膜上皮细胞而发挥功能。本发明还提供由上述k12、pax6、及p63表征的、来源于多能干细胞、尤其是人工多能干细胞的功能性角膜上皮细胞。
5.向再生医疗方面的利用
5.1细胞制剂
利用本发明的方法得到的神经外胚层系列细胞、神经嵴系列细胞/眼胚系列细胞、眼表外胚层系列细胞、及表面外胚层系列细胞、或由上述细胞分化诱导成的眼相关细胞自身可用作研究、再生医疗或后述的细胞制剂的原料。
本发明的细胞制剂也可含有辅助细胞的维持·增殖、向患部的施予的支持材料、成分、其他医药上可允许的载体。作为细胞的维持·增殖所必需的成分,可举出碳源、氮源、维生素、矿物质、盐类、各种细胞因子等培养基成分、或matrigeltm等细胞外基质配制品。
作为辅助向患部的施予的支持材料、成分,可举出:生物降解性高分子,例如,胶原蛋白、聚乳酸、透明质酸、纤维素、及它们的衍生物、以及由其中2种以上形成的复合体;注射用水溶液,例如生理盐水、培养基、pbs等生理缓冲液、含有葡萄糖、其他的辅助剂的等渗溶液(例如d-山梨糖醇、d-甘露糖、d-甘露糖醇、氯化钠)等,可并用适当的助溶剂,例如醇,具体而言为乙醇、多元醇、例如丙二醇、聚乙二醇、非离子性表面活性剂、例如聚山梨醇酯80、hco-50等。
除此以外,根据需要,也可含有医药上可允许的有机溶剂、聚乙烯醇、聚乙烯吡咯烷酮、羧基乙烯基聚合物、羧甲基纤维素钠、聚丙烯酸钠、海藻酸钠、水溶性葡聚糖、羧甲基淀粉钠、果胶、甲基纤维素、乙基纤维素、黄原胶、阿拉伯胶、酪蛋白、琼脂、聚乙二醇、二甘油、甘油、丙二醇、凡士林、石蜡、硬脂醇、硬脂酸、甘露糖醇、山梨糖醇、乳糖、作为医药添加物被允许的表面活性剂、缓冲剂、乳化剂、混悬剂、镇痛剂、稳定剂等。
实际的添加物可根据本发明的治疗剂的剂型而从上述之中单独或适当组合地选择,但不限于这些添加物。例如,用作注射用制剂的情况下,可将经过纯化的抗体溶解于溶剂、例如生理盐水、缓冲液、葡萄糖溶液等,并向其中添加抗吸附剂、例如吐温(tween)80、吐温20、明胶等,使用得到的制剂。
作为能够成为本发明的细胞制剂的对象的疾病,可举出例如史-约综合征(stevens-johnsonsyndrome)、眼类天疱疮、热·化学外伤、无虹膜症、salzmann角膜变性症、特发性角结膜上皮症、沙眼后瘢痕、角膜穿孔、角膜周边部溃疡、准分子激光治疗后的角膜上皮剥离。
5.2培养角膜细胞片
可使通过本发明的方法得到的上皮系前体细胞群、及/或由所述细胞群分化诱导而成的角膜上皮细胞群形成复层,从而制备培养角膜上皮细胞片。
利用本发明的方法,能够在不使用饲养细胞的情况下,使用无血清培养基,简便地得到复层化的、片状的角膜上皮细胞。得到的细胞保持角蛋白12、pax6、muc16这样的角膜上皮细胞特异性标志物,具有与来源于体细胞的角膜上皮细胞同样的功能。另外,由于在不使用来源于动物的饲养细胞、血清的情况下进行制备,因此,安全性高,适合临床应用。本发明还提供由上述k12、pax6、及muc16阳性表征的、来源于多能干细胞、尤其是人工多能干细胞的功能性复层化角膜上皮细胞片及其制备方法。
实施例
以下,通过实施例更详细地说明本发明,但本发明不限于这些实施例。
实施例1:由人ips细胞向眼表上皮·角膜上皮细胞的分化诱导
利用人ips细胞,在不使用饲养细胞的情况下于无血清培养基中分化诱导为眼表上皮·角膜上皮细胞。分化诱导方法的路线示于图1。
人ips细胞使用201b7细胞株(向成纤维细胞导入oct3/4、ox2、c-myc、klf4而制备的ips细胞株),使用stemfit(味之素公司制),将细胞以200~1500个细胞/cm2、300~1000个细胞/cm2、450~700个细胞/cm2的接种密度接种于包被有层粘连蛋白511e8片段的6孔板上,培养7~13天。
将培养基更换为分化培养基(含有10%ksr、1mm丙酮酸钠、0.1mm非必需氨基酸、55μm硫代甘油的gmem),然后每2、3天一次地更换为新鲜的分化培养基,培养约4周。
第4周以后,将培养基更换为含有生长因子的上皮用分化培养基,继续培养4周。在更换为上皮用分化培养基(50%的含有20ng/mlkgf、5ng/mlfgf2、10μmy27632的分化培养基和50%的cnt20(或cntpr;不含egf/fgf2(cellntec公司))后2~3周左右的时间点,通过吹吸操作而除去非上皮性细胞,由此选择性地仅培养第3层的眼表上皮细胞。4周的培养之后,更换为角膜上皮培养用培养基并培养4周,然后利用facs单独分离角膜上皮前体细胞。将单独分离的角膜上皮前体细胞在角膜上皮培养用培养基(含有20ng/mlkgf、10μmy27632、2%b27-添加剂的dmem/f12(2:1))中进一步培养2~3周,制备复层化的培养角膜上皮细胞片。需要说明的是,根据需要,也可在角膜上皮培养用培养基中培养1~2周之后,更换为含有血清的成熟培养用培养基(含有20ng/mlkgf、10μmy27632、胰岛素、转铁蛋白、硒及5%fbs的dmem/f12(3:1)),进行1周左右的培养,由此制备同样的培养角膜上皮细胞片。
在分化培养4周左右时,可诱导以多层状被观察到的外胚层系列的细胞,并形成了包含由各不相同的外胚层系细胞种类构成的同心圆状的层的集落(图2)。
对构成集落的各层的细胞的特性进行了调查(图3)。集落以层状的形式分化为同心圆状,各层中存在不同系列的细胞。即,1~3层为pax6阳性,3~4层为p63、e-钙粘蛋白阳性,tubb3在1~2层中为阳性。
在第2层的内层出现chx10阳性的神经视网膜细胞,自外层出现mitf阳性的视网膜色素上皮细胞,通过挑选并进行培养,可将其作为具有色素的铺路石状细胞而单独分离。在分化初期(第2周),神经嵴细胞作为p75、sox10均为阳性的细胞而出现于2层部分(图4)。确认到在2~3层之间出现表达α晶状体蛋白(crystallin)的晶状体细胞(4周、6周)(图4)。
利用rt-pcr调查了各层中的标志物表达(图5)。自第三层起出现成为角膜上皮的起源的眼表上皮外胚层(pax6+、p63+、ecad+)。
此外,通过免疫染色确认了分化诱导期间的角膜上皮相关标志物(k12、k14、p63、pax6)的表达模式(分化1~12周)(图6),结果,其与小鼠眼发生(e9.5-18.5)时的角膜上皮相关标志物表达(图7)极为相似,确认到由ips细胞向眼表上皮·角膜上皮的诱导经由与实际的角膜发生过程相同的过程而进行。
由以上可以确认,利用本培养方法,能够以模拟生理性发生过程的方式由人多能干细胞诱导包括眼表上皮细胞的与眼相关的细胞群(视网膜、晶状体、神经嵴细胞等)。
实施例2:由人ips细胞向角膜上皮前体细胞的分化诱导
针对按照实施例1、经由人ips细胞的自主分化(4周)而形成的同心圆状的集落,在第4周以后更换为含有生长因子的上皮用分化培养基,通过吹吸在第3层出现的眼表上皮干细胞来除去非上皮性细胞,由此进行单独分离。此外,在第8周以后,更换为角膜上皮培养用培养基,进行向角膜上皮前体细胞的分化诱导。
在分化诱导约第12周,使用tra-1-60、ssea4及itgb4等细胞表面标志物实施了facs(图8)。确认到角膜上皮前体细胞可基于tra-1-60、ssea4及itgb4表达而进行单独分离,另外,tra-1-60阴性细胞中,可被选择性识别为itgb4阳性、ssea4阳性(p3组分)及itgb4阳性、ssea4阴性(p2组分)(图8右)。
此外,由免疫染色的结果可知,p3组分的细胞表达角膜上皮特异性标志物,另一方面,粘膜上皮、皮肤上皮标志物的表达水平低(图9)。由此可确认,p3组分中单独分离出了角膜上皮细胞,而p2组分中包含结膜上皮、其他的复层上皮细胞(图10)。
使用角膜上皮培养用培养基对从p3组分单独分离的细胞进行2~3周的成熟培养,由此得到复层化的角膜上皮细胞。免疫染色的结果显示,得到的细胞表达了角膜屏障功能所必需的标志物zo-1、muc1、muc4、muc16(图11b)。另外,facs分析的结果显示,k14阳性细胞纯度为约99%,角膜上皮分化标志物k12的阳性率为约60%(图11c)。
实施例3:来源于人ips细胞的角膜上皮细胞片向家兔眼的移植
通过角膜切除手术除去家兔的角膜缘整周的上皮细胞层,制备家兔角膜上皮干细胞缺乏症模型。然后,移植以片状回收的来源于人ips细胞的角膜上皮细胞片。
(1)眼表观察图像
在移植后第7天,片移植组中保持了角膜透明性,荧光素染色显示屏障功能已恢复。另一方面,对照眼中大部分被荧光素染色,依然处于屏障功能障碍的状态(图12中)。
(2)移植后的来源于人ips细胞的角膜上皮细胞片
在术后第7天实施安乐死,摘出眼球后在10%中性缓冲福尔马林溶液中进行化学固定。然后通过苏木精&曙红染色观察角膜组织。来源于人ips细胞的角膜上皮细胞片在移植至动物眼后也得以在角膜基质面上成活。在使用了冷冻切片的免疫染色分析中,利用抗人(h2b)抗体,确认了在家兔眼中成活的上皮层来源于人ips细胞,并表达k12、pax6、p63、muc16,保持了角膜上皮的性质(图12右)。
实施例4:由人ips细胞向结膜胚细胞样细胞及泪腺样细胞的分化诱导
针对按照实施例1、经由人ips细胞的自主分化(4周)而形成的同心圆状的集落,在第4周以后更换为含有生长因子的上皮用分化培养基,通过吹吸在第3层出现的眼表上皮干细胞来除去非上皮性细胞,由此进行单独分离。进而,在第8周以后,更换为角膜上皮培养用培养基,实施向角膜上皮前体细胞的分化诱导。
角膜上皮前体细胞的分化诱导后,进一步地每2~3天更换一次培养基,同时在角膜上皮培养用培养基中继续培养。在自分化诱导起约第12周,在角膜上皮培养用培养基中,上皮样细胞群体中出现了pas阳性、pax6阳性的细胞群体。由pas染色及免疫染色的结果确认到,这些细胞表达了作为结膜胚(杯状)细胞标志物的muc5ac、k7(图13a)。
同样地,在角膜上皮细胞的分化诱导后,在更换培养基的同时,在角膜上皮培养用培养基中持续培养。在自分化诱导起约第12周,在角膜上皮培养用培养基中出现了呈现腺样结构的细胞凝集体。在显微镜下采集这样的腺样组织,使用含有5%的fbs、egf及wnt3awp的kcm培养基或含有2%的b27的dmem/f12培养基,在matrigel(注册商标)中进行三维培养,结果,经过约25天生长为腺组织。通过将该腺组织免疫染色,确认到作为泪腺·唾液腺的标志物的aqp5、ltf、muc7、pax6及sox9的表达(图13b)。
由以上结果可确认,由人多能干细胞诱导的眼表上皮干·前体细胞不仅能够分化为角膜上皮,而且也能够分化为被认为与角膜上皮具有相同发生起源的结膜上皮细胞、结膜杯状细胞及泪腺细胞。
实施例5:由人ips细胞向眼周神经嵴细胞的分化诱导
按照实施例1而使人ips细胞在分化培养基中自主地分化(4周),分化诱导为同心圆状的集落(多层结构体)。在自分化诱导起第3周,以第2层为中心地诱导得到pitx2阳性、ap2b阳性的细胞块(眼周神经嵴细胞)。
在向分化培养基中添加egf、fgf2(1-3周)、低浓度(0.5μm)的视黄酸(2-3周)而得到的培养基中进行培养时,也能够诱导细胞块。
利用rt-pcr,在分化培养开始起第9天、第14天、第21天、第28天、第35天对标志物基因的表达进行确认。结果,确认到初始神经嵴标志物sox10经过4周而消失,然后,诱导了pitx2、foxc1等眼周神经嵴标志物的表达。由此,暗示了来源于人ips细胞的初始神经嵴细胞被诱导为眼周神经嵴细胞。
由以上结果可确认,使用由通过本发明而诱导的包含由外胚层系细胞种类构成的同心圆状的层的集落,能够诱导神经嵴细胞、以及作为角膜内皮、虹膜基质细胞的发生起源的眼周神经嵴细胞。另外,可以认为,通过向分化培养基中添加egf、fgf及低浓度(0.5μm)的视黄酸,第2层的视网膜细胞的生长得以被促进,进而,通过施加视黄酸信号,眼周神经嵴细胞的诱导得以被促进。可以认为,对于眼周神经嵴的发生而言,来源于视网膜细胞的视黄酸信号是重要的,而本培养体系模拟了这样的发生。
实施例6:由人ips细胞诱导的角膜上皮前体细胞的单独分离
按照实施例1而使人ips细胞在分化培养基中自主地分化,分化诱导为同心圆状的集落(多层结构体)。在自分化诱导起第14周,以cd200、ssea4、itgβ4作为细胞表面标志物,实施了facs。
可通过设门(gating)而除去cd200阳性细胞,并在cd200阴性细胞中单独分离ssea4阳性、itgβ4阳性的细胞(p3组分)作为角膜上皮前体细胞。单独分离的细胞形成了复层,并表达k12、p63、pax6,显示出了分化的角膜上皮细胞的特征(图15)。
由以上结果确认到,由ips细胞诱导的角膜上皮前体细胞可使用cd200、ssea4、itgβ4而进行纯化。对于cd200而言,迄今为止其在多能干细胞中表达、在角膜上皮中不表达等情况都是未知的,可以认为其是能够以比已知的tra-1-60更宽泛的范围除去杂质的极其优异的标志物。
产业上的可利用性
根据本发明,可得到能够进行移植、复层化的功能性且高纯度的角膜上皮细胞。由于本发明的方法不使用来源于动物的饲养细胞、血清,因此,得到的细胞的安全性高,适合临床应用。此外,根据本发明的方法,不仅能够由人ips细胞等多能干细胞制备角膜上皮,而且也能够制备构成结膜上皮等眼表的各种细胞。
将本说明书中引用的全部刊物、专利及专利申请直接作为参考并入本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!