III型分泌系统靶向分子的制作方法
相关申请
本申请要求2015年5月1日提交的美国临时申请no.62/155967和2015年11月13日提交的美国临时申请no.62/254992的权益,其各自的内容通过参照以其整体结合于此。
发明领域
本发明主要涉及特异性结合革兰氏阴性细菌的iii型分泌系统的细菌v-tip蛋白例如来自铜绿假单胞菌(pseudomonasaeruginosa)的pcrv的分子。更具体而言,本发明涉及阻断或以其它方式抑制效应分子注射到靶细胞中的分子。本发明的分子是单特异性的或多特异性的,并能以单价或多价方式结合其靶抗原。在一些实施方案中,这些抗体可与结合假单胞菌属(pseudomonas)蛋白opri的细菌表面靶向组分组合。本发明还主要涉及特异性结合细菌细胞表面蛋白例如opri的分子和在多种治疗、诊断和/或预防性适应症中使用这些分子的方法。
发明背景
铜绿假单胞菌的v-tip蛋白(pcrv)是能够注射毒性效应分子到真核细胞中的细菌iii型分泌系统(t3ss)的必要组分。v-tip蛋白位于t3ss机构的最末端,且寡聚化被认为是效应分子跨靶细胞膜的功能性易位(translocalization)所必需的。
opri是铜绿假单胞菌和其他假单胞菌属物种的外膜脂蛋白。opri在铜绿假单胞菌菌株中高度保守,因此代表假单胞菌属细菌的细胞表面靶向的优异的候选物。
因此,需要靶向革兰氏阴性细菌的v-tip蛋白和细胞表面组分例如opri的组合物和治疗。
发明概述
本公开文本提供结合革兰氏阴性细菌的iii型分泌系统的细菌v-tip蛋白(例如来自铜绿假单胞菌的pcrv)和/或细胞表面蛋白(例如铜绿假单胞菌的opri蛋白)的分子(例如多肽,包括抗体、抗原结合性抗体片段、抗体样多肽和/或融合多肽)和组合物,以及在多种治疗、诊断和/或预防性适应症中制备和使用这些组合物的方法。本发明的v-tip蛋白靶向分子是单特异性的或多特异性的,并能以单价或多价方式结合其靶抗原。
这些分子可用于结合和中和或以其他方式抑制革兰氏阴性细菌的iii型分泌系统的一种或多种细菌v-tip蛋白的至少一种生物活性。
铜绿假单胞菌和其他耐药革兰氏阴性细菌是一个大的卫生问题,引起社区获得性感染和医院内感染。感染这样的细菌可为严重且致命的。一个重要的致病因子是3型分泌系统(t3ss)。革兰氏阴性细菌的t3ss造成毒素易位到真核细胞中,引起细胞死亡和溶解,从而使细菌建立感染。
铜绿假单胞菌的pcrv是许多革兰氏阴性细菌t3ss所共同的v-tip蛋白的实例。v-tip蛋白位于t3ss机构的最末端,且寡聚化被认为是效应分子跨靶细胞膜的功能性易位所必需的。铜绿假单胞菌的pcrv对于注射效应分子(exos、exot、exou和exoy)到真核细胞胞质溶质中是所需的,导致细胞死亡和溶解。铜绿假单胞菌的pcrv已显示是保护性抗原,表明靶向众多革兰氏阴性细菌的v-tip蛋白将提供有效的治疗选项。
在一些实施方案中,v-tip蛋白靶向分子是抗体和抗体样分子,其特异性结合革兰氏阴性细菌的3型分泌系统(t3ss)机构的v-tip蛋白和阻断对真核细胞的细胞毒性。在一些实施方案中,被称为v-tip蛋白结合蛋白(vpbp)的v-tip蛋白靶向抗体衍生自抗体或抗原结合性抗体片段,包括例如单链可变片段(scfv)、fab片段、单域抗体(sdab)、vnar或vhh。在优选实施方案中,vpbp是人或人源化sdab。sdab片段可衍生自vhh、vnar、工程改造的vh或vk结构域。vhh可产生自骆驼仅重链抗体。vnar可产生自软骨鱼仅重链抗体。已应用各种方法从常规异二聚vh和vk结构域产生单体sdab,包括界面工程(interfaceengineering)和选择特异性种系家族。
在其他实施方案中,vpbp衍生自非抗体支架蛋白,例如但不限于设计的锚蛋白重复序列蛋白(darpin)、亲和体(avimer)、anticalin/脂质运载蛋白(lipocalin)、centyrin和fynomer。
在优选实施方案中,v-tip蛋白是铜绿假单胞菌pcrv或衍生自铜绿假单胞菌pcrv,和vpbp特异性结合pcrv。在一些实施方案中,vpbp能够结合多种革兰氏阴性细菌的2种或更多种vpbp,至少包括来自铜绿假单胞菌的pcrv。在一些实施方案中,vpbp结合来自单一革兰氏阴性细菌物种的v-tip蛋白,例如来自铜绿假单胞菌的pcrv。在一些实施方案中,vpbp结合来自多于一种革兰氏阴性细菌物种的v-tip蛋白,至少包括来自铜绿假单胞菌的pcrv,并因而被认为是物种交叉反应性的。
在一些实施方案中,v-tip蛋白靶向分子是融合蛋白。出乎意料地发现,增强vpbp的效价极大地增强在体外和体内免于铜绿假单胞菌的细胞保护功效。更出乎意料地发现,用单一多特异性融合蛋白中的不同vpbp靶向pcrv上两个不同表位产生甚至更大的免于由铜绿假单胞菌引起的细胞毒性的保护。后一发现结果甚至在个体的单特异性vpbp仅为弱保护性时也适用。事实上发现,当识别pcrv上不同表位的vpbp被掺入单一融合蛋白中时,与对于pcrv上的相同表位为多价的含vpbp融合蛋白相比或与两种分开的各自识别pcrv上不同表位的单特异性含vpbp融合蛋白的组合相比,它们在细胞保护方面更有效力。
在一些实施方案中,本发明包含掺入有多于一个vpbp的融合蛋白,本文称为多价。在一些实施方案中,融合蛋白的vpbp识别靶v-蛋白上的相同表位,本文称为单特异性-多价。在其他实施方案中,融合蛋白的vpbp识别靶v-蛋白上的不同表位,本文称为多特异性-多价。在一些实施方案中,含vpbp融合蛋白包含两个vpbp,并具有对靶v-tip蛋白的二价结合能力。在一些实施方案中,含vpbp融合蛋白包含三个vpbp,并具有对靶v-tip蛋白的三价结合能力。在一些实施方案中,含vpbp融合蛋白包含四个vpbp,并具有对靶v-tip蛋白的四价结合能力。在一些实施方案中,含vpbp融合蛋白包含六个vpbp,并具有对靶v-tip蛋白的六价结合能力。在一些实施方案中,含vpbp融合蛋白包含八个vpbp,并具有对靶v-tip蛋白的八价结合能力。在这些实施方案中,掺入到本发明融合蛋白中的vpbp可为单特异性的或多特异性的。
一般地,本发明融合蛋白由经接头多肽有效连接的至少两个或更多个vpbp构成。在本发明融合蛋白中使用sdab片段作为特异性vpbp具有避免许多双/多特异性抗体方法所共有的重链:轻链错误配对问题的益处。此外,本发明融合蛋白避免使用许多双特异性抗体所必需的长接头。此外,本发明融合蛋白大小(大约75~125kda)通常小于常规抗体。与常规抗体相比,该减小的分子量可使得能够更好地穿透到感染位点中。
在一些实施方案中,本发明融合蛋白由单一多肽组成。在其他实施方案中,本发明融合蛋白由多于一个多肽组成。例如,其中异二聚化结构域被掺入到融合蛋白中以构建不对称融合蛋白。例如,如果免疫球蛋白fc区被掺入到融合蛋白中,ch3结构域可用作均二聚化结构域,或ch3二聚体界面区可突变以实现异二聚化。
在一些实施方案中,融合蛋白在相对的末端含有vpbp。例如,vpbp既位于融合蛋白的氨基末端(n末端)部分,又位于融合蛋白的羧基末端(c末端)部分。在其他实施方案中,所有vpbp存在于融合蛋白的相同末端。例如,vpbp存在于融合蛋白的氨基或羧基末端部分。
在一些实施方案中,融合蛋白没有fc区。
在一些实施方案中,融合蛋白含有免疫球蛋白fc区。在一些实施方案中,免疫球蛋白fc区是选自igg1亚类、igg2亚类、igg3亚类和igg4亚类的igg同种型。
在一些实施方案中,免疫球蛋白fc区或其免疫活性片段是igg同种型。例如,融合蛋白的免疫球蛋白fc区属于人igg1亚类,具有下述氨基酸序列:
在一些实施方案中,免疫球蛋白fc区或其免疫活性片段包含与seqidno:1的氨基酸序列具有至少50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的人igg1多肽序列。
在一些实施方案中,人igg1fc区在氨基酸asn297(加框,kabat编号)处被修饰以防止融合蛋白的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,融合蛋白的fc区在氨基酸leu235(加框,kabat编号)处被修饰以改变fc受体相互作用,例如leu235glu(l235e)或leu235ala(l235a)。在一些实施方案中,融合蛋白的fc区在氨基酸leu234(加框,kabat编号)处被修饰以改变fc受体相互作用,例如leu234ala(l234a)。在一些实施方案中,融合蛋白的fc区在第234和235位氨基酸处被改变,例如leu234ala和leu235ala(l234a/l235a)或leu234val和leu235ala(l234v/l235a)。在一些实施方案中,融合蛋白的fc区没有以下位置的一个或多个处的氨基酸以降低fc受体结合:glu233(e233,seqidno:1中加粗)、leu234(l234)或leu235(l235)。在一些实施方案中,融合蛋白的fc区在gly235处被改变以降低fc受体结合。例如,其中gly235从融合蛋白中缺失。在一些实施方案中,人igg1fc区在氨基酸gly236处被修饰以增强与cd32a的相互作用,例如gly236ala(g236a,seqidno:1中加框)。在一些实施方案中,人igg1fc区没有lys447,其对应于seqidno:1的第218位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引(euindex))。
在一些实施方案中,融合蛋白的免疫球蛋白fc区或免疫活性片段属于人igg2亚类,具有下述氨基酸序列:
在一些实施方案中,融合蛋白或其免疫活性片段包含与seqidno:2的氨基酸序列具有至少50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的人igg2多肽序列。
在一些实施方案中,人igg2fc区在氨基酸asn297(加框)处被修饰以防止抗体的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,人igg2fc区没有lys447,其对应于seqidno:2的第217位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,融合蛋白的免疫球蛋白fc区或免疫活性片段属于人igg3亚类,具有下述氨基酸序列:
在一些实施方案中,抗体或其免疫活性片段包含与seqidno:3的氨基酸序列具有至少50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的人igg3多肽序列。
在一些实施方案中,人igg3fc区在氨基酸asn297(加框,kabat编号)处被修饰以防止抗体的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,人igg3fc区在第435位氨基酸处被修饰以延长半衰期,例如arg435his(r435h,seqidno:3中加框)。在一些实施方案中,人igg3fc区没有lys447,其对应于seqidno:3的第218位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,融合蛋白的免疫球蛋白fc区或免疫活性片段属于人igg4亚类,具有下述氨基酸序列:
在一些实施方案中,抗体或其免疫活性片段包含与seqidno:4的氨基酸序列具有至少50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的人igg4多肽序列。
在其他实施方案中,人igg4fc区在第235位氨基酸片被修饰以改变fc受体相互作用,例如leu235glu(l235e)。在一些实施方案中,人igg4fc区在氨基酸asn297(kabat编号)处被修饰以防止抗体的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,人igg4fc区没有lys447,其对应于seqidno:4的第218位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,人iggfc区被修饰以增强fcrn结合。增强与fcrn的结合的fc突变的实例有met252tyr、ser254thr、thr256glu(分别为m252y、s254t、t256e)(kabat编号,dall’acqua等2006,j.biolchemvol281(33)23514–23524)、met428leu和asn434ser(m428l、n434s)(zalevsky等2010naturebiotech,vol28(2)157-159)、met252ile、thr256asp、met428leu(分别为m252i、t256d、m428l)或met252tyr、met428leu/val(分别为m252y、m428l/v)(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。met252对应于seqidno:1、3和4中的第23位残基和seqidno:2中的第22位残基。ser254对应于seqidno:1、3和4中的第25位残基和seqidno:2中的第24位残基。thr256对应于seqidno:1、3和4中的第27位残基和seqidno:2中的第26位残基。met428对应于seqidno:1、3和4中的第199位残基和seqidno:2中的第198位残基。asn434对应于seqidno:1、3和4中的第205位残基和seqidno:2中的第204位残基。
在本发明融合蛋白包含fc多肽的一些实施方案中,fc多肽是突变的或被修饰的。在这些实施方案中,突变的或修饰的fc多肽包含下述突变:met252tyr和met428leu(m252y、m428l),使用kabat编号系统。
在一些实施方案中,人iggfc区被修饰以改变抗体依赖性细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc),例如见述于以下文献的氨基酸修饰:natsume等,2008cancerres,68(10):3863-72;idusogie等,2001jimmunol,166(4):2571-5;moore等,2010mabs,2(2):181-189;lazar等,2006pnas,103(11):4005–4010,shields等,2001jbc,276(9):6591–6604;stavenhagen等,2007cancerres,67(18):8882-8890;stavenhagen等,2008advan.enzymeregul.,48:152-164;alegre等,1992jimmunol,148:3461-3468;kanekoandniwa,2011biodrugs,25(1):1-11。增强adcc的突变实例包括在ser239和ile332处的修饰,例如ser239asp和ile332glu(s239d、i332e)。增强cdc的突变实例包括在以下残基处的修饰:lys326,其对应于seqidno:1、3和4的第97位残基和seqidno:2的第96位残基;和glu333,其对应于seqidno:1、3和4的第104位残基和seqidno:2的第103位残基。在一些实施方案中,fc区在这些位置的一个或两个处被修饰,例如lys326ala和/或glu333ala(k326a和e333a),使用kabat编号系统。
在一些实施方案中,人iggfc区被修饰以诱导异二聚化。例如,在ch3结构域内thr366处具有氨基酸修饰,在thr366被体积更大的氨基酸例如try置换时(t366w),其能够优先与在以下位置处具有体积更小的氨基酸的氨基酸修饰的第二ch3结构域配对:thr366,其对应于seqidno:1、3和4的第137位残基和seqidno:2的第136位残基;leu368,其对应于seqidno:1、3和4的第139位残基和seqidno:2的第138位残基;和tyr407,其对应于seqidno:1、3和4的第178位残基和seqidno:2的第177位残基,例如分别为ser、ala和val(t366s/l368a/y407v)。经由ch3修饰的异二聚化可进一步通过引入二硫键稳定,例如通过改变相对的ch3结构域上的ser354(其对应于seqidno:1、3和4的第125位残基和seqidno:2的第124位残基)为cys(s354c)和y349(其对应于seqidno:1、3和4的第120位残基和seqidno:2的第119位残基)为cys(y349c)(综述于carter,2001journalofimmunologicalmethods,248:7–15)。在一些的这些实施方案中,fc区可在异二聚体的一个成员上的蛋白-a结合位点处被修饰,以便防止蛋白-a结合和从而实现更有效地纯化异二聚体融合蛋白。该结合位点内的示例性修饰为ile253,其对应于seqidno:1、3和4的第24位残基和seqidno:2的第23位残基,例如ile253arg(i253r)。例如,i253r修饰可与t366s/l368a/y407v修饰组合或与t366w修饰组合。t366s/l368a/y407v修饰的fc能够形成均二聚体,因为不存在t336w修饰的fc情况下存在的二聚化界面的立体障碍。因此,在优选实施方案中,i253r修饰与t366s/l368a/y407v修饰的fc组合以不允许纯化可能已形成的任何均二聚体fc。
在一些实施方案中,人iggfc区被修饰以防止二聚化。在这些实施方案中,本发明融合蛋白为单体的。例如,在残基thr366处修饰成带电残基(例如thr366lys、thr366arg、thr366asp或thr366glu(分别为t366k、t366r、t366d或t366e))防止ch3-ch3二聚化。
在一些实施方案中,融合蛋白含有衍生自免疫球蛋白铰链区的多肽。铰链区可选自任何人igg亚类。例如,融合蛋白可含有修饰的igg1铰链,其具有序列epkssdkthtcppc(seqidno:5),其中与轻链的c末端半胱氨酸形成二硫键的cys220突变成丝氨酸,例如cys220ser(c220s)。在其他实施方案中,融合蛋白含有截短的铰链,其具有序列dkthtcppc(seqidno:6)。在一些实施方案中,融合蛋白具有修饰的来自igg4的铰链,其被修饰以防止或降低链交换,例如,ser228pro(s228p),具有序列eskygppcppc(seqidno:7)。在一些实施方案中,融合蛋白含有一个或多个接头多肽。在其他实施方案中,融合蛋白含有一个或多个接头和一个或多个铰链多肽。
在一些实施方案中,本发明融合蛋白没有在n297与n联聚糖链连接的岩藻糖或具有减少的在n297与n联聚糖链连接的岩藻糖。有众多方法防止岩藻糖基化,包括但不限于:在fut8缺陷细胞系中产生;添加抑制剂到哺乳动物细胞培养基中,例如澳粟精胺(castanospermine)、2-去氧基岩藻糖、2-氟岩藻糖;使用具有天然减少的岩藻糖基化途径的生产细胞系;和生产细胞系的代谢工程。
在一些实施方案中,vpbp被工程改造以消除被人体中存在的既有抗体的识别。在一些实施方案中,本发明的单域抗体通过位置leu11的突变来修饰,例如leu11glu(l11e)或leu11lys(l11k)。在其他实施方案中,本发明的单域抗体通过羧基末端区域中的变化来修饰,例如末端序列由gqgtlvtvkpgg(seqidno:8)或gqgtlvtvepgg(seqidno:9)或其修饰物构成。在一些实施方案中,本发明的单域抗体通过第11位的突变和通过羧基末端区域中的变化来修饰。
在一些实施方案中,本发明融合蛋白的vpbp经由氨基酸接头有效连接。在一些实施方案中,这些接头主要由氨基酸甘氨酸和丝氨酸组成,本文表示为gs-接头。本发明融合蛋白的gs-接头可具有各种长度,例如长度为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个氨基酸。
在一些实施方案中,gs-接头包含选自以下的氨基酸序列:gsggs,即(ggs)2(seqidno:75);ggsggsggs,即(ggs)3(seqidno:76);ggsggsggsggs,即(ggs)4(seqidno:77);ggsggsggsggsggs,即(ggs)5(seqidno:45);ggggs(seqidno:78);ggggsggggs,即(ggggs2)(seqidno:79);和ggggsggggsggggs,即(ggggs3)(seqidno:80)。
在一些实施方案中,融合蛋白是四价的。在一些实施方案中,四价的融合蛋白具有下述结构:vhh-接头-vhh-接头-铰链-fc,其中vhh是人源化或完全人vhh序列。在一些实施方案中,四价的融合蛋白具有下述结构:vhh-接头-铰链-fc-接头-vhh,其中vhh是人源化或完全人vhh序列。
在一些实施方案中,融合蛋白是六价的。在一些实施方案中,六价的融合蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-铰链-fc,其中vhh是人源化或完全人vhh序列。在一些实施方案中,六价的融合蛋白具有下述结构:vhh-接头-vhh-接头-铰链-fc-接头-vhh或vhh-接头-铰链-fc-接头-vhh-接头-vhh,其中vhh是人源化或完全人vhh序列。
在一些实施方案中,融合蛋白没有fc区。在这些实施方案中,其中融合蛋白是四价的,蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-vhh-接头。在这些实施方案中,其中融合蛋白是五价的,蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-vhh-接头-vhh。在这些实施方案中,其中融合蛋白是六价的,蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-vhh-接头-vhh-接头-vhh。在这些实施方案中,vhh是人源化或完全人vhh序列。
在一些实施方案中,含vpbp融合蛋白还可含有另外的结合结构域,其识别革兰氏阴性细菌的非v-tip蛋白,例如来自铜绿假单胞菌的pcrv。这些另外的细菌结合结构域可赋予本发明融合蛋白另外的功能性。这些另外的功能性可包括中和另外的细菌毒力或生长因子或使得宿主吞噬细胞能够调理吞噬细菌。在一些实施方案中,含vpbp融合蛋白还可含有另外的结合结构域,其识别非细菌蛋白。这些另外的非细菌结合结构域可赋予本发明融合蛋白另外的功能性。这些另外的功能性可增强免疫细胞募集或活化,包括嗜中性粒细胞、天然杀伤细胞、巨噬细胞、单核细胞、树突细胞和t-细胞。
在一些实施方案中,含vpbp融合蛋白还可含有另外的结合结构域,其识别外膜蛋白i(opri)蛋白或其片段。在一个优选实施方案中,含vpbp融合蛋白包含至少结合pcrv或其片段的第一结构域和结合opri或其片段的第二结构域。这些双特异性融合蛋白在本文称为“pcrvxopri双特异性融合蛋白”、“pcrvxopri融合蛋白”和/或“pcrvxopri融合物”。opri是细胞表面蛋白,其在铜绿假单胞菌菌株间高度保守。opri经由n-末端cys-脂化锚接于外膜、存在于100%的所测试的铜绿假单胞菌菌株中且在基因组测序的铜绿假单胞菌菌株中100%保守。
在一些实施方案中,第一结构域包含来自表1中示出的pcrv序列的一个或多个序列。在一些实施方案中,第二结构域包含一个或多个结合opri的序列。在一些实施方案中,第二结构域包含来自表2中示出的opri序列的一个或多个序列。
双重靶向pcrv和opri使融合多肽能够拴(tether)或以其它方式连接和/或结合至细菌细胞表面,且其提供增强的体内保护。
在一些实施方案中,v-tip蛋白靶向分子包含来自表1中示出的pcrv序列的一个或多个序列。
本文提供的分子表现出抑制活性,例如通过抑制革兰氏阴性细菌的一种或多种v-tip蛋白的至少一种生物活性,例如效应分子跨靶细胞膜的功能性易位。本文提供的分子在结合至或以其他方式与v-tip蛋白(例如来自铜绿假单胞菌的pcrv)相互作用时,完全地或部分地降低或以其他方式调节革兰氏阴性细菌的一种或多种v-tip蛋白的表达或活性。在分子和v-tip蛋白之间相互作用时,降低或调节革兰氏阴性细菌的一种或多种v-tip蛋白的生物功能是完全的或部分的。当与不存在与本文描述的分子的相互作用(例如结合)的情况下v-tip蛋白的表达或活性水平相比,该分子存在情况下v-tip蛋白的表达或活性水平被降低至少95%、例如96%、97%、98%、99%或100%时,分子被认为是完全地抑制革兰氏阴性细菌的一种或多种v-tip蛋白的表达或活性。当与不存在与本文描述的分子的相互作用(例如结合)的情况下v-tip蛋白的表达或活性水平相比,该分子存在情况下v-tip蛋白的表达或活性水平被降低少于95%、例如10%、20%、25%、30%、40%、50%、60%、75%、80%、85%或90%时,分子被认为是部分地抑制革兰氏阴性细菌的一种或多种v-tip蛋白的表达或活性。
本文提供的v-tip蛋白靶向分子可用于治疗患有与革兰氏阴性细菌的一种或多种v-tip蛋白(例如来自铜绿假单胞菌的pcrv)的至少一种生物活性(例如效应分子跨靶细胞膜的功能性易位)相关的疾病或病症或被鉴定为处于该疾病或病症风险中的受试者的疾病或病症、减轻该疾病或病症的症状、改善该疾病或病症和/或延迟该疾病或病症的进展。
本公开文本提供结合革兰氏阴性细菌的iii型分泌系统的细菌非v-tip蛋白(例如来自铜绿假单胞菌的opri)的分子(例如多肽,包括抗体、抗原结合性抗体片段、抗体样多肽和/或融合多肽)和组合物,以及在多种治疗、诊断和/或预防性适应症中制备和使用这些组合物的方法。本发明的opri-靶向分子是单特异性的或多特异性的,并能以单价或多价方式结合其靶抗原。
在一些实施方案中,opri-蛋白靶向分子是特异性结合opri的抗体和抗体样分子。在一些实施方案中,抗体或其抗原结合片段衍生自抗体或抗原结合性抗体片段,包括例如单链可变片段(scfv)、fab片段、单域抗体(sdab)、vnar或vhh。在一些实施方案中,抗opri抗体是人或人源化sdab。sdab片段可衍生自vhh、vnar、工程改造的vh或vk结构域。vhh可产生自骆驼仅重链抗体。vnar可产生自软骨鱼仅重链抗体。已应用各种方法从常规异二聚vh和vk结构域产生单体sdab,包括界面工程和选择特异性种系家族。
在其他实施方案中,抗opri靶向分子衍生自非抗体支架蛋白,例如但不限于设计的锚蛋白重复序列蛋白(darpin)、亲和体(avimer)、anticalin/脂质运载蛋白(lipocalin)、centyrin和fynomer。
在一些实施方案中,抗opri靶向分子是抗体或其抗原结合片段,其包含选自seqidno:46-70和88的氨基酸序列。在一些实施方案中,抗opri靶向抗体或其抗原结合片段还包含免疫球蛋白fc区或其免疫活性片段。在一些实施方案中,抗opri靶向抗体或其抗原结合片段还包含免疫球蛋白fc区或其免疫活性片段,其包含选自seqidno:1-4的氨基酸序列。
在一些实施方案中,本发明融合蛋白由单一多肽组成。在其他实施方案中,本发明融合蛋白由多于一种多肽组成。例如,其中异二聚化结构域被掺入到融合蛋白中以构建不对称融合蛋白。例如,如果免疫球蛋白fc区被掺入到融合蛋白中,ch3结构域可用作均二聚化结构域,或ch3二聚体界面区可突变以实现异二聚化。
在一些实施方案中,融合蛋白在相对的末端含有vpbp。例如,vpbp既位于融合蛋白的氨基末端(n末端)部分,又位于融合蛋白的羧基末端(c末端)部分。在其他实施方案中,所有vpbp存在于融合蛋白的相同末端。例如,vpbp存在于融合蛋白的氨基或羧基末端部分。
在一些实施方案中,本发明包含掺入多于一个opri靶向序列的融合蛋白,本文称为多价。在一些实施方案中,融合蛋白的opri靶向序列识别opri上的相同表位,本文称为单特异性-多价。在其他实施方案中,融合蛋白的opri靶向序列识别opri上的不同表位,本文称为多特异性-多价。在一些实施方案中,含opri靶向序列融合蛋白包含两个opri靶向序列,并具有对opri的二价结合能力。在一些实施方案中,含opri靶向序列融合蛋白包含三个opri靶向序列,并具有对opri的三价结合能力。在一些实施方案中,含opri靶向序列融合蛋白包含四个opri靶向序列,并具有对opri的四价结合能力。在一些实施方案中,含opri靶向序列融合蛋白包含六个opri靶向序列,并具有对opri的六价的结合能力。在一些实施方案中,含opri靶向序列融合蛋白包含八个opri靶向序列,并具有对opri的八价结合能力。在这些实施方案中,掺入到本发明融合蛋白中的opri靶向序列可为单特异性的或多特异性的。
在一些实施方案中,融合蛋白没有fc区。
在一些实施方案中,融合蛋白包含免疫球蛋白fc区或其免疫活性片段,其包含选自seqidno:1-4的氨基酸序列。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的fc区包含人igg1区。在一些实施方案中,人igg1fc区在氨基酸asn297(加框,kabat编号)处被修饰以防止抗体和/或融合蛋白的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,抗体和/或融合蛋白的fc区在氨基酸leu235(加框,kabat编号)处被修饰以改变fc受体相互作用,例如leu235glu(l235e)或leu235ala(l235a)。在一些实施方案中,抗体和/或融合蛋白的fc区在氨基酸leu234(加框,kabat编号)处被修饰以改变fc受体相互作用,例如leu234ala(l234a)。在一些实施方案中,抗体和/或融合蛋白的fc区在第234和235位氨基酸处被改变,例如leu234ala和leu235ala(l234a/l235a)或leu234val和leu235ala(l234v/l235a)。在一些实施方案中,抗体和/或融合蛋白的fc区没有以下位置的一个或多个处的氨基酸以降低fc受体结合:glu233(e233,seqidno:1中加粗)、leu234(l234)或leu235(l235)。在一些实施方案中,抗体和/或融合蛋白的fc区在gly235处被改变以降低fc受体结合。例如,其中gly235从抗体和/或融合蛋白缺失。在一些实施方案中,人igg1fc区在氨基酸gly236处被修饰以增强与cd32a的相互作用,例如gly236ala(g236a,seqidno:1中加框)。在一些实施方案中,人igg1fc区没有lys447,其对应于seqidno:1的第218位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的fc区包含人igg2区。在一些实施方案中,人igg2fc区在氨基酸asn297(加框)处被修饰以防止抗体的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,人igg2fc区没有lys447,其对应于seqidno:2的第217位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的fc区包含人igg3区。在一些实施方案中,人igg3fc区在氨基酸asn297(加框,kabat编号)处被修饰以防止抗体的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,人igg3fc区在第435位氨基酸处被修饰以延长半衰期,例如arg435his(r435h,seqidno:3中加框)。在一些实施方案中,人igg3fc区没有lys447,其对应于seqidno:3的第218位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的fc区包含人igg4区。在其他实施方案中,人igg4fc区在第235位氨基酸处被修饰以改变fc受体相互作用,例如leu235glu(l235e)。在一些实施方案中,人igg4fc区在氨基酸asn297(kabat编号)处被修饰以防止抗体的糖基化,例如asn297ala(n297a)或asn297asp(n297d)。在一些实施方案中,人igg4fc区没有lys447,其对应于seqidno:4的第218位残基(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的人iggfc区被修饰以增强fcrn结合。增强与fcrn的结合的fc突变实例有met252tyr、ser254thr、thr256glu(分别为m252y、s254t、t256e)(kabat编号,dall’acqua等2006,j.biolchemvol281(33)23514–23524)、met428leu和asn434ser(m428l、n434s)(zalevsky等2010naturebiotech,vol28(2)157-159)、met252ile、thr256asp、met428leu(分别为m252i、t256d、m428l)或met252tyr、met428leu/val(分别为m252y、m428l/v)(kabat等1991sequencesofproteinsofimmunologicalinterest的eu索引)。met252对应于seqidno:1、3和4中的第23位残基和seqidno:2中的第22位残基。ser254对应于seqidno:1、3和4中的第25位残基和seqidno:2中的第24位残基。thr256对应于seqidno:1、3和4中的第27位残基和seqidno:2中的第26位残基。met428对应于seqidno:1、3和4中的第199位残基和seqidno:2中的第198位残基。asn434对应于seqidno:1、3和4中的第205位残基和seqidno:2中的第204位残基。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的fc区突变或被修饰。在这些实施方案中,突变的或修饰的fc多肽包含下述突变:met252tyr和met428leu(m252y,m428l),使用kabat编号系统。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的人iggfc区被修饰以改变抗体依赖性细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc),例如见述于下述文献的氨基酸修饰:natsume等,2008cancerres,68(10):3863-72;idusogie等,2001jimmunol,166(4):2571-5;moore等,2010mabs,2(2):181-189;lazar等,2006pnas,103(11):4005–4010;shields等,2001jbc,276(9):6591–6604;stavenhagen等,2007cancerres,67(18):8882-8890;stavenhagen等,2008advan.enzymeregul.,48:152-164;alegre等,1992jimmunol,148:3461-3468;kaneko和niwa,2011biodrugs,25(1):1-11。增强adcc的突变实例包括在ser239和ile332处的修饰,例如ser239asp和ile332glu(s239d、i332e)。增强cdc的突变实例包括在以下位置的修饰:lys326,其对应于seqidno:1、3和4的第97位残基和seqidno:2的第96位残基;和glu333,其对应于seqidno:1、3和4的第104位残基和seqidno:2的第103位残基。在一些实施方案中,fc区在一个或两个的这些位置处被修饰,例如lys326ala和/或glu333ala(k326a和e333a),使用kabat编号系统。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的人iggfc区被修饰以诱导异二聚化。例如,在ch3结构域内thr366处具有氨基酸修饰,在thr366被体积更大的氨基酸例如try置换时(t366w),其能够优先与在以下位置处具有体积更小的氨基酸的氨基酸修饰的第二ch3结构域配对:thr366,其对应于seqidno:1、3和4的第137位残基和seqidno:2的第136位残基;leu368,其对应于seqidno:1、3和4的第139位残基和seqidno:2的第138位残基;和tyr407,其对应于seqidno:1、3和4的第178位残基和seqidno:2的第177位残基,例如分别为ser、ala和val(t366s/l368a/y407v)。经由ch3修饰的异二聚化可进一步通过引入二硫键稳定,例如通过改变相对的ch3结构域上的ser354(其对应于seqidno:1、3和4的第125位残基和seqidno:2的第124位残基)为cys(s354c)和y349(其对应于seqidno:1、3和4的第120位残基和seqidno:2的第119位残基)为cys(y349c)(综述于carter,2001journalofimmunologicalmethods,248:7–15)。在一些的这些实施方案中,fc区可在异二聚体的一个成员上的蛋白-a结合位点处被修饰,以便防止蛋白-a结合和从而实现更有效地纯化异二聚体融合蛋白。该结合位点内的示例性修饰为ile253,其对应于seqidno:1、3和4的第24位残基和seqidno:2的第23位残基,例如ile253arg(i253r)。例如,i253r修饰可与t366s/l368a/y407v修饰组合或与t366w修饰组合。t366s/l368a/y407v修饰的fc能够形成均二聚体,因为不存在t336w修饰的fc情况下存在的二聚化界面的立体障碍。因此,在优选实施方案中,i253r修饰与t366s/l368a/y407v修饰的fc组合以不允许纯化可能已形成的任何均二聚体fc。
在一些实施方案中,opri靶向抗体或其抗原结合片段或opri-靶向融合多肽的人iggfc区被修饰以防止二聚化。在这些实施方案中,本发明抗体和/或融合蛋白是单体的。例如,在残基thr366处修饰成带电残基(例如thr366lys、thr366arg、thr366asp或thr366glu(分别为t366k、t366r、t366d或t366e))防止ch3-ch3二聚化。
在一些实施方案中,本发明融合蛋白经由氨基酸接头有效连接。在一些实施方案中,这些接头主要由氨基酸甘氨酸和丝氨酸组成,本文表示为gs-接头。本发明融合蛋白的gs-接头可具有各种长度,例如长度为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个氨基酸。
在一些实施方案中,gs-接头包含选自以下的氨基酸序列:gsggs,即(ggs)2(seqidno:75);ggsggsggs,即(ggs)3(seqidno:76);ggsggsggsggs,即(ggs)4(seqidno:77);ggsggsggsggsggs,即(ggs)5(seqidno:45);ggggs(seqidno:78);ggggsggggs,即(ggggs2)(seqidno:79);和ggggsggggsggggs,即(ggggs3)(seqidno:80)。
在一些实施方案中,融合蛋白是四价的。在一些实施方案中,四价的融合蛋白具有下述结构:vhh-接头-vhh-接头-铰链-fc,其中vhh是人源化或完全人vhh序列。在一些实施方案中,四价的融合蛋白具有下述结构:vhh-接头-铰链-fc-接头-vhh,其中vhh是人源化或完全人vhh序列。
在一些实施方案中,融合蛋白是六价的。在一些实施方案中,六价的融合蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-铰链-fc,其中vhh是人源化或完全人vhh序列。在一些实施方案中,六价的融合蛋白具有下述结构:vhh-接头-vhh-接头-铰链-fc-接头-vhh或vhh-接头-铰链-fc-接头-vhh-接头-vhh,其中vhh是人源化或完全人vhh序列。
在一些实施方案中,融合蛋白没有fc区。在这些实施方案中,其中融合蛋白是四价的,蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-vhh-接头。在这些实施方案中,其中融合蛋白是五价的,蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-vhh-接头-vhh。在这些实施方案中,其中融合蛋白是六价的,蛋白具有下述结构:vhh-接头-vhh-接头-vhh-接头-vhh-接头-vhh-接头-vhh。在这些实施方案中,vhh是人源化或完全人vhh序列。
应当理解,施用本发明的治疗实体会与合适的载体、缓冲剂、赋形剂和掺入制剂中以提供改进的转移、递送、耐受等的其他剂一起施用。大量适当的制剂可见于所有药剂师已知的配方集:remington'spharmaceuticalsciences(第15版,mackpublishingcompany,easton,pa(1975)),尤其其中的blaug,seymour的第87章。这些制剂包括例如散剂、糊剂、软膏剂、胶冻剂、蜡、油、脂、含脂(阳离子或阴离子)小泡(例如lipofectin™)、dna缀合物、无水吸收糊、水包油和油包水乳液、碳蜡乳液(各种分子量的聚乙二醇)、半固体凝胶和含有碳蜡的半固体混合物。任何前述混合物可适合于本发明的治疗和疗法,条件是制剂中的活性成分不被制剂灭活,且制剂是生理学上相容的和施用途径耐受的。还参见:baldrickp.“pharmaceuticalexcipientdevelopment:theneedforpreclinicalguidance.”regul.toxicolpharmacol.32(2):210-8(2000);wangw.“lyophilizationanddevelopmentofsolidproteinpharmaceuticals.”int.j.pharm.203(1-2):1-60(2000);charmanwn“lipids,lipophilicdrugs,andoraldrugdelivery-someemergingconcepts.”jpharmsci.89(8):967-78(2000);powell等“compendiumofexcipientsforparenteralformulations”pdajpharmscitechnol.52:238-311(1998);以及其中的药剂师熟知的与制剂、赋形剂和载体有关的信息的引用文献。
附图简述
图1是本公开文本的示例性含vpbp融合蛋白的系列示意图。识别不同表位的vpbp在这些示意图中被不同地加阴影。
图2a、2b和2c是描述使用本公开文本的不同含vpbp融合蛋白的溶血分析的系列图表。
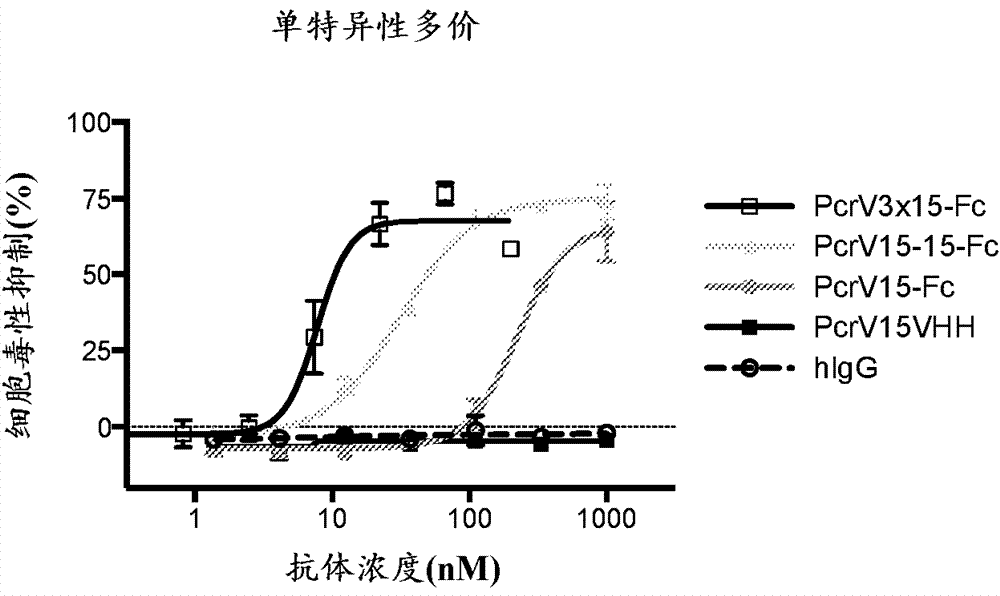
图3a和3b是描述使用本公开文本的不同含vpbp融合蛋白的细胞毒性分析的系列图表。a549细胞系用作靶细胞系。
图4a、4b和4c是描述使用本公开文本的不同含vpbp融合蛋白的感染模型中存活分析的系列图表。v2l2mab用作阳性对照,作为pcrv阻断抗体。
图5是描述实例opri抗体结合至多种铜绿假单胞菌菌株和恶臭假单胞菌(pseudomonasputida)的结合的图表。
图6是描述本公开文本的不同含vpbp融合蛋白经由opri结合铜绿假单胞菌的能力的图表。
图7是描述本公开文本的不同含vpbp融合蛋白在铜绿假单胞菌预防肺炎模型中提供优异的体内保护的能力的图表。本文包括本公开文本的示例性多特异性pcrv-opri(pcrv-18-15-opri-7)融合蛋白,其显示在等同摩尔剂量下相较于双特异性靶向pcrv和psl(公开于us20150284450和digiandomenico等,“amultifunctionalbispecificantibodyprotectsagainstpseudomonasaeruginosa”scitranslmed.,vol.6(262):262ra155(2014))增强的保护性能力。
详述
除非另外规定,与本发明相关使用的科学和技术术语应具有本领域技术人员所通常理解的含义。另外,除非上下文有不同的要求,单数术语应包括复数,复数术语应包括单数。通常,本文描述的与细胞和组织培养、分子生物学和蛋白和寡或多核苷酸化学和杂交相关使用的命名法以及细胞和组织培养、分子生物学和蛋白和寡或多核苷酸化学和杂交的技术是本领域熟知和常用的那些。标准技术用于重组dna、寡核苷酸合成和组织培养和转化(例如电穿孔、脂质转染)。酶反应和纯化技术根据制造商说明书进行,或按照本领域通常完成的那样进行或按照本文所述进行。前述技术和程序一般根据本领域熟知的常规方法和按照本说明书全文引用和讨论的各种一般性和更具体的文献中描述的那样进行。参见例如sambrook等molecularcloning:alaboratorymanual(第2版,coldspringharborlaboratorypress,coldspringharbor,n.y.(1989))。本文描述的与分析化学、合成有机化学和医学和药物化学相关使用的命名法以及分析化学、合成有机化学和医学和药物化学的实验室程序和技术是本领域熟知和常用的那些。标准技术可用于化学合成、化学分析、药物制备、配制和递送和患者治疗。术语患者包括人和兽医学受试者。
除非另外指明,根据本公开文本所用的下述术语应理解为具有下述含义:
本文所用的术语“靶向融合蛋白”和“抗体”可为同义词。本文所用的术语“抗体”是指免疫球蛋白分子和免疫球蛋白(ig)分子的免疫活性部分,即含有特异性结合抗原(与抗原免疫反应)的抗原结合位点的分子。所谓“特异性结合”或“与…免疫反应”或“针对”,意指抗体与所需抗原的一个或多个抗原决定簇反应,而不与其他多肽反应或以低得多的亲和力(kd>10-6)结合。抗体包括但不限于多克隆、单克隆、嵌合、dab(结构域抗体)、单链、fab、fab’和f(ab’)2片段、fv、scfv、fab表达文库和单域抗体(sdab)片段,例如vhh、vnar、工程改造的vh或vk。
已知基本的抗体结构单元包含四聚体。每个四聚体由两个相同对的多肽链组成,每对具有一个“轻”链(约25kda)和一个“重”链(约50-70kda)。各链的氨基末端部分包含约100~110或更多个氨基酸的可变区,主要负责抗原识别。各链的羧基末端部分限定主要负责效应功能的恒定区。通常,获自人的抗体分子涉及igg、igm、iga、ige和igd类中的任一种,这些类别彼此不同之处是分子中存在的重链性质。某些类还具有亚类(亦被称为同种型),例如igg1、igg2等。此外,人的轻链可为κ链或λ链。
本文所用的术语“单克隆抗体”(mab)或“单克隆抗体组合物”是指仅含有一个分子物类的由独特的轻链基因产物和独特的重链基因产物构成的抗体分子的抗体分子群。特别地,单克隆抗体的互补决定区(cdr)在该群的所有分子中是相同的。mab含有能够与抗原的特定表位免疫反应的抗原结合位点,特征在于对表位的独特结合亲和力。
术语“抗原结合位点”或“结合部分”是指免疫球蛋白分子的参与抗原结合的那部分。抗原结合位点由重(“h”)和轻(“l”)链的n末端可变(“v”)区的氨基酸残基形成。重链和轻链的v区内的三个高度差异的延伸段称为“高变区”,间插于更保守的被称为“构架区”或“fr”的侧翼延伸段之间。因此,术语“fr”是指天然存在于免疫球蛋白的高变区之间和附近的氨基酸序列。在抗体分子中,轻链的三个高变区和重链的三个高变区在三维空间中相对于彼此排列以形成抗原结合表面。抗原结合表面与所结合的抗原的三维表面互补,重链和轻链各自的三个高变区被称为“互补决定区”或“cdr”。将氨基酸分配至各结构域是根据下述文献的定义:kabatsequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.(1987和1991));或chothia&leskj.mol.biol.196:901-917(1987);chothia等nature342:878-883(1989)。
本发明融合蛋白的单域抗体(sdab)片段部分在本文可互换地称为靶向多肽。
本文所用的术语“表位”包括能够与/被免疫球蛋白或其片段或t-细胞受体特异性结合的任何蛋白决定簇。术语“表位”包括能够与/被免疫球蛋白或t-细胞受体特异性结合的任何蛋白决定簇。表位决定簇通常由分子例如氨基酸或糖侧链的化学活性表面组群构成,并通常具有特定的三维结构特征以及特定的电荷特征。当解离常数≤1μm,例如≤100nm,优选≤10nm和更优选≤1nm时,称抗体特异性结合抗原。
本文所用的术语“免疫结合”和“免疫结合性”和“特异性结合”是指在免疫球蛋白分子和免疫球蛋白特异性抗原之间发生的类型的非共价相互作用。免疫结合相互作用的强度或亲和力可以以相互作用的解离常数(kd)方式表示,其中越小的kd表示越大的亲和力。选定多肽的免疫结合性可使用本领域熟知的方法定量。一种此类方法需要测量抗原结合位点/抗原复合物形成和解离的速率,其中这些速率取决于复合物配偶体的浓度、相互作用的亲和力和同等地影响两个方向上的速率的几何参数。因此,“开速率常数”(kon)和“闭速率常数”(koff)可通过计算浓度和缔合和解离的实际速率来确定(参见nature361:186-87(1993))。koff/kon比使得能够取消所有与亲和力不相关的参数,并等同于解离常数kd(一般参见davies等(1990)annualrevbiochem59:439-473)。当平衡结合常数(kd)≤1μm,优选≤100nm,更优选≤10nm,和最优选≤100pm至约1pm,如通过例如放射性配体结合测定、表面等离子体共振(spr)、流式细胞术结合测定或本领域技术人员已知的类似测定等测定法所测量,称本发明的抗体特异性结合抗原。
优选地,不同的残基位置的不同在于保守氨基酸取代。
保守氨基酸取代是指具有类似侧链的残基的可互换性。例如,一组具有脂族侧链的氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;一组具有脂族羟基侧链的氨基酸是丝氨酸和苏氨酸;一组具有含酰胺侧链的氨基酸是天冬酰胺和谷氨酰胺;一组具有芳族侧链的氨基酸是苯丙氨酸、酪氨酸和色氨酸;一组具有碱性侧链的氨基酸是赖氨酸、精氨酸和组氨酸;和一组具有含硫铡链的氨基酸是半胱氨酸和甲硫氨酸。优选的保守氨基酸取代组为:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸和天冬酰胺-谷氨酰胺。
如本文所讨论的,预期抗体或免疫球蛋白分子氨基酸序列的小的变异为本发明所涵盖,条件是氨基酸序列的变异维持至少75%、更优选至少80%、90%、95%和最优选99%。特别地,预期保守氨基酸置换。保守置换是在其侧链相关的氨基酸家族内发生的那些。遗传编码的氨基酸通常分成以下家族:(1)酸性氨基酸是天冬氨酸、谷氨酸;(2)碱性氨基酸是赖氨酸、精氨酸、组氨酸;(3)非极性氨基酸是丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸;和(4)不带电的极性氨基酸是甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸。亲水氨基酸包括精氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、组氨酸、赖氨酸、丝氨酸和苏氨酸。疏水氨基酸包括丙氨酸、半胱氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、色氨酸、酪氨酸和缬氨酸。氨基酸的其他家族包括:(i)丝氨酸和苏氨酸,其是脂族羟基家族;(ii)天冬酰胺和谷氨酰胺,其是含酰胺家族;(iii)丙氨酸、缬氨酸、亮氨酸和异亮氨酸,其是脂族家族;和(iv)苯丙氨酸、色氨酸和酪氨酸,其是芳族家族。例如,可合理预期孤立的置换亮氨酸成异亮氨酸或缬氨酸、置换天冬氨酸成谷氨酸、置换苏氨酸成丝氨酸或类似置换氨基酸成结构相关的氨基酸将不会对所得分子的结合或性质具有大的影响,特别是如果置换不涉及框架位点内的氨基酸。氨基酸改变是否产生功能肽可容易地通过测定多肽衍生物的特定活性来确定。测定详述于本文中。抗体或免疫球蛋白分子的片段或类似物可容易地通过本领域普通技术人员制备。片段或类似物的优选的氨基和羧基末端存在于功能结构域附近。结构和功能结构域可通过将核苷酸和/或氨基酸序列数据与公共或专有序列数据库比较来鉴定。优选地,计算机化比较方法用于鉴定已知结构和/或功能的其他蛋白中存在的序列基序或预测的蛋白构象结构域。已知用于鉴定折叠成已知的三维结构的蛋白序列的方法。bowie等science253:164(1991)。因此,前述实例证实,本领域技术人员能够识别可用于限定本发明的结构和功能结构域的序列基序和结构构象。
优选的氨基酸取代是以下的这些:(1)降低对蛋白水解的敏感性,(2)降低对氧化的敏感性,(3)改变形成蛋白复合物的结合亲和力,(4)改变结合亲和力,和(4)赋予或修饰此类类似物的其他生理化学或功能性质。类似物可包括具有不同于天然存在的肽序列的序列的各种突变蛋白。例如,单或多氨基酸取代(优选保守氨基酸取代)可制备在天然存在的序列中(优选在形成分子间接触的结构域外部的多肽部分中。保守氨基酸取代不应实质上改变母本序列的结构特征(例如,氨基酸置换不应趋向于打开母本序列中存在的螺旋,或破坏其他类型的表征母本序列的二级结构)。本领域已知的多肽二级和三级结构实例描述于:proteins,structuresandmolecularprinciples(creighton,ed.,w.h.freemanandcompany,newyork(1984));introductiontoproteinstructure(c.branden和j.tooze,编辑,garlandpublishing,newyork,n.y.(1991));和thornton等nature354:105(1991)。
本文所用的术语“多肽片段”是指这样的多肽,其具有氨基末端和/或羧基末端缺失,但是剩余的氨基酸序列与例如从全长cdna序列推导的天然存在的序列中相应部分相同。片段通常为至少5、6、8或10个氨基酸长,优选至少14个氨基酸长,更优选至少20个氨基酸长,通常至少50个氨基酸长,和甚至更优选至少70个氨基酸长。本文所用的术语“类似物”是指这样的多肽,其包含具有与推导的氨基酸序列的部分实质上的同一性的至少25个氨基酸的区段,并在合适的结合条件下具有与cd47的特异性结合。代表性地,多肽类似物包含相对于天然存在的序列的保守氨基酸取代(或添加或缺失)。类似物代表性地为至少20个氨基酸长,优选至少50个氨基酸长或更长,并可常常与全长的天然存在的多肽一样长。
肽类似物通常用于制药工业,作为具有与模板肽性质类似的性质的非肽药物。这些类型的非肽化合物称为“模拟肽(peptidemimetic)”或“肽模拟物(peptidomimetic)”。fauchere,j.adv.drugres.15:29(1986),veber和freidingertinsp.392(1985);和evans等j.med.chem.30:1229(1987)。这样的化合物常常借助于计算机化分子建模来开发。与治疗上有用的肽结构类似的模拟肽可用于产生等价的治疗或预防作用。通常,肽模拟物与范例多肽(即具有生物化学性质或药理学活性的多肽)(例如人抗体)结构类似,但具有一个或多个肽键任选通过本领域熟知的方法被选自以下的键替换:--ch2nh--、--ch2s-、--ch2-ch2--、--ch=ch--(顺式和反式)、--coch2--、ch(oh)ch2--和-ch2so--。用相同类型的d-氨基酸系统取代共有序列的一个或多个氨基酸(例如,d-赖氨酸代替l-赖氨酸)可用于产生更稳定的肽。此外,可通过本领域已知的方法产生包含共有序列或基本上相同的共有序列变异的约束肽(constrainedpeptide)(rizo和gieraschann.rev.biochem.61:387(1992));例如,通过添加能够形成将肽环化的分子间二硫桥的内部半胱氨酸残基。
术语“剂”在本文中用于指化合物、化合物的混合物、生物大分子和/或由生物材料制备的提取物。
本文所用的术语“标记”或“标记的”是指掺入可检测的标志物,例如通过掺入放射性标记的氨基酸或连接至可被标定的亲和素检测的生物素基部分的多肽(例如,含有荧光标志物或可通过光学或量热方法检测的酶活性的链霉亲和素)。在特定条件下,标记或标志物还可以是治疗性的。标记多肽和糖蛋白的各种方法是本领域已知的,并可被使用。多肽标记的实例包括但不限于下述:放射性同位素或放射性核素(例如,3h、14c、15n、35s、90y、99tc、111in、125i、131i)、荧光标记(例如,fitc、罗丹明、镧系磷光体)、酶标记(例如,辣根过氧化物酶、β-半乳糖苷酶、萤光素酶、碱性磷酸酶)、化学发光、生物素基、被二次报道分子识别的预定多肽表位(例如,亮氨酸拉链对序列、二次抗体的结合位点、金属结合结构域、表位标签)。在一些实施方案中,标签通过各种长度的间隔臂连接以减少潜在的立体阻碍。本文所用的术语“药剂或药物”是指在适当地施用给患者时能够诱发所需的治疗作用的化合物或组合物。
本文所用的术语“治疗”及其类似术语是指降低和/或改善病症和/或与之相关的症状。所谓“减轻”,意指减低、抑制、减弱、减少、阻止和/或稳定疾病例如癌症的发生或进展。应当认识到,虽然没有排除,但是治疗病症或病况不要求病症、病况或与之相关的症状完全消除。
在该公开文本中,“包含”、“包括”、“含有”、“具有”等可具有在美国专利法中对其规定的含义,并可意指“包涵”、“涵盖”等;术语“基本由…构成”或“基本由…组成”同样地具有美国专利法规定的含义,这些术语是开放式的,允许多于所记载的内容,只要所记载的基本或新的特征不被多于所记载的内容改变,但是排除现有技术实施方案。
所谓“有效量”意指相对于未治疗的患者减轻疾病的症状所需要的量。用于实施本发明以治疗性治疗疾病的有效量的活性化合物视施用方式、年龄、体重和受试者的一般健康而变化。最后,主治医师或兽医会决定适合的量和剂量方案。这样的量称为“有效”量。
所谓“受试者”意指哺乳动物,包括但不限于人或非人哺乳动物,例如牛、马、犬、啮齿类、绵羊、灵长类、骆驼或猫。
本文所用的术语“施用”是指转移、递送、引入或运输治疗剂到需要用这样的剂治疗的受试者的任何模式。这样的模式包括但不限于口服、局部、静脉内、腹膜内、肌内、皮内、鼻内和皮下施用。
所谓“片段”意指多肽或核酸分子的部分。该部分优选含有参比核酸分子或多肽的完整长度的至少10%、20%、30%、40%、50%、60%、70%、80%或90%。片段可含有10、20、30、40、50、60、70、80、90,或100、200、300、400、500、600、700、800、900或1000个核苷酸或氨基酸。
本文提供的范围应理解为该范围内所有值的简写。例如,1-50的范围应理解为包括来自由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50组成的组的任何数字、数字组合或子范围。
除非明确说明或根据上下文显然的,本文所用的术语“一个”、“一种”和“所述”应理解为单数的或复数的。除非明确说明或根据上下文显然的,本文所用的术语“或”应理解为包涵的。
除非明确说明或根据上下文显然的,本文所用的术语“约”应理解为本领域的正常容许范围内,例如在平均值的2个标准偏差内。约可理解为在所称值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非另外根据上下文清楚,本文提供的所有数值被术语“约”修饰。
包含本发明的v-tip蛋白靶向分子的本发明治疗性制剂用于治疗或减轻与疾病或病症相关的症状,该疾病或病症与受试者中革兰氏阴性细菌的一种或多种v-tip蛋白(例如来自铜绿假单胞菌的pcrv)的异常活性和/或表达相关。治疗方案通过使用标准方法(包括多种临床和/或实验室程序中的任一种)鉴定患有(或处于发生的风险)与革兰氏阴性细菌的一种或多种v-tip蛋白(例如来自铜绿假单胞菌的pcrv)的异常活性和/或表达相关的疾病或病症的受试者例如(人患者)来完成。术语患者包括人和兽医学受试者。术语受试者包括人和其他哺乳动物。
与用于诊断或治疗特定的与革兰氏阴性细菌的一种或多种v-tip蛋白(例如来自铜绿假单胞菌的pcrv)的异常活性和/或表达相关的疾病或病症的任何已知方法结合确定治疗的有效性。与革兰氏阴性细菌的一种或多种v-tip蛋白(例如来自铜绿假单胞菌的pcrv)的异常活性和/或表达相关的疾病或病症的一个或多个症状的减轻指示,v-tip蛋白靶向分子赋予临床益处。
用于筛选具有所需的特异性的v-tip蛋白靶向分子的方法包括但不限于酶联免疫吸附测定(elisa)、酶促测定、流式细胞术和本领域已知的其他免疫介导的技术。
在下述实施例中进一步描述本发明,它们不限制权利要求书中所述的本发明范围。
实施例1:溶血阻断
本发明vpbp阻断细菌诱发的红细胞(rbc)溶血的能力可通过本领域已知的众多方案测定。例如,将人rbc在pbs中洗涤并以2%(v/v)重悬于dmem。将铜绿假单胞菌细菌及系列稀释的抗体添加到96孔圆底板的rbc。将板在37℃温育2h,然后在4℃温育2h。然后将板旋转以沉淀完整的rbc,之后将上清液转移到平底96-孔板用于分光光度度观察所释放的血红蛋白。
如图2a-2d所示,本发明的单特异性的和多特异性的多价vpbp能够阻断细菌诱发的rbc溶血。
实施例2:细胞毒性阻断
本发明vpbp阻断细菌诱发的哺乳动物细胞的细胞毒性的能力可通过本领域已知的众多方案测定。例如,在96-孔板中培养a549(肺上皮)细胞的汇合单层。对细胞加载calceinam,然后洗涤以去除过量的calcein。将铜绿假单胞菌和不同浓度的抗体添加到a549细胞中,并在37℃温育2h。然后洗涤单层,之后通过荧光定量剩余的细胞。
如图3a-3b中所示,本发明的单特异性的和多特异性的多价vpbp能够阻断细菌诱发的哺乳动物细胞的细胞毒性。
实施例3:铜绿假单胞菌感染模型
本发明vpbp保护免于细菌感染的能力可使用铜绿假单胞菌感染的小鼠模型测定。用pcrv抗体预处理小鼠,24h后感染铜绿假单胞菌。在t=0时,使小鼠气管内感染铜绿假单胞菌,并监测存活4天。重要地,发现与单特异性的多价含vpbp融合蛋白相比,多特异性的多价含vpbp融合蛋白赋予实质上更多的保护(图4a-4c)。相较于本领域已知为铜绿假单胞菌诱发的溶血的有力阻断剂的抗pcrv抗体v2l2(参见例如pct/us2012/063639,公布为wo2013/0170565),本发明的多特异性的多价含vpbp融合蛋白还实质上更有效力。
实施例4:opri抗体结合多种菌株
opri靶向抗体结合假单胞菌属菌株的能力可通过全细胞细菌elisa测定。将细菌培养物在标准细菌学培养基中培养到对数中期,然后在pbs中洗涤和重悬。将等体积的细菌悬液置于96孔板中,并于37c温育24h。将板用bsa封闭,然后加入系列稀释的抗体。在随后的洗涤之后,加入hrp-缀合的抗人fc特异性二次抗体。在温育和和洗涤之后,加入tmb底物,并测量600nm的吸光度以检测抗体与细菌的结合。如图5所示,发现opri抗体结合所测试的所有铜绿假单胞菌菌株以及恶臭假单胞菌。
实施例5:铜绿假单胞菌感染模型中的双特异性分子
本文提供的研究证实,本发明vpbp保护免于细菌感染的能力可使用铜绿假单胞菌感染的小鼠模型测定。特别地,这些研究使用结合pcrv和外膜蛋白i(“opri”)两者的vpbp,本文还称为“pcrvxopri双特异性融合蛋白”、“pcrvxopri融合蛋白”和/或“pcrvxopri融合物”。双重靶向pcrv和opri允许融合多肽拴或以其他方式连接和/或结合至细菌细胞表面,本文提供的研究证实,该双重靶向也产生增强的体内保护。
pcrvxopri双特异性融合物通过靶向opri而靶向细菌细胞表面。图6通过流式细胞术证实,本公开文本的pcrvxopri双特异性融合物结合铜绿假单胞菌。
pcrvxopri双特异性融合物还相较于双特异性分子bis4在体内更有效力,后者结合pcrv和psl,在本领域中已知是铜绿假单胞菌诱发的溶血的阻断剂(参见例如,digiandomenico等,“amultifunctionalbispecificantibodyprotectsagainstpseudomonasaeruginosa”scitranslmed.,vol.6(262):262ra155(2014))。图7证实,pcrvxopri双特异性融合蛋白在铜绿假单胞菌肺炎预防动物模型中提供优异的体内保护。
表1.pcrv-vpbp序列
pcrv1a(1a7)
evqlvqsggglvqaggslrlscaasgrifgtygmgwfrqapgkervfvaaisksgpttyyadsvkgrftisrdnaentvylqmnslkpedtavyycgasshsmlvvttsqvdywgrgtqvtvss(seqidno:10)
pcrv2a(1b9)
evqlvqsggglvqpggslrlscavsglifdnygigwfrqapekeregvscihesdgstyytdsvkgrfaisrdnakntgylemnnlkpedtavyycvvlsyvsrcpegskydywgqgtqvtvss(seqidno:11)
pcrv3a(1b12)
evqlvqsggglvqpggslrlscaasgftldyypigwfrqapgkeregvscisssegstyyadsvkgrftisrdnakntvylqmnnmkpedtavyycatdffttgcpsgggkydywgqgtqvtvss(seqidno:12)
pcrv4a(1g9)
evqlvqsggglvraggslrlscapsertfgsfgmgwfrqapgkerefvaalmwgtsytsyadsvkgrftvskdnakntlylqmnslkpedtavyycaagavgadprrydywgqgtqvtvss(seqidno:13)
pcrv5a(2a5)
evqlvqsggglvqaggslrlscaasglafrnyrmgwfrqapgkerefvaaisgniggsgvgtdyadsvkgrftisrdndkdtaylqmnslkpedtavyycaadhhltmlpgeydfwgegtqvtvss(seqidno:14)
pcrv6a(2a11)
evqlvqsggglvqpggslrlscaasgstldyyaigwfrqapgkeregvacisssdgstdyadsmkgrftisrdnaqktvylqmnslkpedtavyscaavaffcgsswylssgmdywgkgtqvtvss(seqidno:15)
pcrv7a(2a12)
evqlvqsggglvqaggslrlscaasggtfssnamywyrqapgkqrelvasisgtsnanypdsvkgrftisrdnakntvtlqmnslkpedtavyycraapvsgpligrifwgqgtqvtvss(seqidno:16)
pcrv8a(2b4)
evqlvqsggglvqaggslrlscatsgltfsvyamgwfrqapgkqrefvaritaggsgtyyadsmegrftisrdnarntvylqmnslkpedtavyycaaarhwtrgtehlptaydywgqgtqvtvss(seqidno:17)
pcrv9a(2b7)
evqlvqsggglvqaggslrlscassgstfrtygmgwfrqppgkqrewvagmaidglttyadsakgrftasrdnarnivylqmnelkpedtavyycyaagywgqgtqvtvss(seqidno:18)
pcrv10a(2g6)
evqlvqsggglvqaggslrlscttsgitfsdnamywyrqapgkqrelvasissggwtnyadsvkgrftisrdnvkntvtlqmnslepedtalyycraapvrgnfigrvfwgqgtqvtvss(seqidno:19)
pcrv11a(4h7)
evqlvqsggglvqpggslrlscaafgsiftigtmgwyrqapgkqrelvatitrgsstnyadsvkgrftisidsakntvylqmnslksedtavyycaadrgavgpamrvvadywgqgtqvtvss(seqidno:20)
pcrv12a(3b7)
evqlvqsggglvqaggslrlscaasgstfssnamywyrqapgkqrelvasisdggfttyyadsvkgrftiskdnaentvylqmnimkpedtavyycaasissrvvvhtaqadywgqgtqvtvss(seqidno:21)
pcrv13a(4g2)
evqlvqsggglvqpggslrlpcaasgsiftigtmgwyrqapgkqrelvatitrgsstnyadsvkdrftisrdnakrtlhlqmnglkaedtavyycatdlfenscplkhdfwgqgtqvtvss(seqidno:22)
pcrv14a(4g10)
evqlvqsggglvqaggslrlscaasritfalyvidwyrqtpesqrelvarirpeglavyadsvkgrftisrdngrntaylqmnslqeedtavyychadpvftpgrndywgqgtqvtvss(seqidno:23)
pcrv15a(4g9)
evqlvqsggglvqpgeslrlscaasgsifsintmvwyrqvpgkqrelvasitnqgiphyadsvkgrftisrenakntvnlqmnslkpedtavyvcnawirsdgvspylnywgqgtqvtvss(seqidno:24)
pcrv16a(3b10)
evqlvqsggglvqpggslglscvgsgsisgihtmgwyrrapgnqreliatatsagitnysesvkgrftisrdnakstvylqmsslkpedtgvyycndvfgrtswgqgtqvtvss(seqidno:25)
pcrv17a(3g1)
evqlvqsggglvqpggslrlscaasgnifggnvmgwyrqapgkqrelvagigslgrttyadsvkgrfsisrdnakntvylqmdslkpedtavyycnvvrlggpdywgqgtqvtvss(seqidno:26)
pcrv18a(3f2)
evqlvqsggglvqaggslrlscttsgntfsdnamywyrqapgkqreqvasissggwtnyadsvkgrftisrdnvkntvtlqmdrlepedtalyycraapvrgyligrvfwgqgtqvtvss(seqidno:27)
pcrv19a(4e12)
evqlvqsggglvqaggslrlscsasgsnsifnmgwyrqrpgrqrelvalissgtgstsyagsvkgrfaisrdnakatvylqmnslkledtavyycrittdnarlvywgqgtqvtvss(seqidno:28)
pcrv20a(3c1)
evqlvqsggglvqpggslrlscaasgrifsvnnmgwyrqtpgkqrelvavitvngittysdsvkgrftlsrdnakntiylqmnslkpedtavyscygyirlaatnpyvqywgqgtqvtvss(seqidno:29)
pcrv21a(3c7)
evqlvqsggglvqpggslrlscaasgsifsintmgwyrqapgnqrdivatitmngvphyadavkgrftisrdnakntvylqmnglkpedtavyycnawinlygspplqnywgqgtqvtvss(seqidno:30)
pcrv22a(4h8)
evqlvqsggglvqaggslrlscaasgsifsinamgwyrqapgkqrelvtsitnqgiphyadsvkgrftisrenakntvnlqmnslkpedtavyvcnawirgdggspylnywgqgtqvtvss(seqidno:31)
pcrv23a(1g6)
evqlvqsggglvqpgeslrlscaasgsifsintmvwyrqvpgkqrelvasitnqgiphyadsvkgrftisrenakntvnlqmnslkpedtavyvcnawirsdgvppylnywgqgtqvtvss(seqidno:32)
pcrv24a(2e1)
evqlvqsggglvqpggslrlscaasgsifninsmhwyrqapgnqrelvasiskggitnyadsvkgrfaisrddaqntlylqmnslkpedtavyycnawiseiatgpilynywgqgtqvtvss(seqidno:33)
pcrv25a(1f9)
evqlvqsggglvqpggslslscaasgsvfsinrmawyrqapgkqrelvadigtmgasdyadsvkgrftisrdnakktvdlqmnslkpedtavyfcnawmrgapdvaytnywgqgtqvtvss(seqidno:34)
pcrv26a(4h1)
evqlvqsggglvqpggslrlscaasgrvvsinnmgwyqqtpgnqrelvaiitlngvttyadsvkgrftisrdnakntvylqmaslkpedtaiyycnawvrtvpgsaysnywgqgtqvtvss(seqidno:35)
pcrv27a(1b4)
evqlvqsggdlvqpggslrlscaasgrifsvnnmgwyrqapgkqrelvavitmngvttyedsvkgrftlsrdnakntiylqmnslkpedtavyfcygyirlaatnpyvqywgqgtqvtvss(seqidno:36)
hzpcrv15v1
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkqrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsdgvspylnywgqgtlvtvkp(seqidno:37)
hzpcrv15v2
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkqrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsygvspylnywgqgtlvtvkp(seqidno:38)
hzpcrv15v3
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkqrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsegvspylnywgqgtlvtvkp(seqidno:39)
hzpcrv15v4
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkqrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsqgvspylnywgqgtlvtvkp(seqidno:40)
hzpcrv15dav5
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkqrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsdavspylnywgqgtlvtvkp(seqidno:41)
hzpcrv15dtv6
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkqrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsdtvspylnywgqgtlvtvkp(seqidno:42)
hzpcrv15v7
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkgrelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsqgvspylnywgqgtlvtvkp(seqidno:81)
hzpcrv15v8
evqllesgggevqpggslrlscaasgsifsintmvwyrqapgkglelvssitnqgiphyaesvkgrftisrdnakntlylqmsslraedtavyycnawirsqgvspylnywgqgtlvtvkp(seqidno:82)
hzpcrv18
evqllesgggevqpggslrlscaasgntfsdnamywyrqapgkqrelvssissggwtnyaesvkgrftisrdnakntlylqmsslraedtavyycraapvrgyligrvfwgqgtlvtvkp(seqidno:43)
hzpcrv18v2
evqllesgggevqpggslrlscaasgntfsdnamywyrqapgkgrelvssissggwtnyaesvkgrftisrdnakntlylqmsslraedtavyycraapvrgyligrvfwgqgtlvtvkp(seqidno:83)
hzpcrv18v3
evqllesgggevqpggslrlscaasgntfsdnamywyrqapgkglelvssissggwtnyaesvkgrftisrdnakntlylqmsslraedtavyycraapvrgyligrvfwgqgtlvtvkp(seqidno:84)
hzpcrv20v1
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkqrelvsvitvngittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:44)
hzpcrv20v2
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkqrelvsvitvggittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:71)
hzpcrv20v3
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkqrelvsvitvqgittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:72)
hzpcrv20v4
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkqrelvsvitnqgittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:73)
hzpcrv20v5
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkqrelvsvitvsgittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:74)
hzpcrv20v6
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkgrelvsvitnqgittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:85)
hzpcrv20v7
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkglelvsvitnqgittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:86)
hzpcrv20v8
evqllesgggevqpggslrlscaasgrifsvnnmgwyrqapgkglewvsvitnqgittyaesvkgrftisrdnakntlylqmsslraedtavyycygyirlaatnpyvqywgqgtlvtvkp(seqidno:87)
表2.opri结合蛋白序列
opri-vhh-1(本文还称为“opri-1”)
qlqlqesggglvqsgrslrlscsasgslfrfdtvwwyrqapgkqrewvayitaggmtnyadsvkgrftiskdnaknmvylqmdsllpedtavyycnvgrnwgqgtqvtvss(seqidno:46)
opri-vhh-2(本文还称为“opri-2”)
evqlvqsggglvqpgeslrlscaasgnifrfdtvwwyrqppgeqrewvsyitagsitnyadsvkgrftisrdnaknmvylqmdnlkpedtavyycrvggsswgqgtqvtvss(seqidno:47)
opri-vhh-3(本文还称为“opri-3”)
evqlvqsggglvqagdslrlscaasggisstyamgwfrqapgkerefvasirlgseatyyadsvkgrftisrdnalktiylqmnslkpddtavyycavdaslflvtvdywgrgtqvtvss(seqidno:48)
opri-vhh-4(本文还称为“opri-4”)
qvqlvqsggglvqaggslrlscaasgrtfsrcvmgwfrqapgkerefvatiswsgastvyadsvkgrftisrenakntvylqmnslkpedtavyycaaaesswngdirlkgydywgqgtqvtvss(seqidno:49)
opri-vhh-5(本文还称为“opri-5”)
qvtlkesggglvqaggslrlscaasgrsfrtytmawfrqppgkerefvaaitwsggstfyadpvkgrftisrdnakntvylqmntlkpedtavyycavetsisgrytvfqprfydswgqgtqvtvss(seqidno:50)
opri-vhh-6(本文还称为“opri-6”)
qvqlqesggglvqpgeslrlscaasgnifrfdtvwwyrqppgeqrewvsyitagsitnyadsvkgrfiisrdnaknmvylqmdnlkpedtavyycrvgggswgqgtqvtvss(seqidno:51)
opri-vhh-7(本文还称为“opri-7”)
evqlvqsggglvqpggslrlsciasgsifstktmgwyrqapgkqrewvalittglstqyldslegrftisrdnannrvflqmnnlkpedtgvyycnvvpgrgatywgkgtqvtvss(seqidno:52)
opri-vhh-8(本文还称为“opri-8”)
qlqlqesggglvqpgrslrlscagsgsifrydtvwwyrqapgkqrewvayvtaggitnyadsvkgrftiskdnaknmvylqmdsllpedtavyychvgrnwgqgtqvtvss(seqidno:53)
opri-vhh-9(本文还称为“opri-9”)
qlqlqesggglvqaggslrlscaasgrtfssnvysmgwfrqapgkerefvsaitwrggttyyadsvkdrftiskdnakntvylqmnslksedtavyycacsrmdstrydywgqgtqvtvss(seqidno:54)
opri-vhh-11(本文还称为“opri-11”)
evqlvqsggglvqsgrslrlscsasgslfrfdtvwwyrqapgkqrewvayitaggitnyadsvkgrftiskdnaknmvylqmdsllpedtavyycsvgrnwgqgtqvtvss(seqidno:55)
opri-vhh-12(本文还称为“opri-12”)
qvqlqesggglvqpggslrlscaasgitvrintmgwyrqapgkqrelvayitsggitnyvdsvkgrftiarddakntvylqmnslkpedtavyycnvhgwrdfwgqgtqvtvss(seqidno:56)
opri-vhh-13(本文还称为“opri-13”)
qvqlvqsggglvqpggslrlscaasgtifrfntmawyrqapgkqrefvayitwagmtgyqdsvqdrftisrdnakntvslqmnnlkpedtavyfcnkhgssfvrdywgqgtqvtvss(seqidno:57)
opri-vhh-14(本文还称为“opri-14”)
evqlvqsggglvqpggslrlscaaagsdfaigamgwyrqapgkqrdfvahitsggipsfadsvkgrftlsrdnakntvylqmdslkpddtavyycylrkrgsgtttwgqgtqvtvss(seqidno:58)
opri-vhh-15(本文还称为“opri-15”)
qvqlqesggglvqaggslrlscaasgrifsncvmgwfrqapgkerefvaaiswsgdtthyadslkgrfaisrdnanntvflqkdsltpsdtavyycaassritscqamgvvpllqpwydywgrgtqvtvss(seqidno:59)
opri-vhh-16(本文还称为“opri-16”)
qvqlqesggglvqpgrslrlscaasgnifrfdtvwwyrqapgkqrewvayvtaggitnyadsvkgrftiskdnaknivylhtdnlapedtavyycrvgqnwgqgtqvtvss(seqidno:60)
opri-vhh-17(本文还称为“opri-17”)
qlqlqesggglvqpggsprlscaasesifrfntmawyrqapgkqrelvayitwagrtdygdfvkgrftisrdnakntvslqmnslkpedtavyycnkhgsrferdywgqgtqvtvss(seqidno:61)
opri-vhh-18(本文还称为“opri-18”)
qvqlqesggdlvqpggslrlscvasetifrfntmawyrqapgkrrelvgyitwagrtgygdfvegrftisrdnskntvslqmnslkpedtavyycnkhgssftqdywgqgtqvtvss(seqidno:62)
opri-vhh-19(本文还称为“opri-19”)
qlqlqesggdlvqpggslrlscvasetifrfntmawyrqapgkrrelvgyitwagrtgygdfvegrftvsrdnskntvslqmnslkpedtavyycnkhgasftqdywgqgtqvtvss(seqidno:63)
opri-vhh-21(本文还称为“opri-21”)
qlqlqesggglvrpgssltlscvasetifrfntmawyrqapgkrrelvgyitwagrtgygdfvegrftisrdnskntvslqmnslepedtadyycnkhgssflrdywgqgtqvtvss(seqidno:64)
opri-vhh-22(本文还称为“opri-22”)
qvqlqesggglvqpgrslrlscagsgsmfrfdtvwwyrqapgkqrdwvsyitagsianyadsvkgrftisrdntknmvylqmdslkpedtavyycrvggnswgqgtqvtvss(seqidno:65)
opri-vhh-23(本文还称为“opri-23”)
qvqlqqsggglvqpggslrlsceassnifrfntmawyrqapgkqrefaayitwagltgygdslkgrfiisrdnaknivtlqmnslkpedtavyycnkhgsdfvrdywgqgtqvtvss(seqidno:66)
hzopri-7v1(本文还称为“opri-7v1”)
evqllesgggevqpggslrlscaasgsifstktmgwyrqapgkqrewvslittglstqyaesvkgrftisrdnanntvylqmsslraedtavyycnvvpgrgatywgqgtlvtvkp(seqidno:67)
hzopri-7v2(本文还称为“opri-7v2”)
evqllesgggevqpggslrlscaasgsifstktmgwyrqapgkqrewvslittglstqyaesvkgrftisrdnakntlylqmsslraedtavyycnvvpgrgatywgqgtlvtvkp(seqidno:68)
hzopriv3(本文还称为“opri-7v3”)
evqllesgggevqpggslrlscaasgsifstktmgwyrqapgkglewvslittglstqyaesvkgrftisrdnakntlylqmsslraedtavyycnvvpgrgatywgqgtlvtvkp(seqidno:69)
hzopri-7v4(本文还称为“opri-7v4”)
evqllesgggevqpggslrlscaasgsifstktmgwyrqapgkglewvslittglstqyaesvkgrftisrdnakntvylqmsslraedtavyycnvvpgrgatywgqgtlvtvkp(seqidno:70)
hzopri-7v5
evqllesgggevqpggslrlscaasgsifstktmgwyrqapgkgrewvslittglstqyaesvkgrftisrdnakntlylqmsslraedtavyycnvvpgrgatywgqgtlvtvkp(seqidno:88)。
- 还没有人留言评论。精彩留言会获得点赞!