用于抑制NLRP3基因表达的组合物及其用途的制作方法
相关申请
本申请要求2015年11月4日递交的美国临时专利申请序列号62/250796的权益,其内容通过参照以其全部结合于此。
发明领域
本发明涉及用于抑制nlr家族热蛋白结构域相关蛋白3(pyrindomaincontaining3)(nlrp3,也称为cias1)基因表达或者用于诊断、治疗和/或预防对nlrp3基因表达的抑制作出反应的疾病和/或病症的化合物、组合物和方法。
相关技术概述
nlrp3基因属于称为nlr的基因家族(含有核苷酸结合结构域和富亮氨酸重复序列的家族)。nlr蛋白参与免疫系统,帮助启动和调节免疫系统对损伤、毒素或微生物入侵的反应。这些蛋白识别特定分子,被激活,并且通过帮助接触免疫系统的组分来作出反应。
nlrp3基因提供用于制备称为冷吡啉(cryopyrin)的蛋白的指令,该蛋白主要存在于白细胞和软骨形成细胞(软骨细胞)中。冷吡啉识别细菌颗粒、化学品比如石棉、二氧化硅和尿酸晶体以及受损细胞释放的化合物。
一旦被激活,冷吡啉分子组与其他蛋白一起将自身组装成称为炎性体(inflammasome)的结构,炎性体参与炎症过程。当免疫系统将信号传导分子以及白细胞发送至损伤或疾病部位以抗击微生物入侵者并促进组织修复时发生炎症。
nlrp3基因突变与家族性寒冷性自身炎症性综合征(fcas)、穆-韦二氏综合征(mws)、慢性婴儿神经皮肤关节(cinca)综合征和新生儿发病的多系统炎症性疾病(nomid)相关。nlrp3也涉及间质性膀胱炎/膀胱疼痛综合征(ic/bps)的发病机制。因此,需要得益于nlrp3的表达减少或得益于nlrp3活性调节的疾病或障碍治疗。
发明简述
本发明涉及用于调节nlrp3mrna或蛋白表达的化合物、组合物和方法,其使用包含两个或更多个单链反义寡核苷酸的基因沉默化合物(“gso”),所述单链反义寡核苷酸通过其5’-末端连接以使得能够存在两个或更多个可及的3’-末端。本发明的基因沉默化合物有效抑制或减少nlrp3mrna或蛋白表达。
本文提供用于调节nlrp3mrna和蛋白表达的方法、化合物和组合物。在某些实施方案中,用于调节nlrp3mrna和蛋白表达的化合物为基因沉默化合物。
在某些实施方案中,调节可发生在细胞或组织中。在某些实施方案中,细胞或组织在动物体内。在某些实施方案中,动物为人。在某些实施方案中,nlrp3mrna水平降低。在某些实施方案中,nlrp3蛋白水平降低。这种降低可以时间依赖性方式或剂量依赖性方式发生。
还提供用于预防、治疗和改善疾病、障碍和病症的方法、化合物和组合物。
在某些实施方案中,治疗方法包括将nlrp3mrna或蛋白表达基因沉默化合物或组合物给予有需要的个体。
附图简述
如附图中图解说明的那样,本发明的前述和其他目的、特征和优点从以下本发明优选实施方案的更具体描述将变得显而易见,其中在不同的视图中相同的标记符号涉及相同的部件。附图不一定按比例绘制,而是将重点放在说明本发明的原理。
图1描绘基于细胞的测定中的示例性mnlrp3gso的筛选结果。
图2描绘小鼠j774细胞系中的mnlrp3通过示例性gso的沉默。
图3a和图3b证实示例性的mnlrp3gso剂量依赖性地沉默小鼠j774细胞中的nlrp3mrna表达和蛋白水平。
图4证实示例性的mnlrp3gso剂量依赖性地减少j774细胞中的lps加atp诱导的il-1b分泌。
图5证实示例性的mnlrp3gso在基于细胞的测定中特异性地沉默小鼠nlrp3基因表达。
图6描绘在基于细胞的测定中的示例性的hnlrp3gso的剂量反应曲线。
图7a和图7b描述thp-1细胞中的示例性hnlrp3gso的剂量反应曲线。
图8a和图8b证实示例性的hnlrp3gso抑制thp-1细胞中的lps/atp-诱导的细胞因子分泌。
图9描绘人pbmc中的示例性hnlrp3gso的剂量反应曲线。
图10a和图10b证实示例性的hnlrp3gso抑制人pbmc中的lps/atp诱导的细胞因子分泌。
图11a至图11c证实间质性膀胱炎动物模型中的示例性mnlrp3gso对膀胱重量、尿il-1β和尿il-18的作用。
图12a至图12d证实间质性膀胱炎动物模型中的示例性mnlrp3gso对膀胱炎性体基因表达的作用。
图13证实间质性膀胱炎动物模型中的示例性mnlrp3gso对膀胱炎性体基因表达的作用。
图14证实间质性膀胱炎动物模型中的示例性mnlrp3gso对膀胱重量的作用。
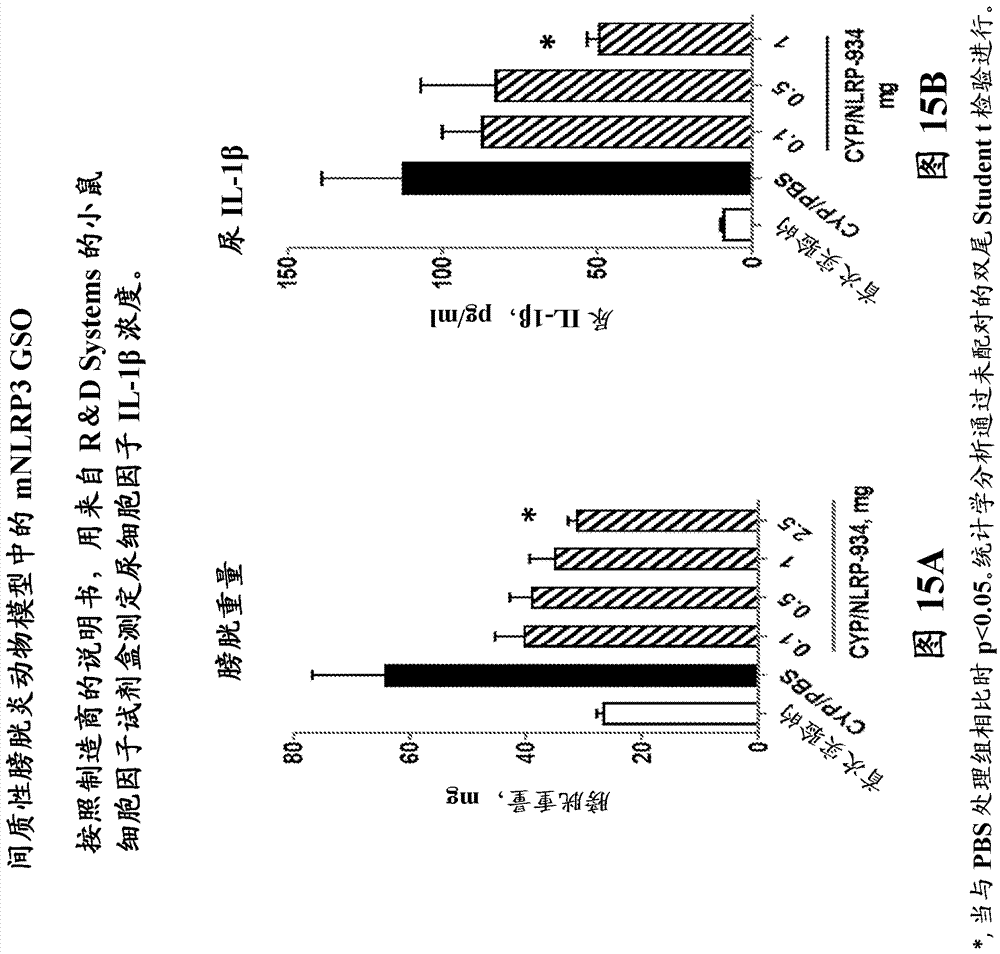
图15a和图15b证实间质性膀胱炎动物模型中的示例性mnlrp3gso对膀胱重量、尿il-1β的作用。
图16a至图16d证实实验性自身免疫性葡萄膜炎动物模型中的示例性mnlrp3gso的作用。
优选实施方案的详述
本发明涉及基因沉默化合物下调nlrp3mrna或蛋白表达的治疗性和预防性用途。这种分子可用于例如提供用于调节nlrp3基因表达或者用于治疗和/或预防能够在患者、受试者、动物或生物体中对nlrp3基因表达的调节作出反应的疾病和/或病症的组合物。
当与附图一起阅读时,本发明的目的、其各种特征以及本发明本身可从以下描述更全面地理解,其中以下术语具有归定的意义。除非提供具体定义,否则与本文描述的分析化学、合成有机化学以及药物和药物化学结合使用的命名法以及程序和技术为本领域熟知和常用的那些。标准技术可用于化学合成和化学分析。在允许的情况下,贯穿本文公开所提及的所有专利、申请、公开的申请和其他出版物、可通过数据库比如美国国家生物技术信息中心(ncbi)获得的genbank登录号和相关的序列信息以及其它数据通过参照本文讨论的文件部分以及以其整体结合。
术语“2’-o-取代的”意指用含有1-6个饱和或不饱和碳原子的-o-低级烷基(例如(但不限于)2’-o-甲基)或用-o-芳基或具有2-6个碳原子的烯丙基取代戊糖部分的2’位置,其中这种烷基、芳基或烯丙基可为未取代的或者可例如用2’-o-甲氧基乙基、乙氧基、甲氧基、卤代、羟基、三氟甲基、氰基、硝基、酰基、酰氧基、烷氧基、羧基、烷氧羰基(carbalkoxyl)或氨基,或者用羟基、氨基或卤代基团,但是不用2’-h基团取代。在一些实施方案中,本发明的寡核苷酸在其5’末端包含4或5个2’-o-烷基核苷酸,和/或在其3’末端包含4或5个2’-o-烷基核苷酸。
当定向使用时,术语“3’”通常指的是来自同一多核苷酸或寡核苷酸中的另一个区域或位置的3’的多核苷酸或寡核苷酸(朝向核苷酸的3’末端)的区域或位置。
术语“3’末端”通常指的是组分寡核苷酸的3’末端核苷酸。“在其3’末端连接的两个或更多个寡核苷酸”通常指的是寡核苷酸的3’末端核苷酸之间可直接经5’、3’或2’羟基,或者间接经非核苷酸接头的连接。这种连接也可经核苷利用核苷的2’和3’羟基位置两者。这种连接还可利用3’末端核苷酸的官能化糖或核碱基。
当定向使用时,术语“5’”通常指的是来自同一多核苷酸或寡核苷酸中的另一个区域或位置的5’的多核苷酸或寡核苷酸(朝向核苷酸的5’末端)的区域或位置。
术语“5’末端”通常指的是组分寡核苷酸的5’末端核苷酸。“在其5’末端连接的两个或更多个单链反义寡核苷酸”通常指的是寡核苷酸的5’末端核苷酸之间可直接经5’、3’或2’羟基,或者间接经非核苷酸接头的连接。这种连接也可经核苷利用核苷的2’和3’羟基位置两者。这种连接还可利用5’末端核苷酸的官能化糖或核碱基。
术语“约”通常意指确切的数字并不重要。因此,具有一个或两个较少核苷残基或者一个到几个另外核苷残基的寡核苷酸被认为是以上描述的每个实施方案的等同物。
术语“可及的”通常意指当涉及本发明的化合物时,分子的相关部分能够被引发对化合物的预期反应所必要的细胞组分识别。
术语“激动剂”通常指的是与细胞的受体结合并诱导反应的物质。激动剂通常模拟天然存在的物质比如配体的作用。
术语“抗原”通常指的是被抗体或被t细胞抗原受体识别并选择性结合的物质。抗原可包括(但不限于)肽、蛋白、脂质、碳水化合物、核苷、核苷酸、核酸及其组合。抗原可为天然的或合成的并且通常诱导对所述抗原特异性的免疫反应。
“反义活性”意指可归因于基因沉默化合物与其靶核酸杂交的任何可检测或可测量的活性。在某些实施方案中,反义活性为由这种靶核酸编码的靶核酸或蛋白的量或表达的减少。
“基因沉默化合物”(本文也称为“gso”或“gsos”)意指包含两个或更多个单链反义寡核苷酸的寡聚化合物,所述单链反义寡核苷酸通过其5’-末端连接以使得能够存在两个或更多个可及的3’-末端。基因沉默化合物能够经历通过氢键键合与靶核酸的杂交。本发明的基因沉默化合物包括(但不限于)包含天然存在的核苷酸、修饰的核苷酸、修饰的寡核苷酸和/或骨架修饰的寡核苷酸的反义寡核苷酸。
“反义抑制”意指与不存在基因沉默化合物时的靶核酸水平或靶蛋白水平相比,在存在与靶核酸互补的基因沉默化合物的情况下靶核酸水平或靶蛋白水平的降低。
“反义寡核苷酸”意指具有允许与靶核酸的相应区域或节段杂交的核碱基序列的单链寡核苷酸。
术语“生物不稳定性”通常指的是分子在体内降解并随后失活的能力。对于寡核苷酸,这种降解由核酸外切酶活性和/或核酸内切酶活性引起,其中核酸外切酶活性指的是从寡核苷酸的3’或5’末端切割核苷酸,和核酸内切酶活性指的是在除了寡核苷酸末端以外的位置切割磷酸二酯键。
术语“载体”通常包括任何赋形剂、稀释剂、填充剂、盐、缓冲剂、稳定剂、增溶剂、油、脂质、含脂质囊泡、微球、脂质体包封或用于药用制剂的其他材料。应该理解,载体、赋形剂或稀释剂的特性将取决于特定应用的给予途径。含有这些材料的药学上可接受的制剂的制备描述于例如remington’spharmaceuticalsciences,第18版,编者a.gennaro,mackpublishingco.,easton,pa,1990中。
术语“共同给予”或“共同给予的”通常指的是给予至少两种不同的物质。共同给予指的是至少两种不同物质以任何顺序以单一剂量或单独剂量的同时给予,以及时间间隔量相隔多达几天的给予。
术语“与...组合”通常意指给予本发明基于寡核苷酸的化合物和另一种在治疗患者过程中不消除化合物的活性的用于治疗疾病或病症的药物。这种给予可以任何顺序进行,包括同时给予以及时间间隔量相隔从几秒到多达几天。这种联合治疗还可包括多于单次给予本发明的化合物和/或独立地给予其他药物。本发明的化合物和其他药物的给予可通过相同或不同的途径进行。
术语“互补”旨在意指第一核酸和第二核酸的核碱基之间配对的能力。
“邻接核碱基”意指彼此紧邻的核碱基。
术语“个体”或“受试者”或“患者”通常指的是哺乳动物,比如人。
“nlrp3核酸”意指编码nlrp3的任何核酸。例如,在某些实施方案中,nlrp3核酸包括编码nlrp3的dna序列、从编码nlrp3的dna(包括包含内含子和外显子的基因组dna)转录的rna序列和编码nlrp3的mrna序列。“nlrp3mrna”意指编码nlrp3蛋白的mrna。
“完全互补”或“100%互补”意指第一核酸的每个核碱基在第二核酸中具有互补核碱基。在某些实施方案中,第一核酸为反义化合物和靶核酸为第二核酸。
“杂交”意指互补核酸分子的退火。在某些实施方案中,互补核酸分子包括反义化合物和靶核酸。
“抑制nlrp3mrna或蛋白表达”意指与不存在本发明基因沉默化合物时的nlrp3表达和/或蛋白水平相比,在存在本发明基因沉默化合物的情况下nlrp3mrna表达和/或蛋白水平的降低。
术语“线性合成”通常指的是在寡核苷酸的一端开始并线性推进至另一端的合成。线性合成允许将相同或不同的(就长度、掺入的碱基组成和/或化学修饰而言)单体单元掺入到寡核苷酸。
术语“哺乳动物”明确地旨在包括温血脊椎动物,非限制性地包括人、非人灵长类、大鼠、小鼠、猫、狗、马、牛、奶牛、猪、绵羊和兔。
术语“核苷”通常指的是由糖(通常为核糖、脱氧核糖、戊糖、阿拉伯糖或己糖)以及嘌呤或嘧啶碱基组成的化合物。
术语“核苷酸”通常指的是包含与糖连接的含磷基团的核苷。
术语“修饰的核苷”或“核苷酸衍生物”通常为包括修饰的杂环碱基、修饰的糖部分或其任何组合的核苷。在一些实施方案中,修饰的核苷或核苷酸衍生物为如本文描述的非天然嘧啶或嘌呤核苷。为了本发明的目的,修饰的核苷或核苷酸衍生物、嘧啶或嘌呤类似物或者非天然存在的嘧啶或嘌呤可互换使用,并且指的是包括非天然存在的碱基和/或非天然存在的糖部分的核苷。为了本发明的目的,如果碱基不是鸟嘌呤、胞嘧啶、腺嘌呤、胸腺嘧啶或尿嘧啶,则认为其为非天然的,并且如果糖不是β-核糖-呋喃糖苷或2’-脱氧核糖-呋喃糖苷,则认为其为非天然的。
本文使用的术语“修饰的寡核苷酸”描述一种寡核苷酸,其中其核苷酸中的至少两个经合成键(即不为在一个核苷酸的5’末端和另一个核苷酸的3’末端之间的磷酸二酯键的键,其中5’核苷磷酸用任何数目的化学基团置换)而共价连接。术语“修饰的寡核苷酸”还包括2’-o,4’-c-亚甲基-β-d-呋喃核糖基核酸、阿拉伯糖核酸、取代的阿拉伯糖核酸、己糖核酸、肽核酸、吗啉代和具有至少一个具有修饰的碱基和/或糖的核苷酸(比如2’-o-取代的、5-甲基胞嘧啶和/或3’-o-取代的核糖核苷酸)的寡核苷酸。
术语“核酸”包括由其转录的基因组区域或rna分子。在一些实施方案中,核酸为mrna。
术语“接头”通常指的是可通过经糖、碱基或骨架共价或非共价键合连接至寡核苷酸的任何部分。非共价连接非限制性地可为静电相互作用、疏水相互作用、π-堆积相互作用、氢键键合及其组合。这种非共价连接的非限制性实例包括watson-crick碱基配对、hoogsteen碱基配对和碱基堆积。接头可用于连接两个或更多个核苷,或者可连接至寡核苷酸中的5’和/或3’末端核苷酸。这种接头可为非核苷酸接头或核苷接头。
术语“非核苷酸接头”通常指的是除了可通过共价或非共价键合连接至寡核苷酸的两个核苷酸之间的直接连接以外的化学部分。优选地,这种非核苷酸接头的长度为约2埃-约200埃,并且可为顺式或反式取向。
术语“核苷酸间连接”通常指的是通过其糖(例如3’-3’、2’-3’、2’-5’、3’-5’、5’-5’)连接两个核苷的由相邻核苷之间的磷原子和荷电或中性基团(例如磷酸二酯、硫代磷酸酯、二硫代磷酸酯或甲基膦酸酯)组成的化学连接。
术语“寡核苷酸”指的是由多个连接的核苷单元形成的多核苷,其可包括例如脱氧核糖核苷酸或核糖核苷酸、合成或天然核苷酸、磷酸二酯或修饰的连接、天然碱基或修饰的碱基、天然糖或修饰的糖或这些组分的组合。核苷单元可为病毒、细菌、细胞碎片或基于寡核苷酸的组成(例如sirna和微rna)的部分。这种寡核苷酸也可得自现有的核酸来源,包括基因组或cdna,但是优选地通过合成方法产生。在某些实施方案中,每个核苷单元包括杂环碱基和呋喃戊糖基、海藻糖、阿拉伯糖、2’-脱氧-2’-取代的核苷、2’-脱氧-2’-取代的阿拉伯糖、2’-o-取代的阿拉伯糖或己糖糖基。核苷残基可通过许多已知的核苷间连接中的任何一种彼此偶联。这种核苷间连接非限制性地包括磷酸二酯、硫代磷酸酯、二硫代磷酸酯、甲基膦酸酯、烷基膦酸酯、烷基硫代膦酸酯、磷酸三酯、氨基磷酸酯、硅氧烷、碳酸酯、烷氧羰基、乙酰胺酯、氨基甲酸酯,吗啉代、硼烷基(borano)、硫醚、桥连氨基磷酸酯、桥连亚甲基膦酸酯、桥连硫代磷酸酯和砜核苷间连接。术语“寡核苷酸”还包括具有一个或多个立体定向性核苷间连接(例如(rp)-或(sp)-硫代磷酸酯、烷基膦酸酯或磷酸三酯连接)的多核苷。本文使用的术语“寡核苷酸”和“二核苷酸”明确地旨在包括具有任何这种核苷间连接的多核苷和二核苷,无论连接是否包含磷酸基。在某些示例性的实施方案中,这些核苷间连接可为磷酸二酯、硫代磷酸酯或二硫代磷酸酯连接或其组合。在示例性的实施方案中,合成寡核苷酸的核苷酸通过至少一个硫代磷酸酯核苷酸间连接来连接。硫代磷酸酯连接可为rp和sp对映体的混合物,或者其可为有规立构或基本上有规立构的rp或sp形式(参见iyer等人(1995)tetrahedronasymmetry6:1051-1054)。在某些实施方案中,本发明反义组合物中的一种或多种寡核苷酸含有一个或多个2’-o,4’-c-亚甲基-β-d-呋喃核糖基核酸,其中核糖用2’和4’碳之间的键修饰,其将核糖固定在3’-endo结构构象中。
术语“肽”通常指的是具有足够长度和组成以影响生物反应例如抗体产生或细胞因子活性的氨基酸的寡聚物或聚合物,无论该肽是否为半抗原。术语“肽”可包括修饰的氨基酸(无论是否天然存在或非天然存在的),其中这种修饰包括(但不限于)磷酸化、糖基化、聚乙二醇化、脂质化和甲基化。
术语“药学上可接受的”意指不干扰本发明化合物的有效性或本发明化合物的生物活性的非毒性材料。
术语“生理学上可接受的”指的是与生物系统比如细胞、细胞培养物、组织或生物体相容的非毒性材料。优选地,生物系统为活生物体,比如哺乳动物,特别是人。
术语“预防有效量”通常指的是足以预防或减少不期望的生物效应发展的量。
“部分”意指核酸的限定数目的邻接(即连接)核碱基。在某些实施方案中,部分为靶核酸的限定数目的邻接核碱基。在某些实施方案中,部分为反义化合物的限定数目的邻接核碱基。
“单链寡核苷酸”意指不与互补链杂交的寡核苷酸。
“可特异性杂交的”指的是在反义寡核苷酸和靶核酸之间具有足够程度的互补性以诱导期望的效应,同时在期望特异性结合的条件下,即在体内测定和治疗性治疗的情况下在生理条件下对非靶核酸呈现最小或没有影响的基因沉默化合物。
“靶向”或“靶向的”意指设计和选择将与靶核酸特异性杂交并诱导期望的效应的基因沉默化合物的过程。
“靶核酸”、“靶rna”、“靶mrna”和“靶rna转录物”均指的是能够被基因沉默化合物靶向的核酸。
“靶节段”意指基因沉默化合物靶向的靶核酸的核苷酸序列。“5’靶位点”指的是靶节段的最5’-核苷酸。“3’靶位点”指的是靶节段的最3’-核苷酸。
术语“治疗有效量”或“药用有效量”通常指的是足以影响期望的生物效应比如有益结果的量,非限制性地包括预防、减少、改善或消除疾病或障碍的体征或症状。因此,药用组合物或方法的每种活性组分的总量足以显示出有意义的患者益处,例如(但不限于)治愈以免疫刺激为特征的慢性病症。因此,“药用有效量”将取决于其中其被给予的情况。药用有效量可以一种或多种预防性或治疗性给予来给予。当应用于单独给予的单个活性成分时,该术语指的是单独成分。当应用于组合时,该术语指的是导致治疗效果的活性成分的组合量,无论是组合、连续还是同时给予。
术语“治疗”通常指的是旨在获得有益或期望的结果的方法,其可包括缓解症状,或者延缓或改善疾病进展。
术语“基因表达”通常指的是来自基因的信息用于合成功能性基因产物(其可为蛋白)的过程。该过程可能涉及蛋白的转录、rna剪接、翻译和翻译后修饰,并且可包括mrna、rna前体、核糖体rna和其他用于蛋白合成的模板。
在某些实施方案中提供用于抑制nlrp3mrna或蛋白表达的方法、化合物和组合物。在某些实施方案中,化合物为反义寡核苷酸、双链或单链sirna化合物或基因沉默化合物。
本文使用的本发明基因沉默化合物包含两个或更多个在其5’末端连接的单链反义寡核苷酸,其中化合物具有两个或更多个可及的3’末端。本发明基于寡核苷酸的化合物的一般结构可用以下式i描述:
3’-nn...n1n2n3n4-5’-x-5’-n8n7n6n5...nm-3’(式i)
其中x为核苷酸接头或非核苷酸接头,n1-n8在每次出现时独立地为核苷酸或核苷酸衍生物,nm和nn在每次出现时独立地为核苷酸或核苷酸衍生物,并且其中m和n独立地为数字0-约40。
组分寡核苷酸在5’末端的连接独立于其他寡核苷酸连接,并且可利用核苷的2’或3’羟基位置直接经5’、3’或2’羟基,或者间接经非核苷酸接头或核苷。连接还可利用5’末端核苷酸的官能化糖或核碱基。
在某些实施方案中提供靶向人nlrp3核酸的基因沉默化合物。在某些实施方案中,人nlrp3核酸为以genbank登录号nm_004895.4(作为seqidno:95结合于此)所示的序列。
在某些实施方案中提供靶向小鼠nlrp3核酸的基因沉默化合物。在某些实施方案中,小鼠nlrp3核酸为以genbank登录号nm_145827.3(作为seqidno:96结合于此)所示的序列。
某些实施方案提供包含两个寡核苷酸的基因沉默化合物,寡核苷酸各自独立地由12-30个核苷酸组成,核苷酸具有包含与seqidno:95的等长部分互补的至少12个邻接核碱基的部分的核碱基序列。某些实施方案提供包含两个寡核苷酸的化合物,寡核苷酸各自独立地由15-25个核苷酸组成,核苷酸具有包含与seqidno:95的等长部分互补的至少12个邻接核碱基的部分的核碱基序列。某些实施方案提供包含修饰的寡核苷酸的化合物,修饰的寡核苷酸由18-21个核苷酸组成,核苷酸具有包含与seqidno:95的等长部分互补的至少12个邻接核碱基的部分的核碱基序列。在某些实施方案中,基因沉默化合物的两个寡核苷酸各自独立地包含与seqidno:95的等长部分互补的至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个或至少19个邻接核碱基。
在某些实施方案中,基因沉默化合物的两个寡核苷酸各自独立地包含与seqidno:95的等长部分互补的至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个或至少23个邻接核碱基。
某些实施方案提供包含两个寡核苷酸的基因沉默化合物,寡核苷酸各自独立地包含由seqidno:42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61,62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的至少12个邻接核碱基组成的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61,62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的至少12个邻接核碱基组成,并且与seqidno:95至少80%互补的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61,62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的至少12个邻接核碱基组成,并且与seqidno:95至少85%互补的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61,62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的至少12个邻接核碱基组成,并且与seqidno:95至少90%互补的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61,62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的至少12个邻接核碱基组成,并且与seqidno:95至少95%互补的部分。
在某些实施方案中,基因沉默化合物的寡核苷酸的核碱基序列独立地在其整个长度上与seqidno:95的核碱基序列至少90%互补。在某些实施方案中,基因沉默化合物的寡核苷酸的核碱基序列独立地在其整个长度上与seqidno:95的核碱基序列至少95%互补。在某些实施方案中,基因沉默化合物的寡核苷酸在其整个长度上与seqidno:95至少99%互补。在某些实施方案中,基因沉默化合物的寡核苷酸的核碱基序列在其整个长度上与seqidno:95的核碱基序列100%互补。
某些实施方案提供包含两个寡核苷酸的基因沉默化合物,寡核苷酸各自独立地由12-30个核苷酸组成,核苷酸具有包含与seqidno:96的等长部分互补的至少12个邻接核碱基的部分的核碱基序列。某些实施方案提供包含两个寡核苷酸的化合物,寡核苷酸各自独立地由15-25个核苷酸组成,核苷酸具有包含与seqidno:96的等长部分互补的至少12个邻接核碱基的部分的核碱基序列。某些实施方案提供包含修饰的寡核苷酸的化合物,修饰的寡核苷酸由18-21个核苷酸组成,核苷酸具有包含与seqidno:96的等长部分互补的至少12个邻接核碱基的部分的核碱基序列。在某些实施方案中,基因沉默化合物的两个寡核苷酸各自独立地包含与seqidno:96的等长部分互补的至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个或至少21个邻接核碱基。
在某些实施方案中,基因沉默化合物的两个寡核苷酸各自独立地包含与seqidno:96的等长部分互补的至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个或至少23个邻接核碱基。
某些实施方案提供包含两个寡核苷酸的基因沉默化合物,寡核苷酸各自独立地包含由seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41的至少12个邻接核碱基组成的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41的至少12个邻接核碱基组成,并且与seqidno:96至少80%互补的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41的至少12个邻接核碱基组成,并且与seqidno:96至少85%互补的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41的至少12个邻接核碱基组成,并且与seqidno:96至少90%互补的部分。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,寡核苷酸各自独立地包含由seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41的至少12个邻接核碱基组成,并且与seqidno:96至少95%互补的部分。
在某些实施方案中,基因沉默化合物的寡核苷酸的核碱基序列独立地在其整个长度上与seqidno:96的核碱基序列至少90%互补。在某些实施方案中,基因沉默化合物的寡核苷酸的核碱基序列独立地在其整个长度上与seqidno:96的核碱基序列至少95%互补。在某些实施方案中,基因沉默化合物的寡核苷酸在其整个长度上与seqidno:96至少99%互补。在某些实施方案中,基因沉默化合物的寡核苷酸的核碱基序列在其整个长度上与seqidno:96的核碱基序列100%互补。
在某些实施方案中,基因沉默化合物的寡核苷酸长度独立地为4-44个核苷酸。在某些实施方案中,基因沉默化合物的寡核苷酸长度独立地为12-30个核苷酸。换句话说,寡核苷酸为12-30个连接的核碱基。在其他实施方案中,寡核苷酸独立地由15-28、18-24、19-22或20个连接的核碱基组成。在某些这种实施方案中,寡核苷酸长度独立地由8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30个连接的核碱基或由任何两个以上数值限定的范围组成。
在某些这种实施方案中,寡核苷酸长度为19个连接的核碱基。
在某些实施方案中,靶区域为靶核酸的结构限定区域。例如,靶区域可包括3’utr、5’utr、外显子、内含子、外显子/内含子连接区、编码区域、翻译起始区域、翻译终止区域或其他限定的核酸区域。nlrp3的结构限定区域可通过登录号从序列数据库比如ncb1获得,并且这种信息通过参照结合于此。在某些实施方案中,靶区域可包括从靶区域内的一个靶节段的5’靶位点到同一靶区域内的另一个靶节段的3’靶位点的序列。
某些实施方案提供一种包含如本文描述的基因沉默化合物或其盐和药学上可接受的载体或稀释剂的组合物。某些实施方案提供一种包含两种或更多种如本文描述的基因沉默化合物或其盐和药学上可接受的载体或稀释剂的组合物。两种或更多种基因沉默化合物可抑制同一靶标的mrna或蛋白表达或者可抑制不同靶标的mrna或蛋白表达。
在某些实施方案中,本发明的基因沉默化合物包含两个经磷酸二酯、硫代磷酸酯或非核苷接头在其5’-5’末端连接的相同或不同序列。包含相同序列的本发明基因沉默化合物能够经watson-crick氢键相互作用与特定mrna结合并抑制mrna和蛋白表达。包含不同序列的本发明基因沉默化合物能够与一个或多个mrna靶标的两个或更多个不同区域结合并抑制mrna和蛋白表达。这种化合物包含与靶mrna互补的异核苷酸(heteronucleotide)序列,并通过watson-crick氢键键合形成稳定的双链体结构。
基因沉默化合物的寡核苷酸通过其5’末端连接以使得能够存在两个或更多个可及的3’末端。在某些实施方案中,寡核苷酸通过表1中列出的一种或多种非核苷酸接头连接。在某些实施方案中,表1中列出的单个接头用于连接基因沉默化合物的寡核苷酸。在某些实施方案中,接头为小分子接头,比如甘油或式ho-(ch2)o-ch(oh)-(ch2)p-oh的甘油同系物,其中o和p独立地为1-约6、1-约4或约1-约3的整数。在一些其他实施方案中,小分子接头为1,3-二氨基-2-羟基丙烷的衍生物。一些这种衍生物具有式ho-(ch2)m-c(o)nh-ch2-ch(oh)-ch2-nhc(o)-(ch2)m-oh,其中m为0-约10、0-约6、2-约6或2-约4的整数。
代表性的非核苷酸接头示出在表1中。
在一些实施方案中,小分子接头为甘油或式ho-(ch2)o-ch(oh)-(ch2)p-oh的甘油同系物,其中o和p独立地为1-约6、1-约4或约1-约3的整数。在一些其他实施方案中,小分子接头为1,3-二氨基-2-羟基丙烷的衍生物。一些这种衍生物具有式ho-(ch2)m-c(o)nh-ch2-ch(oh)-ch2-nhc(o)-(ch2)m-oh,其中m为0-约10、0-约6、2-约6或2-约4的整数。
在某些实施方案中,本发明基因沉默化合物的两个或更多个寡核苷酸可如表2中显示的那样连接。
在式ii和/或v的某些实施方案中,l为接头或核苷酸连接,并且结构域a和/或结构域b为被设计成选择性地与相同靶rna序列或不同靶rna序列杂交的反义寡核苷酸。
在式ii、iii、iv或v的某些实施方案中,l为接头,并且结构域a和/或结构域b和/或结构域c和/或结构域d为被设计成选择性地与相同靶rna序列或不同靶rna序列杂交的反义寡核苷酸。例如,在一个实施方案中,式ii和/或iii的结构域a和/或结构域b和/或结构域c为被设计成选择性地与相同靶rna序列杂交的反义寡核苷酸。在该实施方案中,结构域a和/或结构域b和/或结构域c被设计成与靶rna序列上的相同区域或相同靶rna序列的不同区域杂交。
在本发明该方面的进一步实施方案中,结构域a、结构域b、结构域c和结构域d独立地为基于rna或dna的寡核苷酸。在该实施方案的某些方面,寡核苷酸包含混合骨架寡核苷酸。
在另一个实施方案中,结构域a和/或结构域b和/或结构域c和/或结构域d中的一个或多个为被设计成选择性地与一个靶rna序列杂交的反义寡核苷酸,和剩余的结构域a和/或结构域b和/或结构域c和/或结构域d中的一个或多个为被设计成选择性地与不同的靶rna序列杂交的反义寡核苷酸。
在另一个实施方案中,结构域a和/或结构域b和/或结构域c和/或结构域d中的一个或多个为与互补的基于rna的寡核苷酸杂交的基于rna的寡核苷酸,使得结构域包含sirna分子。
本发明的这些基因沉默化合物可通过本领域公知的方法制备,比如氨基磷酸酯或h-膦酸酯化学,其可手动或通过自动合成仪实施。本发明的合成反义寡核苷酸也可以多种方式修饰而不损害其与mrna杂交的能力。这种修饰可包括至少一个为烷基膦酸酯、硫代磷酸酯、二硫代磷酸酯、甲基膦酸酯、磷酸酯、烷基硫代膦酸酯、氨基磷酸酯、氨基甲酸酯、碳酸酯、磷酸羟基、乙酰胺酯或羧甲基酯或这些的组合的寡核苷酸的核苷酸间连接,以及在一个核苷酸的5’末端和另一个核苷酸的3’末端之间的其他核苷酸间连接,其中5’核苷酸磷酸二酯键已经用任何数目的化学基团置换。
本发明的合成反义寡核苷酸可包含核苷酸间连接的组合。例如,美国专利第5149797号描述了具有介于甲基膦酸酯或氨基磷酸酯侧翼区域之间的硫代磷酸酯核心区域的传统嵌合寡核苷酸。另外,美国专利第5652356号公开了“倒置的”嵌合寡核苷酸,其包含一个或多个侧翼为一个或多个寡核苷酸硫代磷酸酯区域的非离子寡核苷酸区域(例如烷基膦酸酯和/或氨基磷酸酯和/或磷酸三酯核苷间连接)。具有修饰的核苷酸间连接的各种合成的反义寡核苷酸可按照标准方法制备。在某些实施方案中,硫代磷酸酯键可为rp和sp对映体的混合物,或者其可以有规立构或基本上有规立构的rp或sp形式制备。
本发明基因沉默化合物的其它修饰包括在寡核苷酸分子的内部或末端的那些修饰,和包括添加核苷间磷酸酯连接的分子,比如在氨基和末端核糖之间具有不同数目碳残基的胆固醇、胆固醇基或二胺化合物;脱氧核糖和磷酸酯修饰,其切割或交联至相对链或者与基因组结合的相关酶或其他蛋白。这种修饰的寡核苷酸的实例包括具有修饰的碱基和/或糖,比如2’-o,4’-c-亚甲基-β-d-呋喃核糖基、或阿拉伯糖置换核糖的寡核苷酸;或具有糖的3’,5’-取代的寡核苷酸,所述糖在其3’和5’两个位置与除了羟基(在其3’位置)以外和除了磷酸基(在其5’位置)以外的化学基团连接。
本发明基于寡核苷酸的化合物的糖修饰的其他实例包括核糖部分的2’位置的修饰,所述修饰包括(但不限于)用含有1-6个饱和或不饱和碳原子的-o-烷基、或用-o-芳基或具有2-6个碳原子的-o-烯丙基进行2’-o-取代,其中这种-o-烷基、-o-芳基或-o-烯丙基可为未取代的或者可例如用卤代、羟基、三氟甲基、氰基、硝基、酰基、酰氧基、烷氧基、羧基、烷氧羰基或氨基取代。这些取代都不旨在排除在核糖的情况下存在具有天然2’-羟基的其他残基或者在脱氧核糖的情况下存在2’h-。
本发明的基因沉默化合物可包含一个或多个核糖核苷酸。例如,美国专利第5652355号公开了具有dna核心区域侧翼的2’-o-取代的核糖核苷酸区域的传统杂合寡核苷酸。美国专利第5652356号公开了一种“倒置的”杂合寡核苷酸,其包括包含位于两个寡脱氧核糖核苷酸区域之间的2’-o-取代的(或2’oh,未取代的)rna区域的寡核苷酸,一种相对于“传统的”杂合寡核苷酸“倒置的”结构。本发明特别有用的寡核苷酸的非限制性实例在其3’、5’或3’和5’末端具有2’-o-烷基化的核糖核苷酸,具有至少4个,并且在一些示例性实施方案中具有5个如此修饰的邻接核苷酸。2’-o-烷基化基团的非限制性实例包括2’-o-甲基、2’-o-乙基、2’-o-丙基、2’-o-丁基和2’-o-甲氧基-乙基。
本发明基于寡核苷酸的化合物可便利地使用实施例1中进一步描述的自动合成仪和亚磷酰胺方法合成。在一些实施方案中,本发明基于寡核苷酸的化合物通过线性合成方法合成。
一种备选的合成方式为“平行合成”,其中合成从中心接头部分向外进行。如美国专利第5912332号中描述的那样,可使用固体载体连接的接头进行平行合成。或者,可使用通用固体载体(比如磷酸酯连接的可控孔度玻璃)载体。
本发明基于寡核苷酸的化合物的平行合成与线性合成相比具有几个优点:(1)平行合成允许掺入相同的单体单元;(2)与线性合成不同,两个(或全部)单体单元同时合成,从而合成步骤的数目和合成需要的时间与单体单元相同;和(3)合成步骤的减少改善最终免疫调节性寡核糖核苷酸产物的纯度和产率。
在通过线性合成或平行合成方案合成结束时,如果掺入修饰的核苷,则本发明基于寡核苷酸的化合物可合宜地用浓氨溶液或如亚磷酰胺(phosphoramidite)供应商推荐的那样脱保护。产物基于寡核苷酸的化合物优选地通过反相hplc纯化、脱三苯甲基、脱盐和透析。
在某些实施方案中,本发明基因沉默化合物的寡核苷酸选自以下表3中显示的寡核苷酸的非限制性列表。表3中显示的寡核苷酸具有硫代磷酸酯(ps)连接,但是也可包括磷酸二酯键。然而,本领域技术人员将认识到,可包括基于磷酸二酯或非磷酸二酯部分的其他连接。
表3
针对人nlrp3的gso的化合物名称基于如在seqidno:95中描绘的寡核苷酸靶位点。针对小鼠nlrp3的gso的化合物名称基于其seqidno:96的靶位点。例如,包含oligo#13的两个拷贝的gso(例如3-caacctgacccgtgaccct-5’-x-5’-tcccagtgcccagtccaac-3’,其中x代表非核苷酸接头)本文称为例如“943”或“m943”或“gso934”、“mgso-934”或“gso-m934”或“nlrp-934”或“gsonlrp-934”。另外,包含两个不同寡核苷酸比如oligo#93和oligo#94的gso(例如3’-agtcaatctcctacaagga-5’-x-5’-agttctgtgttatggtcag-3’,其中x代表非核苷酸接头)本文称为例如“4101/4265”、“gso4101/4265”或“nlrp-4101/4265”或“gsonlrp-4101/4265”。
某些实施方案提供包含独立地选自表3中列出的寡核苷酸的两个寡核苷酸的基因沉默化合物。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,后者各自独立地包含seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的序列或其组合。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,后者各自独立地包含seqidno:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41的序列或其组合。在某些实施方案中,基因沉默化合物包含两个寡核苷酸,后者各自独立地包含seqidno:42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93或94的序列或其组合。在某些实施方案中,基因沉默化合物的寡核苷酸相同。在某些实施方案中,基因沉默化合物的寡核苷酸不同。
在某些实施方案中,本发明提供一种包含本发明的基因沉默化合物和一种或多种疫苗、抗原、抗体、细胞毒性剂、化学治疗剂(传统化学治疗和现代靶向治疗两者)、激酶抑制剂、变应原、抗生素、激动剂、拮抗剂、反义寡核苷酸、核酶、rnai分子、sirna分子、mirna分子、适体、蛋白、基因治疗载体、dna疫苗、佐剂、共刺激分子或其组合的组合物。
在某些实施方案中,本发明提供一种用于抑制nlrp3mrna或蛋白表达的方法,所述方法包括使细胞与本发明的基因沉默化合物接触。在某些实施方案中,细胞可与两种或更多种靶向nlrp3的不同区域的基因沉默化合物接触。
在某些实施方案中,本发明的基因沉默化合物可用于治疗和/或预防其中抑制nlrp3表达将是有益的疾病。
某些实施方案进一步提供一种在动物中减少nlrp3mrna或蛋白表达的方法,包括给予动物如本文描述的基因沉默化合物或组合物以在动物中减少nlrp3mrna或蛋白表达。在某些实施方案中,动物为人。在某些实施方案中,减少nlrp3mrna或蛋白表达预防、治疗、改善或减缓疾病的进展。在某些实施方案中,可给予两种或更多种靶向nlrp3的不同区域的基因沉默化合物。
在某些实施方案中提供用于治疗疾病或障碍的方法,包括给予动物如本文描述的基因沉默化合物或组合物以在动物中减少nlrp3mrna或蛋白表达。在某些实施方案中,动物为人。在某些实施方案中,可给予两种或更多种靶向nlrp3的不同区域的基因沉默化合物。
在某些实施方案中提供用于在有需要的个体中治疗、预防或改善与nlrp3相关的疾病、障碍和病症的方法、化合物和组合物。还考虑用于制备用于治疗、预防或改善与nlrp3相关的疾病、障碍或病症的药物的方法和化合物。在某些实施方案中,可给予两种或更多种靶向nlrp3的不同区域的基因沉默化合物。
nlrp3相关的疾病、障碍和病症包括(但不限于)将得益于nlrp3mrna或蛋白表达的调节的家族性寒冷性自身炎症性综合征(fcas)、穆-韦二氏综合征(mws)、慢性婴儿神经皮肤关节(cinca)综合征、新生儿发病的多系统炎症性疾病(nomid)、间质性膀胱炎/膀胱疼痛综合征(ic/bps)、多发性硬化症、类风湿性关节炎、痛风、阿尔茨海默病、变态反应和哮喘、炎症性肠病、动脉粥样硬化、ii型糖尿病、葡萄膜炎、高血压、牛皮癣、肥胖症、慢性阻塞性肺病、非酒精性脂肪性肝炎、粘膜炎、帕金森病、石棉肺、肝细胞瘤、间皮瘤、慢性肾病、施尼茨勒综合征、蜂窝组织炎、结膜炎、干眼综合征、坏疽性脓皮病、papa综合征(化脓性关节炎、坏疽性脓皮病和痤疮)及任何其他疾病、障碍或病症。
在某些实施方案中提供用于治疗、预防或改善nlrp3相关疾病的nlrp3基因沉默化合物。在某些实施方案中,nlrp3基因沉默化合物能够在细胞、组织或动物中抑制nlrp3mrna和/或nlrp3蛋白表达。
某些实施方案提供包括给予动物如本文描述的基因沉默化合物的方法。在某些实施方案中,可给予两种或更多种靶向nlrp3的不同区域的基因沉默化合物。
还提供用于制备用于治疗、预防或改善疾病的药物的方法和基因沉默化合物。
某些实施方案提供如本文描述的基因沉默化合物在制造用于治疗、改善、预防疾病的药物中的用途。
某些实施方案提供通过与如本文描述的另外药物或治疗的组合治疗,用于治疗、预防或改善如本文描述的疾病的如本文描述的基因沉默化合物。药物或治疗可共同给予或同时给予。
某些实施方案提供如本文描述的基因沉默化合物在制造通过与如本文描述的另外药物或治疗的组合治疗,用于治疗、预防或改善如本文描述的疾病的药物中的用途。药物或治疗可共同给予或同时给予。
某些实施方案提供如本文描述的基因沉默化合物在制造用于在随后被给予如本文描述的另外药物或治疗的患者中治疗、预防或改善如本文描述的疾病的药物中的用途。
在本发明的任何方法中,本发明的基因沉默化合物可通过单独产生直接的基因表达调节作用和/或与可用于治疗或预防疾病或病症且不会减少本发明基因沉默化合物的基因表达调节作用的任何其他药物组合,而起不同作用。在本发明的任何方法中,用于治疗或预防疾病或病症的药物包括(但不限于)疫苗、抗原、抗体(优选地单克隆抗体)、细胞毒性剂、激酶抑制剂、变应原、抗生素、sirna分子、反义寡核苷酸、tlr拮抗剂(例如tlr3和/或tlr7的拮抗剂和/或tlr8的拮抗剂和/或tlr9的拮抗剂)、化学治疗剂(传统化学治疗和现代靶向治疗两者)、靶向治疗剂、活化细胞、肽、蛋白、基因治疗载体、肽疫苗、蛋白疫苗、dna疫苗、佐剂和共刺激分子(例如细胞因子、趋化因子、蛋白配体、反式激活因子、肽或包含修饰氨基酸的肽)或其组合。或者,本发明的基因沉默化合物可与其他化合物(例如脂质或脂质体)组合给予,以增强本发明基于寡核苷酸的化合物的基因表达调节的特异性或幅度。
在本发明的任何方法中,单独或与任何其他药物组合的本发明基因沉默化合物可经任何合适的途径给予,非限制性地包括肌内、肠胃外、粘膜、口服、舌下、瘤内、经皮、局部、吸入、鞘内、鼻内、气雾剂、眼内、气管内、直肠内、阴道、通过基因枪、皮肤贴片或以滴眼液或漱口水形式。在本发明的任何方法中,单独或与任何其他药物组合的本发明基因沉默化合物可直接给予组织或器官,比如(但不限于)眼、膀胱、肝、肺、肾或肺。在某些实施方案中,单独或与任何其他药物组合的本发明基因沉默化合物的给予为通过肌内给予。在某些实施方案中,单独或与任何其他药物组合的本发明基因沉默化合物的给予为通过粘膜给予。在某些实施方案中,单独或与任何其他药物组合的本发明基因沉默化合物的给予为通过眼内给予。在某些实施方案中,单独或与任何其他药物组合的本发明基因沉默化合物的给予为通过口服给予。在某些实施方案中,单独或与任何其他药物组合的本发明基因沉默化合物的给予为通过直肠内给予。在某些实施方案中,单独或与任何其他药物组合的本发明基因沉默化合物的给予为通过鞘内给予。
本发明基因沉默化合物的治疗性组合物的给予可使用已知程序,使用有效量持续有效减少疾病的症状或替代标志物的有效时间来实施。例如,用于治疗疾病和/或障碍的本发明基因沉默化合物的有效量可为缓解或减轻症状、或者延缓或改善疾病和/或障碍必要的量。在给予调节基因表达的组合物的情况下,本发明基因沉默化合物的有效量为与不存在本发明基因沉默化合物的情况下的基因表达相比,足以实现期望的调节的量。用于任何特定应用的有效量可依例如以下因素而变化:所治疗的疾病或病症、所给予的特定化合物、受试者的大小或者疾病或病症的严重程度。本领域的普通技术人员可凭经验确定特定化合物的有效量而不需要过度的实验。
当全身性给予时,治疗组合物优选地以足以达到约0.0001微摩尔-约10微摩尔的本发明基因沉默化合物的血液水平的剂量给予。对于局部给予,比这低得多的浓度可能是有效的,并且可耐受高得多的浓度。优选地,本发明基因沉默化合物的总剂量在每患者每天约0.001mg-每kg体重每天约200mg的范围内。在某些实施方案中,总剂量可为每天一次、每周两次或每周一次给予0.08、0.16、0.32、0.48、0.32、0.64、1、10或30mg/kg体重。可以期望作为单一治疗事件同时或依次给予个体治疗有效量的一种或多种本发明的治疗组合物。
本发明该方面的方法可用于基因表达的模型研究。方法也可用于预防性或治疗性治疗人或动物疾病。例如,方法可用于儿科和兽医抑制基因表达应用。
以下实施例旨在进一步说明某些优选的本发明实施方案,而不旨在限制本发明的范围。
实施例
细胞培养条件和试剂
细胞裂解缓冲液、nlrp3和α/β-微管蛋白抗体来自cellsignalingtechnology(danvers,ma)。抗兔igg-辣根过氧化物酶(hrp)缀合物来自santacruzbiotechnology,inc.(santacruz,ca)。bio-rad蛋白试剂、readygel、laemmli样品缓冲液和pvdf膜来自bioradlaboratories(hercules,ca),而westernlightningpluschemiluminescence试剂盒来自perkinelmerlifesciences(waltham,ma)。rneasy试剂盒和taqman基因表达测定和pcr试剂分别购自qiagen和thermofisherscientific。hyblotcl放射自显影胶片购自denvillescientific(metuchen,nj)。人和小鼠il-18和il-1βelisa试剂盒购自r&dsystems(minneapolis,mn)。atp购自invivogen(sandiego,ca)。所有其他化学品和试剂购自sigma(st.louis,mo)。
在补充有10%热灭活的确定fbs(hyclone)和抗生素(100iu/ml青霉素g/链霉素)的dulbecco改良的eagle培养基中培养鼠巨噬细胞样细胞j774a.1(美国典型培养物保藏中心(americantypeculturecollection),rockville,md)。所有其他培养试剂购自mediatech(gaithersburg,md)。
gso/脂质复合物的制备
对于所有基因沉默实验,使用不含抗生素的培养基。对于初级筛选,表4中显示的示例性gso以5和25nm最终浓度转染,而对于剂量-反应曲线实验,gso从50或100nm开始连续稀释。为了转染,就在使用之前,以培养基(无血清)或opti-mem制备合适的gso浓度,与lipofectaminernaimax(最终浓度3μl/ml)混合,并在室温下温育20分钟。
表4
其中x为甘油。
监测用gso处理的j774、thp-1或pbmc中的基因表达
对于基因沉默,将j774细胞以0.3×106细胞/ml的浓度在12孔培养板中铺板过夜。第二天早上更换培养基并加入gso/脂质复合物,并将细胞在37℃下温育24小时。
thp-1(在12孔板中100万个细胞/ml)细胞用佛波肉豆蔻醋酸(pma,500ng/ml)分化3小时,洗涤并重悬浮于rpmi完全培养基中且温育过夜。第二天加入gso/脂质复合物并继续温育24小时。
将6孔培养板中新鲜分离的人pbmc(10×106细胞/ml)与gso/脂质温育24小时。
在实验结束时,除去培养基,使用qiashredder试剂盒将沉淀的细胞裂解并匀浆化。
rna分析
使用qiagenrneasymini试剂盒,按照制造商的方案分离rna,并使用high-capacitycdnareversetranscription试剂盒进行逆转录。在steponeplustaqmanreal-timepcrsystem上使用对小鼠(mm00840904_ml)或人(hs00918082_ml)nlrp3特异性的taqmanfastuniversalpcrmastermix和探针(appliedbiosystems,carlsbad,ca)对所产生的cdna实施实时pcr。使用肽基脯氨酰异构酶b即ppib(分别针对小鼠和人的mm00478295_ml和hs00168719_m1)作为内源性对照,将样品中的靶mrna水平标准化。表达数据显示为用gso处理的样品中的nlrp3与pbs对照相比的相对量或log2fc(倍数对照)。
蛋白印迹和蛋白表达的定量
为了监测蛋白表达,在实验结束时收获细胞,用含有蛋白酶抑制剂的冷pbs洗涤,并然后悬浮于含有蛋白酶抑制剂的细胞裂解缓冲液中。将细胞在冰上裂解15分钟,短暂超声处理并以14000g离心20分钟。将上清液转移到新鲜小瓶中并储存在-70℃下直至进一步使用。使用bio-rad蛋白测定通过bradford法测量样品中的蛋白浓度。使用10%或4-15%梯度tris-hclready凝胶使样品(20-30μg/泳道)经受凝胶电泳,并蛋白印迹到pvdf膜上。在pbs-tween20中的5%脱脂乳中封闭1小时之后,将膜与合适的一次抗体温育过夜。使用hrp偶联的二次抗体,通过增强的化学发光法使标记的蛋白可视化,并使用scionimageanalysisprogram(scioncorp.,fredrick,md)进行定量。为了重新探测蛋白印迹,将印迹以pbs洗涤,在剥离缓冲液(thermoscientific)中温育30分钟。然后以pbst彻底洗涤,并使用以上描述的方案,用另一种一次抗体进行探测。
功能抑制研究
在用gso温育细胞24小时后,更换培养基并用脂多糖(100ng/ml)将细胞致敏4小时,且用atp(5mm)刺激1小时。通过elisa分析培养上清液的il-1β和il-18分泌。处理细胞裂解物以用于nlrp3的rna分离和定量实时pcr分析。
间质性膀胱炎动物模型中的mnlrp3gso
1.)用gsos.c.处理的急性cyp-ic模型
通过腹膜内注射以pbs稀释的200mg/kg环磷酰胺(sigma,st.louis,mo),在4组(n=10)7-9周龄的雌性cd1小鼠(charlesriverlaboratories,wilmington,ma)中诱导间质性膀胱炎。给予环磷酰胺后1小时,通过皮下注射不同剂量的nlrpgso或作为溶媒的pbs处理小鼠。使用5只相同性别和年龄的未经任何处理的首次实验cd1小鼠作为对照。
所有小鼠在疾病诱导后24小时时处死。收集尿样品并在-20℃下储存用于稍后进行细胞因子测定。收集膀胱,称重并储存在10%中性缓冲福尔马林中用于组织学处理,或储存在rnalater中用于基因表达分析。结果显示在图11-13中。
2.)用gsos.c.处理的慢性cyp-ic模型
通过在第0天、第1天和第3天腹膜内注射150mg/kg环磷酰胺,在两组(n=10)7-9周龄的雌性cd1小鼠中诱导间质性膀胱炎。给予环磷酰胺后1、2和3天,通过皮下注射25mg/kg的nlrpgso或作为溶媒的pbs处理小鼠。使用5只相同性别和年龄的未经处理的首次实验cd1小鼠作为对照。结果显示在图14中。
3.)用膀胱内滴注gso处理的急性cyp-ic模型
通过腹膜内注射200mg/kg以pbs稀释的环磷酰胺,在4组(n=5)7-9周龄的雌性cd1小鼠中诱导间质性膀胱炎。给予环磷酰胺后1小时,通过膀胱内(i.b.)滴注不同剂量的nlrpgso或作为溶媒的pbs处理小鼠。使用5只相同性别和年龄的未经任何处理的首次实验cd1小鼠作为对照。
所有小鼠在疾病诱导后24小时时处死。收集尿样品并在-20℃下储存用于稍后进行细胞因子测定。收集膀胱,称重并储存在10%中性缓冲福尔马林中用于组织学。结果显示在图15a和b中。
在实验性自身免疫性葡萄膜炎动物模型中的mnlrp3gso
为了诱导实验性自身免疫性葡萄膜炎,将6-7周龄的雄性b10-riii小鼠(jacksonlaboratories,barharbor,me,usa)在尾巴和两条大腿的根部注射100μg的irbp161-180肽(anaspec,sanjose,ca)和1mg在补充有结核分枝杆菌(voigtglobaldistributioninc.,lawrence,ks)的完全弗氏佐剂(sigma,stlois,mo)中以1:1体积/体积乳化至10mg/ml浓度的牛眼匀浆物(invisionbioresources,seattle,wa)。首次免疫之后4小时,小鼠i.p.注射0.5μg百日咳毒素(listbiologicallaboratories,campbell,california)。
所有小鼠在第7天接受100μgirbp/在不完全弗氏佐剂(sigma)中以1:1体积/体积乳化的1mg牛眼匀浆物的加强免疫。
在第8、10和13天,通过皮下注射15mg/kg的nlrpgso或作为溶媒的pbs来处理免疫的小鼠。使用5只相同性别和年龄的未经任何处理的首次实验的b10.riii小鼠作为对照。
在收集血液样品之后第14天时处死所有小鼠。收集来自每只小鼠的左眼并储存在10%中性缓冲福尔马林中用于组织学处理,并将右眼储存在rnalater中用于基因表达分析。结果显示在图16a-16d中。
等同物
本领域的技术人员将认识到,或者使用不超过常规的实验能够确定本文描述的特定物质和程序的许多等同物。例如,可使用与寡核苷酸重叠的反义寡核苷酸。这种等同物认为处于本发明的范围内,并且由以下权利要求覆盖。
尽管本发明已经参考其优选的实施方案具体显示和描述,但是本领域的技术人员将会理解,可在其中进行形式和细节的各种变化而不背离附加权利要求所包括的本发明范围。
- 还没有人留言评论。精彩留言会获得点赞!