一种结直肠癌抗原特异性T细胞的制备方法与流程
本发明涉及免疫细胞领域,更具体地涉及结直肠癌抗原特异性T细胞的制备方法,以及由所述方法获得的结直肠癌抗原特异性T细胞。
背景技术:
结直肠癌是全球第三大最常见癌症,每年有100万左右的新增病例和超过50万人死于该病。结直肠癌的治疗以手术为主,并结合辅助放疗、化疗,虽然辅助放化疗能在一定程度上延长患者的生存期,但也伴随严重的副反应,且即使经过积极的联合治疗,该病依然存在很高的复发转移率。目前迫切需要开发出能有效延长患者生存期,减少复发和转移风险的治疗策略。
转化生长因子βII型受体(TGFβRII)和O位N-乙酰葡萄糖胺糖基转移酶(OGT)基因的框移突变产生一种具有人白细胞抗原A2(HLA-A2)限制性的新生抗原,存在于20-40%HLA-A2限制性结肠癌患者并且不存在于正常人和其他肿瘤中,提呈后的抗原肽为SLYKFSPFPL和RLSSCVPVA。
越来越多的证据表明免疫系统可以预防肿瘤生长和转移扩散。包括细胞因子、肿瘤疫苗、免疫效应细胞,以及基因改造T细胞受体、单克隆抗体等成为国内外免疫治疗研发的热点。目前已开展多项结肠癌免疫治疗临床试验研究,包括促进免疫系统的细胞因子、免疫检查点阻断、抗原疫苗和过继性细胞治疗等。尽管目前基因改造细胞成为免疫治疗中翘楚,但由于制备工艺复杂,并存在脱靶效应,使得其在治疗实体瘤的临床阶段推进受到阻碍。
以往针对细胞因子诱导杀伤性细胞,自然杀伤细胞治疗包括结肠癌在内的实体瘤的研究认为这些治疗方法存在一定的疗效,但由于缺乏抗原特异性文献报道临床治疗效果参差不齐。
肿瘤细胞表面的抗原通过抗原提呈细胞(APC)加工成抗原肽与主要组织相容复合物(MHC)分子形成复合物提呈并参与活化给T细胞,形成肿瘤抗原特异性的细胞毒性T淋巴细胞(CTL)。肿瘤为了逃避识别,下调甚至不表达MHC分子,部分肿瘤患者免疫细胞数量下降功能低下都会造成肿瘤抗原无法提呈,导致T细胞无法活化。所以使用抗原呈递细胞辅助形成杀伤性T细胞是常用的方法,但是这些方法不稳定且不够方便。
综上所述,尚需要更加有效简单的免疫疗法和抗原特异性T细胞更加简单和高效的制备方法。
技术实现要素:
为了解决现有技术面临的问题,本发明人开发了一种制备抗原特异性T细胞,特别是结直肠癌抗原特异性T细胞的方法,其解决或部分解决了以上问题。
本发明的一个方面涉及抗原特异性T细胞的制备方法,其包括使T细胞与肿瘤特异性抗原共孵育。
进一步地,所述方法中的肿瘤特异性抗原可以为结直肠癌特异性抗原。
在一些实施方案中,所述结直肠癌特异性抗原为肽RLSSCVPVA。
在一些实施方案中,本发明方法中的T细胞在混悬液中,进一步地,所述混悬液可以为外周血单核细胞混悬液或者外周血。
在一些实施方案中,本发明方法中的T细胞为CD8+T细胞。
本发明的一个方面涉及由本发明方法获得的抗原特异性T细胞,特别是结直肠癌抗原特异性T细胞。
本发明还涉及由本发明方法获得的结直肠癌抗原特异性T细胞在制备用于治疗结直肠癌的制剂中的用途。
本发明中使用的肽SLYKFSPFPL(下文可简称为“抗原肽1”、“1号肽”或“P1”)和肽RLSSCVPVA(下文可简称为“抗原肽2”、“2号肽”或“P2”)可以是化学合成的或者经生物工程技术产生的,其具有较高的,例如大于99%的纯度,具有良好的均质性。直接使用肽RLSSCVPVA处理获得抗原特异性T细胞的方法,步骤大为简化,可重复性好,具有良好的可操作性和实用价值。
附图说明
图1示出制备的肽的纯度;图1A抗原肽RLSSCVPVA合成质谱分析的离子峰,在12.245’出现;图1B抗原肽RLSSCVPVA合成质谱分析的主要碎片峰,仅有一个,该碎片分子量为931.76,丰度为100%,接近RLSSCVPVA的理论分子量。图1C抗原肽SLYKFSPFPL合成质谱分析的两个离子峰,分别出现在16.731’和21.317’。图1D OGT抗原肽SLYKFSPFPL合成质谱分析的主要碎片峰,有两个,碎片的分子量(丰度)分别为1198.70(99%)和1220.81(1%),第一个碎片的分子量接近SLYKFSPFPL的理论分子量。
图2示出了在不同效应细胞靶细胞比例(简称“效靶比”)情况下,使用1号肽(P1)、2号肽(P2)、1号肽和2号肽的等比例混合物(P1+2)以及未添加抗原肽(NP)的情况下,诱导产生的细胞毒性T淋巴细胞(下文简称“CTL”)对DLD1杀伤活力的影响。
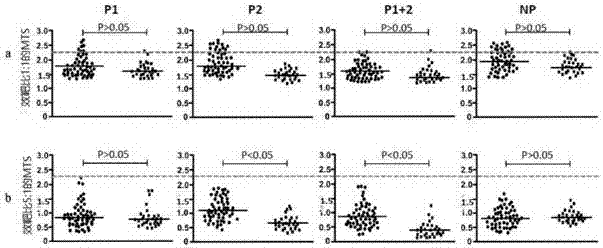
图3示出了效靶比为5/1(a)和10/1(b)时DC负载抗原诱导的CTL与抗原肽直接刺激活化CTL杀伤DLD-1效能比较。
图4示出了对效靶比为5/1(a)和10/1(b)两组的CTL活化后IFN-γ分泌量的测定;每组对比中较前颜色的左侧为负载抗原肽的DC刺激PBMC得到的CTL(DC+T),右侧为相应抗原肽直接刺激PBMC得到的CTL(PBMC)。
具体实施方式
一、实验材料
1、结肠癌细胞系DLD1来自解放军总医院肿瘤中心实验室。
2、外周血样来源
2.1患者组:
收集2014年11月至2015年8月就诊于解放军总医院肿瘤中心的确诊的结肠癌病人,诊断经过经组织或细胞病理学确认,通过纳入,排除标准筛选后,共计42例,其中有HLA A2限制性的患者34例,为最终纳入的患者。组织病理学标本由手术病理或肠镜检查获得并经病理科检测确定。所有实验经解放军总医院伦理委员会批准,病人知晓并签署知情同意书。患者的纳入和排除标准如下:
患者组纳入标准:
①经病理学确诊的结肠癌患者,病理类型仅包括腺癌(高/中/低分化);
②入院前未经过细胞治疗;
③表达HLA A2限制性分子
患者组排除标准:
①其他部位原发肿瘤的结肠部转移或侵犯;
②距离上一次放疗/化疗结束1月内的患者,既往接受过细胞治疗患者;
③不表达HLA A2限制性分子
④伴有自身免疫性疾病和血液系统疾病患者;
⑤病理,随访资料不完善的患者;
⑥伴有其他传染疾病患者。
结肠癌腺癌的诊断和病理类型确定根据2013年美国国立综合癌症网络(NCCN)发布的结肠癌诊疗指南,患者临床分期参考国际抗癌联盟(UICC)和美国癌症联合委员会(AJCC)制定的TNM分级法。根据纳入患者的入院记录和相关检查,记录包括性别,年龄,病理类型,临床分期,既往治疗方案,并发症,合并其他疾病,结肠癌相关遗传疾病或家族史等信息。
2.2对照组:同期在解放军总医院体检中心参加体检的10例健康对照者和4例志愿者的外周静脉血作为对照组。
入选标准为:
①与病人组年龄和性别构成相近
②表达HLA A2限制性分子
排除标准为:
①1个月内有急性或慢性炎症
②由结肠癌或结肠疾病家族史
③不表达HLA A2限制性分子
④自身免疫性疾病,血液系统疾及其他传染疾病患者
二、主要实验试剂如下,所有其他实验试剂为常规试剂,本领域技术人员可容易地购买得到
注:MTS试剂盒是应用新型的水溶性化合物[3-(4,5-二甲基噻唑-2-基)-5-(3-羧甲酯基)-2-(4-磺苯基)-2H-四唑(金翁),内盐;MTS]快速高灵敏度检测细胞增殖和细胞毒性的比色检测产品。
三、主要实验仪器
四、肽RLSSCVPVA和SLYKFSPFPL的合成、纯化以及鉴定
4.1肽的合成
肽RLSSCVPVA和SLYKFSPFPL交由北京中科亚光生物科技有限公司进行商业合成。
4.2合成的肽
北京中科亚光生物科技有限公司提供了在Xevo G2-S QTof质谱仪上获得的检测结果,具体参见附图1。获得了纯度为100%的TGF-βRII抗原肽RLSSCVPVA和99.05%的OGT抗原肽SLYKFSPFPL。
五、外周血采集
在实验组对象入院时空腹情况下抽取外周血20毫升至抗凝管(肝素抗凝)中,采血管帽采血前后用碘伏消毒,保证无菌。采集之后两小时内处理血样,以4℃,2500转/分离心15分钟的条件离心。收集上层血浆吸取1mL保存至冻存管中,分装之后置于-80℃冰箱,待检测。以同样的方法和步骤收集14例健康对照者,分装1mL血浆保存至-80℃冰箱,剩余血浆吸入15mL无菌离心管,封口胶密封,置于56℃水浴30分钟。水浴结束后血浆置23℃,2500转/分离心15分钟的条件离心。离心后密封置于4℃保存留用。
六、外周血单核细胞(PBMC)的获取与体外培养方法
(1)准备:实验开始前一天,将抗人CD3和抗人CD28以1:100加入到无菌1X PBS中混匀,以3mL稀释液加入T25培养瓶中,液体均匀覆盖瓶底,用封口胶密封锡箔纸包裹后放入4℃过夜。
(2)PBMC分离:
稀释:将离心后去除血浆的血细胞用1X PBS稀释,血细胞:PBS体积比=1:2;分层:取两支50ml离心管,分别加入15ml淋巴细胞分离液(下层),倾斜缓慢加入约35ml稀释血细胞(上层);
离心:室温条件,2000转/分离心20分钟。
(3)洗涤:吸取分层液中间的白膜层加入到新的50ml离心管。吸取时注意,旋转吸取,勿将下层红细胞吸取。用2或3倍体积的1X PBS吹打混匀,离心2000转/分钟离心10分钟。洗涤过程进行两次。如果红细胞层表面有白色絮状物或离心后发现分层不清可将分层不清的液体用PBS洗涤后再次用淋巴细胞分离液分离。由此获得PBMC,随后可进行体外培养。
(4)计数接种:洗涤第二次后用培养基重悬,用细胞计数板进行计数,将细胞浓度调整为5×106-1×107/mL,将包被液吸出回收,把细胞悬液接种到包被好的培养瓶中。
(5)细胞因子:白细胞介素1(IL-1α),重组白细胞介素-3(rIL-3),重组干扰素(rIFN-γ)按下表1中的浓度加入培养基中,并调整培养基总量为15mL,一并加入培养瓶中。
(6)第2天:观察细胞情况,按500U/mL浓度加入重组白细胞介素-2(rIL-2),并将培养基总体积加至10mL。此后每隔1-2天扩大容积一次并根据细胞克隆团生长情况加入rIL-2。根据细胞生长情况,加入自体血清平均浓度为5%(2.5%-10%)。
表1.细胞因子浓度及其添加时间
(7)第4天:体系加至20mL,并维持5%自体血清和300U/mL rIL-2浓度。
(8)第7天:观察细胞生长情况,将细胞轻柔吹打,扩至T75培养瓶,总体系达40mL,维持5%自体血清和300U/mL rIL-2浓度。此后根据细胞生长情况补充液体量。如果细胞量足够,在培养到第11天或12天时取出1×107细胞。缓慢地混合均匀,制成细胞混合液。细胞在4℃,1800转/分离心10分钟,回收上清继续作为培养基,细胞用CELL BANKERII按5×105至5×106细胞/mL冻存液缓慢混匀冻存至超低温冰箱或液氮备用。
(9)自第11天起,将rIL-2浓度调整为100U/mL,参考既往文献发现较低浓度的IL-2可以获得较高比例的CD8+T细胞。
(10)收集细胞:第14天:收集细胞到无菌50mL离心管中,按1800转/分离心10分钟,去上清,细胞计数。
(11)将收集的细胞用Bioegend公司流式抗体PE抗人CD3,FITC抗人CD4,PE-Cy7抗人CD8,FITC抗人CD56,PE抗人CD19对细胞进行标记。细胞用1X PBS混匀,取3×106细胞均分至3个流式管,每管体积500uL;按下表顺序加入抗体,抗体加入流式管底部,震荡后室温避光20分钟;再次震荡,随后进行流式检测。
流式检测的结果显示,从0至14天发生了如下变化,培养过程中CD19+B细胞消失,CD8+T细胞在两组中都明显上升,患者组为培养前35.7%,培养后74%;健康对照组为培养前26.4%,培养后78.2%,两组在培养后CD8+T比例无明显差异(P>0.05)。CD3+CD56+表型在健康组表达为59.2%,在患者组为44.7%,两组间有明显统计学差异(P<0.05)。
实施例一:制备抗原肽特异性的细胞毒性T淋巴细胞
1、按照前述方法获得34例结肠腺癌患者和14例健康对照的PBMC;并进行体外培养,在第7天将培养的细胞轻柔吹打,计数调整数量为5×106细胞/孔加入到96孔板,每个样本设三个复孔。
2、将1号肽和2号肽分别按50ug/mL一次性加入,刺激细胞至14天,收集细胞。
3、CTL杀伤效能
3.1肿瘤细胞铺板:在细胞培养的13天对使用RPMI-1640/DMEM等体积混合培养基培养的DLD-1,用PBS洗涤两遍,用胰酶消化,含血清培养基终止消化后以900转/分离心8分钟,含10%胎牛血清的RPMI-1640/DMEM混合培养基重悬计数,将细胞浓度调整到1×103/100uL,铺96孔板,每孔100uL,每种细胞15个孔(分四个实验组和一个空白对照组,每组3个复孔),放入37℃,5%CO2培养箱中贴壁培养6-12小时。
3.2CTL杀伤:将多肽组和对照组CTL分别按1×103/100uL、5×103/100uL浓度加入肿瘤细胞的四个组每孔100uL,效靶比分别为1/1,5/1。分别以3天后,7天后进行MTS测定,评估各处理组CTL对肿瘤细胞的杀伤情况。
3.3MTS:第3天和第7天将96孔板所有孔中的培养基吸出,按组别分装至1.5mL EP管标记,冻存入-30℃冰箱备测细胞因子分泌情况。根据Promega说明书,按RPMI-1640/DMEM等体积混合培养基:MTS=100uL:20uL/孔,将所有孔中加入MTS稀释液,37℃,5%CO2培养箱中孵育2-3小时,取出后冰上避光,用酶标仪测492nm波长时的吸光度(OD)值,空白对照组仅有培养基无细胞(BLANK,所有组别树脂减去BLANK的平均值是肿瘤细胞相对吸光度值,即肿瘤细胞相对活力),阳性对照组仅有肿瘤细胞。
3.4 IFN-γ分泌量测定:
1)试剂盒与待测样品升温30分钟至18-25℃;
2)工作液和标准品的配制依照说明书进行需配制以下液体:(A.浓缩洗涤液用双蒸水稀释,稀释比例为1:25;B.标准品400pg/mL、200pg/mL、100pg/mL、50pg/mL、25pg/mL及12.5pg/mL;C.生物素化抗体工作液;D.酶结合物工作液);
3)加样:设置空白孔、标准品孔和样品孔。空白孔加样品稀释液100μl,余孔分别添加标准品或100μL/孔样品进行测量,加样应施于酶标板底部,不触及孔壁,不产生气泡并轻柔吹打均匀。酶标板膜包覆,37℃孵育90分钟;
4)弃液体,在滤纸上反复扣干,不洗涤。加入生物素标记抗体工作液100μL/孔(在使用前15分在制备薄膜覆盖),在酶标板上加上覆膜,37℃培养1小时;
5)弃去孔内液体,干燥,洗板3次,每次浸泡1-2分钟,约350μL/孔,干燥、吸水纸点击孔液体拍干;
6)加酶结合物工作液(临用前15分钟配制)100μL/孔,加上覆膜,37℃孵育30分钟;
7)弃去孔内液体,干燥,洗5次,方法同步骤5);
8)每个孔加底物溶液(TMB)90μL,酶标板加覆膜,37℃孵育15分钟;
9)加终止液50μL/孔,反应终止,蓝色到黄色的颜色变化。终止液加入顺序应与底物相同的添加顺序。
10)立即用酶标仪在450nm波长测量各孔的OD值;
11)计算结果:标准的IFN-γ浓度为横坐标,相应的纵坐标的OD值,做标准曲线,并根据标准曲线查样品浓度。
实验结果参见图2,杀伤的第3天,效靶比为1/1时,四个处理条件的患者和对照CTL对DLD-1杀伤未见显著差异,患者组内和健康对照组内四个处理间亦无统计差异:P1,P2,P1+2,NP处理条件患者组杀伤的平均OD值±标准差分别为1.834±0.377,1.924±0.663,1.629±0.267,1.95±0.769;健康对照组杀伤平均OD值±标准差为1.625±0.584,1.522±0.238,1.546±0.301,1.702±0.559(P>0.05),红色虚线示无CTL存在,仅有DLD-1的阳性对照,OD值为2.328,见图2a。5/1效靶比时(图2b),P2,P1+2处理条件下患者组和健康组都出现了杀伤效果的明显差异;其中5/1靶比下的P2处理条件患者组杀伤的OD值分别为1.198±1.134;健康对照组杀伤OD值为0.784±0.663。在5/1效靶比下的P1+2处理的患者组OD值为0.759±1.526;健康对照的OD值为:0.456±0.773。在NP处理条件下仅10/1效靶比显示患者组的CTL杀伤能力优于健康对照(P<0.05),OD值为患者组:0.465±0.443健康组:0.539±0.092。说明肽RLSSCVPVA的添加可以有效的提高CTL的比例,继而有效的抑制DLD的活力。
实施例二:树突状细胞(DC)负载的抗原肽和抗原肽单独对CTL产生的影响的比较。
树突状细胞是提呈能力最强的抗原提呈细胞,本领域技术人员已知,使DC负载抗原肽得到DC疫苗,一般而言,DC疫苗对于单独抗原肽产生CTL的效率将更高。然而本发明人通过以下实验的结果,出人意料发现单独施加抗原肽获得了比负载抗原肽的DC疫苗更好的效果。
1、获得负载抗原肽的DC
(1)将外周血样与1X PBS按1:1体积稀释后缓慢加入淋巴细胞分离液中,室温条件下,2000转/分离心20分钟;吸取分层液中间的白膜层加入到新的50ml离心管。用2或3倍体积的1X PBS吹打混匀,离心2000转/分钟离心10分钟。洗涤过程进行两次,得到PBMC。;
(2)将PBMC置于6孔板(6×106-8×106细胞/孔)(5×107细胞/6孔板),37℃培养1-3小时,轻轻吸取非贴壁细胞。
(3)贴壁细胞在含有10%胎牛血清的RPMI-1640培养液中培养,添加800U/ml的GM-CSF和500U/ml的rIL-4,第3天半量换液并补充细胞因子至原浓度,第5天所得的非贴壁细胞即诱导分化而来的未成熟DC。
(4)为了获得成熟DC,第5天向未成熟DC中加入100ng/ml的LPS刺激48小时。
(5)第6天加入1号肽和2号肽,分别按10ug/mL,20ug/mL,50ug/mL,100ug/mL,200ug/mL一次性加入,刺激细胞到第8天,获得负载抗原肽的DC。
(6)第8天,收集细胞进行流式分析检测细胞表型,5管单染配同型对照:FITC抗人CD80、PE抗人CD86、PE抗人CD83、FITC抗人CD11c、PE抗人HLA-DR。
(7)第8天,负载抗原体的DC分三组(P1,P2,P1+2)刺激自体PBMC,第四组为不负载抗原的DC与PBMC共培养,培养基更换为LONZA X-VIVO 15,加入5%的自体血清和300U/mL IL-2。同时根据实施例1对相应的志愿者PBMC进行抗原肽(P1,P2,P1+2)和PBS(阴性对照)的直接刺激。培养到第14天收集所有细胞。
2、CTL杀伤效能
(1)肿瘤细胞铺板:在步骤1中的细胞培养的第13天对使用RPMI-1640/DMEM等体积混合培养基培养的DLD-1,用PBS洗涤两遍,用胰酶消化,含血清培养基终止消化后以900转/分离心8分钟,含10%胎牛血清的RPMI-1640/DMEM等体积混合培养基重悬计数,将细胞浓度调整到1×103/100uL,铺96孔板,每孔100uL,每种细胞15个孔(分四个实验组和一个空白对照组,每组3个复孔),放入37℃,5%CO2培养箱中贴壁6-12小时。
(2)CTL杀伤:在第14天,将P1,P2,P1+2,NP四组健康人的CTL和DC负载抗原刺激的健康人T细胞,根据细胞来源的个体一一对应,分别按1×103/100uL、5×103/100uL、1×104/100uL、2×104/100uL浓度加入肿瘤细胞的四个组每孔100uL,效靶比分别为1/1,5/1,10/1,20/1。分别在3天后,7天后进行MTS测定,评估各处理组CTL对肿瘤细胞的杀伤情况。
(3)MTS杀伤实验与IFN-γ分泌情况:第3天和第7天将96孔板所有孔中的培养基吸出,按组别分装进1.5mL EP管并标记,冻存入-30℃冰箱备测细胞因子分泌情况。根据Promega说明书,按RPMI-1640/DMEM等体积混合培养基:MTS=100uL:20uL/孔,将所有孔中加入MTS稀释液,37℃,5%CO2培养箱中孵育2-3小时,取出后冰上避光,用酶标仪测492nm波长时的吸光度(OD)值,空白对照组仅有培养基无细胞(BLANK(空白),所有组别树脂减去BLANK的平均值是肿瘤细胞相对吸光度值,即肿瘤细胞相对活力),阳性对照组仅有肿瘤细胞。IFN-γ分泌量使用ELISA方法测定。
实验结果参见图3,效靶比为5/1(A)和10/1(B)时DC负载抗原诱导的CTL与抗原直接刺激活化CTL杀伤DLD-1效能比较。P1DC+T、P2DC+T、P1+2DC+T、P0DC+T分别代表DLD-1与分别由负载抗原肽1、抗原肽2、抗原肽1+2和未负载抗原肽的DC刺激PBMC得到的CTL共孵育。PBMC+P1、PBMC+P2、PBMC+P12、T细胞分别表示DLD-1与分别由抗原肽1、2、1+2直接刺激的PBMC得到的CTL和无抗原肽刺激PBMC得到的CTL。
DC负载抗原诱导的CTL与抗原直接刺激活化CTL对DLD-1杀伤效果杀伤活性公式为:
BLANK OD值为0.0403,DLD-1的OD值是3.523,在效靶比为5/1时,负载抗原肽1的DC与抗原肽1直接刺激PBMC得到的CTL对DLD-1的杀伤率分别为26.7%和65.8%(P=0.054),负载抗原肽2的DC与抗原肽2直接刺激PBMC得到的CTL对DLD-1的杀伤率分别为20.7%和81.3%(P=0.039),负载抗原肽1+2的DC与抗原肽1+2直接刺激PBMC得到的CTL对DLD-1的杀伤率分别为39.9%和69.2%(P=0.048)。在效靶比为10/1时,负载抗原肽1的DC与抗原肽1直接刺激PBMC得到的CTL对DLD-1的杀伤率分别为36.3%和88.8%(P=0.0384),负载抗原肽2的DC与抗原肽2直接刺激的PBMC得到CTL对DLD-1的杀伤率分别为37.5%和89.7%(P=0.0224),负载抗原肽1+2的DC与抗原肽1+2直接刺激PBMC得到的CTL对DLD-1的杀伤率分别为45.6%和86.6%(P=0.043)。
对效靶比为5/1,10/1时两组的CTL活化做IFN-γ分泌量的测定,如图4,两处理条件下都显示在接受P1抗原肽刺激时健康人的PBMC活化的CTL更有优势。
根据实施例2的实验结果可以看出,使用抗原肽直接刺激PBMC特别是接受抗原肽1刺激的情况下,在细胞因子存在的同时,获得的CTL对DLD-1的杀伤能力比使用DC负载抗原后刺激活化同一志愿者PBMC来源的CTL的杀伤能力强。使用抗原肽直接刺激PBMC模拟了体内外周血成分接受抗原肽刺激的情形,在活化DC之外,抗原肽同样活化了其他免疫应答的环节,不同于全肿瘤细胞或肿瘤细胞碎片激活T细胞,肿瘤新生抗原肽优化了识别过程,使得仅拥有特异性抗原TCR的T细胞扩增活化,能够更加精准靶向肿瘤细胞,因此使用直接使用抗原刺激外周血也可以实现相同的效果。
序列表
<110> 樊克兴
<120> 一种结直肠癌抗原特异性T细胞的制备方法
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 1号肽,即转化生长因子βII型受体框移突变产生的新抗原肽
<400> 1
Ser Leu Tyr Lys Phe Ser Pro Phe Pro Leu
1 5 10
<210> 2
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 2号肽,即O位N-乙酰葡萄糖胺糖基转移酶框移突变产生的新抗原肽
<400> 2
Arg Leu Ser Ser Cys Val Pro Val Ala
1 5
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤特异抗原及其应用的制作方法与工艺
- 用于制备具有增加的特异性基因表达的树突细胞的方法和包含使用所述方法制备的树突细胞的用于治疗或预防自身免疫性疾病的组合物与流程
- 一种兼有NK细胞特质的抗原特异性T细胞的制备方法与流程
- 一种特异性肿瘤抗原NSE的CTL识别表位肽及其应用的制作方法与工艺
- 一种特异性肿瘤抗原SF的CTL识别表位肽及其应用的制作方法与工艺
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 特异性识别胃癌细胞的DNA适配子GCA‑5及其应用的制造方法与工艺
- 一种制备结直肠癌抗原特异性T细胞的方法与流程
- 用作诱导抗原特异性T细胞反应的免疫原性增强剂的融合蛋白的制造方法与工艺