控制水稻种子大小基因OsNAC1及其应用的制作方法
本发明属于植物生物技术领域,它涉及一种植物种子大小必需基因及其应用,具体涉及一种控制水稻种子大小基因OsNAC1及其应用。
背景技术:
水稻是我国重要的粮食作物,面对人口剧增、环境恶化和耕地面积减少的严峻形势,保证粮食安全成为我国面临的一个日益突出的大问题和严峻挑战,而提高水稻等主要粮食作物的单位面积产量是解决这一问题的重要途径,对保证我国的粮食安全、促进国民经济的发展有举足轻重的作用。有效穗数、每穗粒数和千粒重是构成水稻产量的三个基本要素。种子大小是由粒长、粒宽、粒厚和谷粒充实度共同决定的,是千粒重最主要的决定因素。种子大小也是构成水稻理想株型的主要农艺性状之一,长期以来一直是很多作物育种改良的重要目标,对产量和外观品质有很大的影响。“杂种优势”和“绿色革命”的利用,使我国水稻产量实现了两次飞跃。杂交水稻主要是基于野败型不育系的发现和三系配套法的发明,使产量大幅提升。“绿色革命”则是基于半矮秆基因sd1的发现和利用,使株高大幅度降低,提高了耐肥和抗倒伏能力,从而显著提高产量 (Sasaki et al., 2002)。近10多年来,“超级稻”育种备受人们期待,其采用的最主要的技术就是理想株型和优势利用相结合。由此可见,水稻理想株型研究上的突破是水稻育种能够更快更好地开展下去的前提和基础,因此,对于作为理想株型建成的重要因子之一种子大小相关功能基因的挖掘及其作用机理的研究,进而应用于水稻、小麦等禾谷类作物高产品种的培育,具有重要的理论意义和生产应用前景。
粮食高产、优质是植物基础科学和应用科学研究的重要目标,也是粮食作物遗传改良的重中之重。水稻是重要的粮食作物和模式生物,在水稻、小麦等禾谷类作物中,种子大小既是水稻外观品质性状,又是一个非常重要的产量性状和作物驯化的靶性状。近几年对拟南芥和水稻种子大小相关基因的克隆及功能研究表明,泛素蛋白酶体可能是一种调控种子大小的机制。GW2基因编码一个具有E3泛素连接酶活性的RING蛋白,GW2功能缺失突变增加了水稻细胞的数目,导致颖壳变大,灌浆速率加快,从而使粒宽和粒重增加,产量提高,结果表明GW2通过将其底物锚定到蛋白酶体进行降解,从而负调节细胞的分裂(Song et al., 2007)。此外,敲除小麦TaGW2基因使小麦种子变小,粒重降低(Su et al., 2011)。水稻GW5基因编码一个144 氨基酸组成的核定位蛋白,该蛋白包含一个核定位信号和一个富含精氨酸区域。通过酵母双杂交实验证实GW5 与多聚泛素有相互作用,表明GW5可能通过泛素蛋白酶体途径调节粒宽和粒重。gw5突变后不能将泛素转移到靶蛋白上,因而使得本应降解的底物不能被特异识别,进而激活颖花外壳细胞的分裂,从而增加颖花外壳的宽度,最终谷壳的宽度、粒重以及产量都得到了增加(Song et al., 2011)。SOD2基因编码一个去泛素化酶UBP15 (ubiquitin-specific protease 15),超表达SOD2基因导致拟南芥种子变大,而sod2单突变体降低了拟南芥种子大小,表明SOD2/UBP15是种子大小调控的关键因子,细胞学分析表明SOD2是通过促进珠被的细胞分裂,从而影响种子大小。免疫共沉淀等实验揭示出泛素受体DA1能够与SOD2在体内和体外直接互作,表明SOD2是DA1的直接底物。以上结果表明:泛素受体DA1通过直接与去泛素化酶SOD2互作,并介导SOD2的降解,从而调控植物种子大小(Du et al., 2014)。最新研究发现,E3泛素连接酶DA2和EOD1通过泛素化DA1,激活了DA1的蛋白酶活性,然而活化的DA1可以进一步切割UBP15,TCP15,TCP22等下游底物,进而调控种子大小,表明DA1的蛋白酶活性通过协同调控下游底物的稳定性来调控种子大小(Dong et al., 2017)。
近年来,在植物中发现了一些IKU途径基因参与种子大小调控(图 1)。IKU1基因编码一个包含VQ基序的蛋白,在早期胚乳中表达,IKU1功能缺失突变降低了拟南芥种子大小(Wang et al., 2010)。IKU2编码一个富含亮氨酸的受体激酶,IKU2功能缺失突变也降低了种子大小(Li et al., 2016)。SHB1在种子发育中其关键的调控作用,在芥末中超表达拟南芥SHB1基因增加了芥末种子大小和产量(Savadi et al., 2015)。近期研究发现,SHB1能够结合在MIN3和IKU2基因启动子区域,通过改变MIN3和IKU2基因的表达来调控胚乳的发育,然而ABI5直接与SHB1启动子结合进而抑制SHB1的表达,在拟南芥中超表达油菜IKU2基因增加了种子大小(Li et al., 2016; Xiao et al., 2016)。abi5突变体增加了种子大小,结果表明ABA调控种子发育至少部分是由ABI5介导的SHB1基因表达的抑制所引起的(Cheng et al., 2014)。
水稻种子大小是一个复杂的基因表达调控过程,种子大小是由多基因控制的数量性状。水稻其形态学和遗传学上的研究优势为高等植物种子大小的分子机理研究提供了非常重要的研究模式。因此,挖掘新的控制水稻种子大小基因、对禾谷类作物分子育种及高产品种的培育具有重要的应用价值和理论意义。
技术实现要素:
本发明的目的在于提供一种控制水稻种子大小基因OsNAC1及其应用,该基因是水稻种子大小的关键调控基因,它可以用于水稻、小麦等禾谷类作物高产品种的培育。
本发明的目的是以下述方式实现的:
本发明提供一种控制水稻种子大小基因OsNAC1,来源于水稻(Oryza sativa L.) cv. 中花 11,其核苷酸序列为SEQ ID NO.1,其基因开放阅读框的核苷酸序列为SEQ ID NO.2,其cDNA编码的氨基酸序列为SEQ ID NO.3。
一种重组构建体,包括控制水稻种子大小基因OsNAC1的核苷酸序列,所述构建体用的载体为用于克隆的pMD18-T载体或者用于表达的pCAMBIA1301载体。
控制水稻种子大小基因OsNAC1的核苷酸序列的转基因农杆菌为EHA105。
控制水稻种子大小基因OsNAC1的核苷酸序列在植物组织表达中的应用。
所述植物组织为根、茎、叶、花、穗或种子。
所述植物为单子叶植物或双子叶植物。
所述单子叶植物为水稻、小麦、大麦、高粱或玉米,所述双子叶植物为拟南芥、番茄、烟草、大豆或土豆。
上述控制水稻种子大小基因OsNAC1或上述控制水稻种子大小基因OsNAC1编码的蛋白质,或其他物种中的功能类似蛋白,其氨基酸序列与SEQ ID No.3所示的氨基酸序列具有不小于30%的同源性,该蛋白在培育高产品种植物中的应用。所述高产为增加禾谷类作物种子大小,进而增加单产。
相对于现有技术,本发明的优点在于:
首先对OsNAC1基因进行了组织特异性表达分析,qRT-PCR 结果表明OsNAC1 基因在水稻幼叶高效表达;然后将OsNAC1基因构建到以35S启动子启动的植物表达载体pCAMBIA1301中,获得重组载体pCAMBIA1301-OsNAC1,将重组载体转入农杆菌用于进一步的转化。以水稻愈伤为受体,利用农杆菌介导法将构建好的载体转入到水稻,通过潮霉素和GUS染色获得转基因株系。在水稻中超表达OsNAC1后发现,与野生型水稻相比,OsNAC1超表达转基因水稻种子变小,种子宽度和种子长度都降低,千粒重降低,株高降低,结实率不变。这些结果说明OsNAC1是控制水稻种子大小的基因。此外,我们已经种植了4代转基因株系,并且从T1代开始种子大小和千粒重都显著性的降低,说明我们获得的OsNAC1转基因植株是可以稳定遗传的。OsNAC1基因是水稻种子大小的关键调控基因,表明可以利用基因工程技术调节水稻的种子大小,在利用生物工程技术有目的调控植物株型性状,调整植物群体结构以达到高产、优质方面具有非常重要的应用价值。该基因可以通过CRISPR/Cas9技术用于水稻、小麦等禾谷类作物高产品种的培育。
附图说明
图1表示OsNAC1在野生型水稻不同组织中的表达量。
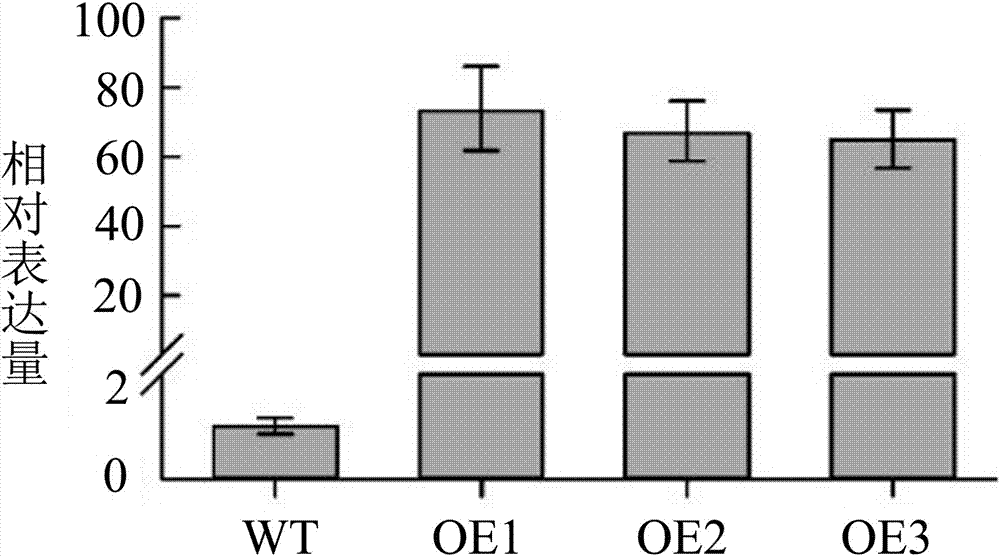
图2是OsNAC1基因在野生型和转基因株系中的表达量检测。
图3是OsNAC1基因超表达植株和对照植株的种子大小表型。
图4是OsNAC1基因超表达植株和对照植株千粒重。
图5是OsNAC1基因超表达植株和对照植株的表型。
图6是OsNAC1基因超表达植株和对照植株株高。
图7是OsNAC1基因超表达植株和对照植株各节间长度统计学分析。
图8是OsNAC1基因超表达植株和对照植株20粒种子长度表型。
图9是OsNAC1基因超表达植株和对照植株种子长度统计学分析。
图10是OsNAC1基因超表达植株和对照植株20粒种子宽度表型。
图11是OsNAC1基因超表达植株和对照植株种子宽度统计学分析。
图12是OsNAC1基因超表达植株和对照植株结实率统计学分析。
具体实施方式
以下本发明拟进一步对OsNAC1基因的上下游基因及其参与的相关调控信号通路进行分析,并分析OsNAC1基因是否具有更广泛的控制种子大小的作用。通过分析该基因在水稻种子大小调控机理研究及高产品种培育中的作用,以为丰富水稻等禾谷类作物种子大小的分子机理积累资料,通过基因工程手段为水稻、小麦等禾谷类作物的高产分子模块设计育种提供新的基因资源。
水稻转基因株系获得及表型分析实验
1材料与方法
1.1 植物材料及种植方式
供试的水稻品种为水稻粳稻品种中花 11即水稻(Oryza sativa L.) cv. 中花 11,保存在周口师范学院植物遗传与分子育种重点实验室。新收的种子种植前先用质量百分比浓度为5% 次氯酸钠消毒40 min或者用1/1000的多菌灵消毒12 h,再用0.1 mol/L HNO3(0.1 mol/L HNO3的配制方法:1 mL 63%的浓HNO3加入100 mL水)浸种16 h,自来水冲洗干净后将消毒后的种子置于28°C环境下浸种1 d,然后将种子均匀的平铺在培养皿中,其中培养皿中放置一层滤纸,并用水湿润;盖上盖子,然后放入32°C下培养,每天换水两到三次,看到大多数种子破壳出根后转入30°C下培养。保存半年以上的种子播种前先晒种2d,消毒后浸种,消毒方法:55°C温汤浸种30min,待水稻芽长到4.8-5.2 mm长的时候播种到纱窗布上,并在水稻营养液中培养,3叶期后,将水稻幼苗移入土壤中并做好对应的标签进行表型观察和后续的试验分析。水稻每间隔8或者10d进行一次施肥。
1.2 所用试剂及载体
本实验所采用的大肠杆菌为DH5α,农杆菌为EHA105,这些菌株为周口师范学院植物遗传与分子育种重点实验室保存,植物表达载体为pCAMBIA1301;其中,限制性内切酶、克隆载体pMD18-T、T4 DNA连接酶、Taq DNA聚合酶购自于TaKaBa生物公司;DNA回收试剂盒为Magen生物公司产品;潮霉素(Hyg)、卡那霉素(Kan)和氨卡霉素(Amp)等购自北京鼎国生物技术有限公司,试验所有引物均由北京奥克鼎盛生物公司合成。
1.3 RNA的提取、cDNA合成和RT-PCR扩增目的基因
RNA提取使用Magen公司的植物RNA提取试剂盒,参考方法为较易提取植物组织RNA小量提取法。以1 μg的RNA 做模板,按照 cDNA 合成试剂盒(TaKaRa)操作说明合成第一链 cDNA。根据OsNAC1基因cDNA全长序列设计特异引物,特异引物序列见表1。RT-PCR 反应体系(20 μL):10×PCR 反应缓冲液 2 µL,dNTP(2.5 mmol/L)1 µL,引物(10 pm/μL)各1 µL,Taq聚合酶(5 U/µL)0.2 µL,模板 cDNA 2 µL,ddH2O 12.8 µL。PCR 反应条件:94℃预变性 5 min;94℃变性30 s,54℃退火30 s,72℃延伸 1 min,33个循环;72℃延伸 10 min,4℃保存。
1.4 OsNAC1基因组织特异性表达分析
OsNAC1基因表达量检测选用实时荧光定量PCR(qRT-PCR)。qRT-PCR结果表明:OsNAC1在幼叶中表达最高,如图 1所示。用于qRT-PCR分析的引物根据基因全长序列设计,选用水稻的Ubiquitin1(Ubi1;Os06g0681400)作为定量PCR内参引物,如表2所示。
1.5 OsNAC1基因植物表达载体的构建
目的基因的PCR产物,按照Megan公司PCR产物纯化试剂盒操作进行纯化。限制性内切酶KpnI和XbaI双酶切连接有目的基因片段的pMD18-T质粒或pCAMBIA1301质粒后,用T4 DNA连接酶将目的基因连接到植物表达载体pCAMBIA1301上,反应体系如下:T4 DNA连接酶(5 U/µL)1 μL,10×buffer 1 μL,目的基因片段5 μL,pCAMBIA1301载体3μL;反应条件:16℃,2 h。连接产物转化感受态E.coli DH5α,涂布LB平板(50 mg/L Kan)培养,37℃过夜倒置培养形成单菌落。
1.6 OsNAC1基因植物表达载体的鉴定
挑取OsNAC1基因植物表达载体质粒转化E.coli DH5α 后形成的单克隆,提取质粒进行PCR鉴定。阳性质粒转化至感受态农杆菌EAH105,涂布LB平板(50mg/L Kan、50mg/L Rif)培养,28℃倒置培养2d,挑选阳性克隆提取质粒并进行酶切验证。
1.7 农杆菌侵染和转基因苗的获得
以水稻愈伤组织为实验材料。OsNAC1基因植物表达载体(质粒)通过冻融法转化农杆菌EHA105。分别挑取含有OsNAC1基因植物超表达载体农杆菌单克隆于28℃培养过夜,取10 mL培养液,3000 rpm,20 min,离心收集菌体沉淀,分别重悬于AAI培养液内,AA培养液包括30 g/L蔗糖,70g/L葡萄糖,200 μmol/L 乙酰丁香酮,PH 5.2,OD600=1.0,然后将悬浮液在摇床上28℃振荡培养3-5 h。将长到一定大小的水稻愈伤组织挑出,放入农杆菌悬浮液浸染30 min;然后将愈伤组织取出,置于灭菌滤纸上沥干50 min;将愈伤组织置于共培养基(共培养基为:2N6,10g/L葡萄糖,200 μmol/L 乙酰丁香酮,PH 5.5)上,28℃暗培养3 d。三天后用500 mg/L头孢美素的灭菌水清洗6遍,包含16μL吐温的100mL灭菌水清洗5遍,然后用无菌水清洗一遍。将沥干的水稻愈伤转移到筛选培养基(筛选培养基为:2N6,500 mg/L头孢美素,50 mg/L潮霉素),28℃暗培养30 d。将新长出的抗性愈伤组织转入分化培养基(分化培养基为:MS+30 g/L蔗糖+30 g/L山梨醇+2 mg/L6-BA(花之舞用KT)+0.8%琼脂+1.0 mg/L NAA+250 mg/L头孢霉素+50 mg/L潮霉素+2 g/L水解酪蛋白,PH 5.8)。挑取出现绿芽的水稻愈伤移入装有生根培养基(生根培养基为:MS/2+30g/L蔗糖+250 mg/L头孢霉素+50 mg/L潮霉素)的三角瓶中,放入恒温培养箱28℃光培养15d。准备移栽。首先通过潮霉素抗性基因和GUS活性分析对阳性转基因植株进行初步筛选,然后通过qRT-PCR技术检测目的基因在野生型和转基因植株中的表达情况,进一步对初次筛选的阳性植株进行再次筛选。
1.8 OsNAC1基因在野生型和转基因水稻中的表达情况检测
取14 d的野生型和转基因水稻叶片进行RNA提取,以1 μg的RNA 做模板,按照 cDNA 合成试剂盒(TaKaRa)操作说明合成第一链 cDNA。以OsNAC1基因cDNA设计特异定量PCR引物,见表2,通过qRT-PCR检测OsNAC1在野生型和转基因株系中的表达情况。
1.9 OsNAC1基因在野生型和转基因水稻中的表型分析
通过qRT-PCR检测了OsNAC1基因在野生型和转基因株系OvOsNAC1(OE1, OE2和OE3)中表达情况,如图2所示;超表达OsNAC1基因显著性的降低了水稻的种子大小,如图3所示,超表达OsNAC1植株千粒重显著性的降低,如图4所示,株高降低如图5,6和7所示;与野生型相比,超表达OsNAC1植株种子长度显著性降低,如图8和9所示,超表达OsNAC1植株种子宽度显著性降低,如图10和11所示,结实率不变,如图12所示。该结果为进一步使OsNAC1基因应用于水稻、小麦高产品种改良奠定了良好的基础和新的基因资源。
2.0 OsNAC1序列对应基因的全长
OsNAC1序列对应基因的全长序列为2292bp,其中包含完整读码框序列长度为1 089bp,序列如下SEQ ID NO.1;
采用NCBI ORF-finder预测其编码蛋白质为362个氨基酸,序列如SEQ ID NO.3所示。
根据序列分析,OsNAC1为一个功能未知的新的和水稻种子大小相关的基因,尚没有与其同源的禾本科作物中任何功能已知的基因被发现。
以上实施例仅用以说明,而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应当理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
SEQUENCE LISTING
<110> 周口师范学院
<120> 控制水稻种子大小基因OsNAC1及其应用
<130> 2
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 2292
<212> DNA
<213> 控制水稻种子大小基因OsNAC1的核苷酸序列
<400> 1
gaaaggccaa tatctcaaga gagctagcta gagctccatt tacaaccatt acaagattgc 60
atcagagaag atatcttcat agataattgt tggagcaaga acacaagaaa acacgtaggt 120
tcaattataa tcgatcgtgg agatggtgac cagcaaggag tttgcaaggg atcaggcggc 180
catggatcag aagatcaaga gcgacgtcgg cgaggtggtg ctcgccggag acgaggaaga 240
agacggggac gtggtgctcc cggggttcag gttccacccg accgacgagg agctcgtcac 300
gttctacctc cggcggaagg tggcgaggaa gtctctcagt atagagatca tcaaggagat 360
ggacatctac aagcacgatc catgggatct ccccagtaag tgcatcccca attaatttga 420
caaataacct caaacacaaa tcattttcaa aataattgag ctaaattctg tgtttgtgtt 480
tgaatgaatg gaatgatttt gtgcagatgc gagcacggta ggtggagaga aggagtggta 540
cttcttctgc ctgagaggga ggaagtacag gaacagcatc aggcccaaca gggtgacggg 600
atccgggttc tggaaggcga cggggatcga ccggccgatc tactccgccg ccgtcaacag 660
caactccggc gagtcgatcg ggctgaagaa gtcgctcgtc tactaccgcg gcagcgccgg 720
caagggcacc aagaccgact ggatgatgca cgagttccgc ctcccgccgg cgatcgccgc 780
cgccgacgcc tccccgtgca tgcaagaagc tgtaagcacg cactcccatg ctctcatgct 840
cgttcgttct ccttctccat cgtcgtcaag gcctcgtgta ctcgatccca tgtacgtaag 900
aagtgcattc gtaatgggag aattacccaa actcagcctg gagagagatg gagaattacc 960
cagactcaac ctggacgaga gagatgggtc agactagagg gatacgagca accaaacaca 1020
ccatatccat atccggttct cctcatctgt gacagatcac aactacgtac aatttgatag 1080
tgtggagtac aatatcatct gcaatacttt acatcaccaa atcgtcttaa tatttttttt 1140
caagctaagt tcagcagttc tttcgagatt acaggcctcc ttttgaacga agaaattttg 1200
cgaaaattct acaaaaattg aactaatcca tgtgaaagtc ctactgaaat tcccacgttt 1260
taaaggagta ctggacatcc tctcacgttc tgacgtgttt ctagtattct accgattgcc 1320
atttctaacc gataagagta cagcctccta atagcattga cctctaactt gtgcacttct 1380
gactgaaaaa aatgcaggag gtctggacca tctgcagaat cttcaagaga agcatcacct 1440
acaggaagca gcagcagcag caggcctgga ggccgccggc gacggtgacc gtcaaggccc 1500
caccgccggg ggactcgagc tccaacaccg gcagcttcga gtcggacggc ggcggcgacg 1560
agttcatgaa ctgcggcctg actccggcca tctcccagca gcagcagcac ggcggccgtc 1620
atcagatgat gagcacgatg agctgcaacg gcggctactt cttcaacgac ggcatccatc 1680
acagccacag ccaccacaag cttcatagtc aatggggctc cctacaaatg gcgccgccgg 1740
agccgaagcc ggagccggag cagaagcctc tgagctcgcc ggcgatgacg atcgccttcc 1800
atcaaaacga ccatggcttc cccgccgccg ccgcggattt ctacaaggat gggtacttgg 1860
aagagattgc gaggatgatg gaggtggctg atccaagtcc aacaggattc tatgactgta 1920
gatattgatc agtaggaaca gggtttcaga atagatgcta gatatgcaga attcgccgac 1980
aagaacagtg ccccctttgt gtgagaggct gacatgtagg gcccatgctg cagaggctgc 2040
tatcactatt agtcttgtac ttttgttttc tgatctaata tatacactcc agatgggatg 2100
tgaactgtca tacaagatac ctgattgtta cttgtgtact tgtgtctgtg atgaactgct 2160
ggctatatgc atactacacc tgtttcaaaa tataagtgat attggctata caattcatag 2220
ataatatctc ttagattttg agatggaggt aatatctctt agtacttaat gaatcatttt 2280
ttggggtgat ca 2292
<210> 2
<211> 1089
<212> DNA
<213> 控制水稻种子大小基因OsNAC1的核苷酸序列的基因开放阅读框
<400> 2
atggtgacca gcaaggagtt tgcaagggat caggcggcca tggatcagaa gatcaagagc 60
gacgtcggcg aggtggtgct cgccggagac gaggaagaag acggggacgt ggtgctcccg 120
gggttcaggt tccacccgac cgacgaggag ctcgtcacgt tctacctccg gcggaaggtg 180
gcgaggaagt ctctcagtat agagatcatc aaggagatgg acatctacaa gcacgatcca 240
tgggatctcc ccaatgcgag cacggtaggt ggagagaagg agtggtactt cttctgcctg 300
agagggagga agtacaggaa cagcatcagg cccaacaggg tgacgggatc cgggttctgg 360
aaggcgacgg ggatcgaccg gccgatctac tccgccgccg tcaacagcaa ctccggcgag 420
tcgatcgggc tgaagaagtc gctcgtctac taccgcggca gcgccggcaa gggcaccaag 480
accgactgga tgatgcacga gttccgcctc ccgccggcga tcgccgccgc cgacgcctcc 540
ccgtgcatgc aagaagctga ggtctggacc atctgcagaa tcttcaagag aagcatcacc 600
tacaggaagc agcagcagca gcaggcctgg aggccgccgg cgacggtgac cgtcaaggcc 660
ccaccgccgg gggactcgag ctccaacacc ggcagcttcg agtcggacgg cggcggcgac 720
gagttcatga actgcggcct gactccggcc atctcccagc agcagcagca cggcggccgt 780
catcagatga tgagcacgat gagctgcaac ggcggctact tcttcaacga cggcatccat 840
cacagccaca gccaccacaa gcttcatagt caatggggct ccctacaaat ggcgccgccg 900
gagccgaagc cggagccgga gcagaagcct ctgagctcgc cggcgatgac gatcgccttc 960
catcaaaacg accatggctt ccccgccgcc gccgcggatt tctacaagga tgggtacttg 1020
gaagagattg cgaggatgat ggaggtggct gatccaagtc caacaggatt ctatgactgt 1080
agatattga 1089
<210> 3
<211> 362
<212> PRT
<213> 控制水稻种子大小基因OsNAC1的核苷酸序列编码的蛋白质
<400> 3
Met Val Thr Ser Lys Glu Phe Ala Arg Asp Gln Ala Ala Met Asp Gln
1 5 10 15
Lys Ile Lys Ser Asp Val Gly Glu Val Val Leu Ala Gly Asp Glu Glu
20 25 30
Glu Asp Gly Asp Val Val Leu Pro Gly Phe Arg Phe His Pro Thr Asp
35 40 45
Glu Glu Leu Val Thr Phe Tyr Leu Arg Arg Lys Val Ala Arg Lys Ser
50 55 60
Leu Ser Ile Glu Ile Ile Lys Glu Met Asp Ile Tyr Lys His Asp Pro
65 70 75 80
Trp Asp Leu Pro Asn Ala Ser Thr Val Gly Gly Glu Lys Glu Trp Tyr
85 90 95
Phe Phe Cys Leu Arg Gly Arg Lys Tyr Arg Asn Ser Ile Arg Pro Asn
100 105 110
Arg Val Thr Gly Ser Gly Phe Trp Lys Ala Thr Gly Ile Asp Arg Pro
115 120 125
Ile Tyr Ser Ala Ala Val Asn Ser Asn Ser Gly Glu Ser Ile Gly Leu
130 135 140
Lys Lys Ser Leu Val Tyr Tyr Arg Gly Ser Ala Gly Lys Gly Thr Lys
145 150 155 160
Thr Asp Trp Met Met His Glu Phe Arg Leu Pro Pro Ala Ile Ala Ala
165 170 175
Ala Asp Ala Ser Pro Cys Met Gln Glu Ala Glu Val Trp Thr Ile Cys
180 185 190
Arg Ile Phe Lys Arg Ser Ile Thr Tyr Arg Lys Gln Gln Gln Gln Gln
195 200 205
Ala Trp Arg Pro Pro Ala Thr Val Thr Val Lys Ala Pro Pro Pro Gly
210 215 220
Asp Ser Ser Ser Asn Thr Gly Ser Phe Glu Ser Asp Gly Gly Gly Asp
225 230 235 240
Glu Phe Met Asn Cys Gly Leu Thr Pro Ala Ile Ser Gln Gln Gln Gln
245 250 255
His Gly Gly Arg His Gln Met Met Ser Thr Met Ser Cys Asn Gly Gly
260 265 270
Tyr Phe Phe Asn Asp Gly Ile His His Ser His Ser His His Lys Leu
275 280 285
His Ser Gln Trp Gly Ser Leu Gln Met Ala Pro Pro Glu Pro Lys Pro
290 295 300
Glu Pro Glu Gln Lys Pro Leu Ser Ser Pro Ala Met Thr Ile Ala Phe
305 310 315 320
His Gln Asn Asp His Gly Phe Pro Ala Ala Ala Ala Asp Phe Tyr Lys
325 330 335
Asp Gly Tyr Leu Glu Glu Ile Ala Arg Met Met Glu Val Ala Asp Pro
340 345 350
Ser Pro Thr Gly Phe Tyr Asp Cys Arg Tyr
355 360
- 还没有人留言评论。精彩留言会获得点赞!
- 一种表达猪溶菌酶基因的乳酸克鲁维酵母及表达方法与流程
- 用于辅助菌株介导的真菌基因组修饰的组合物和方法与流程
- 一种青蚶线粒体COI基因的扩增引物的制造方法与工艺
- CvBV26‑4基因在降低果蝇免疫力和制备免疫低下型果蝇模型中的应用的制造方法与工艺
- 一种用于检测牛源大肠杆菌喹诺酮耐药基因的分子标记及其应用的制造方法与工艺
- 油菜BnaSPT1基因在促进双子叶植物角果生长中的应用的制造方法与工艺
- 油菜BnaSPT3基因在促进双子叶植物角果生长中的应用的制造方法与工艺
- 一种OsGA3ox1基因在水稻雄性不育株系创制中的应用的制造方法与工艺
- 水稻紫叶基因PL1的分子标记及其鉴定方法和应用与制造工艺
- 一种定向敲降斑马鱼基因组中多拷贝基因的方法与制造工艺