H10N7禽流感病毒的实时荧光PCR检测试剂盒及检测方法与流程
本发明属于体外诊断试剂技术领域,具体涉及一种H10N7禽流感病毒的实时荧光PCR检测试剂盒及检测方法。
背景技术:
禽流感病毒(Avian Influenza Virus,AIV)属于正粘病毒科A型流感病毒属,为单股负链RNA,多形态的有囊膜病毒。禽流感病毒的基因组分为8个节段,分别编码HA、NA、NP、NS、MP、PA、PB1和PB2蛋白,病毒囊膜上的纤突,分别具有血凝素(HA)和神经氨酸酶(NA)的活性。这两个基因是病毒的特异性抗原,根据HA和NA蛋白抗原性不同,目前可分为16个H亚型(H1-H16)和9个N亚型(N1-N9)。其病原体AIV为单股负链分节段的RNA病毒,其中血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)是两个比较重要的基因节段,Susan等{Baigent,Susan J.,and John W.McCauley.“Glycosylation of haemagglutinin and stalk-length of neuraminidase combine to regulate the growth of avian influenza viruses in tissue culture.”Virus research 79.1(2001):177-185.}的研究表明HA和NA基因之间存在某种平衡对病毒的致病性有很大关系。
荧光定量PCR技术具有敏感、特异、准确可靠、能实现多重反应和实时性好等特点,多重荧光PCR采用多对引物扩增检测多个模板,克服了单重荧光PCR的不足。
当今呼吸道传染病在全球范围内广泛传播与流行,新的病种不断被发现,流行地域不断扩展,流行的频率不断增强,人感染H10N7禽流感病毒输入的危险性日益增高,对国境口岸的卫生安全造成了严重威胁,因此对呼吸道传染病的监测是国境口岸卫生检疫的重要工作。目前,针对H10N7亚型一步法实时荧光定量RT-PCR方法未见报道,因此,本领域技术人员有必要提供一种敏感性好、特异性高、准确可靠、快速方便的人感染H10N7禽流感病毒的实时荧光PCR检测试剂盒及检测方法。
技术实现要素:
针对上述现有技术中的不足,本发明要解决的技术问题是提供一种敏感性好、特异性高、准确可靠、快速方便的H10N7禽流感病毒的实时荧光PCR检测试剂盒及检测方法。
为实现上述目的之一提供一种利用实时荧光PCR检测H10N7禽流感病毒的试剂盒,本发明采用了以下技术方案:
一种利用实时荧光PCR检测H10N7禽流感病毒的试剂盒,包括:
(1)RNA提取试剂、实时荧光定量PCR扩增反应试剂、阳性对照品、阴性对照品;
(2)引物组和探针组;引物组有引物1至4,分别具有序列表SEQ.ID.No.1和2、SEQ.ID.No.4和5的碱基序列;探针组有探针A和探针B,分别具有序列表SEQ.ID.No.3和SEQ.ID.No.6的碱基序列,所述引物和探针序列如下:
所述的特异性引物为:
引物1为H10正向引物:5’-AGTGAAATAGAACACCAAATTGGCA-3’(SEQ ID No.01所示);
引物2为H10反向引物:5’-TGCTACCAGCAATTCAGCCT-3’(SEQ ID No.02所示);
引物3为N7正向引物:5’-AGAGTGAGGAAGCAACTAAGGC-3’(SEQ ID No.O4所示);
引物4为N7反向引物:5’-AGAAGAGAGTCTCACCGGACT-3’(SEQ ID No.O5所示);
所述的特异性探针为:
探针A为H10探针:5’-FAM-ACTAAGGATTCCATAACAG-3’(SEQ ID No.O3所示);
探针B为N7探针:5’-VIC-ATACCACAAATGTGACGACA-3’(SEQ ID No.O6所示)。
所述探针A中的“FAM”和探针B中的“VIC”表示现有技术中所采用的荧光报告基团。
优选的,所述RNA提取试剂包括裂解液、蛋白酶混合液、磁珠、洗涤液一、洗涤液二和洗脱液;
所述实时荧光定量PCR扩增反应试剂包括PCR扩增缓冲液、引物1、引物2、引物3、引物4、探针A、探针B、逆转录酶、DNA聚合酶、RNase抑制剂;;阳性对照品采用H10N7阳性对照,阴性对照品采用DEPC H2O。
本发明的目的之二是提供一种H10N7禽流感病毒的实时荧光PCR检测方法,包括如下检测步骤:
S1、标本处理:标本混匀后用于下一步核酸提取;
S2、RNA核酸提取:利用裂解法裂解病毒,利用磁珠法进行核酸提取;
S3、RT-PCR扩增反应:
RT-PCR反应体系包括:RT-PCR反应液,两对特异性正、反向引物和两条特异性探针混合液,逆转录酶,DNA聚合酶,RNase抑制剂,DEPC水,RT-PCR质控品,标本RNA核酸;其中,所述的特异性引物和探针是针对HA和NA基因两个靶标的特异性引物扩增区内设计,能够区别其他病毒株;
所述的特异性引物为:
H10-F:5’-AGTGAAATAGAACACCAAATTGGCA-3’(SEQ ID No.01所示);
H10-R:5’-TGCTACCAGCAATTCAGCCT-3’(SEQ ID No.02所示);
N7-F:5’-AGAGTGAGGAAGCAACTAAGGC-3’(SEQ ID No.O4所示);
N7-R:5’-AGAAGAGAGTCTCACCGGACT-3’(SEQ ID No.O5所示);
所述的特异性探针为:
H10-P:5’-FAM-ACTAAGGATTCCATAACAG-3’(SEQ ID No.O3所示);
N7-P:5’-VIC-ATACCACAAATGTGACGACA-3’(SEQ ID No.O6所示);
将上述混合好的反应液进行PCR扩增及荧光信号检测;
S4、结果判定:对RT-PCR反应产物进行荧光检测,根据荧光检测的最低Ct值和最高荧光强度判断结果,若RT-PCR反应产物的荧光检测结果呈阳性,则待测样品含有H10N7禽流感病毒。
优选的,步骤S2中所述的RNA提取采用病毒RNA提取试剂盒提取,取140ul标本,按照试剂盒说明书中的操作步骤提取RNA,最后用60ul洗脱液洗脱RNA。
优选的,步骤S3中所述的RT-PCR反应体系为:RT-PCR反应液10.0μl,引物探针混合液2.75μl,逆转录酶0.2μl,DNA聚合酶0.2μl,RNase抑制剂0.4μl,DEPC H2O 6.45μl,标本核酸5.0μl。
优选的,步骤S3中所述的RT-PCR扩增的反应条件是:45℃逆转录10min;95℃变性2min;95℃变性5s,60℃退火和延伸60s,40个循环。
优选的,所述探针H10-P的5’端标记有报告荧光染料FAM,3’端标记有淬灭荧光染料Eclipse;所述探针N7-P的5’端标记有报告荧光染料VIC,3’端标记有淬灭荧光染料Eclipse。
优选的,步骤S3中所述的引物H10-F、引物H10-R、探针H10-P、引物N7-F、引物N7-R和探针N7-P的摩尔比为3:3:3:2:2:2。
优选的,步骤S3中RT-PCR反应体系的特异性正、反向引物和探针的浓度均为10μM,正向引物分别为H10-F、N7-F,反向引物分别为H10-R、N7-R。
本发明的有益效果在于:
本发明试剂盒和检测方法针对H10N7病毒的双靶基因,既可减少工作量、又可最大限度地解决传统检测方法可能存在的阳性漏检问题,不仅首次公开了针对H10N7禽流感病毒的一步法实时荧光定量RT-PCR方法,同时具有敏感性好、特异性高、准确可靠、快速方便等优势,从而最大限度地防止外来输入性传染病的发生。
附图说明
图1是H10N7流感病毒荧光定量RT-PCR特异性检测结果示意图。其中,纵坐标表示校正荧光强度的对数值,横坐标表示荧光定量RT-PCR扩增的循环数,CT值为达到阈值线所需要的循环数。A:该体系对甲型H10N7流感病毒核酸检测扩增结果;B-G:该检测体系对甲型H1N1流感病毒、甲型H3N2流感病毒、甲型H5N1流感病毒、甲型H7N9流感病毒、甲型H9N2流感病毒及空白对照的扩增检测结果。
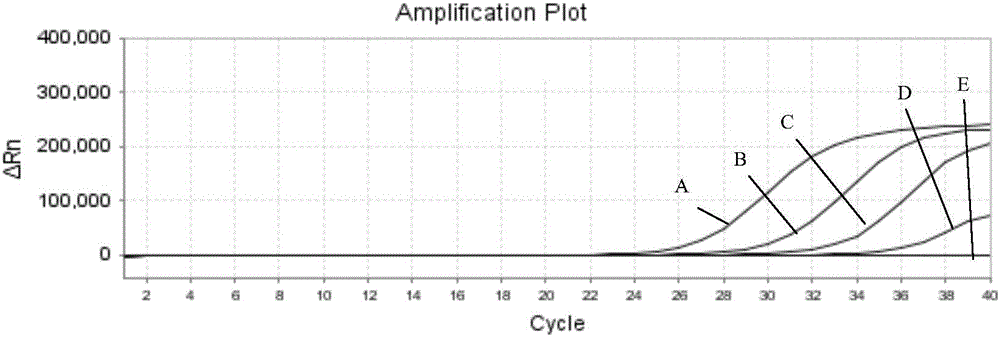
图2是H10N7流感病毒荧光定量RT-PCR H10基因检测灵敏度结果示意图。其中,纵坐标表示校正荧光强度的对数值,横坐标表示荧光定量RT-PCR扩增的循环数。CT值为达到阈值线所需要的循环数,图中从A至E的扩增曲线依次表示采用本扩增体系对1000、100、10、5、0TCID50/ml浓度甲型H10N7流感病毒进行扩增检测的结果。
图3是H10N7流感病毒双重荧光定量RT-PCR N7基因检测灵敏度结果示意图。其中,纵坐标表示校正荧光强度的对数值,横坐标表示荧光定量RT-PCR扩增的循环数。CT值为达到阈值线所需要的循环数。图中从A至E的扩增曲线依次表示采用本扩增体系对1000、100、10、5、0TCID50/ml浓度甲型H10N7流感病毒进行扩增检测的结果。
图4是H10N7流感病毒双重荧光定量RT-PCR临床样本检测结果示意图。其中,纵坐标表示校正荧光强度的对数值,横坐标表示荧光定量RT-PCR扩增的循环数。CT值为达到阈值线所需要的循环数。图中A、B、C表示甲型H10N7流感病毒核酸的扩增结果。
具体实施方式
下面结合具体实施例来进一步描述本发明,但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本技术领域的普通技术人员应该理解的是,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
以下采用的试剂和生物材料如未特别说明,均为商业化产品。
实施例1
一种利用实时荧光PCR检测H10N7禽流感病毒的试剂盒,包括:
(1)RNA提取试剂、实时荧光定量PCR扩增反应试剂、阳性对照品、阴性对照品;
(2)引物组和探针组;引物组有引物1至4,分别具有序列表SEQ.ID.No.1和2、SEQ.ID.No.4和5的碱基序列;探针组有探针A和探针B,分别具有序列表SEQ.ID.No.3和SEQ.ID.No.6的碱基序列,所述引物和探针序列如下:
所述的特异性引物为:
引物1:H10-F:5’-AGTGAAATAGAACACCAAATTGGCA-3’SEQ ID No.01;
引物2:H10-R:5’-TGCTACCAGCAATTCAGCCT-3’SEQ ID No.02;
引物3:N7-F:5’-AGAGTGAGGAAGCAACTAAGGC-3’SEQ ID No.O4;
引物4:N7-R:5’-AGAAGAGAGTCTCACCGGACT-3’SEQ ID No.O5;
所述的特异性探针为:
探针A:H10-P:5’-FAM-ACTAAGGATTCCATAACAG-3’SEQ ID No.O3;
探针B:N7-P:5’-VIC-ATACCACAAATGTGACGACA-3’SEQ ID No.O6。
其中,
(1)所述RNA提取试剂包括裂解液、蛋白酶混合液、磁珠、洗涤液一、洗涤液二和洗脱液;
(2)所述实时荧光定量PCR扩增反应试剂包括PCR扩增缓冲液、引物1、引物2、引物3、引物4、探针A、探针B、逆转录酶、DNA聚合酶、RNase抑制剂;
(3)阳性对照品:H10N7阳性对照;
(4)阴性对照品:DEPC H2O。
实施例2
一种H10N7禽流感病毒的实时荧光PCR检测方法
一、实验步骤
1.材料、试剂、仪器
人感染H10N7禽流感病毒实时荧光PCR检测引物探针委托英潍捷基(上海)贸易有限公司合成,病毒RNA提取试剂盒购自QIAGEN公司,荧光定量PCR仪为ABI7500。
2.标本准备
阳性标本为人感染H10N7禽流感病毒滴定后灭活病毒,然后用DEPC水进行不同倍数的稀释,阴性对照标本为健康人的唾液拭子。
3.RNA的提取
使用病毒RNA提取试剂盒(磁珠法)提取标本RNA。取待检唾液样本200μl,依次加入20μl蛋白酶混合液,200μl裂解液,56℃孵育10min,再将离心管置于磁力架上,吸弃上清;用600μl洗涤液洗去杂质,弃上清,重复洗涤两次;再用80%的酒精洗去杂质,弃上清;最后用60μl洗脱液洗脱得到的RNA即为所要提取的RNA。
4.靶基因的扩增
4.1引物和探针的设计
根据H10N7序列设计特异性引物和探针,特异性引物和探针是针对HA基因和NA基因两个靶标的特异性引物扩增区内设计、能够区别其他病毒株,分别为两对特异性引物和两条特异性探针,特异性引物和探针为:
H10-F:5’-AGTGAAATAGAACACCAAATTGGCA-3’SEQ ID No.O1;
H10-R:5’-TGCTACCAGCAATTCAGCCT-3’SEQ ID No.O2;
H10-P:5’-FAM-ACTAAGGATTCCATAACAG-3’SEQ ID No.O3;
N7-F:5’-AGAGTGAGGAAGCAACTAAGGC-3’SEQ ID No.O4;
N7-R:5’-AGAAGAGAGTCTCACCGGACT-3’SEQ ID No.O5;
N7-P:5’-VIC-ATACCACAAATGTGACGACA-3’SEQ ID No.O6。
4.2阳性对照
本方法中的阳性对照为HA基因和NA基因的两个合成基因片段,连接到pUC57质粒载体上,用DEPC水进行106倍稀释后,最终作为本方法中的阳性对照。
4.3RT-PCR反应平台:
RT-PCR反应体系为:RT-PCR反应液10.0μl,10μM的引物、探针混合液2.75μl,逆转录酶0.2μl,DNA聚合酶0.2μl,RNase抑制剂0.4μl,DEPC H2O 6.45μl,标本核酸5.0μl。其中,引物H10-F、引物H10-R、探针H10-P、引物N7-F、引物N7-R和探针N7-P的摩尔比为3:3:3:2:2:2。
RT-PCR扩增的反应条件是:45℃逆转录10min;95℃变性2min;95℃变性5s,60℃退火和延伸60s,40个循环。
二、实验结果
1.特异性试验结果:如图1所示,依据本发明建立的荧光RT-PCR方法对禽流感H10N7病毒具有较好的特异性,禽流感H10N7型患者的唾液拭子显示阳性反应,对流感病毒H1N1,H3N2,H5N1,H7N9,H9N2以及空白对照流感病毒等均无交叉反应。
2.灵敏性试验结果:对禽流感H10N7型病毒毒株,采用MDCK细胞进行病毒效价测定(100TCID50/ml),将其稀释至1000、100、10、5、0TCID50。病毒RNA用德国QIAGEN公司的试剂盒说明书提取,用本发明建立的荧光RT-PCR方法进行检测,如图2(FAM荧光通道)和图3(VIC荧光通道)所示,图中从A至E的扩增曲线依次表示采用本扩增体系对1000、100、10、5、0TCID50/ml浓度甲型H10N7流感病毒进行扩增检测的结果,结果表明荧光RT-PCR方法检测敏感性达到5TCID50。
3.临床样本的检测结果:从禽流感H10N7型疑似患者的10份临床样本中直接提取病毒RNA,用本发明H10N7病毒双重荧光RT-PCR方法进行检测,结果如图4所示,本发明方法检测出H10N7核酸阳性3份。
综上所述,本实施例中检测结果显示表明本发明方法敏感性好、特异性高、准确可靠。
SEQUENCE LISTING
<110> 解码(上海)生物医药科技有限公司
<120> 一种人感染H10N7禽流感病毒的实时荧光PCR检测方法
<130>
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 25
<212> DNA
<213> 人工序列-H10-F
<400> 1
AGTGAAATAG AACACCAAAT TGGCA 25
<210> 2
<211> 20
<212> DNA
<213> 人工序列-H10-R
<400> 2
TGCTACCAGC AATTCAGCCT 20
<210> 3
<211> 19
<212> DNA
<213> 人工序列-H10-P
<400> 3
ACTAAGGATT CCATAACAG 19
<210> 4
<211> 22
<212> DNA
<213> 人工序列-N7-F
<400> 4
AGAGTGAGGA AGCAACTAAG GC 22
<210> 5
<211> 21
<212> DNA
<213> 人工序列-N7-R
<400> 5
AGAAGAGAGT CTCACCGGAC T 21
<210> 6
<211> 20
<212> DNA
<213> 人工序列-N7-P
<400> 6
ATACCACAAA TGTGACGACA 20
- 还没有人留言评论。精彩留言会获得点赞!
- 人源抗H7N9禽流感病毒中和性抗体1F7L及其应用的制造方法与工艺
- 吲哚衍生物及其制备方法和其抗流感病毒作用与制造工艺
- 检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 检测禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 一种流感病毒逆转录环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶及其应用方法与制造工艺
- 一种保护和稳定病毒RNA的采血管的制造方法与工艺
- H6亚型禽流感病毒荧光定量RT‑PCR检测方法与制造工艺
- 表达H7N9亚型禽流感病毒血凝素蛋白的重组火鸡疱疹病毒株rHOH及构建方法与制造工艺
- 一种提高禽流感疫苗毒株增殖滴度的方法与制造工艺