优化的动物蛋白基因OCX‑36及其原核表达载体的构建的制作方法
本发明涉及分子生物学和生物技术领域,具体地指一种优化的动物蛋白基因ocx-36及其原核表达载体的构建。
背景技术:
由于大肠杆菌表达系统具有培养周期短、表达水平高、生产成本低等优点,是基因工程中应用最为广泛的表达系统,成为基因表达的重要工具,尤其是进入后基因组时代以来,有关蛋白结构以及功能研究的开展,对基因表达的要求更高,大肠杆菌往往是表达的第一选择。然而,动物基因在大肠杆菌系统中表达具有很大的难度和不确定性,虽然已有某些动物基因在大肠杆菌系统中实现成功表达,但效果差别很大,方法各不相同,由于是异源表达,外源的基因会被大肠杆菌防御系统识别并降解造成无法表达,诱导条件、外源基因的性质、菌株种类等等诸多因素都会造成目标基因不表达。另外,大肠杆菌系统通常采用的强启动子容易造成蛋白质折叠不正确,形成包涵体,大肠杆菌没有内质网和高尔基体,合成的肽链无法加工成为有活性的蛋白质。
ovocalyxin-36(ocx-36)是原鸡属(gallusgallus)特有的基因,出现在鸟类和哺乳动物分化之后,源于人脂多糖结合蛋白/人杀菌通透性增加蛋白/腭肺鼻上皮癌关联蛋白(bpi/lbp/plunc)基因簇的顺接重复,氨基酸序列比对搜索结果显示与bpi/lbp/plunc家族蛋白有20-25%同源,实验也证明该蛋白具有显著的抗菌活性。同时研究表明ocx-36mrna的表达发生在蛋壳形成组织,并且在蛋壳形成钙化阶段表达上调,因此ocx-36与生物矿化(如蛋壳形成)息息相关[ovocalyxin-36andotherlbp/bpi/plunc-likeproteinsasmolecularactorsofthemechanismsoftheavianeggnaturaldefences.biochemsoctrans,2011,39:971-976]。
ocx-36是一种前体蛋白,其溶解性较差,并且基因序列中含有串联的稀有密码子,因此作为动物基因的ocx-36在大肠杆菌系统异源表达更加困难,目前国内外还没有关于ocx-36基因体外表达的相关报道。
技术实现要素:
本发明的目的之一是提供了一种优化的动物蛋白基因ocx-36,该优化基因解决了目前动物蛋白基因ocx-36无法在大肠杆菌系统中表达或者在大肠杆菌系统中不能稳定表达的缺点。
本发明的目的之二是提供了一种优化的动物蛋白基因ocx-36表达载体的构建方法,该方法通过优化的基因序列成功构建了重组的表达载体。
本发明的目的之三是提供了一种应用,该应用是利用构建的重组的表达载体制备大量、高纯度的可溶性蛋白rocx-36。
为实现上述目的,本发明提供的一种优化的动物蛋白基因ocx-36,它的核苷酸序列如seqidno.1所示。
本发明通过对ocx-36基因进行分析,基于大肠杆菌的密码子适应指数(cai)0.66(一般认为cai值大于0.8易于表达),其序列中出现连续的稀有密码子,需要对ocx-36基因序列进行优化,提高表达成功率。
本发明还提供了上述基因ocx-36编码的蛋白ovocalyxin-36(简写:rocx-36),它的氨基酸序列如seqidno.2所示。
本发明还提供了一种重组表达载体pet28b-ocx-36,它含有上述优化的动物蛋白基因ocx-36。
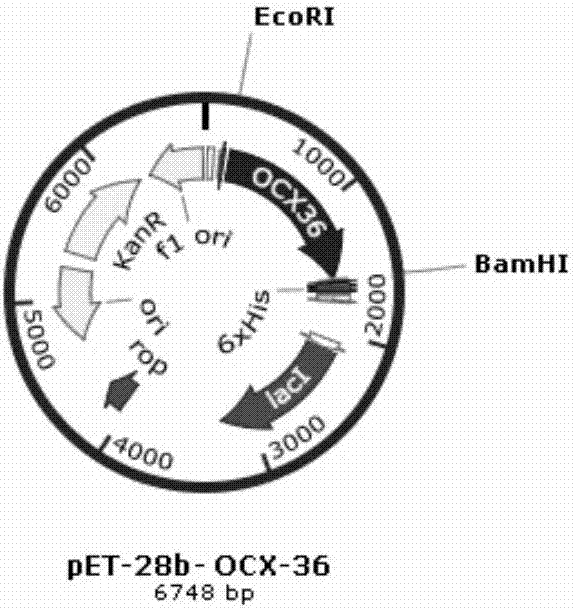
作为优选方案,所述优化的动物蛋白基因ocx-36插入表达载体pet28b(+)的酶切位点bamhⅰ和ecorⅰ之间。
本发明还提供了含有上述重组表达载体的宿主细胞,所述宿主细胞为大肠杆菌c41(de3)感受态细胞。
本发明还提供了一种上述重组表达载体的构建方法,包括以下步骤:
1)对ocx-36编码基因进行分析,根据大肠杆菌的密码子偏好性,对ocx-36基因进行稀有密码子替换,并调整密码子适应指数,同时切除了21个氨基酸长度的信号肽;得到优化的动物蛋白基因ocx-36,其核苷酸序列如核苷酸序列如seqidno.1所示;
2)根据优化的动物蛋白基因ocx-36序列设计特异性引物对,该引物对分别加入保护碱基和相应的限制酶切位点,引物序列分别为:
f-bamhⅰ:cgggatccatgaagccgctgaagctttt,如seqidno.3所示;
r-ecorⅰ:cggaattctcacacggagatcgccaaca,如seqidno.4所示;
3)以优化的动物蛋白基因ocx-36的序列为模板,进行pcr,得到pcr产物;
4)将pcr产物连接到质粒pmd-19t上,得到质粒pmd-19t-ocx-36,
5)bamhⅰ和ecorⅰ分别对pmd-19t-ocx-36和pet28b(+)进行双酶切,回收得到酶切化的ocx-36和线性化的pet28b(+);
6)将酶切化的ocx-36和线性化的pet28b(+)用t4连接酶4℃连接过夜,得到连接产物pet28b-ocx-36。
本发明还提供了一种上述重组表达载体的宿主细胞制备ovocalyxin-36蛋白的方法,包括以下步骤:
1)将连接产物转化大肠杆菌c41(de3)或者bl21(de3),t7e(de3)感受态细胞;
2)冰浴30min后,42℃热激90s,600μl无抗性lb复苏45min,取适量复苏后的菌液于37℃培养箱中过夜;
3)异丙基硫代-β-d-半乳糖苷(iptg)诱导表达,浓度为1mm,诱导温度20~37℃,诱导4h;
4)取诱导表达的菌液,加入ph7.5的pbs缓冲液,12000×g离心10min,超声破碎后离心,保留上清液;
5)上清液上样至ni-ntahisbind树脂,结合液为20mm咪唑、10mmtris-hcl、500mmnacl,ph8.0;洗脱液为200mm咪唑、10mmtris-hcl、500mmnacl,ph8.0,洗脱得到蛋白rocx-36。
本发明还提供了一种利用上述制备的蛋白ovocalyxin-36在制备抗炎的药品中的应用。
作为优选方案,蛋白ovocalyxin-36在制备结肠炎的药品中的应用。
本发明还提供了一种利用上述制备得到蛋白ovocalyxin-36在制备结肠炎的药品中的应用。
本发明的有益效果在于:
本发明提供了一种采用大肠杆菌表达体系获取原鸡属特有的ocx-36蛋白的方法,优化其基因结构,成功建立了蛋白rocx-36的可溶性表达技术。利用该技术可以获得占总表达蛋白40%-50%的蛋白rocx-36,且分离纯化只需要一次亲和层析,生产成本低,易于大量表达,适于工业化生产。ocx-36在大肠杆菌中的成功克隆表达,将有利于工业化生产应用,在生物、医药、食品、材料等领域具有十分广阔的应用前景。
附图说明
图1为实验技术流程图;
图2为重组质粒pet28b-ocx-36的质粒图谱,
图中,kan表示卡那抗性,bamhⅰ和ecorⅰ为双酶切位点,优化的动物蛋白基因ocx-36为目的基因;
图3为优化的动物蛋白基因ocx-36的pcr扩增结果图,
图中,m表示核酸marker,1表示扩增获得的优化的动物蛋白基因ocx-36;
图4为质粒双酶切检测结果图,
图中,m表示核酸marker,1、2表示酶切之后的载体和优化的动物蛋白基因ocx-36;
图5为测序结果分析比对;
图6为表达产物的westblot结果图;
图中,-:阴性对照;+:阳性对照;1.e.colic41菌株,37℃,沉淀;2.e.colic41菌株,37℃,上清;3.e.colic41菌株,25℃,沉淀;4.e.colic41菌株,25℃,上清;5.e.colibl21菌株,37℃,沉淀;6.e.colibl21菌株,37℃,上清;7.e.colibl21菌株,25℃,沉淀;8.e.colibl21菌株,25℃,上清;9.e.colit7e菌株,37℃,沉淀;10.e.colit7e菌株,37℃,上清;11.e.colit7e菌株,25℃,沉淀;12.e.colit7e菌株,25℃,上清。
图7为表达产物纯化后sds-page结果图;
图8为活性检测实验结果图;
图9为ocx-36蛋白对巨噬细胞raw264.7细胞活力的影响;
图10为ocx-36蛋白对raw264.7细胞凋亡的影响;
图中,图10a为pbs处理的对照组、图10b为脂多糖活化的巨噬细胞、图10c为脂多糖和ocx-36蛋白共同处理的巨噬细胞;
图11为ocx-36蛋白对脂多糖活化的raw264.7细胞tnf-α表达水平的影响;
图12为ocx-36蛋白对脂多糖活化的raw264.7细胞il-β表达水平的影响;
图13为ocx-36蛋白对脂多糖活化的raw264.7细胞il-6表达水平的影响;
图14为ocx-36蛋白对脂多糖活化的raw264.7细胞炎症基因mrna表达的影响;
图中,图14a为inos的mrna表达水平、图14b为tnf-α的mrna表达水平、图14c为il-β、图14d为il-6;
图15为小鼠结肠组织h&e染色结果图;
图中,a为患有结肠炎未经治疗的结肠组织,b为蛋白rocx-36治疗过的结肠组织。
图16为结肠组织透射电镜观察结果图;
图中,a为患有结肠炎未经治疗的结肠组织,b为蛋白rocx-36治疗过的结肠组织。
具体实施方式
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
实施例1:ocx-36基因序列的优化
(1)密码子分析及优化
对ocx-36原始基因进行分析,结果见表1、表2,ocx-36原始基因中稀有密码子数量占11%,并且编码区有连续的稀有密码子簇出现,这种情况下该基因很难在大肠杆菌表达。根据大肠杆菌的密码子偏好性,对ocx-36原始基因进行稀有密码子替换,并调整密码子适应指数,同时切除了21个氨基酸长度的信号肽。
表1
表2
(2)引物设计及pcr反应
根据优化的动物蛋白基因ocx-36序列设计特异性引物对,上游引物自起始密码子处设计,下游引物至终止密码子处设计,分别加入保护碱基和相应的限制酶切位点,引物序列分别为:
f-bamhⅰ:cgggatccatgaagccgctgaagctttt(bamhⅰ);
r-ecorⅰ:cggaattctcacacggagatcgccaaca(ecorⅰ)。以优化的动物蛋白基因ocx-36的cdna为模板,与设计的引物对进行pcr扩增反应,步骤如下:
pcr反应程序为:94℃预变性5min;94℃变性30s,56℃复性90s,72℃延伸30s,30个循环;72℃延伸7min,15℃保存。
pcr反应体系为:dh2o(14.2μl),10×kodbuffer(2μl),kod(0.2μl),dntp(1.6μl),cdna(1μl),f-bamhⅰ(0.5μl),r-ecorⅰ(0.5μl)。
实施例2:原核表达载体的构建与表达纯化
(1)目的片段与载体连接
bamhⅰ和ecorⅰ对质粒pmd-19t-ocx-36进行酶切,反应体系为:bamhⅰ(0.2μl),ecorⅰ(0.2μl),10×tangobuffer(2μl),质粒pmd-19t-ocx-36(2μl),dh2o(14μl)。反应结束后进行1.5%凝胶电泳检测分离酶切片段,gelextractionkit回收待用。
双酶切处理之后的优化的动物蛋白基因ocx-36和表达载体16℃连接4小时。
具体反应体系为:酶切后优化的动物蛋白基因ocx-36(3.5μl),酶切后pet-28b(+)(0.5μl),t4ligasebuffer(0.5μl),t4ligase(0.5μl),dh2o(5μl)。
(2)连接产物的转化
取大肠杆菌感受态细胞dh10b置于冰上,将2μl的连接产物缓慢加入30μl感受态细胞中,电转仪转化。向离心管中加入500μlsoc培养基,于37℃的恒温摇床中180rpm,复苏45min。
吸取50μl菌液涂在含有0.05mg/ml氨苄霉素的lb固体培养基,37℃培养12-16h。
(3)菌落pcr鉴定及测序
灭菌牙签挑取单个白色菌落,接种到lb培养液中,37℃、200r/min振荡培养10-12h,至菌液浑浊,以菌液作模板进行pcr扩增,琼脂糖凝胶电泳检测目的条带,筛选阳性克隆的菌落测序(图5)。
(4)表达
将阳性克隆菌分别转入e.colibl21,t7e,c41中,冰浴30min,42℃,90s热激,加600μl无抗性lb复苏45min,取适量复苏后的菌液涂带有kana抗性的培养皿,放入37℃培养箱中过夜。诱导条件:iptg浓度为1mm,诱导时间4h,诱导温度分别为25℃和37℃,体积3ml。表达产物免疫印迹分析结果如图6。
(5)纯化
取诱导表达的菌液离心,12000×g离心10min,加入pbs缓冲液(ph7.5),超声破碎菌体释放蛋白,裂解液于12000×g离心10min将细胞碎片等杂质去除,保留上清液,4℃备用。
上清液经超滤管浓缩,上样至ni-ntahisbind树脂,结合液为20mm咪唑、10mmtris-hcl、500mmnacl,ph8.0;洗脱液为200mm咪唑、10mmtris-hcl、500mmnacl,ph8.0。洗脱下的目的蛋白放入透析袋,ph7.6,500mmtris-hcl中透析过夜,sds-page检测(图7)。
实施例3:活性检测
采用琼脂扩散法比较天然状态的ocx-36蛋白与重组表达的蛋白rocx-36抑菌效果。使用的菌种为革兰氏阴性菌(大肠杆菌、绿脓杆菌、沙门氏菌),革兰氏阳性菌(金黄色葡萄球菌、粪肠球菌)。
结果如图8所示,表明重组表达的蛋白rocx-36活性较高。
综上所述,上述构建了含有优化的动物蛋白基因ocx-36的表达载体pet28b-ocx-36,获得的蛋白rocx-36具有较高的活性。
实施例4:蛋白rocx-36的体外抗炎效果
(1)蛋白rocx-36的细胞毒性评价
巨噬细胞raw264.7与0~500μg/ml不同浓度的蛋白rocx-36孵育72h,cck-8法检测细胞活力,酶标仪在450nm波长处测定各孔吸光度值od450。
通过吸光度值计算细胞活力,计算公式为:
实验结果如图9所示,表明各个浓度的蛋白rocx-36对巨噬细胞没有毒性。
(2)蛋白rocx-36对脂多糖活化的巨噬细胞凋亡的影响
rwa264.7细胞分别与lps(0.1μg/ml),lps(0.1μg/ml)+rocx-36(25μg/ml)孵育24h,pbs作空白对照,annexinv-fitc/pi对rwa264.7进行双染色,流式细胞术检测细胞凋亡,
结果图10所示:pbs空白对照组、lps活化组以及rocx-36+lps共同作用组早期凋亡的巨噬细胞比例分别为0%、(23.96±0.33)%、(12.79±0.41)%,差异具有统计学意义(p<0.01);晚期凋亡的比例分别为0%、(5.52±0.25)%、(4.54±0.36)%,差异具有统计学意义(p<0.05),rocx-36对lps活化的巨噬细胞凋亡抑制作用明显,早期凋亡率降低了187%,晚期凋亡率降低了122%。
(3)蛋白rocx-36对脂多糖活化的巨噬细胞促炎因子表达的影响
tnf-α、il-1β和il-6是由巨噬细胞释放,并参与调控炎症反应进程的促炎因子。使用lps(0.1μg/ml)刺激raw264.7细胞,elisa法检测细胞上清液中tnf-α、il-1β和il-6的表达水平,然后与各浓度的蛋白rocx-36实验组进行比较,β-actin作为内参基因。
结果如图11-13所示,不同浓度蛋白rocx-36对炎症因子tnf-α、il-1β和il-6释放量均具有显著的(p<0.01或p<0.05)抑制效果,抑制作用具有蛋白浓度依赖性。
(4)蛋白rocx-36对脂多糖活化的巨噬细胞炎症基因mrna表达的影响
rt-pcr技术检测inos,tnf-α,il-1β和il-6炎症细胞因子在基因水平上的调控,β-actin作为内参基因,蛋白rocx-36对这些炎症因子mrna转录水平的影响;
如图14a-d所示:在0.1μg/ml的lps的诱导下,raw264.7细胞内的inos,tnf-α,il-1β和il-6mrna大量表达。而25~100μg/ml的蛋白rocx-36对lps诱导的巨噬细胞炎症因子的mrna表达具有抑制作用,并且呈现剂量依赖性。
实施例5:蛋白rocx-36对结肠炎的治疗效果
对结肠炎模型小鼠腹腔注射剂量浓度为5mg/kg的蛋白rocx-36,连续注射三天,小鼠处死之后,取结肠组织,制作组织切片,h&e染色以及透射电镜观察肠道形态变化。h&e染色观察发现,患有肠炎的小肠绒毛形态受损严重,而蛋白rocx-36治疗对绒毛形态有明显的改善作用(图15)。透射电镜观察发现,患有结肠炎的肠道上皮微绒毛排列稀疏、脱落严重,与对照组相比,蛋白rocx-36的治疗能够缓解空肠上皮微绒毛脱落现象,同时微绒毛排列更加整齐、紧凑(图16)。
以上结果表明蛋白rocx-36能有效改善肠道绒毛和微绒毛形态,可以用于治疗结肠炎。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
<110>华中农业大学
<120>优化的动物蛋白基因ocx-36及其原核表达载体的构建
<211>1365bp
<212>dna
<213>优化的动物蛋白基因ocx-36
<400>1
gaattcgccaccatggctgtgctcagtggactcagttgcgctatcagcccaagagctatg60
cagcaggttctgagtgacgctatcatccagaccggactgttggagaagcacctgcaggga120
atggctctccctaacatcatgagcgaccgtggactgctcagcagtccaaccatcatcact180
ggcctgcacttggagaggagttggctcccaaccttgtccatcgctctgttgccaggaatc240
ggaatgcagctggttgtcaccgttcacttggacctgtctggaaactgcctgatgggaatc300
ctgagcgaggttatcgccatcagcttggacgtgactattaccagcaacatcaagagcacc360
agcttcgagctgggcaccgtgcacgttaccgttgacgactgtttctgcatcctgggagct420
gtgaagatcaagctgatcagcggcctgttgagcctgtctgtgcacgacatggtgttctcc480
cacttgacagctacactgccaggattgctgtgcccagttatggacgctgtttccgagatc540
gtgaacgtgcagttgctgagcacactgaacgtggtcatgccagtgggtttgaagggtatg600
gtgcactaccacctggtcggtccaccctttacatctggtagctctctgatgatggacctg660
gacggtacagtgcagcaaatgggcggttctatcattccccacgactcctacgcttccaca720
ctgcctcctttgttggacggtctgctggttatcatcctcaggcaaagcttcctctcctcc780
ctcctcgctctcttgttgcacatccaaccttacactttcccttgttcctccgaggctttc840
tccggtgccaatcaactccgtgattccatcactgacctctaccctactggttgcacatcc900
tgtcctgccgcctcacctctctctatccgtgttgaatgtgtgggtaaccctatcctcctc960
ctggaacccaacaaggccacagtcgaactctccgttctcctccaagtcttcgttaagcgt1020
cccgatggttctgtcatcatcctcttgttgctgaaggccgatctctctctcaacgtgcgc1080
ctctcaatctctcgcggctctctcatgctcgccttctcactctcacgcgtctctctcttt1140
ctggaatcatcagatatcggcatctcagaaatttcaaacctgaaaccccacctgactaaa1200
ctcctggtcgaaatctatctgccccgcctgaatgccgtcgccgccgatggcattcccctg1260
cccgatgtcttcggcattactctcatgggcgccgaactgcaaattctcctgggcctgctg1320
gccatttcagtcggctcacaccatcatcaccatcactaactcgag1365
<210>2
<211>442
<212>prt
<213>蛋白ovocalyxin-36
<400>2
mavlsglscaispramqqvlsdaiiqtgllekhlqgmalpnimsdrgllssptiitglhl60
erswlptlsiallpgigmqlvvtvhldlsgnclmgilseviaisldvtitsnikstsfel120
gtvhvtvddcfcilgavkiklisgllslsvhdmvfshltatlpgllcpvmdavseivnvq180
llstlnvvmpvglkgmvhyhlvgppftsgsslmmdldgtvqqmggsiiphdsyastlppl240
ldgllviilrqsflssllalllhiqpytfpcsseafsganqlrdsitdlyptgctscpaa300
splsirvecvgnpilllepnkatvelsvllqvfvkrpdgsviillllkadlslnvrlsis360
rgslmlafslsrvslflessdigiseisnlkphltkllveiylprlnavaadgiplpdvf420
gitlmgaelqillgllaisvgs442
<210>3
<211>28
<212>dna
<213>f-bamhⅰ
<400>3
cgggatccatgaagccgctgaagctttt28
<210>4
<211>28
<212>dna
<213>r-ecorⅰ
<400>4
cggaattctcacacggagatcgccaaca28
- 还没有人留言评论。精彩留言会获得点赞!