从鱼鳞中同时提取并分离活性成分的方法与流程
本发明涉及生物提取技术,属于鱼副业深加工技术领域,特别是一种从鱼鳞中同时提取和分离鸟嘌呤、胶原蛋白肽和胶原蛋白的方法。
背景技术:
鱼鳞(scale)是鱼真皮层的胶原质生成的骨质鳞片,占鱼体重量的1%~5%。鱼鳞外表上像花瓣,且边缘呈微小的卷曲,白色光泽,略带有鱼腥味,质地坚且柔软。已有研究表明,鱼鳞中有机物占41%~55%,无机物占38%~46%,含水量为16.4%~17.8%。有机物含量最多的是蛋白质,其中又以胶原蛋白和鱼鳞角蛋白为主,占鱼鳞有机物的90%,也含有嘌呤类化合物。无机物以羟基磷灰石为主。
鱼鳞在营养和医学领域显示出良好的作用。营养学家研究发现,鱼鳞含有较多的卵鳞脂,有增强大脑记忆力、缓延细胞衰老的作用;鱼鳞中含有大量的胶原蛋白,可起多种生物学功能,如促进伤口愈合、止血等,抗原性较低,可促进骨骼的形成,增强皮肤代谢等。鱼鳞胶原蛋白与其他胶原蛋白比,其蛋白质易分解,容易被消化、吸收。鱼鳞中所含的多种不饱和脂肪酸,可以在血液中以结合蛋白的形式帮助传递及乳化脂肪,减少胆固醇在血管壁上沉积,具有防止动脉硬化、预防高血压及心脏病等多种作用。因此,鱼鳞是特殊的保健食品。从鱼鳞中提取的6-疏代鸟嘌吟,临床治疗急性白血症,有效率为70%~75%;并对胃癌、淋巴腺瘤亦有奇效。
鱼鳞中含有较多的鸟嘌呤,鸟嘌呤可以从鸟粪或鱼鳞中提取。鸟嘌呤及其衍生物具有重要生物活性,如抗肿瘤、抗病毒[kima.,hongh.j.synthesisandanti-hivstudyofnovelacyclicguaninederivatives[j].nucleosidesnucleotidesnucleicacids,2008,27(2):121-130]等,也是主要的医药中间体,可用于合成一系列高效低毒的抗疱疹病药物。
中国是世界上最大的淡水鱼养殖国家。每年在水产品加工过程中产生的下脚料(如鱼皮、鱼骨、蟹壳、鱼鳞等)达到250万吨以上[张俊杰,曾庆孝.鱼鳞的开发利用前景[j].加工技术,2004,(5):74-75],其中鱼鳞达35~45万吨[何兰.鱼鳞胶原的制备与开发应用前景[j].水产科技情报,2007,34(5):210-212]。如何利用鱼鳞资源,使其变废为宝,是近些年来从事渔业深加工产业研究的热点。对这些鱼鳞废弃物的深加工利用,已有大量的研究报道。研究主要集中在用鱼鳞提取胶原蛋白、抗氧化肽、降血压肽[曾丽,李丽,王加斌,等.水产胶原蛋白肽功能活性及其制备工艺研究进展[j].浙江海洋学院学报,2013,32(2):163-168],用鱼鳞制各鱼鳞羟基磷灰石等[郝俊杰超声预处理酶膜耦合反应制备鱼鳞胶原蛋白肽的技术研究,江苏大学硕士学位论文,2014]和提取鸟嘌呤或珍珠精或鱼鳞精(fishsilver)[曾晓丹,张盈娇,夏陈,王自鹏,曹阳草鱼鱼鳞提取鸟嘌呤的工艺和质量研究[j],现代农业科技,2012,1:15-16;cn1033827a一种从鱼鳞中提取珍珠精的方法;cn201410730562.1一种从鱼鳞中提取珍珠精的方法]等。
从鱼鳞中提取胶原蛋白的方法,通用的技术路线可归结为:先将鱼鳞除杂,洗净晾干,再用除钙剂除去钙,再选择合适的提取剂和设备提取胶原蛋白和分离。根据选择的提取剂不同,得到的胶原蛋白不同[鉏晓艳,熊光权,李新,耿胜荣,于巍,江洪有,廖涛草鱼鱼鳞胶原蛋白肽的制备及分析[j].食品研究与开发,2014,35(7):36-39;张慧洁水解胶原蛋白分子量控制技术的研究,天津科技大学硕士论文,2014,2-3]。用热水处理获取的鱼鳞胶被称为热法胶,用酸液处理获取的鱼鳞胶被称为酸法胶,用碱液处理获取的鱼鳞胶则被称为碱法胶,采取蛋白酶获得的鱼鳞胶被称为酶法胶或胶原蛋白肽,cn103773828a从鱼鳞中提取胶原蛋白的方法;cn104892750a一种酸溶性鱼鳞胶原蛋白的制备方法;cn101418328a一种鱼鳞胶原蛋白的制备方法;cn103773830b一种从鱼鳞中提取胶原蛋白的方法;cn105063154a一种从鱼鳞中提取胶原蛋白的方法;cn103773830b一种从鱼鳞中提取胶原蛋白的方法;雷静,李和生,张丽媛,孙楠楠,乌贼皮胶原蛋白的提取及结构表征[j],天然产物研究与开发,2012,24:575-580]等。
从鱼鳞中提取鸟嘌呤的方法,目前研究较少。仅见有曾晓丹等人从草鱼鱼鳞中提取鸟嘌呤[曾晓丹,张盈娇,夏陈,王自鹏,曹阳草鱼鱼鳞提取鸟嘌呤的工艺和质量研究[j],现代农业科技,2012,1:15-16]、两个中国发明专利[cn1033827a一种从鱼鳞中提取珍珠精的方法;cn201410730562.1一种从鱼鳞中提取珍珠精的方法]。前一文献方法是将预先处理好的鱼鳞,在温度98℃下、加入表面活性剂和在浓度为5.0mol/l的盐酸条件下将草鱼鱼鳞提取2.0h,得到滤液后静止结晶,并将结晶用盐酸溶液再次精制后即得盐酸鸟嘌呤。后两个专利方法均在后续处理中使用了表面活性剂和对人体和环境有很大影响的四氯化碳。
以上所公开的技术内容仅是对鱼鳞的胶原蛋白或胶原蛋白肽或鸟嘌呤所分别进行的单独提取。也就是说在提取胶原蛋白或胶原蛋白肽时,未对鸟嘌呤进行提取;在提取鸟嘌呤时,未对胶原蛋白或胶原蛋白肽进行提取,尤其是用酸做除钙剂时,已有部分胶原蛋白溶解于酸而丢失。因而以上所述及的方法存在着对具有重要可用成分的丢失和资源的浪费的问题,且业内至今也未见就如何利用鱼鳞同时提取出高附加值产品的胶原蛋白、胶原蛋白肽和鸟嘌呤而提出有效的技术方案。因此,研发一种从鱼鳞中同时提取活性成分及其分离的方法,对提高生产效率、减少资源浪费十分必要。
技术实现要素:
本发明的目的是:提出一种从鱼鳞中同时提取并分离活性成分的方法,从鱼鳞中一步提取并分离出具有重要生理作用的胶原蛋白、胶原蛋白肽和鸟嘌呤产品,以实现鱼鳞的高效利用。
本发明的技术解决方案是:以鱼鳞为原料,将鱼鳞中的鸟嘌呤、胶原蛋白肽和胶原蛋白同时进行提取,再控制提取液的浓度和酸度及温度,依次将胶原蛋白、鸟嘌呤和胶原蛋白肽进行分离;具体步骤如下:对洗净和除杂质的鱼鳞经过冷冻干燥后,粉碎成丝状鱼鳞;将丝状鱼鳞按照一定的固液比与提取溶剂混合后,置于超声装置中,在设置的超声功率、温度和超声时间下进行提取,离心分离去不溶物,得含有鸟嘌呤、胶原蛋白肽和胶原蛋白的混合提取液;将混合提取液置于旋转蒸发装置中进行浓缩得到浓缩液;浓缩液置于低温下静置至出现沉淀和清液后,过滤得到沉淀a和清液b;沉淀a用去离子水洗涤至无氯离子后冷冻干燥得白色物c;将清液b通过碱性溶液调节至一定ph值后,在低温下静置一定时间,过滤及用去离子水洗涤至无氯离子后得到白色沉淀d和澄清溶液e,白色沉淀d被冷冻成白色粉末状d;澄清溶液e继续用碱性溶液调节至一定ph值后,浓缩,在低温下静置一定时间,过滤分离得沉淀f和滤液g,沉淀f经洗涤、冷冻干燥后为无色物f,滤液g被浓缩后直接冷冻干燥得白色粉末g;白色物c、白色粉末状d的红外与标准牛血清蛋白红外图完全一致,且不溶于水,易溶于盐酸,证明两种物为胶原蛋白;无色物f的红外与标准鸟嘌呤基本一致,不溶于水,证明为不纯的鸟嘌呤;白色粉末g极易溶于水,也极易溶于酸,红外图和标准牛血清胶原蛋白一致,标明为含有盐的水溶性胶原蛋白肽。
其中,所用的鱼鳞为海鱼、淡水鱼的鱼鳞或两种鱼鳞的混合物。
其中,所述的洗净和去杂质的鱼鳞是指:将市场所购置的鱼鳞,用水洗涤至无血色和洗涤水溶液无浑浊物,不做其他任何处理,直接进行冷冻干燥,粉碎成丝状鱼鳞。
其中,提取溶剂的选择是以两种标准样品鸟嘌呤和胶原蛋白在不同的溶剂,如去离子水、氨水、氢氧化钠溶液、盐酸溶液分别进行溶解试验;其中盐酸溶液均能溶解两种标准样品(鸟嘌呤和胶原蛋白);故盐酸溶液为同时提取的优选溶剂。
其中,混合提取液的提取过程是:将丝状鱼鳞按照质量数与0.050~0.82mol/l浓度的盐酸溶液体积按照1g:10~19ml比混合后,置于超声装置中,功率35~71%、时间20~40分钟和温度300c进行提取;离心分离去不溶物,得含有鸟嘌呤、胶原蛋白肽和胶原蛋白的混合提取液。
其中,混合提取液是在利用均匀设计法设计的提取条件下获得的;对胶原蛋白及胶原蛋白肽的提取率是通过光度法对混合提取液中代表胶原蛋白及胶原蛋白肽的羟脯氨酸进行测定和计算的;对鸟嘌呤的提取率是通过高效液相色谱法对混合提取液中的鸟嘌呤进行检测和计算的;对提取条件和提取率的关系通过excel2003软件进行拟合,得出了回归分析方程,用偏微分法解此方程,得到了优化的提取条件为:丝状鱼鳞的质量与盐酸的体积比为1g:16.6ml,hcl浓度0.33mol/l,超声功率57%,提取时间28min,提取温度为300c。
其中,浓缩过程是:混合提取液6000r/min离心20min,得滤液,滤液经旋转蒸发浓缩得浓缩液。
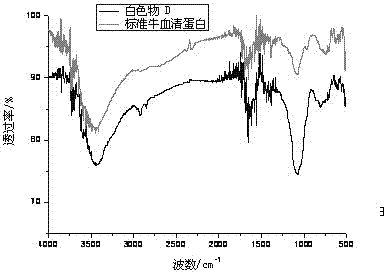
其中,胶原蛋白的分离是:浓缩液置于00c~100c静置过夜后,过滤分离,得到沉淀a和清液b;沉淀a用去离子水洗涤至无氯离子后在冻干机中冷冻干燥得白色物c;清液b用0.5~1mol/l的氢氧化钠调节ph值为6.0~6.5后,同样是在00c~100c低温静置过夜后,通过定量滤纸过滤及去离子水洗涤,得到白色沉淀d和澄清溶液e,白色沉淀d被冷冻成白色粉末状d;白色物c、白色粉末状d的红外与标准牛血清蛋白红外图完全一致,且不溶于水,易溶于盐酸,证明两种物为胶原蛋白。
其中,鸟嘌呤的分离是:通过定量滤纸过滤白色沉淀d后所得的澄清溶液e用0.05~0.2mol/l氢氧化钠调节ph值为7.0-7.5后,浓缩,在00c~100c低温静置过夜至有清液和沉淀,过滤分离得沉淀f和滤液g,沉淀f经水洗涤,冷冻干燥后为无色物f;无色物f的红外与标准鸟嘌呤基本一致,不溶于水,证明为不纯的鸟嘌呤。
其中,胶原蛋白肽的分离是:过滤分离得沉淀f后的滤液g,旋转蒸发至无水蒸出,再在低温冰箱中结冰后在冷冻干燥机中冻干得白色粉末g;白色粉末g极易溶于水,也极易溶于酸,红外图和标准牛血清胶原蛋白一致,标明为含有盐的水溶性胶原蛋白肽。
本发明具有以下优点:
(一)本发明以鱼鳞经过简单水洗除杂步骤,直接进行同时鱼鳞中活性成分的提取和分离,简化了目前已有的专利技术或文献用鱼鳞作原料提取胶原蛋白或胶原蛋白肽需要加除钙剂除去钙的步骤,使得提取工艺简便。
(二)使用一定浓度的盐酸作为提取剂,同时起到了多种作用:可溶解胶原蛋白和鸟嘌呤,还可将部分胶原蛋白酸解成胶原蛋白肽,而且还在后续通过与氢氧化钠作用生产盐,起到了将胶原蛋白盐析出的作用和除去鱼鳞中钙的作用。
(三)现有利用鱼鳞提取胶原蛋白或胶原蛋白肽的发明或文献技术中,在提取过程中仅提取了鱼鳞单一活性成分,其他有用成分丢失;本发明与现有这些技术相比,鱼鳞中的胶原蛋白、胶原蛋白肽和鸟嘌呤有效成分一步获得了提取和基本的分离,充分利用了鱼鳞自然资源,克服了单一提取的技术缺陷。
附图说明
图1为本发明的工艺流程图;其中:(1)为提取优化工艺流程图;(2)为提取与分离工艺流程图;
图2为提取的白色物c与标准牛白蛋白红外扫描图;
图3为提取的白色物d及标准牛白蛋白的红外扫描图;
图4为提取的无色物f与鸟嘌呤标样红外扫描图;
图5为提取的白色物g与标准牛白蛋白的红外扫描图。
具体实施方式
下面通过实施例对本发明进行具体的描述。必须指出的是给出的实施例,仅是对本发明的进一步说明,不能理解为对本发明保护范围的限制,该领域的专业人员可以根据本发明的内容作出某些非本质性的改进和调整。
实施例1:依以下步骤提取并分离鱼鳞中的活性成分
(1)鱼鳞的预处理:将市场所购置的鱼鳞,用水洗涤至无血色和洗涤水溶液无浑浊物,不做其他任何处理,直接进行冷冻干燥,粉碎成丝状鱼鳞;
(2)混合提取液的获得:将50.0g丝状鱼鳞按照质量数与0.050mol/l浓度的盐酸溶液体积按照1g:10ml比混合后,置于超声装置中,功率35%、时间20分钟和温度300c进行提取;离心分离去不溶物,得含有鸟嘌呤、胶原蛋白肽和胶原蛋白的混合提取液;
(3)浓缩:混合提取液6000r/min离心20min,得滤液,滤液经旋转蒸发浓缩得浓缩液;
(4)胶原蛋白的分离:浓缩液置于00c静置过夜后,过滤分离,得到沉淀a和清液b;沉淀a用去离子水洗涤至无氯离子后在冻干机中冷冻干燥得白色物c6.8g;清液b用0.5mol/l的氢氧化钠调节ph值为6.0后,同样是在00c低温静置过夜后,通过定量滤纸过滤及去离子水洗涤,得到白色沉淀d和澄清溶液e,白色沉淀d被冷冻成白色粉末状d4.6g;白色物c、白色粉末状d的红外与标准牛血清蛋白红外图完全一致,且不溶于水,易溶于盐酸,证明两种物为胶原蛋白;
(5)鸟嘌呤的分离:通过定量滤纸过滤白色沉淀d后所得的澄清溶液e用0.05mol/l氢氧化钠调节ph值为7.0后,浓缩,在00c低温静置过夜至有清液和沉淀,过滤分离得沉淀f和滤液g,沉淀f经水洗涤,冷冻干燥后为无色物f0.24g;无色物f的红外与标准鸟嘌呤红外基本一致,不溶于水,证明为不纯的鸟嘌呤;
(6)胶原蛋白肽的分离:过滤分离得沉淀f后的滤液g,旋转蒸发至无水蒸出,再在低温冰箱中结冰后在冷冻干燥机中冻干得白色粉末g5.2g;白色粉末g极易溶于水,也极易溶于酸,白色粉末g的红外图和标准牛血清胶原蛋白红外图一致,标明为含有盐的水溶性胶原蛋白肽。
实施例2:依以下步骤提取并分离鱼鳞中的活性成分
(1)鱼鳞的预处理:将市场所购置的鱼鳞,用水洗涤至无血色和洗涤水溶液无浑浊物,不做其他任何处理,直接进行冷冻干燥,粉碎成丝状鱼鳞;
(2)混合提取液的获得:将50.0g丝状鱼鳞按质量数与0.45mol/l浓度的盐酸溶液体积按照1g:14.5ml比混合后,置于超声装置中,功率53%、时间30分钟和温度300c进行提取;离心分离去不溶物,得含有鸟嘌呤、胶原蛋白肽和胶原蛋白的混合提取液;
(3)浓缩:混合提取液6000r/min离心20min,得滤液,滤液经旋转蒸发浓缩得浓缩液;
(4)胶原蛋白的分离:浓缩液置于50c静置过夜后,过滤分离,得到沉淀a和清液b;沉淀a用去离子水洗涤至无氯离子后在冻干机中冷冻干燥得白色物c13.8g;清液b用0.75mol/l的氢氧化钠调节ph值为6.3后,同样是在50c低温静置过夜后,通过定量滤纸过滤及去离子水洗涤,得到白色沉淀d和澄清溶液e,白色沉淀d被冷冻成白色粉末状d11.1g;白色物c、白色粉末状d的红外与标准牛血清蛋白红外图完全一致,且不溶于水,易溶于盐酸,证明两种物为胶原蛋白;
(5)鸟嘌呤的分离:通过定量滤纸过滤白色沉淀d后所得的澄清溶液e用0.13mol/l氢氧化钠调节ph值为7.5后,浓缩,在50c低温静置过夜至有清液和沉淀,过滤分离得沉淀f和滤液g,沉淀f经水洗涤,冷冻干燥后为无色物f0.28g;无色物f的红外与标准鸟嘌呤基本一致,不溶于水,证明为不纯的鸟嘌呤;
(6)胶原蛋白肽的分离:过滤分离得沉淀f后的滤液g,旋转蒸发至无水蒸出,再在低温冰箱中结冰后在冷冻干燥机中冻干得白色粉末g8.6g;白色粉末g极易溶于水,也极易溶于酸,红外图和标准牛血清胶原蛋白一致,标明为含有盐的水溶性胶原蛋白肽。
实施例3:依以下步骤提取并分离鱼鳞中的活性成分
(1)鱼鳞的预处理:将市场所购置的鱼鳞,用水洗涤至无血色和洗涤水溶液无浑浊物,不做其他任何处理,直接进行冷冻干燥,粉碎成丝状鱼鳞;
(2)混合提取液的获得:将50.0g丝状鱼鳞按质量数与0.82mol/l浓度的盐酸溶液体积按照1g:19ml比混合后,置于超声装置中,功率71%、时间40分钟和温度300c进行提取;离心分离去不溶物,得含有鸟嘌呤、胶原蛋白肽和胶原蛋白的混合提取液;
(3)浓缩:混合提取液6000r/min离心20min,得滤液,滤液经旋转蒸发浓缩得浓缩液;
(4)胶原蛋白的分离:浓缩液置于100c静置过夜后,过滤分离,得到沉淀a和清液b;沉淀a用去离子水洗涤至无氯离子后在冻干机中冷冻干燥得白色物c15.6g;清液b用1mol/l的氢氧化钠调节ph值为6.5后,同样是在100c低温静置过夜后,通过定量滤纸过滤及去离子水洗涤,得到白色沉淀d和澄清溶液e,白色沉淀d被冷冻成白色粉末状d12.1g;白色物c、白色粉末状d的红外图与标准牛血清蛋白红外图完全一致,且不溶于水,易溶于盐酸,证明两种物为胶原蛋白;
(5)鸟嘌呤的分离:通过定量滤纸过滤白色沉淀d后所得的澄清溶液e用0.2mol/l氢氧化钠调节ph值为7.5后,浓缩,在100c低温静置过夜至有清液和沉淀,过滤分离得沉淀f和滤液g,沉淀f经水洗涤,冷冻干燥后为无色物f0.33g;无色物f的红外图与标准鸟嘌呤红外图基本一致,不溶于水,证明为不纯的鸟嘌呤;
(6)胶原蛋白肽的分离:过滤分离得沉淀f后的滤液g,旋转蒸发至无水蒸出,再在低温冰箱中结冰后在冷冻干燥机中冻干得白色粉末g9.2g;白色粉末g极易溶于水,也极易溶于酸,白色粉末g红外图和标准牛血清胶原蛋白红外图一致,标明为含有盐的水溶性胶原蛋白肽。
实施例4:依以下步骤提取并分离鱼鳞中的活性成分
(1)鱼鳞的预处理:将市场所购置的鱼鳞,用水洗涤至无血色和洗涤水溶液无浑浊物,不做其他任何处理,直接进行冷冻干燥,粉碎成丝状鱼鳞;
(2)混合提取液的获得:将50.0g丝状鱼鳞按质量数与0.33mol/l浓度的盐酸溶液体积按照1g:16.6ml比混合后,置于超声装置中,功率57%、时间28分钟和温度300c进行提取;离心分离去不溶物,得含有鸟嘌呤、胶原蛋白肽和胶原蛋白的混合提取液;
(3)浓缩:混合提取液6000r/min离心20min,得滤液,滤液经旋转蒸发浓缩得浓缩液;
(4)胶原蛋白的分离:浓缩液置于50c静置过夜后,过滤分离,得到沉淀a和清液b;沉淀a用去离子水洗涤至无氯离子后在冻干机中冷冻干燥得白色物c17.1g;清液b用1mol/l的氢氧化钠调节ph值为6.0后,同样是在50c低温静置过夜后,通过定量滤纸过滤及去离子水洗涤,得到白色沉淀d和澄清溶液e,白色沉淀d被冷冻成白色粉末状d12.5g;白色物c、白色粉末状d的红外与标准牛血清蛋白红外图完全一致,且不溶于水,易溶于盐酸,证明两种物为胶原蛋白;
(5)鸟嘌呤的分离:通过定量滤纸过滤白色沉淀d后所得的澄清溶液e用0.05mol/l氢氧化钠调节ph值为7.5后,浓缩,在100c低温静置过夜至有清液和沉淀,过滤分离得沉淀f和滤液g,沉淀f经水洗涤,冷冻干燥后为无色物f0.42g;无色物f的红外与标准鸟嘌呤基本一致,不溶于水,证明为不纯的鸟嘌呤;
(6)胶原蛋白肽的分离:过滤分离得沉淀f后的滤液g,旋转蒸发至无水蒸出,再在低温冰箱中结冰后在冷冻干燥机中冻干得白色粉末g10.5g;白色粉末g极易溶于水,也极易溶于酸,红外图和标准牛血清胶原蛋白一致,标明为含有盐的水溶性胶原蛋白肽。
综上,根据本发明的技术解决方案和所给出的具体实施例及相关的检测数据证实,本发明达到预期的发明目的。
- 还没有人留言评论。精彩留言会获得点赞!