NKT细胞培养基、培养方法及二者的应用与流程
本发明涉及细胞培养
技术领域:
,尤其是涉及一种nkt细胞培养基、培养方法及二者的应用。
背景技术:
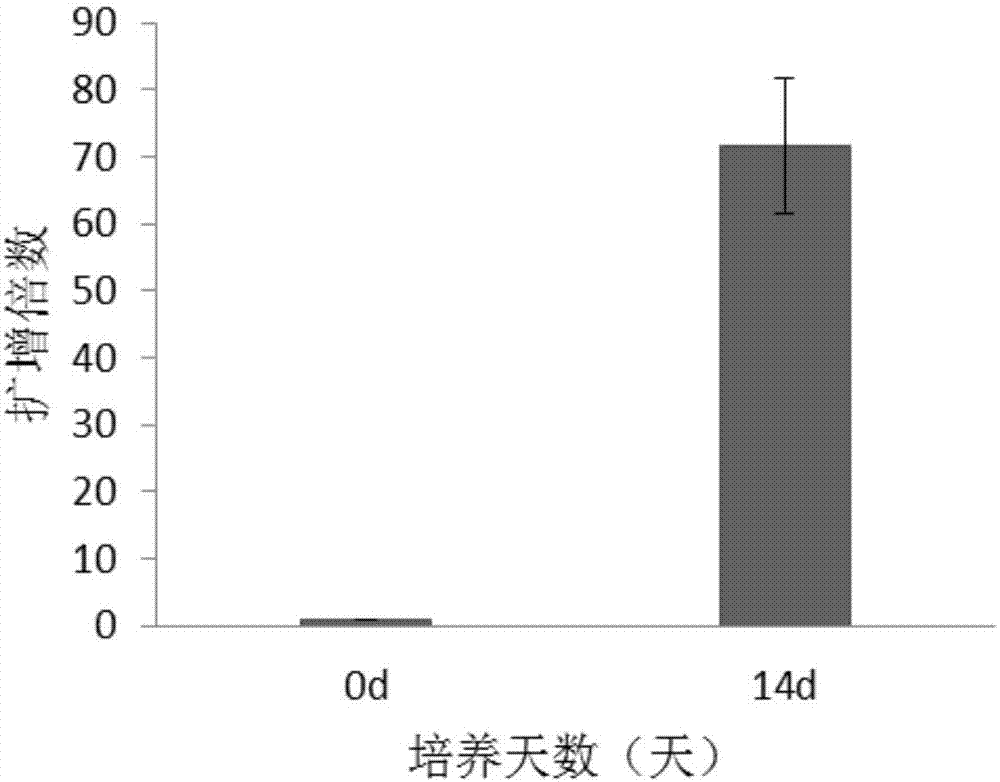
:自然杀伤性t细胞(naturekillertcells,nkt细胞)是一群细胞表面既有t细胞受体(tcr)又有nk细胞受体的淋巴细胞亚群。nkt细胞的分布与nk细胞分布相似,也具有组织特异性,在各组织,如肝脏、骨骼、脾脏、淋巴结、外周血、肺脏和胸腺中所占比例各不相同。nkt细胞表面的tcr可以识别由胸腺细胞表面的cd1d分子(非经典mhcⅰ类分子)所提呈的糖脂类抗原,并能够分泌大量细胞因子,参与机体的先天性免疫和适应性免疫。nkt细胞在抗病毒免疫、肿瘤免疫,以及自身免疫疾病中发挥着重要作用。体外实验及肿瘤动物模型的研究显示,cd3+cd56+nkt细胞可通过发挥细胞毒效应杀伤肿瘤细胞,尤其是在血液性肿瘤中,如非霍奇金氏淋巴瘤、白血病等。cd3+cd56+nkt细胞具有高增殖能力,高细胞杀伤毒性,广泛的肿瘤杀伤作用,对正常骨髓造血影响小的特点,因此,cd3+cd56+nkt细胞治疗被认为是新一代过继免疫治疗的有效方法。目前现有nkt细胞的培养方法主要是使用含有胎牛血清及多种细胞因子混合的培养基扩增培养,或者采用肿瘤细胞与多种细胞因子刺激外周血单个核细胞活化增殖为nkt细胞的方法。现有培养工艺中会添加动物源血清,可能会引入外源性病毒和支原体,存在一定的安全隐患;培养方法使用的肿瘤细胞也会存在一定的安全性问题;且现有方法培养的nkt细胞扩增数量不足,nkt细胞比例低,不能够满足临床治疗的需求。有鉴于此,特提出本发明。技术实现要素:本发明的第一个目的在于提供一组细胞培养基,本发明的第二个目的在于提供一种细胞培养方法,本发明的第三个目的在于提供上述细胞培养基或细胞培养方法在培养nkt细胞中的应用,以缓解现有技术中存在的nkt细胞扩增数量不足,nkt细胞比例低,纯度不高、技术操作复杂、生产成本高的技术问题。本发明提供了一组细胞培养基,所述细胞培养基包括:第一培养基、第二培养基和第三培养基;所述第一培养基包括第一基础培养基和第一细胞因子;所述第二培养基包括第二基础培养基和第一细胞因子;所述第三培养基包括第二基础培养基和第二细胞因子;其中,所述第一基础培养基和第二基础培养基为无血清培养基;所述第一基础培养基包括x-vivo15;所述第二基础培养基包括aim-v;所述第一细胞因子为白细胞介素-2、白细胞介素-12、白细胞介素-15和白细胞介素-21;所述第二细胞因子为白细胞介素-2和白细胞介素-15。进一步地,在所述第一培养基或第二培养基中,所述白细胞介素-2、白细胞介素-12、白细胞介素-15和白细胞介素-21的终浓度依次为500-1500iu/ml、2-8ng/ml、10-30ng/ml和5-15ng/ml。进一步地,在所述第三培养基中,所述白细胞介素-2和白细胞介素-15的终浓度依次为500-1500iu/ml和10-30ng/ml。进一步地,所述第一培养基和第二培养基还包括自体血浆。本发明还提供了一种细胞培养方法,应用上述的细胞培养基进行培养。进一步地,所述细胞培养方法包括:使用第一培养基进行培养,在第一培养阶段每隔一个补液周期补充第二培养基;在第二培养阶段每隔一个补液周期补充第三培养基;进一步地,所述第一培养阶段为接种后0-7天,所述第二培养阶段为接种后8-20天。进一步地,所述补液周期为2-4天。进一步地,所述细胞为外周血单个核细胞。另外,本发明还提供了上述的细胞培养基或上述的细胞培养方法在培养nkt细胞中的应用。本发明提供的一组细胞培养基,包括第一培养基、第二培养基和第三培养基,每种培养基包括无血清基础培养基和细胞因子。其中,利用无血清基础培养基可以避免引入外源性物质,降低污染风险,同时,多种细胞因子能够使nkt细胞受到信号刺激,活化nkt细胞,促进其大量扩增。本发明提供的细胞培养方法,简单高效、成本低、短周期内可大量扩增高纯度的nkt细胞,对于临床治疗至关重要。附图说明图1为本发明实施例1提供的nkt细胞培养的流程图;图2为本发明实施例2提供的nkt细胞扩增倍数结果图;图3a为本发明实施例3提供的nkt细胞中cd3+nkg2d+细胞占比的流式结果图;图3b为本发明实施例3提供的nkt细胞中cd3+cd56+细胞占比的流式结果图;图3c为本发明实施例3提供的nkt细胞中cd3+cd16+细胞占比的流式结果图;图3d为本发明实施例3提供的nkt细胞中cd4+cd25+细胞占比的流式结果图;图4为本发明实施例4提供的nkt细胞杀伤效果结果图。具体实施方式下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明提供了一组细胞培养基,包括:第一培养基、第二培养基和第三培养基;第一培养基包括第一基础培养基和第一细胞因子;第二培养基包括第二基础培养基和第一细胞因子;第三培养基包括第二基础培养基和第二细胞因子;其中,第一基础培养基和第二基础培养基为无血清培养基;第一基础培养基包括x-vivo15;第二基础培养基包括aim-v;第一细胞因子为白细胞介素-2(interleukin-2,il-2)、白细胞介素-12(interleukin-12,il-12)、白细胞介素-15和(interleukin-15,il-15)白细胞介素-21(interleukin-21,il-21);第二细胞因子为白细胞介素-2(interleukin-2,il-2)和白细胞介素-15(interleukin-15,il-15)。在本发明中,在第一培养基或第二培养基中,il-2的终浓度例如可以为,但不限于500iu/ml、600iu/ml、700iu/ml、800iu/ml、900iu/ml、1000iu/ml、1100iu/ml、1200iu/ml、1300iu/ml、1400iu/ml或1500iu/ml;il-12的终浓度例如可以为,但不限于2ng/ml、3ng/ml、4ng/ml、5ng/ml、6ng/ml、7ng/ml、或8ng/ml;il-15的终浓度例如可以为,但不限于10ng/ml、15ng/ml、20ng/ml、25ng/ml或30ng/ml;il-21的终浓度例如可以为,但不限于5ng/ml、10ng/ml、或15ng/ml。在一个优选的实施方式中,在第一培养基或第二培养基中,il-2、il-12、il-15和il-21的终浓度依次为1000iu/ml、5ng/ml、20ng/ml和10ng/ml。在本发明中,在第三培养基中,il-2的终浓度例如可以为,但不限于500iu/ml、600iu/ml、700iu/ml、800iu/ml、900iu/ml、1000iu/ml、1100iu/ml、1200iu/ml、1300iu/ml、1400iu/ml或1500iu/ml;il-15的终浓度例如可以为,但不限于10ng/ml、15ng/ml、20ng/ml、25ng/ml或30ng/ml。在一个优选的实施方式中,在第三培养基中,il-2和il-15的终浓度依次为1000iu/ml和20ng/ml。在本发明中,第一培养基和第二培养基还包括自体血浆。其中,第一培养基与第二培养基中,自体血浆的浓度为0-5%,例如可以为,但不限于0,1%,2%,3%,4%或5%。在一个优选的实施方式中,自体血浆的浓度为5%。本发明提供的细胞培养基,利用无血清基础培养基可以避免引入外源性物质,降低污染风险,同时,多种细胞因子能够使nkt细胞受到信号刺激,活化nkt细胞,促进其大量扩增。本发明还提供了一种细胞培养方法,应用上述的细胞培养基进行培养。在本发明中,细胞培养方法包括:使用第一培养基进行培养,在第一培养阶段每隔一个补液周期补充第二培养基;在第二培养阶段每隔一个补液周期补充第三培养基;其中,第一培养阶段为接种后0-7天,第二培养阶段为接种后8-20天。在本发明中,接种的细胞为外周血单个核细胞。在一个优选的实施方式中,接种的细胞为人源外周血单个核细胞。在本发明中,补液周期为2-4天,例如可以为,但不限于2天、3天或4天。在一个优选的实施方式中,补液周期为3天。在本发明中,在第一培养阶段,用第一培养基重悬外周血单个核细胞,并调整细胞浓度至1.0-2.0×106/ml,每隔3天,用第二培养基进行补液,并调整细胞浓度至1.0-2.0×106/ml,至第一培养阶段结束。在第二培养阶段,每隔3天,用第三培养基进行补液,并调整细胞浓度至1.0-2.0×106/ml,至第二培养阶段结束。其中,细胞浓度例如可以为,但不限于1.0×106/ml、1.5×106/ml或2.0×106/ml。在一个优选的实施方式中,细胞浓度为1.5×106/ml。另外,本发明还提供了上述的细胞培养基或上述的细胞培养方法在培养nkt细胞中的应用。本发明提供的细胞培养方法,简单高效、成本低、短周期内可大量扩增高质量高纯度的nkt细胞,对于临床治疗至关重要。为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。实施例1nkt细胞的培养利用本发明提供的细胞培养基及细胞培养方法对nkt细胞进行培养,培养流程如图1所示,包括如下步骤:步骤(a):采集人源外周血,将采集的外周血转移至50ml离心管中,于20℃温度下2000rmp,10min离心收集血浆备用;使用淋巴细胞分离液(corning)分离并收集外周血单个核细胞,收集后的单个核细胞用pbs清洗三次并计数,备用;其中,使用淋巴细胞分离液分离并收集外周血单个核细胞的方法为:1、将吸取血浆后的血液样本按照1:1的比例加入pbs,混匀;2、将稀释后的血液样本缓慢加在淋巴细胞分离液面上,稀释后的血液样本与淋巴细胞分离液的比例为1:1;3、离心,转速2000rpm,时间15min,慢升慢降,离心温度为20℃。4、离心后吸取单个核细胞层细胞。步骤(b):使用无血清第一基础培养基重悬步骤(a)提供的外周血单个核细胞,调整细胞浓度至1.5×106/ml,并接种至细胞培养瓶中;步骤(c):加入5%自体血浆至培养瓶中,添加第一细胞因子:il-2(1000iu/ml),il-12(5ng/ml),il-15(20ng/ml)和il-21(10ng/ml);步骤(d):细胞培养每3天进行补液,使用无血清第二基础培养基调整细胞密度为1.5×106/ml,补加5%自体血浆及第一细胞因子:il-2(1000iu/ml),il-12(5ng/ml),il-15(20ng/ml),il-21(10ng/ml);步骤(e):细胞培养至第7天后,每3天进行补液,使用无血清第二基础培养基调整细胞密度为1.5×106/ml,补加第二细胞因子il-2(1000iu/ml)、il-15(20ng/ml);步骤(f):细胞培养至第14天,收集细胞,pbs清洗3次,进行细胞质量检验,合格后获得大量扩增的活率高、纯度高、细胞毒性强的nkt细胞,用于细胞治疗或者冻存。实施例2细胞扩增倍数分析分别在培养第0天、14天取细胞计数,用台盼蓝染色后计数,计算扩增倍数及细胞活率,计数结果除以初始细胞数即为细胞扩增倍数。结果分析:此方法可检测细胞的扩增情况,结果如表1和图2所示,从结果中可以看出,外周血单个核细胞经14天培养后均可扩增50倍以上,能够满足临床治疗所需数量。表1nkt细胞扩增倍数结果为重复实验数据的统计结果。表1nkt细胞扩增倍数结果培养天数(天)0天14天扩增倍数171.75±10.13实施例3细胞纯度分析在培养第14天时取细胞,pbs清洗3次,洗涤后调整细胞浓度为1.5×105/ml,加入流式抗体(cd3-pe、cd4-fitc、cd16-pecy5、cd25-apc、cd56-fitc、nkg2d-apc荧光标记单抗10μl),4℃避光孵育30min,pbs洗涤1次,pbs重悬后使用流式细胞仪进行细胞表型检测。结果分析:结果如表2和图3a、3b、3c和3d所示,从结果中可以看出,细胞表型为cd3+cd56+、cd3+cd16+、cd3+nkg2d+的细胞比例均大于50%,其中,cd3+nkg2d+细胞占比:92.66%,cd3+cd56+细胞占比:56.29%,cd3+cd16+细胞占比:76.73%,细胞表型为cd4+cd25+的细胞比例均小于5%,为1.88%。表明本发明实施例1提供的nkt细胞纯度高。表2流式结果为重复实验数据的统计结果,图3a、3b、3c和3d为其中一次实验结果图。表2nkt细胞流式结果细胞表型cd3+cd56+cd3+cd16+cd3+nkg2d+cd4+cd25+占比(%)57.28±2.5872.83±4.5189.63±3.001.34±0.48实施例4细胞毒性分析取培养至14天的细胞,用rpmi1640培养基重悬细胞为1×106/ml细胞悬液备用;使用k562细胞作为靶细胞,使用含2%fbs的rpmi1640培养基重悬细胞为1×105/ml细胞悬液备用;均按照效靶比为5:1、10:1、20:1接种细胞至96孔板中,设置效应细胞孔和靶细胞孔,每种培养方法接3个副孔,37℃,5%co2培养24h;使用mtt法测吸光度值,计算杀瘤率,结果如表3和图4所示。从结果中可以看出,本发明实施例1提供的nkt细胞杀伤效果明显。表3nkt细胞杀伤效果为重复实验数据的统计结果。表3nkt细胞杀伤效果效靶比5:110:120:1杀瘤率(%)21.89±6.8541.29±7.9260.16±8.33最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1