一种用于检测寨卡病毒的引物组、试剂盒及检测方法与流程
本发明属于生物检测技术领域,具体涉及一种用于检测寨卡病毒的环介导等温扩增荧光引物组、试剂盒及检测方法。
背景技术:
寨卡病毒(zikavirus,zikv)于1947年首次在乌干达从恒河猴体内被发现,1953年在乌干达和坦桑尼亚的人体中分离到病毒。zikv通过受到感染的伊蚊属蚊虫叮咬传播到人,这主要涉及热带地区的埃及伊蚊。它与传播登革热、基孔肯雅热和黄热病的蚊虫相同。然而,已有两例寨卡病毒通过性传播的病例,在另一例病例中发现精液中存在寨卡病毒。
近年来zikv感染病例和爆发疫情的国家及地区增加明显,2007年首次在太平洋岛国密克罗尼西亚的雅浦岛出现寨卡病毒暴发疫情,2013年和2015年又分别在法属波利尼西亚和巴西发生大型疫情。已有的研究表明寨卡病毒病可能会造成神经和自身免疫系统并发症,在巴西出现的疫情中,当地卫生当局发现在普通民众中寨卡病毒感染和吉兰-巴雷综合征同时有所上升,目前研究人员正在对吉兰-巴雷综合征病例激增与寨卡病毒感染之间潜在的但尚未证实的联系进行研究。另外越来越多的证据表明寨卡病毒与小头症之间存有关联。2015年5月,巴西报告首例寨卡病毒病病例,同年10月,巴西报告新生儿小头畸形明显上升,时空分布与寨卡病毒流行区相吻合。然而,在能够更好地解释婴儿小头症与寨卡病毒之间的关系之前仍需要作出更多调查,目前对其他可能病因还在开展进一步调查。
寨卡病毒属于黄病毒科(flaviviridae)黄病毒属(flavivirus),为单链正义rna病毒,基因组全场约10.8kb。寨卡病毒离子呈球形,直径约40-70nm。分子生物学和生物信息学分析表明,寨卡病毒主要存在非洲型和亚洲型两个亚型,在系统发生树上与同为黄病毒属的登革病毒、日本脑炎病毒及西尼罗病毒相近。寨卡病毒基因组只有一个开放阅读框(openreadingframe,drf),所编码的蛋白前体经宿主蛋白酶和病毒蛋白酶切割成不同功能蛋白,包括3个结果蛋白(c、prm/m、e)和7个非结构蛋白(ns1、ns2a、ns2b、ns3、ns4a、ns4b、ns5)。
目前针对寨卡病毒的实验室诊断方法有病原学方法、血清学方法和针对病毒核酸检测技术。传统的病原学方法主要通过细胞进行病毒分离,耗时、耗力,而且寨卡病毒的病毒血症持续时间短,较难采集到合适的样品。血清学试验,包括elisa、免疫荧光、中和试验等,也被广泛应用于寨卡病毒的实验室检测。但是病毒特异性igm和中和抗体出现较晚,约发病后1周末期才可检出,同时黄病毒间交叉反应常见,难以鉴别。荧光定量虽然重复性好、定量准确,但其所需设备精密,实验操作要求高,限制其大范围的使用。
自2016年2月9日我国确认第一例输入性寨卡病例以来,截止到2016年5月18日已经确诊17例寨卡病毒感染病例,均为输入性病例,入境口岸大多在广东地区。根据广东地区的伊蚊分布、人口密度和出入境流动情况,以及疫区疾病流行趋势分析,推测广东地区地区输入性病例还会有所增加;针对伊蚊分布广泛的地区进行风险评估和预警分析,结果显示寨卡病毒在广东地区发生地方性流行的风险指数较高。因此,建立一种快速、准确、灵敏、操作简单的检测方法对我国的寨卡病毒防控工作具有重要的意义。
技术实现要素:
为了解决现有技术存在的问题,本发明提供了一种能够快速、准确、灵敏、操作简单地检测出是否感染寨卡病毒的环介导等温扩增荧光引物组、试剂盒及检测方法。
本发明的目的是提供一种用于检测寨卡病毒的引物组。
本发明的再一目的是提供一种含有所述引物组的试剂盒以及能够快速、准确、灵敏、操作简单的检测出是否感染寨卡病毒的检测方法。
根据本发明的用于检测寨卡病毒的引物组,包括引物p1、引物p2、引物p3、引物p4、引物p5和引物p6,所述引物p1的序列如seqidno:1所示,所述引物p2的序列如seqidno:2所示,所述引物p3的序列如seqidno:3所示,所述引物p4的序列如seqidno:4所示,所述引物p5的序列如seqidno:5所示,所述引物p6的序列如seqidno:6所示。
其中,seqidno:1的序列为:cagtgtgaagaagaactatcaa;
seqidno:2的序列为:tgtgatgttacctgatag;
seqidno:3的序列为:
tgcgcatatcaggccaacaactgctgttgcagacgcg;
seqidno:4的序列为:
ggttcgccaaggcagatatagattcctgagactacgtcgca;
seqidno:5的序列为:gctgtgagtacttcgatacg;
seqidno:6的序列为:cggtcggtctgataatcat。
本申请的发明人,根据寨卡病毒中核酸的保守序列,设计出一对内引物(引物p1和引物p2)、一对外引物(引物p3和引物p4)和一对环引物(引物p5和引物p6),能够特异性识别靶序列上的8个独立区域,保证了检测反应的高度特异性。对寨卡病毒进行快速定性检测。
根据本发明的含有所述引物组的试剂盒,其中,所述试剂盒中包含所述引物组和反应液,所述反应液包括反应浓缩液和逆转录酶;所述反应浓缩液包括dna聚合酶,缓冲液,dntp,mgso4,甜菜碱和荧光染料。
使用所述试剂盒,能够快速、准确、灵敏地检验出是否感染寨卡病毒。
根据本发明的含有所述引物组的试剂盒,其中,还包括对照物,所述对照物包括阳性对照物和阴性对照物。
根据本发明的含有所述引物组的试剂盒,其中,所述阳性对照物为含目的基因的大肠杆菌质粒dna,所述目的基因的序列如seqidno:7所示;所述阴性对照物为不含目的基因的反应液。
seqidno:7的序列为:
aaggcaaactgtcgtggttctagggagtcaagaaggagcagttcacacggcccttgctggagctctggaggctgagatggatggtgcaaagggaaggctgtcctctggccacttgaaatgtcgcctgaaaatggataaacttagattgaagggcgtgtcatactccttgtgtaccgcagcgttcacattcaccaagatcccggctgaaacactgcacgggacagtcacagtggaggtacagtacgcagggacagatggaccctgcaaggttccagctcagatggcggtggacatgcaaactctgaccccagttgggaggctgataaccgctaaccctgtaatcactgaaagcactgagaactctaagatgatgctgga。
根据本发明的含有所述引物组的试剂盒,其中,所述引物p1和引物p2的浓度为40nm,引物p3和引物p4的浓度为5nm、引物p5和引物p6的浓度为20nm。
根据本发明的含有所述引物组的试剂盒,其中,所述引物组的体积为6ul,所述反应浓缩液的体积为15ul,逆转录酶的体积为1ul。
根据本发明的使用所述引物组的寨卡病毒检测方法,所述检测方法包括以下步骤:
a、提取rna:提取样本中的rna;
b、引物处理:将引物p1、引物p2、引物p3、引物p4、引物p5和引物p6稀释后,混合均匀;
c、环介导等温扩增反应:将样品、引物试剂和反应液混合均匀后,放入等温扩增荧光检测系统,进行环介导等温扩增反应;所述反应液包括反应浓缩液和逆转录酶;所述反应浓缩液包括dna聚合酶,缓冲液,dntp,mgso4,甜菜碱和荧光染料;
d、检测:在环介导等温扩增反应过程中,对cdna的浓度进行分析,得到扩增曲线和溶解曲线;
e、结果判断:根据所获得扩增曲线和溶解曲线判定,若扩增曲线为明显的s型曲线,以及溶解曲线峰型单一且较为尖锐,则判定为阳性结果;扩增曲线没有出现明显s型曲线,则判定为阴性结果;扩增曲线有明显s型曲线,但溶解曲线峰型不单一,则判定为非特异性扩增。
需要说明的是,核酸的等温扩增法属于核酸体外扩增诸多方法中的一类,在核酸扩增过程中温度恒定不变,即不需要环境温度的反复变化即可完成dna的复制和扩增,其技术的核心在于其独特的引物结构和扩增方式以及具有特殊活性的dna聚合酶的使用,本申请中使用的是等温扩增荧光法。
等温扩增荧光法(isothermalamplificationfluorescentidentificationmethod)是核酸等温扩增和荧光技术的结合,其反应过程在恒温条件下进行,通过添加有特殊链置换活性的dna聚合酶和针对目标基因特异性片段设计的特异性引物组使核酸扩增得以在恒温条件下来完成,同时在体系中加入荧光基团即荧光标记物,该荧光标记物能特异性结合到dna双链氢键的小沟部分,且结合到dna双链之后可被激发并发出特殊波长的荧光,该荧光标记物在单独存在的情况下不会被激发且只与dna双链结合,故体系中的荧光强度即代表了体系中dna双链的浓度,最后通过荧光信号累积实时监控整个核酸扩增过程,实现核酸扩增的实时监测,核酸复制扩增反应结束后可对产物做退火溶解曲线分析,溶解曲线可进一步坚定该核酸扩增产物是否是特异性扩增。结合技术的应用,实现了在确保实验结果准确性,该方法是一种高特异性的快速扩增法,非常适合黄龙病的田间快速检测。
因体系中加入了能特异性与dna双链集合的荧光物质,故随着扩增的不断进行和产物的累积,能实时监测整个扩增反应的全过程并做到定性和简单的定量分析。
根据本发明的使用所述引物组的寨卡病毒检测方法,其中,步骤b中,稀释后,所述引物p1和引物p2的浓度为40nm,引物p3和引物p4的浓度为5nm、引物p5和引物p6的浓度为20nm;步骤c中,所述引物组中各引物的体积均为1ul,所述反应浓缩液的体积为15ul,逆转录酶的体积为1ul,样品的体积为3ul;使用定量pcr仪设置65℃、30s/循环,60个循环,循环完成后进行溶解曲线分析或使用恒温荧光pcr仪,设置为65℃,30分钟,进行溶解曲线分析。
为进一步增加检测的准确性,方便实验人员对照使用,根据本发明的使用所述引物组的寨卡病毒检测方法,其中,步骤c中,设置阳性对照组和阴性对照组,当阳性对照组的检测结果是阳性结果,阴性对照组的检测结果时阴性结果时,则说明实验有效,否则实验无效;所述阳性对照物为含目的基因的大肠杆菌质粒dna,所述目的基因的序列如seqidno:7所示;所述阴性对照物为不含目的基因的反应液。
其中,seqidno:7的序列如前所示。
本发明的有益效果为:
1、所述用于检测寨卡病毒的引物组中的6条引物对应目标序列8个特异区域的识别保证了检测反应的高度特异性。
2、所述试剂盒,能够用于多个检测平台上,不仅可以用在等温扩增荧光检测仪和定量pcr仪,也可以用在其他可以提供恒定温度的设备上如金属浴等。
3、所述寨卡病毒检测方法,能够快速、准确、灵敏地检验出是否感染寨卡病毒。
4、所述寨卡病毒检测方法,可以直接使用rna样本作为反应模板,不需要做额外的逆转录实验,并且,使用了环介导等温扩增方法,大大缩减了检测使用时间,实现了寨卡病毒的现场检测。
5、所述寨卡病毒检测方法,降低了对操作人员的专业要求,使得非专业人员可以顺利完成检测工作。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
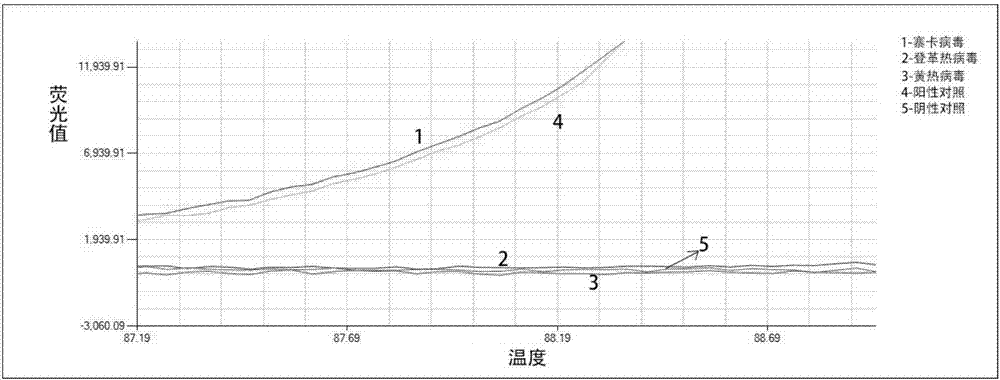
图1是实施例3中验证实验的扩增曲线;
图2是图1中局部a的放大图;
图3是实施例3中验证实验的溶解曲线。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1
用于检测寨卡病毒的引物组,包括引物p1、引物p2、引物p3、引物p4、引物p5和引物p6,所述引物p1的序列如seqidno:1所示,所述引物p2的序列如seqidno:2所示,所述引物p3的序列如seqidno:3所示,所述引物p4的序列如seqidno:4所示,所述引物p5的序列如seqidno:5所示,所述引物p6的序列如seqidno:6所示。
实施例2
含有实施例1所述环介导等温扩增引物组的试剂盒,所述试剂盒还包括反应液和对照组,所述反应液包括dna聚合酶、缓冲液、dntps、mgso4、甜菜碱和荧光染料;所述对照物包括阳性对照物和阴性对照物,所述阳性对照物为含目的基因的大肠杆菌质粒dna,所述目的基因的序列如seqidno:7所示,所述阴性对照物为不含目的基因的反应液。
一般来说,引物试剂的浓度需要使用前配置,为方便使用,所述引物p1和引物p2的浓度为40nm,引物p3和引物p4的浓度为5nm、引物p5和引物p6的浓度为20nm。所述环介导等温扩增引物组的体积为6ul,所述反应液的体积为15ul,所述环介导等温扩增引物组中各引物的体积均为1ul。
本实施例中,反应液直接使用optigene公司的imm。当然本领域技术人员也能够使用其他反应液,在此就不在赘述。
所述试剂盒能够快速、准确、灵敏地检验出是否感染寨卡病毒。
实施例3
使用所述引物组的寨卡病毒检测方法,包括以下步骤:a、提取rna:提取样本中的rna;
b、引物处理:将引物p1、引物p2、引物p3、引物p4、引物p5和引物p6稀释后,混合均匀;稀释后,所述引物p1和引物p2的浓度为40nm,引物p3和引物p4的浓度为5nm、引物p5和引物p6的浓度为20nm;
c、环介导等温扩增反应:将样品、引物试剂和反应液混合均匀后,放入等温扩增荧光检测系统,进行环介导等温扩增反应;所述反应液包括反应浓缩液和逆转录酶;所述反应浓缩液包括dna聚合酶,缓冲液,dntp,mgso4,甜菜碱和荧光染料;所述引物组中各引物的体积均为1ul,所述反应浓缩液的体积为15ul,逆转录酶的体积为1ul,样品的体积为3ul;使用定量pcr仪设置65℃、30s/循环,60个循环,循环完成后进行溶解曲线分析或使用恒温荧光pcr仪,设置为65℃,30分钟,进行溶解曲线分析;
设置阳性对照组和阴性对照组,当阳性对照组的检测结果是阳性结果,阴性对照组的检测结果时阴性结果时,则说明实验有效,否则实验无效;所述阳性对照物为含目的基因的大肠杆菌质粒dna,所述目的基因的序列如seqidno:7所示;所述阴性对照物为不含目的基因的反应液
d、检测:在环介导等温扩增反应过程中,对cdna的浓度进行分析,得到扩增曲线和溶解曲线;
e、结果判断:根据所获得扩增曲线和溶解曲线判定,若扩增曲线为明显的s型曲线,以及溶解曲线峰型单一且较为尖锐,则判定为阳性结果;扩增曲线没有出现明显s型曲线,则判定为阴性结果;扩增曲线有明显s型曲线,但溶解曲线峰型不单一,则判定为非特异性扩增。
本实施例为使用登革热病毒、黄热病毒、寨卡病毒核酸样本为模板,使用寨卡病毒检测引物组,进行检测实验,验证试剂盒及检测方法的特异性。
1.试验材料和方法
1.1试验材料
感染寨卡病毒的血清样本;
1.2感染寨卡病毒的血清样本提取
感染血清样本,使用磁珠法核酸提取试剂盒(genesigeasydna/rnaextractionkit)提取样本核酸,提取的部分核酸使用一步法ran逆转录试剂盒()进行逆转录生成cdna,作为反应模板,使用pcr检测。
1.3环介导等温扩增检测
扩增总体系25ul,包括反应浓缩液15ul、寨卡病毒环介导等温扩增引物混合液6ul、、逆转录酶1ul、反应样本3ul。混匀后放入定量pcr仪(dna-technologydt-prime)或者恒温荧光pcr仪(genieii),程序按照上述设定,通过获得的扩增曲线和溶解曲线判定结果。同时使用定量pcr试剂盒检测。
1.4特异性实验检测
使用登革热病毒、黄热病毒、寨卡病毒核酸样本为模板,使用寨卡病毒检测引物组,进行检测实验,验证试剂盒的特异性。
2试验结果
2.1特异性实验结果
最终获得的扩增曲线(图1)和溶解曲线(图2)。扩增曲线中只用寨卡病毒样品有扩增,其他病毒核酸样品并无扩增,同时扩增产生的溶解曲线峰型单一且尖锐,说明寨卡病毒检测引物组特异性好。能够快速、准确、灵敏地检验出是否感染寨卡病毒。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
sequencelisting
<110>张薇
<120>一种用于检测寨卡病毒的引物组、试剂盒及检测方法
<130>2010
<160>7
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>人工序列
<400>1
cagtgtgaagaagaactatcaa22
<210>2
<211>18
<212>dna
<213>人工序列
<400>2
tgtgatgttacctgatag18
<210>3
<211>37
<212>dna
<213>人工序列
<400>3
tgcgcatatcaggccaacaactgctgttgcagacgcg37
<210>4
<211>41
<212>dna
<213>人工序列
<400>4
ggttcgccaaggcagatatagattcctgagactacgtcgca41
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
gctgtgagtacttcgatacg20
<210>6
<211>19
<212>dna
<213>人工序列
<400>6
cggtcggtctgataatcat19
<210>7
<211>378
<212>dna
<213>flavivirus
<400>7
aaggcaaactgtcgtggttctagggagtcaagaaggagcagttcacacggcccttgctgg60
agctctggaggctgagatggatggtgcaaagggaaggctgtcctctggccacttgaaatg120
tcgcctgaaaatggataaacttagattgaagggcgtgtcatactccttgtgtaccgcagc180
gttcacattcaccaagatcccggctgaaacactgcacgggacagtcacagtggaggtaca240
gtacgcagggacagatggaccctgcaaggttccagctcagatggcggtggacatgcaaac300
tctgaccccagttgggaggctgataaccgctaaccctgtaatcactgaaagcactgagaa360
ctctaagatgatgctgga378
- 还没有人留言评论。精彩留言会获得点赞!