一种可溶性微针贴片及其制备方法与流程
本发明涉及一种可溶性微针贴片及其制备方法。
背景技术:
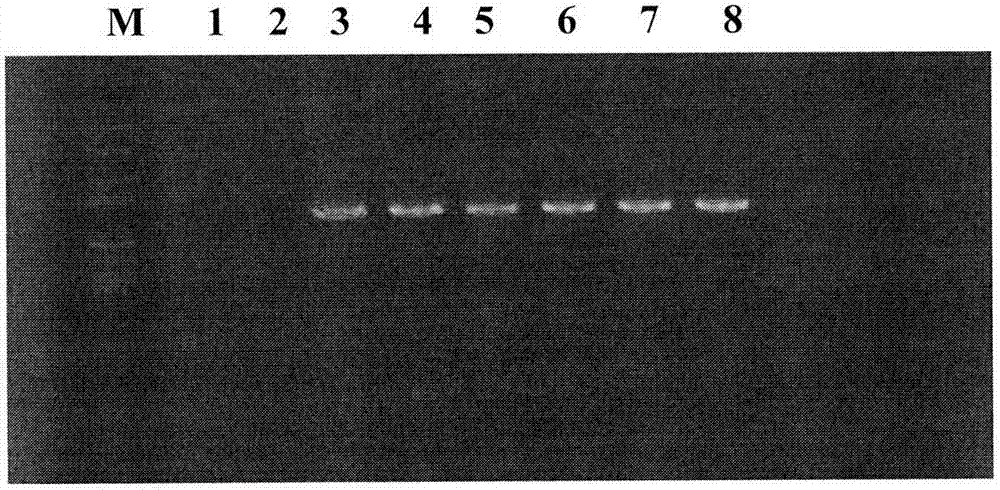
:乙型肝炎由乙型肝炎病毒(hbv)感染引起。hbv属嗜肝dna病毒科,为环状、双股dna病毒,外层是脂蛋白包膜,含乙肝表面抗原(hbsag);内部是核心,含有核酸及乙肝核心抗原。乙肝病毒s基因编码表面抗原(hbsag)。hbsag有重要的生物学意义,是乙肝疫苗的主要成分,是诊断乙肝病毒感染的重要依据。s基因区可分为s区、前s1区和前s2区3段,3段的5′端各有一个起始密码子(aug),但共用一个终止密码子。翻译的产物形成hbsag的主蛋白(226个氨基酸)、中蛋白(281个氨基酸)和大蛋白(409个氨基酸)。s基因区的突变,特别是“α”决定簇氨基酸145位点的变异,会导致hbsag抗原性改变,致使临床上广泛使用的hbsag诊断试剂对其无法检出,造成漏检,由此可能会导致这类病毒携带者成为供血员,给受血者带来严重的后果。目前用于hbsag基因变异的分子检测方法主要有4种:(1)测序法:hbv基因检测的金标准,准确率高,但灵敏度较低,耗费时间长;(2)rflp方法:原理为将待测的dna片段用限制性内切酶酶切,以识别并切割特异的序列,将酶切后的产物进行电泳,根据dna片段的大小来判断目的基因是否会有特异性序列,但标准化程度较低、对混合基因型检测能力较差,检测基因突变时,对于1个碱基以上的突变,需要多个检测系统分别检出;(3)定量pcr方法:灵敏度高,但通量低,难以检测多基因位点变异;(4)反向线性探针杂交法:先将已知探针分别点到硝酸纤维素膜或尼龙膜上,与5’端标记生物素引物的pcr扩增的产物杂交,再经相应的显色反应显出杂交信号。肉眼判读容易误判,检测成本高,难以在国内临床实验室常规开展。技术实现要素:本发明的目的是提供一种可溶性微针贴片及其制备方法。本发明首先提供了成套探针,由探针p1、探针p2、探针p3、探针p4、探针p5、探针p6、探针p7、探针p8和探针p9组成;所述探针p1为如下(a1)或(a2):(a1)序列表的序列1所示的单链dna分子;(a2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的dna分子;所述探针p2为如下(a3)或(a4):(a3)序列表的序列2所示的单链dna分子;(a4)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的dna分子;所述探针p3为如下(a5)或(a6):(a5)序列表的序列3所示的单链dna分子;(a6)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的dna分子;所述探针p4为如下(a7)或(a8):(a7)序列表的序列4所示的单链dna分子;(a8)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的dna分子;所述探针p5为如下(a9)或(a10):(a9)序列表的序列5所示的单链dna分子;(a10)将序列5经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列5具有相同功能的dna分子;所述探针p6为如下(a11)或(a12):(a11)序列表的序列6所示的单链dna分子;(a12)将序列6经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列6具有相同功能的dna分子;所述探针p7为如下(a13)或(a14):(a13)序列表的序列7所示的单链dna分子;(a14)将序列7经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列7具有相同功能的dna分子;所述探针p8为如下(a15)或(a16):(a15)序列表的序列8所示的单链dna分子;(a16)将序列8经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列8具有相同功能的dna分子;所述探针p9为如下(a17)或(a18):(a17)序列表的序列9所示的单链dna分子;(a18)将序列9经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列9具有相同功能的dna分子。所述探针p1、探针p2、探针p3、探针p4、探针p5、探针p6、探针p7、探针p8和探针p9进行nh2修饰。所述nh2修饰可位于所述探针的5’末端或3’末端。在本发明的实施例中,所述nh2修饰位于所述探针的3’末端。所述成套探针还包括质控探针和阴性探针。所述质控探针具体可如序列表的序列12所示。所述阴性探针可为与乙肝病毒无关的植物基因序列,具体可如序列表的序列13所示。所述质控探针5’端进行生物素标记,3’端进行nh2修饰。本发明还保护所述成套探针的应用,为如下(b1)或(b2):(b1)检测待测样本中hbsag位点突变;(b2)制备用于检测待测样本中hbsag位点突变的试剂盒。本发明还保护基因芯片,是将所述成套探针固定在芯片介质上得到的。所述芯片介质具体可为醛基化玻璃片。所述基因芯片的制备方法具体可为:将所述成套探针中的每条探针分别溶解于点样液(3×ssc,0.01%sds)中,使用点样仪将探针点于醛基化玻璃片表面,干燥过夜。每条探针在点样液中的浓度具体可为100μm。本发明还保护所述基因芯片的应用,为如下(c1)或(c2):(c1)检测待测样本中hbsag位点突变;(c2)制备用于检测待测样本中hbsag位点突变的试剂盒。本发明还保护引物芯片组合,由所述基因芯片和引物对组成;所述引物对由引物f和引物r组成;所述引物f为如下(d1)或(d2):(d1)序列表的序列10所示的单链dna分子;(d2)将序列10经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列10具有相同功能的dna分子;所述引物r为如下(d3)或(d4):(d3)序列表的序列11所示的单链dna分子;(d4)将序列11经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列11具有相同功能的dna分子。所述引物r进行生物素标记。所述生物素标记可位于引物r的5’末端或3’末端。在本发明的实施例中,所述生物素标记位于引物r的5’末端。本发明还保护引物探针组合,由所述成套探针和引物对组成;所述引物对由引物f和引物r组成;所述引物f为如下(d1)或(d2):(d1)序列表的序列10所示的单链dna分子;(d2)将序列10经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列10具有相同功能的dna分子;所述引物r为如下(d3)或(d4):(d3)序列表的序列11所示的单链dna分子;(d4)将序列11经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列11具有相同功能的dna分子;所述引物r进行生物素标记。所述生物素标记可位于引物r的5’末端或3’末端。在本发明的实施例中,所述生物素标记位于引物r的5’末端。本发明还保护所述引物芯片组合或所述引物探针组合的应用,为如下(e1)或(e2):(e1)检测待测样本中hbsag位点突变;(e2)制备用于检测待测样本中hbsag位点突变的试剂盒。本发明还保护含有所述成套探针的试剂盒甲,或,含有所述基因芯片的试剂盒乙,或,含有所述引物芯片组合的试剂盒丙,或,含有所述引物探针组合的试剂盒丁;所述试剂盒甲或试剂盒乙或试剂盒丙或试剂盒丁的应用为如下(f1)或(f2):(f1)检测待测样本中hbsag位点突变;(f2)制备用于检测待测样本中hbsag位点突变的试剂盒。本发明还保护一种检测待测样本中hbsag位点突变的方法,包括如下步骤:以离体待测样本的核酸为模板,采用所述引物对进行pcr扩增,得到pcr扩增产物;将所述pcr扩增产物与所述基因芯片进行杂交,根据杂交结果判断待测样本中hbsag位点突变。所述方法中,所述模板可以按照如下步骤制备得到:提取离体待测样本的核酸,以所述核酸作为模板,经过巢式pcr扩增,得到扩增产物(所述模板)。所述巢式pcr分为两轮扩增,第一轮扩增以所述核酸作为模板,采用引物1和引物2进行pcr扩增,第二轮扩增以第一轮得到的pcr扩增产物为模板,采用引物3和引物4进行pcr扩增。所述引物1为序列表的序列15所示的单链dna分子。所述引物2为序列表的序列16所示的单链dna分子。所述引物3为序列表的序列17所示的单链dna分子。所述引物4为序列表的序列18所示的单链dna分子。所述第一轮扩增的反应程序具体可为:94℃预变性3min,94℃变性35s,59℃退火35s,72℃延伸70s,2个循环;94℃变性35s,57℃退火35s,72℃延伸70s,2个循环;94℃变性35s,55℃退火35s,72℃延伸70s,2个循环;94℃变性35s,53℃退火35s,72℃延伸70s,2个循环;94℃变性35s,51℃退火35s,72℃延伸70s,2个循环;94℃变性35s,55℃退火35s,72℃延伸70s,30个循环;72℃延伸7min。所述第二轮扩增的反应程序具体可为94℃预变性3min,94℃变性25s,59℃退火25s,72℃延伸50s,30个循环;72℃延伸7min,68℃延伸5min。所述核酸具体可为病毒dna。所述方法中,可采用生物芯片成像仪扫描所述基因芯片获取杂交结果。所述方法中,在将所述pcr扩增产物与所述成套探针或所述基因芯片进行杂交前,可先将pcr扩增产物98℃热变性5min,然后冰浴放置5min。所述杂交包括如下步骤:(1)将所述pcr产物与所述基因芯片45℃杂交1h;(2)向芯片上加入辣根过氧化物酶标记链霉亲和素,37℃水浴杂交25min。所述杂交具体包括如下步骤:(a)将所述pcr产物与杂交液(2×ssc,1.2%sds,5%甲酰胺)混匀后加至基因芯片的点样区,45℃水浴杂交1小时;(b)完成步骤(a)后,取基因芯片,依次用a液(1×ssc,0.2%sds)、b液(0.2×ssc)、c液(0.1×ssc)各清洗20秒,甩干;(c)完成步骤(b)后,取基因芯片,向点样区中加入标记液(辣根过氧化物酶标记链霉亲和素),37℃水浴杂交25min;(d)完成步骤(c)后,取基因芯片用1×pbst(1×pbs+0.05%tween20)洗涤20s,甩干。以上任一所述hbsag位点具体包括如下4个hbsag位点:(e1)hbsag第118位氨基酸;(e2)hbsag第120位氨基酸;(e3)hbsag第126位氨基酸;(e4)hbsag第145位氨基酸。以上任一所述hbsag位点突变具体为如下4种突变:(f1)hbsag第118位氨基酸由苏氨酸突变为其它氨基酸(具体可为赖氨酸);(f2)hbsag第120位氨基酸由脯氨酸突变为其它氨基酸(具体可为谷氨酰胺);(f3)hbsag第126位氨基酸由苏氨酸突变为其它氨基酸(具体可为异亮氨酸);(f3)hbsag第145位氨基酸由甘氨酸突变为其它氨基酸(具体可为丙氨酸或精氨酸)。使用以上任一所述成套探针或基因芯片或引物探针组合或引物芯片组合进行hbsag位点突变检测时,结果判断方法为:质控探针阳性并且阴性探针阴性表示结果有效,有效结果读取方法如下:探针p1阳性表示hbsag第118位氨基酸为野生型(苏氨酸);探针p2阳性表示hbsag第118位氨基酸为突变型(赖氨酸);探针p3阳性表示hbsag第120位氨基酸为野生型(脯氨酸);探针p4阳性表示hbsag第120位氨基酸为突变型(谷氨酰胺);探针p5阳性表示hbsag第126位氨基酸为野生型(苏氨酸);探针p6阳性表示hbsag第126位氨基酸为突变型(异亮氨酸);探针p7阳性表示hbsag第145位氨基酸为野生型(甘氨酸);探针p8阳性表示hbsag第145位氨基酸为突变型(丙氨酸);探针p9探针阳性表示hbsag第145位氨基酸为突变型(精氨酸)。以上任一所述hbsag的野生型如序列表的序列14所示。以上任一所述待测样本具体可为血清。本发明利用基因芯片的高通量、平行检测特性,对引起hbsag突变的多个基因设计探针,将这些探针结合于同一张芯片上;检测时从待测患者血清样本中提取病毒dna,经体外扩增后,与芯片探针杂交,根据杂交信号判断突变类型。本发明提供的检测方法具有高通量、高特异性、操作简单、结果判断能自动化、容易进行标准化控制的优点,适合于hbsag基因变异的临床检测应用,能够满足体检及献血员筛选的需要。附图说明图1为基因芯片分布图。图2为实施例3中部分患者样本经过步骤2得到的pcr扩增产物电泳图。m:marker,从上到下条带大小依次为:8000bp,5000bp,3000bp,2000bp,1000bp,750bp,500bp,250bp,100bp;1、2:阴性对照(健康人血清pcr产物);3-8:部分患者样本的pcr产物。图3为实施例3中部分患者样本经过步骤6得到的pcr扩增产物电泳图。m:marker,从上到下条带大小依次为:8000bp,5000bp,3000bp,2000bp,1000bp,750bp,500bp,250bp,100bp;1-8:部分样品的pcr产物,9、10:阴性对照(peasy-t1载体质粒dna)。图4为基因芯片对乙型肝炎病人的临床样本检测结果(hbsag118k/145a变异)。图5为基因芯片对乙型肝炎病人的临床样本检测结果(野生型hbsag126t)。图6为基因芯片对乙型肝炎病人的临床样本检测结果(hbsag120q/126i/145r变异)。图7为基因芯片对乙型肝炎病人的临床样本检测结果(野生型hbsag120p,126t,145g)。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例1、基因芯片的制备根据我国乙型肝炎病毒(hbv)序列流行的特点,设计用于检测4个hbsag变异位点的寡核苷酸探针,如表1所示(表1中的探针均在3’末端进行nh2修饰)。hbsag野生型如序列表的序列14所示。4个hbsag变异位点分别为:(1)s118:hbsag第118位氨基酸;(2)s120:hbsag第120位氨基酸;(3)s126:hbsag第126位氨基酸;(4)s145:hbsag第145位氨基酸。表1探针信息探针名称探针序列(5′-3′)碱基数118t19ctaccagcacgggacmatgtttttttttttt(序列1)31118k19ctaccagcaagggacmatgtttttttttttt(序列2)31120p17camgggaccatgcaaaatttttttttttt(序列3)29120q17camgggacaatgcaaaatttttttttttt(序列4)29126t19cctgcacgactcctgctcatttttttttttt(序列5)31126i19cctgcacgattcytgctcatttttttttttt(序列6)31145g19cttcggacggaaactgcactttttttttttt(序列7)31145a19cttcggacgcaaactgcactttttttttttt(序列8)31145r19ccttcggacagaaactgcatttttttttttt(序列9)31分别合成表1的9条探针后,将每条探针分别溶解于点样液(3×ssc,0.01%sds)中,探针在点样液中的浓度为100μm。使用点样仪将探针点于醛基化玻璃片表面,干燥过夜,制备得到基因芯片,所述基因芯片的分布图如图1所示(p为质控探针,n为阴性探针)。质控探针:5’-tttttttttttttttttttt-3’,5’末端进行生物素标记,3’末端进行nh2修饰。阴性探针:5’-caagctgactctagcagatctttc-3’(与乙肝病毒无关的植物基因序列)。使用所述基因芯片进行检测后,质控探针孔阳性并且阴性探针孔阴性表示结果有效。检测结果读取方法如下:118t19探针孔阳性表示hbsag第118位氨基酸为野生型(t),118k19探针孔阳性表示hbsag第118位氨基酸为突变型(k);120p17探针孔阳性表示hbsag第120位氨基酸为野生型(p),120q17探针孔阳性表示hbsag第120位氨基酸为突变型(q);126t19探针孔阳性表示hbsag第126位氨基酸为野生型(t),126i19探针孔阳性表示hbsag第126位氨基酸为突变型(i);145g19探针孔阳性表示hbsag第145位氨基酸为野生型(g),145a19探针孔阳性表示hbsag第145位氨基酸为突变型(a),145r19探针孔阳性表示hbsag第145位氨基酸为突变型(r)。t为苏氨酸,k为赖氨酸,p为脯氨酸,q为谷氨酰胺,i为异亮氨酸,g为甘氨酸,a为丙氨酸,r为精氨酸。实施例2、检测方法的建立1、取待测血清,使用病毒dnaout试剂盒按照说明书方法提取病毒dna。2、以步骤1得到的病毒dna为模板,进行巢式pcr反应,得到pcr扩增产物(约1200bp);具体步骤如下:(1)第一轮pcr,反应体系:模板(病毒dna)5μl,pcr反应液12μl,上下游引物各2.5μl,ddh2o2.5μl,taq酶0.5μl;pcr反应程序:94℃预变性3min,94℃变性35s,59℃退火35s,72℃延伸70s,2个循环;94℃变性35s,57℃退火35s,72℃延伸70s,2个循环;94℃变性35s,55℃退火35s,72℃延伸70s,2个循环;94℃变性35s,53℃退火35s,72℃延伸70s,2个循环;94℃变性35s,51℃退火35s,72℃延伸70s,2个循环;94℃变性35s,55℃退火35s,72℃延伸70s,30个循环;72℃延伸7min。上游引物(序列表的序列15):5’-agtcaggaagacagcctactcc-3’;下游引物(序列表的序列16):5’-aggtgaagcgaagtgcacac-3’。(2)第二轮pcr,反应体系:模板(第一轮pcr产物)5μl,pcr反应液15μl,上下游引物各0.5μl,ddh2o28.5μl,taq酶0.5μl;pcr反应程序:94℃预变性3min,94℃变性25s,59℃退火25s,72℃延伸50s,30个循环;72℃延伸7min,68℃延伸5min。上游引物(序列表的序列17):5’-ttcctgctggtggctccagttc-3’;下游引物(序列表的序列18):5’-ttccgcagtatggatcggcag-3’。3、采用乙醇沉淀法纯化步骤2得到的pcr扩增产物,然后采用taq酶在纯化产物末端加a尾。4、将步骤3处理后的产物连接到peasy-t1载体上,进行菌落pcr进行阳性菌落鉴定(阳性pcr扩增产物约300bp);pcr反应体系:单菌落,pcr反应液12μl,上下游引物各0.25μl,ddh2o12.4μl,taq酶0.1μl;pcr反应程序:94℃预变性3min,94℃变性25s,56℃退火25s,72℃延伸50s,35个循环;72℃延伸10min。上游引物:5’-ttcctgctggtggctccagttc-3’;下游引物:5’-ttccgcagtatggatcggcag-3’。5、取步骤4鉴定的阳性菌落培养并提取质粒dna。6、以步骤5得到的质粒dna为模板,进行pcr扩增,pcr反应体系:模板(质粒dna)5μl,pcr反应液12μl,引物f2200.25μl,引物r5501.25μl,ddh2o6μl,taq酶0.5μl;pcr反应程序:94℃预变性3min,94℃变性30s,50℃退火30s,72℃延伸30s,35个循环后,72℃延伸5min。引物f220(序列10):5’-tggatgtgtctgcggcgtt-3’;引物r550(序列11):5’-cgaaccactgaacaaatggcac-3’。引物r550的5’末端进行生物素标记。7、将步骤6得到的产物98℃热变性5min,然后迅速移至冰浴中,放置5min。8、将5μl步骤7处理的产物和5μl杂交液(2×ssc,1.2%sds,5%甲酰胺)混匀后加至实施例1制备的基因芯片的点样区,置于杂交盒中45℃水浴杂交1小时,然后依次用a液(1×ssc,0.2%sds)、b液(0.2×ssc)、c液(0.1×ssc)各清洗20秒,甩干,再向点样区中加入10μl标记液(辣根过氧化物酶标记链霉亲和素),置于杂交盒中37℃水浴放置25min,取出芯片,用1×pbst(1×pbs+0.05%tween20)洗涤20s,甩干。每个芯片反应区避光加入等体积的显色试剂a液和b液,将芯片放入生物芯片成像仪中扫描,根据扫描结果判断hbsag变异位点情况。实际检测中,也可以省略步骤3-步骤5,直接取步骤2得到的pcr扩增产物,作为模板,按照步骤6、7和步骤8进行操作。实施例3、临床样品检测研究对象:40例慢性乙型肝炎患者,男24例,女16例,符合中华医学会肝病学分会、中华医学会感染病学分会:慢性乙型肝炎防治指南(2015年版)慢性乙型肝炎诊断标准,排除自身免疫性疾病以及其他肝病。取研究对象血清样本,按照实施例2中的方法进行检测。部分样本经过步骤2得到的pcr扩增产物电泳图见图2,扩增产物大小均为1200bp左右,与预期一致;经过步骤的6得到的pcr扩增产物电泳图见图3,扩增产物大小均为300bp左右,与预期一致。使用本发明制备的基因芯片,共检测了经临床诊断确认的慢性乙型肝炎患者40例。芯片检测结果显示,40例患者中t118k/g145a突变3例,t126i/g145r突变2例,p120q/t126i/g145r突变2例,t126i/g145r突变2例,t126i突变26例,t126i/g145a突变1例,g145r突变1例,未突变3例。部分检测结果见图4至图7。图4为1例hbsag118k/145a突变的患者检测结果。图5为1例126t(未突变)患者检测结果。图6为1例p120q/t126i/g145r突变的患者检测结果。图7为1例120p/126t/145g(未突变)患者检测结果。将检测结果与dna测序结果进行比较,结果表明采用基因芯片进行检测,结果与dna测序结果完全一致。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1