用于干细胞的培养基的制作方法
本文所引用的所有文献以整体形式并入作为参考。
本发明在于干细胞培养基及方法领域,特别是用于扩增干细胞群、例如人上皮干细胞群的培养基及方法的领域。
背景技术:
对用于扩增干细胞群的培养基和方法存在很大的关注。干细胞群具有诸多用途。例如,干细胞及其分化后代可用于细胞测试、药物筛选及毒性测试。干细胞还表现出基于细胞的治疗的前景,例如在用于治疗受损组织的再生医疗方面。它们还用作分化细胞的源以用于移植目的,例如移植用于治疗糖尿病的胰腺β细胞等。此外,高效的细胞培养基对于提供和维持用于研究目的的细胞群而言是重要的。
还对用于培养干细胞以形成、维持和扩增类器官、例如肠隐窝绒毛、胃或胰腺类器官的培养基及方法存在关注。类器官包括干细胞,例如上皮干细胞,其保持它们的未分化表型和自我更新性质,但还具有生长成组织样结构的分化后代。类似于相关或相同的细胞的群,隐窝绒毛、胃或胰腺类器官更近地模拟它们的器官组织的基础生理机能,它们可以用于毒性测试、或者用于药物或食品补充剂的测试。它们还可用于培养目前缺少合适的组织培养物或动物模型的病原体。此外,这样的类器官可用于再生医疗,例如用于辐射后和/或术后修复肠上皮、或用于修复经受炎性肠疾病的患者的肠上皮。
明确的是,存在着许多用于干细胞及其支化后代的临床和研究应用。对于所有这些应用,可再现干细胞培养方法对于提供足量的合适品质的细胞而言是极为重要的。例如,对于有效药物筛选,必须小心地控制条件,需要用于控制细胞的分化和增殖的精确培养方法以便可产生纯的表型和染色体组型相同的细胞的群。同样地,对于其中可以向患者直接提供培养的细胞的基于细胞的治疗,细胞必须在遗传和表型上合理以当向患者提供时避免不期望的免疫反应或最终细胞类型。
尽管已经描述了用于培养包括肠上皮干细胞在内的原代上皮干细胞的多种培养系统(bjerknes和cheng,2006.methodsenzymol.419:337-83),但迄今为止,没有确立维持人上皮干细胞的分化潜能及表型和基因组完整性的长期培养系统。
国际专利申请wo2010/090513公开了用于培养上皮肝细胞或分离的组织碎块的方法。使该方法优化以通过向培养基添加wnt-3a来培养人结肠和肠隐窝。这是首次将人肠干细胞培养物培养延长的时段(高达3个月)并且被规定为首个可再现人肠干细胞培养系统。然而,仍亟需改进的干细胞培养基及方法,特别是人干细胞培养基及方法,其改进在培养物中生长的干细胞的增殖速率、存活时间及表型和基因组完整性。
发明简述
本发明提供了改进的用于干细胞、特别是人上皮干细胞以及包括所述干细胞的类器官的培养基及方法,其与已知的培养基及方法相比提供了显著的优势。本发明还提供了相关的培养基补充剂、组合物及用途。
因此,本发明提供了用于扩增干细胞群的培养基,其中所述培养基包括至少一种或多种与一种或多种丝氨酸/苏氨酸蛋白激酶靶标结合并降低其活性的抑制剂。其具有以每周约五倍扩增的扩增速率连续生长至少3个月的作用。丝氨酸/苏氨酸蛋白激酶优选选自:tgfβ受体激酶1、alk4、alk5、alk7、p38。令人惊讶地,发明人已发现在培养基中包括某些丝氨酸/苏氨酸激酶的抑制剂显著改进了培养基在扩增干细胞群方面的性能。干细胞群可以为正常(健康)细胞或病变细胞(例如,癌干细胞)。特别地,p38和alk的抑制剂表现为在所有受试化合物之中提供最大的改进。这是出乎意外的,因为不存在预测这些特定抑制剂如何运行的已知机制。实际上,被选择进行测试并以类似途径发挥作用的小分子抑制剂之中多种小分子抑制剂对所述方法没有作用。因此,技术人员不能预测这些特定激酶的抑制剂会对培养基具有此种显著改进。当向培养基共同添加两种抑制剂、例如p38抑制剂如sb202190和alk抑制剂如a83-01时,仍观察到进一步的改进。
为达成这种认知,发明人研究了已知在某些癌症、例如结肠直肠癌中被破坏的信号转导途径。他们假定这些影响癌症中的最终细胞类型的途径还在决定培养条件中的最终细胞类型方面发挥作用。然而,应强调的是,这种假设完全是新颖的;因为现有技术不能预测这些额外的化合物中任一种对培养基的作用,并且不具体预期这些化合物中任一种实际上可能具有有益作用。
在第一种筛选实验中,与标准干细胞培养基组合地测试了一系列维生素、激素和生长因子。胃泌激素和烟酰胺初步被确定为产生显著改进的培养条件。将这些因子并入标准培养条件,进行第二种筛选实验,其中测试与相关信号转导途径相关的小分子抑制剂,所述相关信号转导途径例如erk、p38、jnk、pten、rock和hedgehog。选择这些途径是因为它们已知在某些癌症中被破坏。
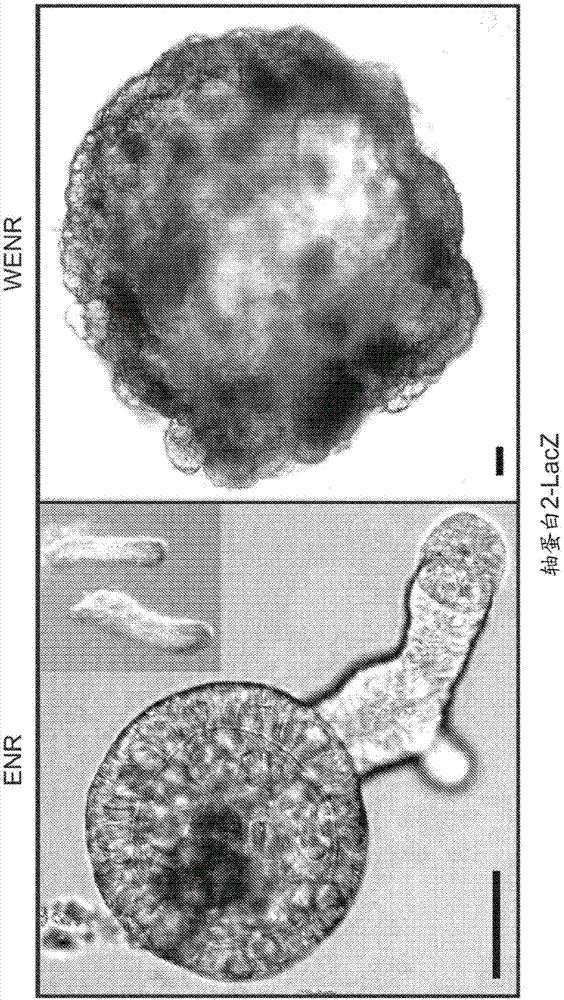
使用由wnt-3a(“w”)优化的前述干细胞培养基(包含上皮生长因子(egf或“e”)、noggin(“n”)和r-spondin(“r”),本文还称为“enr”培养基)(本文称为“wenr”培养基)培养人肠干细胞的先前尝试已使大部分细胞在7天内蜕变,并且非常少的细胞存活超过1个月。这样的尝试已经历了漫长的增殖时间、染色体异常以及从芽殖到囊状结构的形态变化。“囊状”表示类器官几乎为球形的。“芽殖”表示类器官具有从基础结构生长的多个区域。具有芽殖结构并非总是优点,尽管芽殖结构通常具有更大的表面积并且通常更接近地类似于相应的体内结构。
发明人表明改进的方法使干细胞连续生长至少7个月。
新方法还增加了细胞在扩增的群中的增殖速度。这当使细胞生长以用于商业和医疗目的时明显具有大的用途。
新方法还增加了细胞在扩增的群中的品质。这是非常有利的,因为干细胞及其分化后代的临床和研究应用需要提供高品质的细胞群的可再现干细胞培养方法。通常,干细胞的体外扩增旨在提供尽可能接近地类似于其体内相对物的细胞群。这种性质本文称为细胞的“基因组和表型完整性”。
发明人首次发现可以在不损失基因组和表型完整性的情况下于培养物中扩增人上皮干细胞至少7个月(参见实施例1)。在本发明的改进的培养条件下,人肠类器官呈现芽殖类器官结构,而非在先前培养条件下所见的囊状结构。在从三个不同供体采集的20个细胞的每一个细胞中,大于3月龄的类器官的中期分裂相一致地显示出46个染色体。此外,微阵列分析显示培养物中的干细胞具有与包括肠干细胞基因的肠隐窝细胞类似的分子标签。
发明人还例示了由本发明的培养基和方法产生的人肠类器官模拟了对外部因子反应的体内最终细胞类型决定。例如,先前已经表明,肠干细胞中的notch抑制终止了肠上皮增殖并体内诱导杯形细胞增生。发明人还能表明,本发明的肠类器官当用notch抑制剂处理时中断增殖并且大部分细胞在3天内转化成杯形细胞。
当在培养基中包括tgf-β抑制剂和/或p38抑制剂以扩增来自其他上皮组织、例如胃、胰腺、肝脏和前列腺的干细胞或类器官时,观察到类似的优势(参见实施例)。组织可以为正常(健康)组织或病变组织,例如癌组织或表现出囊性纤维化表型的组织。
这些结果表明与先前的方法和培养基相比,由本发明的方法和培养基所产生的对干细胞和类器官的基因组和表型完整性的显著改进。
因此,本发明提供了用于扩增和/或分化成体干细胞群的培养基,其中所述培养基包括:
i.rspondin1-4之一和/或rspondin模拟物;以及
ii.一种或多种直接或间接负调节tgf-β信号转导的抑制剂。
本发明还提供了包含本发明培养基以及细胞外基质或3d基质的组合物,所述3d基质通过其与细胞膜蛋白如整合素的相互作用而模拟细胞外基质,例如含层粘连蛋白的细胞外基质,诸如matrigeltm(bdbiosciences)。
本发明还提供了包含本发明培养基或组合物的气密容器。
本发明还提供了本发明培养基用于扩增和/或分化干细胞、干细胞群、组织碎块或类器官的用途。
本发明还提供了用于扩增单干细胞、干细胞群或组织碎块优选产生类器官的方法,其中所述方法包括在本发明的培养基中培养单干细胞或干细胞群。
本发明还提供了由本发明方法获得的类器官或细胞群。
本发明还提供了类器官,优选通过本发明方法获得的类器官,其为包括围绕中央腔的上皮细胞的三维类器官,其中任选地,上皮细胞存在于不同的分裂域和分化域中。
本发明还提供了类器官,优选通过本发明方法而获得的类器官,其为包括布置在单层、任选折叠单层的区域以及分层细胞的区域中的上皮细胞的三维类器官,并且优选地,其为包括围绕中央腔的上皮细胞的三维类器官,其中任选地,上皮细胞存在于不同的分裂域和分化域中。
本发明还提供了组合物,其包括:
i)一种或多种本发明的类器官或细胞群;以及
ii)本发明的培养基和/或细胞外基质。
本发明还提供了用于药物筛选、靶标确认、靶标发现、毒理、毒理筛选、个体化医疗、可再生医疗或离体细胞/器官模型,例如用作疾病模型的本发明的类器官、细胞群或组合物。
本发明还提供了用于将本发明的类器官、细胞群或组合物移植入哺乳动物、优选移植入人类的类器官、细胞群或组合物。
本发明还提供了使用本发明培养基已获得或可获得的干细胞群或包含所述干细胞的类器官。干细胞或包含所述干细胞的类器官可以用于例如移植目的或其他治疗应用。例如,干细胞或包含干细胞的类器官可以用于药物筛选、靶标确认、靶标发现、毒理和毒理筛选、个体化医疗、可再生医疗和立体细胞/器官模型,例如疾病模型。
本发明还提供了包含本发明培养基的组合物。
本发明还提供了包含本发明抑制剂的培养基补充剂。
本发明还提供了包含本发明的培养基和/或培养基补充剂的气密容器。
可以根据特别需求和应用来改变本发明的培养基、补充剂和组合物的具体成分。同样地,可以根据特别需求和应用来改变本发明的方法的精确步骤。
还可以通过常规实验来优化本发明的培养基、补充剂、方法、组合物和用途。例如,如果培养基、补充剂或组合物不能给出所需水平的干细胞扩增,则可以在进一步的实验中改变变量,例如培养基或补充剂中每一成分的量、接种密度、培养条件、培养期等。可以通过常规优化以与其他成分无关的方式优化本文所述成分的每一成分的量,或者可以添加或移除一种或多种成分。可以通过将培养基与已知培养基或方法一起测试或通过将培养基替代已知培养基或方法进行测量,从而测试培养基支持干细胞扩增的能力。
以下更详细地描述本发明的培养基、补充剂、方法、组合物及用途。除非另外指出,则本发明的实践将采用常规细胞培养技术、分子生物学以及微生物学,其在本领域技术人员范围之内。
对哺乳类细胞培养基和方法提供指导的诸多教材是可得的,包括用于培养干细胞的培养基和方法的专用教材。这样的教材包括j.pollard和j.m.walker的‘basiccellcultureprotocols’(1997)、a.doyle和j.b.griffiths的‘mammaliancellculture:essentialtechniques’(1997)、r.i.freshney的‘cultureofanimalcells:amanualofbasictechnique’(2005)、c.helgason和c.l.miller的‘basiccellcultureprotocols’(2005)、a.bongso的‘stemcells:frombenchtobedside’(2005)、j.f.loring,r.l.wesselschmidt和p.h.schwartz的‘humanstemcellmanual:alaboratoryguide’(2007)。
用于本发明的干细胞和细胞培养试剂及设备是可商购的,例如,来自cellartisab(
在非限制性的多个方面,本申请提供了以下示例性实施方案:
实施方案1.用于扩增和/或分化成体干细胞群的培养基,其中所述培养基包括:
i.rspondin1-4和/或rspondin模拟物之一;以及
ii.一种或多种直接或间接负调节tgf-β信号转导的抑制剂。
实施方案2.如实施方案1所述的培养基,其中所述一种或多种抑制剂结合选自以下的一种或多种丝氨酸/苏氨酸蛋白激酶并降低其活性:alk5、alk4、tgf-β激酶抑制剂1以及alk7。
实施方案3.如实施方案1或2所述的培养基,其中所述一种或多种直接或间接负调节tgf-β信号转导的抑制剂选自a83-01、sb-431542、sb-505124、sb-525334、sd-208、ly-36494以及sjn-2511。
实施方案4.如前述实施方案中任一实施方案所述的培养基,其中所述培养基还包括直接或间接负调节p38信号转导的抑制剂。
实施方案5.如实施方案4所述的培养基,其中所述一种或多种直接或间接负调节p38信号转导的抑制剂选自sb-202190、sb-203580、vx-702、vx-745、pd-169316、ro-4402257以及birb-796。
实施方案6.如前述实施方案中任一实施方案所述的培养基,其中所述培养基包括a83-01和sb-202190,或者a83-01和sb-20358。
实施方案7.如前述实施方案中任一实施方案所述的培养基,其中以1nm至100μm、10nm至100μm、100nm至10μm、或约1μm的浓度添加所述抑制剂,例如,其中所述一种或多种抑制剂的总浓度为10nm至100μm、100nm至10μm、或约1μm。
实施方案8.如前述实施方案中任一实施方案所述的培养基,其中所述培养基还包括一种或多种选自以下的组分:bmp抑制剂、wnt激动剂、受体酪氨酸激酶配体、rock抑制剂、烟酰胺以及胃泌激素。
实施方案9.如前述实施方案中任一实施方案所述的培养基,其中所述培养基包括rspondin1-4和/或rspondin模拟物中任一种、bmp抑制剂(例如noggin)、tgf-β抑制剂、受体酪氨酸激酶配体(例如egf)、烟酰胺、wnt激动剂(例如wnt(3a)),并且任选地还包括一种或多种选自以下的组分:p38抑制剂、胃泌激素、fgf10、hgf和rock抑制剂。
实施方案10.如实施方案8或9所述的培养基,其中所述bmp抑制剂选自noggin、脊索蛋白、包括脊索蛋白域的脊索蛋白样蛋白、卵泡抑素、包括卵泡抑素域的卵泡抑素相关蛋白、dan、包括dan半胱氨酸结域的dan样蛋白、硬化蛋白/sost以及α-2巨球蛋白。
实施方案11.如实施方案8或9所述的培养基,其中所述wnt激动剂选自wnt-3a、gsk-抑制剂(例如chir99021)、wnt5、wnt-6a、norrin和任何其他wnt家族蛋白。
实施方案12.如实施方案8或9所述的培养基,其中所述受体酪氨酸激酶配体为促有丝分裂生长因子,例如选自生长因子家族,其由上皮生长因子(egf)、转化生长因子-α(tgf-α)、碱性成纤维细胞生长因子(bfgf)、脑源性神经营养因子(bdnf)、肝细胞生长因子(hgf)以及角质形成细胞生长因子(kgf)组成。
实施方案13.如实施方案8或9所述的培养基,其中所述rock抑制剂选自r-(+)-反式-4-(l-氨基乙基)-n-(4-吡啶基)环己甲酰胺二盐酸盐单水合物(y-27632)、5-(l,4-二氮杂环庚烷-1-基磺酰基)异喹啉(法舒地尔或ha1077)以及(s)-(+)-2-甲基-l-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂环庚烷二盐酸盐(h-1152)。
实施方案14.如前述实施方案中任一实施方案所述的培养基,其中所述培养基还包括前列腺素信号转导途径活化剂,例如pge2和/或aa。
实施方案15.如前述实施方案中任一实施方案所述的培养基,其中所述培养基还包括睾酮,例如(二氢)睾酮。
实施方案16.如实施方案1至15中任一实施方案所述的培养基,其用于培养肠细胞,所述培养基包括以下或由以下组成:基础培养基、wnt-3a、egf、noggin、rspondin1-4中任一种、tgf-β抑制剂、烟酰胺,以及优选的p38抑制剂。
实施方案17.如实施方案1至15中任一实施方案所述的培养基,其用于培养胃细胞,所述培养基包括以下或由以下组成:基础培养基、wnt-3a、egf、noggin、rspondin1-4任一种、tgf-β抑制剂、胃泌激素、烟酰胺、fgf-10,以及优选的p38抑制剂。
实施方案18.如实施方案1至15中任一实施方案所述的培养基,其用于扩增肝脏细胞,所述培养基包括以下或由以下组成:基础培养基、rspondin1-4任一种、noggin、烟酰胺、egf、fgf10、hgf、胃泌激素、tgf-β抑制剂和pge2,以及优选的wnt-3a。
实施方案19.如实施方案1至15中任一实施方案所述的培养基,其用于扩增胰腺细胞,所述培养基包括以下或由以下组成:基础培养基、rspondin1-4任一种、noggin、egf、fgf10、胃泌激素、tgf-β抑制剂,以及优选的exendin4和wnt-3a。
实施方案20.如实施方案1至15中任一实施方案所述的培养基,其用于培养前列腺细胞,所述培养基包括以下或由以下组成:基础培养基、egf、rspondin1-4任一种、noggin、烟酰胺、tgf-β抑制剂,以及优选的wnt-3a和fgf-10。
实施方案21.如实施方案20所述的用于培养前列腺细胞的培养基,其中所述培养基还包括睾酮,例如(二氢)睾酮。
实施方案22.如前述实施方案中任一实施方案所述的培养基,其用于培养癌细胞、例如癌干细胞、诸如来自目标组织类型的腺癌或癌细胞,其中所述培养基包括用于培养来自相对应的无癌目标组织类型的细胞的培养基的组分或由所述组分组成,任选地,其中用于培养所述目标组织类型的无癌细胞的培养基不包括以下的一种或多种:wnt-3a、egf、noggin、rspondin、tgf-β抑制剂、p38抑制剂、烟酰胺、胃泌激素、fgf10以及hgf。
实施方案23.如前述实施方案中任一实施方案所述的培养基,其用于从目标组织分化干细胞,其中所述培养基包括用于扩增来自所述目标组织类型的干细胞的培养基的组分或由所述组分组成,但是其中所述用于分化干细胞的培养基不包括以下的一种或多种:wnt、rspondin、bmp抑制剂、tgf-β抑制剂、受体酪氨酸激酶配体、p38抑制剂和烟酰胺。
实施方案24.如实施方案23所述的培养基,其用于分化肠细胞,所述培养基包括以下或由以下组成:基础培养基、egf、noggin、tgf-β抑制剂和p38抑制剂。
实施方案25.如实施方案23所述的培养基,其用于分化肝细胞,所述培养基包括以下或由以下组成:基础培养基、noggin、egf、胃泌激素、tgf-β抑制剂、γ-分泌酶抑制剂如dapt或dbz,以及优选的wnt-3a。
实施方案26.如实施方案23所述的培养基,其用于分化胰腺细胞,所述包括以下或由其组成:基础培养基、noggin、egf、fgf10、胃泌激素、tgf-β抑制剂、γ-分泌酶抑制剂,以及优选的exendin4。
实施方案27.如前述实施方案中任一实施方案所述的培养基,其中所述培养基与细胞外基质或3d基质接触,所述3d基质通过其与细胞膜蛋白如整合素相互作用而模拟细胞外基质。
实施方案28.如实施方案27所述的培养基,其中所述细胞外基质为含层粘连蛋白的细胞外基质,例如matrigeltm(bdbiosciences)。
实施方案29.组合物,其包含实施方案1至26中任一实施方案所述的培养基以及细胞外基质或3d基质,所述3d基质通过其与细胞膜蛋白如整合素的相互作用而模拟细胞外基质,所述细胞外基质例如含层粘连蛋白的细胞外基质,诸如matrigeltm(bdbiosciences)。
实施方案30.气密容器,其包括前述实施方案中任一实施方案所述的培养基或组合物。
实施方案31.实施方案1至28中任一实施方案所述的培养基用于扩增和/或分化干细胞、干细胞群、组织碎块或类器官的用途。
实施方案32.如实施方案31所述的用途,其中所述干细胞、干细胞群、组织碎块或类器官选自一种或多种肠干细胞、小肠隐窝、结肠隐窝、胃干细胞、肝脏干细胞、胰腺干细胞和前列腺干细胞。
实施方案33.如实施方案31或32所述的用途,其中从正常组织获得所述干细胞、干细胞群、组织碎块或类器官。
实施方案34.如实施方案31或32所述的用途,其中从病变组织、例如从腺瘤、癌、腺癌、患有囊性纤维化的患者的肠、或患有炎性肠疾病的患者的肠获得所述干细胞、干细胞群、组织碎块或类器官。
实施方案35.用于扩增单干细胞、干细胞群或组织碎块的方法,优选获得类器官,其中所述方法包括在实施方案1至28中任一实施方案所述的培养基中培养单干细胞或干细胞群。
实施方案36.如实施方案35所述的方法,其中所述方法包括:
提供干细胞、干细胞群或分离的组织碎块;
提供实施方案1至28中任一实施方案所述的培养基;
使所述干细胞与所述培养基接触;
在合适的条件下培养所述细胞。
实施方案37.如实施方案35所述的方法,其中所述方法包括使所述干细胞、干细胞群或分离的组织碎块以及培养基与细胞外基质或3d基质接触,所述3d基质通过其与细胞膜蛋白如整合素相互作用而模拟细胞外基质,所述细胞外基质例如含层粘连蛋白的细胞外基质,诸如matrigeltm(bdbiosciences)。
实施方案38.如实施方案37所述的方法,其中所述培养基扩散入所述细胞外基质。
实施方案39.如实施方案35至38中任一实施方案所述的方法,其中所述方法包括:
在第一扩增培养基中培养干细胞、干细胞群或组织片段;
继续培养所述干细胞、干细胞群或组织片段并且用分化培养基补充所述培养基,其中所述分化培养基不包括选自以下的一种或多种因子、优选不包括所有选自以下的因子:tgf-β抑制剂、p38抑制剂、烟酰胺和wnt。
实施方案40.如实施方案35至38中任一实施方案所述的方法,其用于获得小肠或结肠类器官,所述方法包括:
在实施方案17所述的培养基中扩增小肠或结肠干细胞或组织碎块;以及任选地
在实施方案24所述的培养基中分化所述扩增的小肠或结肠干细胞或组织碎块。
实施方案41.如实施方案35至39中任一实施方案所述的方法,其用于获得胃类器官,所述方法包括在实施方案16所述的培养基中培养胃干细胞或组织碎块。
实施方案42.如实施方案35至39中任一实施方案所述的方法,其用于获得肝脏类器官,所述方法包括:
在实施方案19所述的培养基中扩增肝脏细胞或组织碎块;以及任选地
在实施方案25所述的培养基中分化所述扩增的肝脏细胞或组织碎块。
实施方案43.如实施方案35至39中任一实施方案所述的方法,其用于获得胰腺类器官,所述方法包括:
在实施方案20所述的培养基中扩增胰腺细胞或组织碎块;以及任选地
在实施方案26所述的培养基中分化所述扩增的胰腺细胞或组织碎块。
实施方案44.如实施方案35至39中任一实施方案所述的方法,其用于获得前列腺类器官,所述方法包括在实施方案19所述的培养基中培养前列腺干细胞或组织碎块。
实施方案45.如实施方案35至39中任一实施方案所述的方法,其用于获得腺癌或癌类器官,所述方法包括在实施方案22所述的培养基中培养腺癌或癌干细胞或组织碎块。
实施方案46.如实施方案35至39中任一实施方案所述的方法,其中在最初1、2、3、4、5、6或7天内向所述培养基添加rock抑制剂,任选地每隔一天添加。
实施方案47.如实施方案35至39中任一实施方案所述的方法,其包括使用实施方案1至28中任一实施方案所述的培养基来培养所述干细胞3个月或更久,例如4、5、6、7、8、9个月或更久。
实施方案48.通过实施方案35至47中任一实施方案所述的方法而获得的类器官或细胞群。
实施方案49.如实施方案48所述的类器官或细胞群,其当在实施方案1至28中任一实施方案所述的培养基中培养时,可以在培养物中存在至少3个月,例如至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久。
实施方案50.如实施方案48所述的类器官或细胞群,其中所述类器官或细胞群被培养至少3个月,例如至少4个月、至少5个月、至少6个月、至少7个月、至少9个月、或至少12个月或更久。
实施方案51.如实施方案48至50中任一实施方案所述的类器官或细胞群,其中所述类器官或细胞群以每周至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍或至少10倍的速率扩增。
实施方案52.如实施方案48至51中任一实施方案所述的类器官或细胞群,其中所述类器官或细胞群为人类器官或人细胞群。
实施方案53.如实施方案48至52中任一实施方案所述的类器官或细胞群,其中所述类器官或细胞群为正常类器官或细胞群或者病变类器官或细胞群,例如通过培养从患有疾病的人或动物采集的干细胞而获得的类器官或细胞群。
实施方案54.如实施方案48至53中任一实施方案所述的类器官或细胞群,其在-5℃以下、-10℃以下、-20℃以下、-40℃以下、-60℃以下、或-80℃以下、-100℃以下、或-150℃以下,例如约-180℃被冷冻并贮存。
实施方案55.类器官,优选实施方案48至54中任一实施方案所述的类器官,其为包括围绕中央腔的上皮细胞的三维类器官,其中任选地,所述上皮细胞存在于不同的分裂域和分化域中。
实施方案56.如实施方案55所述的类器官,其为包括在单层区域、任选折叠的单层的区域和分层细胞区域中布置的上皮细胞的三维类器官。
实施方案57.如实施方案48至56中任一实施方案所述的类器官,其中所述类器官不存在非上皮细胞。
实施方案58.如实施方案48至57中任一实施方案所述的类器官,其中所述类器官存在正常体内组织的所有分化细胞类型。
实施方案59.如实施方案48至58中任一实施方案所述的类器官,其中所述类器官为小肠类器官、结肠类器官、胃类器官、胰腺类器官、肝脏类器官或前列腺类器官。
实施方案60.组合物,其包含:
i)一种或多种实施方案48至59中任一实施方案所述的类器官或细胞群;以及
ii)实施方案1至28中任一实施方案所述的培养基和/或细胞外基质。
实施方案61.如实施方案48至59中任一实施方案所述的类器官或实施方案48至54中任一实施方案所述的细胞群或实施方案29或60所述的组合物,其用于药物筛选、靶标确认、靶标发现、毒理、毒理筛选、个性化医疗、再生医疗或离体细胞/类器官模型,例如用作疾病模型。
实施方案62.如实施方案61所述的类器官、细胞群或组合物,其中所述再生医疗或个性化医疗包括将所述类器官、细胞群或组合物植入哺乳动物,优选植入人。
发明详述
根据本发明,提供了用于扩增干细胞群的培养基,其中所述培养基包括至少一种或多种与一种或多种丝氨酸/苏氨酸蛋白激酶靶标结合并降低其活性的抑制剂,其中所述培养基具有使干细胞群连续生长至少3个月、优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久的作用。
抑制剂
本发明第一方面所用的培养基包括任何直接或间接负调节tgf-β或p38信号转导的抑制剂。在优选实施方案中,本发明的培养基包括直接或间接负调节tgf-β信号转导的抑制剂。在一些实施方案中,本发明的培养基包括直接或间接负调节tgf-β的抑制剂和直接或间接负调节p38信号转导的抑制剂。在其他实施方案中,本发明的培养基还包括rspondin或rspondin模拟物。
一种或多种抑制剂优选靶向丝氨酸/苏氨酸蛋白激酶,其选自:tgf-β受体激酶1、alk4、alk5、alk7、p38。这些激酶的任一激酶的抑制剂是实现这些分子中一个(或多个)分子的酶活性的降低的抑制剂。alk和p38激酶的抑制以前表现为与b-细胞淋巴瘤相关(
不期望受限于理论,本发明人提出alk和p38属于负调节干细胞、特别是人上皮干细胞的长期维持的途径。发明人假设在任何水平下对该途径发挥作用(包括例如通过抑制smad1/5信号转导)的抑制剂还会有益于细胞培养。smad在tgf-β信号转导方面发挥关键作用。
在一些实施方案中,本发明的抑制剂结合于丝氨酸/苏氨酸蛋白激酶并降低其活性,所述丝氨酸/苏氨酸蛋白激酶选自:tgf-β受体激酶1、alk4、alk5、alk7、p38。
在本发明的一些实施方案中,培养基包括tgf-β抑制剂,意即直接或间接负调节tgf-β信号转导的任何抑制剂。在一些实施方案中,本发明的培养基包括一种或多种结合一种或多种丝氨酸/苏氨酸蛋白激酶并降低其活性的tgf-β抑制剂,所述丝氨酸/苏氨酸蛋白激酶选自alk5、alk4、tgf-β受体激酶1和alk7。
alk4、alk5和alk7均是tgf-β超家族的紧密相关的受体。alk4具有gi号91;alk5(还称为tgf-β受体激酶1)具有gi号7046;以及alk7具有gi号658。在一实施方案中,本发明的抑制剂结合alk4、alk5(tgf-β受体激酶1)和/或alk7并降低其活性。在另一实施方案中,tgf-β受体结合smad蛋白并降低其活性,所述smad蛋白例如r-smad或smad1-5(即smad1、smad2、smad3、smad4或smad5)。在优选实施方案中,本发明的培养基包括alk5抑制剂。
已知各种用于测定物质是否为tgf-β抑制剂的方法。例如,可以使用细胞测试,其中用包括人pai-1启动子或smad结合位点的报告构建体(reporterconstruct)稳定地转染细胞,驱动荧光素酶报告基因。相对于对照组的荧光素酶活性的抑制可用作化合物活性的量度(degouville等人,brjpharmacol.2005年5月;145(2):166–177)。另一实例为用于测量激酶活性的
各种tgf-β抑制剂在本领域中已知(例如,参见表1)。在一些实施方案中,直接或间接负调节tgf-β信号转导的抑制剂选自a83-01、sb-431542、sb-505124、sb-525334、sd-208、ly-36494和sjn-2511。
在本发明的一些实施方案中,培养基包括p38抑制剂,意即直接或间接负调节p38信号转导的任何抑制剂。在一些实施方案中,本发明的抑制剂结合p38(gi号1432)并降低其活性。p38蛋白激酶是丝裂原活化蛋白激酶(mapk)家族的一部分。mapk是丝氨酸/苏氨酸特异性蛋白激酶,其对诸如环境胁迫和炎性细胞因子的细胞外刺激反应并调节诸如基因表达、有丝分裂、分化、增殖和细胞存活/细胞凋亡的各种细胞活性。p38mapk以α、β、β2、γ和δ亚型形式存在。p38抑制剂是结合至少一种p38亚型并降低其活性的作用剂。已知各种用于测定物质是否为p38抑制剂的方法,并且可以与本发明一起使用。实例包括:thr180/tyr182的磷酸化的磷酸特异性抗体检测,其提供细胞p38活化或抑制的得到确认的量度;生物化学重组激酶测试;肿瘤坏死因子α(tnfα)分泌测试;以及p38抑制剂的discoverrx高通量筛选平台(参见http://www.discoverx.com/kinases/literature/biochemical/collaterals/drx_poster_p38%20kba.pdf)。还存在多种p38活性测试试剂盒(例如,millipore,sigma-aldrich)。
发明人假设在一些实施方案中,p38的高浓度(例如,高于100nm,或高于1μm,高于10μm,或高于100μm)可以具有抑制tgf-β的作用。然而,发明人不希望受该假设的约束并且在其他实施方案中,p38抑制剂不抑制tgf-β信号转导。
各种p38抑制剂在本领域中已知(例如,参见表1)。在一些实施方案中,直接或间接负调节p38信号转导的抑制剂选自sb-202190、sb-203580、vx-702、vx-745、pd-169316、ro-4402257和birb-796。在本发明的其他实施方案中,培养基包括以下二者:a)结合选自alk4、alk5和alk7的任一种或多种激酶并降低其活性的抑制剂;以及b)结合p38并降低其活性的抑制剂。在优选实施方案中,培养基包括结合alk5并降低其活性的抑制剂以及结合p38并降低其活性的抑制剂。
在一实施方案中,本发明的抑制剂结合其靶标(例如,tgf-β或p38),并与对照相比,使所述靶标的活性降低了10%以上;30%以上;60%以上;80%以上;90%以上;95%以上;或99%以上,如细胞测试所评估的。如上所述,用于测量靶标抑制的细胞测试的实例在本领域是公知的。
本发明的抑制剂所具有的ic50值可以等于或小于2000nm;小于1000nm;小于100nm;小于50nm;小于30nm;小于20nm或小于10nm。ic50值是指抑制剂抑制其靶标的生物或生物化学功能的效能。ic50表示将激酶抑制50%需要多少特定抑制剂。可以根据上述测试方法来计算ic50值。
本发明的抑制剂可以竞争地、非竞争地、无竞争地或通过混合抑制而发挥作用。例如,在某些实施方案中,抑制剂可以为靶标激酶的atp结合袋的竞争性抑制剂。
本发明的抑制剂可以以各种形式存在,包括天然或修饰的底物,酶,受体,小有机分子、例如高达2000da、优选高达800da或更低的天然或合成的小有机分子,模拟肽,无机分子,肽,多肽,反义寡核苷酸适配子,以及其包括小分子的结构或功能性模拟物。本发明的抑制剂还可以为适配子。如本文所用,术语“适配子”是指可采用高度特异性三维构象的寡核苷酸(dna或rna)的链。适配子被设计为对某些靶标分子具有高结合亲和性和特异性,包括细胞外和细胞内蛋白。
例如,抑制剂可以为分子量为50-800da、80-700da、100-600da或150-500da的小合成分子。
在一些实施方案中,小分子抑制剂包括吡啶基咪唑或2,4-双取代蝶啶或喹唑啉,例如包括:
可以根据本发明而使用的抑制剂的特定实例包括但不限于sb-202190、sb-203580、sb-206718、sb-227931、vx-702、vx-745、pd-169316、ro-4402257、birb-796、a83-01、sb-431542、sb-505124、sb-525334、ly364947、sd-208、sjn2511(参见表1)。本发明的培养基可以包括表1所列的抑制剂的任一种或多种。本发明的培养基可以包括一种抑制剂与所列的另一种抑制剂的任何组合。例如,本发明的培养基可以包括sb-202190或sb-203580或a83-01;或者本发明的培养基可以包括sb-202190和a83-01;或本发明的培养基可以包括sb-203580和a83-01。技术人员会认识到在本发明的培养基或培养基补充剂中可以包括结合靶标并降低其活性的其他抑制剂和抑制剂的组合。
考虑到抑制剂的ic50值,可以向培养基添加本发明的抑制剂直至合适的最终浓度。
例如,可以向培养基以50nm至100μm或100nm至50μm或1μm至50μm的浓度添加sb-202190。例如,可以向培养基以约10μm添加sb-202190。
可以向培养基以50nm至100μm或100nm至50μm或1μm至50μm的浓度添加sb-203580。例如,可以向培养基以约10μm添加sb-203580。
可以向培养基以50nm至100μm或100nm至50μm或1μm至25μm的浓度添加vx-702。例如,可以向培养基以约5μm添加vx-702。
可以向培养基以10nm至50μm或50nm至50μm或250nm至10μm的浓度添加vx-745。例如,可以向培养基以约1μm添加vx-745。
可以向培养基以100nm至200μm或200nm至100μm或1μm至50μm的浓度添加pd-169316。例如,可以向培养基以约20μm添加pd-169316。
可以向培养基以10nm至50μm或50nm至50μm或500nm至10μm的浓度添加ro-4402257。例如,可以向培养基以约1μm添加ro-4402257。
可以向培养基以10nm至50μm或50nm至50μm或500nm至10μm的浓度添加birb-796。例如,可以向培养基以约1μm添加birb-796。
可以向培养基以10nm至10μm或20nm至5μm或50nm至1μm的浓度添加a83-01。例如,可以向培养基以约500nm添加a83-01。
可以向培养基以80nm至80μm或100nm至40μm或500nm至10μm的浓度添加sb-431542。例如,可以向培养基以约1μm添加sb-431542。
可以向培养基以40nm至40μm或80nm至20μm或200nm至1μm的浓度添加sb-505124。例如,可以向培养基以约500nm添加sb-505124。
可以向培养基以10nm至10μm或20nm至5μm或50nm至1μm的浓度添加sb-525334。例如,可以向培养基以约100nm添加sb-525334。
可以向培养基以40nm至40μm或80nm至20μm或200nm至1μm的浓度添加ly36494。例如,可以向培养基以约500nm添加ly36494。
表1:本发明的示例性抑制剂
可以向培养基以40nm至40μm或80nm至20μm或200nm至1μm的浓度添加sd-208。例如,可以向培养基以约500nm添加sd-208。
可以向培养基以40nm至40μm或80nm至20μm或200nm至1μm的浓度添加ly364947。例如,可以向培养基以约500nm添加ly364947。
可以向培养基以20nm至20μm或40nm至10μm或100nm至1μm的浓度添加sjn2511。例如,可以向培养基以约200nm添加sjn2511。
因此,在一些实施方案中,向培养基以1nm至100μm、10nm至100μm、100nm至10μm或约1μm的浓度添加直接或间接负调节tgf-β或p38信号转导的抑制剂,例如其中一种或多种抑制剂的总浓度为10nm至100μm、100nm至10μm或者约1μm。
除抑制剂之外,细胞培养基通常包括多种组分,其对于支持培养的细胞的维持和/或扩增而言是必要的。本发明的细胞培养基因此会通常包括除本发明抑制剂之外的其他组分。考虑到以下公开,技术人员会容易地配制组分的合适的组合。本发明的培养基会通常为营养溶液,其包括标准细胞培养组分,例如以下更详细地描述的氨基酸、维生素、无机盐、碳能源和缓冲剂。可以在培养物中包括的其他标准细胞培养组分包括激素如孕酮、蛋白如白蛋白、过氧化氢酶、胰岛素和转铁蛋白。这些其他标准细胞培养组分组成了“基础”培养基。
可以通过修饰现有的细胞培养基来产生本发明的培养基。技术人员从公知常识会了解可用于干细胞培养的培养基类型。可能合适的培养基是可商购的,并且包括但不限于达尔伯克改良伊戈尔培养基(dmem)、最小必需培养基(mem)、敲除-dmem(ko-dmem)、格拉斯哥最小必需培养基(g-mem)、伊戈尔基础培养基(bme)、dmem/ham’sf12、改进型dmem/ham’sf12、iscove改良达尔伯克培养基和最小必需培养基(mem)、ham'sf-10、ham’sf-12、medium199和rpmi1640培养基。因此,在一些实施方案中,这些先已存在的细胞培养基用作基础培养基,向其添加直接或间接负调节tgf-β或p38信号转导的抑制剂,并且任选地向其添加一种或多种本文所述的其他组分。
在一些实施方案中,本发明的培养基包括一种或多种选自:bmp抑制剂、wnt激动剂、受体酪氨酸激酶配体、rock抑制剂、烟酰胺和胃泌激素的其他组分。在一些实施方案中,本发明的培养基包括rspondin1-4和/或rspondin模拟物中任一种、tgf-β抑制剂、bmp抑制剂(例如noggin)以及wnt激动剂(例如wnt(3a))。
在一些实施方案中,本发明的培养基包括rspondin1-4和/或rspondin模拟物中任一种、bmp抑制剂(例如noggin)、tgf-β抑制剂、受体酪氨酸激酶配体(例如egf)、烟酰胺、wnt激动剂(例如wnt(3a)),并任选地包括一种或多种选自:p38抑制剂、胃泌激素、fgf10、hgf和rock抑制剂的其他组分。可以添加任选的其他组分以优化用于培养源自特定组织的细胞的培养基,如稍后更详细阐述的。
本发明的培养基可以包括一种或多种骨形态发生蛋白(bmp)抑制剂。bmp配体通过组装由四部分组成的跨膜丝氨酸/苏氨酸激酶受体复合物(由两个i型和两个ii型受体组成)而以二聚体形式信号转导。复合物组装引发磷酸化级联,活化bmp反应性smad1/5/8,并导致转录活性的变化。有利地,本发明人表明bmp抑制剂促进lgr5的表达,因此在本发明培养基中存在bmp抑制剂会同样产生与不存在bmp抑制剂的情况相比更加增殖的类器官(例如,参见实施例3)。因此,bmp抑制剂是本发明扩增培养基的有利组分。因此,当期望在没有细胞分化的情况下细胞培养至少3个月(例如至少4、5、6、7、8或9个月)时,使用bmp抑制剂在扩增培养基的使用中是有利的。
多种类型的天然bmp结合蛋白是已知的,包括noggin(peprotech)、脊索蛋白和包括脊索蛋白域的脊索蛋白样蛋白(r&d系统)、卵泡抑素和包括卵泡抑素域的卵泡抑素相关蛋白(r&d系统)、dan和包括dan半胱氨酸结(cystein-knot)域的dan样蛋白(r&d系统)、硬化蛋白/sost(r&d系统)和α-2巨球蛋白(r&d系统)。bmp抑制剂是结合bmp分子以形成复合物的作用剂,其中例如通过防止或抑制bmp分子与bmp受体的结合而降低bmp活性。或者,抑制剂可以为结合bmp受体并防止bmp配体与受体结合的作用剂,例如结合受体的抗体。bmp抑制剂可以为蛋白或小分子,并且可以为天然存在的、修饰的和/或部分或全完合成的。本发明的培养基的bmp抑制剂可以为noggin、dan或包括cerberus和gremlin(r&d系统)的dan-样蛋白。这些可扩散蛋白能以不同亲和度结合bmp配体并且抑制它们向信号转导受体的通路。用于本发明培养基的优选的bmp抑制剂是noggin。noggin可以以任何合适的浓度使用。在一些实施方案中,本发明的培养基的基础培养基可以包括约10ng/ml至约100ng/ml的noggin。例如,培养基可以包括至少10ng/ml的noggin、至少20ng/ml的noggin、至少50ng/ml的noggin、至少100ng/ml的noggin、约100ng/ml的noggin或100ng/ml的noggin。在一些实施方案中,培养基可以包括小于200ng/ml的noggin、小于150ng/ml的noggin、小于100ng/ml的noggin、小于75ng/ml的noggin、小于50ng/ml的noggin或小于30ng/ml的noggin。可以在培养期间每隔一天、或培养期间每天、或每三天、每四天、每五天或根据需要来向培养基添加bmp抑制剂。bmp抑制剂是例如用于扩增胰腺、小肠、结肠、肝脏、前列腺干细胞的扩增培养基的特别有利的组分。然而,noggin已表现为抑制一些分化(例如,参见实施例3)。因此,在一些实施方案中,本发明的分化培养基不包括bmp抑制剂。
在一些实施方案中,用bmp抑制剂培养的细胞与不用bmp抑制剂培养的细胞相比具有lgr5的上调表达。因此,添加bmp抑制剂通常导致更加增殖的类器官。这是令人惊讶的,因为在文献中,所描述的是bmp活性可用于将胰腺细胞分化成导管细胞(参见角蛋白7和19表达)和内分泌细胞。因此,技术人员会预期包括bmp抑制剂如noggin以降低增殖并增加分化。然而,发明人令人惊讶地发现,使用bmp是有利的,因为其导致更加增殖的类器官和lgr5的更高表达。本发明的培养基可以包括一种或多种wnt激动剂。当wnt蛋白结合卷曲受体家族成员的细胞表面受体时所发生的一系列事件限定了wnt信号转导途径。这导致了散乱家族(dishevelledfamily)蛋白的活化,所述蛋白抑制包括轴蛋白、gsk-3和蛋白apc的蛋白复合物以降解细胞内β-连环蛋白。所得的富核的β-连环蛋白通过tcf/lef家族转录因子而增强转录。wnt激动剂定义为活化细胞中tcf/lef-介导的转录的作用剂。因此wnt激动剂选自结合并活化卷曲受体家族成员的真wnt激动剂,包括wnt家族蛋白、细胞内β-连环蛋白降解的抑制剂以及tcf/lef的活化剂中的任一种及全部。所述wnt激动剂刺激细胞中的wnt活性增加至少10%、更优选至少20%、更优选至少30%、更优选至少50%、更优选至少70%、更优选至少90%、更优选至少100%(相对于在不存在所述分子的情况下所述wnt活性的水平)。如技术人员所知,可通过测量wnt的转录活性,例如通过ptopflash和pfopflashtcf荧光素酶受体构建体来测定wnt活性(korinek等人,1997science2751784-1787)。
在一些实施方案中,wnt激动剂包括分泌性糖蛋白,包括wnt-l/int-1、wnt-2/irp(inm-相关蛋白)、wnt-2b/13、wnt-3/int-4、wnt-3a(r&d系统)、wnt-4、wnt-5a、wnt-5b、wnt-6(kirikoshih等人,2001biochembiophysrescom283798-805)、wnt-7a(r&d系统)、wnt-7b、wnt-8a/8d、wnt-8b、wnt-9a/14、wnt-9b/14b/15、wnt-10a、wnt-10b/12、wnml和wnt-16。在“thewntfamilyofsecretedproteins”,r&dsystemscatalog,2004中提供了人wnt蛋白的概述。其他wnt激动剂包括分泌性蛋白的r-spondin家族,其涉及wnt信号转导途径的活化和调节并且由4个成员(r-spondin1(nu206,nuvelo,sancarlos,ca)、r-spondin2((r&d系统)、r-spondin3和r-spondin-4)和norrin(还称为nome疾病蛋白或ndp)(r&d系统)组成,其为分泌性调节蛋白,所述蛋白发挥与wnt蛋白相同的功能,因为其以高亲合性结合于卷曲-4受体并诱导wnt信号转导途径的活化(kestutisplanutis等人,(2007)bmccellbiol812)。在一些实施方案中,用于本发明的一种或多种wnt激动剂为r-spondin模拟物,例如lgr5的激动剂,诸如抗-lgr5抗体。为氨基嘧啶衍生物的wnt信号转导途径的小分子激动剂是最近被确定的,并且还明确列为wnt激动剂(lm等人(2005)angewchemintedengl44,1987-90)。
在一些实施方案中,wnt激动剂为gsk-抑制剂。已知的gsk-抑制剂包括小干扰rna(sirna,cellsignaling)、锂(sigma)、kenpaullone(biomolinternational,leost,m等人(2000)eurjbiochem267,5983-5994)、6-溴靛玉红-30-丙酮肟(meyer,l等人(2003)chembiol10,1255-1266)、sb216763和sb415286(sigma-aldrich)、以及frat-家族成员和抑制gsk-3与轴蛋白相互作用的frat-衍生的肽。由meijer等人,(2004)trendsinpharmacologicalsciences25,471-480提供了概述,其并入本文作为参考。技术人员已知用于测定gsk-3抑制水平的方法和测试,并且包括例如liao等人2004,endocrinology,145(6)2941-2949所述的方法和测试。
在一些实施方案中,wnt激动剂是rnf43或znrf3的抑制剂。发明人已发现,rnf43和znrf3存在于细胞膜并且负调节膜中wnt受体复合物的水平,可能通过卷曲蛋白的泛素化。因此,发明人假设用拮抗抗体、rnai或小分子抑制剂抑制rnf43或znrf3会间接刺激wnt途径。rnf43和znrf3具有催化环形域(具有泛素化活性),其可以在小分子抑制剂设计中用作靶标。多种抗-rnf43抗体和多种抗-znrf3抗体是可商购的。在一些实施方案中,这样的抗体在本文情形中是合适的wnt激动剂。
在一些实施方案中,所述wnt激动剂选自wnt-3a、gsk-抑制剂(例如chir99021)、wnt5、wnt-6a、norrin和任何其他wnt家族蛋白。
在一些实施方案中,所述wnt激动剂包括以下任一种或由其组成:rspondin1、rspondin2、rspondin3或rspondin4。在优选实施方案中,所述wnt激动剂选自wnt家族成员、r-spondin1-4、norrin和gsk-抑制剂中的任一种或多种。在一些实施方案中,所述wnt激动剂为gsk-3抑制剂,例如chir99021(stemgent04-0004)。在一些实施方案中,向培养基添加chir99021直至最终浓度为50nm至100μm,例如100nm至50μm、1μm至10μm、1μm至5μm、或3μm。在其中使用gsk-3抑制剂的一些实施方案中,gsk-3抑制剂不为bio(6-溴靛玉红-3’-肟,stemgent04-0003)。发明人发现向基础培养基添加至少一种wnt激动剂对于增殖上皮干细胞或分离的隐窝而言是必要的。
在其他优选实施方案中,所述wnt激动剂包括以下或由其组成:r-spondin1或r-spondin4。向基础培养基以优选至少50ng/ml、更优选至少100ng/ml、更优选至少200ng/ml、更优选至少300ng/ml、更优选至少500ng/ml的浓度添加r-spondin1、r-spondin2、r-spondin3或r-spondin4。r-spondin1、r-spondin2、r-spondin3或r-spondin4的最优选浓度为约500ng/ml或500ng/ml。在一些实施方案中,向培养基以至少500ng/ml、至少600ng/ml、至少700ng/ml、至少800ng/ml、至少900ng/ml、至少1μg/ml、至少1.5μg/ml或至少2μg/ml的浓度添加r-spondin1、r-spondin2、r-spondin3或r-spondin4。在另一优选实施方案中,向培养基以约1μg/ml或1μg/ml的浓度添加r-spondin1、r-spondin2、r-spondin3或r-spondin4。在一些实施方案中,向基础培养基以小于1000ng/ml、例如小于800ng/ml、小于600ng/ml、小于550ng/ml、小于500ng/ml、小于400ng/ml、小于300ng/ml或小于200ng/ml或小于100ng/ml的浓度添加r-spondin1、r-spondin2、r-spondin3或r-spondin4。在一些实施方案中,向培养基添加r-spondin1、r-spondin2、r-spondin3或r-spondin4(“rspondin1-4”)中的两种或多种(例如,2、3或4种)。优选地,当添加rspondin1-4中的两种或多种时,rspondin的最终浓度等于上述浓度。当本文所述的培养基被称为包括“rspondin1-4”时,其表示培养基包括rspondin1、rspondin2、rspondin3和rspondin4的任一种或多种。当本文所述的培养基被称为包括“rspondin”时,其表示培养基包括rspondin1、rspondin2、rspondin3、rspondin4和rspondin模拟物中的任一种或多种。
在干细胞培养期间,优选向培养基每隔一天添加所述wnt家族成员,同时优选每四天更新培养基。
在优选实施方案中,wnt激动剂选自r-spondin、wnt-3a和wnt-6。更优选地,r-spondin和wnt-3a二者均用作wnt激动剂。这种组合是特别优选的,因为这种组合令人惊讶地对类器官形成具有协同作用。优选的浓度为约500ng/ml或500ng/ml(对于r-spondin)以及约100ng/ml或100ng/ml(对于wnt3a)。
本发明的培养基可以包括一种或多种受体酪氨酸激酶配体。用于本发明的受体酪氨酸激酶配体的实例为egf,其为受体酪氨酸激酶egfr的配体。许多受体酪氨酸激酶配体还为促有丝分裂生长因子。
本发明的培养基可以包括一种或多种促有丝分裂生长因子。一种或多种促有丝分裂生长因子可以选自生长因子家族,所述生长因子家族包括上皮生长因子(egf,peprotech)、转化生长因子-α(tgf-α,peprotech)、碱性成纤维细胞生长因子(bfgf,peprotech)、脑源性神经营养因子(bdnf,r&d系统)以及角质形成细胞生长因子(kgf,peprotech)。egf是多种培养的外胚层和中胚层细胞的有效促有丝分裂因子,并且对特定细胞的体内和体外分化以及一些成纤维细胞在细胞培养中的分化具有显著作用。egf前体以膜结合分子形式存在,其被蛋白水解地切开以产生刺激细胞的53-氨基酸肽激素。优选的促有丝分裂生长因子为egf。向基础培养基优选以5-500ng/ml或者至少5ng/ml且不高于500ng/ml的浓度添加egf。优选的浓度为至少10、20、25、30、40、45或50ng/ml且不高于500、450、400、350、300、250、200、150或100ng/ml。更优选的浓度为至少50ng/ml且不高于100ng/ml。甚至更优选的浓度为约50ng/ml或50ng/ml。相同的浓度可以用于fgf,优选用于fgf10或fgf7。如果使用多于一种的fgf、例如fgf7和fgf10,则fgf的浓度如上所定义并且是指所用的fgf的总浓度。在干细胞培养期间,优选向培养基每隔一天添加所述促有丝分裂生长因子,同时优选每四天更新培养基。可以使用fgf家族的任何成员。优选地,使用fgf7和/或fgf10,fgf7还已知为kgf(角质形成细胞生长因子)。在其他优选实施方案中,向基础培养基添加促有丝分裂生长因子的组合,例如egf和kgf或者egf和bdnf。在其他优选实施方案中,向基础培养基添加促有丝分裂生长因子的组合,例如egf和kgf或者egf和fgf10。向培养基以5-500纳克/ml或至少5纳克/ml且不高于500纳克/ml,例如至少10、20、25、30、40、45或50ng/ml且不高于500、450、400、350、300、250、200、150或100ng/ml的浓度添加促有丝分裂生长因子。促有丝分裂生长因子可以选自egf、tgf-α、kgf、fgf7和fgf。优选地,促有丝分裂因子选自egf、tgf-α和kgf,或选自egf、tgf-α和fgf7,或选自egf、tgf-α和fgf,或选自egf和kgf,或选自egf和fgf7,或选自egf和fgf,或选自tgf-α和kgf,或选自tgf-α和fgf7,或选自tgf-α和fgf。egf可以由tgf-α替代。在一些实施方案中,促有丝分裂生长因子为肝细胞生长因子(hgf)。在一些实施方案中,向培养基添加hgf。
在一些实施方案中,受体酪氨酸激酶配体为促有丝分裂生长因子,例如选自生长因子家族,其由上皮生长因子(egf)、转化生长因子-α(tgf-α)、碱性成纤维细胞生长因子(bfgf)、脑源性神经营养因子(bdnf)、肝细胞生长因子(hgf)以及角质形成细胞生长因子(kgf)组成。
rock抑制剂,例如y-27632(10μm;sigma),可以被包括在所述任何培养基中,特别是在进行细胞分选实验之前的最初几天的培养中的所述任何培养基中,因为其已知避免失巢凋亡(程序化细胞死亡的形式,其由从周围细胞外基质分离的贴壁依赖性细胞来诱导)。因此,本文所定义的任何培养基在最初几天可以额外地包括rock抑制剂。在一些实施方案中,本发明的培养基例如在进行细胞分选实验之前的最初几天的培养中额外地包括rock抑制剂、例如y-27632。
本发明方法的其他实施方案包括含有rock(ρ-激酶)抑制剂的培养基。发现rock抑制剂的添加防止失巢凋亡,尤其当培养单干细胞时。所述rock抑制剂优选选自r-(+)-反式-4-(l-氨基乙基)-n-(4-吡啶基)环己甲酰胺二盐酸盐单水合物(y-27632,sigma-aldrich)、5-(l,4-二氮杂环庚烷-1-基磺酰基)异喹啉(法舒地尔或ha1077,caymanchemical)以及(s)-(+)-2-甲基-l-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂环庚烷二盐酸盐(h-1152,tocrisbioschience)。在培养干细胞的最初七天内,向培养基优选每隔一天添加所述ρ-激酶抑制剂,例如y-27632。在单细胞接种之后或分割之后,在最初几天的培养中,例如最初1、2、3、4、5、6或7天中,在培养基中优选包括rock抑制剂。可以使用rock抑制剂的任何合适浓度,例如1-200μm、1-100μm、5-50μm或约10μm。y27632的优选浓度为10μm。因此,在一些实施方案中,本发明提供了用于培养干细胞的方法和/或用于获得类器官的方法,其中在最初1、2、3、4、5、6或7天内向培养基添加、任选每隔一天添加rock抑制剂。在一些实施方案中,在最初2、3、4、5、6、7、8、9或10天之后,不向培养基添加rock抑制剂。
当培养单干细胞(如上所述)时,即当类器官的起始材料为单干细胞时,添加rock抑制剂是尤其重要的。因此,在一些实施方案中,本发明提供了用于获得类器官的方法,其中所述方法包括培养干细胞、任选的单干细胞,其中在最初1、2、3、4、5、6或7天内向培养基添加、任选每隔一天添加rock抑制剂,并且在最初2、3、4、5、6、7、8、9或10天之后任选不添加rock抑制剂。
当培养多种细胞时,例如当类器官的起始材料为组织碎块时,rock抑制剂并非那么重要,并且有时不是必要的。因此,在一些实施方案中,本发明提供了用于获得类器官的方法,其中所述方法包括培养干细胞、任选的组织碎块,其中从不添加或在最初2、3、4、5、6、7、8、9或10天之后不添加rock抑制剂。
在细胞分割入多种培养物时,以相同方式向培养基添加rock抑制剂,意即在分割之后,特别当分割包括从第一培养物采集单干细胞并且将其放入第二培养物中时,在1、2、3、4、5、6或7天内,任选每隔一天。如果分割包括从第一培养物采集多种干细胞并将其放入第二培养物中,则添加rock抑制剂并非那么重要,并且有时不是必要的。因此,在一些实施方案中,其中用于获得类器官或用于培养干细胞的方法包括分割,任选地,当单细胞涉及分割时,在分割之后的最初1、2、3、4、5、6或7天内、任选每隔一天向新的培养基添加rock抑制剂。在一些实施方案中,其中用于获得类器官或用于培养干细胞的方法包括分割,任选地,当多种细胞涉及分割时,从不添加或在最初2、3、4、5、6、7、8、9或10天之后不向培养基添加。
在其他实施方案中,本发明的方法包括还含有notch激动剂的培养基。notch信号转导已表现出在最终细胞类型决定以及在细胞存活和增殖方面发挥重要作用。notch受体蛋白能与许多表面结合性或分泌性配体相互作用,所述配体包括但不限于δ1、jagged1和2以及δ样1、δ样3、δ样4。当配体结合时,notch受体被一系列涉及adam蛋白酶家族成员的切割事件以及由γ分泌酶早老素调节的膜内切割而激活。这导致notch的细胞内域向细胞核的转运,其中其转录地激活下游基因。优选的notch激动剂选自jagged1和δ1,或其活性片段或衍生物。最优选的notch激动剂为具有序列cddyyygfgcnkfcrpr的dsl肽(dontu等人,2004.breastcancerres6.r605-r615)。所述dsl肽优选以10μm至100nm或至少10μm且不高于100nm的浓度使用。notch激动剂的添加,尤其在第一周的培养期间的添加,将培养效率增加2-3倍。在培养干细胞的最初7天内,向培养基优选每隔一天添加notch激动剂。因此,在一些实施方案中,本发明提供了用于培养干细胞的方法和/或用于获得类器官的方法,其中在最初1、2、3、4、5、6或7天内向培养基添加、任选每隔一天添加notch激动剂。在一些实施方案中,在最初2、3、4、5、6、7、8、9或10天之后,不向培养基添加notch激动剂。
所述notch激动剂定义为刺激细胞中的notch活性增加至少10%、更优选至少20%、更优选至少30%、更优选至少50%、更优选至少70%、更优选至少90%、更优选至少100%(相对于在不存在所述分子的情况下所述notch活性的水平)的分子。如技术人员已知的,可以通过测量notch的转录活性,例如通过所述的4xwtcbfl-荧光素酶报告构建体(hsieh等人,1996molcell.biol.16,952-959)来测定notch活性。
在其他实施方案中,用γ-分泌酶抑制剂、例如dapt或dbz来补充细胞培养基。γ-分泌酶抑制剂可在分化期间影响最终细胞类型决定。例如,在一些实施方案中,γ-分泌酶抑制剂可影响最终细胞类型趋于分泌细胞,例如杯形细胞。可以使用γ-分泌酶抑制剂的任何合适的浓度,例如1nm至10μm、1nm至1μm、1nm至100nm,或优选1nm至20nm。例如,可以向培养基添加γ-分泌酶抑制剂直至最终浓度为约1nm。
在其他实施方案中,用胃泌激素(或合适的替代物,例如leu15-胃泌激素)补充细胞培养基。可以向培养基添加胃泌激素(或合适的替代物)直至最终浓度为1nm至10μm、1nm至1μm、5nm至100nm,或优选10nm至50nm。例如,可以向培养基添加leu15-胃泌激素直至最终浓度为约10nm。胃泌激素对于本发明的一些培养基而言并非必要的。因此,在一些实施方案中,本发明的培养基不包括胃泌激素。特别地,胃泌激素对于培养肠干细胞或对于获得肠(隐窝-绒毛或结肠隐窝)类器官而言并非必要的。然而,甚至当不需要胃泌激素时,仍可以将其添加至培养基而没有副作用。
在其他实施方案中,用烟酰胺补充本发明的培养基。发现添加烟酰胺改进了培养效率和人结肠类器官的使用寿命。向培养基添加烟酰胺直至最终浓度为1mm至100mm、5mm至50mm,或优选5mm至20mm。例如,可以向培养基添加烟酰胺直至最终浓度为约10mm。
在本发明的优选实施方案中,用烟酰胺和胃泌激素(或合适的替代物,例如leu15-胃泌激素)补充培养基,其中向培养基以上述任何浓度添加烟酰胺和胃泌激素。
在一些实施方案中,用前列腺素信号转导途径的活化剂补充补充培养基(参见图24,antagonismoftheprostaglandind2receptorsdp1andcrth2asanapproachtotreatallergicdiseases.roypettipher,trevort.hansel&richardarmernaturereviewsdrugdiscovery6,313-325(2007年4月))。例如,用选自以下的化合物中任一种或多种来补充培养基:磷脂、花生四烯酸(aa)、前列腺素e2(pge2)、前列腺素g2(pgg2)、前列腺素f2(pgf2)、前列腺素h2(pgh2)、前列腺素d2(pgd2)。例如,在一些实施方案中,用pge2和/或aa补充培养基。在一些实施方案中,向培养基添加pge2直至最终浓度为至少10nm,例如至少20nm、至少30nm、至少40nm、至少45nm、10nm至500nm、10nm至400nm、10nm至300nm、10nm至200nm、10nm至100nm、20nm至50nm。在优选实施方案中,向培养基添加pge2直至最终浓度为50nm。在一些实施方案中,向培养基添加aa直至最终浓度为至少1μg/ml、至少5μg/ml、至少8μg/ml、至少9μg/ml、至少10μg/ml,例如1μg/ml至1000μg/ml、1μg/ml至500μg/ml、1μg/ml至100μg/ml、1μg/ml至50μg/ml或者5μg/ml至20μg/ml。在优选实施方案中,向培养基添加aa直至最终浓度为10μg/ml。在本发明培养基的情形中,aa和pge2是可互换的。因此,当本文所述的培养基被称为包括pge2时,其可以可替代地包括aa(以适当的浓度)而非pge2。相反,当本文所述的培养基被称为包括aa时,其可以可替代地包括pge2(以适当的浓度)而非aa。此外,技术人员会理解,当本发明的培养基包括pge2和/或aa时,培养基反而会包括选自以下的化合物中任一种或多种来替代pge2和/或aa或除pge2和/或aa之外还包括选自以下的化合物中任一种或多种:磷脂、前列腺素g2(pgg2)、前列腺素f2(pgf2)、前列腺素h2(pgh2)以及前列腺素d2(pgd2)。
在其他实施方案中,用rank配体(本文还称为rankl)来补充本发明的培养基。rank配体可用于引导分化趋于特定最终细胞类型。例如,当rank配体包括在用于小肠细胞的培养基中、优选包括在用于分化小肠细胞的培养基中,其导致更大比例的细胞被分化成m细胞。因此,在一些实施方案中,本发明提供了包括rankl的培养基。特别地,本发明提供了用于培养、优选用于分化小肠细胞的培养基,其中所述培养基包括rankl。可以使用任何浓度的rankl,例如10ng/ml至1000ng/ml、10ng/ml至500ng/ml或者50ng/ml至100ng/ml。例如,可以向培养基添加rankl直至最终浓度为约100ng/ml。
包括egf、noggin和r-spondin的培养基本文称为“enr培养基”。包括enr培养基和wnt激动剂如wnt-3a的培养基本文称为“wenr培养基”。在本发明的优选实施方案中,培养基包括wenr培养基。在本发明最优选的实施方案中,培养基包括用胃泌激素和/或烟酰胺补充的wenr培养基(即,wenrg或wenr+烟酰胺或wenrg+烟酰胺)。
培养基的ph可以为约7.0至7.8,约7.2至7.6,或约7.4。可以使用缓冲剂维持ph。技术人员容易选择合适的缓冲剂。可使用的缓冲剂包括碳酸盐缓冲剂(例如nahco3)和磷酸盐(例如nah2po4)。这些缓冲剂通常以约50mg/l至约500mg/l来使用。还可以使用其他缓冲剂,例如n-[2-羟乙基]-哌嗪-n'-[2-乙磺酸](hepes)和3-[n-吗啉基]-丙磺酸(mops),通常为约1000mg/l至约10,000mg/l。培养基可以包括ph指示剂如酚红以容易地监测培养基的ph状态(例如约5mg/升至约50mg/升)。
用于本发明的培养基可以包括一种或多种氨基酸。技术人员了解用于干细胞培养基的氨基酸的合适的类型和量。可以存在的氨基酸包括l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-胱氨酸、l-谷氨酸、l-谷氨酰胺、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸、l-缬氨酸及其组合。一些培养基会包括所有这些氨基酸。通常,每一氨基酸当存在时,以培养基的约0.001g/l至约1g/l(通常约0.01g/l至约0.15g/l)而存在,除了l-谷氨酰胺,其以约0.05g/l至约1g/l(通常约0.1g/l至约0.75g/l)而存在。氨基酸可以具有合成来源。
用于本发明的培养基可以包括一种或多种维生素。技术人员了解用于干细胞培养基的维生素的合适的类型和量。可以存在的维生素包括硫胺素(维生素b1)、核黄素(维生素b2)、烟酸(维生素b3)、d-泛酸钙(维生素b5)、吡哆醛/吡哆胺/吡哆醇(维生素b6)、叶酸(维生素b9)、氰钴胺(维生素b12)、抗坏血酸(维生素c)、钙化醇(维生素d2)、dl-α生育酚(维生素e)、生物素(维生素h)和甲萘醌(维生素k)。
用于本发明的培养基可以包括一种或多种无机盐。技术人员了解用于干细胞培养基的无机盐的合适的类型和量。在培养基中通常包括无机盐以辅助细胞渗透平衡的维持以及辅助调节膜电位。可以存在的无机盐包括钙盐、铜盐、铁盐、镁盐、钙盐、钾盐、钠盐、锌盐。所述盐通常以氯化物、磷酸盐、硫酸盐、硝酸盐和碳酸氢盐的形式使用。可以使用的具体盐包括cacl2、cuso4-5h2o、fe(no3)-9h2o、feso4-7h2o、mgcl、mgso4、kcl、nahco3、nacl、na2hpo4、na2hpo4-h2o和znso4-7h2o。
培养基的渗透度可以为约200mosm/kg至约400mosm/kg,约290mosm/kg至约350mosm/kg,或约280mosm/kg至约310mosm/kg。培养基的渗透度可以小于约300mosm/kg(例如约280mosm/kg)。
用于本发明的培养基可以包括以一种或多种糖形式的碳能源。技术人员了解用于干细胞培养基的糖的合适的类型和量。可以存在的糖包括葡萄糖、半乳糖、麦芽糖和果糖。糖优选为葡萄糖,特别是d-葡萄糖(右旋糖)。碳能源会通常以约1g/l至约10g/l而存在。
本发明的培养基可以包括血清。可以使用从任何合适源获得的血清,包括胎牛血清(fbs)、山羊血清或人血清。优选地,使用人血清。根据常规技术,可以以培养基的约1体积%至约30体积%来使用血清。
在其他实施方案中,本发明的培养基可以包括血清替代物。各种不同的血清替代物制剂是商购的,并且对于技术人员是已知的。当使用血清替代物时,根据常规技术,可以以培养基的约1体积%至约30体积%来使用该血清替代物。
在其他实施方案中,本发明的培养基可以为无血清和/或无血清替代物的。无血清培养基为不含任何类型的动物血清的培养基。无血清培养基可以优选避免干细胞的可能的外源污染。无血清替代物培养基是不用任何商购血清替代物制剂补充的培养基。
在优选实施方案中,用纯化的、天然的、半合成的和/或合成的生长因子补充细胞培养基,并且该细胞培养基不包括不明确的组分,例如胎牛血清(fetalbovineserum)或牛犊血清(fetalcalfserum)。例如,补充剂如b27(invitrogen)、n-乙酰半胱氨酸(sigma)和n2(invitrogen)刺激一些细胞的增殖。在一些实施方案中,用这些补充剂中的一种或多种来补充细胞培养基,例如用这些补充剂中的一种、任意两种或全部三种。
在其他实施方案中,用exendin-4补充细胞培养基。exendin-4,即一种39个氨基酸肽,其活化glp-1(胰高血糖素样肽-1)受体以增加胰腺泡细胞中的细胞内camp而对vip(血管活性肠肽)受体没有作用。
用于本发明的培养基可以包括一种或多种微量元素,例如以下的离子:钡、溴(bromium)、钴、碘、锰、铬、铜、镍、硒、钒、钛、锗、钼、硅、铁、氟、银、铷、锡、锆、镉、锌和/或铝。
培养基可以包括还原剂,例如浓度为约0.1mm的β-巯基乙醇。
本发明的培养基可以包括一种或多种额外的作用剂,例如先前报道用于改进干细胞培养的营养物或生长因子,例如胆固醇/转铁蛋白/白蛋白/胰岛素/孕酮、腐胺、亚硒酸盐/其他因子。
本发明的培养基可以扩散入细胞外基质(ecm)。在本发明的优选方法中,分离的组织碎块或分离的上皮干细胞与ecm连接。ecm由多种多糖、水、弹性蛋白和糖蛋白组成,其中糖蛋白包括胶原、巢蛋白(entactin)(巢蛋白(nidogen))、纤连蛋白和层粘连蛋白。ecm由结缔组织细胞分泌。不同类型的ecm是已知的,其包括不同组合物,包括不同类型的糖蛋白和/或糖蛋白的不同组合。通过在容器中培养产生ecm的细胞、例如成纤维细胞来提供ecm,然后移除这些细胞,并且添加分离的组织碎块或分离的上皮干细胞。外基质生成细胞的细胞的实例为:软骨细胞,主要产生胶原和蛋白聚糖;成纤维细胞,主要产生iv型胶原、层粘连细胞、间质原胶原和纤连蛋白;以及结肠成肌纤维细胞,主要产生胶原(i、iii和v型)、硫酸软骨素蛋白聚糖、透明质酸、纤连蛋白和腱生蛋白-c。或者,ecm为可商业提供的。可商购的细胞外基质的实例为细胞外基质蛋白(invitrogen)和来自engelbreth-holm-swarm(ehs)小鼠肉瘤细胞的基膜制剂(例如matrigeltm(bdbiosciences))。可以使用合成的细胞外基质材料,例如pronectin(sigmaz378666)。若需要,可以使用细胞外基质材料的混合物。用于培养干细胞的ecm的使用增加了干细胞的长期存活和未分化干细胞的连续存在。在不存在ecm的情况下,不能培养干细胞培养物较长时段,并且没有观察到未分化干细胞的连续存在。此外,ecm的存在允许三维组织类器官的培养,其不能在不存在ecm的情况下培养。细胞外基质材料通常会沉到其中悬浮细胞的培养皿的底部上。通常,当基质在37℃固化时,添加培养基并该培养基扩散入ecm。培养基中的细胞通过与ecm表面结构相互作用、例如与整合素相互作用而粘附于ecm。以约1μg/cm2、或约1μg/cm2至约250μg/cm2、或约1μg/cm2至约150μg/cm2使用的约1mg/ml的纤连蛋白溶液(原液)可以用于涂覆细胞培养容器。在一些实施方案中,用纤连蛋白以8μg/cm2至125μg/cm2来涂覆细胞培养容器。
用于本发明方法的ecm的实例包括至少一种糖蛋白,例如层粘连蛋白。
用于本发明方法的优选的ecm包括至少两种不同的糖蛋白,例如两种不同类型的胶原或者胶原和层粘连蛋白。ecm可为合成的水凝胶细胞外基质或天然存在的ecm。由matrigeltm(bdbiosciences)提供其他优选的ecm,其包括层粘连蛋白、巢蛋白和胶原iv。在一些实施方案中,细胞外基质为含层粘连蛋白的细胞外基质,例如matrigeltm(bdbiosciences)。
在一些实施方案中,单干细胞、细胞群或组织碎块被嵌入基质胶(matrigel)中,其任选地为生长因子降低的和/或无酚红的。
在一些实施方案中,将培养基置于ecm的顶部上。然后,移除培养基并且根据需要及当需要时进行补充。在一些实施方案中,每1、2、3、4、5、6或7天补充培养基。如果“添加”或从培养基“移除”组分,则其在一些实施方案中可以表示从ecm移除培养基自身,然后将含“添加的”组分或不包括“移除的”组分的新的培养基置于ecm上。
在一些实施方案中,本发明的培养基与细胞外基质或通过其与细胞膜蛋白如整合素相互作用而模拟细胞外基质的3d基质接触。
在一些实施方案中,基础培养基包括改进型dmem/f12或由改进型dmem/f12组成,所述改进型dmem/f12补充有青霉素/链霉素、10mmhepes、glutamax、1×n2、1×b27(所有均来自invitrogen)和1mmn-乙酰半胱氨酸(sigma)。
本发明培养基的实例
在一实施方案中,细胞培养基包括结合alk5并降低其活性的tgf-β抑制剂以及结合p38并降低其活性的p38抑制剂。例如,在一实施方案中,细胞培养基包括a83-01和/或sb202190,优选a83-01+sb202190。已令人惊讶地发现a83-01+sb202190一起用于本发明的培养基协同增加了人结肠类器官的传代数。在一实施方案中,细胞培养基包括wenr+a83-01+sb202190。在一实施方案中,细胞培养基包括wenr+a83-01+sb202190+烟酰胺。在一实施方案中,细胞培养基包括wenrg+烟酰胺+a83-01+sb202190(其中“g”为胃泌激素)。在一实施方案中,细胞培养基包括wenr+a83-01+烟酰胺+fgf10。在一实施方案中,细胞培养基包括wenrg+a83-01+烟酰胺+fgf10。在一实施方案中,细胞培养基包括wenrg+a83-01+烟酰胺+fgf10+sb202190。在一实施方案中,细胞培养基用于获得结肠类器官。还提供了通过使用该实施方案所述的细胞培养基培养上皮细胞而获得的结肠类器官。
例如,在一实施方案中,细胞培养基包括wenrg+a83-01+fgf10,其中wnt激动剂为r-spondin,但没有其他wnt激动剂存在或没有烟酰胺存在。例如,在一些实施方案中,细胞培养基包括egf(例如50ng/ml)、r-spondin(例如10%或1μg/ml)、noggin(例如100ng/ml)、fgf10(例如100ng/ml)、a8301(例如500nm)以及胃泌激素(例如10μm),并任选地包括sb202190。这些组分可以被添加至基础培养基,例如dmem/f12培养基。在一些实施方案中,还用选自p/s、glutamax、10nmmhepes、b27、n2和n-乙酰半胱氨酸的任一种或多种(例如,1、2、3、4或5种)组分或全部组分来进一步补充基础培养基。已经发现使用这样的细胞培养基可用于获得胰腺类器官。还提供了通过使用该实施方案所述的细胞培养基培养上皮细胞而获得的胰腺类器官。在一些实施方案中,培养基不包括胃泌激素或烟酰胺或胃泌激素和烟酰胺。
本发明的组织特异性培养基
在本文实施例中描述了特别优选的培养基。本发明的培养基可适于与不同组织一起使用,例如如下文所述。
肠培养基
在一些实施方案中,用于小肠隐窝、例如小鼠小肠隐窝的培养基包括基础培养基或由其组成,例如上文所述,还包括:egf,例如小鼠egf;bmp抑制剂,例如小鼠noggin;以及rspondin,例如人rspondin-1或4。在一些实施方案中,这种培养基还包括tgf-β抑制剂(例如a83-01)和/或p38抑制剂(例如sb202190)。在一些实施方案中,用于结肠隐窝、例如小鼠结肠隐窝的培养基包括基础培养基或由其组成,例如上文所述,还包括:wnt激动剂,例如重组人wnt-3a或wnt-3a条件培养基;egf,例如小鼠egf;bmp抑制剂,例如小鼠noggin;以及rspondin,例如人rspondin-1或4。在一些实施方案中,这种培养基还包括tgf-β抑制剂(例如a83-01)和/或p38抑制剂(例如sb202190)。
在一些实施方案中,用于人肠干细胞、人小肠隐窝或人结肠隐窝的培养基(还称为hisc培养基)包括基础培养基或由其组成,例如上文所述,还包括:wnt激动剂,例如重组人wnt-3a或wnt-3a条件培养基;egf;bmp抑制剂,例如noggin;rspondin,例如人rspondin-1;tgf-β抑制剂,例如a83-01;p38抑制剂,例如sb202190;胃泌激素;以及烟酰胺。在一些实施方案中,hisc培养基可不包括p38抑制剂和/或胃泌激素。
在一些实施方案中,本发明提供了用于培养肠细胞的培养基,其包括以下或由其组成:基础培养基、wnt-3a、egf、noggin、rspondin1-4任一种、tgf-β抑制剂、烟酰胺以及优选的p38抑制剂。
在一些实施方案中,用于扩增小肠或结肠干细胞、例如人小肠或结肠细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)和谷氨酰胺/glutamax)、wnt3a(任选为条件培养基)、rspondin1-4任一种(优选1μg/ml)、noggin(优选50-100ng/ml)、烟酰胺(优选10mm)、egf(优选10-50ng/ml)、胃泌激素(优选10nm)、tgf-β抑制剂如a83-01(优选500nm)。在其他实施方案中,这种培养基还包括p38抑制剂,例如sb202190(优选100nm)。在其他实施方案中,这种培养基还包括rock抑制剂,例如ly2157299。
在一些实施方案中,本发明提供了用于分化肠细胞的培养基,其包括以下或由其组成:基础培养基、egf、noggin、tgf-β抑制剂和p38抑制剂。
在一些实施方案中,用于分化小肠或结肠干细胞、例如人小肠或结肠细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)和谷氨酰胺/glutamax)、noggin(优选50-100ng/ml)、egf(优选10-50ng/ml)、胃泌激素(优选10nm)、tgf-β抑制剂如a83-01(优选500nm),以及p38抑制剂如sb202190(优选100nm)。在一些实施方案中,该分化培养基可不包括胃泌激素。在一些实施方案中,可添加γ-分泌酶抑制剂至分化培养基(优选的浓度为1μm)。γ-分泌酶抑制剂可影响最终细胞类型决定,例如趋于分泌细胞,例如杯形细胞。在一些实施方案中,可以添加rankl至分化培养基(例如,浓度为100ng/ml)。rankl可影响分化期间的最终细胞类型决定,例如趋于m-细胞。
癌培养基
在一些实施方案中,用于结肠癌细胞的培养基包括基础培养基或由其组成,例如上文所述,还包括:wnt激动剂,例如重组人wnt-3a或wnt-3a条件培养基;egf;bmp抑制剂,例如noggin;rspondin,例如人rspondin-1;tgf-β抑制剂,例如a83-01;p38抑制剂,例如sb202190;胃泌激素;以及烟酰胺。
在一些实施方案中,用于结肠癌、例如人结肠癌的培养基包括:基础培养基,例如包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)、primocin和/或p/s(抗生素)(500x)以及hepes)、rspondin(任选为条件培养基)(优选为1μg/ml)、noggin(优选100ng/ml)、烟酰胺(优选10mm)、egf(优选50ng/ml)、胃泌激素(优选50nm)、tgf-β抑制剂如a83-01(优选500nm)、p38抑制剂如sb202190(优选10μm),任选地包括pge2(优选10nm)和/或rock抑制剂(优选10μm)。
在一些实施方案中,结肠癌细胞还可在hisc培养基中生长。在一些实施方案中,结肠癌细胞可以在hisc培养基中培养,其中培养基不包括以下一种或多种或全部:egf、noggin、rspondin、tgf-β抑制剂和p38抑制剂。癌细胞可以具有组成型活化或失活某些生长路径的突变。例如,许多结肠癌产生wnt通路的组成型活化。在这样的情况中,培养基不需要wnt激动剂。其他突变会使上述培养基省略其他因子。其他上皮癌(癌)还可在本发明的培养基中生长。在优选实施方案中,从癌干细胞获得的癌类器官在适于生长由正常干细胞获得的相对应的正常组织类器官的培养基(培养基任选地不包括某些因子)中生长。例如,通过培养胃癌干细胞而获得的胃癌类器官可以在与通过培养胃干细胞而获得的正常胃类器官相同的培养条件(培养基任选地不包括某些因子)中生长。在另一实例中,通过培养胰腺癌干细胞而获得的胰腺癌类器官可以在与通过培养胰腺干细胞而获得的正常胰腺类器官相同的培养条件(培养基任选地不包括某些因子)中生长。在另一实例中,通过培养前列腺癌干细胞而获得的前列腺癌类器官可以在与通过培养前列腺干细胞而获得的正常前列腺类器官相同的培养条件(培养基任选地不包括某些因子)中生长。在另一实例中,通过培养肝癌干细胞而获得的肝癌类器官可以在与通过培养肝干细胞而获得的正常肝脏类器官相同的培养条件(培养基任选地不包括某些因子)中生长。在许多情形中,可以优选(或至少更便利)的是,在正常组织培养基(没有排除任何因子)中生长癌类器官。正常组织培养基应使具有遗传背景的癌生长,而没有排除任何特定癌突变。
因此,在一些实施方案中,本发明提供了用于培养癌细胞、例如癌干细胞、诸如来自目标组织类型的腺癌或癌细胞的培养基,其中所述培养基包括用于培养来自相对应的无癌目标组织类型的细胞的培养基组分或由其组成,任选地,其中用于培养目标组织类型的无癌细胞的培养基不包括以下中一种或多种:wnt-3a、egf、noggin、rspondin、tgf-β抑制剂、p38抑制剂、烟酰胺、胃泌激素、fgf10以及hgf。
腺瘤培养基
在一些实施方案中,用于肠腺瘤、例如小鼠肠腺瘤的培养基包括基础培养基,例如上文所述,还包括egf,例如小鼠egf。
胃培养基
在一些实施方案中,本发明提供了用于培养胃细胞的培养基,其包括以下或由其组成:基础培养基、wnt-3a、egf、noggin、rspondin1-4中任一种、tgf-β抑制剂、胃泌激素、烟酰胺以及优选的p38抑制剂。
在一些实施方案中,用于胃干细胞、例如人胃干细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)、primocin和/或p/s(抗生素)(500x)以及谷氨酰胺/glutamax)、rspondin1-4中任一种(任选为条件培养基)(优选1μg/ml)、noggin(任选为条件培养基)(优选100ng/ml)、wnt3a(任选为条件培养基)、烟酰胺(优选5mm)、egf(优选50ng/ml)、fgf10(优选200ng/ml)、胃泌激素(优选1nm)、tgf-β抑制剂如a83-01(优选2μm)。用于胃干细胞的培养基任选还包括p38抑制剂,例如sb202190(优选10nm)。用于胃干细胞的培养基任选还包括pge2(优选500nm)。用于胃干细胞的培养基任选还包括rock抑制剂(优选10μm)。
在一些实施方案中,用于胃干细胞、例如小鼠胃干细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)、primocin和/或p/s(抗生素)(500x)以及谷氨酰胺/glutamax)、rspondin1-4中任一种(任选为条件培养基)(优选1μg/ml)、noggin(任选为条件培养基)(优选100ng/ml)、wnt3a(任选为条件培养基)、egf(优选50ng/ml)、fgf10(优选200ng/ml)、胃泌激素(优选1nm)和rock抑制剂(优选10μm)。在一些实施方案中,这种培养基还包括tgf-β抑制剂(例如a83-01)和/或p38抑制剂(例如sb202190)。
前列腺培养基
在一些实施方案中,用于扩增前列腺干细胞的培养基包括睾酮,任选地包括二氢睾酮(本文还称为dht)。睾酮是来自雄激素组的类固醇激素。在人类中,大部分睾酮经历5α-还原而形成更有效的雄激素,即二氢睾酮。可以向本发明的培养基添加睾酮、二氢睾酮或睾酮模拟物(例如,模拟结合于雄激素受体的睾酮的活性的分子)。因此,当使用术语睾酮时,其还通常可被二氢睾酮或睾酮类似物替代。发明人已表明,向用于前列腺干细胞的培养基添加睾酮导致分化增加,但还导致干细胞群的连续扩增(例如,参见图41-45)。这非常令人惊讶,因为文献教导了睾酮通过发挥作用来抑制增殖并维持终末分化,从而在细胞分化方面发挥重要作用(mirochnik等人,plosone,7(3),e31052,2012;niu等人,oncogene29,3593-3604,2010)。技术人员已预期到,向用于前列腺的培养基添加睾酮会导致完全分化的类器官而没有进一步扩增潜能。这会与当在分化培养基中分化结肠、胰腺和肝脏时所观察到的情形类似。然而,相反地,本发明人已发现,尽管睾酮增加了分化,但其还使干细胞扩增持续进行。因此,在包括睾酮的培养基中生长的类器官令人惊讶地包括干细胞和分化的细胞,即,腔细胞和基细胞。
在一些实施方案中,用于获得前列腺类器官的培养基包括基础培养基和睾酮,任选地包括二氢睾酮和rspondin1-4或rspondin模拟物中任一种。在一些实施方案中,培养基还包括bmp抑制剂,例如noggin。在一些实施方案中,培养基还包括酪氨酸受体激酶配体,任选地,其中酪氨酸受体激酶配体为促有丝分裂生长因子,例如egf、fgf、kgf或hgf。在一些实施方案中,用于获得前列腺类器官的培养基包括egf、noggin、rspondin1-4中任一种、以及睾酮。
在优选实施方案中,用于前列腺细胞的培养基包括tgf-β抑制剂。在一些实施方案中,用于前列腺类器官的培养基包括egf、noggin、rspondin1-4中任一种、tgf-β抑制剂、以及睾酮。在一些实施方案中,用于前列腺细胞的培养基还包括p38抑制剂。在一些实施方案中,用于获得前列腺类器官的培养基不包括本发明的抑制剂,例如tgf-β抑制剂和/或p38抑制剂。在一些实施方案中,用于前列腺干细胞的培养基不包括睾酮。在一些实施方案中,培养基包括基础培养基、egf、noggin、以及rspondin1-4中任一种,并且任选地包括tgf-β抑制剂,并且不包括睾酮。
在一些实施方案中,本发明提供了用于培养基前列腺细胞的培养基,其包括以下或由其组成:基础培养基、egf、rspondin1-4中任一种、noggin、烟碱、tgf-β抑制剂、以及优选的wnt3a和fgf-10。在一些实施方案中,用于培养基前列腺细胞的培养基还包括睾酮,例如(二氢)睾酮。在一些实施方案中,培养基还包括p38抑制剂。在一些实施方案中,用于前列腺细胞,例如小鼠、人、正常或癌前列腺细胞的培养基包括:基础培养基(例如包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)以及谷氨酰胺/glutamax)、rspondin1-4中任一种(任选为条件培养基)(优选1μg/ml)、noggin(任选为条件培养基)(优选100ng/ml)、烟酰胺(优选10mm)、egf(优选50ng/ml)、fgf10(优选100ng/ml)、tgf-β抑制剂如a83-01(优选500nm)、(二氢)睾酮(优选1nm)10nm以及任选的wnt-3a。在一些实施方案中,这种培养基还包括rock抑制剂(优选10μm)。在一些实施方案中,用于前列腺细胞的培养基还包括p38抑制剂,例如sb202190。在一些其中培养基小鼠前列腺细胞的实施方案中,培养基可不包括tgf-β抑制剂。在其他实施方案中,培养基可不包括烟酰胺、fgf10和/或rock抑制剂。
胰腺培养基
在一些实施方案中,本发明提供了用于扩增胰腺细胞的培养基,其包括以下或由其组成:基础培养基、rspondin1-4中任一种、noggin、egf、fgf10、胃泌激素、tgf-β抑制剂以及优选的exendin4和wnt-3a。
在一些实施方案中,用于扩增胰腺干细胞、例如人胰腺干细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)以及谷氨酰胺/glutamax)、rspondin1-4中任一种(任选为条件培养基)(优选1μg/ml)、noggin(任选为条件培养基)(优选100ng/ml)、烟酰胺(优选10mm)、egf(优选50ng/ml)、fgf10(优选100ng/ml)、胃泌激素(优选100nm)、tgf-β抑制剂如a83-01(优选2μm)。在其他实施方案中,这种培养基还包括wnt-3a。在其他实施方案中,该培养基还包括p38抑制剂,例如sb202190(优选100nm)。在其他实施方案中,该培养基还包括rock抑制剂,例如ly2157299(优选10μm)。在其他实施方案中,这种培养基还包括exendin4(优选50ng/ml)。
在一些实施方案中,用于扩增胰腺干细胞、例如小鼠胰腺干细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)、primocin和/或p/s(抗生素)、hepes以及谷氨酰胺/glutamax)、rspondin1-4中任一种(任选为条件培养基)(优选1μg/ml)、noggin(任选为条件培养基)(优选100ng/ml)、烟酰胺(优选10mm)、egf(优选50ng/ml)、fgf10(优选100ng/ml)、胃泌激素(优选100nm)以及tgf-β抑制剂如a83-01(优选2μm)。在其他实施方案中,这种培养基还包括rock抑制剂,例如ly2157299(优选10μm)。在一些实施方案中,用于胰腺细胞的培养基还包括p38抑制剂,例如sb202190。
在一些实施方案中,本发明提供了用于分化胰腺细胞的培养基,其包括以下或由其组成:基础培养基、noggin、egf、fgf10、胃泌激素、tgf-β抑制剂、γ-分泌酶抑制剂以及优选的exendin4。
在一些实施方案中,用于分化胰腺干细胞、例如人胰腺干细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)以及谷氨酰胺/glutamax)、noggin(优选100ng/ml)、egf(优选50ng/ml)、fgf10(优选10nm)、胃泌激素(优选100nm)、tgf-β抑制剂如a83-01(优选50nm)以及γ-分泌酶抑制剂(dapt/dbz)(优选10μm)。在其他实施方案中,这种培养基还包括exendin4(优选50ng/ml)。在一些实施方案中,用于胰腺细胞的培养基还包括p38抑制剂,例如sb202190。
在一些实施方案中,用于分化胰腺干细胞、例如小鼠胰腺干细胞的培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)以及谷氨酰胺/glutamax)、egf(优选50ng/ml)以及γ-分泌酶抑制剂(例如dapt/dbz)(优选10μm)。
巴雷特食管培养基
在一些实施方案中,用于巴雷特食管的培养基包括基础培养基或由其组成,例如上文所述,还包括:wnt激动剂,例如重组人wnt-3a或wnt-3a条件培养基;egf;bmp抑制剂,例如noggin;rspondin,例如人rspondin-1;tgf-β抑制剂,例如a83-01;p38抑制剂,例如sb202190;胃泌激素;烟酰胺;以及fgf,例如人fgf10(即hisc+fgf)。在一些实施方案中,这种分化培养基不包括胃泌激素。
在一些实施方案中,本发明提供了用于获得巴雷特食管类器官的方法,其中所述方法包括在任选还包括fgf10的hisc培养基中将从巴雷特食管分离的上皮培养1、2、3、4、5、6、7天或更多天;以及在最初1、2、3、4天或更多天之后除去烟酰胺和sb202190。在一些实施方案中,培养基还包括notich抑制剂,例如dbz。在一些实施方案中,在notch抑制剂的存在下培养的巴雷特食管类器官几乎不包括或不包括增殖的细胞,并且与在notch抑制剂的不存在下培养的类器官相比,包括更多的杯形细胞(参见图5)。
肝脏培养基
在一些实施方案中,肝细胞可在第一“扩增”培养基(本文还称为em)中生长,优选之后在第二“分化”培养基(本文还称为dm)中培养细胞。然而,在一些实施方案中,不实施在dm培养基中分化的步骤,例如在一些方法中,细胞被移植并允许体内分化。类似地,存在着用于其他组织,例如胰腺、小肠和结肠的扩增培养基和分化培养基(见上文)。
在一实施方案中,肝脏扩增培养基包括egf、wnt激动剂、fgf和烟酰胺。优选地,wnt激动剂为r-spondin1-4(例如,rspondin1、2、3和4中任一种或多种),因此,该扩增培养基称为“erfnic”。特别优选的扩增培养基还包括hgf,并被称为“erfhnic”。
在一些实施方案中,用tgfβ抑制剂补充肝脏扩增培养基。在一些实施方案中,tgfβ以至少5nm存在,例如至少50nm、至少100nm、至少300nm、至少450nm、至少475nm,例如5nm-500mm、10nm-100mm、50nm-700μm、50nm-10μm、100nm-1000nm、350-650nm或更优选500nm。tgfβ抑制剂存在于扩增培养基中对于人细胞的实施方案是特别优选的。
在一些实施方案中,本发明提供了用于扩增肝细胞的培养基,其包括以下或由其组成:基础培养基、rspondin1-4中任一种、noggin、烟酰胺、egf、fgf10、hgf、胃泌激素、tgf-β抑制剂及pge2,以及优选的wnt-3a。
在一些实施方案中,肝脏扩增培养基还包括p38抑制剂。
在一些实施方案中,用前列腺素信号转导途径的活化剂(还称为前列腺素途径活化剂)补充肝脏扩增培养基(参见图24)。例如,用选自以下的化合物中任一种或多种来补充肝脏扩增培养基:磷脂、花生四烯酸(aa)、前列腺素e2(pge2)、前列腺素g2(pgg2)、前列腺素f2(pgf2)、前列腺素h2(pgh2)、前列腺素d2(pgd2)。例如,在一些实施方案中,用pge2和/或aa补充肝脏扩增培养基。在一些实施方案中,向肝脏扩增培养基添加pge2直至最终浓度为至少10nm、至少30nm、至少40nm、至少45nm、至少50nm,例如10nm至500nm、10nm至400nm、10nm至300nm、10nm至200nm、10nm至100nm、20nm至50nm。在优选实施方案中,向肝脏扩增培养基添加pge2直至最终浓度为50nm。在一些实施方案中,向肝脏扩增培养基添加aa直至最终浓度为至少1μg/ml,例如至少3μg/ml、至少5μg/ml、至少8μg/ml、至少9μg/ml、至少10μg/ml,1μg/ml至1000μg/ml、1μg/ml至500μg/ml、1μg/ml至100μg/ml、1μg/ml至50μg/ml或者5μg/ml至10μg/ml。在优选实施方案中,向培养基添加aa直至最终浓度为10μg/ml。
在优选实施方案中,用tgf-β抑制剂和前列腺素信号转导途径的活化剂(例如pge2和/或aa)以及任选的p38抑制剂来补充肝脏扩增培养基。
在优选实施方案中,肝脏扩增培养基还包括胃泌激素。
在一实施方案中,肝脏分化培养基包括egf、tgf-β抑制剂、fgf(例如,fgf10、fgf2或任何其他合适的fgf家族成员)以及notch抑制剂。在一实施方案中,tgf-β抑制剂为a83-01和/或notch抑制剂为dapt。这种分化培养基在本文称为“eafd”并且为本发明的优选分化培养基。fgf可以任选地被hgf替代,或者fgf和hgf均可以存在或不存在于分化培养基中。在一些实施方案中,egf可以被hgf或另一种受体酪氨酸激酶配体替代。还可以添加地塞米松,例如以10nm至10μm的浓度。肝脏分化培养基可以任选地包括前列腺素途径活化剂,例如pge2或aa。然而,分化培养基还可以不包括这种组分。在一些实施方案中,还可以添加制瘤素m,例如以1ng/ml至1mg/ml的浓度,从而辅助向干细胞的最终细胞类型的分化。
在一些实施方案中,本发明提供了用于分化肝细胞的培养基,其包括以下或由其组成:基础培养基、noggin、egf、胃泌激素、tgf-β抑制剂、γ-分泌酶抑制剂如dapt或dbz,以及优选的wnt-3a。
在一些实施方案中,肝细胞可以最初在扩增培养基中培养,所述扩增培养基还包括wnt和noggin,例如“enrw”培养基包括egf、noggin、r-spondin和wnt(例如wnt-3a)、任选的前列腺素途径活化剂如pge2或aa、任选的tgfβ抑制剂以及任选的fgf、hgf、烟酰胺。在优选实施方案中,用tgf-β抑制剂和前列腺素信号转导途径的活化剂(例如pge2和/或aa)中一种、更优选二者来补充肝脏扩增培养基。
在一些实施方案中,用于肝脏的扩增培养基包括egf、noggin、胃泌激素、fgf、烟酰胺、tgf-β抑制剂如a83-01、hgf、rspondin1-4(例如rspondin1、2、3或4中任一种或多种)以及pge2。
在优选实施方案中,肝脏细胞可以最初在用pge2和/或aa补充的扩增培养基中培养,所述扩增培养基包括egf、noggin、胃泌激素、fgf10、烟酰胺、a8301、hgf以及rspondin1-4中任一种。可以以rspo条件培养基的形式提供rspondin1-4。例如,扩增培养基可以包括egf(100ng/ml,invitrogen);noggin(25ng/ml,peprotech);胃泌激素(10nm,sigma);fgf10(例如100ng/ml,peprotech);烟酰胺(10mm,sigma);a8301(500nm,tocris);hgf(50ng/ml,peprotech);用pge2(50nm)和/或aa(10μg/ml)补充的rspo条件培养基(10%,例如1μg/ml)。扩增培养基还可以包括rock抑制剂。
当扩增小鼠干细胞时,上述培养基可以不包括以下一种或多种:tgf-β抑制剂(例如a83-01)以及pge2。
发明人已发现这种培养基对于在最初几天刺激细胞的初始扩增是最佳的。因此,这种第一扩增培养基在本文有时称为em1。在一些实施方案中,在约1天、2天、3天、4天、5天、6天、7天或更多天,例如2周、1个月、5周、8周、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月以上、14个月以上之后,移除wnt和noggin。在一些实施方案中,然后在本发明的扩增培养基中扩增细胞,如上所述,所述扩增培养基不包括wnt或noggin。这种第二扩增培养基在本文有时称为em2。在一些实施方案中,在em2中培养基细胞约1天、2天、3天、4天、5天、6天、7天或更长时段,例如3周、4周、5周、10周、20周或更多周。然后,可以将培养基更换为优化分化培养基,如上所述,所述培养基包括tgf-β抑制剂和notch抑制剂。通常,分化培养基不包括wnt激动剂、r-spondin或烟酰胺。在一些实施方案中,分化培养基不包括前列腺素途径活化剂,例如pge2或aa。这激励了细胞趋于成熟肝细胞和胆管上皮细胞(cholangyocyte)的分化。这些细胞适于移植入人或动物。
用于肝脏的扩增培养基(em2):
在本发明的一方面,提供了细胞培养基,其包括用于动物或人细胞的基础培养基或由其组成,向所述基础培养基添加:作为促有丝分裂生长因子的上皮生长因子、能与fgfr2或fgfr4结合的fgf、优选fgf10,烟酰胺,以及优选的wnt激动剂,优选r-spondin1-4。这种培养基称为em2。这种“em2”培养基优选用于扩增肝细胞。
在一些实施方案中,em2包括前列腺素途径活化剂,例如pge2和/或aa。
在一些实施方案中,em2包括tgf-β抑制剂,例如a83-01。
优选地,wnt激动剂为r-spondin1-4。包括egf、r-spondin1-4、fgf和烟酰胺的培养基本文称为erfnic。
在一些实施方案中,em2培养基不包括noggin,并且更优选不包括bmp-抑制剂。在一些实施方案中,em2培养基不包括wnt,例如wnt-3a。
在一些实施方案中,除了fgf,还存在hgf。在除fgf还包括hgf的优选培养基为erfhnic(egf+r-spondin(优选r-spondin1-4)+fgf(优选fgf10)+hgf+烟酰胺+前列腺素途径抑制剂如pge2和/或aa和tgf-β抑制剂。发明人已发现含tgf-β抑制剂和前列腺素途径活化剂的erfhnic培养基是用于长期扩增细胞的优化培养基。在不存在hgf的情况下,细胞在培养基中保持活性不长于3个月。此外,在不存在hgf的情况下,在10次传代之后,细胞与存在hgf的情况下培养的细胞相比表现出生长劣势,如由更低的增殖比而证明的。特别地,在15次传代之后,细胞在不存在hgf的情况下不以与存在hgf的情况下相同的速率比生长类器官。因此,发现hgf对于在长期培养期间维持良好的增殖速率而言是必要的。因此,本发明提供了本发明的erfhnic培养基用于培养细胞至少2周、至少1个月、至少2个月、更优选至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少15个月、至少20个月、至少24个月、至少25个月、至少30个月以上、例如3年以上的用途。在实践中,本发明的一些实施方案包括em2用于细胞的约20-50次传代的用途。例如,细胞可以每周一回地分割4-8次,连续7-10周。优选地,细胞会以每周约4-5倍或者多于一周2次群体倍增的速率而扩增。本发明还提供了本发明的erfhnic培养基用于培养细胞至少8次传代、例如至少9次、至少10次、至少11次、至少12次、至少15次、至少20次、至少25次、至少30次、至少40次、至少50次、至少60次传代,或15-35次传代、例如约20-30次传代的用途。在一些实施方案中,tgf-β抑制剂如a83-01也存在于em2培养基中。这当培养人细胞或类器官时是特别可用的。在一些实施方案中,a83-01以400-600nm、例如450-550nm、470-530nm或约500nm的浓度存在。在其中tgf-β抑制剂存在于em2的实施方案中,优选不存在notch抑制剂。在一些实施方案中,em2还包括p38抑制剂。
用于肝脏的扩增培养基(em1):
在一方面,本发明提供了包括用于动物或人细胞的基础培养基或由该基础培养基组成的细胞培养基,向所述基础培养基添加egf、bmp抑制剂、r-spondin、wnt。优选地,bmp抑制剂为noggin,并且em1培养基称为“enrw”(egf、noggin、r-spondin和wnt(例如wnt3a))。这种培养基称为em1。在一些实施方案中,em1还包括前列腺素途径活化剂,例如pge2和/或aa。在一些实施方案中,em1包括tgf-β抑制剂,例如a83-01。更优选地,em1还包括前列腺素途径活化剂和tgf-β抑制剂。发明人已发现含wnt和noggin的培养基对于刺激细胞的初始扩增是理想的。因此,在一些实施方案中,仅使用em1培养基进行1次传代或1周,但还预期可使用em1培养基约1年,因为其对于细胞不是有害的。因此,在一些实施方案中,em1培养基用于培养细胞,从第0天至第10天,例如,从第0-7天、第0-6天、第0-5天、第0-4天、第0-3天、第0-2天、第0-1天,其中第0天为细胞与其来源的组织分离的那天,并且第1天为次日;或者用于1周以上,例如2、3、4周或更多周或1、2、3、4、5、6、7、8、9、10、11、12个月或更久。在一些实施方案中,em1培养基仅用于第一天或最初两天的培养。在一些实施方案中,em1培养基用于1次以上的传代,例如1、2、3、4、5、6、7、8、9、10、15、20、25、30次以上的传代,例如20-30次传代、30-35次传代、32-40次传代或更多次。在一些实施方案中,在冷冻步骤或涉及不与最佳生长相结合的培养基或温度变化的任何其他运输步骤之后,使用em1培养基。这种“em1”培养基优选用于扩增肝细胞。
用选自fgf、hgf、烟酰胺、胃泌激素、b27、n-乙酰半胱氨酸和n2的化合物中一种或多种来补充em1培养基。在从冷冻的原料或从单细胞开始培养的情况下,优选用rock抑制剂补充em1培养基。y27632是优选的用于本发明的rock抑制剂。
因此,在一实施方案中,提供了包括用于动物或人细胞的基础培养基或由该基础培养基组成的细胞培养基,向所述基础培养基添加:作为促有丝分裂生长因子的上皮生长因子、fgf(例如,能与fgfr2或fgfr4结合的fgf)、优选fgf10和hgf,
前列腺素途径活化剂,例如pge2和/或aa;
tgf-β抑制剂;
胃泌激素、烟酰胺、b27、n2和n-乙酰半胱氨酸,并且优选地;
bmp抑制剂,优选noggin;以及
wnt激动剂,优选r-spondin1和/或wnt-3a。
还可以向上述培养基添加b27(invitrogen)、n-乙酰半胱氨酸(sigma)和n2(invitrogen)、胃泌激素(sigma)和烟酰胺(sigma),并且认为控制细胞增殖且有助于dna稳定性。在本文的情形中,烟酰胺还称为“nic”。
‘n2补充剂’可得自invitrogen,carlsbad,ca;www.invitrogen.com;编号17502-048;以及得自paalaboratoriesgmbh,pasching,austria;www.paa.com;编号f005-004;bottenstein&sato,pnas,76(1):514-517,1979。n2补充剂由paalaboratoriesgmbh以100×液体浓缩物形式提供,其包括500μg/ml人转铁蛋白、500μg/ml牛胰岛素、0.63μg/ml前列腺素、1611μg/ml腐胺以及0.52μg/ml亚硒酸钠。n2补充剂可以以浓缩物形式添加至培养基,或在添加至培养基之前被稀释。其可以以1×最终浓度或其他最终浓度来使用。n2补充剂的使用是将转铁蛋白、胰岛素、前列腺素、腐胺和亚硒酸钠并入本发明培养基的便利方式。在一些其中培养基包括b27的实施方案中,其还不包括n2。因此,当根据需要存在b27时,本发明的实施方案可以适于不包括n2。
‘b27补充剂’(可得自invitrogen,carlsbad,ca;www.invitrogen.com;目前编号17504-044;以及得自paalaboratoriesgmbh,pasching,austria;www.paa.com;编号f01-002;brewer等人,jneuroscires.,35(5):567-76,1993)可用于配制包括生物素、胆固醇、亚油酸、亚麻酸、前列腺素、腐胺、视黄醇、乙酸视黄酯、亚硒酸钠、三碘化甲状腺氨酸(t3)、dl-α生育酚(维生素e)、白蛋白、胰岛素和转铁蛋白的培养基。b27补充剂由paalaboratoriesgmbh以液体50×浓缩物形式提供,其还包括生物素、胆固醇、亚油酸、亚麻酸、前列腺素、腐胺、视黄醇、乙酸视黄酯、亚硒酸钠、三碘化甲状腺氨酸(t3)、dl-α生育酚(维生素e)、白蛋白、胰岛素和转铁蛋白。在这些成分中,至少亚麻酸、视黄醇、乙酸视黄酯和三碘化甲状腺氨酸(t3)为细胞核激素受体激动剂。b27补充剂可以以浓缩物形式添加至培养基,或在添加至培养基之前被稀释。其可以以1×最终浓度或其他最终浓度来使用。b27补充剂的使用是将生物素、胆固醇、亚油酸、亚麻酸、前列腺素、腐胺、视黄醇、乙酸视黄酯、亚硒酸钠、三碘化甲状腺氨酸(t3)、dl-α生育酚(维生素e)、白蛋白、胰岛素和转铁蛋白并入本发明培养基的便利方式。
例如,细胞培养基可以包括基础培养基或由其组成,向所述基础培养基添加:补充有fgf10、hgf和烟酰胺的egf和r-spondin1;例如补充有fgf10(100ng/ml)、hgf(25-50ng/ml)、烟酰胺(1-10mm)、前列腺素途径活化剂如pge2(50nm)和/或aa(10ug/ml)以及tgf-β抑制剂如a83-01(500nm)补充的egf(50ng/ml)和r-spondin1(1μg/ml)。在一些实施方案中,培养基还包括p38抑制剂。发明人已发现,这种培养基可用于长期扩增细胞。因此,这种细胞培养基优选用作本发明的em2。基础培养基优选补充有b27、n2和200ng/mln-乙酰半胱氨酸。在一些实施方案中,基础培养基为改进型-dmem/f12。然而,可以使用任何其他合适的基础培养基。
细胞培养基及使用这种培养基的方法的另一实例包括改进型-dmem/f12或由其组成,所述改进型-dmem/f12优选补充有b27、n2、200ng/mln-乙酰半胱氨酸、50ng/mlegf、1μg/mlr-spondin、10nm胃泌激素、100ng/mlfgf10、10mm烟酰胺、50ng/mlhgf、50%wnt条件培养基、前列腺素途径活化剂如pge2(50nm)和/或aa(10ug/ml)以及tgf-β抑制剂如a83-01(500nm)且优选10-100ng/mlnoggin。wnt条件培养基包括改进型dmem、p/s、b27、n2且还包括fcs。转染有wnt3a表达质粒的293t细胞产生wnt。在数天之后采集整个培养基(即,具有分泌的wnt)并用作wnt源。
因此,本发明提供了细胞培养基,其包括用于动物或人细胞的基础培养基或由该基础培养基组成,向所述基础培养基添加:
作为促有丝分裂生长因子的上皮生长因子、能与fgfr2或fgfr4结合的fgf、优选fgf10以及hgf,
前列腺素途径活化剂,例如pge2和/或aa,
tgf-β抑制剂,
胃泌激素、烟酰胺、b27、n2和n-乙酰半胱氨酸,并且优选地
bmp抑制剂,更优选noggin,以及
wnt激动剂,更优选r-spondin1和/或wnt-3a。
因此,本发明提供了第一优选培养基,其包括用于动物或人细胞的基础培养基或由该基础培养基组成,向所述基础培养基添加:
作为促有丝分裂生长因子的上皮生长因子、fgf10以及hgf,
前列腺素途径活化剂,例如pge2和/或aa,
tgf-β抑制剂,
胃泌激素、烟酰胺、b27、n2和n-乙酰半胱氨酸,
bmp抑制剂,更优选noggin,以及
wnt激动剂,更优选r-spondin1和wnt-3a。
在一些实施方案中,向扩增培养基添加p38抑制剂。
这种培养基可用作本发明的em1细胞培养基以刺激细胞的初始扩增。在一些实施方案中,作用em1细胞培养基的培养基包括本发明的em2培养基的所有组分并且还包括wnt-3a和noggin。
在其中用n-乙酰半胱氨酸、b27和n2补充基础培养基的实施方案中,优选向培养基添加以下:egf、r-spondin1、胃泌激素、fgf10、烟酰胺和hgf及wnt-条件培养基以及前列腺素途径活化剂如pge2和/或aa。优选地,用n-乙酰半胱氨酸、egf、r-spondin1、胃泌激素、fgf10、烟酰胺和hgf及wnt-条件培养基以及前列腺素途径活化剂如pge2和/或aa以上文所述的量来补充基础培养基。优选地,tgf-β抑制剂还以本文所述的量存在。
例如,在一些实施方案中,可以用150ng/ml至250ng/ml的n-乙酰半胱氨酸补充基础培养基;优选地,用约200ng/ml或精确为200ng/ml的n0乙酰半胱氨酸补充基础培养基。例如,在一些实施方案中,可以用40ng/ml至60ng/ml的egf补充基础培养基;优选地,用约50ng/ml或精确为50ng/ml的egf补充基础培养基。例如,在一些实施方案中,可以用0.5μg/ml至1.5μg/ml的r-spondin1补充基础培养基;优选地,用约1μg/ml或精确为1μg/ml的r-spondin1补充基础培养基。例如,在一些实施方案中,可以用5nm至15nm的胃泌激素补充基础培养基;优选地,用约10nm或精确为10nm的胃泌激素补充基础培养基。例如,在一些实施方案中,可以用25ng/ml至200ng/ml的fgf10、例如70ng/ml至130ng/ml的fgf10补充基础培养基;优选地,用约100ng/ml或精确为100ng/ml的fgf10补充基础培养基。例如,在一些实施方案中,可以用5mm至15mm的烟酰胺补充基础培养基;优选地,用约10mm或精确为10mm的烟酰胺补充基础培养基。例如,在一些实施方案中,可以用25ng/ml至100ng/ml的hgf、例如35ng/ml至65ng/ml的hgf补充基础培养基;优选地,用约50ng/ml或精确为50ng/ml的hgf补充基础培养基。例如,在一些实施方案中,可以用35%至65%的wnt-条件培养基补充基础培养基;优选地,用约50%或精确为50%的wnt-条件培养基补充基础培养基。
例如,在一些实施方案中,用前列腺素信号转导途径的活化剂补充肝脏扩增培养基(参见图24)。例如,用选自以下的化合物中任一种或多种来补充肝脏扩增培养基:磷脂、花生四烯酸(aa)、前列腺素e2(pge2)、前列腺素g2(pgg2)、前列腺素f2(pgf2)、前列腺素h2(pgh2)、前列腺素d2(pgd2)。例如,在一些实施方案中,用pge2和/或aa补充肝脏扩增培养基。在一些实施方案中,向肝脏扩增培养基添加pge2直至最终浓度为至少10nm,例如10nm至500nm、10nm至400nm、10nm至300nm、10nm至200nm、10nm至100nm、20nm至50nm。在优选实施方案中,向肝脏扩增培养基添加pge2直至最终浓度为50nm。在一些实施方案中,向肝脏扩增培养基添加aa直至最终浓度为至少1μg/ml,例如1μg/ml至100μg/ml、1μg/ml至500μg/ml、1μg/ml至100μg/ml、1μg/ml至50μg/ml、或5μg/ml至10μg/ml。在优选实施方案中,向培养基添加aa直至最终浓度为10μg/ml。
在一些实施方案中,在细胞培养基中不存在胃泌激素和n2之一或二者。
优选地,基础培养基为改进型-dmem/f12。
这种第一培养基(例如,em1、em2或者em1和em2二者)优选在本发明的培养方法的最初两周内使用。然而,可以将其使用更短的时段,例如1、2、3、5、7或10天,或更长的时段,例如3、4、5、10、20周以上、5个月以上,例如6、7、8、9、10、11、12个月以上。
用于肝脏的分化培养基(dm):
在另一方面,提供了包括用于动物或人细胞的基础培养基或由该基础培养基组成的第二细胞培养基,向所述基础培养基添加:egf、tgf-β抑制剂、notch抑制剂和前列腺素途径活化剂如pge2和/或aa。发明人已发现这种培养基可用于分化细胞。用于分化细胞的培养基在本文可称为dm。
优选地,第二细胞培养基还包括fgf和/或hgf。
在一实施方案中,第二培养基包括用于动物或人细胞的基础培养基或由该基础培养基组成,向所述基础培养基添加:
作为促有丝分裂生长因子的上皮生长因子、fgf10以及hgf;
notch抑制剂;
tgf-β抑制剂;以及
前列腺素途径活化剂,例如pge2和/或aa。
在一实施方案中,tgf-β抑制剂为a83-01和/或notch抑制剂为dapt。在另一实施方案中,dm细胞培养基还包括地塞米松。在另一实施方案中,dm细胞培养基还包括制瘤素m。在另一实施方案中,dm细胞培养基还包括胃泌激素。
在实例中描述了优选的第二细胞培养基及使用这种培养基的方法,并且其包括基础培养基或由基础培养基组成,向所述基础培养基添加:50ng/mlegf、100ng/mlfgf10、50nma8301和10μmdapt。改进型-dmem/f12可以用作基础培养基,任何其他合适的基础培养基也一样。
在一些实施方案中,用于肝细胞、例如人肝细胞的分化培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)、谷氨酰胺/glutamax)、noggin(优选100ng/ml)、egf(优选50ng/ml)、胃泌激素(优选10nm)、tgf-β抑制剂如a83-01(优选50nm)以及γ-分泌酶抑制剂(dapt/dbz)(优选10μm)。
在一些实施方案中,用于肝细胞、例如小鼠肝细胞的分化培养基包括以下或由其组成:基础培养基(例如,包括改进型dmem/f12、b27(50x)、n-乙酰半胱氨酸(1mm)、谷氨酰胺/glutamax)、egf(优选50ng/ml)、fgf10(优选100ng/ml)、胃泌激素(优选10nm)、tgf-β抑制剂如a83-01(优选50nm)以及γ-分泌酶抑制剂(dapt/dbz)(优选10μm)。
在一些实施方案中,第二细胞培养基不包括r-spondin或wnt。在一些实施方案中,第二细胞培养基不包括wnt激动剂。在一些实施方案中,第二细胞培养基不包括烟酰胺。在一些实施方案中,第二细胞培养基不包括bmp抑制剂。在一些实施方案中,第二细胞培养基不包括前列腺素途径活化剂,例如pge2或aa。
发明人已发现r-spondin1和烟酰胺均抑制成熟肝细胞标志物cyp3a11的表达,但促进成肝细胞标志物白蛋白的表达。因此,为增加细胞向更成熟的肝脏最终细胞类型的分化,发明人从细胞培养基移除r-spondin和烟酰胺。发明人还已发现特异性胆转录因子的表达在包括r-spondin1的扩增培养基中被高度上调,表明培养基因表达是不平衡的,更趋于胆细胞最终细胞类型。notch和tgf-β信号转导途径已涉及体内胆细胞最终细胞类型。实际上,rbpj(对于实现活性notch信号转导是必要的)的缺失导致异常管腺发生(zongy.development2009),并且向肝脏外植体添加tgf-β促进了体外胆分化(clotmanf.genesanddevelopment2005)。因为notch和tgf-β信号转导途径在肝脏培养物中被高度上调(图22),所以发明人推断胆管细胞最终细胞类型的抑制可能触发细胞更趋于肝细胞表型的分化。已经发现向优选不包括r-spondin或wnt的分化培养基添加tgf-β抑制剂(例如a8301)和notch抑制剂(例如dapt)增强了成熟肝细胞标志物的表达并增加了肝细胞样细胞的数量(例如,参见实施例5)。
普通培养基
本发明的细胞培养基允许上皮干细胞或分离的隐窝在细胞外基质上存活和/或增殖和/或分化。在一些实施方案中,本发明的细胞培养基允许本发明的类器官在细胞外基质上存活和/或增殖和/或分化,所述类器官例如隐窝绒毛类器官、结肠类器官、胰腺类器官、胃类器官、巴雷特食管类器官、腺癌类器官或结肠癌类器官。在一些实施方案中,本发明的细胞培养基允许本发明的类器官在细胞外基质上存活和/或增殖和/或分化,所述类器官例如小肠(隐窝绒毛)类器官、结肠类器官、胰腺类器官、胃类器官、巴雷特食管类器官、腺癌类器官、癌类器官、结肠癌类器官、前列腺类器官或前列腺癌类器官。优选地,在其中存在tgf-β抑制剂和/或p38抑制剂的实施方案中,细胞培养基允许本发明的细胞群或类器官的存活和/或增殖、优选存活和增殖。优选地,其中tgf-β抑制剂和/或p38抑制剂最初存在于细胞培养基但随后从该培养基移除(例如通过当更新培养基时不添加所述抑制剂)的实施方案允许本发明的细胞群或类器官的存活和/或分化、优选存活和分化。
在一些实施方那中,向本文所述的培养基的任一种添加p38抑制剂。
术语细胞培养基(cellculturemedium)与培养基(medium)、培养基(culturemedium)或细胞培养基(cellmedium)同义。
本发明培养基的用途
本发明还提供了本发明培养基用于扩增和/或分化干细胞、干细胞群、组织碎块或类器官的用途。
在一些实施方案中,干细胞、干细胞群、组织碎块或类器官选自一种或多种肠干细胞、小肠隐窝、结肠隐窝、胃干细胞、肝脏干细胞、胰腺干细胞和前列腺干细胞。
在一些实施方案中,可从正常组织获得干细胞、干细胞群、组织碎块或类器官。
在一些实施方案中,可从病变组织、例如从腺瘤、癌、腺癌、患有囊性纤维化的患者的肠、或患有炎性肠疾病的患者的肠获得干细胞、干细胞群、组织碎块或类器官。
根据本发明培养的干细胞
在成年人和小鼠的许多器官中发现干细胞。尽管在各组织中的成体干细胞的精确特性可存在明显变化,但成体干细胞至少共有以下特性:它们保留未分化的表型;它们的后代可以以趋于在相关组织中存在所有世系的形式分化;它们在整个生命中保持自维持能力;以及它们能在损伤之后再生相关组织。干细胞存在于特有位置,即干细胞壁龛,其提供合适的细胞间接触和信号以维持干细胞群。本发明的干细胞优选表达lgr5。
在一实施方案中,本发明提供了细胞群或一种或多种根据本发明通过培养干细胞或组织碎块而产生或获得的包括该干细胞的类器官,所述类器官被培养至少3个月,优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久。
细胞“群”是大于1个细胞、优选至少1×103个细胞、至少1×104个细胞、至少1×105个细胞、至少1×106个细胞、至少1×107个细胞、至少1×108个细胞或至少1×109个细胞的诸多细胞。
根据本发明而培养基的本发明的干细胞可以为人干细胞。根据本发明而培养基的本发明的干细胞可以为上皮干细胞。
在一些实施方案中,本发明的和/或根据本发明而培养的干细胞不为胚胎干细胞。在一些实施方案中,本发明的和/或根据本发明而培养的干细胞不为人胚胎干细胞。优选地,本发明的干细胞为成体干细胞。
在优选实施方案中,干细胞可为人上皮干细胞。人上皮干细胞包括人上皮组织源的干细胞。这些包括但不限于胰腺组织、小肠组织、大肠组织、角膜组织、嗅觉组织、呼吸组织、胃组织、肝脏和皮肤、乳腺组织和/或前列腺组织,例如选自胰腺组织、小肠组织、大肠组织、角膜组织、嗅觉组织和呼吸组织的组织。上皮干细胞能形成由上皮组成的不同细胞类型。一些上皮、例如皮肤或肠表现出快细胞更替,表明所存在的干细胞必须连续增殖。其他上皮、例如肝脏或胰腺在正常条件下表现出非常慢的更替。
肠干细胞
小肠的自我更新上皮被划归为隐窝和绒毛(gregoreff和clevers,2005genesdev19,877-90)。沿着隐窝-绒毛轴的每一细胞被极化,由此在肠绒毛的顶部上的或在结肠隐窝的上部位置中的细胞为极其分化的,并且通过细胞凋亡而连续流失入腔内。存在于隐窝底部的干细胞的连续增殖以及存在于隐窝中部的祖细胞的大量增殖确保了适当替换脱落的细胞。在小鼠中所产生的上皮更新时间为5天。很早就已知自我更新的干细胞存在于隐窝底部附近,并产生能以趋于所有世系形式分化的迅速增殖的短暂扩充(ta)细胞。干细胞的估算数量为4-6个/隐窝(bjerknes和cheng,1999gastroenterology116,7-14)。由ta细胞形成三种分化的细胞类型,即肠上皮细胞、杯形细胞和肠内分泌细胞,并且在沿隐窝-绒毛轴的粘结带(coherentband)中继续它们的迁移。每一绒毛接受来自多个不同隐窝的细胞。在隐窝底部存在第四种主要的分化细胞类型,即,潘氏细胞。
结肠与小肠类似,但具有平整表面上皮而非绒毛。结肠隐窝的组织类似小肠隐窝。潘氏细胞不存在于结肠隐窝中;相反,存在所谓的“深隐窝分泌”细胞。上皮的平整表面包括分化的细胞(结肠上皮细胞和分泌细胞)。分化的杯形细胞在整个隐窝出现,还于短暂扩充细胞混合。
组织碎块和干细胞的分离
隐窝可与小肠和大肠分离,所述小肠和大肠包括十二指肠、空肠、回肠和结肠以及胃的幽门区域和胃体区域(根据技术人员已知的规约)。例如,隐窝可通过将分离的组织与螯合剂一起孵育而分离,所述螯合剂由其与基膜和基质类型的钙-和镁-依赖性相互作用而释放细胞。在洗涤组织之后,用载玻片从粘膜下层刮掉上皮细胞层,并切碎。之后,在胰蛋白酶或更优选在edta和/或egta中孵育,并且使用例如过滤和/或离心分离步骤从隐窝分离未消化的组织碎块和单细胞。可以使用其他蛋白水解酶、例如胶原酶和/或分散酶i来替代胰蛋白酶。类似的方法用于分离胰腺和胃的碎块。类似的方法可用于分离本文所述的其他组织的碎块。本发明的培养基适于培养这样的组织碎块(参见实施例1)。
本发明的培养基允许确立长期培养条件,在该条件下单隐窝经历多重隐窝裂变事件,而同时产生其中存在所有分化细胞类型的绒毛样上皮域。培养的隐窝在将它们引入培养物之后经历显著的形态变化。新分离的隐窝的上部开口被密封并且该区域逐渐膨胀且被凋亡细胞填充,很像凋亡细胞在绒毛尖端被夹断。隐窝区域经历连续的产生额外隐窝的芽殖事件,即,表明隐窝裂变的过程。在本发明的优选实施方案中,类器官包括隐窝状扩展,其包括所有分化的上皮细胞类型,包括增殖细胞、潘氏细胞、肠上皮细胞和杯形细胞。在类器官的任何阶段确认没有肌成纤维细胞或其他非上皮细胞。
芽殖隐窝结构的扩展产生了类器官,包括围绕被绒毛样上皮内衬且被凋亡细胞体填充的中央腔的隐窝样结构。隐窝-绒毛类器官包括被绒毛样上皮内衬的中央腔。以连续时间间隔打开腔以将内含物释放入培养基。
当培养单上皮干细胞时形成类似的隐窝-绒毛类器官结构。在约一周之后,形成与用完整隐窝获得的隐窝-绒毛类器官结构非常类似的结构。
分离干细胞的方法是已知的,并且技术人员可根据所用的干细胞类型来选择用于本发明的合适的方法。例如,可以使用与lgr5和/或lgr6(其为上皮干细胞上的独有细胞表面标志物)结合的化合物来进行上皮干细胞的分离。这样的化合物的实例为抗-lgr5和抗lgr6抗体。
在本发明的一些实施方案中,单lgr5+上皮干细胞(例如来自结肠、小肠或胰腺)可用于形成类器官,例如分别形成结肠、隐窝-绒毛或胰腺类器官。
在其他实例中,来自肝脏、前列腺或胃的单lgr5+上皮干细胞可用于获得类器官,例如分别获得肝脏、前列腺或胃的类器官。
在其他实施方案中,使用本文所述的方法和培养基,包括lgr5+干细胞的组织碎块、例如来自肠道的培养的隐窝,可以用于获得类器官。
在一些实施方案中,单lgr5+上皮干细胞或组织碎块可为癌干细胞或癌组织碎块,例如来自癌或腺癌。在一些实施方案中,单lgr5+上皮干细胞可为来自肿瘤病理或病变组织、例如巴雷特食管症、囊性纤维化或腺瘤的干细胞或组织碎块。从癌性、肿瘤或病变起始材料获得的类器官具有与体内起始材料类似的特性,因此可用作用于药物筛选、靶标确认、靶标发现、毒理和毒理筛选、个体化医疗、可再生医疗以及离体细胞/器官模型、例如疾病模型的研究工具。在一实施方案中,本发明提供了根据本发明方法通过培养人干细胞或组织碎块而产生或获得的类器官。在一实施方案中,本发明提供了根据本发明方法通过培养人干细胞或组织碎块而产生或获得的隐窝-绒毛类器官或胃类器官或胰腺类器官或结肠类器官或巴雷特食管类器官或腺癌类器官或结肠癌类器官。在一实施方案中,本发明提供了根据本发明的方法通过培养人干细胞或组织碎块而产生或获得的前列腺类器官。根据本发明方法通过培养人干细胞或组织碎块而产生或获得的此类类器官群、例如隐窝-绒毛、胃或胰腺类器官可各自包括多于10个、优选多于20个、更优选多于40个类器官。所述类器官的集合优选包括包括至少10%的活细胞、更优选至少20%的活细胞、更优选至少50%的活细胞、更优选至少60%的活细胞、更优选至少70%的活细胞、更优选至少80%的活细胞、更优选至少90%的活细胞。可以在facs中使用赫斯特染色或碘化丙啶染色来评价细胞的活性。
发明人已表明,本发明的培养基和方法可用于癌细胞系的培养,所述癌细胞系包括结肠直肠癌和腺癌(参见实施例1)。如实施例1所述,培养技术可广泛用作用于感染性、炎性和肿瘤病理的研究工具。因此,本发明的干细胞可为癌干细胞。在本发明的一些实施方案中,癌干细胞可形成腺癌或结肠癌类器官。在一些实施方案中,这些类器官包括的细胞为ki67+(thermoscientific*cellomics,millipore)。
同样地,发明人已表明,本发明的培养基和方法可用于培养具有其他病变基因型和/或表型的干细胞。例如,可使用本发明的培养基和方法来扩增从患有囊性纤维化的患者采集的肠干细胞。这些干细胞保持囊性纤维化基因型和表型。因此,在本发明的一些实施方案中,从患有疾病的患者采集干细胞,所述疾病例如囊性纤维化、炎性肠疾病(例如克罗恩病)、癌、腺瘤(adenoma)、腺癌(adenocarcinoma)、结肠癌、糖尿病(例如i型或ii型)、巴雷特食管症、高雪氏病、α-1-抗胰蛋白酶缺乏症、lesch-nyhan综合征、贫血、schwachman-bodian-diamond综合征、真性红细胞增多症、原发性骨髓纤维化、糖原贮积症、家族性高胆固醇血症、crigler-najjar综合征、遗传性酪氨酸血症、庞倍氏症、进展性家族性胆汁郁积症、赫尔勒综合征、scid或渗漏性scid、omenn综合征、软骨-毛发发育不全、单纯疱疹性脑炎、硬皮病、成骨不全症、贝克肌营养不良、杜氏肌营养不良、先天性角化不良等。在本发明的一些实施方案中,可以通过培养从患有疾病的人或动物采集的干细胞来获得病变类器官。病变类器官仍具有获取它们的组织的特性。因此,从小肠隐窝生长的囊性纤维化小肠类器官在小肠类器官所定义的范围内。同样地,结肠癌类器官在结肠类器官所定义的范围内。
对于癌干细胞的定义,在文献中存在一些混淆。在此,我们遵循最近aacr研讨会(clarke等人,2006.cancerres.66:9339-44)所达成的共识,其表明癌干细胞“是在具有自我更新能力的肿瘤内并产生包括该肿瘤的癌细胞的异质世系的细胞”。因此,癌干细胞可以仅通过它们重现连续生长的肿瘤的产生的能力来在实验上定义。在文献中可替代的术语包括肿瘤起始细胞和肿瘤发生细胞。用于癌干细胞活性的测试需要解决自我更新的潜能和肿瘤增殖的潜能。金标准测试目前是连续异种移植入免疫缺陷小鼠。此外,在本发明情形中的癌干细胞通常表达lgr5。然而,在一些实施方案中,还可通过本发明的培养基和方法培养不表达lgr5的癌起始/增殖/干细胞。
干细胞以包括该干细胞的类器官的基因组和表型完整性
用于干细胞及其分化后代的临床和研究应用需要提供合适品质的细胞群的可再现干细胞培养方法。通常,干细胞的体外扩增旨在提供尽可能类似其体内相对物的细胞群。这种性质本文称为细胞的“基因组和表型完整性”。通过培养病变细胞、例如癌细胞或囊性纤维化细胞而获得的类器官还与它们的体内相对物类似,即,它们保持其病变基因型和/或表型,因此还保持其“基因型和表型完整性”,意即它们保持表明体内情形的疾病的基因或表型不稳定特性。因此,在一些实施方案中,本发明提供给了从健康组织获得的“正常”类器官。在其他实施方案中,本发明提供了从病变组织获得的“疾病”类器官,例如癌类器官(例如,结肠癌类器官或腺癌类器官)或囊性纤维化小肠类器官。
发明人首次发现可以在培养物中以最小损失基因型和表型完整性的方式扩增人上皮干细胞至少3个月、优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久(参见实施例1)。在本发明的改进的培养条件下,人肠类器官表现出芽殖类器官结构,而非在先前培养条件下所见的囊状结构。在从三个不同供体采集的20个细胞的每一个细胞中,大于3月龄的类器官的中期分裂相一致地显示出46个染色体。此外,微阵列分析显示培养物中的干细胞具有与包括肠干细胞基因的肠隐窝细胞类似的分子标签。
因此,在一些实施方案中,本发明提供了以最小损失基因组和表型完整性的形式生长至少3个月、优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久的类器官。
在一些实施方案中,本发明提供了包括芽殖结构的人肠类器官。在本发明的一些实施方案中,人肠类器官不包括囊状结构。在本发明的一些实施方案中,人肠类器官包括比囊状结构更多的芽殖结构。本发明人还例示了由本发明的培养基和方法产生的人肠类器官模拟了对外部因子反应的体内最终细胞类型决定。例如,先前已经表明,肠干细胞中的notch抑制终止了肠上皮增殖并诱导杯形细胞体内增生。本发明人还表明,本发明的肠类器官当用notch抑制剂处理时中断增殖并且大部分细胞在3天内转化成杯形细胞。
这些结果表明与先前方法和培养基相比,本发明的方法和培养基所产生的对干细胞和类器官的基因组和表型完整性的显著改进。
能通过染色体组型分析来确认本发明的干细胞的基因组完整性。使用sato,t等人,singlelgr5stemcellsbuildcrypt-villusstructuresinvitrowithoutamesenchymalniche.nature459,262-265,2009中描述的已知方法可以对干细胞及其后代进行染色体组分类。
“正常染色体组型”是其中所有染色体均存在(即整倍性)且没有明显改变的染色体组型。因此,在本发明的优选实施方案中,在1、2、3、4、5、6、9、12个月或更久之后,在扩增群中多于50%、多于70%、多于80%、多于90%、多于95%或多于99%的干细胞和分化细胞表现出正常染色体组型。术语“扩增群”包括类器官。
“正常表型”是指大致表现出与平均体内相对细胞相同的视觉特性、基因表达和行为的细胞。因此,在本发明的优选实施方案中,在1、2、3、4、5、6、9、12个月以上之后,在根据本发明而培养的扩增群中多于50%、多于70%、多于80%、多于90%、多于95%或多于99%的干细胞表现出正常表型。
例如,可以通过类器官外部的死亡细胞的数量、与囊状生长相比类器官的“芽殖”量(芽殖结构是优选的)以及单层上皮细胞的整体完整性(例如柱形鳞状表型)来判断视觉上正常的表型。此外,所存在的细胞类型可以有助于判断类器官是否是视觉上“正常的”。
以下概述本发明的干细胞和类器官的优选性质。
干细胞标志物
当本文提及小鼠基因时,本发明的人类器官可以具有类似的基因谱,但其中用人基因相对物替代小鼠基因。因此,本发明还提供了具有本文所述的基因表达谱但涉及相对应的人基因的人类器官。技术人员会易于获得本文所列举的小鼠基因的人相对物。
在一实施方案中本发明提供了由lgr5的天然表达表征的成体干细胞群。在优选实施方案中,本发明提供了由至少lgr5和一个或多个(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23个)选自以下的干细胞标志物的天然表达表征的成体干细胞群:lgr4、epcam、cd24a、cdca7、轴蛋白、ck19、巢蛋白、生长激素抑制素、cxcr4+、cd133+、dcamkl-1、cd44、sord、sox9、cd44、prss23、sp5、hnf1α、hnf4a、sox9、krt7和krt19、tnfrsf19。干细胞标志物可以为组织特异性的。例如,胰腺干细胞或类器官可以由以下的一个或多个(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个,例如1、2、3或4个)的显著水平的天然表达来表征:ck19、巢蛋白、生长素抑制剂、胰岛素、胰高血糖素、cxcr4+、ngn3、pdx1、neurod、nkx2.2、nkx6.1、pax6、mafa、hnf1b、任选的tnfrsf19;胃类器官可以由以下的一个或多个(例如1、2、3或4个)的显著水平的天然表达来表征:cd133+、dcamkl-1、cd44、任选的tnfrsf19;以及隐窝-绒毛类器官可以由以下的一个或多个或全部(例如1或2个)的显著水平的表达来表征:sord和/或prss23,或由表/图14的所有基因的例如显著水平的表达来表征。
在标志物表达的情形中本文所用的术语“显著水平”与以下所述的术语“可检测水平”同义使用。
小肠和胃类器官细胞群还表达小肠和胃共有的祖先群的标志物,例如cd44和sox9之一或二者(barker&huch等人,cellstemcell2010)。这些在本发明的干细胞中高度表达。本发明该方面的细胞还可以上调wnt靶标基因,包括例如mmp7、sp5、tnfrs19和轴蛋白2的之一、二者或全部。这提供了以下需求的强有力的证据,即对维持这些培养物的自我更新能力的活性且稳健的典型wnt信号转导能力的需求。
发明人已观察到,在早期类器官中以比分化细胞显著更高的水平存在“干细胞”基因的表达,所述分化细胞成为这些干细胞的后代。例如,在本发明的类器官中优选表达基因lgr5、lgr4、epcam、cd44、tnfrsf19、sox9、cd24a、sp5、prom1/cd133、cdca7,但当胰腺、肝脏、小肠和结肠类器官分化时优选被显著下调。此外,在本发明的类器官中优选表达基因rnf43和znrf3。
“天然表达”表示细胞未以任何方式被重组地加工,即,未通过引入外源基因材料、例如引入异质(非天然)或更强的启动子或其他与内源基因或该基因的外源引入形式可操作地连接的调控序列来人工地引导细胞表达这些标志物或调节这些标志物的表达。天然表达来自细胞内的基因组dna,包括编码序列的外显子(当这些存在时)之间的内含子。天然表达不来自cdna。天然表达若需要可以由多种方法中的任一种来确认,例如从基因的阅读框内测序以检查不存在外源异质序列。“成体”表示胚胎后。对于本发明的干细胞,术语“成体干细胞”表示干细胞在比胚胎期更晚的生长阶段与动物的组织或器官分离。
这种干细胞群还由某些标志物的任何显著水平的天然表达的缺失来表征,所述标志物中许多与细胞分化相关。具体地,分离的成体干细胞群的细胞不以显著水平天然表达以下中的一种或多种:cd11b、cd13、cd14、afp、pdx1、任何cyp成员(例如cyp3a11、cyp11a1)。如本文所定义,这些标志物被称为负标志物。
检测标志物和分离细胞
术语“表达的”用于描述标志物在细胞内的存在。为了被认为是表达的,标志物必须以可检测水平存在。“可检测水平”表示可以使用诸如pcr、印迹或facs分析的标准实验室方法之一来检测到标志物。如果表达可以在30次pcr周期之后被合理地检测到(相当于细胞的表达水平为约100个拷贝/细胞),则基因被认为由本发明的群的细胞表达。术语“表达(express)”和“表达(expression)”具有一致的含义。表达水平低于此阀值时,认为标志物未表达。标志物在本发明细胞中的表达水平与同一标志物在另一细胞(例如胚胎干细胞)中的表达水平之间的比较,可优选通过比较从从同一物种分离的两种细胞类型来进行。优选的,该物种为哺乳动物,并且更优选地,该物种为人。这样的比较可方便地利用逆转录酶-聚合酶链反应(rt-pcr)实验来进行
在一些实施方案中,如果在本发明的细胞群或类器官中的至少约5%(例如,至少10%、至少20%、至少30%、至少40%、至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少98%、至少99%或100%)的细胞表现出标志物的表达,则本发明的细胞群或类器官被认为表达标志物。
在一些实施方案中,如果与持家基因gadph的mrna数量相比,细胞包括1×102至1×105、例如5×102至1×104或1×103至1×104倍以上的编码细胞标志物的mrna拷贝,则该细胞以显著水平表达细胞标志物。
在一些实施方案中,基因于在扩增培养基中培养的本发明的类器官或细胞中的表达与在分化培养基或在完全分化的成体组织中培养类器官或细胞相比为更高数倍(例如,至少1.5倍、2倍、3倍、4倍、5倍)。在一些实施方案中,本发明的细胞或类器官在分化条件下培养时与在扩增条件下培养的本发明的细胞或类器官相比表现出基因(其已知为分化基因)表达的增加,并且与在扩增培养基中培养的本发明的细胞或类器官相比还表现出至少一种或多种干细胞/祖基因的表达水平的降低。
本领域内已知的许多物理分离方法中的任何一种都可用于选择本发明此方面的细胞,并且将其与其他细胞类型进行区别。这样的物理方法可包括基于由本发明的细胞特异性表达的标志物的facs和各种免疫-亲和方法。如上所述,lgr5、cd44和sox9是在本发明的干细胞中以高水平表达的3种细胞标志物。因此,仅以例示方式,本发明的干细胞可通过许多物理分离方法来分离,这依赖于这些标志物的存在。
在一实施方案中,本发明的细胞可通过利用例如针对这些标志物之一的抗体的facs来分离。荧光激活细胞分选(facs)可用于检测特性细胞类型或世系的标志物特性。如本领域技术人员所显而易见的,这可通过荧光标记的抗体,或通过荧光标记的具有与一抗结合特异性的二抗来实现。合适的荧光标记的实例包括但不限于fitc、alexa
对本领域技术人员显而易见的是,利用抗-lgr5抗体的facs分析将提供纯化的干细胞群。然而,在一些实施方案中,可优选进一步通过利用其他可识别的标志物中的一种或多种进行另一次facs分析来纯化细胞群。
免疫组织化学还用于了解生物标志物和分化表达的蛋白在细胞群或类器官的不同部分中的分布和定位。可以以许多方式来实现可视化抗体-抗原相互作用,所述方式在本领域是公知的,例如在barker等人,identificationofstemcellsinsmallintestineandcolonbymarkergenelgr5.nature,2007oct25;449(7165):1003-7中所述的那些。
在另一实施方案中,本发明的细胞可以通过免疫-亲和纯化来分离,其为本领域公知的分离方法。仅通过例示方式,本发明的细胞可通过针对c-kit的免疫-亲和纯化来分离。如本领域技术人员所显而易见的,该方法依赖于抗体在纯化柱上的固定。然后,将细胞样品负载到柱上,使合适的细胞被抗体结合,由此与该柱结合。在洗涤步骤之后,使用优先与固定的抗-c-kit抗体结合并允许细胞从柱释放的竞争物将细胞从柱洗脱。对本领域技术人员显而易见的是,利用固定抗体的免疫-亲和纯化会提供纯化的细胞群。然而,在一些实施方案中,可以优选进一步通过利用其他可识别的标志物中的一种或多种进行另一次免疫-亲和纯化来纯化细胞群,并且利用等份的分离的克隆来确定其他相关细胞内标志物的表达。
对本领域技术人员显而易见的是,lgr5或干细胞纯化可在许多纯化步骤之后,所述纯化步骤例如用本领域已知的方法纯化上皮、例如上皮的edta纯化或epcamfacs分选。
对本领域技术人员显而易见的是,连续的纯化步骤并非必须需要涉及相同的物理分离方法。因此,明显的是,例如,细胞可通过利用抗-lgr5抗体的facs步骤,之后通过利用ssea-1亲和柱的免疫-亲和纯化步骤来纯化。在某些实施方案中,分离之后可将细胞培养至少约15天、至少约20天、至少约25天或至少约30天。在某些方面,将细胞在培养物中扩增更长时间以提高细胞群中细胞表型的同质性。
微阵列分析、聚类分析和比较基因表达谱可用于比较群表型与原始母细胞或合适的体内相对物的表型(satot等人,panethcellsconstitutethenicheforlgr5stemcellsinintestinalcrypts.nature469415-418)。
lgr5+干细胞的世系示踪表明在类器官中隐窝-绒毛特性的保留。
在另一实施方案中,高含量分析可用于评价本发明干细胞的表型完整性。例如,存在许多高含量筛选试剂盒和平台,例如点扫描4色imagexpressultra(moleculardevices,unioncity,usa)、bdbiosciences的涡流盘(尼普科夫盘)pathway855和435(先前为attobiosciences,rockville,maryland)、opera(perkinelmerinc.,waltham,ma)和狭缝扫描incell3000(ge/amershambiosciences,cardiff,uk)、arrayscanvti(cellomics(cellomics))、incellanalyzer2000(gehealthcarepiscataway,newjersey,usa)、acumenex3(ttplabtechltd(acumenex3))、scanalyzer(scanalyzerlemnatec,aachengermany)和imagexpressmicro(moleculardevices,unioncity,usa)、incell1000(ge/amershambiosciencespiscataway,newjersey,usa)、pathwayht(bectondickinsonbiosciences)和imagexpressmicro(moleculardevices,unioncity,usa)、scan^r(olympussoftimagingsolutions,germany)。
涂板密度
在本发明的一些实施方案中,通常接种单细胞混悬液或细胞小簇(2-50个细胞/簇),而非细胞大簇,如本领域已知的。随着它们分裂,这样的细胞被以促进细胞增殖的密度接种到支持物上。通常,当单细胞分离时,所用的涂板密度为至少1-500个细胞/孔,孔表面为0.32cm2。当接种簇时,涂板密度优选为250-2500个细胞/cm2。对于再涂板,可以使用的密度为约2500个细胞/cm2至约5,000个细胞/cm2。在再涂板期间,通常接种单细胞混悬液或细胞小簇,而非细胞大簇,如本领域所已知的。
进一步分化
在本发明的一些实施方案中,可撤回扩增培养基的某些组分以使培养的细胞的最终细胞类型变化为趋于分化。可从培养基撤回用于维持未分化状态和/或活化干细胞或组基因程序的培养基的任何组分。
在本发明的一些实施方案中,本发明抑制剂的撤回可以使类器官的细胞分化为成熟细胞,例如在隐窝-绒毛类器官中的成熟杯形细胞和肠内分泌细胞。因此,在一些实施方案中,本发明提供了使用不包括本发明抑制剂的第二培养基来进一步分化类器官的方法。例如,参见
实施例1。
例如,在一些实施方案中,从细胞培养基撤回tgf-β抑制剂和/或p38抑制剂以使细胞分化。组分从细胞培养基的“撤回(withdrawn)”或“撤回(withdrawal)”表示当再涂板细胞且更换培养基时,不向新鲜的培养基添加该组分。
在一些实施方案中,wnt存在于扩增培养基中,但不存在于分化培养基中。例如,一些实施方案包括wnt的撤回以用于将结肠类器官分化为成熟肠上皮细胞。还可撤回wnt以使隐窝-绒毛类器官分化。
在一些实施方案中,rspondin存在于扩增培养基中,但不存在于分化培养基中。例如,一些实施方案包括rspondin的撤回以用于将结肠类器官分化为成熟肠上皮细胞。还可撤回rspondin以使隐窝-绒毛类器官分化。在一些实施方案中,可以撤回rspondin和wnt以使隐窝-绒毛类器官分化。
在一些实施方案中,烟酰胺存在于扩增培养基中,但不存在分化培养基中。因此,在一些实施方案中,从细胞培养基撤回烟酰胺和sb202190(或另一p38抑制剂)以使细胞分化为例如隐窝-绒毛类器官或结肠类器官。
因此,获得分化的细胞或类器官的方法可以包括在包括tgf-β和/或p38抑制剂的本发明培养方法中培养上皮细胞以使细胞存活和/或增殖(即,扩增培养基),然后继续培养细胞并补充培养基,其中补充的培养基不包括tgf-β和/或p38抑制剂(即,分化培养基)。
在一些实施方案中,分化培养基包括额外的组分。例如,在一些实施方案中,分化培养基包括γ分泌酶抑制剂,例如dapt或dbz。在一些实施方案中,分化培养基包括rank配体(本文还称为rankl)。如上所述,γ分泌酶抑制剂的添加可引导肠类器官细胞、例如小肠类器官细胞的分化趋于分泌细胞、例如杯形细胞。向培养基添加rankl可引导分化肠类器官细胞、例如小肠类器官细胞趋于m细胞。
在一些实施方案中,本发明提供了用于从目标组织分化干细胞的培养基,其中所述培养基包括用于从目标组织类型扩增干细胞的培养基的组分或由其组成,但是其中所述用于分化干细胞的培养基不包括以下的一种或多种:wnt、rspondin、bmp抑制剂、tgf-β抑制剂、受体酪氨酸激酶配体、p38抑制剂和烟酰胺。
此外,本发明提供了用于扩增单干细胞、干细胞群或组织碎块优选产生类器官的方法,其中所述方法包括:
在第一扩增培养基中培养干细胞、干细胞群或组织碎块;
继续培养所述干细胞、干细胞群或组织碎块并且用分化培养基补充所述培养基,其中所述分化培养基不包括选自以下的一种或多种因子、优选不包括所有所述因子:tgf-β抑制剂、p38抑制剂、烟酰胺和wnt。
通常,当组分被描述为从培养基“移除”时,其表示当补充培养基时不添加该组分,即补充的培养基不包括该组分。当培养基被“补充”时,其可以表示从细胞外基质物理移除培养基,然后用新鲜的培养基替换。
对于结肠、肝脏和胰腺,在扩增培养基中存在非常少的分化细胞。仅在用分化培养基补充扩增培养基时,细胞才开始分化。在该阶段,类器官还开始损失其干细胞。分化的类器官可适于某些用途,例如(但不限于)移植、代谢疾病的药物筛选、毒理(例如使用包括肝细胞的肝脏类器官),以及适于研究小肠的抗菌功能。扩增的类器官可以通常更适于其他用途,例如(但不限于)再生医疗和药物筛选,例如用于癌或囊性纤维化。扩增的类器官通常具有比分化的类器官更大的生长潜能(因此,更加长寿)。在一些实施方案中,结肠、肝脏和胰腺类器官不进一步分化。
小肠和前列腺类器官与结肠、肝脏和胰腺类器官不同,因为它们维持扩增的干细胞群并同时还分进行分化。它们不需要在单独的分化培养基中培养以使分化的细胞类型存在。它们可以被认为具有扩增和分化的类器官的性质。然而,为了实现小肠类器官的完全分化,它们可以在单独的分化培养基中培养,所述分化培养基优选不包括wnt3a并优选包括γ分泌酶抑制剂和/或rank配体(本文还称为rankl)。“完全”分化表示存在所有分化的细胞类型,包括杯形细胞、神经内分泌细胞、丛细胞、m-细胞、肠上皮细胞和潘氏细胞。在扩增类器官中还存在(有时以更小的量)这些分化细胞类型中的一些,例如潘氏细胞。
类器官
上述细胞生长成类器官。因此,通过本发明的方法而获得的类器官是本发明的另一方面。还提供了本文所述的类器官。类器官优选为人类器官。尽我们所知,以下是首次的,即所获得的人类器官在延长的时段(即,至少3个月,优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久的培养,参见本文所包括的实施例)之后为功能性的且是活着的。功能性优选通过组织特异性标志物的存在和/或通过本文所定义的类器官的结构来表征。因为,所获得的类器官的最终量与持续时间相关,所以技术人员会理解本发明是开创性发明并可能在例如再生医疗方面开启新的发展可能。因此,提供了本文所述的类器官,其在至少3个月(例如,至少4、5、6、7、8个月以上)的培养之后为功能性的且是活着的。例如,提供了本文所述的类器官,其在至少3个月(例如,至少4、5、6、7、8个月或更久)的培养之后保持其结构、标志物表达和功能中的至少一种或多种(例如1、2或3种)。
例如,本发明的类器官可以包括细胞群,其为至少1×103个细胞、至少1×104个细胞、至少1×105个细胞、至少1×106个细胞、至少1×107个细胞或更多。每一类器官包括约1×103个细胞至5×103个细胞。发明人已经表明,可以使类器官从单lgr5+干细胞生长成包括上述细胞群或包括约104个细胞的细胞群的类器官。例如,对于小鼠已经表明,可以使类器官从单干细胞开始生长。因此,本发明提供了用于从单干细胞产生类器官的方法。在一些实施方案中,类器官包括约104个细胞。在一些实施方案中,可以在24孔板的一个孔中一起生长10-20个或20-30个或30-40个或40-50个类器官。
在一些实施方案中,本发明提供了类器官或细胞群,其当在本发明的培养基中培养时,可以在培养物中存在至少3个月,例如至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久。
在一些实施方案中,本发明提供了类器官或细胞群,其中所述类器官或细胞群以每周至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍或至少10倍的速率扩增。
优选地,细胞群或类器官会以每周约4-5倍或者多于一周2次群体倍增的速率而扩增。因此,在一些实施方案中,细胞群或类器官以每周至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍或至少10倍的速率扩增。
可以使用从任何合适的源分离的细胞来获得本发明的类器官。通常,用于产生类器官的细胞将与产生该类器官的相同组织类型分离。类器官优选为哺乳动物的,例如,鼠的、牛的、猪的或人的。最优选地,类器官为人的。
在一些实施方案中,本发明提供了类器官或细胞群,其中所述类器官或细胞群为正常(健康)类器官或细胞群或者病变类器官或细胞群,例如通过培养从患有疾病的人或动物采集的干细胞而获得的类器官或细胞群。
在一些实施方案中,本发明提供了类器官或细胞群,其在-5℃以下、-10℃以下、-20℃以下、-40℃以下、-60℃以下、或-80℃以下、-100℃以下、-150℃以下或约-180℃被冷冻并贮存。本发明的类器官或细胞群可以在液氮中贮存。因此,在一些实施方案中,本发明提供了在液氮中贮存的类器官或细胞群。
在一些实施方案中,本发明提供了本发明的类器官,其中所述类器官为小肠类器官、结肠类器官、胃类器官、胰腺类器官、肝脏类器官或前列腺类器官。
类器官结构和形态
通过扩增干细胞而获得的本发明的类器官提供了与其体内相对物类似的细胞群。
成像分析可用于评价细胞在培养物中的特性,例如细胞形态;细胞结构;细胞凋亡或细胞溶解的证据;以及类器官组成和结构。本领域公知许多类型的成像分析,例如电子显微镜、共焦显微镜、立体显微镜、荧光显微镜。组织学分析可以揭示基础构造和细胞类型。
在附图中给出了根据本发明而产生的类器官的示例性实例。可以看出,本发明的类器官可具有一层有至少一个芽和中央腔的细胞。基质胶外部的类器官趋于比基质胶中间的类器官更大,可能由于它们更好地接近必要生长因子。在结构上,本发明的类器官的形状通常为细长的。它们可以包括一种或多种芽殖结构——与导管或岛类似的单细胞上皮层。在共焦显微镜下,该结构可以对角蛋白呈染色阳性。它们可包括具有极化核和小细胞质的细胞。类器官可具有由多层形成的部分;这样的细胞常常趋于在细胞更中心处具有它们的核,即未极化的。多层部分中的细胞可自我组建以在细胞之间包括间隙或腔。在一些实施方案中,本发明的类器官包括上皮细胞或由其组成。在一些实施方案中,类器官包括单层的上皮细胞或由其组成。在一些实施方案中,类器官不存在非上皮细胞。在一些实施方案中,本发明的类器官包括在其相应的体内组织相对物中存在的所有分化的细胞类型。
在一些实施方案中,人肠类器官表现出芽殖类器官结构,而非在先前培养条件下所看到的囊状结构。在从三个不同供体采集的20个细胞的每一个细胞中,大于3月龄的类器官的中期分裂相一致地显示出46个染色体。
在一些实施方案中,本发明的类器官包括单一单层的细胞。在一些实施方案中,本发明的类器官具有由多层形成的部分。多层细胞在本文还称为“分层”细胞区域。“分层”表示存在多层(多于一层)的细胞。在一些实施方案中,本发明的类器官包括单一的单层,其被折叠(或内折)以形成两个或多个层。有时可能难以在折叠(或内折)单层与分层细胞区域之间进行区分。在一些实施方案中,类器官包括分层细胞区域和折叠单层区域。在一些实施方案中,本发明的类器官具有由多层形成的部分以及包括单一单层细胞的部分。在形态上,细胞显得与它们相对应的体内组织相对物类似。
因此,在一些实施方案中,本发明还提供了类器官,优选使用本发明的培养基和方法获得的类器官,其为包括围绕中央腔的上皮细胞的三维类器官,其中任选地,上皮细胞存在于不同的分裂域和分化域中。在一些实施方案中,本发明的类器官为包括在单层(任选为折叠的单层)区域和分层细胞区域中布置的上皮细胞的三维类器官。在一些实施方案中,所述类器官不存在非上皮细胞。在一些实施方案中,在所述类器官中存在正常体内组织的所有分化细胞类型。
隐窝-绒毛类器官
在小肠隐窝-绒毛类器官中,类器官的结构布置与体内隐窝-绒毛的结构非常类似:lgr5+干细胞及其壁龛细胞(潘氏细胞)在隐窝底部彼此紧挨着,然后是短暂扩充细胞,其仅在隐窝底部之上并导入绒毛的侧面,最后是分化细胞,例如组成绒毛其余部分并以趋于绒毛顶部的形式变得越来越分化的肠上皮细胞。可以看出,本发明的类器官可具有一层有至少一个芽和中央腔的细胞。基质胶外部的类器官趋于比基质胶中间的类器官更大,可能由于它们更好地接近必要生长因子。在结构上,本发明的类器官的形状通常为细长的。在共焦显微镜下,该结构可以对角蛋白呈染色阳性。它们可包括具有极化核和小细胞质的细胞。隐窝-绒毛类器官通常为单层的。
在一些实施方案中,例如对于小鼠隐窝-绒毛类器官,隐窝-绒毛类器官是三维类器官,其包括围绕被绒毛样上皮域内衬的中央腔的隐窝样域,所述绒毛样上皮域为包括分化细胞类型的上皮域。在一些实施方案中,所述类器官不存在非上皮细胞。
在一些实施方案中,例如对于人隐窝-绒毛类器官,隐窝-绒毛类器官是三维类器官,其包括包围中央腔的隐窝样域。在一些实施方案中,分裂的细胞被局限于芽殖结构。不存在或存在很少的分化细胞。在分化条件下,形成肠的分化细胞。在一些实施方案中,所述类器官不存在非上皮细胞。在一些实施方案中,当类器官扩增时,例如当其在本发明的扩增培养基中时,类器官具有很少的分化细胞或不具有分化细胞。
在一些实施方案中,在包括rankl的本发明的培养基中培养的本发明的小肠类器官包括m-细胞。在本发明的一些实施方案中,在包括γ分泌酶抑制剂的本发明的培养基中培养的本发明的小肠类器官包括杯形细胞。在一些实施方案中,在分化培养基(例如其中分化培养基包括基础培养基、noggin、egf、tgf-β抑制剂和p38抑制剂、γ分泌酶抑制剂和rankl)中培养的小肠类器官包括所有分化细胞类型,例如包括杯形细胞、神经内分泌细胞、丛细胞、m-细胞、肠上皮细胞和潘氏细胞。在扩增类器官中还存在(有时以更小的量)这些分化细胞类型中的一些,例如潘氏细胞。
人肠类器官表现出芽殖类器官结构,而非在先前培养条件下所看到的囊状结构。新分离的隐窝的上部开口被密封并且该区域逐渐膨胀且被凋亡细胞填充,很像凋亡细胞在绒毛尖端被夹断。因此,在一些实施方案中,隐窝-绒毛类器官具有围绕被绒毛样上皮内衬且被凋亡细胞体填充的中央腔的隐窝样结构。在一些实施方案中,以连续时间间隔打开腔以将内含物释放入培养基。
在一些实施方案中,隐窝区域经历连续的产生额外隐窝的芽殖事件,即,表明隐窝裂变的过程。
发明人还例示了由本发明的培养基和方法产生的人肠类器官模拟了对外部因子反应的体内最终细胞类型决定。例如,先前已经表明,肠干细胞中的notch抑制终止了肠上皮增殖并诱导杯形细胞体内增生。因此,在一些实施方案中,当用notch抑制剂处理本发明的隐窝-绒毛类器官时,增殖停止,并且在3天内,大部分细胞(例如,多于50%、多于60%、对于70%、多于80%、多于90%、对于95%、多于98%)转化成杯形细胞。
在从三个不同供体采集的20个细胞的每一个细胞中,大于3月龄的类器官的中期分裂相一致地显示出46个染色体。此外,微阵列分析显示培养物中的干细胞具有与包括肠干细胞基因的肠隐窝细胞类似的分子标签。
结肠类器官
结肠类器官表现出与隐窝-绒毛类器官类似的细胞组成。因此,上述对隐窝-绒毛类器官的评论加以必要的变通而适于结肠类器官。例如,参见图1和2。
通常,结肠和小肠类器官之间的差异在于隐窝在结肠中是更浅的,使其看来有点像“足球”而非具有突出物的球体。小肠和结肠类器官均具有包括干细胞和短暂扩充(ta)细胞的域,以及其他包括正在分化和/或已分化的细胞的域。对于小肠类器官,分化域有时称为“绒毛-样”。结肠类器官的分化域在细胞组成方面通常与小肠的“绒毛-样”域类似,但结肠自身不具有绒毛。
所存在的wnt的量可以影响类器官中芽殖结构的尺寸(即,隐窝的深度)。更多的wnt降低了芽殖。结肠产生了比小肠更多的wnt,因此在培养基中需要更少的额外的wnt,并且通常具有比小肠更浅的隐窝。在类器官中看到相同的差异。
在一些方面,本发明提供了结肠类器官。发明人已发现可以通过在enr+wnt3a(wenr)细胞培养基中培养结肠隐窝来获得小鼠结肠类器官。因此,在一些实施方案中,本发明提供了通过在wenr培养基中培养结肠隐窝而获得的结肠类器官。
发明人还令人惊讶地发现可以使用包括wenr加胃泌激素加烟酰胺的培养基来维持人结肠类器官。在一些实施方案中,通过使用包括wenr加胃泌激素加烟酰胺且还包括tgfβ抑制剂的培养基来获得本发明的人结肠类器官。例如,在一些实施方案中,以下细胞培养基可以用于获得人结肠类器官:wenr+胃泌激素+烟酰胺+a8301+sb202190。在其他实施方案中,以下细胞培养基可以用于获得人结肠类器官:wenr+烟酰胺+a83-01。
在一些实施方案中,小鼠结肠类器官具有约200-700μm、例如250-600μm、300-500μm、320-450μm、340-400μm、300-380μm、例如约360μm的最大直径。在一些实施方案中,结肠类器官具有约100-400μm、例如150-350μm、170-300μm、190-280μm、195-250μm、例如约235μm的最小直径。在其他实施方案中,类器官可以具有高达1mm的直径。在一些实施方案中,人结肠类器官具有约300-800μm、例如350-700μm、400-600μm、450-550μm、475-540μm、500-530μm、例如约500μm的最大直径。在一些实施方案中,结肠类器官具有约200-500μm、例如250-450μm、300-415μm、350-400μm、325-380μm、例如约375μm的最小直径。在其他实施方案中,类器官可以具有高达1mm的直径。在一些实施方案中,本发明的结肠类器官包括芽殖结构。这些通过使用edu染色来可视化增殖细胞而成为可见的。
人结肠类器官在人肠干细胞培养基(“hisc”)条件(wenrg+烟酰胺+tgf-β抑制剂(例如a83-01)+p38抑制剂(例如sb202190))下保持它们特有的芽殖结构。在一些实施方案中,结肠类器官为三维类器官,其包括增殖的且含有干细胞的芽殖结构。这些干细胞域围绕中央腔。分裂细胞通常被局限于芽殖结构。在一些实施方案中,不存在或存在很少的分化细胞。在分化条件下,形成肠的分化细胞,例如成熟肠上皮细胞。在一些实施方案中,所述类器官不存在非上皮细胞。
胰腺类器官
本发明的胰腺类器官优选表现出芽殖。在一些实施方案中,胰腺类器官的直径为100-1000微米,例如200-900微米、300-1000微米、400-700微米。胰腺类器官优选为单层的。仅存在非常早期的岛或导管结构。芽殖结构表明健康的增殖状态和干细胞维持。
在一些实施方案中,例如当胰腺类器官在本发明的培养基(并且不存在tgf-β抑制剂)中生长时,胰腺类器官主要为具有很少芽殖结构或导管状域的囊状结构。囊状结构主要包括单层,但可以存在一些分层细胞区域。细胞表达干细胞和祖(导管)标志物。在类器官中不存在分化细胞,例如β-细胞。主要由单层形成囊肿,但存在分层部分。细胞类型与干细胞/祖细胞(导管细胞基因表达)类似。不存在分化细胞(β-细胞)。
在其他实施方案中,例如当胰腺类器官在存在tgf-β抑制剂如a83-01的情况下、例如在本发明的培养基中生长时,胰腺类器官包括更多的芽殖结构/导管状域(这表明细胞为导管状细胞,而非结构象导管),如krt19染色所示(例如,参见图31)。可以确定极化细胞的单层,但还确定了具有分化细胞的区域。
腺癌和结肠癌类器官
腺癌和结肠癌类器官通常形成囊状结构,而非芽殖结构。这表明不存在良好的细胞壁龛支持。用efg+noggin培养的腺瘤隐窝在最初10天表现出约16倍扩增。腺瘤(腺癌)和结肠癌类器官可以提供可用的研究工具和药物筛选模型。
癌、腺瘤和腺癌类器官主要为囊状的(例如,参见图4和9)。然而,在一些实施方案中,它们还可以包括与其正常组织类器官相对物类似的结构。
巴雷特食管(be)类器官
本发明的be类器官包括芽殖结构(例如,参见图5)。
在形态上,本发明类器官中的细胞显得与它们相应的体内组织相对物类似。
巴雷特食管症是通过在下食管中存在柱状上皮而标示的疾病,所述柱状上皮由于化生而替代正常鳞状细胞上皮。巴雷特食管的组织学特征是在食管中存在肠杯形细胞。利用巴雷特食管与肠上皮之间的类似性,发明人表明本发明的培养基和方法可用于将巴雷特食管上皮维持高达1个月。发明人还首次证明,向本发明的培养基添加fgf10能使巴雷特食管类器官形成芽殖结构并将培养持续时间显著地延长至3个月以上。因此,巴雷特食管类器官是本发明类器官的实例。在一些实施方案中,巴雷特食管类器官具有囊状结构。在一些实施方案中,本发明的巴雷特食管类器官包括潘氏细胞。在一些实施方案中,本发明的巴雷特食管类器官表达溶菌酶。
因此,发明人还描述了用于培养巴雷特食管上皮的包括fgf10的本发明培养基。
在本发明的一些实施方案中,可以使用还包括fgf10的本发明培养基来使巴雷特食管类器官生长。在一些实施方案中,这些巴雷特食管类器官表达ki67,并具有最小数量,例如小于10%、小于5%或小于1%的pas-阳性细胞和粘蛋白-阳性细胞。在一些实施方案中,巴雷特食管类器官包括溶菌酶阳性潘氏细胞。
胃部(胃)类器官(例如,参见图46)
在本发明的培养基中培养的小鼠胃类器官是三维类器官,其包括单层上皮或由其组成,所述单层上皮包括围绕由上皮域内衬的中央腔的胃腺基底样域(由干细胞和祖细胞形成),所述上皮域包括分化细胞类型,并且任选地,其中所述类器官不存在非上皮细胞。
在本发明的培养基中生长的人胃类器官包括囊状结构。囊状结构是单层极化细胞。在存在tgf-β的情况下生长的这些人胃类器官与在不存在tgf-β的情况下生长的人类器官相比更近似于小鼠胃类器官。
前列腺类器官(参见图41至43)
在包括egf、noggin、rspondin的培养条件下,小鼠前列腺类器官形成在腔内的三维囊状结构。层适时地向内折叠,形成3-4层的(分层)上皮细胞。外层主要由ck5+基础上皮细胞组成,而内层主要由ck8+腔上皮细胞组成。确定没有干细胞室;所有域包括分裂细胞。因此,在一些实施方案中,在不存在睾酮的情况下生长的前列腺类器官包括分层的分裂上皮细胞。在其他实施方案中,前列腺类器官包括:包括ck5+基础上皮细胞的细胞的外层;以及包括ck8+腔上皮细胞的内层。在一些实施方案中,在不存在睾酮的情况下生长的前列腺类器官不包括任何干细胞。
向前列腺培养基添加睾酮
发明人已经表明向用于前列腺类器官的培养条件添加(二氢)睾酮导致大部分细胞分化成ck8+腔细胞,其形成单层上皮,所述单层上皮折叠在自身之上以成为两层。在存在睾酮的情况下生长的前列腺类器官主要由具有或不具有第二层基细胞的腔细胞组成。结构与体内结构类似。存在分化和分裂的细胞,以及干细胞和祖细胞。因此,在一些实施方案中,例如当在包括睾酮的培养基中培养时,前列腺素是包括囊状结构和腔的三维类器官。在一些实施方案中,前列腺类器官包括形成单层上皮的ck8+腔细胞。在一些实施方案中,将单层折叠成两层或多更层。在其他实施方案中,类器官可以包括分层细胞的区域。在一些实施方案中,前列腺类器官包括分化细胞,同时维持分化细胞群。在一些实施方案中,由细胞或组织起始材料的来源(即,在分离之前于前列腺中的位置)来决定类器官的形状。前列腺由不同的叶或表现出不同的上述上皮结构(分层和折叠)的区域组成。在体外培养之后,类器官在某种程度上可以维持其所源自的前列腺部分的不同的宏观结构(分成或折叠的)。
肝脏类器官
在结构上,本发明的小鼠肝脏类器官的形状通常为细长的。它们可以包括一个或多个芽殖结构——具有与胆管不同结构的单细胞上皮层。在共焦显微镜下,该结构可以对角蛋白呈染色阳性。它们可包括具有极化核和小细胞质的细胞。类器官可具有由多层形成的部分;这样的细胞常常趋于在细胞更中心处具有它们的核,即未极化的。多层部分中的细胞可自我组建以在细胞之间包括间隙或腔。在一些实施方案中,本发明的人肝脏类器官具有大致囊状的结构。
在一些实施方案中,肝脏类器官是具有囊状结构的三维类器官(例如,参见图30)。在扩增条件下,类器官可以由干细胞和祖细胞组成,其中定义了两个域:(1)导管状域,其由具有细胞内衬的中央腔的单层立方形上皮(对导管标志物krt19呈阳性)形成;以及(2)假分层上皮域,其中检测到krt19阳性细胞和分散的白蛋白阳性细胞。这种构造(具有单层上皮的区域连同假分层上皮的区域)与胚胎肝脏芽类似。在扩增条件下,不存在完全分化的细胞,尽管在某些实施方案中可以检测到肝细胞/成肝细胞-特异性标志物的表达。分化条件导致囊状类器官的形成,其中导管样域(单层上皮)损失并整个结构变成包括>50%的极化肝细胞的假分层上皮。
肝脏类器官优选包括肝细胞和胆管上皮细胞(尽管在dm中分化之后尤其看到肝细胞,并且肝细胞不需要扩增),更优选地,其中可以检测到以下标志物的至少一种或多种:至少一种肝细胞标志物,例如白蛋白、转甲状腺素蛋白、b-1整合素和谷氨酰胺合成酶和/或cyp3a11、fah、tbx3、tat和gck中至少一种和/或至少一种胆管上皮细胞标志物,例如角蛋白7和19。技术人员已知如何检测这些标志物的每一种(即,rt-pcr和/或免疫荧光)。优选地,这些标志物中每一种的表达如实验部分所进行的那样来评价。这些标志物的每一种通常在使用本发明方法的至少两周、三周或一个月的培养之后表达。在两种培养条件中的类器官的微阵列分析表明肝脏类器官与成体肝脏组织类似。
优选地,在肝脏类器官中的所有细胞表达肝细胞表面标志物。例如,在一些实施方案中,肝脏类器官中的至少50%(例如50-60%)、至少60%、至少70%、至少80%、至少90%、至少99%或100%的细胞表达肝细胞标志物。在一些实施方案中,在肝脏类器官中约35%的细胞表达肝细胞表面标志物,例如25-45%、30-40%、33-37%、35%以下或15-35%的细胞。在一些实施方案中,扩增期会具有较少的干细胞,例如小于20%、小于10%、小于5%的细胞、小于2%、小于1%、优选0%的细胞。优选地,根据本发明所产生的细胞和类器官还具有肝细胞功能,例如表达成熟肝标志物或对其呈染色阳性:白蛋白、b-1整合素、ck-8、ck-18、运甲状腺素蛋白(ttr)、葡萄糖6p、met、谷氨酰胺合成酶(glul)、转铁蛋白、fahd1、fahd2a、k7、k19和细胞色素p450亚型3a13(cyp3a13)、51(cyp51)2d10(cyp2d10)、2j6(cyp2j6)、39a1(cyp39a1)、4a10(cyp4a10)、4f13(cyp4f13)4f16(cyp4f16)、cyp4b1and20a1(cyp20a1)。此外,在一些实施方案中,在两种培养条件中均未检测到胚胎肝脏基因afp,如同在成体肝脏中一样。在一些实施方案中,α胎蛋白的表达仅高于背景基因表达。
此外,在两种条件中高度表达公知的肝脏转录因子,例如hnf1a、hnf1b和hnf4a。
因为肝脏和胰腺与器官紧密相关,我们研究了我们的肝脏培养物是否也表达胰腺-特异性基因。将胰腺功能地分为内分泌胰腺和外分泌胰腺。内分泌胰腺主要特征为表达胰岛素、胰高血糖素和生长激素抑制素。通过一组内分泌胰腺特异性转录因子、最重要的为pdx1和neurod来严格地调节这些激素的表达。通过用于产生消化酶淀粉酶、胰腺脂肪酶和糜蛋白酶等的腺泡隔室和导管隔室来形成外分泌胰腺。还通过特异性外分泌胰腺基因如ptf1来调节这些基因的表达。
在本文所述的肝脏培养基中不存在胰腺特异性基因ptf1a、胰腺淀粉酶(amy2a4)、胰腺脂肪酶(pnlip)、胰岛素(ins1和ins2)、胰高血糖素(gcg)、糜蛋白酶(cela1)、pdx1和neurod。
在一些实施方案中,在肝脏类器官中以与成体肝脏肝细胞中相对应的基因类似的水平表达以下基因的一种或多种或全部:aqp1、bmp2、apo3、apol7a、sord、c3、ppara、pparg、tbx3、lgf1、ll17rb、ll1b、tgfbi、apoa1、apoa4、apob、cyp26b1、cyp27a1、cyp2b13、cyp2b9、cyp2c37、cyp2f2、cyp2g1、cyp2j13、cyp3a11、cyp4a10和cypf14。例如,参见图27a。
在一些实施方案中,在肝脏类器官中以与成体肝脏肝细胞中相对应的基因相比类似的关闭水平表达以下基因中的一种或多种:ccl2、osmr、icam1和cxcl2。
在一些实施方案中,在肝脏类器官和新生肝脏中差异表达以下基因之一或二者:mki67和cdkn3,表明这些基因在类器官中的表达比在分化类器官中或整个器官中更高。
在一些实施方案中,在肝脏类器官和新生肝脏中以类似的水平表达以下基因中的一种、两种或全部:cyp2j6、olfm4和lefty1。例如,参见附图27b。
在一些实施方案中,本发明的肝脏类器官当在本发明的扩增培养基(例如em1或em2)中培养时具有导管表型。
在一些实施方案中,本发明的肝脏类器官当在本发明的分化培养基中培养时表达成体肝脏标志物。
在一实施方案中,本发明的肝脏类器官具有如图27c所示的基因表达谱。
在特别优选的实施方案中,本发明的小鼠肝脏细胞群或类器官具有如图28所示的基因表达谱。例如,在一优选实施方案中,本发明的小鼠肝脏细胞群或类器官:
a)表达以下干细胞标志物中至少一种(例如,1、2、3、4、5、6、7、8、9、10、11种)、优选全部:lgr5、lgr4、epcam、cd44、tnfrsf19、sox9、sp5、cd24a、prom1、cdca7和elf3;和/或
b)不表达以下干细胞标志物:lgr6;和/或
c)当在本发明扩增培养基中生长时表达以下肝细胞或胆管上皮细胞标志物中至少一种(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19种)、优选全部:hnf1a、hnf1b、hnf4a、hhex、onecut1、onecut2、prox1、cdh1、foxa2、gata6、foxm1、cebpa、cebpb、cebpd、cebpg、glul、krt7、krt19和met;和/或
d)当在本发明的扩增培养基中生长时不表达以下基因中至少一种(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17种):afp、ins1、ins2、gcg、ptf1a、cela1、cela2a、cela3b、neurod1、neurod2、neurog1、neurog2、neurog3、amy2a4、igf1r、igf2和cd34;和/或
e)表达以下再程序化基因中的至少一种(例如,1、2或3种):klf4、myc和pou5f1;和/或
f)不表达以下再程序化基因:sox2,
其中优选例如使用微阵列通过测量mrna水平的表达来监测基因的表达。
更优选地,本发明的小鼠肝脏细胞群或类器官具有以上全部特征a)至f)。
在一些实施方案中,上述本发明的小鼠肝脏细胞群或肝脏类器官的基因表达谱用于在本发明的肝脏扩增培养基中培养的小鼠细胞群或类器官。
在一些实施方案中,提供了本发明的人肝脏细胞群或类器官,其具有图29所示的基因表达标签。例如,在本发明的em1中培养的人肝脏细胞群或类器官优选表达图29中所指的基因以在em1细胞培养基中表达。例如,在本发明的em2中培养的人肝脏细胞群或类器官优选表达在图29中所指的基因以在em2细胞培养基中表达。例如,在本发明的dm中培养的人肝脏细胞群或类器官优选表达在图29中所指的基因以在dm细胞培养基中表达。
例如,在一优选实施方案中,本发明的人肝脏细胞群或类器官:
a)表达以下干细胞标签基因中至少一种(例如,1、2、3、4、5、6、7、8、9种)、优选全部:lgr4、tacstd1/epcam、cd44、sox9、sp5、cd24、prom1、cdca7和elf3;和/或
b)表达以下再程序化基因中的至少一种(例如,1、2、3或4种):klf4、myc、pou5f1和sox2;和/或
c)表达以下肝细胞/胆管上皮细胞特异性基因中至少一种(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19种)、优选全部:hnf1a、hnf1b、hnf4a、hhex、onecut1、onecut2、prox1、cdh1、foxa2、gata6、foxm1、cebpa、cebpb、cebpd、cebpg、glul、krt7、krt19和met;和/或
d)不表达以下肝细胞/胆管上皮细胞特异性基因中至少一种(例如,1、2、3、4、5、6种)、优选全部:neurog2、igf1r和cd34、afp、gcg和ptf1a,例如,其不表达neurog2、igf1r和cd34;和/或
e)表达以下干细胞特异性基因中至少一种(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18种)、优选全部:ttr、alb、fah、tat、cyp3a7、apoa1、hmgcs1、pparg、cyp2b6、cyp2c18、cyp2c9、cyp2j2、cyp3a4、cyp3a5、cyp3a7、cyp4f8、cyp4v2和scarb1;
其中优选例如使用微阵列通过测量mrna水平的表达来监测基因的表达。
更优选地,本发明的人肝脏细胞群或类器官具有以上全部特征a)至e)。
在一些实施方案中,如图29所示,本发明的人肝脏细胞群或类器官中的基因相对于参照rna的表达被上调或下调。优选地,所述参照rna是通用人参照rna(stratagene,编号740000)。在一些实施方案中,基因相对于参照rna被上调或下调,如果其同样示于图29中,则其相对于参照rna被上调或下调,但是上调或下调的程度无需相同。在其他实施方案中,上调或下调的程度是+/-35%、+/-30%、+/-25%、+/-20%、+/-20%、+/-15%、+/-10%、+/-5%、+/-3%,或更优选+/-1.5倍、+/-2倍、+/-3倍、+/-5倍,或与图29所示的大致相同。在其他实施方案中,本发明的人类器官中的基因表达的绝对水平是+/-35%、+/-30%、+/-25%、+/-20%、+/-15%、+/-10%、+/-5%、+/-3%,或+/-1.5倍、+/-2倍、+/-3倍、+/-5倍,或与图29所示的大致相同。
本发明的人肝细胞群或类器官还优选表达lgr5和/或tnfrsf19,优选二者。在一些实施方案中,在本发明的扩增培养基中培养时,人肝细胞群或类器官表达lgr5和/或tnfrsf19,优选二者。优选地,lgr5和/或tnfrsfr19的表达通过rtpcr来检测。在一些实施方案中,与在扩增培养基中培养时它们在类器官或细胞中的表达水平相比,当分化培养基中培养时,lgr5和/或tnfrsf19以更低的表达水平存在于类器官或细胞中(例如低至少2倍,至少3倍,至少4倍,至少5倍,至少10倍,至少15倍)。
优选地,本发明的肝脏细胞和类器官可以优选分泌白蛋白,例如,以约1μg/小时/106细胞至10μg/小时/106细胞,优选2μg至6μg/小时/106细胞的速率。
此外,这样的细胞和类器官可分泌尿素。例如,在细胞的35mm平皿中,尿素合成的活性可以是48小时1μg至50μg,优选5μg至30μg。
本发明的肝脏细胞和类器官例如当染色时可显示明显的糖原累积。可通过两日内将培养基由低葡萄糖分化培养基转换为补充有10%fbs和0.2μm地塞米松的高葡萄糖dmem来检测本发明的细胞和类器官主动合成糖原的能力。
本发明的肝脏细胞和类器官可具有诱导型细胞色素p450活性(如cyp1a)。这种活性可例如利用乙氧基试卤灵-o-脱乙基酶(erod)测试来检测(cancerres,2001,61:8164-8170)。例如,可将细胞或类器官暴露于p450底物如3-甲基胆蒽,并将erod的活性水平与对照细胞进行比较。
在形态上,肝脏类器官细胞呈现肝细胞样。
如图30所示,优选的肝脏类器官包含囊状结构或由其组成,在所述囊状结构外部是具有芽和中央腔的细胞层。这种肝脏类器官可具有以下特征的一种或多种(如2、3或全部4种):(a)具有的细胞密度>5×105细胞/cm3、优选>10×105细胞/cm3;(b)具有相当于2-30层细胞的厚度,优选相当于2-15层细胞的厚度;(c)细胞在三维空间互相接触;(d)显示健康肝组织固有的功能;(e)具有细长的形状,具有两个限定的域,即单层上皮域,其中可检测到高度极化的细胞并表达角蛋白标志物(该域与胆管域类似),并且其他域构成类器官的主体且由具有非极化细胞的多层上皮形成,其中可检测到白蛋白表达。对本领域技术人员而言明显的是,这样的肝脏类器官优选不是肝脏碎块,和/或不包含血管,和/或不包含肝小叶或胆管。
在本发明的情形中,肝脏碎块是成体肝脏,优选人成体肝脏的一部分。因此,优选地,如本文所确定的肝脏类器官不是肝脏碎块。优选利用来自成体肝脏的细胞,优选来自成体肝脏的上皮干细胞,更优选来自成体肝脏表达lgr5的上皮干细胞来获得肝脏类器官。还可以从当损坏或培养时表达lgr5并因此为lgr5-表达循环干细胞的任何细胞获得肝脏类器官。
在一些实施方案中,肝脏类器官包括表达lgr5的细胞。例如,在一些实施方案中,肝脏类器官中至少2%,更优选至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%的细胞表达lgr5。类似地,本发明提供了表达lgr5的细胞或细胞群,其中所述细胞获自本发明的肝脏的类器官。本发明同样包括此类细胞的后代。
在实施方案中,肝脏类器官是利用本发明的方法仍在培养并因此与细胞外基质相接触的肝脏类器官。优选地,将肝脏类器官嵌入非间充质或间质细胞外基质。在本发明的情形中,“接触”意指物理或机械或化学接触,其表示为了从所述细胞外基质分离所述肝脏类器官需要使用力。
在优选实施方案中,可将肝脏类器官培养至少2、3、4、5、6、7、8、9、10周或1、2、3、4、5、6、7、8、9、10个月或更久。在一些实施方案中,在培养物中扩增或维持肝脏类器官至少3个月、优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月或更久。优选地,使用包括tgfβ抑制剂的本发明扩增培养基培养的肝脏类器官可以以一周5倍扩增或每周两次以上群体倍增(例如,至少10次倍增、至少20次倍增、更优选至少25次倍增、例如至少30次倍增)培养至少4周、最优选至少5周。优选地,使用除tgfβ抑制剂还包括前列腺素途径活化剂的本发明扩增培养基培养的肝脏类器官可以以每周2次以上倍增(例如,2-3次倍增)培养至少7周(即,至少15次倍增、至少25次倍增、至少30次倍增、至少32次倍增、至少35次倍增如32-40次倍增、例如至少50次倍增)。因此,优选地,使用本发明的扩增培养基获得本发明的肝脏类器官,例如人肝脏类器官。
在另一优选实施方案中,肝脏类器官源自单细胞,优选表达lgr5的单细胞,更优选其中所述单细胞包含核酸构建体,所述核酸构建体含有目标核酸分子。
类器官组成和基因表达
隐窝-绒毛、结肠隐窝和胰腺类器官通常包括干细胞和/或祖细胞,因此这些类器官共有某些基因表达谱。在一些实施方案中,可以检测到以下标志物的一种或多种(例如,1、2、3、4、5、6或7种)或全部:lgr5、lgr4、epcam、cd44、sox9、cd24a和cd133/prom1以及任选的tnfrsf19。在另一实施方案中,可以检测到以下祖基因的一种或两种或全部:pdx1、nkx2.2和nkx6.1。在分化之后,预期隐窝-绒毛、结肠隐窝和胰腺类器官的基因表达谱不同,因为分化类器官表达组织特异性成体标志物,例如在胰腺中的胰岛素。
隐窝绒毛类器官
在本发明的一些实施方案中,类器官包括隐窝-绒毛样扩展,其包括所有分化的上皮细胞类型,包括增殖细胞、潘氏细胞、肠上皮细胞和杯形细胞。在一些实施方案中,本发明的隐窝-绒毛类器官不包括肌成纤维细胞或其他非上皮细胞。本发明的隐窝-绒毛类器官优选包括在隐窝-绒毛样结构中的肠上皮细胞,包括吸收肠上皮细胞、杯形细胞、肠内分泌细胞和潘氏细胞。优选地,可以检测到以下标志物中至少一种(例如,2、3、4、5或6种):smoc2、cdca7、olfm4、ascl2、axin2和/或lgr5、tnfrsf19、cd24a、sox9、cd44、prom1(参见图2e和图14)。在一些实施方案中,可以检测到标志物rnf43和znrf3。在一些实施方案中,smoc2、cdca7、olfm4、ascl2、axin2和/或lgr5中一种或一些(例如,1、2、3、4或5种)或全部在隐窝中被上调至少2倍、3倍或4倍,而在隐窝中下调至少2倍、3倍或4倍的标志物包括abcg1、enpp3、cste、muc17和/或apoa1中至少一种或一些(例如,1、2、3或4种)或全部。在这种情形下,“上调”相对于肠的绒毛或结肠隐窝的顶部。将分化类器官细胞的基因表达与干细胞相比的微阵列分析揭示了小肠隐窝-绒毛和结肠类器官具有相当的小肠隐窝分子标签,包括小肠干细胞基因的表达。因此,本发明还提供了具有上述隐窝-绒毛类器官的分子标签的结肠类器官。体外培养的类器官明显表现出与新分离的小肠隐窝类似的表达谱并表达已知的干细胞标志物。
在一些实施方案中,编码在图14中列举的在隐窝-绒毛类器官或结肠类器官中分别被上调的一种或多种基因(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25种)的mrna在本发明的隐窝-绒毛类器官或结肠类器官中与新分离的小肠绒毛相比被上调,如微阵列所测定的。在一些实施方案中,编码在图14中列举的在隐窝-绒毛类器官或结肠类器官中分别被下调的一种或多种基因(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25种)的mrna在本发明的隐窝-绒毛类器官或结肠类器官中与新分离的小肠绒毛相比被下调,如微阵列所测定的。在一些实施方案中,上调或下调倍数为图14所示倍数+/–25%,例如+/–20%、+/–15%、+/–10%、+/-5%、+/-3%或约为图14所引的倍数。例如,本发明的隐窝-绒毛类器官可以具有与新分离的小肠绒毛相比上调9.54倍+/-25%的adora2b。其经加以必要的变通而用于图14所列的其他基因。
在一些实施方案中,隐窝绒毛类器官表现出lgr5的天然表达。在一些实施方案中,隐窝绒毛类器官表现出至少lgr5和选自以下的干细胞标志物的一种或多种(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16种)或全部的天然表达:ck19、巢蛋白、生长激素抑制素、cxcr4+、cd133+、dcamkl-1、cd44、sord、sox9、cd44、prss23、sp5、hnf1α、hnf4a、sox9、krt7和krt19。此外或可替代地,隐窝-绒毛类器官可以通过表达以下一种或多种或全部(例如1或2种)来表征:sord和/或prss23。此外或可替代地,隐窝-绒毛类器官可以通过表达cd44和/或sox9来表征。在另一实施方案中,隐窝-绒毛类器官表现出选自以下的标志物中一种或多种(例如,1、2、3、4、5、6、7、8、9种)或全部的表达:lgr5、lgr4、epcam(tacstd1)、cd44、tnfrsf19、sox9、sp5、cd24a、prom1和cdca7。
在一些实施方案中,隐窝绒毛类器官包括表达溶菌酶的潘氏细胞。
结肠类器官
在一些实施方案中,结肠类器官包括肠内分泌细胞(例如,使用嗜铬粒蛋白a染色所检测到的)、杯形细胞(使用粘蛋白2染色所检测到的)。在一些实施方案中,结肠类器官中小于10%的细胞为肠内分泌细胞(例如0.01-5%、0.1-3%)。在一些实施方案中,结肠类器官中小于30%的细胞为杯形细胞(例如1-25%、1-15%、5-10%)。在一些实施方案中,肠内分泌细胞和/或杯形细胞的分布如图1d所示。
在一些实施方案中,结肠类器官包括成熟肠上皮细胞(例如,通过碱性磷酸酶染色所见的)。在一些实施方案中,结肠类器官中小于10%的细胞为成熟肠上皮细胞(例如小于5%、小于3%、0.01-5%、0.1-3%、0.1-5%)。
在优选实施方案中,结肠类器官不包括潘氏细胞,因为在天然存在的体内结肠中不存在潘氏细胞。
在一些实施方案中,结肠类器官表现出lgr5的天然表达。
在一些实施方案中,结肠类器官表达绒毛蛋白1、alpi、chga和muc2中一种或多种(例如,1、2、3或4种)。在一些实施方案中,与新分离的结肠隐窝相比,由本发明结肠类器官表达的绒毛蛋白1mrna的相对量为至少3%(例如,至少5%、至少8%、至少10%),例如5-15%。在一些实施方案中,与新分离的结肠隐窝相比,由本发明结肠类器官表达的alpimrna的相对量为至少0.5%(例如,至少1%、至少2%),例如0.5-5%。在一些实施方案中,与新分离的结肠隐窝相比,由本发明结肠类器官表达的chgamrna的相对量为至少15%(例如,至少20%、至少22%),例如15-30%。在一些实施方案中,与新分离的结肠隐窝相比,由本发明结肠类器官表达的muc2mrna的相对量为至少20%(例如,至少25%、至少30%、至少35%),例如25-37%。
在一些实施方案中,本发明的人结肠类器官表达已知的干细胞标志物。
胰腺类器官
胰腺包括三类细胞类型:导管细胞、腺泡细胞和内分泌细胞。内分泌细胞产生激素胰高血糖素、胰岛素生长激素抑制素和胰腺多肽(pp),其分泌入血液并帮助身体调节糖代谢。腺泡细胞是外分泌系统的一部分,其产生消化酶和来自将腺泡细胞与消化器官连接的胰腺管的导管细胞。在发育期间,胰岛被认为起源于祖内分泌细胞,所述祖内分泌细胞从胰腺管出现并在分化之后聚集以形成胰岛。胰岛包括α细胞、β细胞、δ细胞和pp细胞。
胰腺类器官细胞可以具有与导管细胞标志物、例如k7、k19和hnf1b中一种或多种(例如1种、2种或全部)和/或一种或多种一般干细胞标志物如sox9和/或onecut1类似的表达谱。这可能为其干细胞标签的一部分。通常,看到较少的分化标志物。在一些其中从胰腺管分离细胞以产生本发明的胰腺类器官的实施方案中,产生本发明的胰腺类器官的细胞类型不为导管细胞(即,对形成导管管(ductaltube)的角蛋白7和角蛋白19呈阳性的上皮细胞),但其为与胰腺管连接的细胞,即,在导管与胰腺组织接触之后位于下一细胞层中的细胞(即,不朝向导管的腔)。因此,在其中产生胰腺类器官的细胞类型不为导管细胞的实施方案中,胰腺类器官不表达k7或k19。然而,这样的胰腺类器官仍优选表达一种或多种一般干细胞祖标志物,例如sox9。
本发明的胰腺类器官优选包括α细胞、β细胞、δ细胞和pp细胞。在其他优选实施方案中,胰腺类器官包括β-细胞。例如,胰腺类器官可以包括多于1%、多于5%、多于10%、多于15%、或多于20%的β-细胞。胰岛素的表达可用作β-细胞的标志物。在可替代的实施方案中,胰腺类器官包括当移植入人或动物时可产生分化细胞类型的任选具有导管起源的祖细胞类型。在优选实施方案中,祖细胞类型当植入人或动物时可产生胰岛素-分泌β-细胞。发明人已经表明,根据本发明的培养基和方法而生长的人胰腺类器官可被植入小鼠并在一个月内刺激胰岛素-分泌细胞(参见实施例4)。可以容易理解的是,这会产生用于患有糖尿病和胰岛素缺乏的患者的革命性治疗。
在一些实施方案中,本发明的胰腺类器官可以包括导管细胞、腺泡细胞和内分泌细胞。在一些实施方案中,k19用作导管细胞的标志物。
在一些实施方案中,β-细胞存在于胰岛(pancreaticislands)或胰岛(isletsoflangerhans)内。岛通常在体内包括约1500个细胞,例如1300-1700个细胞。在一实施方案中,胰腺类器官包括以质量计至少0.5%、至少1%、至少1.5%、至少2%、至少3%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%或更多的胰岛。在一些实施方案中,胰腺类器官的胰岛由约65-90%的β-细胞、约15-20%的α-细胞、约3-10%δ细胞和约1%pp细胞组成。然而,这绝不是排他的。例如,在一些实施方案中,期望在本发明的类器官中具有许多β细胞。或者,类器官可以包括可被移植以使其体内分化的祖细胞。
在一些实施方案中,胰腺类器官表达pdx1、nkx2.2和nkx6.1中一种、两种或全部。胰腺类器官可以表达neurod、pax6、pax4和mafa中一种、两种、三种或全部四种。pax4用作存在胰岛素生成细胞时的标志物,因为其对于在胚胎发育期间从内分泌祖细胞分化胰岛素生成细胞而言是必要转录因子。胰腺类器官可以表达ngn3。
在一些实施方案中,可以在本发明的胰腺类器官中检测到以下标志物中至少一种(例如1、2、3、4、5种):胰岛素(ins1和/或ins2)、胰高血糖素(gcg)、生长激素抑制素、pdx1和neurod。在一些实施方案中,可以在本发明的胰腺类器官中检测到以下标志物中至少一种(例如1、2、3、4、5种):胰岛素(ins1和/或ins2)、胰高血糖素(gcg)、生长激素抑制素、pdx1和neurod,并且不能检测到以下标志物:ptf1a、amy2a4、pnlip和cela1。在一些实施方案中,可以在本发明的胰腺类器官中检测到以下标志物中至少一种(例如1、2、3、4、5、6、7、8或9种):ptf1a、胰腺淀粉酶(amy2a4)、胰腺脂肪酶(pnlip)、胰岛素(ins1和/或ins2)、胰高血糖素(gcg)、生长激素抑制素、糜蛋白酶(cela1)、pdx1和neurod。
在一些实施方案中,胰腺类器官表现出lgr5的天然表达。在一些实施方案中,胰腺类器官表现出至少lgr5和选自以下的干细胞标记物的一种或多种(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种)的天然表达:ck19、巢蛋白、cxcr4+、cd133+、dcamkl-1、cd44、sord、sox9、cd44、prss23、sp5、hnf1α、hnf4a、sox9、krt7和krt19、prom1、cd24a、lgr4、epcam。可替代或另外地,在一些实施方案中,胰腺类器官可以通过ck19、巢蛋白、(胰岛素、胰高血糖素)和cxcr4+的一种或多种(例如1、2、3或4种)的天然表达来表征。
在一些实施方案中,本发明的胰腺类器官或细胞表达生长激素抑制素。生长激素抑制素是在分化δ细胞中表达的激素并可以用作δ细胞的标志物。
可替代或另外地,在一些实施方案中,胰腺类器官表现出一种或多种早期内分泌标志物、例如以下早期内分泌标志物的至少一种或多种(例如,1、2、3、4、5、6或7种)的天然表达:sox9、hnf1b、hnf6、hnf1a、nkx2.2、nkx6.1和pdx1。
可替代或另外地,在一些实施方案中,胰腺类器官表现出一种或多种早期内分泌标志物、例如以下早期内分泌标志物的至少一种或多种(例如,1、2、3、4种)的天然表达:foxa2、hnf6、hnf1b和sox9。在一些实施方案中,尽管胰腺类器官表现出以下内分泌标志物中一种或多种(例如,1、2、3或4种)的天然表达:foxa2、hnf6、hnf1b和sox9,但它们未表现出ngn3的表达。
可替代或另外地,在一些实施方案中,胰腺类器官表现出一种或多种导管标志物、例如角蛋白7和角蛋白19之一或二者的天然表达。在一些实施方案中,胰腺类器官表现出一种或多种导管标志物的显著或可检测水平的天然表达。因此,在一些实施方案中,胰腺类器官具有导管表型。在一些实施方案中,胰腺类器官表现出选自以下的下列标志物中一种或多种(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15种)或全部的表达:hnf1a、hnf1b、hnf4a、hhex、onecut1、onecut2、cdh1、foxa2、gata6、cebpb、cebpd、cebpg、glul、krt7、krt19和met。
然而,胰腺类器官可具有一些与胰岛素产生前体细胞的特征相结合的导管特征。例如,它们可以表达一种或多种如图16b所示的导管标志物。在一些实施方案中,相对于成体胰腺或肝脏类器官,胰腺类器官展现出于大致如图16b所示的基因表达谱。例如,在一些实施方案中,这些基因在胰腺类器官中与成体胰腺肝脏类器官相比被上调或下调了与图16b大致相同的倍数比,例如小于+/-3%、小于+/-5%、小于+/-10%、小于+/-20%。
在一些实施方案中,在胰腺类器官中,从导管内衬显现胰腺阳性细胞。
在一些实施方案中,与肝脏类器官相比,以下基因中一种或多种(例如,1、2、3、4、5、6或7种)、优选全部在胰腺类器官中被上调:aaas、rps4y2、atp2c2、akap2、uts2、sox17、agr2。例如,在一些实施方案中,与肝脏类器官相比,这些基因在胰腺类器官中被上调了与图19大致相同的倍数比,例如小于+/-3%、小于+/-5%、小于+/-10%、小于+/-20%。
在一实施方案中,胰腺类器官包括总共至少103个、至少104个、至少105个或更多的细胞。在一实施方案中,胰腺类器官包括多于50%、多于60%、多于70%或多于80%的导管样内分泌祖细胞。然而,还预期的更少比例的导管样内分泌祖细胞。
巴雷特食管(be)类器官
本发明的be类器官为ki67+。
优选地,be类器官在从扩增培养基撤回烟酰胺和sb202190以将其转化成分化培养基之后4天具有最小数量(例如,小于25%、小于20%、小于10%、小于5%、小于2%、小于1%的细胞)的pas+和mucin+细胞。
在一些实施方案中,be类器官包括杯形细胞。这些可以通过用γ-分泌酶抑制剂如dbz(例如,10μm)处理分化培养基4天而诱导。
在一些实施方案中,本发明的巴雷特食管类器官包括潘氏细胞。
在一些实施方案中,本发明的巴雷特食管类器官表达溶菌酶。
胃类器官
在一些实施方案中,本发明的胃类器官表现出lgr5的天然表达。在一些实施方案中,本发明的胃类器官表现出至少lgr5和选自以下的干细胞标记物的一种或多种(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或17种)的天然表达:ck19、巢蛋白、生长激素抑制素、cxcr4+、cd133+、dcamkl-1、cd44、sord、sox9、cd44、prss23、sp5、hnf1α、hnf、sox9、krt7和krt19。可替代或另外地,在一些实施方案中,胃类器官可以通过cd133+、dcamkl-1和cd44的一种或多种(例如1、2或3种)的天然表达来表征。可替代或另外地,胃类器官可以由cd44和sox9来表征。
前列腺类器官
在一些实施方案中,本发明的前列腺类器官、例如小鼠前列腺表现出lgr5的天然表达。在一些实施方案中,前列腺类器官表现出腔前列腺标志物、例如细胞角蛋白18(ck18)和细胞角蛋白8(ck8)的天然表达。在一些实施方案中,本发明的前列腺类器官表现出雄激素受体(ar)的天然表达。在一些实施方案中,前列腺类器官表达基础标记物,例如p63和/或细胞角蛋白5(ck5)。在一些实施方案中,与不存在睾酮(例如dht)的情况下生长的类器官相比,当向培养基添加睾酮(例如dht)时,基础标记物、lgr5和tnfrsf19的表达被下调。在所有条件下表达前列腺特异性转录因子nkx3.1。因此,在一些实施方案中,本发明的前列腺类器官表现出前列腺特异性标志物nkx3.1的天然表达。
在一些实施方案中,本发明的前列腺类器官、例如正常或癌变人前列腺类器官表现出腔标志物、例如ck18、ck8和/或b-msp的天然表达。在一些实施方案中,前列腺类器官表现出ar的天然表达。在一些实施方案中,表达基础上皮标记物,例如ck14、ck5和/或p63。在一些实施方案中,表达tnfrsf19。在所有条件下表达前列腺特异性转录因子nkx3.1。因此,在一些实施方案中,本发明的前列腺类器官表现出前列腺特异性标志物nkx3.1的天然表达。
向本发明的培养基添加睾酮(例如dht)使前列腺类器官生长,其维持干细胞群,允许高达3倍的更快生长(与没有睾酮的情况相比),并且还存在前列腺的大部分(即使不是全部)的分化细胞类型(基细胞和腔细胞)。这些条件允许不受限的细胞扩增(迄今为止以一周2.5次群体倍增直至9个月)。因此,在一些实施方案中,前列腺类器官包括前列腺的所有分化细胞类型,例如基细胞和腔细胞。在优选实施方案中,前列腺类器官包括所有分化细胞类型,例如基细胞和腔细胞以及干细胞。
在正常组织中,添加睾酮(例如dht)增加所有培养条件中的ar表达。在一些实施方案中,前列腺类器官与在不存在睾酮的情况下生长的前列腺细胞相比具有上调的ar表达。在肿瘤组织中,睾酮(例如dht)添加不影响ar表达。因此,在一些实施方案中,前列腺癌类器官与体内前列腺癌细胞相比不具有增加的ar表达。在来自正常组织的前列腺类器官中,在enrf条件下表达干细胞标志物lgr5。在从肿瘤组织获得的前列腺类器官中,通过添加睾酮(例如dht)来诱导lgr5表达。在一些实施方案中,前列腺类器官表达lgr5。
类器官功能
在一些实施方案中,通过本发明的培养基和方法产生的类器官模拟对外部因子反应的体内最终细胞类型决定。优选地,根据本发明而产生的细胞和类器官还具有组织特异性功能。
胰腺类器官
胰腺类器官优选具有内分泌和外分泌胰腺功能,例如表达胰岛素、胰高血糖素和生长激素抑制及的一种或多种(例如,1种、2种或全部3种)。通过一组内分泌胰腺特异性转录因子、最重要的为pdx1和neurod来严格地调节这些激素的表达。通过用于产生消化酶淀粉酶、胰腺脂肪酶和糜蛋白酶等的腺泡隔室和导管隔室来形成外分泌胰腺。还通过特异性外分泌胰腺基因如ptf1a来调节这些基因的表达。
优选地,本发明的胰腺细胞和类器官可以优选分泌胰岛素,例如,以约1μg/小时/106细胞至10μg/小时/106细胞,例如2μg至6μg/小时/106细胞的速率。可以通过本领域公知的方法、例如通过与参照进行比较的免疫印迹或通过c-肽酶联免疫吸附测定来检测胰岛素分泌水平。例示胰腺类器官的优选方法可通过测试c-肽的产生来分泌胰岛素。胰岛素原c-肽用作胰岛素a-链与b-链之间的重要连接子,并促进有效的组装以及胰岛素在内质网中的加工。然后,将等摩尔量的c-肽和胰岛素贮存在胰腺β细胞的分泌粒中,并且二者最终释放至门脉循环。因此,c-肽是胰岛素分泌的优选标志物。
因此,在一些实施方案中,提供了胰腺类器官,其在体内移植之后分泌胰岛素。在一些实施方案中,在体内移植之后,胰腺类器官以约1μg/小时/106细胞,例如至少2μg/小时/106细胞、至少4μg/小时/106细胞、至少6μg/小时/106细胞、至少8μg/小时/106细胞或至少10μg/小时/106细胞的速率分泌胰岛素。在一些实施方案中,胰腺类器官中的细胞当体外培养时不能分泌胰岛素和/或不将胰岛素表达为标志物。然而,来自本发明的胰腺类器官的细胞优选当植入患者、例如植入患者胰腺时能体内分泌胰岛素。在一些实施方案中,分泌胰岛素的能力可以当移植之后不立即呈现,但在移植之后约1个月内呈现,例如移植之后6周、2个月或3个月。
在一些实施方案中,如果富集内分泌细胞样品从本发明的胰腺类器官获得,则富集内分泌细胞样品中75-85%的细胞会是胰岛素分泌细胞。
在一些实施方案中,本发明提供了用于治疗糖尿病的胰腺类器官。在一些实施方案中,胰腺类器官为扩增器官,而在其他实施方案中,它们可以为分化类器官。在一些实施方案中,将一个或多个(例如1、2、3、4、5、6、7等)整体类器官移植入动物或患者,而在其他实施方案中,将细胞样品移植入患者。
隐窝-绒毛类器官
隐窝-绒毛类器官优选具有分泌和自我更新功能。例如,隐窝-绒毛类器官优选分泌粘蛋白、酶分泌物和激素分泌物,例如溶菌酶、肠促胰酶肽、分泌素和胃抑制肽以及其他的糖蛋白。
胃类器官
人胃部结构地和功能地分为两个主要区域。与肠接近的幽门窦主要产生保护粘液,并分泌激素,例如胃泌激素。胃体分泌盐酸和胃酶,例如胃蛋白酶原。在称为内陷的腺体中组建两种区域的胃上皮。这些腺体怀有胃干细胞、祖细胞和分化细胞。分化细胞的精确组成根据组织区域的功能而变化。在幽门窦中,腺体主要由粘蛋白6生成细胞和激素生成内分泌细胞组成。在体中,胃蛋白酶原生成主细胞和酸分泌壁细胞分散在粘液生成细胞与稀疏的内分泌细胞之间。由主要产生表面粘液5的粘液生成细胞来占据胃腺体之间的表面区域。
胃类器官在结构和功能上与胃上皮类似。尽管它们主要为球状的,但它们可具有域,所述域具有最可能与腺体结构类似的内陷。粘蛋白和胃蛋白酶原的染色表明在胃类器官中最丰富的细胞类型是粘蛋白6生成粘液细胞和胃蛋白酶原生成主细胞(和/或其祖先)。因此,rt-pcr标明胃蛋白酶原和粘蛋白6的表达。此外,胃泌激素的表达表明内分泌细胞的存在,并且lgr5的表达表明干细胞的存在。
在一些实施方案中,胃类器官具有胃泌激素、胃蛋白酶原、粘蛋白6和/或lgr5中一种或多种(例如,1、2、3或4种)的天然表达。在一些实施方案中,胃类器官包括粘蛋白6生成粘液细胞和胃蛋白酶原生成主细胞以及任选的lgr5+干细胞。在一些实施方案中,胃类器官包括内分泌细胞。在一些实施方案中,胃类器官主要是球状的,但具有域,所述域具有与腺体结构类似的内陷。
前列腺类器官
在一些实施方案中,前列腺类器官包括两种不同的上皮世系(基细胞和腔细胞)或由其组成。在一些实施方案中,基细胞和腔细胞分泌前列腺液。
前列腺上皮体内被强烈折叠,确保最大的表面积。两种上皮世系形成了简单分层上皮,其具有形成基础层/外层的基础上皮细胞和位于顶部形成内层/腔层的强极化腔上皮细胞。腔隔室对于前列腺的分泌功能是必要的。前列腺液是碱性的,并由多种蛋白组成,例如前列腺特异性抗原(psa)、人激肽释放酶2(klk2)和β-微精原蛋白(β-msp)。前列腺液的主要功能是:1)准备精液的uturus的环境,这通过体液的碱性和β-msp的旁分泌功能来进行;以及2)增加精液的流动性,使精子自由游动,这通过蛋白酶psa和分解seminogelins的klk2来进行。
通过雄激素受体(ar)严格调节分泌蛋白的表达,所述雄激素受体(ar)结合睾酮并随后转移至核并活化转录。ar功能的中断表明在转录和蛋白水平上强力下调分泌蛋白。
图43示出在enr+二氢睾酮(dht)条件下生长的前列腺类器官的分层,明确表明细胞角蛋白5+基细胞形成细胞外层以及细胞角蛋白8+腔细胞形成强极化内层。在一些实施方案中,前列腺类器官包括细胞角蛋白5+基细胞和细胞角蛋白8+腔细胞,任选地,其中细胞角蛋白5+基细胞形成细胞外层以及细胞角蛋白8+腔细胞形成强极化内层。在一些实施方案中,前列腺类器官包括折叠的细胞层,任选地包括强折叠。这样的折叠使分泌细胞的表面积最大化,表明在形态水平上,前列腺类器官与体内前列腺类似。在一些实施方案中,前列腺类器官的形态与前列腺的体内形态类似。
在enr条件中培养的前列腺类器官不分泌前列腺液进入腔中。相反,向培养基添加睾酮(例如dht)导致在类器官腔中分泌体液,例如前列腺液。这归因于ar-依赖性转录程序在前列腺类器官中被睾酮(例如dht)活化,其导致由ck8+腔细胞分泌体液。数据表明前列腺类器官在形态和功能上均与体内前列腺上皮类似。
因此,在一些实施方案中,例如其中前列腺类器官在包括睾酮(例如dht)的培养基中培养,前列腺类器官分泌体液、例如前列腺液进入类器官的腔中。在一些实施方案中,例如其中前列腺类器官在包括睾酮(例如dht)的培养基中培养,前列腺类器官的功能与前列腺的体内功能类似。
组织碎块
在本发明的情形中,组织碎块是成体组织、优选人成体组织的一部分,例如人成体小肠、结肠或胰腺的一部分。在本发明情形中的人成体组织的其他实例包括胃部、肝脏和前列腺。组织可以为正常(健康)组织或其可以为病变或受感染的组织。因此,优选地,如本文所确定的类器官不是组织碎块。优选使用来自成体组织的细胞,优选来自成体组织、任选来自成体组织碎块的上皮干细胞,更优选来自表达lgr5的成体组织或成体组织碎块的上皮干细胞,从而获得类器官。因此,在本发明的情形中,组织碎块优选包括lgr5+干细胞。
在一实施方案中,类器官是使用本发明的方法(优选使用本发明的培养基)而仍正在培养的并因此与细胞外基质接触的类器官。优选地,将类器官嵌入非间充质细胞外基质。在本发明的情形中,“接触”意指物理或机械或化学接触,其表示为了从所述细胞外基质分离所述类器官需要使用力。在一些实施方案中,细胞外基质是由engelbreth-holm-swarm(ehs)小鼠肉瘤细胞、例如基质胶(bdbiosciences)而分泌的凝胶状蛋白混合物。在本发明的其他实施方案中,可以从培养物中移除类器官并用于移植或再生目的。因此,本发明提供了用于移植入哺乳动物、优选移植入人的本发明的类器官。
存活率
发明人在此首次表明,向先前所述干细胞培养基添加alk4、alk5、alk7或p38激酶的抑制剂将培养物涂板效率提高了至少50%,并且在一些情况中提高了100%以上(参见表2)。发明人已表明在培养基中包括两种抑制剂(alk抑制剂和p38抑制剂,例如a83-01和sb-202190)协同地延长了培养时间。
因此,在本发明的一些实施方案中,干细胞存活至少3个月,优选至少4个月、至少5个月、至少6个月、至少7个月、至少9个月或至少12个月以上。
增殖速度
基于细胞群倍增水平来评价增殖速度。群倍增水平是指群中的细胞从它们体外初始分离开始已加倍的总次数。群倍增水平可以通过细胞计数而测定。或者,增殖速度可以通过细胞增殖测试来评价,例如其中特异性荧光探针通过brdu并入测量dna合成活性以及通过ki67表达来测量细胞增殖(thermoscientific*cellomics,millipore)。
用于干细胞的细胞增殖测试的其他实例易于获得,能在线或在诸如currentprotocols的期刊中得到。许多实例中的一个是http://products.invitrogen.com/ivgn/en/us/adirect/invitrogen?cmd=catdisplaystyle&catkey=101&filterdispname=cellularproliferationassaysforstemcells&filtertype=1&op=filter&filter=ft_1101%2ff_494303*&_bcs_=h4siaaaaaaaaah2nsqrdmaxev0ztsekdkfmzzc70c4ijakfsgvuofz%2fk0i6f4x284c48yjxfhffm%0apq7gnsmby0ke6x8frdjmc7hv03u3le6swh9m1nnuwulqq1ufjkxgeivvotnsbn6lbl1ypshvqpyq%0adripfqe33rlnkq21lvuql7craaaa。
发明人已观察到使用本发明的培养基,细胞可扩增高达平均一周5倍。例如,生长两周的单细胞会平均产生约25个细胞。技术人员会理解到本发明的干细胞的平均群倍增时间可以根据诸多因素而变化,例如传代数、培养条件、接种密度等。
在一实施方案中,平均群倍增时间可为6-48小时、12-36小时、18-30小时或约24小时。例如,使用本发明的培养基而培养的干细胞群可以预期倍增每周约4-7次或约5次。
在另一实施方案中,平均群倍增时间为12-96小时、24-72小时或约72小时。在另一实施方案中,细胞群平均一周被整一次、多于两次、多于三次、多于四次或多于五次。
本发明类器官的其他性质
在优选实施方案中,可将类器官培养至少2、3、4、5、6、7、8、9、10周或1、2、3、4、5、6个月或更久。在优选实施方案中,可将类器官培养至少2、3、4、5、6、7、8、9、10周或1、2、3、4、5、6、7、8、9、10、11、12个月或更久。在另一优选实施方案中,类器官源自单细胞,优选表达lgr5的单细胞,更优选其中所述单细胞包含核酸构建体,所述核酸构建体含有目标核酸分子。
本发明还提供了类器官,其优选包括至少50%活细胞、更优选至少60%活细胞、更优选至少70%活细胞、更优选至少80%活细胞、更优选至少90%活性细胞。可以在facs中使用赫斯特染色或碘化丙啶染色来评价细胞的活性。
活细胞优选具有组织特异性功能或者组织特异性功能的特征,如上所述。
发明人已表明由本发明的培养基和方法产生的类器官可在-80℃以下冷冻并贮存,例如在液氮中。冷冻的类器官可以被解冻并放入培养物中,而不损失其3d结构和完整性,并且没有显著的细胞死亡。因此,在一实施方案中,本发明提供了在-5℃以下、-10℃以下、-20℃以下、-40℃以下、-60℃以下或-80℃以下贮存的冷冻类器官。
本发明的细胞和类器官与先前制备(wo2009/022907和wo2010/016766)的任何细胞和类器官不同,因为它们具有更好的表型(更好的分化谱,包括当添加用于隐窝-绒毛类器官的γ-分泌酶抑制剂时的杯形细胞转化)和染色体组型完整性(如上述方法所测定的)、更好的存活率和更快的细胞增殖速度。因此,对于肠、结肠和胰腺实施方案,本发明的类器官明显呈现具有表型和染色体组型完整性的完全保存以及增殖和分化的维持的人肠、结肠和胰腺上皮。
本发明的干细胞或类器官的用途
本发明提供了本发明的类器官或扩增群用于药物筛选、(药物)靶标确认、(药物)靶标发现、毒理和毒理筛选、个体化医疗、可再生医疗和/或用作离体细胞/器官模型如疾病模型的用途。
根据本发明的培养基和方法培养的细胞和类器官被认为如实地表达体内情形。这对于从正常组织生长的扩增细胞群和类器官以及对于从病变组织生长的扩增细胞群和类器官而言是准确的。因此,本发明的类器官或扩增细胞群不但可用作离体病变模型,还提供了正常离体细胞/器官模型。
本发明的类器官还可用于培养病原体,因此可用作离体感染模型。可以使用本发明的类器官而培养的病原体的实例包括在其动物宿主中引起疾病的病毒、细菌、朊病毒或真菌。因此,本发明的类器官可用作呈现感染状态的疾病模型。在本发明的一些实施方案中,类器官可用于疫苗开发和/或生产。
可通过本发明的类器官而研究的疾病因此包括遗传疾病、代谢疾病、病原性疾病、炎性疾病等,例如包括但不限于囊性纤维化、炎性肠疾病(例如克罗恩病)、癌、腺瘤、腺癌、结肠癌、糖尿病(例如i型或ii型)、巴雷特食管症、高雪氏病、α-1-抗胰蛋白酶缺乏症、lesch-nyhan综合征、贫血、schwachman-bodian-diamond综合征、真性红细胞增多症、原发性骨髓纤维化、糖原贮积症、家族性高胆固醇血症、crigler-najjar综合征、遗传性酪氨酸血症、庞倍氏症、进展性家族性胆汁郁积症、赫尔勒综合征、scid或渗漏性scid、omenn综合征、软骨-毛发发育不全、单纯疱疹性脑炎、硬皮病、成骨不全症、贝克肌营养不良、杜氏肌营养不良、先天性角化不良等。
通常,细胞系和最近的ips细胞已用作离体细胞/器官和/或疾病模型(例如,参见robinton等人,nature481,295,2012)。然而,这些方法经受许多挑战和劣势。例如,细胞系不能从所有患者获得(仅某些活体组织切片产生成功的细胞系),因此,细胞系不能用于个体化诊断和医疗。ips细胞通常需要某些水平的基因操作以将细胞再程序化为特定最终细胞类型。或者,它们经历影响染色体组型完整性的培养条件,因此在培养物中的时间必须保持最少(这对于人胚胎干细胞也一样)。这表明ips细胞不能准确地呈现体内情形,而是尝试模拟体内细胞的行为。细胞系和ips细胞还经受遗传不稳定性。
相反,本发明的类器官提供了如实呈现体内情形的遗传稳定的平台。本发明的类器官还连续地扩增,提供了良好的遗传稳定细胞源。特别地,扩增群可被“分割”,表明类器官被分割开,并且类器官的所有细胞被分成新的培养皿或培养瓶。从类器官移除分裂的细胞,然后其自身培养并扩增以产生包含进一步扩增的群的新的类器官,其然后被再次分割。分割本文还称为“传代”。本发明的类器官可被培养1次以上的传代,例如1、2、3、4、5、6、7、8、9、10、15、20、25、30次以上的传代,例如20-30次传代、30-35次传代、32-40次传代或更多次。在一些实施方案中,扩增细胞群或类器官被每月分割一次、每两周分割一次、一周分割一次、一周分割三次、一周分割四次、一周分割五次、一周分割六次或每天分割一次。因此,本发明的类器官可提供遗传稳定的细胞材料的持续源。在一些实施方案中,本发明的扩增类器官包括在相应的体内情形中存在的所有分化的细胞类型。在其他实施方案中,可以分化本发明的类器官以提供体内存在的所有分化细胞类型。因此,本发明的类器官可用于获得对多种疾病和治疗的机制的深入了解以进行体外药物筛选、以评价可能的治疗、以确定用于未来新颖(药物)治疗开发的可能的靶标(例如蛋白)和/或以探索与细胞替代疗法结合的基因修复。
本发明的类器官可被冷冻并解冻,并且被置于培养物中,而没有损失它们的基因完整性或表型特性,并且没有损失增殖能力。因此,类器官可被容易地贮存并运输。
由于这些原因,本发明的类器官或扩增细胞群可为用于药物筛选、靶标确认、靶标发现、毒理和毒理筛选以及个体化医疗的工具。
因此,在其他方面,本发明提供了扩增干细胞群或类器官、例如本发明的肠隐窝-绒毛类器官或胰腺类器官在药物发现筛选、毒性测试或医疗、例如再生医疗中的用途。例如,小肠、结肠、胰腺、胃、肝脏或前列腺类器官中任一种可用于药物发现筛选、毒性测试或用于医疗、例如再生医疗。
粘膜疫苗
类器官的其他重要的用途是开发粘膜疫苗。粘膜疫苗是通过粘膜给药的疫苗。其可以为任何粘膜表面,例如通过鼻、口或直肠。它们可以通过吸入器、喷雾器或其他外部辅助而给药。其与注射相比具有诸多明显的益处,例如不需要医疗人员来给药疫苗,这例如在发展中国家可为重要的。
在肠中,m细胞(或“微褶皱细胞”)是在回肠的聚集淋巴小结的卵泡相关上皮中得到的细胞。它们将生物体和颗粒从肠腔穿过上皮屏障运输至免疫细胞,并因此在刺激粘膜免疫中是重要的。它们以下独特能力,即,从小肠的腔通过内吞作用或吞噬作用吸收抗原并随后将其通过转胞吞作用而递送至位于其底外侧上的独特袋样结构中的树突细胞(抗原呈现细胞)和淋巴球(即t细胞)。
图48示出小鼠类器官当用rank配体刺激时可发育成m细胞。图49示出还可以在人长类器官中产生m细胞。因此,在本发明的一些实施方案中,扩增细胞群包括m细胞。在本发明的一些实施方案中,类器官、例如小肠类器官包括m细胞。
粘膜疫苗当它们靶向m细胞时可以显著增加它们的效率。因此,本发明的扩增干细胞群或类器官可用于测试m细胞吸收病原体或抗原以及将它们呈现给免疫系统的能力。因此,在一些实施方案中,本发明提供了本发明的扩增干细胞群或类器官在药物筛选、例如在疫苗开发和/或疫苗生产中的用途。例如,在一些实施方案中,扩增干细胞群或类器官可以用于开发或生产针对病毒、细菌、真菌或其他寄生虫感染、例如(但不限于)霍乱、呼吸道合胞病毒(rsv)、轮状病毒和hiv的疫苗。在特定实施方案中,本发明提供了用于粘膜疫苗开发的在包括rankl的本发明培养基中分化的小肠类器官。
药物筛选
出于优选高通量的目的,本发明的扩增干细胞群或类器官、例如隐窝-绒毛类器官或胰腺类器官在多孔板、例如96孔板或384孔板中培养。分子库(libraries)用于确定影响所述类器官的分子。优选的库包括抗体片段库、肽噬菌体展示库、肽库(例如lopaptm,sigmaaldrich)、脂质库(biomol)、合成化合物库(例如lopactm,sigmaaldrich)或天然化合物库(specs,timtec)。此外,可使用诱导或抑制干细胞后代中一种或多种基因的表达的基因库。这些基因库包括cdna库、反义库和sirna或其他非编码rna库。细胞优选暴露于多种浓度的受试作用剂某一时段。在暴露时段结束时,评价培养物。术语“影响”用于涵括细胞的任何变化,包括但不限于增殖的降低或丧失、形态变化和细胞死亡。本发明的扩增干细胞群或类器官、例如隐窝-绒毛类器官或胰腺类器官可用于确定特异性靶向上皮癌细胞但不靶向本发明的扩增干细胞群或类器官、例如隐窝-绒毛类器官或胰腺类器官的药物。
发明人已表明,可以从小肠采集活体组织切片并将其扩增7-14天并获得用于进行药物筛选的类器官。短时间获得可用的本发明类器官的能力表明该类器官高度可用于测试单独患者对具体药物的反应并根据反应来调整治疗。在一些实施方案中,其中从来自患者的活体组织切片获得类器官,将所述类器官培养小于21天,例如小于14天、小于13天、小于12天、小于11天、小于10天、小于9天、小于8天、小于7天(等)。
类器官还可用于广泛的药物发现目的。例如,图32至40表明从健康患者和从囊性纤维化患者采集的小肠类器官可用于测试针对囊性纤维化的药物。特别地,图32至40表明正常小肠类器官的毛喉素诱导膨胀取决于囊性纤维化跨膜电导调节因子(cftr),因此可以将毛喉素诱导膨胀用作正读出来测验cftr函数的修正。因此,在一些实施方案中,本发明的类器官可用于筛选囊性纤维化药物。然而,技术人员会理解的是,本发明的类器官会广泛地用作用于以下的药物筛选工具:人胃肠道的感染病理、炎性病理和肿瘤病理,以及胃肠道的其他疾病,以及本文所述其他组织、例如胰腺、肝脏和前列腺的感染病理、炎性病理和肿瘤病理以及其他疾病。在一些实施方案中,本发明的类器官可用于筛选癌症药物。
在一些实施方案中,扩增细胞群,例如本发明的类器官或使用本发明的培养基和方法而获得的类器官,可用于测试适用作药物、化妆品和/或预防医疗的化学库、抗体库、天然产品(植物提取物)库等。例如,在一些实施方案中,来自目标患者的细胞活体组织切片、例如来自癌症患者的肿瘤细胞,可使用本发明的培养基和方法而培养,然后用化学化合物或化学库来处理。然后,可以测定那种化合物有效修饰、杀灭和/或治疗患者的细胞。这使特定患者对特定药物的反应得到测试,因此允许对特定患者调整治疗。因此,这允许个体化医疗方法。
以该方式使用用于确定药物的类器官的额外优势在于还可以筛选正常类器官(源自健康组织的类器官)以检查药物和化合物是否对健康组织具有最小作用。这允许筛选具有最小脱靶活性或不期望副作用的药物。
以该方式可以筛选用于多种疾病的药物。例如,本发明的类器官可用于筛选用于以下的药物:囊性纤维化、巴雷特食管症、癌、腺癌、腺瘤、炎性肠疾病(例如克罗恩病)、肝病等。测试参数取决于目标疾病。例如,当筛选癌症药物时,癌细胞死亡通常为最终目标。对于囊性纤维化,测量类器官扩增对药物和cftr刺激物的反应是目标。在其他实施方案中,可以评价代谢或基因表达以研究筛选的药物和化合物对目标细胞或类器官的作用。
因此,本发明提供了用于筛选治疗药物或预防药物或化妆品的方法,其中所述方法包括:
例如用本发明的培养基将本发明的扩增细胞群(例如类器官)培养任选至少21天;
将本发明所述扩增细胞群(例如类器官)暴露于一种候选分子或候选分子库;
评价所述扩增细胞群(例如类器官)的任何作用,例如细胞的任何变化、例如增殖的降低或丧失、形态变化和/或细胞死亡;
确定导致所述作用的候选分子作为潜在药物或化妆品。
在一些实施方案中,利用计算机-或机械人-辅助培养和数据采集方法以增加筛选的通量。
在一些实施方案中,从患者活体组织切片获得扩增细胞群(例如类器官)。在一些实施方案中,向所述患者给药对培养的扩增细胞群(例如类器官)产生所需作用的候选分子。
因此,在一方面,提供了治疗患者的方法,其包括:
(a)从患者的目标病变组织获得活体组织切片;
(b)使用本发明的筛选方法筛选合适的药物;以及
(c)用在步骤(b)获得的药物治疗所述患者。
在一些实施方案中,药物或化妆品可用于治疗、预防或改善以下的症状:遗传疾病、代谢疾病、病原性疾病、炎性疾病等,例如包括但不限于囊性纤维化、炎性肠疾病(例如克罗恩病)、癌、腺瘤、腺癌、结肠癌、糖尿病(例如i型或ii型)、巴雷特食管症、高雪氏病、α-1-抗胰蛋白酶缺乏症、lesch-nyhan综合征、贫血、schwachman-bodian-diamond综合征、真性红细胞增多症、原发性骨髓纤维化、糖原贮积症、家族性高胆固醇血症、crigler-najjar综合征、遗传性酪氨酸血症、庞倍氏症、进展性家族性胆汁郁积症、赫尔勒综合征、scid或渗漏性scid、omenn综合征、软骨-毛发发育不全、单纯疱疹性脑炎、硬皮病、成骨不全症、贝克肌营养不良、杜氏肌营养不良、先天性角化不良等。
靶标发现
在一些实施方案中,本发明的类器官或使用本发明的培养基或方法而生长的细胞可用于靶标发现。源自健康或病变组织的类器官的细胞可用于靶标确认。本发明的类器官可用于对于以下的药物靶标的发现:囊性纤维化、炎性肠疾病(例如克罗恩病)、癌、腺瘤、腺癌、结肠癌、糖尿病(例如i型或ii型)、巴雷特食管症、高雪氏病、α-1-抗胰蛋白酶缺乏症、lesch-nyhan综合征、贫血、schwachman-bodian-diamond综合征、真性红细胞增多症、原发性骨髓纤维化、糖原贮积症、家族性高胆固醇血症、crigler-najjar综合征、遗传性酪氨酸血症、庞倍氏症、进展性家族性胆汁郁积症、赫尔勒综合征、scid或渗漏性scid、omenn综合征、软骨-毛发发育不全、单纯疱疹性脑炎、硬皮病、成骨不全症、贝克肌营养不良、杜氏肌营养不良、先天性角化不良等。根据本发明的培养基和方法而培养的细胞和类器官被认为如实地呈现体内情形。对此,它们可为发现具体疾病中新颖(分子)靶标的工具。
为研究新的药物靶标,化合物库(例如sirna)可用于转导细胞并使具体基因失活。在一些实施方案中,用sirna转导细胞以抑制基因(大)组的功能。基因组的任何功能读出或特异性细胞功能可用于确定靶标是否与研究相关。使用本领域公知的测定来测定疾病特异性读出。例如,测定细胞增殖以检测涉及癌症的基因。例如,本文所述的topflash测试可用于检测由sirna抑制导致的wnt活性的变化。当出现生长降低或细胞死亡时,可以通过本领域已知的方法来确定相对应的sirna相关基因。这些基因可能为用于抑制这些细胞生长的靶标。当确定时,用于被研究的细胞过程的经确定的靶标的特异性会需要通过本领域公知方法来确定。使用这些方法,可以将新的分子确定为用于治疗的可能的药物靶标。
靶标和药物确认筛选
从病变和/或正常组织获得的患者特异性类器官可用于在高通量筛选中确定的分子的靶标确认。对于在高通量筛选中被确定为可能的治疗药物的化合物的确认也是相同的。在类器官培养系统中扩增的原始患者材料的使用可用于检测来自高通量药物发现细胞系研究的假阳性等。
在一些实施方案中,扩增的干细胞群(例如,本发明的类器官)、例如隐窝-绒毛类器官或胰腺类器官,可用于确认在高通量筛选中被确定为可能的药物或化妆品的化合物。
毒性测试
扩增的干细胞群(例如,本发明的类器官)、例如隐窝-绒毛类器官或胰腺类器官,可进一步替代细胞系如caco-2细胞在潜在新颖的药物或者已知或新颖的食品补充剂的毒性测试中的使用。
毒理筛选以与药物筛选(如上所述)类似的方式运行,但它们测试药物的毒性而非治疗作用。因此,在一些实施方案中,候选药物的作用是有毒的。
培养病原体
此外,扩增的干细胞群(例如,本发明的类器官)、例如隐窝-绒毛类器官或胰腺类器官,可用于培养病原体,例如目前缺少合适的组织培养物或动物模型的诺瓦克病毒。
再生医疗和移植
包括扩增干细胞群(例如本发明的类器官)、例如隐窝-绒毛类器官或胰腺类器官的培养物可用于再生医疗,例如用于肠上皮的放射后和/或术后修复、用于经受炎性肠疾病如克罗恩病和溃疡性结肠炎的患者中的肠上皮的修复、以及用于经受短肠综合征的患者中的肠上皮的修复。其他用途呈现于患有小肠/结肠遗传性疾病的缓和中的肠上皮的修复。包括胰腺类器官的培养物还可用于再生医疗,例如用作在胰腺或其一部分切除之后的移植物,以及用于治疗糖尿病、例如糖尿病i和糖尿病ii。
在可替代的实施方案中,扩增的上皮干细胞被再程序化为相关最终组织类型例如包括胰腺β-细胞的胰腺细胞。迄今,不可能由成体干细胞再生胰腺细胞。本发明的培养方法将能够分析将最相关的上皮干细胞转分化成包括胰腺β-细胞的胰腺细胞的因子。
对技术人员显而易见的是,基因治疗还可用于涉及修复受损或病变组织的方法。例如,可由腺病毒基因或逆转录病毒基因递送载体形成用于向干细胞递送诸如dna和/或rna的遗传信息的用途。技术人员可替换或修复在基因治疗中靶向的特定基因。例如,可将正常基因插入基因组内的非特异性位置以替换无功能基因。在另一实例中,异常基因序列可通过同源重组而被替换成正常基因序列。或者,选择性复原突变可使基因恢复成其正常功能。其他实例是改变特定基因的调节(程度为基因被开启或关闭)。优选地,通过基因治疗方法离体治疗干细胞并随后将其转移至需要治疗的哺乳动物、优选人。
因为可以扩增从成年供体采集的小活体组织切片且没有明显的限制或遗传危害,所以该技术可用于产生用于再生目的的可移植的上皮。可将类器官冷冻并解冻并放入培养物且未损失其3d结构和完整性且没有显著细胞死亡的事实为移植目的增加了类器官的适用性。此外,在一些实施方案中,嵌入ecm或与其接触的类器官可被移植入哺乳动物、优选移植入人。在另一实施方案中,可以同时将类器官和ecm移植入哺乳动物、优选移植入人。
技术人员会理解,ecm可用作3d支架以获得包括本发明的扩增细胞群或类器官的组织状结构。然后,可将这样的结构通过本领域公知的方法移植入患者。可使用ecm蛋白、例如胶原和/或层粘连蛋白合成地制备ecm支架,或者可通过将分离的器官或组织碎块“脱细胞”以留下由ecm组成的支架来获得ecm支架(例如参见macchiarini等人,thelancet,372卷,9655期,2023–2030页,2008年)。在一些实施方案中,通过将器官或组织碎块脱细胞来获得ecm支架,其中任选地,所述器官或组织碎块来自胰腺、肝脏、肠、胃部或前列腺。
如上所述,本发明提供了用于移植入哺乳动物、优选移植入人的本发明的类器官或细胞群。还提供了治疗需要移植物的患者的方法,其包括将本发明的类器官或细胞群移植入所述患者,其中所述患者为哺乳动物、优选人。
有利地,本发明能从成年供体采集小活体组织切片并扩增且没有任何明显限制或遗传危害,因此本文所提供的技术可用于产生用于再生目的的可植入的上皮。
有意义地,发明人已发现当本发明的人胰腺类器官被植入小鼠的肾筋膜下时,这些细胞分化以形成分泌胰岛素的β细胞。这是有意义的,因为其表明即使本发明的细胞群或类器官不以可检测水平分泌胰岛素并将细胞或类器官在体外培养,这些细胞也可用于植入患者以治疗胰岛素缺乏症、例如糖尿病。
因此,本发明包括治疗胰岛素缺乏症如糖尿病或者具有功能失调胰腺的患者的方法,其包括将本发明的胰腺类器官或来自本发明的胰腺类器官的细胞移植入所述患者。
在一些实施方案中,细胞或类器官当移植入患者时不表达或分泌胰岛素,但在患者内分化以使它们分泌胰岛素。例如,分泌胰岛素的能力可以当移植之后不立即为可检测的,但在移植之后约1个月内呈现,例如移植之后6周、2个月或3个月。
患者优选为人,但可以可替代地为非人哺乳动物,例如猫、狗、马、牛、猪、绵羊、兔或小鼠。
因此,通过细胞疗法治疗人或非人动物患者的方法包括在本发明的范围内。这样的细胞疗法包括通过任何合适手段将本发明的干细胞或类器官施用于患者。具体地,这样的治疗方法包括再生受损组织。根据本发明,可用同种异体或自体干细胞或类器官治疗患者。“自体”细胞是源自相同生物体并且被再引入该生物体以用于细胞疗法、例如用于允许组织再生的细胞。然而,细胞不必从与它们被引入的组织相同的组织分离。自体细胞不需要与患者匹配以克服排斥问题。“同种异体”细胞是源自与细胞引入的个体(以用于细胞疗法、例如用于允许组织再生)不同的个体的细胞,尽管具有相同物种。可能仍需要一定程度的患者匹配以防止排斥问题。
通常,将本发明的细胞或类器官通过注射或移植而引入患者身体中。通常,细胞将被直接注射入其中它们意图发挥作用的组织。或者,细胞通过门静脉而注射。包括本发明的细胞和药物可接受的载体的注射器包括在本发明的范围内。与包括本发明的细胞和药物可接受的载体的注射器连接的导管包括在本发明的范围内。
技术人员能根据所移植的材料(即,细胞群、细胞混悬液中的单细胞、类器官或类器官碎片)以及所治疗的器官来选择合适的给药方法和途径。
如上所述,本发明的细胞可用于再生组织。为了实现该功能,细胞可被直接注射或移植入受损组织,其中根据它们在体内的位置,它们可繁殖并最终分化成所需细胞类型。或者,类器官可被直接注射或移植入受损组织。受治疗影响的组织包括所有受损组织,尤其包括可被疾病、损伤、创伤、自身免疫反应或通过病毒或细菌感染而损害的那些组织。在本发明的一些实施方案中,本发明的细胞或类器官用于再生结肠、小肠、胰腺、食管或胃系统。
例如,在一实施方案中,使用hamilton注射器,将本发明的细胞或类器官注入患者。
技术人员会意识到对于待治疗的特定病况本发明的细胞或类器官的合适剂量为多少。
在一实施方案中,将在多种成分的溶液、微球或微粒中的本发明的细胞或类器官给予灌溉需要再生的组织或受损器官部分的动脉。通常,使用导管进行这样的给药。导管可为用于血管成形术和/或细胞递送的多种气囊式导管之一,或设计为将细胞递送至身体的特定局部的具体目的的导管。对于某些应用,细胞或类器官可被封装在由多种不同的生物可降解化合物制成且直径为约15μm的微球中。这种方法可以允许血管内给予的细胞或类器官保持在受损位点且不穿过毛细管网络并且进入最初通过的全身循环中。在毛细管网络动脉侧的停留还可促进它们转运入血管外空间。
在另一实施方案中,细胞或类器官可以被逆行注射入血管树,所述细胞括类器官通过静脉以将它们递送至全身,或局部注射入流入所述细胞或类器官所涉及的器官或身体部分的特定静脉。对于次实施方案,可以使用上述的许多制剂。
在另一实施方案中,本发明的细胞或类器官可以被植入与生物相容性植入物粘附的受损组织。在该实施方案中,细胞可以在植入患者之前与生物相容性植入物体外粘附。如本领域技术人员所明确的,多种粘附剂中任一种可用于在移植之前将细胞与植入物粘附。仅通过实例方法,这样的粘附剂可以包括纤维蛋白、整合素家族中一个或多个成员、钙粘素家族中一个或多个成员、选择素家族中一个或多个成员、一种或多种粘附分子(cam)、免疫球蛋白家族中一种或多种以及一种或多种人工粘附剂。该列举仅以例示方式提供,并不旨在进行限制。本领域技术人员显而易见的是,可以使用一种或多种粘附剂的任何组合。
在另一实施方案中,在将基质移植入患者之前,可以将本发明的细胞或类器官嵌入基质。通常地,基质被移植入患者的受损组织。基质的实例包括基于胶原的基质、基于纤维蛋白的基质、基于层粘连蛋白的基质、基于纤连蛋白的基质和人工基质。该列举仅以例示方式提供,并不旨在进行限制。
在其他实施方案中,可将本发明的细胞或类器官连同形成基质的组分一起移植或注射入患者。这可以使细胞在注射或移植之后形成基质,确保细胞或类器官保持在患者内的合适位置处。形成基质的组分的实例包括烷基纤维蛋白凝胶液(fibringlueliquidalkyl)、氰基丙烯酸酯单体、增塑剂、多糖如葡聚糖、含氧化乙烯的低聚物、嵌段共聚物如泊洛沙姆和普朗尼克、非离子表面活性剂如吐温和triton'8'、以及形成人工基质的组分。该列举仅以例示方式提供,并不旨在进行限制。本领域技术人员显而易见的是,可以使用一种或多种形成基质的组分的任何组合。
在其他实施方案中,本发明的细胞或类器官可以包括在微球内。在该实施方案内,可将细胞封装在微球的中心。还在该实施方案内,可将细胞嵌入微球的基质材料。基质材料可以包括任何合适的可生物降解聚合物,包括但不限于藻酸酯、聚乙二醇(plga)和聚氨酯。该列举仅以实例方式提供,并不旨在进行限制。
在其他实施方案中,本发明的细胞或类器官可以与意欲移植的医疗装置粘附。这样的医疗装置的实例包括支架、针、缝针、splits、起搏器、假关节、人造皮肤和杆棒。该列举仅以例示方式提供,并不旨在进行限制。本领域技术人员明确的是,细胞可以通过多种方法与医疗装置粘附。例如,可以使用纤维蛋白、整合素家族中一个或多个成员、钙粘素家族中一个或多个成员、选择素家族中一个或多个成员、一种或多种粘附分子(cam)、免疫球蛋白家族中一种或多种以及一种或多种人工粘附剂,从而将细胞或类器官与医疗装置粘附。该列举仅以例示方式提供,并不旨在进行限制。本领域技术人员显而易见的是,可以使用一种或多种粘附剂的任何组合。
本发明的方法
本发明还提供了用于扩增干细胞的方法,其中所述方法包括:
a)提供干细胞群;
b)提供本发明的培养基;
c)使所述干细胞与所述培养基接触;以及
d)在合适的条件下培养所述细胞。
此外,本发明提供了用于扩增分离的组织碎块的方法,其中所述方法包括:
a)提供分离的组织碎块;
b)提供本发明的培养基;
c)使所述分离的组织碎块与所述培养基接触;以及
d)在合适的条件下培养所述细胞。
用于“扩增”细胞群或分离的组织碎块的方法是包括在初始群中维持或增加干细胞数量以产生扩增的干细胞群的方法,所述扩增的干细胞群保持其未分化的表型和自我更新性质。然而,其还可以包括产生分化的后代,所述后代可以例如形成促进类器官形成的组织样结构。因此,本文提供了用于获得类器官的方法,所述类器官例如小肠(隐窝-绒毛)类器官、结肠类器官、胰腺类器官、胃类器官、前列腺类器官、肝脏类器官、腺癌类器官、癌类器官或巴雷特食管类器官,所述方法包括在本发明的培养基中培养干细胞或包括所述干细胞的组织碎块。本发明提供了用于扩增单干细胞、干细胞群优选产生类器官的方法,其中所述方法包括在本发明的培养基中培养单干细胞、干细胞群或组织碎块。在一些实施方案中,用于获得类器官的方法包括用第一“扩增”培养基培养干细胞或组织碎块,然后用第二“分化”培养基培养所述干细胞或组织碎块。在一些实施方案中,分化培养基不包括扩增培养基的某些组分,例如分化培养基不包括wnt、rspondin、烟酰胺、tgf-β抑制剂和/或p38抑制剂。
在一些实施方案中,用于扩增单干细胞或干细胞群优选产生类器官的方法包括在本发明的第一培养基中扩增所述单干细胞、干细胞群或组织碎块,并且任选地,在本发明的第二培养基中分化所述扩增的细胞或组织碎块。
因此,本发明提供了用于扩增单干细胞或干细胞群优选产生类器官的方法,其中所述方法包括:
提供干细胞、干细胞群或分离的组织碎块;
提供本发明的培养基;
使所述干细胞与所述培养基接触;
在合适的条件下培养所述细胞。
在一些实施方案中,所述方法包括使干细胞、干细胞群或分离的组织碎块以及培养基与细胞外基质或通过与细胞膜蛋白如整合素相互作用而模拟细胞外基质的3d基质接触,所述细胞外基质例如含层粘连蛋白的细胞外基质,诸如matrigeltm(bdbiosciences)。在一些实施方案中,将培养基扩散入细胞外基质。
在一些实施方案中,本发明提供了用于扩增单干细胞或干细胞群或组织碎块优选产生类器官的方法,其中所述方法包括:
在第一扩增培养基中培养干细胞、干细胞群或组织碎块;
继续培养所述干细胞、干细胞群或组织碎块并且用分化培养基补充所述培养基,其中所述分化培养基不包括选自以下的一种或多种因子、优选不包括所有所述因子:tgf-β抑制剂、p38抑制剂、烟酰胺和wnt。
在一些实施方案中,本发明提供了用于扩增单干细胞或干细胞群优选产生目标组织的类器官的方法,其包括:
在适于所述目标组织的本发明的培养基中扩增来自所述目标组织的干细胞或组织碎块;并且任选地,在适于所述目标组织的本发明的培养基中分化所述扩增的干细胞或组织碎块。
分离的干细胞优选在至少部分模拟所述干细胞天然存在的细胞壁龛的微环境中培养。通过在呈现控制干最终细胞类型的关键调节信号的生物材料的存在下培养所述干细胞来模拟所述细胞壁龛,所述生物材料例如基质、支架和培养底物。所述生物材料包括天然的、半合成的和合成的生物材料和/或其混合物。支架提供了二维或三维的网络。适于所述支架的合成材料包括选自多孔固体、纳米纤维和水凝胶的聚合物,例如包括自我组装肽在内的肽,由聚乙二醇磷酸酯、聚乙二醇延胡索酸酯、聚丙烯酰胺、聚甲基丙烯酸羟乙酯、聚乙酸纤维素和/或其共聚物组成的水凝胶(参见例如saha等人,2007curropinchembiol11(4)381-387,saha等人,2008biophysicaljournal954426-4438,little等人,2008chemrev108,1787-1796)。如技术人员所已知的,支架的机械性质、例如弹性影响干细胞的增殖、分化和迁移。优选的支架包括在植入个体之后被天然组分所替代以例如促进组织再生和/或伤口愈合的可生物降解(共)聚合物。此外,优选的是,所述支架在植入个体之后基本不诱导免疫原反应。所述支架补充有天然的、半合成的或合成的配体,所述配体提供了干细胞增殖和/或分化和/或迁移所需的信号。在优选实施方案中,所述配体包括限定的氨基酸片段。所述合成的聚合物的实例包括
通过干细胞和周围的细胞以及由所述壁龛中的细胞产生的细胞外基质(ecm)来部分地确定细胞壁龛。在本发明的一实施方案中,分离的隐窝或上皮干细胞与ecm连接。ecm由多种多糖(主要为硫酸肝素蛋白多糖)、水、弹性蛋白和和糖蛋白组成,其中糖蛋白包括胶原、巢蛋白(entactin)(巢蛋白(nidogen))、纤连蛋白和层粘连蛋白。ecm由结缔组织细胞分泌。不同类型的ecm是已知的,其包括不同组合物,包括不同类型的糖蛋白和/或糖蛋白的不同组合。通过在容器中培养ecm生成细胞、例如成纤维细胞来提供ecm,然后移除这些细胞,并且添加分离的隐窝或上皮干细胞。外基质生成细胞的细胞的实例为:软骨细胞,主要产生胶原和蛋白聚糖;成纤维细胞,主要产生iv型胶原、层粘连细胞、间质原胶原和纤连蛋白;以及结肠成肌纤维细胞,主要产生胶原(i、iii和v型)、硫酸软骨素蛋白聚糖、透明质酸、纤连蛋白和腱生蛋白-c。或者,ecm为可商业提供的。商业提供的ecm通常为合成的ecm。可商购的细胞外基质的实例为细胞外基质蛋白(invitrogen)和matrigeltm(bdbiosciences)。用于培养干细胞的ecm的使用增加了干细胞的长期存活和未分化干细胞的连续存在。
用于本发明方法的ecm的实例包括至少两种不同的糖蛋白,例如两种不同类型的胶原或者胶原和层粘连蛋白。ecm可为合成的水凝胶细胞外基质或天然存在的ecm。由matrigeltm(bdbiosciences)提供最优选的ecm,其包括层粘连蛋白、巢蛋白和胶原iv。因此,在一些实施方案中,用于本发明方法的ecm为通过与细胞膜蛋白如整合素相互作用而模拟细胞外基质的3d基质。
因此,在一些实施方案中,本发明的方法包括使干细胞、干细胞群或分离的组织碎块以及培养基与细胞外基质接触,所述细胞外基质例如含层粘连蛋白的细胞外基质,诸如matrigeltm(bdbiosciences)。在一些实施方案中,将培养基扩散入细胞外基质。
本发明的组合物及其他形式
本发明提供了包括本发明的培养基和干细胞的组合物。本发明提供了还包括本发明的培养基和类器官的组合物。此外,本发明提供了包括本发明的培养基和细胞外基质的组合物。
本发明还提供了包括本发明的培养基、细胞外基质和本发明的干细胞的组合物。本发明还提供了包括本发明的培养基、细胞外基质和一种或多种本发明的类器官的组合物。本发明还提供了可用于产生本文所述培养基的培养基补充剂。“培养基补充剂”是自身不能支持干细胞、但当与其他细胞培养成分结合时能使干细胞培养或改进干细胞培养的成分的混合物。因此,补充剂可用于通过与其他细胞培养成分结合以产生合适的培养基制剂来产生本发明的功能细胞培养基。培养基补充剂的使用在本领域是公知的。
本发明提供了包括本发明抑制剂的培养基补充剂。补充剂可以包括本文所公开的任何抑制剂(或抑制剂的组合)。补充剂还可以包括一种或多种本文所述的额外地细胞培养成分,例如一种或多种选自氨基酸、维生素、无机盐、碳能源和缓冲剂的细胞培养成分。
培养基或培养基补充剂可以为浓缩液体培养基或补充剂(例如2倍至250倍浓缩液体培养基或补充剂)或可以为干燥的培养基或补充剂。液体和干燥的培养基或补充剂在本领域中是公知的。可以冻干培养基或补充剂。
本发明的培养基或补充剂通常在使用前例如通过紫外线、加热、辐射或过滤来消毒以防止污染。培养基或培养基补充剂可以被冷冻(例如在-20℃或-80℃)以用于贮存或运输。在一些实施方案中,培养基可以以液体形式贮存(例如在约4℃)。在一些实施方案中,培养基可以被分割并以两组分形式贮存:冷冻组分(例如在约-20℃至约-80℃)和液体组分(例如在约4℃)。特别地,在冷冻组分中优选包括温度敏感性或时间敏感性可降解材料,而在液体形式中可贮存更不敏感的材料(例如dmem或fcs)并由此包括在液体组分中以用于贮存和运送。
本发明还提供了包含本发明培养基或本发明培养基补充剂的气密容器。气密容器可以优选用于运输或贮存本文公开的培养基或培养基补充剂以防止污染。容器可以为任何合适的容器,例如烧瓶、板、瓶、广口瓶、小瓶或袋。
本发明还提供了包括本发明的培养基、培养基补充剂和/或组合物的试剂盒。在一些实施方案中,试剂盒还包括至少一种其他额外的组分,例如其选自:cm(例如matrigeltm)、细胞群以及类器官。
概述
以上使用“gi”编号。gi编号或“geninfoidentifier”是当序列被添加至其数据库时由ncbi加工的一系列连续分配给每一序列记录的数字。gi编号不具有与序列记录的登记号的类似之处。当升级序列(例如用于矫正或用于添加注释或信息)时,则其接收新的gi编号。因此,与给定gi号相关的序列从不变化。
术语“包括(comprising)”涵括了“包含(including)”以及“由...组成”,例如“包括”x的组合物可以仅有x组成,或者可以包含额外的物质,例如x+y。
措辞“基本”不排除“完全”,例如,基本不含y的组合物可以完全不含y。若需要,措辞“基本”可以从本发明的定义中省略。
与数值x相关的术语“约”是任选的,并且表示例如x+10%。
除非具体指出,则包括将两种以上的成分混合的步骤的方法不需要任何特定混合次序。因此,组分可以任何次序混合。当存在三种组分时,则两种组分可彼此结合,然后该组合可与第三组分等结合。
通过实施例,以下更详细地描述了本发明的多个方面和实施方案。要认识到在不背离本发明的范围的情况下可以进行细节的修改。
附图描述
图1:小鼠结肠培养
a.左侧:axin2表达处于wnt信号转导途径的控制下。用egf、noggin和r-spondin(enr)培养3天的axin2-lacz报告小鼠的结肠隐窝类器官。不存在lacz染色表明在enr生长条件下于结肠类器官中不存在活性wnt信号。插图示出在从axin2-lacz报告小鼠新鲜分离的结肠隐窝中由lacz表达(暗斑)可视化的活性wnt信号转导。右侧:用enr+wnt3a(wenr)培养10天的源自axin2-lacz小鼠的结肠隐窝。暗斑表明在这些类器官中的lacz表达。
b.左侧:用enr培养3天的lgr5-gfp-ires-creer结肠隐窝。不存在gfp荧光表明在enr生长条件下于结肠类器官中lgr5表达的损失。插图示出在从lgr5-gfp-ires-creer小鼠新鲜分离的结肠隐窝中的lgr5-gfp表达。右侧:用wenr培养10天的lgr5-gfp-ires-creer结肠隐窝表明lgr5干细胞的存在。
c.在三种条件下测定培养效率:enr、wenr完整隐窝、以及在轻度酶消化之后的wenr隐窝。从近侧结肠(黑色柱)或远侧结肠(白色柱)分离结肠隐窝。*:p<0.05。
d,e:在从wenr培养基移除wnt3a之后4天形成类器官分化。d.能看到在肠内分泌细胞中的嗜铬粒蛋白a(cha);在杯形细胞中的粘蛋白2(muc2)以及用dapi的复染色。e.由粘性磷酸酶染色可视化成熟肠上皮细胞。
f.示出成熟上皮细胞标志物(vil1(绒毛蛋白1)、alpi(碱性磷酸酶)、chga(嗜铬粒蛋白a)、muc2(粘蛋白2))的相对mrna表达。将wenr培养的结肠隐窝类器官在wenr(阴影图案)或enr(黑色)条件中培养4天。将新鲜分离的结肠隐窝(白色)用于对照。a、b、d、e中的比例尺:50μm。误差条表明s.e.m.n=3。
图2:人结肠培养
a.烟酰胺对人结肠隐窝类器官的作用。大部分人结肠隐窝类器官于wenr+胃泌激素(wenrg)条件(左面板)中在几天内死亡。添加烟酰胺(中面板)改进了培养效率和人结肠类器官的使用寿命。*p<0.001.nic:烟酰胺。
b.用于alk4/5/7(a83-01)和用于map激酶p38(sb202190)的小分子抑制剂对人结肠隐窝类器官的作用。左面板:在含wenrg+烟酰胺的培养基中培养的人结肠类器官在培养之后3-4周形成囊状结构。中间面板:人结肠类器官在人肠干细胞培养(“hisc”)条件(wenrg+烟酰胺+a83-01+sb202190)下保持其特有芽殖结构。右面板:a83-01和sb202190协同增加人结肠类器官的传代数。*p<0.001。n.s.=统计学不显著的。误差条表示s.e.m.n=5。
c.通过并入edu而可视化的增殖细胞被局限于芽殖结构。dapi用作复染色。
d.来自3月龄人结肠隐窝类器官的染色体组型的典型图像。比例:100μm。
e.培养的人肠类器官的表达谱的热图。热图是人小肠隐窝和人小肠绒毛的比较。在隐窝中高度表达的基因为深灰色(热图的上半部),在绒毛中更加高度表达的基因为浅灰色(热图的下半部)。体外培养的类器官明显表现出与新分离的小肠隐窝类似的表达谱并表达已知的干细胞标志物。(线1:人小肠类器官#1,线2:人小肠类器官#2,线3:人结肠类器官,线4:新分离的人小肠隐窝。四个样品与人小肠绒毛比较)。
图3:人肠类器官细胞类型组成
(a-c)人类器官在撤回烟酰胺和sb202190之后分化成不同细胞类型的肠。不同细胞类型的标志物用于示出分化。(a)顶面板:成熟肠上皮细胞的碱性磷酸酶染色,中面板:杯形细胞的pas染色,底面板:肠内分泌细胞的突触素染色。(b)在每一情况中,发光区域表示染色。中面板中的粘蛋白2(muc2)染色表示杯形细胞,并且左手面板中的嗜铬粒蛋白a(chga)表示肠内分泌细胞(参见箭头和插图)。dapi用作复染色(右面板)。(c)在左手面板中染色溶菌酶(lysz)以示出潘氏细胞。dapi用作复染色(右面板)。
(d-f)通过sb202190处理类器官(d)阻断杯形细胞分化(muc2),同时notch抑制剂dbz增加人类器官(f)中的杯形细胞数。通过edu并入(中间面板)在sb202190处理的类器官(d)中得到增加或在dbz处理的类器官(f)中得到降低来表示分化细胞。
类器官在以下条件下培养5天:a)顶部:enrg+a83-01+sb202190+烟酰胺,a)中部和底部、b)、c)wenrg+a83-01,d)wenrg+a83-01+sb202190,e)wenrg+a83-01,f)wenrg+a83-01+dbz。
比例尺:20μm(a),50μm(b-f).a,b,d-f:人结肠隐窝类器官,c:人小肠类器官。
图4:腺瘤(腺癌)培养物
a.用egf(e)(顶部)或egf+noggin(en)(底部)培养10天的lgr5-gfp-ires-creer/apcfl/fl隐窝。b.lgr5和axin2的相对mrna表达。用egf(阴影)或egf+noggin(黑色)培养新分离的腺瘤细胞(白色)。
c.来自分选的lgr5-gfphi、lgr5-gfplo、lgr5-gfp-ve细胞的类器官培养效率。*p<0.01。单因素anova。误差条表示s.e.m.n=3。
d.人结肠腺癌细胞的时间进程培养。
图5:巴雷特食管的培养和用notch抑制剂的处理
a.从用hisc条件培养7天的巴雷特食管(be)分离的上皮形成囊状结构。b.添加fgf10显著增加be类器官的传代数。误差条表示s.e.m.n=3。c.be类器官的典型时间进行。d.来自be类器官的石蜡切片。在向培养基添加(右侧)或不添加(左侧)notch抑制剂dbz的情况下,撤回烟酰胺和sb2021904天。增殖细胞(ki67染色)消失并且pas+杯形细胞通过dbz处理而增加。
图6:在wnt-3a存在下于小鼠结肠类器官中恢复axin2mrna表达
分析分离的结肠隐窝在用enr(阴影)或wenr(黑色)培养3天或7天之后的axin2mrna表达。将新分离的结肠隐窝用作对照。误差条表示s.e.m.n=3。
图7:成熟上皮细胞标志物的相对mrna表达
在hisc条件中培养新分离的小肠隐窝(白色)14天,然后用所示培养条件培养4天。分析alpi(碱性磷酸酶)、vil1(绒毛蛋白1)、lyz(溶菌酶)、chgb(嗜铬粒蛋白b)和muc2(粘蛋白2)的mrna表达。培养条件:hisc(黑色)、enrg+a83-01+sb202190+烟酰胺、wenrg+a83-01、enrg+a83-01、enrg。新分离的小肠隐窝用作对照(对于alpi、vil1和lyz设定为1.0,对于chgb和muc2设定为5.0)。误差条表示s.e.m.n=3。
图8分选的lgr5-gfp-细胞形成lgr5-gfp+类器官
用egf+noggin(en)或egf(e)培养单次分选的lgr5-gfp-apcfl/fl腺瘤细胞7天。源自lgr5-gfp-细胞的腺瘤类器官在en条件但不在e条件下恢复lgr5-gfp表达(a,c:明亮的,b,d:gfp自发荧光)。
图9:腺瘤/结肠癌类器官的组织化学分析
用所示组织化学(he、pas和碱性磷酸酶)或免疫组织化学(嗜铬粒蛋白a、ki67和胱天蛋白酶3)染色分析小鼠小肠腺瘤类器官(左面板)和人结肠癌类器官(右面板)。
图10:be类器官中的潘氏细胞
在分化的be类器官中观察到溶菌酶+潘氏细胞。
图11:用于类器官培养的试剂列表
图12:用于优化人肠类器官培养的试剂列表
图13:用于优化人肠类器官培养的小分子抑制剂列表
图14:25种最大上调和最大下调的基因的列表
通过微阵列将来自人小肠类器官或结肠类器官的mrna与来自新分离的小肠绒毛的mrna进行比较。示出25中最大上调和最大下调的基因。阴影线突出了与绒毛相比,在新分离的人小肠隐窝中前70种最大上调和下调的基因中的基因。
图15:每一类器官培养条件的增殖、分化和细胞凋亡状态的总结
图16:小鼠胰腺类器官的微阵列比较
a–微阵列聚类分析,将来自胰腺类器官(在实施例2所述条件中培养)的rna与来自成体胰腺、成体肝脏和新生肝脏的rna进行比较。从左至右:i)胰腺类器官;ii)成体胰腺;iii)成体肝脏(样品1[s1]和样品2[2]);iv)成体肝脏s2;以及v)新生肝脏。
b–来自微阵列分析的原始信号数据,将所选的导管标志物(ngn3表达所必须的转录因子)的表达水平与成体肝脏、成体胰腺、扩增培养基中的胰腺类器官和肝脏类器官中的内分泌标志物的表达水平进行比较。
图17:noggin对胰腺类器官表达的作用
a–条形图,其示出在egfra中培养的胰腺类器官(因此从未用noggin培养)(黑色)与在egfran中培养的类器官(因此通常用noggin培养)(白色)的基因表达分析。还示出在egfra中培养胰腺类器官2天、然后撤回noggin并培养另外2或4天对基因表达的作用(浅灰色),以及在egfra中培养类胰腺类器官2天、然后添加noggin并培养另外2或4天对基因表达的作用(深灰色)。在y轴上呈现mrna水平(任意单位)。在主图中分析以下早期内分泌标志物的mrna:sox9、hnf1b、hnf6、hnf1a、nkx2.2、nkx6.1和pdx1。在插图部分中分析以下导管标志物的mrna:角蛋白7(krt7)和角蛋白19(krt19)。
b–条形图,其示出在扩增培养基的胰腺类器官中noggin对lgr5表达的作用。提供了在egfra中培养的胰腺类器官(从未用noggin培养)(黑色)以及在egfran中培养的类器官(因此通常用noggin培养)(白色)的数据。还示出在egfran中培养胰腺类器官、然后撤回noggin并培养另外6天(浅灰色)对lgr5基因表达的作用,以及在egfra中培养胰腺类器官、然后添加noggin并培养另外6天(深灰色)对lgr5基因表达的作用。在y轴上呈现mrna水平(任意单位)。
图18:由离体扩增的、体内移植的祖细胞发育的人胰岛素生成细胞
a–在p0:(第1天);p0:(第5天);p1:(第12天)以及p3:(第24天)时来自祖细胞(胰腺干细胞)的人胰腺组织的生长,其中“p”是指传代数。
图18b和c示出人胰腺类器官于小鼠肾筋膜下的移植。
b–在胰腺类器官细胞移植入受体小鼠之后3小时:在上图中的dapi(核标志物)染色表示所有细胞;在下图中的k19(导管标志物)染色示出所有移植的细胞,以及在下图中的胰岛素(β细胞标志物)表示胰岛素生成细胞。
c–在胰腺类器官细胞移植入受体小鼠之后1个月:在上图中的dapi(核标志物)染色(蓝色)表示所有细胞;在中图中的ck19(导管标志物)表达(绿色)表示所有移植的细胞,以及在下图中的胰岛素(β细胞标志物)(红色)表示胰岛素生成细胞。精选的胰岛素产生细胞是环形的,但所有明显染色的细胞被认为是胰岛素阳性的。
图19:胰腺类器官基因表达
该表示出当与肝脏类器官相比时,最大上调的基因的胰腺基因表达。
图20:小鼠肝脏类器官培养物在长期培养之后示出稳定的染色体组型。
a–在用fgf10、hgf和烟酰胺补充的egf(e)和r-spondin1(r)(左图,er)中保持24个月的肝脏类器官的dic图像,或者在用noggin(n)和wnt3a条件培养基(w)补充的相同组合(右图,enrw)中保持的肝脏类器官的dic图像。
b–在培养物中8个月之后的小鼠肝脏类器官的染色体组型分析。得到正常染色体计数(n=40,左面板图)和多倍性,即典型的肝细胞特征(n=80,右面板图)。
图21:补助因子fgf10、hgf和烟酰胺;对肝脏类器官生长和分化的作用
a–描述在肝脏发育3个阶段期间(即,从成肝细胞到成熟肝细胞)差异表达的基因的图表。
b–示出所用方案的图解。在实验之前2天,在扩增培养基(用fgf10、hgf和烟酰胺补充的erfhnic:egf(e)和r-spondin1(r);erfhnic在图21b中示为‘er’)中接种培养物。两天之后,将培养基更换成仅为egf(e),或补充有r-spondin1(er)的egf(其具有或不具有在本文所述浓度下的选自fgf10(f)或hgf(h)或烟酰胺(nic)或其组合的额外补充剂)。五天之后,对于每一情况,将培养物分割并以1:4的比例再涂板。在这些条件下,将培养物每7天进行分割并再涂板,总计10周。
c–在受试的每一培养条件中的第一次分割之后第一天。结果表明与fgf10或hgf或烟酰胺或其组合相结合的egf和rspondin1对于实现至少1次传代是必要的。
d–在长期培养之后,用fnic补充的er或用fhnic补充的er的组合均导致高传代数。在10次传代之后,对于包括3种补助因子的培养条件erfhnic而言生长速率更佳。
e–示出在撤回某些因子(起始点为erfhnic)之后5天,不同肝细胞标志物(cyp3a11、alb、fah)和胆管上皮细胞标志物(k19)的表达的rt-pcr分析。注意的是,仅有条件ef表现出所有受试的肝细胞标志物的表达。hprt用作管家基因以标准化基因表达。
图22:示出在来自三种不同肝脏培养条件的细胞中以及在成体肝脏组织中的不同肝细胞和胆管上皮细胞特异性转录因子的量化的表。还示出notch和tgf-β信号转导途径的关键组分的表达。e=efhnic,er=erfhnic,enrw=enrwfhnic.
图23:分化方案
a–示出所用方案的图解。在实验之前2天,在扩增培养基(用fgf10、hgf和烟酰胺补充的erfhnic:egf(e)和r-spondin1(r);erfhnic在图23a中示为‘er’)中接种培养物。两天之后,将培养基更换为egf(e),其以补充有所示浓度的a8301(a)、或dapt(d)、或fgf10(f)、或hgf(h)、或烟酰胺(nic)、或r-spondin1(r)、或wnt3a、或noggin(n)、或其组合。在多个时点分离rna。小鼠肝脏细胞当作正对照(+),而水当作负对照(-)。
b–示出在分化条件下7天,肝细胞标志物cyp3a11、alb、fah、tbx3、tat和gck的rt-pcr分析。注意的是,仅有条件eadf表现出所有受试的肝细胞标志物的表达。hprt用作管家基因以标准化基因表达。
c–在分化条件之后的时间进程表达分析。在分化之后第2、3和8天,由rtpcr分析肝细胞标志物cyp3a11、alb、fah以及胆管上皮细胞标志物k19的表达。注意的是,在第5天开始肝脏标志物cyp3a11和fah的表达,并且之后在第8天达到峰值。hprt用作管家基因以标准化基因表达。a;a8301,d;dapt,f;fgf10,h;hgf,de;地塞米松
d–示出在不同浓度的分化化合物a和d之后7天,肝细胞标志物cyp3a11、alb、fah、tbx3、tat、g6p和gck的表达的滴定实验。hprt用作管家基因以标准化基因表达。
e–用于肝脏标志物k19、白蛋白和肝细胞表面标志物的免疫荧光染色。
f–对源自albcreert2lacz小鼠肝脏的类器官的xgal染色。在它莫西芬诱导的源自albcreert2lacz的培养物中eadf分化之后,检测到白蛋白阳性细胞(箭头)。
图24:前列腺素信号转导途径(antagonismoftheprostaglandind2receptorsdp1andcrth2asanapproachtotreatallergicdiseases.roypettipher,trevort.hansel&richardarmernaturereviewsdrugdiscovery6,313-325(2007年4月))。
图25:肝脏类器官,其在(a)包括hegf(100ng/ml,invitrogen);人noggin(hnoggin)(25ng/ml,peprotech);胃泌激素(10nm,sigma);hfgf10(peprotech);烟酰胺(10mm,sigma);a8301(500nm,tocris);hhgf(50ng/ml,peprotech);rspo条件培养基(10%)的基础培养基;(b)基础培养基+pge2(50nm);(c)基础培养基+chir99021(3μm);(d)基础培养基+chir99021(3μm)+pge2(50nm)中培养。
图26:肝脏类器官,其在具有或不具有花生四烯酸的基础培养基(如图25所述)中培养。
图27:在分化条件下小鼠肝脏类器官的基因表达谱与成体和新生肝脏谱类似。
a–示出在分化条件eadf和成体或新生肝脏之间相近表达(a)或相近关闭(b)的基因的基因簇。
b–示出在肝脏类器官和成体或新生肝脏(a)之间差异表达的基因以及在eadf和新生肝脏(b)之间相近表达的基因的基因簇。
c–来自微阵列分析的原始信号数据,将所选的导管标志物(ngn3表达所必须的转录因子)的表达水平与成体肝脏、成体胰腺、扩增培养基中的胰腺类器官和肝脏类器官中的内分泌标志物的表达水平进行比较。
图28:小鼠肝脏标签基因
表示出a)在小鼠肝脏肝细胞中表达的标志物;b)在小鼠肝脏肝细胞中未表达的标志物;c)在扩增培养基中小鼠肝脏类器官的小鼠肝脏肝细胞标签中表达的肝细胞和胆管上皮细胞标志物;d)在扩增培养基中小鼠肝脏类器官的小鼠肝脏肝细胞标签中未表达的肝细胞和胆管上皮细胞标志物;e)在小鼠肝脏类器官中表达的再程序化基因;f)在小鼠肝脏类器官中未表达的再程序化基因。使用universalmousereferencerna(strategene,编号740100)作为参照rna,使用肝脏微阵列来获得结果。如果所检测到的绝对值小于100,则基因被认为未检测到。
图29:人肝脏标签基因
示出人类器官的肝脏微阵列的结果的表。从左到右,示出a)扩增培养基em1,b)扩增培养基em2,c)分化培养基,d)成体肝脏的结果。
在左侧四个柱中的数值(log2)是样品和用于所有阵列的参照(商用)rna样品之间的比较的结果。示出与在参照样品中存在rna相比,在每一样品中mrna的相对表达。所用的参照rna为universalhumanreferencerna(stratagene,编号740000)。因此,在这些柱中的负数与实际表达水平无关,其仅表示存在比参照样品更少的所述rna。在右侧的4个柱为绝对值。如果它们低于100,则它们被认为是未检测到的。
图30:肝脏类器官的形态。(a)上面板:示出不同域(pt=门脉三联管,cv=中央静脉)的小鼠肝脏的石蜡切片。下面板:示出不同域b(单层上皮)和h(分层上皮)的肝脏类器官的石蜡切片。(b)右面板:在肝脏类器官中的e钙粘素染色。可以确定两种不同的域。域b,由与肝脏中胆管结构类似的单层上皮形成。这种胆管域是由对泛角蛋白(pancytokeratin)(pck)染色呈阳性的高极化细胞形成的(下面板)。左面板示出在肝脏类器官中存在第二域。这种h域是由具有非极化细胞的分层上皮形成的。在中央腔附近组织细胞并表达肝细胞标志物alb。放大率10×。
图31:胰腺类器官的h&e染色
在8次传代内(约10周),在扩增培养基egfnra83-01[(egf(50ng/ml)、胃泌激素(50nm)、noggin(10%)、rspondin(5%)、fgf10(100ng/ml)和a8301(50nm)]中培养小鼠胰腺类器官。使用bd细胞回收方案,按照制造商的指示从基质胶移除类器官,并用4%多聚甲醛在室温下于1h内固定。因此,用冷pbs洗涤类器官三次,用增加浓度的乙醇脱水,并且嵌入石蜡中。用苏木精-曙红染色3μm石蜡切片以分析胰腺类器官的组织。
观察到类器官在形状和结构方面的强烈变化。一些类器官为由单层极化上皮细胞形成的囊状结构。其他类器官表现出相同的单层上皮细胞和一些分层区域,其中细胞尺寸更小且具有圆形形状。在一些类器官中,观察到占据囊状结构的内部空间的内陷。
染色表明,一些类器官主要包括单层的上皮细胞(左下部),而其他类器官包括分层区域和/或假分层区域和/或折叠单层(右下侧)。大部分胰腺类器官包括分层细胞和单层(有时为折叠的)的区域。
图32:毛喉素-诱导的小鼠小肠类器官膨胀的量化。(a)用毛喉素或dmso刺激的类器官的光学显微镜分析。示出了在开始刺激之后所指定时点的典型样品。红线指出内部类器官腔。(b)使用图像分析软件的物体识别(绿线)的钙黄绿素-绿色标记的类器官的荧光共焦图像。(c)毛喉素刺激的钙黄绿素-绿色标记的类器官的典型实例。使用肝脏细胞共焦显微镜来成像示差干涉对比(dic)和荧光性。在左上角指出t=0时的表面积。(d)在单个孔中11种单个类器官的t=0时的表面积(标准化面积)。平均值以黑色指出(均值±s.e.m.)。(e)由毛喉素产生的剂量依赖性表面积增加(5μm(n=4,所分析的类器官数),5×10-2μm(n=11),5×10-4μm(n=10),dmson=9))。比例尺(a-c)30μm。所有结果是至少三次独立实验的代表。
图33:小鼠类器官的毛喉素诱导的膨胀是cftr依赖性的。(a)用dmso(n=8)、cftr-inh172(n=7)、glyh-101(n=9)或者cftr-inh172和glyh-101(n=11)二者预孵育的毛喉素刺激的钙黄绿素-绿色标记的类器官的标准化膨胀曲线(均值±s.e.m.)。(b)对毛喉素反应的钙黄绿素-绿色标记的野生型或cftr-缺乏类器官的典型共焦微阵列图像。比例尺50μm。(c)在野生型(n=6)或cftr-缺乏(n=11)类器官中毛喉素诱导的膨胀的量化(均值±s.e.m.)。(d,e)与b,c类似,但用于野生型(n=8)和cftr-f508del(n=12)类器官。比例尺30μm。(f)t=0时在(c)中量化的野生型或cftr-缺乏类器官的绝对尺寸(均值±s.e.m.)。(g)在37℃通过(n=20)或不通过(n=15)cftr抑制而培养的、或27℃通过(n=31)或不通过(n=27)cftr抑制而培养24小时的钙黄绿素-绿色标记的cftr-f508del类器官的毛喉素刺激膨胀(均值±s.e.m.)。(h)用dmso通过(n=15)或不通过(n=18)cftr抑制而预孵育24小时的、或用cftr校正化合物vrt-325通过(n=14)或不通过(n=26)cftr抑制而预孵育24小时的钙黄绿素-绿色标记的cftr-f508del类器官的毛喉素诱导膨胀(均值±s.e.m.)。(i)用dmso(n=16)、vrt-325(n=18)、corr-4a(n=20)或二者校正物(n=20)预处理24小时的cftr-f508del类器官的标准化毛喉素诱导膨胀(均值±s.e.m.)。所有结果是至少三次独立实验的代表。
图34:人健康对照或囊状纤维化类器官中的毛喉素诱导膨胀(a)用dmso、cftrinh-172、glyh-101或者cftrinh-172和glyh-101(n=5,n=7,n=8,n=10)预孵育的毛喉素诱导的类器官膨胀的量化(均值±s.e.m.)。(b)源自四个单独的健康对照(1-4:n=30,n=18,n=13,n=42)和1个cfcftr-f508del纯合患者(n=30)的类器官的毛喉素刺激的膨胀(均值±s.e.m.)。(c)在37℃或27℃下通过或不通过cftr抑制(对于所有条件均为n=10)孵育24小时的毛喉素诱导钙黄绿素-绿色标记的cftr-f508del类器官的标准化溶胀(均值±s.e.m.)。(d)当cftr药学操作时对毛猴反应的源自钙黄绿素-绿色标记的hc的或源自cf患者的类器官的典型共焦显微图像。比例尺60μm。(e)用dmso、vrt-325、corr-4a或二者校正物(对于所有情况均为n=10)预处理24小时的cftr-f508del类器官的标准化毛喉素诱导膨胀(均值±s.e.m.)。(f)通过或不通过校正物vx-809预处理24小时、vx-770刺激(同时使用毛喉素)或组合vx-809和vx-770处理(对所有情况均为n=10)的对毛喉素反应的源自cf患者的类器官膨胀(均值±s.e.m.)。(g)与hc类器官相比,当dmso处理(对照)或来自e和f的组合化合物处理时类器官的毛喉素诱导膨胀(对所有情况均为n=10)(均值±s.e.m.)。(d)中的每条线表示由每个个体至少三次独立实验而平均的类器官膨胀。来自所有其他图的结果是至少三次独立实验的代表。
图35:用毛喉素或dmso刺激的野生型小鼠类器官的光学显微分析。示出了在开始刺激之后所指定时点的典型样品。当通过洗涤除去毛喉素时,类器官的毛喉素诱导膨胀(fis)逆转。
图36:cftrmrna在小鼠和人类器官中表达。条形示出实时pcr循环阀值(ct),表示从cftr-f508del(左图)或cftr-/-(中图)类器官及其相应地野生型或人类器官分离的cftr、β2m或gapdh的mrna水平。
图37:渐进的毛喉素诱导膨胀防止类器官崩溃。单独毛喉素刺激的(a)野生型、(b)cftr-f508del(温度救助)和(c)人(5%wnt3a-条件培养基,wcm)类器官的标准化表面积增加。高达10分钟(图32d,e+33a,c,e)、20分钟(图33g)或40分钟(图33i+34a-c)(虚线)分析不同类器官类型的平均毛喉素诱导膨胀。
图38:通过校正化合物处理而增加的fis是cftr依赖性的。用dms、或用vrt-325和corr-4a通过或不通过cftr抑制(所有情况均为n=10)预孵育24小时的钙黄绿素-绿色标记的人cftr-f508del类器官的毛喉素诱导膨胀(均值±s.e.m.)。结果是至少三次不同实验的代表。
图39:在人类器官中霍乱毒素诱导的类器官膨胀是cftr依赖性的。毛喉素和霍乱毒素诱导源自hc的类器官的膨胀,但不诱导cftr-f508del类器官的膨胀。与毛喉素相比,霍乱毒素反应延迟,这归因于其顶端细胞外功能。(所有情况均为n=10)(均值±s.e.m.)。结果是至少三次不同实验的代表。
图40:在正常或降低wnt3a培养条件中的人类器官。(a)在正常(50%,左面板)或降低的(5%,右面板)wnt3a条件培养基(wcm)浓度下培养的人类器官的光学显微图像。比例尺400μm。(b)在正常或降低的wnt3a条件下毛喉素诱导膨胀的典型实例。比例尺50μm。虚线表示内部类器官腔。(c)在正常wnt3a水平下用dmso、cftrinh-172、glyh-101或者cftrinh-172和glyh-101(n=29,n=41,n=26,n=15)预孵育的毛喉素诱导类器官膨胀的量化(均值±s.e.m.)。(d)由两次独立实验而平均的在50%(n=9)或5%(n=12)wnt3a条件培养基(wcm)浓度下培养的低传代芽殖类器官的毛喉素诱导膨胀的量化(均值±s.e.m.)。所有结果是至少三次独立实验的代表。
图41:前列腺类器官的h&e染色
小鼠前列腺上皮的组织碎块嵌入基质胶中。每周分割扩增细胞。培养能保持延长的时段,而不损失遗传稳定性或增殖能力。图41示出前列腺自身的前列腺上皮和类器官培养物在三个月时段之后的比较。小鼠前列腺类器官在存在或不存在睾酮的情况下于包括enr(egf、noggin和rspondin)的培养基中生长。人培养物需要添加tgf-β抑制剂。h&e的固定以及嵌入石蜡中表明体内上皮的不同水平的分层和折叠。培养的前列腺类器官在折叠和分层方面表现出类似的多样性。
图42:前列腺类器官的ck8(分化标志物)染色
小鼠前列腺上皮的组织碎块嵌入基质胶中。每周分割扩增细胞扩增物。培养能保持延长的时段,而不损失遗传稳定性或增殖能力。图42示出存在表达腔细胞的ck8。培养物在存在或不存在睾酮的情况下于包括enr(egf、noggin和rspondin)的培养基中生长。人培养物需要添加tgf-β抑制剂。添加睾酮允许分化成ck8阳性腔细胞,而同时刺激肝细胞的维持和扩增。睾酮还增加了上皮的分层和折叠。
图43:在培养物中25周之后的小鼠前列腺
前列腺类器官在egf、noggin、rspondin、nac、b27、glutamin/max、pen/strep、ad-dmem/f12+睾酮中生长。由组织来源(在分离前于前列腺中的位置)确定类器官的形状。前列腺由不同的叶或区域组成。不同区域呈现特异性上皮结构(分层和折叠)。在体外培养之后,类器官可以维持其所源自的前列腺部分的不同宏观结构(分层或折叠)。
图44:3周前列腺培养的pcr
将正常和癌前列腺上皮分离并在enrfgf10、enrf+dht、wenrf、wenrf+dht、enr、enr+dht培养条件中生长三周。所有培养条件包括a83、p38i和烟酰胺。
图44(a):将rna分离并且对前列腺上皮的标志物进行rt-pcr。在正常和肿瘤组织中,表达腔标记物ck18、ck8和b-msp。所有培养条件表达ar。在正常组织中,添加dht增加所有培养条件中的ar表达。在肿瘤组织中,dht添加不影响ar表达。在所有培养条件中,表达基础上皮标志物ck14、ck5和p63。在正常组织中,在enrf条件下表达假定的干细胞标志物lgr5。在肿瘤组织中,通过在所有培养条件中添加dht诱导lgr5表达。tnfrsf19(也为假定的肝细胞标志物)在所有条件中于正常和肿瘤组织中表达。在所有条件下表达前列腺特异性转录因子nkx3.1。添加睾酮增加了生长/倍增,同时维持前列腺(基础和腔)不同细胞类型的标志物。
图44(b):在enrf+1nmdht条件下生长的人类器官的两个典型图片。
1道:线1enrf正常组织
2道:线1enrf+1nmdht正常组织
3道:线2wenrf正常组织
4道:线2wenrf+1nmdht正常组织
5道:线3enr正常组织
6道:线3enr+1nmdht正常组织
7道:全前列腺正常组织
8道:h2o
9道:线1enrf肿瘤组织
10道:线1enrf+1nmdht肿瘤组织
11道:线2wenrf肿瘤组织
12道:线2wenrf+1nmdht肿瘤组织
13道:线3enr肿瘤组织
14道:线3enr+1nmdht肿瘤组织
15道:全前列腺肿瘤组织
16道:h2o
图45:小鼠前列腺类器官的pcr
在enr或enr+1nmdht条件下培养三种生物依赖性线。将rna分离并且对前列腺上皮的标志物进行rt-pcr。在两种培养条件下,广泛表达腔前列腺标志物细胞角蛋白18(ck18)和细胞角蛋白8(ck8)。在两种条件中表达雄激素受体(ar)。在两种培养条件中表达基础标志物p63和细胞角蛋白5(ck5),但当添加dht基础标志物时下调。假定肝细胞标志物lgr5和tnfrsf19当添加dht时下调。然而,在这些条件下,维持干性(stemness),同时还存在分化细胞。这些条件允许不受限的细胞扩增(目前以一周2.5次群体倍增持续9个月)。所有培养对前列腺特异性标志物nkx3.1呈阳性。添加睾酮使生长/倍增增加至高达3倍,同时维持前列腺(基础和腔)不同细胞类型的标志物。
1道:线1enr
2道:线1enr+1nmdht
3道:线2enr
4道:线2enr+1nmdht
5道:线3enr
6道:线3enr+1nmdht
7道:全小鼠前列腺
8道:h2o
图46:胃部(胃)类器官
人胃部类器官。组织从身体分离。细胞在胃部类器官培养基(egf、noggin、rspondin、wnt、烟酰胺、fgf10、胃泌激素、tgf-β抑制剂(a8301)中培养。每周分割细胞。
图46(a):该图片在培养2个月之后采集。
图46(b):在培养2周之后,在固定和石蜡切片培养物之后的h&e和不同抗体染色。其示出存在以下细胞:粘蛋白生成细胞的pas;表面粘液隐窝细胞的muc5ac;粘液颈细胞的muc6。h&e染色示出单层的极化上皮。
图47:前列腺组织的分离
参见实施例8(来自ucsf的照片)
图48:a)在存在不同剂量重组小鼠rankl的情况下培养72h的小鼠类器官。由qpcr测定rank的mrna表达水平、转录因子spib和m细胞特异性标志物gp2和annexinv。b)在用100ng/mlrankl培养72h的小鼠类器官中的gp2(参见箭头)和annexinv(参见箭头)的共焦分析。
图49:在存在不同剂量的重组人rankl的情况下培育人类器官7天。由qpcr测定rank、sipb和m细胞特异性标志物gp2的mrna表达水平。em:扩增培养基,dm:分化培养基。
实施例
实施例1:
为解决对用于人上皮干细胞的改进的培养基和方法的需求,发明人研究了已知在某些癌症、例如结肠直肠癌中被破坏的信号转导途径。假定这些影响癌症中的最终细胞类型的途径还在决定于体外细胞培养条件下的最终细胞类型方面发挥作用。
在第一种筛选实验中,与标准干细胞培养基组合地测试了一系列维生素、激素和生长因子。胃泌激素和烟酰胺被确认为产生显著改进的培养条件。将这些因子并入标准培养条件,进行第二种筛选实验,其中测试与相关信号转导途径相关的某些小分子抑制剂,例如erk、p38、jnk、pten、rock和hedgehog。在现有技术中,不存在合理的方式来预测这些额外的化合物中每一种会对培养基特性产生何种结果。
表2:用于优化人肠类器官培养的试剂列表
总之,发明人已经确立了长期培养条件,在该条件下,源自小鼠小肠(si)的单隐窝或干细胞在长时段内扩增。生长的隐窝经历多个隐窝分裂事件,同时产生绒毛样上皮域,其中存在所有分化的细胞类型。发明人现已改编了培养条件以由小鼠结肠和人si和结肠生长类似的上皮类器官。基于小鼠小肠培养系统,发明人优化了小鼠和人结肠培养系统。他们发现向生长因子添加wnt3a混合物允许小鼠结肠隐窝无限扩增。对于长期人si和结肠培养,额外添加烟酰胺、小分子alk抑制剂和p38抑制剂是优选的。培养系统还允许小鼠apcmin腺瘤、人结肠直肠癌和人食管化生型巴雷特上皮的生长。培养技术应广泛用作用于人胃肠道的感染、炎性和癌病理的研究工具。此外,再生应用对于离体扩增肠上皮可以变得可行的。由干细胞及其位于隐窝的祖先的增殖来驱动小肠和结肠上皮的自我更新。尽管已表示了多种培养系统(evansgs等人,jcellsci1992;101(pt1):219-31;fukamachih.jcellsci1992;103(pt2):511-9;perreaultn&jean-francoisb.expcellres1996;224:354-64;whiteheadrh等人,gastroenterology1999;117:858-65),但最近仅使长期培养系统变成可行地维持基础隐窝生理。公开了两种不同的方案,其允许小鼠小肠上皮的长期扩增。kuo和同事证明了包括上皮以及基质元素的小碎块以生长因子依赖性形式长期生长(ootania等人,natmed2009;15:701-6)。发明人通过结合在小肠上皮生长需求方面先前所限定的深刻理解而设计了用于单干细胞的培养系统。wnt信号转导是隐窝增殖的关键需求(korinekv等人,natgenet1998;19:379-83;pintod等人,genesdev2003;17:1709-13;kuhnertf等人,procnatlacadsciusa2004;101:266-71)并且wnt激动剂r-spondin1诱导体内显著的隐窝增生(kimka等人,science2005;309:1256-9)。第二,egf信号转导与小肠增生相关(dignassau&sturma.eurjgastroenterolhepatol2001;13:763-70)。第三,noggin的转基因表达诱导了隐窝数量的扩增(haramisap等人,science2004;303:1684-6)。第四,分离的肠细胞在正常组织环境之外经历失巢凋亡(hofmannc等人,gastroenterology2007;132:587-600)。因为层粘连蛋白(α1和α2)在隐窝基底富集(sasakit等人,expcellres2002;275:185-),所以发明人探究了层粘连蛋白富集的基质胶来支持肠上皮生长。基于基质胶的培养已经成功用于乳腺上皮的生长(stinglj等人,breastcancerrestreat2001;67:93-109)。在该培养条件(r-spondin1、egf和noggin在基质胶中)下,发明人获得了永远扩增的小肠类器官,其在构造、细胞类型组成和自我更新动力学方面呈现出小肠上皮的所有印记。
尽管大量的努力,但长期成体人肠上皮细胞培养仍为困难的。存在一些长期培养模型,但这些技术和细胞系未得到广泛接受,可能归因于在提取和维持活细胞方面的固有技术难点(roglerg等人,scandinavianjournalofgastroenterology2001;36:389-98;busetm等人,invitrocellular&developmentalbiology:journalofthetissuecultureassociation1987;23:403-12;whiteheadrh等人,invitrocellular&developmentalbiology:journalofthetissuecultureassociation1987;23:436-42;deveneycw等人,thejournalofsurgicalresearch1996;64:161-9;pangg等人,gastroenterology1996;111:8-18;latellag等人,internationaljournalofcolorectaldisease1996;11:76-83;panjaa.laboratoryinvestigation;ajournaloftechnicalmethodsandpathology2000;80:1473-5;grossmannj等人,europeanjournalofcellbiology2003;82:262-70)。受到确立小鼠小肠培养的鼓励,发明人旨在修改小鼠和人结肠上皮的培养条件。现在,发明人报道了用于小鼠和人结肠上皮的长期培养方案的确立,其可适于原发性结肠腺瘤/腺癌以及巴雷特食管症。
结果
小鼠结肠培养系统的确立
在尝试确立小鼠结肠培养系统时,发明人探究了我们的小肠培养条件(本文称为enr:egf+noggin+r-spondin)。在我们的经验中,通常在enr培养条件下观察到结肠上皮的初始生长,但其总是失败的。使用从小鼠结肠末端部分分离的上皮来研究类器官形成。在enr条件下,单末端结肠隐窝的涂板效率远低于小肠的涂板效率(1-3%对比>90%),并且这些类器官不能传代。最近,发明人已表明,潘氏细胞产生多种wnt配体(gregorieffa等人,gastroenterology2005;129:626-38),并且由这些潘氏细胞产生wnt对于维持肠干细胞是必要的(satot等人,nature;469:415-8)。为测定结肠类器官中的wnt信号转导状态,发明人培养了来自axin2-lacz小鼠(可靠的wnt受体)(lustigb等人,molcellbiol2002;22:1184-93)或lgr5-gfp敲入小鼠(lgr5是wnt-依赖性干细胞标志物)(barkern等人,nature2007;449:1003-7)的结肠隐窝。
新分离的结肠隐窝容易在其底部表达axin2-lacz或lgr5-gfp,但它们在开始培养之后短期内丧失了wnt受体的表达(图1a,b和图6)。相反,小肠类器官在其芽殖结构底部组成性表达wnt受体(satot等人,nature;469:415-8;satot等人,nature2009;459:262-5)。这些发现表明结肠类器官产生不足量的wnt配体来维持结肠干细胞。为了克服该情形,发明人向enr培养基添加重组wnt3a或wnt3a-条件培养基(wenr培养基)。这使隐窝的涂板效率增加了约10倍。结肠隐窝形成具有多种axin2-lacz(图1a)或lgr5-gfp+(图1b)芽的类器官结构,意味着恢复wnt活化。新分离的结肠隐窝在其上部包括完全成熟的细胞,并且发明人推断这些成熟细胞可以干扰类器官生长。当发明人将结肠隐窝适度消化成细胞的小簇、由此从分化的上隐窝区域物理分离增殖隐窝底部时,源自隐窝顶部的大部分碎块死亡,但来自结肠隐窝基底的细胞簇有效行程类器官(图1c)。
在enr条件下生长的小鼠小肠上皮产生伴有肝细胞自我更新的所有分化的上皮细胞类型。发明人先前已表明,向这些培养物中添加wnt3a干扰了肠分化并产生主要由未分化的祖先组成的类器官(satot等人,nature;469:415-8)。这不是出人意料的,因为wnt信号转导在维持未分化隐窝祖先状态中挥发核心作用(vandeweteringm等人,cell2002;111:241-50)。与该观察一致,在wenr条件中的结肠类器官不能适当分化。当撤回wnt-3a时,发明人观察到沿所有上皮世系的分化(图1d-f)。值得注意的是,单分选lgr5+结肠上皮干细胞当在存在y-27632的情况下培养最初两天时可形成类器官。
人结肠培养系统的确立
受到改进的小鼠结肠隐窝培养的成就的鼓励,发明人向人结肠隐窝施用培养条件。尽管这些隐窝最初存活,但大部分随后在7天内分解。为增加人结肠隐窝的涂板效率,发明人删选了候选生长因子、激素和维生素(列于图12中)。其中,发明人发现胃泌激素和烟酰胺(nad+的前体,并发现抑制去乙酰化酶活性(denujm.trendsbiochemsci2005;30:479-83))改进了培养效率(图12)。胃泌激素对涂板效率的作用是微小的。然而,激素不干燥肠分化,并且我们决定在人肠培养条件中包括胃泌激素(下文简称为“g”)。重要地,亚酰胺(10mm)对于将培养时段延长超过最初7天而言是必要的(图2a)。在这种培养条件下,人结肠类器官会被扩增至少1个月。从1个月开始,结肠类器官的形态从芽殖类器官结构改变成囊状结构(图2b,左侧)。与形态转化相符,增殖逐渐降低。偶然地,囊状类器官恢复其增殖潜能。然而,所有类器官最终在3个月内停滞了生长。在其他原始培养系统、例如乳腺上皮细胞或角化细胞中已观察到两阶段生长停滞,并且被称为死亡1期(m1;衰老期)和死亡2期(m2;危险期)(shay等人,2006)。甚至在撤回wnt之后(数据未示出),在这种条件中培养人肠类器官中没有观察到多世系分化。
发明人假设由于培养条件不足而非衰老/复制老化的细胞固有性质而发生生长停滞。因此,发明人拓展了我们对优化培养条件的尝试。发明人筛选了在wenr+胃泌激素+烟酰胺培养条件下,map激酶的、结肠癌中突变的信号转导分子的、以及组蛋白修饰物(图12)的多种小分子调节剂。发明人发现两种小分子抑制剂a83-01(alk4/5/7抑制剂;nm)和sb202190(p38抑制剂;10μm)显著改进涂板效率。也被测试且表现出与a83-01相同结果的其他tgf-β受体1(alk5)抑制剂为ly364947、sb431542、sb505124。可预期的是,其他alk抑制剂也会以相同方式发挥作用。此外,两种化合物的组合协同地延长了培养时段。发明人证明了所有10个受试样品通过每周1:5分割而扩增至少6个月。在这种培养条件下,人结肠类器官呈现芽殖类器官结构,而非在先前培养条件下所见到的囊状结构(图2b)。增殖细胞被局限于芽(图2c)。在每一个细胞(各自来自三个不同供体的20个细胞;图2d)中,大于3月龄的类器官的中期分裂相一致地显示出46个染色体。发明人在培养两个月之后测序了结肠类器官的完整外显子组(所有外显子)。类器官中的突变数量非常低。实际上,在由一个克隆而发源的四个平行类器官培养物中,仅发现一个突变,其存在于所有培养物中并因此可能源自母体组织。
这些结果表明alk受体和p38信号转导负调节人肠上皮细胞的长期维持。发明人将优化的培养条件称为hisc(人肠干细胞培养)条件。
人肠类器官模拟物体内分化
在hisc条件下,发明人未能观察到分化的细胞。在小鼠结肠类器官中所见到的,在人类器官中的成熟肠上皮细胞分化需要撤回wnt(图3a顶面板和图7)。然而,杯形细胞和肠内分泌细胞分化保持阻滞。我们发现烟酰胺和sb202190强烈抑制这种分化,同时撤回两种试剂能使类器官产生成熟杯形细胞和肠内分泌细胞(图3a(中面板和底面板)、3b和图7)。
在人小肠类器官中观察到wnt、烟酰胺和sb202190的相同分化抑制作用。在小肠类器官中观察到溶菌酶+潘氏细胞,但在结肠类器官中则没有(图3c)。已经报道了p38抑制剂处理体内抑制杯形细胞分化并且增加肠上皮增殖(otsukam.gastroenterology2010;138:1255-65,1265e1-9)。实际上,发明人在p38抑制剂处理的肠类器官中观察到相同的表型(图3d与e)。
发明人进一步检查了人肠类器官对notch抑制的反应。发明人先前已表明,使用γ-分泌酶抑制剂(二苯并吖庚因;dbz)的notch抑制或通过notch途径转录因子csl缺失肠干细胞的条件靶向的notch抑制终止了肠上皮增殖并体内诱导杯形细胞增生(vanesjh等人,nature2005;435:959-63)。实际上,当用dbz处理时,肠类器官停止了它们的增殖并且大部分细胞在3天内转化成杯形细胞(图3e与f)。
apc-缺乏腺瘤和结肠腺癌的确立
最近,发明人报道了当它莫西芬诱导的cre活化时在lgr5-gfp-ires-creert2xapcflox/flox小鼠中由lgr5干细胞形成有效小鼠肠腺瘤(barkern等人,genesdev2008;22:1856-64)。发明人在诱导和优化培养条件之后10天分离了肠腺瘤。腺瘤有效形成囊状类器官结构而没有芽殖。因为apc损失组成性活化wnt途径,所以发明人预期r-spondin1对于腺瘤类器官生长会变成必不可少的。这是实际观察到的。此外,长期培养正常小肠所必要的noggin在腺瘤类器官中是必不可少的。有趣的是,发明人观察到在撤回noggin之后7天于腺瘤类器官中损失lgr5-gfp,但不损失axin2-lacz(图4a,b,并且数据未示出)。对于在er-培养基中生长的正常肠类器官,得到类似的观察(satot等人,nature2009;459:262-5)。这表明需要noggin(最可能通过抑制bmp信号)来维持lgr5表达,但对于扩增腺瘤类器官则不需要。从肠隐窝分离的刚分离的lgr5hi(而非lgr5low)细胞可体外启动类器官生长(satot等人,nature2009;459:262-5)。为测定类似lgr5-级系在腺瘤中存在,发明人从en-培养的类器官中分离了lgr5-gfphi、gfplow和gfp-ve细胞,并检查了它们的类器官形成能力。在7天培养之后,lgr5-gfphi表现出最高的类器官形成效率。然而,lgr5-gfplow或–ve还以相当高的效率形成类器官(图4c)。值得注意的是,分选的gfp-ve腺瘤细胞能产生lgr5-gfph类器官(图8)。
在过去四十年内,已经分离了许多结肠直肠癌细胞系。典型地,这样的细胞系在结肠肿瘤的原始培养物进入组织培养危机之后成为稀少的克隆产物。目前,不存在稳固的培养系统,其允许原始人结肠癌样品的连续培养而没有培养危机以及随后适应培养的细胞的克隆产物。作为下一步,发明人向人结肠直肠癌样品施用肠腺瘤培养条件。如所预期的,结肠癌细胞不需r-spondin或noggin。egf在大部分结肠癌类器官中是可分散的,而一些结肠癌类器官在撤回egf之后其增殖减速。与小鼠肠腺瘤不同,在培养条件中的结肠直肠癌类器官生长成无规紧密结构,而非简单囊状结构(图4d)。
发明人检查了腺瘤和结肠癌类器官的增殖/分化状态。如所预期的,大部分细胞为ki67+。与wnt对肠上皮细胞分化的强抑制作用(图1f和图7)相一致,在两种类型的类器官中未观察到碱性磷酸酶染色(图9)。相反,我们在腺瘤类器官中和在一些结肠癌类器官中偶然观察到pas+杯形细胞和嗜铬粒蛋白a+内分泌细胞(图9)。
培养人化生型巴雷特上皮
巴雷特食管通过在下食管中存在柱状上皮而标示,所述柱状上皮由于化生而替代正常鳞状细胞上皮(odzerd.natrevgastroenterolhepatol2009;6:478-90)。巴雷特食管的组织学特征是在食管中存在肠杯形细胞。利用巴雷特上皮和肠上皮之间的类似性,发明人使小巴雷特上皮(be)活体组织切片经历人结肠培养条件。在这些培养条件下,正常食管鳞状细胞暂短地增殖1周,但类器官不能传代。在hisc条件下,巴雷特食管上皮可被维持高达1个月(图5a)。be类器官形成囊状类器官结构,其与衰老的人结肠类器官是不可区分的,并且通常在培养之后1个月经历生长停滞。向hisc条件添加fgf10使be类器官形成芽殖结构并且显著延长了培养持续时间(>3个月)(图5b,c)。与人肠类器官相反,be类器官在撤回烟酰胺和sb202190之后4天,保持具有最小数量的pas+和粘蛋白+细胞的ki67+。在撤回之后4天,用γ-分泌酶抑制剂dbz(10μm)的处理阻断增殖并诱导杯形细胞分化(图5d-g)。这支持了我们先前的建议,即,这样的抑制剂的局部递送可以对通过分化治疗来移除巴雷特食管病灶呈现可用的治疗策略(menkev等人,diseasemodels&mechanisms2010;3:104-10)。值得注意的是,我们偶然观察到溶菌酶+潘氏细胞(图10),这表明be类器官保存多世系分化。
讨论
本文开发的方案允许稳固且长期培养从小肠、结肠腺瘤(腺癌)和巴雷特食管分离的原始人上皮细胞(表3)。
表3:类器官培养系统的组成列表
所有原液和等分的基质胶在-20℃贮存
与小鼠小肠相反,小肠结肠上皮细胞在培养基中需要wnt配体。发明人先前已经报道cd24hi潘氏细胞产生wnt-3/11,这对于小肠中的干细胞维持是必要的(satot等人,nature2011;469:415-8)。wnt-6和-9bmrna在结肠隐窝底部表达(gregorieffa等人,gastroenterology2005;129:626-38.)。仍不能确定结肠隐窝基底细胞的这种局部wnt产生是否足以体内活化标准wnt信号或者是否在结肠粘膜中是否存在另外的wnt配体源。人肠类器官培养条件和小鼠肠类器官培养条件之间的差异出人意料地大。a83-01抑制了通过微阵列在小鼠隐窝和人隐窝中检测到的alk4/5/7受体。发明人当前正在研究alk信号调节人类器官生长所用的机制。发明人未观察到在长期培养物中的细胞内转化并且染色体变化在优化培养条件下未变得明显的。此外,类器官可经历比其他成体人上皮培养系统所报道的显著更大量的细胞分裂(deyd等人,plosone2009;4:e5329;garrawayip等人,theprostate2010;70:491-501)。通常确信躯体细胞在其增殖能力方面存在固有限制,即称为复制老化的现象(walenkh.invitrocellular&developmentalbiology.animal2004;40:150-8)。大部分正常人细胞被认为计数它们已分裂次数,最终经历称为细胞衰老的生长停滞。该过程可以通过缩短端粒并随后激活dna损坏信号(m1)或端粒磨损(m2)而触发。在不存在两种小分子激酶抑制剂的情况下,人肠类器官在10-20次群体倍增之后经历生长停滞。相反,当添加抑制剂时,在优化培养条件中的复制能力可被延长为至少高达100次群体倍增,这超过hayflick极限(hayflickl.thejournalofinvestigativedermatology1979;73:8-14)。该结果明确表明在第一培养系统中所见的衰老表型反映了不足的生长条件,而非固有复制老化。
培养技术可用于研究干细胞生物学和分化控制的基础方面,由当notch抑制剂处理时干细胞损耗和杯形细胞分化而例示。此外,类器官培养平台可用于对肠道病理学的药理学、毒物学或微生物学研究,因为类器官比常用的结肠癌细胞系如caco2或dld1更加紧密地呈现肠上皮。最后,因为可以扩增从成年供体采集的小活体组织切片且没有明显的限制或遗传危害,所以该技术可用于产生用于再生目的的可移植的上皮。
实施例2–培养小鼠胰腺类器官
还在小鼠胰腺类器官的培养基中测试了tgf-β抑制剂的用途。所用的扩增培养基是dmem/f12培养基(补充有p/s、glutamax、10mmhepes、b27、n2和n-乙酰半胱氨酸)、egf(50ng/ml)、r-spondin(10%)、noggin(100ng/ml)、fgf10(100ng/ml)、a8301(tgf-β抑制剂,500nm)和胃泌激素(10μm)。这与实施例2中所用的上述hisc培养基略有不同,因为不存在wnt激动剂(而是rspondin)或烟酰胺,并添加fgf10。然而,这些培养基共有许多关键组分(enr+胃泌激素+tgf-β抑制剂),在两种情形下,添加tgf-β抑制剂是有利的。在这些条件中生长的胰腺类器官会被扩增至>3个月并传代至少5次。
对在上述扩增培养基中生长的胰腺类器官实施微阵列实验,并且结果与成体胰腺、成体肝脏和新生肝脏进行比较(参加图16a)。胰腺类器官明显与成体胰腺而非与肝脏样品聚集,表明与成体胰腺的良好表型类似性。
图16b示出来自微阵列分析的原始信号,比较了在胰腺类器官、成体胰腺、成体肝脏和肝脏类器官中的导管标志物、内分泌标志物以及ngn3表达所必须的转录因子(ngn3是与内分泌世系的详情相关的转录因子)的表达水平。在胰腺类器官中的krt19、krt7和其他导管标志物的高水平表达表明胰腺类器官明显具有导管表型。这些胰腺类器官最初从导管制剂(ductalpreparations)生长。ngn3表达的必要转录因子(foxa2、hnf6、hnf1b、sox9)所有均还在胰腺类器官中表达,尽管ngn3自身的表达在扩增条件下未检测到。
对于产生胰岛素生成细胞而言是重要的基因的表达水平是低的。然而,明显的是,癌扩增培养基中,胰腺类器官的增殖和表达谱与在早期祖先内分泌细胞中所见的那些紧密类似。
胰腺主要由三种不同细胞类型形成:腺泡细胞、导管细胞和内分泌细胞。在成体胰腺的总rna样品中,90%的rna来自腺泡细胞,所以内分泌标志物的表达水平在总胰腺样品中是非常稀的。因此,对于每一具体的细胞类型,筹划的其他实验。例如,发明人计划实施胰腺类器官、富集腺泡细胞制剂、富集导管细胞制剂和富集内分泌细胞制剂之间的微阵列比较,以与在胰岛素生成细胞所存在的水平相比,更好地估计在我们的胰腺类器官中重要基因的mrna水平。例如,在富集内分泌细胞的样品中,75-85%的所存在的细胞会为胰岛素分泌细胞。
实施例3–noggin对扩增培养基的作用
为了研究bmp抑制剂noggin在扩增培养基中的作用,发明人将胰腺类器官中的早期内分泌标志物和导管标志物的mrna水平(所述胰腺类器官已在egfra培养基中培养由此从未在存在noggin的情况下培养)与已经在egfran培养基(即,通常存在noggin)中培养的类器官中的相同标志物的表达水平进行比较。发明人还比较了胰腺类器官(分别通过向培养物添加noggin或从该培养物移除noggin)的这些标志物的mrna水平。具体地,将胰腺类器官的一个样品在egfra培养基中培养,然后添加noggin,并且将类器官培养另外2或4天。将胰腺类器官的另一个样品在egfran培养基中培养,然后移除noggin,并且将类器官培养另外2或4天。比较基因表达并且结果示于图17a中。发现noggin降低了角蛋白7和角蛋白19(导管标志物)的表达,表明noggin阻断了趋于导管表型的分化(在白色和深灰色样品中的角蛋白比在黑色样品中的角蛋白更低)。noggin未影响产生胰岛素生成细胞所必要的一些转录因子的表达(即,sox9、hnf6、hnf1a、pdx1、nkx2.2、nkx6.1和hnf1b)。尽管noggin使培养物免于获得全导管表型(其可能会防止向胰岛素生成细胞的进一步分化),但发明人在扩增培养基中包括noggin,因为其允许细胞扩增并同时维持与胰岛素生成前体细胞的特征相结合的一些导管特征。
使用得自胰腺管的胰腺类器官来评价存在或不存在noggin或其向egfra培养基添加或从egfra培养基撤回对lgr5基因表达的作用。图17b的结果表明用noggin培养的胰腺类器官表达了比不用noggin培养的胰腺类器官高2倍的lgr5(比较从左数第二个白色条与左侧白色条)。添加(深灰色)或撤回(浅灰色)noggin还表现出影响lgr5水平。不清楚在存在noggin情况下的lgr5基因表达的增加是归因于lgr5+细胞数量的增加或是归因于每细胞lgr5表达水平的增加。然而,本发明人在此表明诸如noggin的bmp抑制剂促进了lgr5的表达,因此导致更加增殖的类器官。因此,bmp抑制剂表现为扩增培养基的有利组分。
这是令人惊讶的,因为在文献中描述了bmp活性可用于胰腺细胞的分化培养。该结论基于以下观察,即,分化成导管(参见角蛋白7和19的表达)和内分泌细胞需要bmp信号转导。因此,技术人员会预期包括bmp抑制剂如noggin在扩增培养基中是不利的。然而,发明人令人惊讶地发现使用bmp抑制剂是有利的,因为其导致更加增殖的类器官和更高的lgr5表达。
实施例4–人胰腺类器官在小鼠肾包囊下的移植
将使用实施例1所述方案而已扩增的胰腺类器官(参见图18a)移植在免疫缺陷小鼠的肾包囊下。
仅在移植之前,用细胞恢复液(bd#354253,bdbiosciences)处理类器官以除去基质胶残留物。类器官用pbs洗涤数次并制丸。
使用nih对肾包囊下胰岛移植所推荐的程序(“purifiedhumanpancreaticislets,invivoisletsfunction”,documentno.3104,a04,生效日期2008年7月7日,dait,niaid,nih)来实施这些类器官在免疫缺陷受体的肾包囊下的移植。在移植前1周,在受体小鼠(nod/scid/il2rgammakoa.k.a.nsg)中通过高剂量130mg/kg链脲霉素注射来化学诱导高血糖症。检测血糖水平,并且血糖高于18mmol/l的小鼠被认为是高血糖症的。
为了移植,将高血糖症受体麻醉并且在左翼产生小切口以暴露左肾。在硅化pe50移植管中收集约2.5–3.0mm3的类器官并使用hamilton注射器移植到肾包囊下。在烧灼受损的包囊之后,将肾放回腹腔中。然后用5-0丝线闭合腹膜和皮肤。
将一只小鼠在移植后3小时处死,并且分析移植物的成熟β细胞和祖标志物。在该小鼠中,在小鼠肾筋膜包囊中未能看到胰岛素生成细胞(图18b)。
使另一小鼠在密切监管下于具有取暖垫的笼中恢复。监测经移植的小鼠的体重和血糖水平1个月。在一个月之后,将小鼠处死,并且分析移植物的成熟β细胞和祖标志物。
在移植后1个月,可确定大量的胰岛素生成细胞。这些胰岛素生成细胞为图18c中的所有染色的细胞,为增加清晰度,圈出精选的染色细胞。特别地,胰岛素阳性细胞从导管内衬出现,而在初始制剂中没有看到胰岛素阳性细胞。
胰岛素生成细胞在移植后1个月存在而在移植后3小时不存在的发现证明胰岛素生成细胞大部分在移植后出现或仅在移植后出现。
这些结果表明从用本发明的培养基和方法培养的本发明胰腺类器官采集的细胞可被植入小鼠并可促进胰岛素生成细胞在胰腺中的生长。令人振奋地,可移植人胰腺类器官。这开启了使用移植的类器官细胞以促进胰岛素产生例如用于治疗糖尿病的诸多令人振奋的可能性。
实施例5–包括tgf-β抑制剂的肝脏类器官培养物
在er或enrw条件下,肝脏类器官培养物自我更新,并且以每周计,可维持并扩增高达1年(图20a)。1年之后的染色体组型分析表明没有染色体畸变的迹象。所分析的多于66%的细胞呈现正常的染色体数并且它们的13%还表现出多倍性,即肝细胞的特有特征(图20b)。
补充有fgf10(100ng/ml)、hgf(25-50ng/ml)和烟酰胺(1-10mm)的egf(50ng/ml)与r-spondin1(1μg/ml)的组合对于长期维持培养物是优选的。在这些条件下,我们获得了表达胆管和一些成肝细胞或未成熟肝细胞标志物(glul、白蛋白)的长期存活的细胞培养物。然而,对这些肝细胞标志物呈阳性的细胞的数量非常低。在这些培养条件下,没有检测到成熟肝细胞标志物(例如,p450细胞色素)。这些结果表明本文所述的培养条件促进了能产生肝细胞样细胞的肝脏祖先(liverprogenitors)的表达,尽管数量较低,但为未完全成熟的肝细胞(图21a)。
为增加培养物的干细胞性质并体外获得成熟肝细胞,我们首先确定向egf和rspondin1添加的三种补助因子(fgf10、hgf和烟酰胺)对肝细胞表达以及对培养物的自我更新发挥正作用或负作用。我们生成肝脏类器官培养物并用egf或egf和rspondin1加fgf10或hgf或烟酰胺或其组合来培养这些肝脏类器官培养物,并且我们将培养物每周一次进行分割,总计10周。在每一时点,我们还分析了多种成熟肝细胞标志物(fah、cyp3a11)和成肝细胞标志物(白蛋白)的表达(图21b)。
观察到与fgf10组合的rspondin1和烟酰胺对肝脏培养物的生长和自我更新是必要的(图21c&d)。rspondin1和烟酰胺均抑制成熟标志物cyp3a11的表达,但促进成肝细胞标志物白蛋白的表达。向仅包括egf(不具有rspondin1且不具有烟酰胺)的培养基添加fgf10或hgf促进了成熟标志物cyp3a11的表达,尽管水平非常低(图21e)。为确定其他可能促进肝细胞分化的化合物,我们使用两种不同的方法,均基于基础培养条件:egf+hgf和/或fgf10。
第一种方法包括测试除了egf+fgf10或hgf条件之外的一系列化合物。化合物的完整列举示于表4中。
表4
第二种方法考虑了来自与实现体内胆分化和肝细胞分化所必须的转录因子的表达相关的公开发展研究的认知。图21示出在补充有fgf10、hgf和烟酰胺的e或er或enrw条件下的类器官中转录因子表达的比较分析。除tbx3和prox1之外,还存在肝细胞详情所需的所有转录因子。然而,我们还注意到,特异性胆转录因子的表达在包括rspondin1(r)的培养基中被高度上调,表明培养基因表达是不平衡的,更趋于胆细胞最终细胞类型。
notch和tgf-β信号转导途径已涉及体内胆细胞最终细胞类型。实际上,rbpj(对于实现活性notch信号转导是必要的)的缺失导致异常管腺发生(zongy.development2009),并且向肝脏外移体添加tgf-β促进了体外胆分化(clotmanf.genesanddevelopment2005)。因为notch和tgf-β信号转导途径在肝脏培养物中被高度上调(图22),所以我们推断胆管细胞最终细胞类型的抑制可能触发细胞更趋于肝细胞表型的分化。选择a8301作为tgfb受体alk5、4和7的抑制剂,并且选择dapt作为γ-分泌酶(实现notch途径所必须的活性蛋白酶)的抑制剂。我们首先将细胞在扩增条件(er培养基)中培养2天,并且在第2天(图23a),我们通过添加不同化合物的组合来开始分化条件。培养基隔天更换,并且稍后8-9天分析分化的标志物的表达。将er和enrw条件用作负对照。
egf+fgf10与dapt和a8301的组合导致所分析的肝细胞标志物(cyp3a11、tat、白蛋白)的表达令人惊讶地大幅增加(图23b)。到低5天,该作用已为可检测到的,并且在第8-9天达到峰值(图23c)。分别在10μm(dapt)和50nm(a8301)实现最大浓度效率(图23d)。添加地塞米松(已知的肝细胞分化分子)不产生任何基因表达的改进。egf、fgf10、a8301和dapt的组合不仅增强肝细胞样细胞的表达而且还增加肝细胞样细胞的数量,如通过针对肝细胞标志物白蛋白和2f8的免疫荧光以及在源自albcrelacz的类器官上的xgal染色所评定的。因此,我们可断定前述分化方案促进来自肝脏干细胞培养物的肝细胞样细胞的体外产生。
方法
试剂
在培养实验中所用的试剂示于表4中。
小鼠:如前所述将lgr5-egfp-ires-creert2小鼠(barkern等人,nature2007;449:1003-7)、apcfl/fl(sansomoj等人,genesdev2004;18:1385-90)、axin2-lacz小鼠(lustigb等人,molcellbiol2002;22:1184-93)、c57b/6野生型小鼠(6-12周龄)基因分型,并且用于试验。将lgr5-egfp-ires-creert2小鼠与apcfl/fl小鼠杂交。通过腹膜内注射它莫西芬(2mg/小鼠)来诱导cre酶活性。在它莫西芬诱导自后4周对小鼠实施安乐死。纵向打开小鼠小肠和结肠,用冷pbs洗涤并进一步处理以用于隐窝分离。使用立体显微镜确定包括肠腺瘤的区域,用手术刀切开并用冷pbs洗涤。
人组织材料
从来自diaconessenhospitalutrecht或umcu医院的30名患者获得手术切除的肠组织。
从20名患有结肠癌的患者(9个为盲肠上升性结肠,7个为乙状结肠,4个为直肠;33-86岁)、5名通过结肠镜筛查的患者(33-63岁)和5名患有巴雷特食管症的患者(45-78岁)收集患者材料。对于正常组织,保持与肿瘤大于3cm的距离。将肠组织洗涤并且剥去深层肌肉层。将组织切碎成约5mm的片,并且用冷pbs进一步洗涤。从umcu医院获得内窥镜活体组织切片(肠或食管的)。对于每一情况,收集至少5个活体组织切片样品并贮存在冷pbs中。该研究由dhu和umcu的伦理委员会批准,并所有样品在知情同意的情况下获得。
隐窝/腺瘤分离和细胞解离
用冷pbs进一步洗涤肠碎块(小肠正常结肠、人正常小肠和结肠),直至上清液澄清。接下来,在冰上,于2mmedta冷螯合缓冲剂(具有5.6mmna2hpo4、8.0mmkh2po4、96.2mmnacl、1.6mmkcl、43.4mm蔗糖、54.9mmd-山梨糖醇、0.5mmdl-二硫苏糖醇的蒸馏水)中孵育组织碎块30分钟(gregorieffagastroenterology2005(129)626-638)。在除去edta缓冲剂之后,使用10-ml移液管将组织碎块充分再悬浮于冷螯合缓冲剂中以分离肠隐窝。使组织碎块在正常重力下沉淀1分钟,并且移除上清液以由倒置显微镜进行检查。再悬浮/沉淀程序通常为6-8次,并且丢弃不包括隐窝的上清液。在涂覆有牛血清白蛋白的50ml-falcon管中收集包括隐窝的上清液。将分离的隐窝制丸,用冷螯合缓冲剂洗涤,并且以150–200g离心3分钟以将隐窝与单细胞分离。
将小鼠结肠隐窝制丸,并用trypleexpress(invitrogen)再悬浮并于37℃孵育15分钟。在这种解离条件下,结肠隐窝被适度消化,由此将结肠隐窝底部与结肠隐窝的顶部物理分离。
将来自它莫西芬诱导的lgr5-egfpires-creert2/apcfl/fl小鼠的包括腺瘤的肠碎块在冰上于2mmedta螯合缓冲剂中孵育60分钟。在用冷螯合缓冲剂洗涤之后,分离大部分正常肠上皮细胞,同时腺瘤细胞保持与间质结合。接下来,在37℃下,于硝化缓冲剂(具有2.5%胎牛血清、青霉素/链霉素(invitrogen)、75u/ml胶原酶ix型(sigma)、125μg/ml分散酶ii型(invitrogen)的dmem)中孵育腺瘤碎块30分钟。使腺瘤碎块在正常重力下沉淀1分钟,并且在50ml-falcon管中收集上清液,制丸并用pbs洗涤。分离的腺瘤细胞以150–200g离心3分钟以将腺瘤与单细胞分离。
用pbs洗涤来自巴雷特食管和人结肠癌样品并切碎成5mm片的活体组织切片样品数次。在37℃下,将组织碎块于消化缓冲液中孵育60分钟。在消化之后,在显微镜下人工挑选组织碎块。
对于分选实验,在37℃下,用包括2,000u/mldnase(sigma)的trypleexpress(invitrogen)来解离分离的隐窝60分钟。使解离的细胞经过20-μm细胞筛(celltrics)并用pbs洗涤。通过前向散射、侧向散射和脉冲宽度以及碘化丙啶或7-add(ebioscience)的负染色来设门筛选活上皮单细胞。
肠隐窝、腺瘤、巴雷特食管和结肠癌的培养
使用血细胞计数器来计数分离的肠隐窝、巴雷特食管和结肠癌细胞。将隐窝、上皮碎块或单细胞嵌入在冰上的基质胶中(生长因子降低,不含酚红;bdbioscience)并且在48-孔板中接种(500个隐窝/碎块或1000个单细胞/25μl基质胶/孔)。在37℃下,将基质胶聚合10分钟,并且覆盖250μl/孔的基础培养基(补充有青霉素/链霉素、10mmhepes、glutamax、1×n2、1×b27(均来自invitrogen)和1mmn-乙酰半胱氨酸(sigma)的改进型dmem/f12),包括以下优化生长因子组合:对于小鼠肠腺瘤为小鼠egf、对于小鼠小肠隐窝为enr(小鼠egf、小鼠noggin、人r-spondin-1)、对于小鼠结肠隐窝为wenr(重组人wnt-3a或wnt-3a条件培养基+enr)、对于人小肠/结肠隐窝为hisc(人肠干细胞:wenr+胃泌激素+烟酰胺+a83-01+sb202190)、对于巴雷特食管为hisc+人fgf10。结肠癌细胞表现异质行为,并不需要添加生长因子小鼠egf和/或a83-01和/或sb202190。对于细胞分选实验,在最初2天内,在培养基中孵育y-27632(10μm;sigma)以避免时失巢凋亡。试剂和每一生长因子的浓度在图12中示出。每一器官的生长因子和小分子抑制剂的优化组合的概述在图12中给出。
成像分析
通过具有leicasp5的共焦显微镜(倒置显微镜(nikondm-il))或立体显微镜(leica,mz16-fa)来采集类器官的图像。对于免疫组织化学,将样品用4%多聚甲醛(pfa)在室温下固定1小时,并且用标准技术加工石蜡切片。如前所述来进行免疫组织化学。对于全标本免疫染色(whole-mountimmunostaining),使用recovery溶液(bdbioscience)从基质胶分离隐窝类器官,并用4%pfa固定,然后用0.1%tritonx-100透化。一抗为小鼠抗-ki67(1:250,monosan)、兔抗-muc2(1:100,santacruz)、兔抗-溶菌酶(1:1,000,dako)、兔抗-突触素(1:100,dako)以及抗-嗜铬粒蛋白a(1:100,santacruz)。二抗为对氧化物酶-结合的抗体或alexa-568-结合的抗体。edu染色遵循制造商的方案(click-it;invitrogen)。用dapi(molecularprobes)染色dna。用共焦显微镜获得三维图像并用volocitysoftware(improvision)重建。
微阵列分析和实时pcr分析
在geo数据库中以登录号gse28907存储数据。
实施例6–包括前列腺素-2或花生四烯酸的肝脏类器官培养
通过向基础培养基添加前列腺素e2(pge2)或花生四烯酸(aa)有效地增强了肝脏类器官的体外存活、生长和表达。
图25和26示出添加50nm(还理解为在10-500nm的范围内发挥作用)的pge2或添加10μg/ml(还在100μg/ml发挥作用,尽管不那么好)的aa与仅用基础培养基相比产生更多的更大类器官。重要地,添加pge2或aa允许更长的扩增时间。这表明类器官在生长降低或减缓之前可扩增更大群体倍增。在没有pge2的情况下,在以每周5倍扩增培养5周之后,看到生长降低。在有pge2的情况下,以每周5倍扩增,在至少8周之前没有生长降低。看到pge2具有比aa略微更大的作用。所用的基础培养基为:hegf(100ng/ml,invitrogen);人noggin(hnoggin)(25ng/ml,peprotech);胃泌激素(10nm,sigma);hfgf10(peprotech);烟酰胺(10mm,sigma);a8301(500nm,tocris);hhgf(50ng/ml,peprotech);rspo条件培养基(10%)。
pge2和aa连同磷脂、前列腺素g2(pgg2)、前列腺素f2(pgf2)、前列腺素h2(pgh2)、前列腺素d2(pgd2)均处于相同的前列腺素信号转导途径(参见图24)。将预期到添加该途径的任何其他活化组分对培养基会具有相同的有益作用。
添加pge2或aa对扩增培养基是特别有益的。然而,它们在某些情况中还可包括在分化培养基中。
实施例7-gsk3在培养基中是有效的wnt激动剂
chir99021(gsk3抑制剂)还表现为培养基的有效wnt激动剂。特别地,其还表现为用于结肠或肝脏类器官的培养基中wnt的合适替代物。
此外,作为实施例6扩展,图25示出在存在chir99021(wnt激动剂)和pge2的情况下生长的人肝脏细胞与仅用wnt激动剂或pge2而生长的细胞相比产生更多且更大的类器官,并且与仅在基础培养基中相比产生必然更多/更大的类器官。
因此,gsk3抑制剂可用于培养基来替代其他诸如wnt和rspondin1-4的wnt激动剂,或除诸如wnt和rspondin1-4的wnt激动剂之外,在培养基中还使用gsk3抑制剂。
令人惊讶的是,chir99021是有效的wnt替代物,因为gsk3不仅涉及wnt途径还涉及许多不同途径。该发现开启了设计靶向gsk3的可用于培养基的其他wnt激动剂的可能性。
实施例8–前列腺
前列腺上皮的分离(小鼠方案)
编号的步骤对应于图47。
i)处死最少8周龄的雄性小鼠以分离成熟前列腺;从小鼠分离泌尿生殖窦。
ii)通过破坏/切割血管和结缔组织并在尿道底部产生切口来移除精囊。
iii)通过破坏/切割在尿道基底附近的膀胱来移除膀胱。
iv)通过轻度牵引并切割来移除剩余的囊&脂肪组织。在中部应留下的应是前列腺叶(其中的6个)和粉色结构,其为尿道;
v)移除尿道,通过粉色而易于将其识别(在图中深色染色的)。小心地拉出前列腺叶,因此它们不再与尿道连接;仅通过将它们拉离来单独分离每一叶,或者与整个前列腺一起继续。
接下来,将前列腺(叶)切成小片;在37℃下,在1ml10mg/ml胶原酶ii(溶解于admem/f12中)中消化前列腺一个半小时;在胶原酶消化之后,仅应保留上皮细胞的“指状”结构。
‐在admem/f12洗涤
‐让大块沉淀并移走上清液(在低速下的离心移除大部分间质)
‐在4℃以50×g离心5分钟
‐再悬浮于1ml胰蛋白酶(tle)中并在37℃消化约30分钟
每10分钟用移液管上移和下移以确保消化
‐在admem/f12洗涤
‐在enr或enr+1nm二氢睾酮中开始培养(约接种5000个细胞/孔)(0.1nm-10μm),我们不清楚上限
‐或通过facs与分离的具体细胞类型一起继续
结果
根据上述方法在enr+二氢睾酮中培养的前列腺上皮细胞目前可维持35周。在存在睾酮的情况下,培养基的扩增与没有睾酮的情况相同。然而,在使用睾酮的情况下,存在所有细胞类型,包括干细胞、短暂扩充细胞和分化的细胞,即,存在增加的分化,同时维持干细胞群。在存在睾酮的情况下生长的前列腺类器官看起来也更像体内类器官(参见图41和42)。此外,ihc和rt-pcr表明在存在睾酮的情况下生长的前列腺类器官包括基细胞和腔细胞。
本发明还提供了以下编号的实施方案:
1.用于扩增干细胞的培养基,其中所述培养基包括至少一种或多种与一种或多种选自以下的丝氨酸/苏氨酸蛋白激酶靶标结合并降低其活性的抑制剂:tgfβ受体激酶1、alk4、alk5、alk7、p38;以及其中培养基允许连续生长至少3个月。
2.如实施方案1所述的培养基,其中所述至少一种或多种抑制剂包括:
与alk5结合并降低其活性的抑制剂;以及
与p38结合并降低其活性的抑制剂。
3.如实施方案1或实施方案2的所述培养基,其中所述抑制剂是与其靶标结合并将其靶标的活性降低95%以上的作用剂,如细胞检测所评价的。
4.如前述实施方案中任一实施方案所述的培养基,其中所述抑制剂的ic50值小于100nm。
5.如前述实施方案中任一实施方案所述的培养基,其中所述抑制剂竞争性地、非竞争性地、无竞争性地、或通过混合抑制发挥作用。
6.如前述实施方案中任一实施方案所述的培养基,其中所述抑制剂竞争性地发挥作用并与所述丝氨酸-苏氨酸蛋白激酶靶标的atp-结合袋结合。
7.如前述实施方案中任一实施方案所述的培养基,其中所述抑制剂为a)小分子抑制剂;b)蛋白或肽;c)反义寡核苷酸;或d)适配子。
8.如前述实施方案中任一实施方案所述的培养基,其中所述小分子抑制剂的分子量为50da至800da。
9.如前述实施方案中任一实施方案所述的培养基,其中所述抑制剂为吡啶咪唑或2,4-双取代喋啶或喹唑啉衍生抑制剂。
10.如前述实施方案中任一实施方案所述的培养基,其中以10nm至10μm的浓度添加所述抑制剂。
11.如前述实施方案中任一实施方案所述的培养基,其中所述抑制剂选自包括以下的化合物组:sb-202190、sb-203580、sb-206718、sb-227931、vx-702、vx-745、pd-169316、ro-4402257、birb-796、a83-01、ly364947、sb-431542、sb-505124、sb-525334、ly364947、sd-093和sjn2511。
12.如前述实施方案中任一实施方案所述的培养基,其中以50nm至100μm的浓度添加sb-202190或sb-203580。
13.如前述实施方案中任一实施方案所述的培养基,其中所述干细胞为人干细胞。
14.如前述实施方案中任一实施方案所述的培养基,其中所述干细胞为上皮干细胞。
15.如实施方案14所述的培养基,其中所述人上皮干细胞为a)胰腺干细胞;b)肠干细胞;或c)结肠干细胞。
16.如前述实施方案中任一实施方案所述的培养基,其中所述干细胞形成类器官的一部分或分离的组织碎块。
17.如前述实施方案中任一实施方案所述的培养基,其中所述干细胞为癌干细胞。
18.如前述实施方案中任一实施方案所述的培养基,其中在干细胞群中的在1、2或3个月以上之后具有正常染色体组型的细胞的比例为90%以上。
19.如前述实施方案中任一实施方案所述的培养基,其中在干细胞群中的在1、2或3个月以上之后为具有正常表型的细胞的比例为90%以上。
20.如前述实施方案中任一实施方案所述的培养基,其中所述干细胞存活三个月以上,例如六个月以上。
21.如前述实施方案中任一实施方案所述的培养基,其中所述干细胞的平均群体倍增时间为12小时至36小时、18小时至30小时、或约24小时。
22.如前述实施方案中任一实施方案所述的培养基,其中所述培养基包括用于动物或人细胞的基础培养基以及:
一种或多种骨形态发生蛋白(bmp)抑制剂;
一种或多种促有丝分裂生长因子;以及
一种或多种wnt激动剂。
23.如前述实施方案中任一实施方案所述的培养基,其中所述培养基包括胃泌激素和/或烟酰胺。
24.用于扩增干细胞群的方法,其中所述方法包括:
提供干细胞群;
提供前述实施方案中任一实施方案的培养基;
使所述干细胞与所述培养基接触;以及
在合适的条件下培养所述细胞。
25.组合物,其包括前述实施方案中任一实施方案所述的培养基以及干细胞。
26.组合物,其包括本发明的培养基和细胞外基质。
27.培养基补充剂,其包括前述实施方案中任一实施方案所述的一种或多种抑制剂。
28.气密容器,其包括前述实施方案中任一实施方案所述的培养基或实施方案27所述的培养基补充剂。
29.用于培养巴雷特食管上皮的实施方案1至23中任一实施方案所述的培养基,其中所述培养基还包括fgf10。
30.使用前述实施方案中任一实施方案所述的培养基而获得的干细胞类器官,其用于移植用途或其他医疗应用。
31.包括β-细胞的胰腺类器官。
32.如实施方案31所述的胰腺类器官,其还包括α细胞、δ细胞和pp细胞。
33.如实施方案31或32中任一实施方案所述的胰腺类器官,其包括α细胞、β细胞、δ细胞和pp细胞
34.如实施方案31或33中任一实施方案所述的胰腺类器官,其表达pdx1、nkx2.2和nkx6.1中的一种、两种或全部三种。
35.如实施方案31至34中任一实施方案所述的胰腺类器官,其表达neurod、pax6和mafa中的一种、两种或全部三种。
36.如实施方案35所述的胰腺类器官,其还表达ngn3。
37.胰腺类器官,例如实施方案31至36中任一实施方案所述的胰腺类器官,其能在将所述类器官植入患者之后分泌胰岛素。
38.如实施方案31至37中任一实施方案所述的胰腺类器官,其还用于治疗患有诸如糖尿病的胰岛素缺乏症的患者。
39.治疗患有诸如糖尿病的胰岛素缺乏症的患者的方法,其包括将实施方案31至37中任一实施方案所述的胰腺类器官植入所述患者。
40.人类器官,其选自隐窝-绒毛类器官、结肠类器官、胰腺类器官、胃类器官、巴雷特食管类器官、腺癌类器官和结肠癌类器官。
41.使用实施方案1至23中任一实施方案所述的培养基而获得的小肠或隐窝-绒毛类器官,其用于治疗受损上皮,例如在微绒毛包含病(mvid)患者中的受损上皮。
42.包括用于动物或人细胞的基础培养基或由其组成的肝脏类器官,向所述基础培养基添加一种或多种受体酪氨酸激酶配体,例如促有丝分裂生长因子(例如egf)、烟酰胺,并且优选添加wnt激动剂,优选r-spondin1-4和/或chir99021,以及以下中的一种或二者:a)前列腺素途径活化剂,例如pge2和/或aa,以及b)tgf-β抑制剂,例如a83-01。
序列表
<110>荷兰皇家科学院(koninklijkenederlandseakademievanwetenschappen)
<120>用于干细胞的培养基
<130>p057192wo
<140>pct/ib2012/052950
<141>2012-06-11
<150>us61/520569
<151>2011-06-10
<150>gb1111244.8
<151>2011-06-30
<150>us61/571663
<151>2011-06-30
<150>us61/513461
<151>2011-07-29
<150>us13/194866
<151>2011-07-29
<150>us61/594295
<151>2012-02-02
<160>30
<170>seqwin2010,version1.0
<210>1
<211>17
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>dsl肽(dslpeptide)
<400>1
cysaspasptyrtyrtyrglypheglycysasnlysphecysargpro
151015
arg
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>引物(primer)
<400>2
gcagcattacctgctctacgtt22
<210>3
<211>25
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>3
gcttgataagctgatgctgtaattt25
<210>4
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>4
gcagccag8
<210>5
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>5
catggaccgcttcccata18
<210>6
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>6
ggcacctgtctgtccacat19
<210>7
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>7
tggctctg8
<210>8
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>8
cagccaacgctgcttctc18
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>9
tggcatggaattgacagc18
<210>10
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>10
cctcctgg8
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>11
ccgctactggtgtaatgatgg21
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>12
catcagcgatgttatcttgcag22
<210>13
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>13
aggagcag8
<210>14
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>14
gccagctcatcaaggacag19
<210>15
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>15
gcaggcatcgtagtagtgctg21
<210>16
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>16
ttgcccag8
<210>17
<211>24
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>17
tgaccttgatttattttgcatacc24
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>18
cgagcaagacgttcagtcct20
<210>19
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>19
gcttgccacaacttcctaagat22
<210>20
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>20
tcagtttagtcatggtggacga22
<210>21
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>21
ggtggtgg8
<210>22
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>22
tgtggaaccgggaagatg18
<210>23
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>23
gaccacaggtatggttctgga21
<210>24
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>24
tggtggag8
<210>25
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>25
cgatccagaaagatgatggtc21
<210>26
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>26
cggaagcctctgtctttcc19
<210>27
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>引物(probe)
<400>27
ggatggag8
<210>28
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>正向引物(forwardprimer)
<400>28
tcctcctcagaccgctttt19
<210>29
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>反向引物(reverseprimer)
<400>29
cctggttcatcatcgctaatc21
<210>30
<211>8
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>探针(probe)
<400>30
actcccag8
- 还没有人留言评论。精彩留言会获得点赞!