一种β-内酰胺酶保护剂及制备方法与流程
本发明涉及药品和生物技术领域,具体涉及一种β-内酰胺酶保护剂及制备方法。
背景技术
β-内酰胺酶是细菌产生的、能催化水解β-内酰胺抗生素的β-内酰胺环的灭活酶。主要分为四类:(1)青霉素酶,水解底物主要是青霉素类抗生素;(2)头孢菌素酶,水解底物主要是头孢菌素类抗生素;(3)金属β-内酰胺酶,水解底物主要是碳青霉烯类抗生素;(4)苯唑西林类青霉素酶(oxa型),水解底物主要是苯唑西林、氯唑西林、甲氧西林、双氯西林等耐青霉素酶抗生素。绝大多数的β-内酰胺酶活性中心多为丝氨酸(丝氨酸活性酶),而金属β-内酰胺酶的活性中心多为组氨酸和半胱氨酸,需要zn2+或mn2+形成配位化合物,催化水解反应。
β-内酰胺酶由工业化微生物发酵法生产,经纯化工艺制成酶制剂,其成品有冻干粉和水溶液二种。它常用于药品的微生物检测以及β-内酰胺抗生素药品生产的洁净环境监测。
用于药厂β-内酰胺抗生素生产的洁净环境监测的加酶平皿培养基中所添加的酶类是β-内酰胺酶,该酶在加酶平皿培养基辐照灭菌后活性损失极大,因此迫使加酶平皿生产时须成倍加大酶量,造成药厂用户难以承受加酶平皿的使用成本,甚至无法采购和使用合格的加酶平皿。
技术实现要素:
本发明的目的是提供一种β-内酰胺酶保护剂及制备方法,经过加酶产品的酶活稳定性验证,所述β-内酰胺酶保护剂可以大大减少酶活力损失,保持酶活性的相对稳定。
为解决上述问题,本发明采用以下技术方案,提供一种β-内酰胺酶保护剂及制备方法:
1.所述β-内酰胺酶保护剂以酶活力单位(万单位,wu)计由以下成分组成:dextran200.1-0.6mg/wu,海藻糖0.5-2mg/wu,山梨醇d0.1-0.6mg/wu,l-组氨酸0.2-1mg/wu,l-精氨酸0.2-1mg/wu,l-抗坏血酸磷酸酯钠盐0.01-0.06mg/wu,吐温200.02-0.06mg/wu,znso40.002-0.006mg/wu。
2.所述制备方法包括以下步骤:
(1)以酶活力1万单位计,精确称取所需量的dextran20、海藻糖、山梨醇d、l-组氨酸、l-精氨酸、znso4置于三角瓶或配制罐中,加入适量0.05m柠檬酸盐缓冲液(ph7.0),100-150rpm搅拌使之溶解。
(2)在上述溶液中加入所需量的l-抗坏血酸磷酸酯钠盐、吐温20,100-150rpm搅拌10-15min使之混合均匀,即得β-内酰胺酶保护剂溶液。
(3)控制β-内酰胺酶保护剂溶液的ph=7.0±0.2,其溶液体积≤生产配制溶液体积的2.5%。
(4)所需量的β-内酰胺酶先用适量ph7.0柠檬酸盐缓冲液溶解,控制酶溶液的体积≤生产配制溶液体积的0.5%,加入保护剂溶液中,100-150rpm搅拌10-15min使之混合均匀,得到含酶的保护剂溶液。
(5)含酶的保护剂溶液用0.22um滤膜除菌过滤。控制含酶的保护剂溶液总体积≤生产配制溶液总体积的3%。
3.作为优选,所述保护剂成分中dextran20为0.5mg/wu,海藻糖1.5mg/wu,山梨醇d0.2mg/wu,l-组氨酸0.6mg/wu,l-精氨酸0.4mg/wu,l-抗坏血酸磷酸酯钠盐0.03mg/wu,吐温200.04mg/wu,znso40.004mg/wu。控制保护剂溶液的ph=7.0±0.2,溶液体积≤生产配制溶液体积的2.5%。
4.本发明的有益结果是:区别于现有β-内酰胺酶在储运和使用过程中酶活性大幅下降而影响应用的情况,本发明的β-内酰胺酶保护剂中多糖类和醇类与酶形成多羟基氢键结构,替代水分子维持酶的空间结构稳定;氨基酸类保护酶的丝氨酸、组氨酸及半胱氨酸活性中心;甘油为常用的保水剂;zn2+是酶的激活剂;吐温20是非离子表面活性剂,常作为酶促反应的酶活性保护剂。经过加酶产品的酶活力稳定性验证,本发明的保护剂可以大大减少酶活力损失,保持酶活性的相对稳定,降低β-内酰胺酶的使用成本。
附图说明
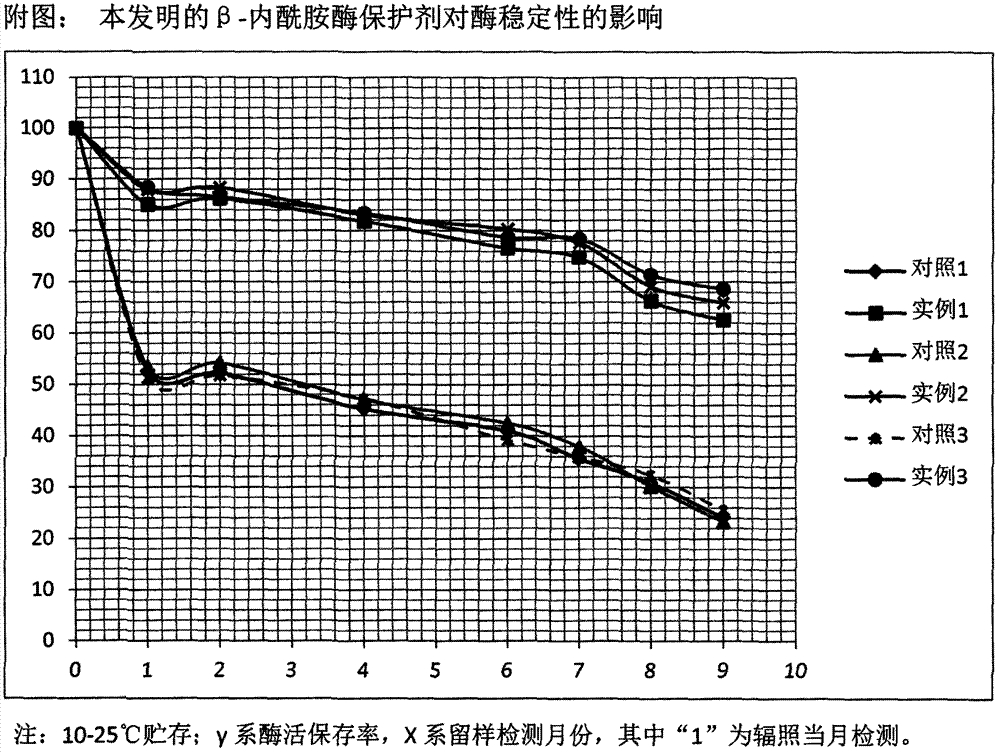
图1是本发明的β-内酰胺酶保护剂对酶稳定性的影响。
具体实施方式
下面结合实施例对本发明进行详细说明。
实施例1制备φ90mmtsac无菌平皿(20万单位/20g.皿)。
(酶原料:杭州××生物技术有限公司,头孢菌素酶批号7041630d,采用中国药典方法测得酶活力单位为1009.8万单位/g。)
1.配制tsa溶液6000ml,灭菌后,60℃保温备用。
2.一种β-内酰胺酶保护剂及制备方法,以酶活力单位(万单位,wu)计包括dextran200.1mg/wu,海藻糖0.5mg/wu,山梨醇d0.1mg/wu,l-组氨酸0.2mg/wu,l-精氨酸0.2mg/wu,l-抗坏血酸磷酸酯钠盐0.01mg/wu,吐温200.02mg/wu,znso40.002mg/wu。
所述β-内酰胺酶保护剂及制备方法,包括以下步骤:
(1)配制tsa溶液6000ml,灭菌后,60℃保温备用。
(2)精确称取所需量的dextran200.5g、海藻糖2.5g、山梨醇d0.5g、l-组氨酸1g、l-精氨酸1g、znso410mg置于三角瓶中,加入ph7.0柠檬酸盐缓冲液120ml,100-150rpm磁力搅拌使之溶解。
(3)在上述溶液中加入所需量的l-抗坏血酸磷酸酯钠盐0.05g、吐温200.1g,100-150rpm磁力搅拌10-20min使之混合均匀,即得β-内酰胺酶保护剂溶液。
3.取所需量头孢菌素酶5000万单位(5000wu),用20-25ml柠檬酸盐缓冲液(ph7.0)溶解,加入保护剂溶液中,100-150rpm磁力搅拌10-20min使之混合均匀,得到含酶的保护剂溶液。
4.含酶的保护剂溶液用0.22um滤膜除菌过滤,加入到备用的5000mltsa溶液中,100-150rpm搅拌10-20min使含酶的保护剂溶液和tsa溶液充分混匀,得到酶保护剂-tsac溶液。此溶液制备的平皿为实验组。
5.取头孢菌素酶1000万单位(1000wu),用10-15ml柠檬酸盐缓冲液(ph7.0)溶解,加入到1000mltsa溶液中,100-150rpm磁力搅拌10-20min使之混合均匀,即得酶-tsac溶液。此溶液制备的平皿为对照组。
6.上述二种tsa溶液按20g/皿灌装tsac平皿,冷却后真空包装,10k辐照灭菌,即得二种tsac无菌平皿。
实施例2制备φ90mmtsac无菌平皿(20万单位/20g.皿)
(酶原料:杭州××生物技术有限公司,头孢菌素酶批号7041630d,采用中国药典方法测得酶活力单位为1009.8万单位/g。)
1.配制tsa溶液6000ml,灭菌后,60℃保温备用。
2.一种β-内酰胺酶保护剂及制备方法,以酶活力单位(万单位,wu)计包括dextran200.5mg/wu,海藻糖2mg/wu,山梨醇d0.5mg/wu,l-组氨酸1mg/wu,l-精氨酸1mg/wu,l-抗坏血酸磷酸酯钠盐0.05mg/wu,吐温200.05mg/wu,znso40.006mg/wu。
所述β-内酰胺酶保护剂及制备方法,包括以下步骤:
(1)配制tsa溶液6000ml,灭菌后,60℃保温备用。
(2)精确称取所需量的dextran202.5g、海藻糖10g、山梨醇d2.5g、l-组氨酸5g、l-精氨酸5g、znso430mg置于三角瓶中,加入ph7.0柠檬酸盐缓冲液130ml,100-150rpm磁力搅拌使之溶解。
(3)在上述溶液中加入所需量的l-抗坏血酸磷酸酯钠盐0.25g、吐温200.25g,100-150rpm磁力搅拌10-20min使之混合均匀,即得β-内酰胺酶保护剂溶液。
3.取所需量头孢菌素酶5000万单位(5000wu),用20ml柠檬酸盐缓冲液(ph7.0)溶解,加入保护剂溶液中,100-150rpm磁力搅拌10-20min使之混合均匀,得到含酶的保护剂溶液。
4.含酶的保护剂溶液用0.22um滤膜除菌过滤,加入到备用的tsa溶液中,100-150rpm搅拌10-20min使含酶的保护剂溶液和tsa溶液充分混匀,得到酶保护剂-tsac溶液。此溶液制备的平皿为实验组。
5.取头孢菌素酶1000万单位(1000wu),用10-15ml柠檬酸盐缓冲液(ph7.0)溶解,加入到1000mltsa溶液中,100-150rpm磁力搅拌10-20min使之混合均匀,即得酶-tsac溶液。此溶液制备的平皿为对照组。
6.上述二种tsa溶液按20g/皿灌装tsac平皿,冷却后真空包装,10k辐照灭菌,即得二种tsac无菌平皿。
实施例3制备φ90mmtsam无菌平皿(20万单位/20g.皿)
(酶原料:杭州××生物技术有限公司,金属β-内酰胺酶批号:6021639d,采用中国药典方法测得酶活力单位为730.2万单位/g。)
1.配制tsa溶液6000ml,灭菌后,60℃保温备用。
2.一种β-内酰胺酶保护剂及制备方法,以酶活力单位(万单位,wu)计包括dextran20为0.5mg/wu,海藻糖1.5mg/wu,山梨醇d0.2mg/wu,l-组氨酸0.6mg/wu,l-精氨酸0.4mg/wu,l-抗坏血酸磷酸酯钠盐0.03mg/wu,吐温200.04mg/wu,znso40.004mg/wu。
所述β-内酰胺酶保护剂及制备方法,包括以下步骤:
(1)配制tsa溶液5000ml,灭菌后,60℃保温备用。
(2)精确称取所需量的dextran202.5g、海藻糖7.5g、山梨醇d1g、l-组氨酸3g、l-精氨酸2g、znso420mg置于三角瓶中,加入ph7.0柠檬酸盐缓冲液130ml,100-150rpm磁力搅拌使之溶解。
(3)在上述溶液中加入所需量的l-抗坏血酸磷酸酯钠盐0.15g、吐温200.2g,100-150rpm磁力搅拌10-20min使之混合均匀,即得β-内酰胺酶保护剂溶液。
3.取所需量的金属β-内酰胺酶5000万单位(5000wu),用20ml柠檬酸盐缓冲液(ph7.0)溶解,加入保护剂溶液中,100-150rpm磁力搅拌10-20min使之混合均匀,得到含酶的保护剂溶液。
4.含酶的保护剂溶液用0.22um滤膜除菌过滤,加入到备用的tsa溶液中,100-150rpm搅拌10-20min使含酶的保护剂溶液和tsa溶液充分混匀,得到酶保护剂-tsac溶液。此溶液制备的平皿为实验组。
5.取金属β-内酰胺酶1000万单位(1000wu),用10-15ml柠檬酸盐缓冲液(ph7.0)溶解,加入到1000mltsa溶液中,100-150rpm磁力搅拌10-20min使之混合均匀,即得酶-tsac溶液。此溶液制备的平皿为对照组。
6.上述二种tsa溶液按20g/皿灌装tsac平皿,冷却后真空包装,10k辐照灭菌,即得二种tsac无菌平皿。
实施例4酶活力稳定性比较
1.辐照后酶活力比较:实施例1-3的样品与不加保护剂的加酶tsac
2.留样观察的酶活力比较:实施例1-3的样品与不加保护剂的加酶tsac
附表:保护剂对酶稳定性的影响(采用中国药典方法(碘量法)测定验证样品的酶活力)
根据附表中的数据计算脂肪酶的酶活保存率,酶活保存率按以下公式计算:
x——酶活保存率,%;
e1——不同时间后测得的酶活;
e——加入的酶活量;
由附表数据和附图可知:
(1)不加β-内酰胺酶保护剂的加酶平皿,辐照后平均酶活为5327u/g,平均酶活保存率为53.27%;辐照后3个月的平均酶活为4725u/g,酶活保存率47.25%;辐照后6个月的平均酶活为3649u/g,酶活保存率36.49%。
(2)加入β-内酰胺酶保护剂的加酶平皿,辐照后平均酶活为8717u/g,平均酶活保存率为87.17%;辐照后3个月的平均酶活为8277u/g,酶活保存率82.77%;辐照后6个月的平均酶活为7695u/g,酶活保存率76.95%。
(3)优选保护剂组分实施例3,辐照后酶活为8843u/g,平均酶活保存率为88.43%;辐照后3个月的平均酶活为8338u/g,酶活保存率83.38%;辐照后6个月的平均酶活为7843u/g,酶活保存率78.43%。
- 还没有人留言评论。精彩留言会获得点赞!