ZnT8A自身抗体检测试剂盒的制作方法
本发明属于生物检测领域,具体地说,涉及一种用于定量检测ZnT8A自身抗体的试剂盒、尤其是通过磁微粒化学发光法定量检测人ZnT8A自身抗体的试剂盒。
背景技术:
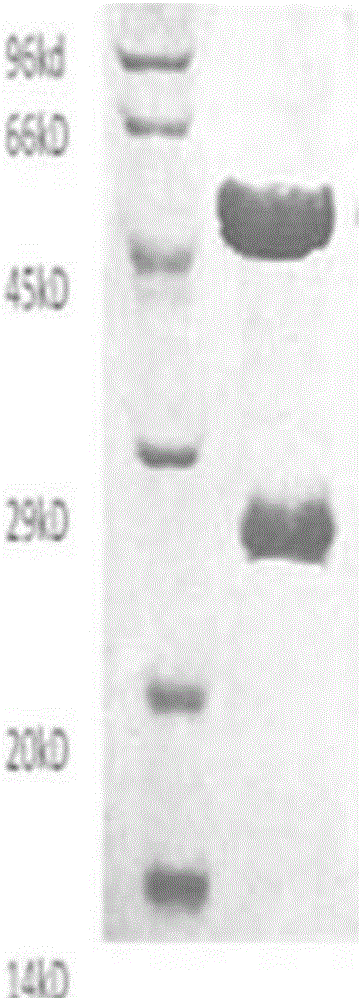
:糖尿病作为目前继心血管疾病和肿瘤之后的第三大非传染性疾病,已成为严重威胁人类健康的世界性公共卫生问题。在糖尿病人群中约有10%属于1型糖尿病(TIDM),中国人口基数大,因此该类患者的绝对例数多。TIDM是由自身反应性T细胞介导的,以胰岛B细胞选择性破坏为特征,通常起病年龄较轻,胰岛功能衰竭的速度更快,血糖较难控制,容易出现糖尿病并发症,因此治疗的关键在于早期诊断或筛查出这类患者并给予恰当的干预措施,延缓乃至阻止胰岛功能衰竭,从而减少并发症发生和改善生活质量。TIDM是一种器官特异性自身免疫性疾病,患者体内常存在多种自身抗体。现己明确的包括胰岛细胞抗体(ICA)、谷氨酸脱梭酶抗体(GADA)、蛋白酪氨酸磷酸酶-2抗体(IA-2A)、胰岛素自身抗体(IAA)等。这些自身抗体可以在TIDM发病前数年出现,是TIDM自身免疫反应的重要预测和诊断标志。目前认为,联合GADA、IA-2A、IAA检测能提高TIDM诊断的敏感性。然而,已发现和应用的糖尿病自身抗体对TIDM诊断效率仍然偏低,导致部分患者漏诊而被采用不合适的治疗方式,从而严重影响患者身心健康,造成巨大的社会及经济负担。故深入探讨和发现新的胰岛自身抗体对自身免疫糖尿病的诊断与治疗有着重要的实用价值。最近发现的阳离子外流锌转运蛋白ZnT8(SLC30A8)是人类T1DM的主要自身抗原之一,具有高度B细胞特异性,其通过影响锌离子浓度而在胰岛素合成和分泌中发挥重要作用。在胰岛素合成中,ZnT8能将锌从质膜输入到胰岛素分泌颗粒里,易化锌-胰岛素固相六聚体的形成,并参与胰岛素的分泌,同时锌亦参加胰岛A细胞、B细胞分泌的胰高血糖素以及胰岛素旁分泌和自分泌的调节。锌转运蛋白8(ZnT8)是TIDM的关键抗原,其自身抗体(ZnT8A)是糖尿病自身抗体中的又一新成员,提示ZnT8A很可能是一个独立的T1DM标志物。而联合检测GADA、IA-2A、IAA以及ZnT8A,可将T1D诊断阳性率提高到98%以上,而自身抗体阴性的T1DM患者从5%降至1.8%,至少合并两种抗体阳性的患者从72%增加到82%。这一重要发现提示ZnT8A对于T1DM,尤其是其它自身抗体阴性的患者有着重要的诊断价值。与GADA和IA-2A不同,由于ZnT8A具有高度的B细胞特异性,提示其可用于监测胰岛免疫损伤和评价临床干预的疗效。ZnT8A目前被国际上认为是继ICA、GADA、IA-2A后的第四种主要胰岛自身抗体。这一重要发现提示ZnT8A对于TIDM,特别是其他自身抗体阴性的患者有着重要的诊断价值。用于捕获ZnT8A自身抗体的抗原蛋白的活性对于ZnT8A自身抗体捕获至关重要,当ZnT8抗原蛋白活性与人体内ZnT8蛋白的构象一致的情况下,才可能捕获到低浓度的ZnT8A自身抗体。现在利用的网织红细胞体外无细胞表达体系是主要的制备抗原蛋白的方法,但是该方法制备的ZnT8蛋白含量较少,成本高昂,制约了临床上大规模开展应用。目前,ZnT8A的检测方法主要为放射配体免疫法(RIA),虽然RIA具有较高的灵敏度,但存在反应时间长且易导致放射性污染。现有的绝大部分ZnT8A自身抗体检测试剂盒为定性试剂盒,仅反映血清中自身抗体是否存在;而对于一些疾病来说,如T1DM自身抗体与疾病的进程存在关联;在T1DM发展的晚期,ZnT8A自身抗体含量有所降低,因此定量检测血清中ZnT8A含量对于T1DM的鉴别有重要意义。ZnT8A现在还没有国际或国家校准品;而且临床上难易得到足够的阳性血清制备ZnT8A阳性校准品,这对于ZnT8A的检测应用形成了制约因素。技术实现要素:为了克服现有的ZnT8A自身抗体含量检测技术的上述缺陷,本发明人基于磁微粒化学发光法,设计了一种全新的试剂盒,能够对生物样品中ZnT8A的含量进行精确测量,从而为1型糖尿病的鉴别诊断提供可靠依据。本发明人采用增加融合生物素标签的方法构建原核表达蛋白,由于在表达过程中引入了生物素标签序列,避免因后续的生物素标记到抗原识别位点中的赖氨酸残基上而引起抗原失活;同时通过链霉亲和素-生物素(SA-biotin)体系间接法固定抗原,以避免抗原与固相载体表面结合而引起的构象变化,从而保障抗原的识别活性。另外,本发明人通过偶联蛋白质的方法制备出兔抗人ZnT8多克隆抗体与人IgGFc’片段的偶联物作为校准品,解决了ZnT8A校准品制备问题,从而可以实现ZnT8A的定量检测。具体而言,本发明提供了如下技术方案。一种用于定量检测ZnT8A自身抗体的试剂盒,其包括:偶联有链霉亲和素的磁性微粒;生物素化捕获抗原蛋白,其选自生物素化第一捕获抗原蛋白、生物素化第二捕获抗原蛋白、或它们的混合物;酶标记的兔抗人IgGFc抗体;化学发光底物液;ZnT8A校准品,其中所述生物素化第一捕获抗原蛋白的氨基酸序列为SEQIDNO:1,简称为ZnT8-aviCR:MHHHHHHSSGLVPRGSGMKETAAAKFERQHMDSPDLGTDDDDKAMADIGSGLNDIFEAQKIEWHELKDFSILLMEGVPKSLNYSGVKELILAVDGVLSVHSLHIWSLTMNQVILSAHVATAASRDSQVVRREIAKALSKSFTMHSLTIQMESPVDQDPDCLFCEDPCD(SEQIDNO:1),其中的生物素标签序列是C末端的GLNDIFEAQKIEWHE;所述生物素化第二捕获抗原蛋白的氨基酸序列为SEQIDNO:2,简称为ZnT8-aviCW:MHHHHHHGLNDIFEAQKIEWHELKDFSILLMEGVPKSLNYSGVKELILAVDGVLSVHSLHIWSLTMNQVILSAHVATAASWDSQVVRREIAKALSKSFTMHSLTIQMESPVDQDPDCLFCEDPCD(SEQIDNO:2),其中的生物素标签序列是C末端的GLNDIFEAQKIEWHE。在一种实施方式中,上述试剂盒中,所述ZnT8A校准品是兔抗人ZnT8多克隆抗体与人血清IgGFc’片段的偶联物。在一种优选的实施方式中,用于兔抗人ZnT8多克隆抗体与人IgGFc’偶联的双功能试剂为GMBS。优选地,兔抗人ZnT8多克隆抗体:GMBS的摩尔比为40:1;并且优选兔抗人ZnT8多克隆抗体-GMBS:人IgGFc’的摩尔比为1:1-6。优选地,所述兔抗人ZnT8多克隆抗体的免疫原为ZnT8CR(aa268-369)与ZnT8CW(aa268-369)按摩尔比为1:1的混合物,其中ZnT8CR(aa268-369)的氨基酸序列为SEQIDNO:3,本文中简称为ZnT8CR或者CR:LKDFSILLMEGVPKSLNYSGVKELILAVDGVLSVHSLHIWSLTMNQVILSAHVATAASRDSQVVRREIAKALSKSFTMHSLTIQMESPVDQDPDCLFCEDPCD(SEQIDNO:3);ZnT8CW(aa268-369)的氨基酸序列为SEQIDNO:4,本文中简称为ZnT8CW或者CW:LKDFSILLMEGVPKSLNYSGVKELILAVDGVLSVHSLHIWSLTMNQVILSAHVATAASWDSQVVRREIAKALSKSFTMHSLTIQMESPVDQDPDCLFCEDPCD(SEQIDNO:4)。相应地,本文中ZnT8CR(aa268-369)与ZnT8CW(aa268-369)的混合物简称为ZnT8CR/CW或者CR/CW。ZnT8A校准品可用于制作标准曲线,从而使得ZnT8A检测定量化。在一种优选的实施方式中,上述试剂盒中的所述生物素化捕获抗原蛋白是所述生物素化第一捕获抗原蛋白和所述生物素化第二捕获抗原蛋白的组合物,两者的摩尔比为1:0.1~10。优选地,所述生物素化第一捕获抗原蛋白与所述生物素化第二捕获抗原蛋白的摩尔比为1:1。在一种实施方式中,上述试剂盒中的所述磁性微粒的粒径是0.1-10微米、优选0.2-5微米、优选0.2-3微米、更优选0.2-2微米、更优选0.3-1微米,以便在试剂盒使用时的检测体系形成接近均相的反应体系。在一种优选的实施方式中,所述磁性微粒是表面带有活性基团、以四氧化三铁为内核的聚合物。所述活性基团可以是氨基、羧基、IDA(亚氨基二乙酸)、环氧基等,优选氨基或羧基。在一种优选的实施方式中,上述试剂盒中的偶联有链霉亲和素的磁性微粒呈磁珠悬液形式,即链霉亲和素磁珠悬液作为磁分离试剂。本发明的试剂盒中的ZnT8A自身抗体检测体系采用酶催化的底物化学发光法,从而通过进行光电信号检测而确定样品中的ZnT8A自身抗体含量。在一种实施方式中,上述试剂盒中的酶优选是过氧化物酶、碱性磷酸酶、磷酸酯酶或荧光素酶,更优选辣根过氧化物酶(Horseradishperoxidase,简称HRP)或者碱性磷酸酶,更优选辣根过氧化物酶。作为辣根过氧化物酶的作用底物,可以选自下组:氨基苯二酰一肼(鲁米诺)、异氨基苯二酰一肼、氨基丁基乙基异氨基苯二酰一肼(ABEI)、氨基己基乙基异氨基苯二酰一肼(AHEI)、7-二甲基氨基萘-l,2-二羧酸酰肼、环取代的氨基邻苯二甲酰肼、蒽-2,3-二羧酸酰肼、菲-1,2-二羧酸酰肼、芘二羧酸酰肼、5-羟基-邻苯二甲酰肼、6-羟基邻苯二甲酰肼、2,3-二氮杂萘二酮类似物、9,10-二氢化吖啶类化合物比如9,10-二氢化吖啶酯、9,10-二氢化吖啶酯、9,10-二氢化吖啶硫酯、9,10-二氢化吖啶磺酰胺、9,10-二氢化吖啶二硫缩烯酮化合物。优选是鲁米诺。酶的作用底物可以单独作为试剂盒的组成部分,即,底物溶液。优选地,所述底物溶液含有鲁米诺(luminol)。相对应地,上述试剂盒进一步包含引发剂溶液,该引发剂溶液包含过氧化氢,比如是双氧水溶液。在一种优选的实施方式中,上述试剂盒用于测定生物样品中的ZnT8A,所述生物样品来源于受测对象、尤其是有1型糖尿病嫌疑的患者。样本可以包含多种形式,比如全血、血浆、血清、尿液、唾液、眼泪、体液、胃液、粪便。其中优选血清。本发明人开发的试剂盒可定量检测临床样本的ZnT8A含量,T1DM与其他对照样本检测特异系性90-99%,灵敏度达到30%以上,临界值(cutoff值)为15U/mL。该磁微粒化学发光法不仅具有与RIA相同的灵敏度,而且避免了放射性物质的使用,能够定量检测生物样品中的ZnT8A,便于临床应用的大规模推广。附图说明图1是实施例1含生物素标签序列的蛋白ZnT8-aviCR和ZnT8-aviCW的SDS-PAGE图。其中左侧条带为mark。图2是本发明实施例2中兔抗人ZnT8多克隆抗体的SDS-PAGE图。其中左侧条带为mark。图3是实施例4的ZnT8A自身抗体检测试剂盒中ZnT8A校准品的标准曲线。其中,Y轴代表发光信号(强度)值的对数值,X轴代表ZnT8校准品的浓度对数值。具体实施方式以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。本文中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。本文中,ZnT8是锌转运蛋白8。研究发现,ZnT8的C末端(羧基端)区段ZnT8(aa268-369)具有较高的检测敏感性和特异性,成为首选的抗原区段。该抗原区段具有良好的抗原性,可作为1型糖尿病患者辅助诊断试剂的优选抗原。目前研究得较多的包括氨基酸序列为SEQIDNO:3的ZnT8CR(aa268-369,325R)和氨基酸序列为SEQIDNO:4的ZnT8CW(aa268-369,325W),两者的差别在于ZnT8氨基酸序列中羧基端第325位氨基酸不同,前者为R,后者为W。因为ZnT8CR(aa268-369)和ZnT8CW(aa268-369)具有良好的抗原性,本发明针对性地设计了ZnT8-aviCR和ZnT8-aviCW序列,它们可以单独地、或者联合作为ZnT8A的捕获抗原。在一种优选的实施方式中,上述ZnT8-aviCR和ZnT8-aviCW,联合作为ZnT8A的捕获抗原,其原因在于:ZnT8蛋白的羧基端第325位氨基酸因个体携带易感基因不同而存在精氨酸R和色氨酸W两种变异体(ZnT8CR(aa268-369)和ZnT8CW(aa268-369))。ZnT8家族包含R325W等突变体的多态性决定了ZnT8抗体特异性的多态性,ZnT8的两种形态325R、325W决定了1型糖尿病人体内形成相应的自身抗体ZnT8A。由于个体间存在不同ZnT8的水平差异性,故采用两个捕获抗原ZnT8-aviCR和ZnT8-aviCW可提高ZnT8的检出率。在一种具体实施方式中,可使用ZnT8CR(aa268-369)与ZnT8CW(aa268-369)的混合物作为免疫原,通过传统的抗体生产技术获得两个捕获抗原ZnT8-aviCR和ZnT8-aviCW的混合物。本文中,ZnT8Ab或ZnT8A是针对ZnT8的自身抗体。“ZnT8pAb”是指ZnT8多克隆抗体。本发明设计的序列为SEQIDNO:1的ZnT8-aviCR保留了ZnT8CR(aa268-369)的活性,因而可作为捕获抗原用于识别并结合ZnT8A。氨基酸序列SEQIDNO:1中的生物素标签序列可以避免因后续的生物素标记到抗原识别位点中的赖氨酸残基上而引起抗原失活。当通过链霉亲和素-生物素体系将ZnT8-aviCR固定在磁珠上时,可以避免引起ZnT8-aviCR构象变化,从而保障其抗原识别活性。本发明设计的序列为SEQIDNO:2的ZnT8-aviCW保留了ZnT8CW(aa268-369)的活性,因而可作为捕获抗原用于识别并结合ZnT8A。氨基酸序列SEQIDNO:2中的生物素标签序列可以避免因后续的生物素标记到抗原识别位点中的赖氨酸残基上而引起抗原失活。当通过链霉亲和素-生物素体系将ZnT8-aviCW固定在磁珠上时,可以避免引起ZnT8-aviCW构象变化,从而保障其抗原识别活性。本文中,人IgGFc有时简称为hIgGFc,人IgGFc’有时简称为hIgGFc’,其中的带撇的符号表示含有游离巯基-SH,即Fc段之间的二硫键被打开,标示为Fc’。本发明将兔抗人ZnT8多克隆抗体与IgGFc片段偶联在一起,使得ZnT8多克隆抗体能够被兔抗人IgGFc抗体捕获,从而用于磁微粒化学发光法测试。兔抗人ZnT8多克隆抗体(ZnT8pAb)与IgGFc片段的偶联物可作为ZnT8A自身抗体的替代物,用作ZnT8A校准品,使得ZnT8A的ELISA测试能够用于临床实践,克服了ZnT8A难以制备或取得的技术障碍。磁微粒免疫检测技术是利用高分子材料合成一定粒度大小的磁性固相微粒,作为载体,以物理吸附、化学偶联等方法包被具有特异性亲和力的抗体或抗原等各种免疫活性物质。磁微粒具有顺磁性,在磁场下具有磁场响应性,将磁微粒应用于免疫检测固相,增加包被表面积,从而增加抗原或抗体吸附量及接触面积,提高反应灵敏度,同时使得抗原-抗体结合物与游离抗体的分离更容易,即清洗更方便;而且磁微粒反应体系更接近于均相反应体系,加快了反应的速度,缩短了反应时间。本发明的试剂盒的作用原理是基于磁微粒化学发光免疫检测机制。在本发明中,术语“磁性微粒”、“磁微粒”、“磁珠”和“磁性颗粒”表示相同的意义,都是指用于将亲和素、生物素、抗原/抗体、酶、核酸/寡核苷酸、小分子药物等固定在其表面的具有超顺磁性的胶态复合材料,可均匀分散于一定基液中,在磁场中富集。至于磁性微粒,可以使用生物检测领域中常用的磁性微粒。作为一种选择方式,可以根据需要在磁性微粒表面覆盖高分子成分比如PEI(聚醚酰亚胺Polyetherimide)、PVA(聚乙烯醇)、PS(聚苯乙烯)等聚合物,包括硅化物、多聚糖、蛋白、纤维素或树脂等。磁微粒化学发光免疫检测所使用的磁珠具有超顺磁和相应的磁场响应性,根据磁珠表面基团类型,所述磁珠包括羧基磁珠、氨基磁珠、硅基磁珠、巯基磁珠、IDA(亚氨基二乙酸)磁珠、环氧基磁珠、醛基磁珠、链霉素亲和素磁珠等,本发明所提供试剂盒中优选链霉素亲和素磁珠。在本发明的一种实施方式中,上述磁性微粒的粒径范围是0.1-10微米。磁性微粒的平均粒径的下限为0.1微米,优选为0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95或1微米;其上限为10微米,优选为9.5、9、8.5、8、7.5、7、6.5、6、5.5、5、4.5、4、3.5或3微米。更优选0.2-5微米、优选0.2-3微米、更优选0.3-2微米、更优选0.3-1微米。比如磁性微粒的平均粒径可以为0.2-5微米,优选0.2-3微米、更优选0.2-2微米、更优选0.3-1微米。如果平均粒径小于0.1微米,则价格过高,并可能造成上述免疫复合物的分离困难,可能影响ZnT8A含量的测定精确性;另一方面,如果平均粒径大于10微米,则不利于ZnT8A检测体系形成接近均相的反应体系,进而可能影响到ZnT8A含量的测定精确性。为了实现化学发光检测,本发明的试剂盒中采用酶作为催化剂来催化底物的化学发光反应,所使用的酶能够催化或者激活化学发光化合物或者荧光染料,从而快速地将无色的底物转变成有色的产物、或者引起光变化,或者将非荧光的荧光染料转变成强烈的荧光产物。在一种实施方式中,酶选自含有过渡金属的过氧化物酶、碱性磷酸酶、磷酸酯酶和荧光素酶,更尤其优选是过氧化物酶。其中过氧化物酶可以包括:乳过氧化物酶、微小过氧化物酶、髓过氧化物酶、卤素过氧化物酶例如钒溴过氧化物酶、辣根过氧化物酶、真菌的过氧化物酶比如木质素过氧化物酶和在白腐真菌中产生的依赖Mn的过氧化物酶、以及大豆过氧化物酶。其他氧化物酶的模拟化合物并不是酶,而是具有类似过氧化物酶的活性,其包括铁络合物比如亚铁原卟啉,已知该化合物可以催化底物的化学发光氧化,这种化合物也被包含在本发明所使用的过氧化物酶含义的范围内。考虑到化学发光法在蛋白质检测中的普遍适用性,优选酶是过氧化物酶、碱性磷酸酶、磷酸酯酶或荧光素酶,更优选辣根过氧化物酶(Horseradishperoxidase,简称HRP)。作为酶催化的底物,这些底物是适用于化学发光检测、显色检测或者荧光检测的化合物。因此,在本发明的一个实施方式中,优选酶能够催化或者激活化学发光化合物或者荧光染料,从而快速地将无色的底物转变成有色的产物、或者引起光变化,或者将非荧光的荧光染料转变成强烈的荧光产物。比如,当酶是辣根过氧化物酶时,相应的显色化合物例如是常用的邻苯二胺(OPD)、四甲基联苯胺(TMB)比如3,3′,5,5′-四甲基联苯胺、或2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS);当酶是磷酸酯酶(AP)时,相应的显色化合物例如是常用的对硝基苯磷酸酯(p-NPP)或者相应的荧光底物例如是(磷酸4-甲基伞酮)。优选的化学发光化合物是能够被氧化从而当存在酶和引发剂溶液时产生化学发光,其示例性化合物种类包括氨基苯二酰一肼(鲁米诺)、异氨基苯二酰一肼、氨基丁基乙基异氨基苯二酰一肼(ABEI)、氨基己基乙基异氨基苯二酰一肼(AHEI)、7-二甲基氨基萘-l,2-二羧酸酰肼、环取代的氨基邻苯二甲酰肼、蒽-2,3-二羧酸酰肼、菲-1,2-二羧酸酰肼、芘二羧酸酰肼、5-羟基-邻苯二甲酰肼、6-羟基邻苯二甲酰肼、2,3-二氮杂萘二酮类似物、9,10-二氢化吖啶类化合物比如9,10-二氢化吖啶酯、9,10-二氢化吖啶酯、9,10-二氢化吖啶硫酯、9,10-二氢化吖啶磺酰胺、9,10-二氢化吖啶二硫缩烯酮化合物。一般来讲,任何已知可以在过氧化氢和过氧化物酶的作用下产生化学发光的化合物都可在本发明中被用做化学发光化合物来产生化学发光,这样的化合物包括占辛染料、芳香胺和杂环胺。可在本发明中使用的荧光染料包括可用于蛋白质的荧光免疫测定的化合物,其可共轭于蛋白质比如抗体。优选的荧光染料包括萤火虫荧光素化合物。荧光素是荧光素酶的底物,其在荧光素酶存在的条件下被氧化从而产生氧化荧光素并发光。在一种实施方式中,酶是辣根过氧化物酶,并且作用底物都是鲁米诺。上述试剂盒进一步包含引发剂溶液比如双氧水,用于实现酶催化反应。引发剂溶液提供了为产生对于化学发光所需激发态化合物所需要的反应物。该反应物可以是一种对于通过直接与化学发光化合物反应而进行化学发光反应所必需的反应物。例如,当催化剂是过氧化物酶时,将会发生这种情况。在一种优选实施方式中,引发剂溶液包含过氧化物化合物。该过氧化物成分是任何能够与过氧化物酶反应的过氧化物或者烷基氢过氧化物。优选的过氧化物包括过氧化氢(双氧水)、过氧化脲和过硼酸盐。该过氧化物与过氧化物酶反应,估计可能是在酶的活性部位将铁的氧化态变成了不同的氧化态。所述引发剂溶液还可以包含选自下组的过氧化物酶增强子:苯酚化合物、芳香胺、芳基硼酸化合物、芳基硼酸酯化合物、芳基硼酸酸酐化合物。在优选的实施方式中,上述试剂盒中可进一步包括辅助试剂,比如,显色剂(底物溶液和引发剂溶液)、酶抑制剂、缓冲液、稳定剂、稀释剂、洗涤试剂、以及ZnT8A质控品。比如,所述缓冲液用于增加检测试剂的稳定性、提高检测灵敏度以及检测特异性。所述稀释剂用于稀释样本,是含有BSA的溶液。所述洗涤试剂用于洗涤磁珠,除去没有偶联到磁珠上的物质。洗涤试剂可以是含有磷酸盐、氯化钠以及表面活性剂的缓冲液。在优选的实施方式中,上述试剂盒还可分别包括下述物品中的至少之一:携带工具,其空间划分为可以收容一种或多种容器、96孔板或板条的限定空间,该容器例如是药瓶、试管、和类似物,每样容器都含有一个单独的用于本发明方法的组分;说明书,其可以写在瓶子、试管和类似物上,或者写在一张单独的纸上,或者在容器的外部或内部;也可以是多媒体的形式,比如电脑光盘、录像等等。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于举例说明目的,而不是对本发明的限制。此外应理解,在阅读了本发明的构思之后,本领域技术人员对其作出的各种改变或调整,均应落入本发明的保护范围内,这些等价形式同样属于本申请所附权利要求书限定的范围。实施例材料和仪器链亲和素标记的磁微粒(SA磁珠),粒径为300nm,为磁微粒悬液,浓度为1mg/mL,购自无锡百运纳米科技有限公司。ZnT8CR(aa268-369)、ZnT8CW(aa268-369),上海良润生物医药科技有限公司提供。GMBS(N-[γ-马来酰亚胺丁酰氧]琥珀酰亚胺酯),购自中国医药(集团)上海化学试剂公司。IgGFc,购自佰泰科生物技术有限公司。标记有HRP的兔抗人IgGFc抗体,购自洛阳佰奥通实验材料中心。浓缩洗液:0.15%PBST,pH7.4。用前以纯化水作25倍稀释。化学发光底物液:购自ThermoScientific,货号:34080,分为A液(作为HRP底物的鲁米诺溶液)和B液(作为引发剂的双氧水)。其他化学试剂均为分析纯,均购自中国医药(集团)上海化学试剂公司。为简要起见,实施例中,有时将辣根过氧化物酶称为“酶”或者“HRP”。磁力架,购自Corning公司。化学发光型免疫分析仪,安图生物,型号:LUMO。实施例1生物素化捕获抗原ZnT8CR(aa268-369)和ZnT8CW(aa268-369)的制备ZnT8蛋白的氨基酸序列信息依据uniportKB数据库,编号为Q8IWU4,GeneBank数据库mRNA编码序列登录号为NM_001172815。针对大肠杆菌表达载体进行密码子优化,并在N端加入avi-tag序列信息,按照pET30的多克隆位点序列信息,在两端分别设计酶切位点NdeI和HindIII酶切位点。将测序正确的质粒序列转入BL21(DE3)细菌载体中,利用0.5mMIPTG于25℃诱导表达12h。蛋白包涵体表达后,8M尿素溶解,利用6xHis进行亲和纯化后。采用梯度尿素浓度进行复性。最终得到氨基酸序列为SEQIDNO:1的ZnT8-aviCR和氨基酸序列为SEQIDNO:2的ZnT8-aviCW。图1显示了ZnT8-aviCR和ZnT8-aviCW的SDS-PAGE图。实施例2兔抗人ZnT8多克隆抗体制备及纯化采用背部皮下及四肢多点注射健康雄性新西兰大白兔制备多克隆抗体。采用常规兔多克隆抗体制备流程。主要免疫程序为:基础免疫前耳缘静脉用一次性5mL灭菌注射器取血5mL,室温放置30min,4℃下3000rpm离心分离血清作阴性对照。首次免疫用400μgZnT8抗原(摩尔比为1:1的ZnT8CR(aa268-369)与ZnT8CW(aa268-369)的混合物)与等体积弗氏完全佐剂充分乳化后,背部皮下4-6多点免疫,每点约0.1mL,总体积不超过1mL。第14天后进行第二次免疫,相同量抗原与等体积不完全佐剂充分乳化,背部皮下及四肢多点注射,每点约0.1mL,总体积不超过1mL,第28天用等量抗原配以等体积不完全佐剂进行第三次免疫,免疫途径、免疫剂量同上。第三次免疫7天后耳缘静脉取血5mL,分离血清,用间接ELISA方法检测抗血清效价。效价达到1:32000时,第三次免疫7天后,用200μg抗原不加佐剂腹腔加强免疫一次,3天后颈动脉插管收集全血,室温放置30min,4℃下3000rpm离心分离血清,-70℃保存。抗ZnT8特异性抗体纯化。抗体制备的关键在于所得特异性抗体的效价、特异性需要得到保证。利用抗原偶联琼脂糖CL4B凝胶,将血清加入凝胶颗粒中反应,洗脱未结合的部分,利用pH2.9的甘氨酸-盐酸缓冲液洗脱特异性抗体,并加入1MTis缓冲液(pH9.0)调节pH。首先需通过Westernblot技术验证所得抗体的特异性,然后利用间接ELISA方法验证抗体的效价。加强免疫后,收集兔血清,采用饱和硫酸铵方法纯化血清总抗体;将初步纯化的抗体溶解于PBS溶液,调节浓度为2mg/mL;随后使用ZnT8抗原亲和纯化方法纯化抗ZnT8特异性抗体,获得针对ZnT8的特异性兔抗人ZnT8多克隆抗体(ZnT8pAb)。图2显示了兔抗人ZnT8多克隆抗体的SDS-PAGE图。实施例3ZnT8A校准品的制备及其活性分析利用双功能交联剂GMBS(N-[γ-马来酰亚胺丁酰氧]琥珀酰亚胺酯),分别偶联ZnT8pAb的-NH2基团与人IgGFc’的-SH基团。利用DMSO溶解GMBS,配制2mg/mL的工作液。ZnT8pAb和人IgGFc’(hIgGFc’)分别置于PBS(pH7.4-7.6)缓冲液,冰浴条件下透析4次,每次2h,并调整浓度为2mg/mL、1mg/mL。GMBS与ZnT8pAb溶液按照摩尔比40:1的比例混合,37℃旋转振荡反应30min,形成ZnT8pAb-GMBS复合物;将人IgGFc’(PBS溶液)加入终浓度为10mM的DTT溶液,30℃旋转混匀,反应90min,形成含有游离巯基-SH的hIgGFc’。将ZnT8pAb-GMBS复合物、hIgGFc’分别利用10KD透析袋在PBS溶液中透析2次,除去多余的GMBS、DTT;测定蛋白浓度。分别按照GMBS:IgGFc’为1:1、1:2、1:4、1:6的比例,在30-37℃旋转混合反应2h。将反应产物利用100kDa超滤管超滤,去除多余的hIgGFc’片段。超滤纯化后的嵌合抗体保存于蛋白质稳定剂中,-80℃长期保存。通过直接法检测ZnT8A校准品的活性。微孔反应板包被ZnT8抗原蛋白1μg/mL(在CBS中,4℃包被)。分别加入兔抗人ZnT8多克隆抗体稀释液和作为ZnT8A校准品的偶联hIgGFc’片段的兔抗人ZnT8多克隆抗体,梯度稀释为0、5、10、20、40、80、160ng/mL;酶标记二抗采用兔抗人IgGFc-HRP(50ng/mL),对照采用羊抗兔IgG-HRP作为酶标二抗进行检测。计算两种情况下兔抗人ZnT8多克隆抗体活性以及hIgGFc标记效果。结果如表1所示,ZnT8A校准品和对照这二者背景值均很低,在500多,最大发光值均在14万以上,R2均大于0.99,线性范围均在5-160ng/ml,故ZnT8A校准品活性较好且hIgGFc标记成功。将1ng/ml的兔抗人ZnT8多克隆抗体活性定义为1U/mL。表1、ZnT8A校准品活性及hIgGFc’标记效果浓度(ng/mL)ZnT8A校准品对照160159363.4140468.98095099.2102079.54046740.447431.862021109.5120503.99109357.299417.6253801.934552.580576.17581.06实施例4建立ZnT8A检测磁微粒化学发光法体系利用粒径为300nm的SA磁珠与1μg/mL生物素化抗原蛋白ZnT8-aviCR和ZnT8-aviCW(ZnT8-aviCR和ZnT8-aviCW按摩尔比1:1的混合物)孵育15-30min反应,清洗磁珠,除去游离的ZnT8-aviCR和ZnT8-aviCW,得到ZnT8抗原磁珠。基于磁微粒的ZnT8A化学发光法检测体系包括:链亲和素标记的磁微粒(简称SA磁珠);ZnT8A校准品;作为捕获抗原的生物素化抗原蛋白ZnT8-aviCR和ZnT8-aviCW;标记有HRP的兔抗人IgGFc抗体;HRP的化学发光底物液,洗涤液。将1mg/mLSA磁珠用100μL捕获抗原包被于化学发光板,混合均匀后于37℃孵育15min;使用磁分离器设备,将磁微粒用洗液洗涤3次;然后加入100μLZnT8A校准品(3.125-200ng/mL)或待测样本,混合均匀后于37℃孵育15min;使用磁分离器设备,将磁微粒用洗液洗涤3次;加入标记有HRP的兔抗人IgGFc抗体,混合均匀后于37℃孵育15min;使用磁分离器设备,将磁微粒用洗液洗涤3次;将化学发光底物加入化学发光板中,混合均匀;5min内用化学发光检测仪检测发光信号值,并记录。采用四参数拟合方式,建立定标曲线,计算测定结果。图3显示了ZnT8A校准品的标准曲线,其中Y轴代表发光信号(强度)值的对数值,X轴代表ZnT8校准品的浓度对数值。使用本发明试剂盒检测ZnT8A浓度时,所用时间短,测定结果仅需1h即可得出。对不同用量的磁微粒(10μL、20μL、30μL),在BSA、PBS、蛋白质稳定剂几种稀释液中进行筛选,蛋白质稳定剂为最优稀释液。确定捕获抗原浓度时,对0.5、1、1.5μg/mL的抗原浓度进行比较,结果显示1μg/mL为实验最优浓度值。通过以上研究确定了检测体系的主要组成部分,并建立了用于ZnT8A检测的磁微粒化学发光检测体系,线性范围3.125-200U/mL,线性R2>0.99。实施例5试剂盒的临床应用发明人从医院收集T1DM血清样本100例,T2DM血清样本100例,正常人血清样本100例,系统性红斑狼疮病人(自身抗体阳性)血清样本50例、桥本甲状腺炎病人血清样本20例,类风湿性关节炎病人血清样本(RF阳性)样本30例,按照实施例4中的过程进行检测,同时对T1DM样本用GADA试剂盒(上海瓦兰生物科技)同步对照检测。检测所得结果如表2和表4所示,统计学指标如表3所示。表2.试剂盒测定ZnT8A的统计结果表3.试剂盒测定ZnT8A的统计学指标样本例数(T1DM和对照)检测参考值敏感性特异性400例>15U35%99%表4.两种试剂盒检测100例T1DM的结果GADA阳性检出率(52%)GADA阴性检出率(48%)ZnT8阳性检出率(35%)25%10%ZnT8阴性检出率(65%)27%38%表2和表3中数据显示,99%的正常人血清中ZnT8A含量小于15U/mL,以此作为临界值,在1型糖尿病人血清ZnT8A阳性率为35%;1型糖尿病人中阳性检出率达到为35%;表4中数据显示,即使在GADA抗体检测为阴性的情况下,ZnT8A依然具有10%的检出率。综上所述,本发明的试剂盒可用于定量检测临床样本的ZnT8A含量,为1型糖尿病的鉴别诊断提供可靠依据。序列表<110>上海良润生物医药科技有限公司<120>ZnT8A自身抗体检测试剂盒<130>SHPI1600844<160>4<170>PatentInversion3.3<210>1<211>168<212>PRT<213>人工序列<400>1MetHisHisHisHisHisHisSerSerGlyLeuValProArgGlySer151015GlyMetLysGluThrAlaAlaAlaLysPheGluArgGlnHisMetAsp202530SerProAspLeuGlyThrAspAspAspAspLysAlaMetAlaAspIle354045GlySerGlyLeuAsnAspIlePheGluAlaGlnLysIleGluTrpHis505560GluLeuLysAspPheSerIleLeuLeuMetGluGlyValProLysSer65707580LeuAsnTyrSerGlyValLysGluLeuIleLeuAlaValAspGlyVal859095LeuSerValHisSerLeuHisIleTrpSerLeuThrMetAsnGlnVal100105110IleLeuSerAlaHisValAlaThrAlaAlaSerArgAspSerGlnVal115120125ValArgArgGluIleAlaLysAlaLeuSerLysSerPheThrMetHis130135140SerLeuThrIleGlnMetGluSerProValAspGlnAspProAspCys145150155160LeuPheCysGluAspProCysAsp165<210>2<211>125<212>PRT<213>人工序列<400>2MetHisHisHisHisHisHisGlyLeuAsnAspIlePheGluAlaGln151015LysIleGluTrpHisGluLeuLysAspPheSerIleLeuLeuMetGlu202530GlyValProLysSerLeuAsnTyrSerGlyValLysGluLeuIleLeu354045AlaValAspGlyValLeuSerValHisSerLeuHisIleTrpSerLeu505560ThrMetAsnGlnValIleLeuSerAlaHisValAlaThrAlaAlaSer65707580TrpAspSerGlnValValArgArgGluIleAlaLysAlaLeuSerLys859095SerPheThrMetHisSerLeuThrIleGlnMetGluSerProValAsp100105110GlnAspProAspCysLeuPheCysGluAspProCysAsp115120125<210>3<211>103<212>PRT<213>人工序列<400>3LeuLysAspPheSerIleLeuLeuMetGluGlyValProLysSerLeu151015AsnTyrSerGlyValLysGluLeuIleLeuAlaValAspGlyValLeu202530SerValHisSerLeuHisIleTrpSerLeuThrMetAsnGlnValIle354045LeuSerAlaHisValAlaThrAlaAlaSerArgAspSerGlnValVal505560ArgArgGluIleAlaLysAlaLeuSerLysSerPheThrMetHisSer65707580LeuThrIleGlnMetGluSerProValAspGlnAspProAspCysLeu859095PheCysGluAspProCysAsp100<210>4<211>103<212>PRT<213>人工序列<400>4LeuLysAspPheSerIleLeuLeuMetGluGlyValProLysSerLeu151015AsnTyrSerGlyValLysGluLeuIleLeuAlaValAspGlyValLeu202530SerValHisSerLeuHisIleTrpSerLeuThrMetAsnGlnValIle354045LeuSerAlaHisValAlaThrAlaAlaSerTrpAspSerGlnValVal505560ArgArgGluIleAlaLysAlaLeuSerLysSerPheThrMetHisSer65707580LeuThrIleGlnMetGluSerProValAspGlnAspProAspCysLeu859095PheCysGluAspProCysAsp100当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1