革兰氏阳性及阴性菌质谱检测试剂盒及快速鉴定的方法与流程
本发明涉及微生物质谱检测试剂盒领域,尤其涉及一种应用于不同革兰氏类型单菌落使用不同配比的基质液处理结晶化以便进行maldi-tof质谱检测的基质液配方及快速鉴定的方法。
背景技术:
微生物体内存在大量的高度保守的蛋白和核酸,这些蛋白及核酸具有物种水平上的差异,且可稳定遗传,利用基质辅助激光解析飞行质谱(maldi-tof-ms)可以定量的解析这些蛋白和核酸,通过标记物种特征峰及质量图谱进行质谱鉴定。随着可靠的生物标志物不断涌现,maldi-tof质谱技术的越加完善。不断完善的微生物质谱因子数据库以管家基因及特异性蛋白为生物标记,大量的研究以标识特异性质谱峰为数据内容,不断弥补着质谱在分辨率和正确率上的不足。
建立稳定可靠的maldi-tof质谱微生物样品处理方法是微生物快速检测技术的重要环节。为了实现微生物的maldi-tof-ms飞行质谱检测,菌株样品需要进行前处理。微生物的细胞壁成分及培养方式的巨大差异使得质谱分析前处理流程及随之而来的基质液配比的要求也不同。传统的预混基质液配方单一,不能区分革兰氏染色阴性和阳性菌,微生物前处理的差异极大的影响质谱检测的准确性。同时目前的基质预混方法存在缺陷,均不能有效区分革兰氏阳性和阴性菌的质谱分析特征,商业化基质液无法长期保存。这些缺陷都制约着微生物快速鉴定技术的精准性和有效性。在进行微生物质谱的快速鉴定时还没有针对革兰氏菌的不同特征进行分类处理的标准化质谱试剂盒及处理方法的技术报道。
因此,需要采用一种针对不同革兰氏菌的检测流程及基质液处理方法,含有所有必要试剂,使用简单方便。
技术实现要素:
本发明目的是克服微生物质谱快速鉴定技术中前处理方法单一的技术不足,采用一种针对不同革兰氏阳性和阴性菌分类处理的质谱样品制备试剂盒及制备方法,该试剂盒及方法为微生物质谱快速检测样品优化处理提供的新的途径,为准确快速的鉴定微生物提供基础。
一种革兰氏阳性和阴性菌分类处理的质谱样品制备试剂盒包括以下物质:(1)前处理液:取纯甲酸、乙酸和水,5-10℃环境下混合,控制甲酸浓度20-30%(v/v)而乙酸0-10%(v/v),随后加入0.2-0.5mm的硫脲;(2)革兰氏阳性菌预混液:先将乙醇、乙腈、水常温混合,三者配比为1:1:1,使用时预先加入1.0-1.5%的基质,基质是α-氰基-4-羟基肉桂酸(chca)、二羟基苯甲酸、芥子酸中的任何一种,迅速振荡搅拌,待粉末溶解完全后静置10分钟,1000rpm离心1分钟,管底出现少量黄色沉淀则表示过饱和溶液配置成功,-20℃保存;(3)革兰氏阴性菌预混液:先将乙醇、乙腈、水常温混合,三者配比为1:1.5:1,加入0.5mm的硫脲,使用时预先加入2.0-2.5%的基质,迅速振荡搅拌完全,加入10%的稳定剂,继续振荡搅拌30秒,待粉末溶解完全后静置10分钟,1000rpm离心1分钟。-20℃保存;(4)菌落缓冲液:0.1m的pbs或naac,ph值6.5~7.2;(5)标准菌株:atcc8739大肠埃希菌株干粉,由bsa溶液与纯菌落混合后经过冷冻干燥而得;(6)标准蛋白混合物:由atcc25923金黄色葡萄球菌,经过由5m尿素,2m硫脲,1.0%3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(chaps)及0.5mtris-hcl组成的裂解液处理后1分钟,13000rpm离心15分钟,去除沉淀后获得的蛋白混合物;(7)稳定剂:2~5%的三氟乙酸溶液;(8)革兰氏染色液:包括结晶紫溶液、碘酒、番红溶液、95%乙醇和水。
采用质谱样品制备试剂盒快速鉴定方法,其包括以下步骤:
(1)待测菌落使用所述革兰氏染色液进行革兰氏染色以判别革兰氏阳性或阴性菌;(2)将革兰氏阳性或阴性预混液与基质混合配置而成基质液,革兰氏阴性基质液是在所述革兰氏阴性菌预混液加入2.0-2.5%的所述基质,迅速振荡搅拌完全,加入10%的稳定剂,继续振荡搅拌30秒,待粉末溶解完全后静置10分钟,1000rpm离心1分钟;革兰氏阳性基质液是在所述革兰氏阳性菌预混液加入1.0-1.5%的所述基质,迅速振荡搅拌,待粉末溶解完全后静置10分钟,1000rpm离心1分钟,管底出现少量黄色沉淀则表示过饱和溶液配置成功,两种所述基质液都短期使用置于4℃环境下,或一周内用完则置于-20℃环境下;(3)取新鲜培养的革兰氏阳性或阴性菌单菌落,使用所述菌落缓冲液配置成麦氏浊度的菌悬液,其中革兰氏阴性菌3.0~3.5mcf或者革兰氏阳性菌2.0~2.5mcf,取100μl置于0.5ml离心管中,充分振荡后13000rpm离心5分钟,除去上清后备用,置于靶板上待处理;(4)革兰氏阳性菌需要加入20μl的所述前处理液,随后充分振荡,室温下静置10分钟,随后打开管盖,在洁净台内通风5分钟;(5)加入现配的革兰氏阳性或阴性基质液20μl,重复振荡后在对应所述靶板上加入每个样品1~1.5μl的所述革兰氏阳性或阴性基质液,室温下通风干燥10分钟,待结晶化完全后可进行质谱鉴定;(6)对应菌株样品及标准菌株均需要经过上述处理,革兰氏阳性菌选用标准蛋白混合物作为参照,革兰氏阴性菌则选用atcc8739标准菌株作为参照;使用参照可以定期校正质谱的精准性,以减少鉴定误差;(7)微生物质谱鉴定,需要配合对应仪器的微生物质谱数据库对比分析。
附图说明
图1是待测菌种进行质谱分析的流程图;
图2-1是c1和c2组的空肠弯曲杆菌经不同配比基质液处理后的质谱图谱;质谱图谱荷质比范围设定在2000~12000m/z,横坐标为质谱峰丰度值(信噪比);
图2-2是c4和c5组的空肠弯曲杆菌经不同配比基质液处理后的质谱图谱;质谱图谱荷质比范围设定在2000~12000m/z,横坐标为质谱峰丰度值(信噪比);
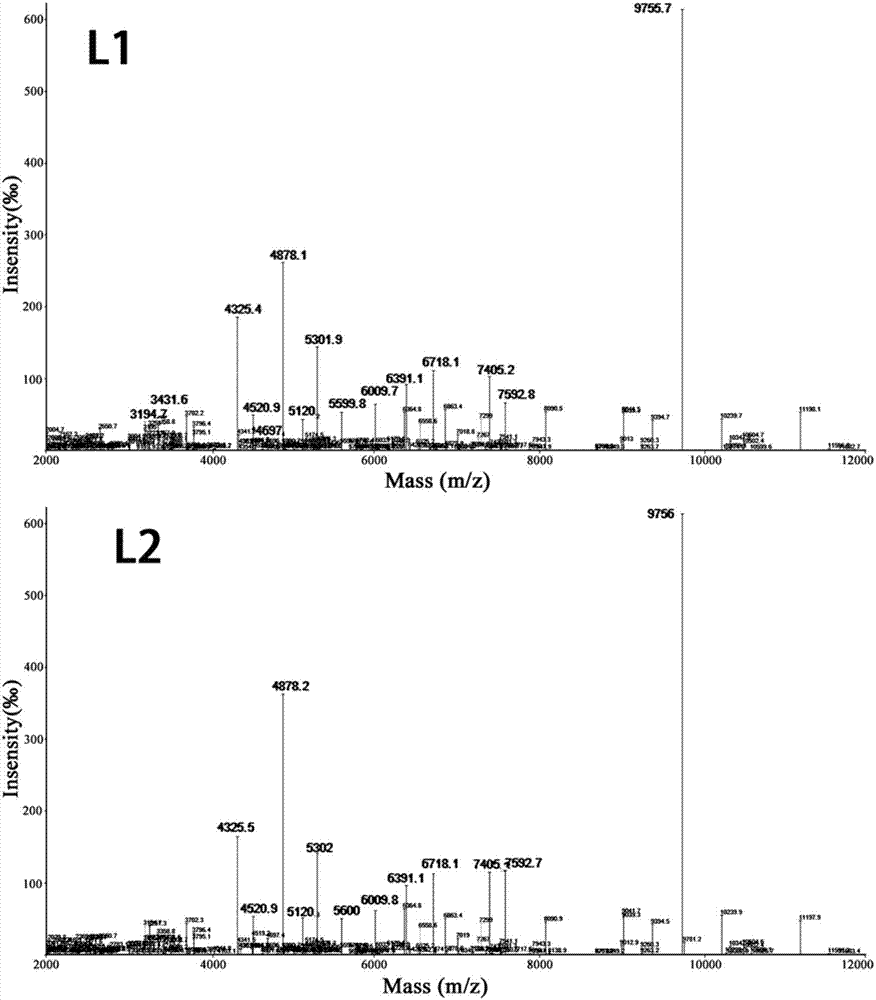
图3-1是l1和l2组的单核细胞增生李斯特菌经不同配比基质液处理后的质谱图谱;经不同基质液处理,质谱图谱荷质比范围设定在2000~12000m/z,横坐标为质谱峰丰度值(信噪比);
图3-2是l3和l4组的单核细胞增生李斯特菌经不同配比基质液处理后的质谱图谱;经不同基质液处理,质谱图谱荷质比范围设定在2000~12000m/z,横坐标为质谱峰丰度值(信噪比);
图4不同配比基质液处理空肠弯曲菌后质量图谱特征峰及丰度值对比;黑色箭头代表该特征峰值的丰度值较高(p<0.05);
图5不同配比基质液处理单核细胞增生李斯特菌后质量图谱特征峰及丰度值对比,黑色箭头代表该特征峰值的丰度值较高(p<0.05),灰色箭头代表该组质谱峰在此特征峰值处缺失;
具体实施方式
本发明提出的是用于分类处理革兰氏阴性和阳性菌的maldi-tof前处理试剂,包括:
前处理液:取纯甲酸、乙酸和水,5-10℃环境下混合,控制甲酸浓度20-30%(v/v)而乙酸0-10%(v/v),随后加入0.2-0.5mm的硫脲;
革兰氏阳性菌预混液:先将乙醇、乙腈、水常温混合,三者配比为1:1:1,使用时预先加入1.0-1.5%的基质,基质是α-氰基-4-羟基肉桂酸(chca)、二羟基苯甲酸、芥子酸中的任何一种,迅速振荡搅拌,待粉末溶解完全后静置10分钟,1000rpm离心1分钟,管底出现少量黄色沉淀则表示过饱和溶液配置成功,-20℃保存;
革兰氏阴性菌预混液:先将乙醇、乙腈、水常温混合,三者配比为1:1.5:1,加入0.5mm的硫脲,使用时预先加入2.0-2.5%的基质,迅速振荡搅拌完全,加入10%的稳定剂,继续振荡搅拌30秒,待粉末溶解完全后静置10分钟,1000rpm离心1分钟。-20℃保存;
菌落缓冲液:0.1m的pbs或naac,ph值6.5~7.2;
标准菌株:atcc8739大肠埃希菌株干粉,由bsa溶液与纯菌落混合后经过冷冻干燥而得;(6)标准蛋白混合物:由atcc25923金黄色葡萄球菌,经过由5m尿素,2m硫脲,1.0%3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(chaps)及0.5mtris-hcl组成的裂解液处理后1分钟,13000rpm离心15分钟,去除沉淀后获得的蛋白混合物;
稳定剂:2~5%的三氟乙酸母液;
革兰氏染色液:包括结晶紫溶液、碘酒、番红溶液、95%乙醇和水。为了避免浪费,基质将进行分装,每次使用前加入预混液中,按照要求现配现用。
表1革兰氏阴性及阳性菌预混液配比
一种采用质谱样品制备试剂盒快速鉴定方法包括以下步骤:
(1)待测菌落使用所述革兰氏染色液进行革兰氏染色以判别革兰氏阳性或阴性菌,革兰氏染色包括:首先涂片后进行结晶紫染色1分钟,水洗后加入碘酒染色1分钟,再次水洗后加入95%乙醇洗脱30秒,进一步水洗后加入番红溶液复染1分钟,最后水洗进行显微镜观察,结果根据革兰氏染色法进行判别。
(2)将革兰氏阳性或阴性预混液与基质混合配置而成基质液,革兰氏阴性基质液是在所述革兰氏阴性菌预混液加入2.0-2.5%的所述基质,迅速振荡搅拌完全,加入10%的稳定剂,继续振荡搅拌30秒,待粉末溶解完全后静置10分钟,1000rpm离心1分钟;革兰氏阳性基质液是在所述革兰氏阳性菌预混液加入1.0-1.5%的所述基质,迅速振荡搅拌,待粉末溶解完全后静置10分钟,1000rpm离心1分钟,管底出现少量黄色沉淀则表示过饱和溶液配置成功,两种所述基质液都短期使用置于4℃环境下,或一周内用完则置于-20℃环境下;
(3)取新鲜培养的革兰氏阳性或阴性菌单菌落,使用所述菌落缓冲液配置成麦氏浊度的菌悬液,其中革兰氏阴性菌3.0~3.5mcf或者革兰氏阳性菌2.0~2.5mcf,取100μl置于0.5ml离心管中,充分振荡后13000rpm离心5分钟,除去上清后备用,置于靶板上待处理;
(4)革兰氏阳性菌需要加入20μl的所述前处理液,随后充分振荡,室温下静置10分钟,随后打开管盖,在洁净台内通风5分钟;
(5)加入现配的革兰氏阳性或阴性基质液20μl,重复振荡后在对应所述靶板上加入每个样品1~1.5μl的所述革兰氏阳性或阴性基质液,室温下通风干燥10分钟,待结晶化完全后可进行质谱鉴定;
(6)对应菌株样品及标准菌株均需要经过上述处理,革兰氏阳性菌选用标准蛋白混合物作为参照,革兰氏阴性菌则选用atcc8739标准菌株作为参照;使用参照可以定期校正质谱的精准性,以减少鉴定误差;
(7)微生物质谱鉴定,需要配合对应仪器的微生物质谱数据库对比分析。
新鲜培养的革兰氏阳性或阴性菌单菌落使用普通大豆琼脂平板或血琼脂平板。
数据收集和分析
将靶板置入maldi-tof-ms质谱仪,调节质谱参数,使用atcc8739或标准蛋白样品进行机器校准。设置分子量误差<0.1%,分子量范围3000~20000da,采集参数数量100次。
质谱数据包含每一个菌株的胎指纹图谱,含有特征峰荷质比及峰相对丰度值。将这些数据通过软件saramis或biotyper进行数据库比对,随后生成与菌库中对应的超级图谱或参考图谱,经过相似性计算,获得对应菌株的检出率或分值,以此作为鉴定的结果。以梅里埃vitekms系统为例,检出结果<75%代表结果不可信,介于75~90%代表结果可信但不准确,需要进一步鉴定,介于90~99%代表结果较可信,可以结论,而达到99.99%代表结果非常可信。
检测方法验证实验
我们采用革兰氏阴性菌空肠弯曲菌和革兰氏阳性菌单核增生李斯特菌进行方法学验证。按照表2配方进行配置预混液。c1~4为革兰氏阴性菌,l1~4为革兰氏阳性菌。
经过质谱鉴定得到空肠弯曲菌(见图2-1及图2-2)和单核细胞增生李斯特菌的质量图谱(见图3-1及图3-2)。我们将所得质谱数据中的特征峰峰值(荷
空肠弯曲菌质谱数据分析所示(见图4),各组的质谱峰图谱极其相似,各组检出峰未出现缺失现象。其中c3组特征峰4365、4776、6158、7035、7082、8461和9553m/z的相对峰强度较其他组更高,其中高峰值区的特征峰具有更高的峰强度,而低峰值区则没有显著的差异(p<0.05)。基质液的含水量对空肠弯曲菌质谱峰型有一定的影响,c4组含水较高可能由此降低了高峰值特征峰的相对峰强度,使得检出率小幅度下降。chca的含量的高低对质谱结果的影响不明显,而tfa含量达到0.5%可以增加空肠弯曲菌的检出率,而tfa浓度高于0.5%后检出峰相对峰强度增强不明显(结果未给出)。甲酸裂解处理后峰值强度没有明显增强,空肠弯曲菌不能通过甲酸裂解处理提高检出。4365、5267、5498和7035m/z的相对峰强度较高,可能是空肠弯曲菌的特异性生物标志峰。
单核细胞增生李斯特菌的质谱峰图谱与空肠弯曲菌不同(见图5)。所有组的图谱呈现明显的中高峰值区聚集现象,低峰值区的峰相对强度很低。l3和l4组的特征峰4519、4877、6009、6389、6717、7404和7591m/z的峰相对强度较高,峰型更突出,可见甲酸裂解后的实验组其各特征峰峰强度均有显著的提高,甲酸处理是革兰氏阳性菌质谱鉴定的关键。l3组基质液无水,导致3714、5118和5172等特征峰缺失,而l1组基质液中缺乏并未出现类似空肠弯曲菌的检出率下降的现象,可见tfa浓度对革兰氏阳性李斯特菌的影响较低。4324、4877和9755m/z特征峰峰强度较高,可以作为单核增生李斯特菌质谱检测的特异性生物标志。
通过对空肠弯曲菌及李斯特菌质谱鉴定基质液的比较分析,我们发现菌株前处理优化对于微生物质谱分析至关重要。革兰氏阳性菌李斯特菌及阴性菌空肠弯曲菌对基质液要求不同,李斯特菌需要甲酸破壁处理却对tfa含量要求较低,而空肠弯曲菌的基质液则需要将tfa含量提高至0.5%以上方能显著提高检出,而无需甲酸破壁处理。质谱基质液含水量控制在30%(v/v)能够减少特征峰缺失,有效的提高检出率。为了降低成本,质谱分析用空肠弯曲菌基质液最优配方为:乙醇:乙腈:水=1:1.5:1,2.5%chca,0.2-0.5%tfa;李斯特菌基质液最优配方为:乙醇:乙腈:水=1:1:1,1.0%chca。
食源性致病菌在vitekms鉴定过程中对基质液的要求有差异,我们同步进行了其他医源性和食源性微生物的相关检测验证(表4)。基质液的优化能够提高大部分微生物质谱分析检出率,优化基质液配比和处理程序可以优化食源性致病菌质谱检测效率,提高质谱微生物鉴定的优势。
本发明的有益效果在于:
院内感染和食源性样本相关的革兰氏阴性菌,如铜绿假单胞、变形杆菌、不动杆菌、嗜血杆菌和志贺氏菌,其质谱特征峰随菌株生长状态和培养时间等改变有巨大的差异。而大部分革兰氏阳性菌,如金黄色葡萄球菌、芽孢杆菌及一些厌氧菌,他们对检出要求则相对较低,易检出。由此对于此类菌的质谱检测我们制定了针对前处理方法、培养条件和时间、培养基种类等条件的特异性处理流程。
主要的技术改进:
菌株前处理优化:阳性菌和阴性菌的基质液要求不同,且对甲酸破壁的要求也不同
优化基质液组分配方:对比成品基质液及自配基质液的检出效果。。其中阴性菌基质液必须添加一定量的三氟乙酸(tfa),而阳性菌则要求略低;预混液的含水量直接影响着特征峰缺失情况,合理选用含水量适宜的预混液可以提高检出率
阳性基质液:乙醇:乙腈:水=1:1:1,1~1.5%chca
阴性基质液:乙醇:乙腈:水=1:1.5:1,2.0~2.5%chca,0.2~0.5%tfa
分析预处理方法的改进:根据不同致病菌对于培养时间、培养条件和平板要求的差异,建立不同革兰氏类型致病菌质谱分析流程,革兰氏阴性菌和阳性菌的前处理方法能显著提高未知样品菌的检出率;
点样流程程序化:原有流程中,直接涂布菌落的方法存在人为差异。涂布量无法控制,且不同菌落的质地、含水量、颗粒密度不同严重影响基质液处理样品后蛋白结晶的程度。设置了如图1的流程化过程。
表2不同实验组的质谱基质液配比浓度(v/v)
表3不同配比的基质液处理后鉴定结果及检出率差异
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测幽门螺杆菌基因及药物代谢型的Miseq测序方法与流程
- 革兰氏阴性菌阳性血培养分离胶及化学试剂前处理方法与流程
- 一种截短侧耳素的提取方法与流程
- 一种含千金子素的千金子脂肪油‑胆盐混合胶束及其制备方法和应用与流程
- 一种噬菌蛭弧菌冻干粉的制备方法与流程
- 具有表面具备杀菌作用的散热片的热交换器、具有具备杀菌作用的表面的金属构件、利用热交换器的散热片的表面或者金属构件的表面抑制霉菌发生的方法和杀菌方法、以及具有金属构件的电热水器、饮料供应器和饭盒盖与制造工艺
- 作为抗微生物化合物的多黏菌素衍生物的制造方法与工艺
- 吉他霉素的免疫胶体金检测卡及其制备方法与制造工艺
- 一种快速提取革兰氏阳性菌基因组DNA的方法和试剂盒与制造工艺
- 爱格氏菌AUH‑JLD49s及其在3′‑去甲基‑牛蒡苷元转化中的应用的制造方法与工艺